A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
דגימה ועיבוד צחצוח אף באמצעות מיקרוסקופ וידאו ריסני דיגיטלי במהירות גבוהה – התאמה למגפת הקורונה
In This Article
Summary
כדי להבטיח ניתוח פונקציונלי ריסוני מוצלח ואיכותי לאבחון PCD, שיטה מדויקת וזהירה לדגימת אפיתל נשימתי ועיבודו היא חיונית. כדי להמשיך לספק שירות אבחון PCD במהלך מגיפת COVID-19, פרוטוקול מיקרוסקופ הווידאו הריסי עודכן כדי לכלול אמצעי בקרת זיהום מתאימים.
Abstract
דיסקינזיה ריסנית ראשונית (PCD) היא סיליופתיה גנטית, המובילה למחלה אוטוסינופולמונרית משמעותית. אבחון PCD לעתים קרובות מתפספס או מתעכב בגלל אתגרים עם שיטות אבחון שונות. מיקרוסקופ וידאו ריסני, באמצעות מיקרוסקופ וידאו דיגיטלי במהירות גבוהה (DHSV), אחד מכלי האבחון עבור PCD, נחשב לשיטה האופטימלית לביצוע ניתוח פונקציונלי ריסני (CFA), הכולל ניתוח תדירות פעימות ריסניות (CBF) ודפוס פעימות (CBP). עם זאת, ל-DHSV אין נוהל הפעלה סטנדרטי שפורסם לעיבוד וניתוח דגימות. הוא משתמש גם באפיתל נשימתי חי, נושא משמעותי בבקרת זיהומים במהלך מגיפת COVID-19. כדי להמשיך לספק שירות אבחון במהלך משבר בריאותי זה, פרוטוקול מיקרוסקופ הווידיאו הריסי הותאם כך שיכלול אמצעי בקרת זיהום נאותים.
כאן, אנו מתארים פרוטוקול מתוקן לדגימה ועיבוד מעבדה של דגימות נשימה ריסניות, תוך הדגשת התאמות שנעשו כדי לעמוד באמצעי בקרת הזיהום של COVID-19. מתוארות תוצאות מייצגות של CFA מדגימות צחצוח אף שהתקבלו מ -16 נבדקים בריאים, שעובדו ונותחו על פי פרוטוקול זה. אנו גם ממחישים את החשיבות של השגה ועיבוד של רצועות אפיתל באיכות אופטימלית, שכן דגימות שאינן עומדות בקריטריונים לבחירת איכות מאפשרות כעת CFA, מה שעלול להפחית את אמינות האבחון ואת היעילות של טכניקה זו.
Introduction
דיסקינזיה ריסנית ראשונית (PCD) היא סיליופתיה תנועתית הטרוגנית תורשתית, שבה ריסונים נשימתיים הם נייחים, איטיים או דיסקינטיים, מה שמוביל לפגיעה בסילוק הליחה ולמחלה אוטו-סינו-פולמונרית כרונית 1,2,3,4. הביטויים הקליניים של PCD הם שיעול רטוב כרוני וגודש כרוני באף החל מינקות מוקדמת, זיהומים חוזרים או כרוניים בדרכי הנשימה העליונות והתחתונות המובילים לברונכיאקטזיס, ודלקת אוזניים חוזרת או כרונית וסינוסיטיס 5,6,7. כמחצית מחולי PCD מציגים פגמים צדדיים באיברים כגון situs inversus או situs ambiguus. חלק מהחולים מציגים גם בעיות פוריות עקב זרע לא תנועתי אצל גברים וריסים תנועתיים בחצוצרות אצל נשים 1,2,8. PCD הוא נדיר, אך השכיחות קשה להגדרה, ונעה בין 1:10,000 ל-1:20,000 9,10. עם זאת, השכיחות האמיתית של PCD נחשבת גבוהה יותר בשל קשיים באבחון והיעדר חשד קליני. הסימפטומים של PCD מחקים ביטויים נשימתיים נפוצים של מצבים נשימתיים חריפים או כרוניים אחרים, והאתגרים האבחנתיים של אישור האבחנה ידועים היטב, מה שמוביל לטיפול ומעקב לקויים 2,5,9,11.
מיקרוסקופ וידאו ריסני, באמצעות מיקרוסקופ וידאו דיגיטלי במהירות גבוהה (DHSV), הוא אחד מכלי האבחון עבור PCD 4,8,12,13. DHSV נחשבת לשיטה האופטימלית לביצוע ניתוח פונקציונלי ריסני (CFA), הכולל ניתוח תדירות פעימות ריסניות (CBF) ותבנית פעימות (CBP) 2,14,15,16. DHSV משתמש באפיתל נשימתי חי, המתקבל בדרך כלל מצחצוח אף13.
לאור התפרצות COVID-19 הנוכחית, אישור של אבחנה PCD חשוב כעת עוד יותר מכיוון שהראיות מצביעות על כך שמחלות נשימה בסיסיות עלולות להוביל לתוצאות גרועות יותר לאחר הידבקות ב- COVID-1917,18. שירות אבחון PCD בטוח ויעיל במהלך המגפה הנוכחית יאפשר גם לחולי PCD מאומתים ליהנות מאמצעי הגנה נוספים, בהשוואה לאוכלוסייה הכללית19.
העברת COVID-19 מתרחשת בעיקר באמצעות התפשטות טיפתית20. פוטנציאל גבוה של העברה מחולים אסימפטומטיים (או סימפטומטיים מינימליים) מוצע על ידי עומס נגיפי גבוה בדגימת אף20. בנוסף, אם חלקיקים נגיפיים הופכים לאירוסוליים, הם נשארים באוויר לפחות 3 שעות21. לכן, עובדי רפואה נשימתית נחשפים למאגר גבוה של עומס נגיפי בעת ביצוע טיפול קליני ואיסוף דגימות לטכניקות אבחון22. יתר על כן, מניפולציה של דגימות נשימה חיות חושפת את הטכנאי לזיהום COVID-19. בעוד שהמלצות מומלצות לרופאים נשימתיים ומנתחי אף אוזן גרון המטפלים בחולי COVID-19 מיושמות23, חסרות המלצות לביצוע DHSV במהלך מגיפת COVID-19.
על מנת להמשיך ולספק שירות אבחון PCD, תוך הבטחת בטיחותם של עובד הבריאות (ביצוע איסוף דגימות) והטכנאי (ביצוע עיבוד דגימות), היה צורך להתאים את פרוטוקול מיקרוסקופ הווידאו הריסי במהלך מגפת הקורונה. הטכניקה של videomicroscopy ciliary מוגבל כיום לשירות מחקר ומרכזי אבחון מיוחדים, כמו CFA דורש הכשרה רבה וניסיון. יתר על כן, כיום, קיים מחסור בסטנדרטיזציה ובנוהל הפעלה מדויק לעיבוד וניתוח דגימות באמצעות DHSV 4,13.
מטרת מאמר זה היא לתאר נהלי פעולה סטנדרטיים עבור DHSV, תוך התייחסות מיוחדת לאמצעי בקרת זיהום ובטיחות בעת דגימה ועיבוד אפיתל אף חי. זה יאפשר אבחון וטיפול PCD באיכות גבוהה להמשיך, למרות התפרצות COVID-19 הנוכחית.
Protocol
האישור התקבל מוועדת האתיקה של בית החולים בליאז' ומהמחלקה האוניברסיטאית להיגיינה והגנה על הבריאות בעבודה.
1. דגימת אפיתל ריסני נשימתי
- יש לוודא שהנבדקים נקיים מזיהום במשך 4-6 שבועות לפחות, וללא תרופות באף ובשאיפה, לפני הדגימה.
- הכינו תוספת להכנת M199: תוספת תרבית תאים בינונית 199 (M199) (500 מ"ל) עם תמיסה אנטיביוטית (5 מ"ל סטרפטומיצין/פניצילין (50 מק"ג/מ"ל)) ותמיסה אנטי-פטרייתית (5 מ"ל אמפוטריצין B (2.5 מיקרוגרם/מ"ל)).
- הכינו 2 (אחד לכל נחיר) 15 מ"ל צינורות חרוטיים עם מכסים, ומלאו כל אחד מהם עם 3 מ"ל של M199 מוסף.
- הכינו מברשת ציטולוגיה של הסימפונות (עובי: 2 מ"מ ואורך: 11 מ"מ). חתכו את קצה החוט כדי לוודא שהמברשת תהיה באורך של כ-15 ס"מ (איור 1A,B). כדי להחזיק את המברשת בעת ביצוע צחצוח האף, השתמשו במלקחיים לאף של וייל-בלייקסלי (איור 1B).
- הסתגלות לקורונה: הימנע מעיבוד דגימת אפיתל אף חי במצב לא ידוע ל- COVID-19, בדוק את המטופל ל- COVID-19 48 עד 72 שעות לפני צחצוח האף למיקרוסקופ וידאו ריסני. בדיקת COVID-19 זו מורכבת מתגובת שרשרת פולימראז מדגימת מטוש אףולוע 24,25. מכיוון שסטטוס המטופל ל-COVID-19 אינו ידוע בשלב זה, רופאים ואנשי צוות חייבים להיות מוגנים כראוי23,26, כולל מסכת FFP2, כפפות, מגן פנים או משקפי מגן, וחלוק עמיד במים עם שרוולים ארוכים. במקרה של בדיקת PCR לא זמינה, בלתי אפשרית או מוטלת בספק, ביצע את כל עיבוד צחצוח האף במעבדה לבטיחות ביולוגית L2. במקרה של סטטוס חיובי ל-COVID-19, דחו את בדיקת אבחון ה-PCD ושקלו גישות חלופיות לניהול המטופל.
זהירות: דגימת מטוש אף ולוע זו לבדיקת COVID-19 עלולה לגרום לדיסקינזיה ריסנית משנית על ידי פגיעה באפיתל ריסני הנשימה באף27,28. כדי למנוע זאת, להציג צמר גפן דק לתוך חלל האף עד nasopharynx תחת שליטה אנדוסקופית נוקשה, הימנעות פגיעה טורבינטים או מחיצה. לאחר מכן הדגימה נלקחת מן nasopharynx ולהסיר את צמר גפן תחת שליטה של אנדוסקופ נוקשה. עם ציוד מתאים, אנדוסקופיה נוקשה 0° מבוצעת בקלות במבוגרים וילדים ללא טראומה.
2. השגת דגימות אפיתל ריסני נשימתי
הסתגלות ל-COVID-19: גם אם סטטוס COVID-19 של המטופל שלילי, בשל שיעור שלילי כוזב, המטופל מתבקש לשמור מסכה כירורגית על פיו במהלך ההליך, וכפפות, מסכת FFP2 ומגן פנים נלבשים על ידי הרופא.
- הכנת צחצוח אף
- בקשו מהמטופל לקנח את האף.
- יש לבצע צחצוח אף תחת אנדוסקופיה של האף או עיוור. אם משתמשים באנדוסקופיה של האף, יש לבדוק את 2 הנחיריים לפני צחצוח האף (אין לחזור על הפעולה אם נעשה 48-72 קודם לכן עבור ספוגית אף COVID-19). הבדיקה מאפשרת לאמת את מצב הרירית (רמה גבוהה של דלקת עלולה לגרום לדימום בעת ביצוע צחצוח האף, ...), את מצב הטורבינאט התחתון (כדי לשלול נוכחות של טלנגיאקטזיה למשל), ואם המחיצה ישרה (איור 1C).
- בקשו מהמטופל לשכב, או לשבת בנוחות, כשהראש מונח לאחור על הכיסא (מכיוון שצחצוח האף גורם לרפלקס להזיז את הראש לאחור). מטפל שני מחזיק את הראש במהלך צחצוח האף, במיוחד אצל ילדים.
- נערו את המברשת בתוסף M199 לפני צחצוח האף (הרטבת המברשת מפחיתה את הגירוי מההברשה).
הערה: ניתן להרטיב את המברשת בתוך תוספת M199; אם החולה אלרגי לאנטיביוטיקה (פניצילין וסטרפטומיצין נמצאים בתווך תרבית התא המשלימה), להרטיב את המברשת במי מלח.
- צחצוח אף
- יש להכניס בעדינות את צחצוח האף ללא הרדמה מקומית או כללית13. אם באמצעות אנדוסקופיה האף, מניחים את האנדוסקופ בכניסה לאף כדי לדמיין את טורבינאט האף הנחות, ולאחר מכן להכניס את מברשת הציטולוגיה באף. אם אתם מבצעים צחצוח אף "מסונוור", הכניסו את המברשת לאף, בעקבות רצפת האף (איור 1D).
הערה: חלק ממרכזי האבחון משתמשים בהרדמה מקומית עם טמפון של נפזולין לביצוע צחצוח אף. - העבר את המברשת אחורית וקדמית מספר פעמים על החלק האחורי של טורבינאט האף התחתון ולאחר מכן נסוג. המפעיל צריך להרגיש שהמברשת משפשפת את האפיתל, והמטופל עלול להרגיש עין דומעית חד צדדית בצד הצחצוח.
הערה: אם צחצוח האף מבוצע קדמי מדי, לא יתקבלו תאים ריסונים, מכיוון שחלל האף הקדמי מרופד באפיתל מעבר לא ריסני. - לאחר הדגימה, הניחו מיד דגימות צחצוח אף בתוך מדיום התרבית. רצועות אפיתל נשימתי המתקבלות נעקרות ממקומן על-ידי התסיסה של המברשת בצינור המכיל את תוספת M199, ואז סוגרות את הצינור (איור 1E).
- הסתגלות לקורונה: אין לעקור רצועות אפיתל על ידי התסיסה של המברשת בתוסף M199 מיד לאחר הדגימה. הניחו את המברשת בצינור, חתכו את החוט כך שיוכל להיכנס לחלוטין לתוך הצינור, וסגרו את הצינור מיד. הכניסו את הדגימה לשקית כפולה אטומה.
- יש להכניס בעדינות את צחצוח האף ללא הרדמה מקומית או כללית13. אם באמצעות אנדוסקופיה האף, מניחים את האנדוסקופ בכניסה לאף כדי לדמיין את טורבינאט האף הנחות, ולאחר מכן להכניס את מברשת הציטולוגיה באף. אם אתם מבצעים צחצוח אף "מסונוור", הכניסו את המברשת לאף, בעקבות רצפת האף (איור 1D).
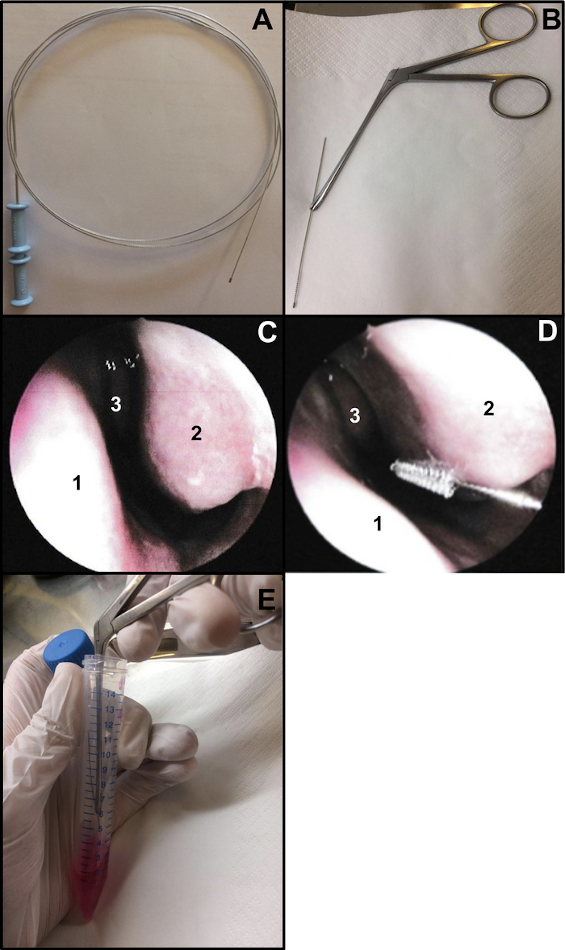
איור 1: טכניקת צחצוח האף. (A) מברשת ציטולוגיה שלמה של הסימפונות (B) מוכנה למברשת: קצה ההברשה של החוט נחתך (באורך של כ-15 ס"מ) ומוחזק על ידי מלקחיים לאף של וייל-בלייקסלי(C) מבט אנדוסקופי על חלל האף: מחיצה (1) טורבינאט נחות (2) וטורבינאט אמצעי (3) (D) צחצוח האף מתבצע בחלק האחורי של הטורבינאט התחתון (2). מחיצת אף (1) טורבינאט אמצעי (3). (E) רצועות האפיתל הנשימתי נעקרות על ידי ניעור המברשת בתווך תרבית התאים M199 המוסף. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
3. עיבוד אפיתל נשימתי
- נתח דגימות צחצוח אף תחת מיקרוסקופ תוך 9 שעות לאחר הדגימה, מכיוון שגם CBF וגם CBP יציבים במסגרת זמן זו (נתונים שלא פורסמו).
- השתמש במיקרוסקופ אור זקוף או הפוך, עם ניגודיות פאזה טבילת שמן x100 או עדשת ניגודיות התאבכות. באופן אידיאלי, הניחו את המיקרוסקופ על שולחן נגד רטט מכיוון שהכאה ריסונית עשויה להיות כפופה לממצאים עקב תנודות חיצוניות (למשל מספסל המעבדה)13.
הסתגלות לקורונה: המפעיל משתמש בציוד מגן אישי לביצוע עיבוד האף, כולל מסכת FFP2, כפפות וחלוק עמיד במים עם שרוולים ארוכים.
- הכן את תא ההדמיה.
- השהו את רצועות האפיתל המרוסנות בתא הדמיה פתוח שנבנה במעבדה, ואפשרו לריסונים לפעום בחופשיות תוך כדי ניתוח תחת המיקרוסקופ. תא זה נוצר על ידי הפרדה של חלקת כיסוי (22 מ"מ x 40 מ"מ) ומגלשת זכוכית על ידי שתי החלקות כיסוי מרובעות סמוכות (20 מ"מ x 20 מ"מ), המופרדות במרחק של 15 מ"מ, ומודבקות על שקופית זכוכית12 (איור 2, איור 4A).
הסתגלות לקורונה: התא שנבנה במעבדה המתואר לעיל פתוח, ומאפשר חילופי גזים ולחות בין הדגימה לסביבה13. בהקשר של מגפת COVID-19, ניתן להשתמש בתא הדמיה סגור באמצעות ספייסר תקוע דו-צדדי, בעומק 0.25 מ"מ (איור 3, איור 4B). הספייסר תקוע על מגלשת הזכוכית, ואז מחליק כיסוי (22 מ"מ x 40 מ"מ) תקוע על גבי הספייסר.

איור 2: הרכבה של החדר הפתוח שנבנה במעבדה. (A) 2 הכיסויים המרובעים (20 מ"מ x 20 מ"מ) מונחים על מגלשת הזכוכית. (B) פתקי הכיסוי המרובעים מופרדים במרחק של כ-15 מ"מ, ומודבקים על מגלשת הזכוכית. (C) התא ממולא בין שני פתקי הכיסוי המרובעים הסמוכים בדגימה קטנה (כ-60 מיקרוליטר) של אפיתל ריסוני בתוספת M199. (D) תלוש כיסוי מלבני ארוך (22 מ"מ x 40 מ"מ) מונח על שני פתקי הכיסוי המרובעים הסמוכים, ומכסה את החדר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 3: הרכבה של התא הסגור באמצעות ספייסר תקוע דו-צדדי. (A) מגלשת הזכוכית והספייסר התקוע הדו-צדדי. (B) ההגנה מוסרת בצד אחד של הספייסר, ואז הספייסר תקוע על מגלשת הזכוכית. (C) ההגנה מוסרת מהצד השני של הספייסר התקוע הדו-צדדי, ואז הספייסר מתמלא בדגימה קטנה (כ-60 מיקרוליטר) של אפיתל ריסני בתוספת M199. (D) מכסה מלבני ארוך (22 מ"מ x 40 מ"מ) תקוע על הספייסר וסוגר את החדר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
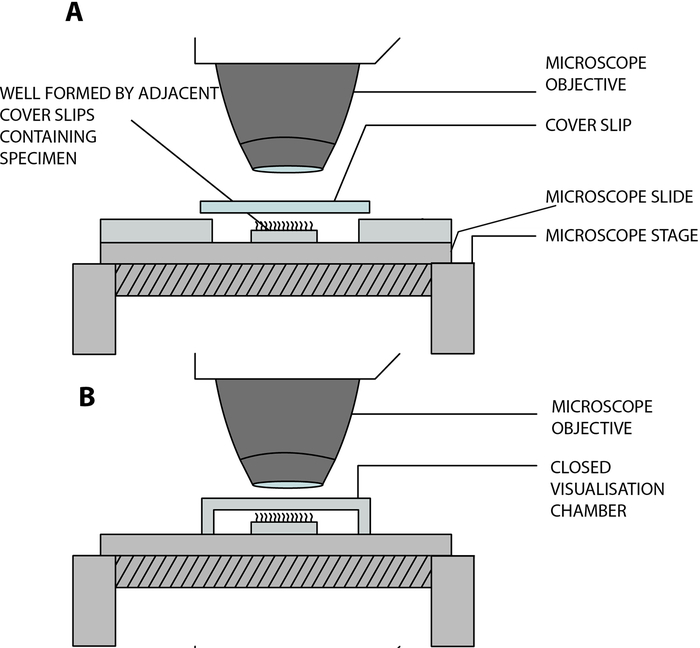
איור 4: דיאגרמה סכמטית המציגה את תאי התצוגה החזותית העיקריים המשמשים לביצוע מיקרוסקופ וידאו ריסני באמצעות מיקרוסקופ וידאו דיגיטלי במהירות גבוהה (DHSV). (A) טכניקת הטיפה התלויה הפתוחה: הדגימה המרוסקת תלויה בטיפת מדיום תרבית תאים בתא פתוח שנוצר על ידי הפרדה של תלוש כיסוי ושקופית זכוכית על ידי שני כיסויים סמוכים. (B) טכניקת הטיפה התלויה הסגורה: הדגימה המרוסקת תלויה בטיפת תווך תרבית תאים בתא סגור שנוצר על ידי ספייסר הדחוק בין צד זכוכית לחלקת כיסוי. הספייסר נדבק בחוזקה הן למגלשת הזכוכית והן למחליק הכיסוי. הועתק ושונה מ Kempeneers et al.13. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
- שליטה בטמפרטורה
- הקיפו את המיקרוסקופ בניילון בועות (איור 5A,B).
- חברו את מחמם העדשה סביב המטרה באמצעות רצועת סקוטש (איור 5C)
- הפעל את בקר מחמם העדשות שעה אחת לפני ביצוע בדיקת טמפרטורת הבקרה.
- הפעל את המיקרוסקופ ובדוק שהגדרת המיקרוסקופ נעשתה, שכן כמות האור דרך הדגימה יכולה לשנות את הטמפרטורה בשקופית.
- הפעילו את בקר הקופסה המחוממת (איור 5D).
- ודא שבדיקת הייחוס פועלת כראוי לפני שתתחיל. להחזיק את קצה הבדיקה התייחסות בין האצבעות; זה צריך למדוד את טמפרטורת הגוף.
- שים מדיה חופשית במרכז השקופית, בין שני פתקי הכיסוי המרובעים הסמוכים (20 מ"מ x 20 מ"מ) המודבקים עליה.
- מקם את קצה בדיקת הייחוס ב- M199 המשלים. יש לכסות בכיסוי מלבני (22 מ"מ x 40 מ"מ). ודא כי הבדיקה מוקפת לחלוטין על ידי מדיה (אחרת הטמפרטורה עלולה לרדת).
- הסתגלות לקורונה: כדי לבצע את בקרת הטמפרטורה בתא הסגור באמצעות ספייסר, חתכו צד אחד של הספייסר (חור זה חייב להיות באותו גודל כמו גשושית הייחוס). הדביקו את הספייסר על שקופית הזכוכית, הניחו מדיה חופשית במרכז הספייסר. הניחו את קצה גשושית הייחוס לתוך התמיסה, דרך החור של הספייסר, ואז הדביקו כיסוי מלבני (22 מ"מ x 40 מ"מ) על הספייסר.
- מניחים את המגלשה בצלחת של הקופסה המחוממת. סגור את הקופסה המחוממת עם המכסה.
- הוסיפו שמן על המטרה של טבילת שמן.
- מניחים את הקופסה המחוממת על במת המיקרוסקופ.
- התאם את טמפרטורת הצלחת והמכסה (טמפרטורת המכסה צריכה להיות גבוהה ב -2 ° C מטמפרטורת הצלחת כדי למנוע עיבוי) כדי למדוד 37 ° C עם בדיקת הייחוס בתווך.
- המתן 5 דקות (הזמן הדרוש כדי להעלות את הטמפרטורה של הדגימה ל 37 ° C).
- כוונן את המטרה, קרב אותה לשקופית עד שתיגע בקצה העדשה בכיסוי.
- הזיזו את המטרה כדי לראות את מרכז הגשושית במיקרוסקופ.
הערה: ודא שהבדיקה נראית על מסך המחשב (כדי לבדוק שמערכת המצלמה פועלת לפני שאתה מסתכל על הדגימה המרוססת). בעת צפייה במרכז הגשוש, המסך שחור לחלוטין. - כוונן את הטמפרטורה של מחמם העדשות (כדי לפצות על אובדן הטמפרטורה כאשר עדשת טבילת השמן באה במגע עם הכיסוי). הקפד למדוד 37 ° C עם בדיקת הייחוס בתוך התווך כאשר המטרה נוגעת בהחלקת הכיסוי.
הערה: באופן אידיאלי, עבוד בחדר עם טמפרטורה מבוקרת, כך שהטמפרטורות שהוגדרו לא ישתנו. אם טמפרטורת החדר אינה נשלטת, עליך לבצע בדיקת בקרת טמפרטורה זו מדי יום לפני ביצוע וידאומיקרוסקופיה ריסנית. - לאחר בדיקת הטמפרטורה, הסר את המגלשה מהקופסה המחוממת.
- נקו את המגלשה ואת קצה בדיקת הייחוס עם אלכוהול והניחו בצד.
- נקה את העדשה עם איזופרופנול ורקמות ניקוי עדשה בתנועות סיבוביות.

איור 5: ציוד המשמש במעבדת DHSV. (A) המיקרוסקופ המצויד בעדשת ניגודיות פאזה טבילת שמן 100x, מונח על שולחן נגד רטט כדי למנוע שתנודות חיצוניות יגרמו לממצאים לניתוח פונקציונלי ריסני (B) המיקרוסקופ מוקף בניילון בועות כדי למנוע איבוד חום מאוויר הסביבה. (C) מטרת טבילת השמן יוצרת איבוד חום. ניתן למנוע זאת באמצעות מחמם עדשות (חצים). (D) הדגימה מחוממת באמצעות קופסת חימום. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
4. הכנת דגימות אפיתל ריסניות נשימתיות
- נערו את הצינורית בעדינות כדי לאפשר לריסונים להתפשט ברחבי הצינור (כדי למנוע מריסונים להיתקע על רצועות ריסונים אחרות, ריר או פסולת, המונעים מהם לפעום בחופשיות).
הערה: שלב זה חיוני להשגת "קצוות אופטימליים" של אפיתל ריסוני (איור 12). - למשוך כ 50 μL של אפיתל ciliated בתוספת M199 באמצע הצינור עם פיפטה.
- הניחו את הדגימה על התא שנבנה במעבדה (בין שני פתקי הכיסוי המרובעים הסמוכים (20 מ"מ x 20 מ"מ)) וכסו בכיסוי מלבני (22 מ"מ x 40 מ"מ). היזהרו לא להוסיף בועות.
- הסתגלות לקורונה: בצע שלבים 4.1-4.3 בארון בטיחות מיקרוביולוגי. נוהל בארון הבטיחות המיקרוביולוגי.
- הפעילו את ארון הבטיחות המיקרוביולוגי 10 דקות לפני הכנת הדגימה (כדי לוודא שהסביבה סטרילית).
- לפני כל טיפול, יש לחטא את כל ארון הבטיחות המיקרוביולוגי באתנול 70%.
- יש לחטא את כל החומר הדרוש באתנול 70% לפני הכנסתו לארון הבטיחות המיקרוביולוגי.
- פתח את צינורות החרוט של 15 מ"ל המכילים את הדגימות רק פעם אחת מתחת לארון הבטיחות המיקרוביולוגי, ולאחר מכן עקר רצועות אפיתל על ידי תסיסה של המברשת (באמצעות מלקחיים לאף של וייל-בלייקסלי) בתוספת M199.
- הדביקו את הספייסר על מגלשת הזכוכית והסר את ההגנה מהספייסר התקוע הדו-צדדי.
- נערו את הצינורית בעדינות כדי לאפשר לריסונים להתפשט ברחבי הצינור.
- משכו דגימה קטנה של אפיתל ריסני בתוסף M199 מאמצע הצינור עם פיפטה (כ-60 מיקרוליטר) ומלאו את הספייסר.
- הדביקו את הכיסוי המלבני (22 מ"מ x 40 מ"מ) על המרווח כדי לסגור את התא.
- יש לחטא את המגלשה לפני היציאה מארון הבטיחות המיקרוביולוגי.
- הסר את המגלשה מארון הבטיחות המיקרוביולוגי.
- החליפו כפפות ביציאה מארון הבטיחות המיקרוביולוגי.
- יש להמתין 10 דקות לפני כיבוי ארון הבטיחות המיקרוביולוגי לאחר השימוש (כדי לוודא שסביבת ארון הבטיחות המיקרוביולוגי סטרילית לפני סגירת הדלת).
- מניחים את המגלשה בצלחת של הקופסה המחוממת. סגור את הקופסה המחוממת עם המכסה.
- הוסיפו שמן על המטרה של טבילת שמן.
- מניחים את הקופסה המחוממת על במת המיקרוסקופ.
- הפעל את הקופסה המחוממת ואת מחמם העדשות.
הערה: יש להפעיל את מחמם העדשות שעה אחת לפני השימוש. - התאם את הגדרות הטמפרטורה של הקופסה המחוממת ובקרי מחמם העדשות בהתאם לערכים שהתקבלו בשלב 3.4.
- המתן 5 דקות (הזמן הדרוש לעליית הטמפרטורה של הדגימה עד 37 מעלות צלזיוס בעת שימוש בהגדרות שנקבעו מראש הן עבור הקופסה המחוממת והן עבור תנור החימום האובייקטיבי).
- התקרבו למטרה עד לשקופית עד שנגעו בקצה העדשה בכיסוי.
5. הדמיה של קצוות ריסניים נשימתיים
- קבע את מצלמת הווידאו המהירה למיקרוסקופ, חבר את המצלמה למחשב והפעל את המצלמה.
- הפעל את המחשב.
- חבר את מצלמת הווידיאו מיקרוסקופיה הדיגיטלית במהירות גבוהה למחשב (כך שהתמונה הנצפית דרך עדשות העין תוקרן על הצג) באמצעות התוכנה.
- פתח את התוכנה ולאחר מכן התפריט הראשי נפתח באופן אוטומטי (איור 6A).
הערה: התוכנה היא התוכנה המשמשת במעבדה לרכישת תמונה ועיבוד. המערכת מאפשרת להקליט ולהשמיע רצפי וידאו בקצב פריימים מופחת או פריים אחר פריים. ניתן להוריד אותו בחינם. - מצלמה פתוחה (איור 6A).
- כאשר מסנן ספירת המצלמה מופיע, בחר אישור (איור 6B).
- בחר רענן רשימה; בחר את שם המצלמה; בחר את הממשק: מומחה ולאחר מכן בחר פתח (איור 6C).
- בקו הבקרה של המצלמה בחלק העליון של תפריט הדו-שיח המעוגנת, בחר Live (Figure 6D).
- בחרו 'הפעל' כדי להציג את התמונה ו'עצור' כדי לסיים את הצפייה (איור 6D).
- פתח את התוכנה ולאחר מכן התפריט הראשי נפתח באופן אוטומטי (איור 6A).

איור 6: תיאור השימוש בתוכנה: הדמיה של קצוות ריסניים נשימתיים על הצג. (A) התפריט הראשי מופיע ישירות בעת פתיחת התוכנה. (ב) סגור את מסנן ספירת המצלמה. (C) בחר את המצלמה ובחר ממשק: מומחה. (D) מצב החי מאפשר לדמיין על הצג את התמונה הנראית דרך המיקרוסקופ. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
- כוונן את הגדרת רכישת המצלמה (בפינה השמאלית העליונה) (איור 7).
- ב ״הגדרות רכישה ״, בחר /י ״מצלמה״ ולאחר מכן התאם את קצב הפריימים: קצב (Hz): 500 (ראה להלן) (איור 7A).
- בהגדרות רכישה, בחר מצלמה ולאחר מכן התאם את אזור העניין (ROI) (איור 7A).
הערה: החזר ההשקעה מחושב באמצעות סולם מדורג שנצפה עם המטרה x100 טבילת שמן ומוקרן על הצג, כדי להגדיר את מספר הפיקסלים המתאימים ל- 50 מיקרומטר (מכיוון שברצונך להקליט קצוות ריסונים בגודל של כ- 50 מיקרומטר (ראה להלן)). - בהגדרות רכישה, בחר הקלט, ולאחר מכן התאם את משך הווידאו ואת המספר הכולל של פריימים שהוקלטו (משך של 2 שניות, מתאים ל- 1000 פריימים אם קצב הפריימים שנבחר הוא 5OO Hz) (איור 7B).
הערה: מניסיוננו, יש צורך באורך וידאו מינימלי של 2 שניות כדי לאפשר ניתוח מלא של CBF ו- CBP. - בחר File ולאחר מכן Save Camera Cfg כדי לשמור את הגדרת הרכישה החדשה (הזן שם ובמידת הצורך הערה עבור תצורה חדשה זו) (איור 7C,D).
- כדי לפתוח תצורת מצלמה חדשה זו, פתח קובץ וטען Cfg מצלמה (איור 7C).
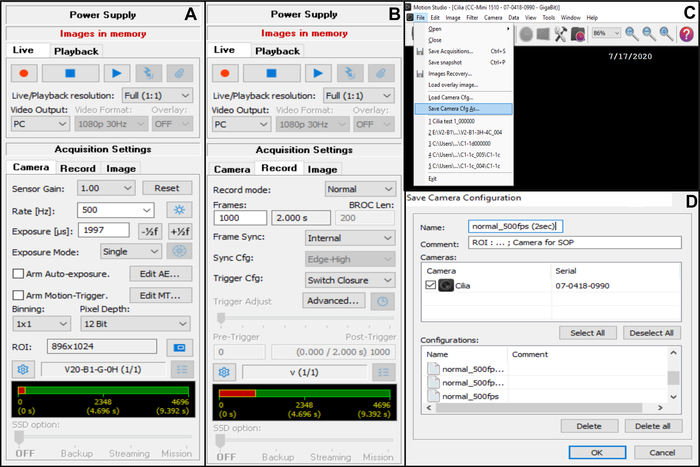
איור 7: תיאור השימוש בתוכנה: התאמת הגדרות רכישת המצלמה להקלטת וידאו של הקצוות המכים בקצוות. (A) בהגדרת הרכישה מצלמה, התאם את אזור העניין (ROI) ואת קצב הפריימים להקלטת וידאו (Rate). (ב) בהגדרת הרכישה רשומה, התאם את משך הקלטת הווידאו (מספר הפריימים הדרושים למשך ההקלטה שנבחר, בהתאם לקצב הפריימים שנבחר קודם לכן). (C) ניתן לשמור הגדרות תצורה חדשות אלה של המצלמה באמצעות הפונקציה Save camera Cfg . טען מצלמה Cfg מאפשר לפתוח מחדש את הגדרות התצורה שנשמרו לשימוש נוסף. (D) ניתן לתת שם להגדרות תצורת המצלמה החדשות, ולהוסיף הערה במידת הצורך. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
- צפו דרך עדשות עיניים וחפשו תאים או פסולת בתוך הדגימה, ואז התמקצעו.
- ודא שהתמונה גלויה על הצג, ושפר את איכות התמונה על-ידי התאמת המעבה (ואת מנסרת DIC אם משתמשים בעדשת ניגודיות הפרעה), וכוונן את המיקוד במידת הצורך.
- חפש רצועות של אפיתל ciliated.
6. בחירת קצוות ריסונים נשימתיים
הערה: המערכת הניסויית מאפשרת לצפות בריסונים פועמים בשלושה מישורים נפרדים: פרופיל צדדי, פועם ישירות לכיוון הצופה, ומלמעלה ישירות (איור 8).
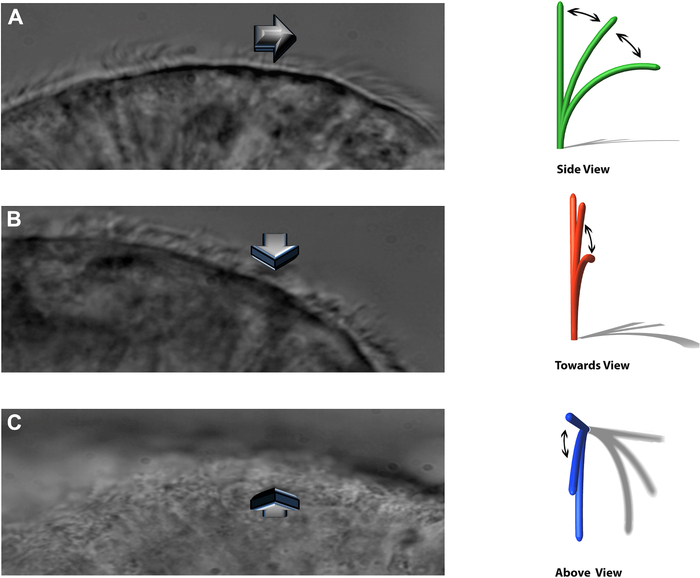
איור 8: טכניקת DHSV מאפשרת לראות ריסונים פועמים בשלושה מישורים נפרדים. (A) בפרופיל הצידי. (ב) מכות ישירות כלפי המתבונן ו-(ג) ישירות מלמעלה. הועתק מתוך Kempeneers et al.16. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
- רשום רק קצוות אפיתל שלמים ללא הפרעה שאורכם לפחות 50 מיקרומטר.
- עבור רשומות שנעשו בפרופיל הצידי, קבעו את איכות הקצה על פי שיטת הניקוד Thomas et al.29 (איור 9). השתמשו רק בקצוות רגילים (איור 9A) או בקצוות עם הקרנות מינוריות (איור 9B) לניתוח פונקציונלי ריסני. אל תכלול תאים מבודדים (איור 9E).

איור 9: תמונה מייצגת של שיטת הניקוד על ידי Thomas et al29 עבור האיכות השונה של קצוות אפיתל ciliated. (A) קצה רגיל: מוגדר כרצועת אפיתליה ריסנית אחידה שלמה באורך > 50 מיקרומטר (B) קצה ריסוני עם בליטות מינוריות: מוגדר כקצה באורך >50 מיקרומטר, עם תאים המקרינים מקו קצה האפיתל, אך ללא נקודה של קרום התא האפי המוקרנת מעל קצות הריסים על התאים הסמוכים (Cקצה ריסוני עם בליטות עיקריות: מוגדר כקצה באורך >50 מיקרומטר, כאשר תאים מקרינים מקו קצה האפיתל, כאשר לפחות נקודה אחת של קרום התא האפי מקרינה מעל קצות הריסים על התאים הסמוכים (D) תא ריסוני מבודד: מוגדר כתא הריסי היחיד בקצה אפיתל באורך >50 מיקרומטר (Eתאים בודדים: מוגדרים כתאים ריסונים שאין ביניהם מגע בינם לבין עצמם או כל סוג תא אחר. סרגל קנה מידה: 5.5 מיקרומטר. הועתק מתוך Thomas et al.29אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
- בצע CFA באמצעות ריסונים בלבד ללא ריר ולכלוך, והכה בפרופיל שנבחר עבור הקצה המוקלט. בחר רק קצוות מרוסקים המאפשרים לפחות 2 הערכת CBF ו- CBP (ראה להלן) לאורך הקצה.
- השתמש עבור CFA רק דוגמאות המניבות מינימום של 6 קצוות פועמים בפרופיל הצידי ועומדים בקריטריונים לעיל; נתח עד 20 קצוות בפרופיל הצידי.
- השתמש לפחות 1 קצה נוסף של ריסונים פועם מעל פרופיל הצופה כדי לאפיין את CBP.
7. הקלטת קצה מרוסס
- הקלט את קצה הריסונים הפועם באמצעות קצב פריימים של 500 פריימים לשנייה במצלמה, והקרן על צג ברזולוציה גבוהה. נדרש קצב מסגרות מינימלי של 400 הרץ כדי לאפשר ניתוח של CBF ו- CBP13. הקלט קצה אחד בקצב מסגרות של 30 מסגרות לשנייה כדי להעריך את יעילות פינוי החלקיקים.
- בחר Live, בקו הבקרה של המצלמה בחלק העליון של תפריט הדו-שיח המעוגן (איור 6D)
- בחרו 'הפעל' כדי להציג את התמונה ו'עצור' כדי לסיים את הצפייה (איור 6D)
- כדי להקליט קצה, הקש Record (איור 6D). כדי להציג את ההקלטה לפני השמירה, עבור אל קו הבקרה של המצלמה בחלק העליון של תפריט הדו-שיח המעוגן ובחר הפעלה. בחר הפעל כדי להציג את הווידאו שהוקלט ועצור כדי לסיים את הצפייה (איור 10A).
הערה: הפסק להציג את הקצה המוקלט לפני השמירה.
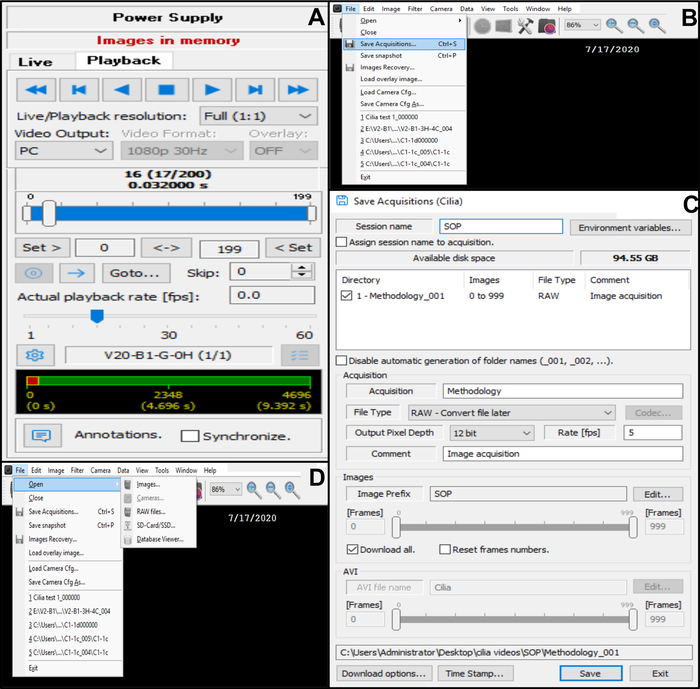
איור 10: תיאור השימוש בתוכנה. (A) מצב הפעלה. כדי לסקור רצף וידאו מוקלט של מכות קצה מרוסס, בחר במצב הפעלה. בחר הפעל כדי להציג את התמונה ועצור כדי לסיים את הצפייה. ניתן להתאים את שיעור התהילה כדי לשפר את ניתוח הפונקציה הרירית (B, C) שמירת הקלטות הווידאו של קצוות מכים (B) כדי לשמור את הסרטון, בחר קובץ ואז שמור רכישות. (ג) הזן את שם הסרטון המוקלט ובחר את המיקום שבו מוקלט הסרטון. ודא שההקלטה נשמרת כ- . קובץ RAW (D) בחירה של הקלטה של קצוות מכים לניתוח: כדי לפתוח הקלטת וידאו, בחר קובץ, לאחר מכן פתח ולאחר מכן תמונות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
- שמור את הווידאו במסד הנתונים (איור 10B,C).
- פתחו את 'קובץ' בפינה השמאלית העליונה ולאחר מכן שמרו רכישות (איור 10B).
- בתיבה שמור רכישות, הזן את שם הווידאו המוקלט וודא שההקלטה נשמרת כתבנית סוג קובץ RAW (איור 10C).
- לאחר שמירת הווידאו, חזור למצב שידור חי (חזור לקו הבקרה של המצלמה בחלק העליון של תפריט הדו-שיח המעוגן ובחר בשידור חי) (איור 6D).
- חזור על ההליך כדי לרשום את מספר הקצוות העומדים בקריטריוני הבחירה הדרושים עבור CFA.
הערה: ניתן להקליט מספר קצוות מכים העומדים בקריטריוני הבחירה משקופית אחת, תוך 20 דקות לכל היותר לאחר הכנת השקף (כדי למנוע התייבשות). לאחר 20 דקות, אם לא ניתן להשיג מספיק קצוות העומדים בקריטריוני הבחירה, הכן שקופית חדשה. - הסר את השקופית מהקופסה המחוממת.
- הסירו את הכיסוי המלבני והשליכו אותו למיכל הפסולת הרפואית המסוכנת הספציפית.
- נקו את השקופית (כששני פתקי הכיסוי הריבועיים מודבקים עליה) עם 70% אתנול ונייר סופג. לאחר שהשקופית נקייה, ניתן להשתמש בה שוב.
- הסתגלות לקורונה: הניחו את המגלשה עם הכיסוי והספייסר בשקית אטומה, הסירו את הכפפות והמסכה והניחו אותן בשקית האטומה. הניחו את השקית האטומה במיכל הפסולת הרפואית המסוכנת הספציפית.
8. ניתוח פונקציונלי ריסני
- הכנה ראשונית לביצוע הערכת CBF ו- CBP ידנית
- פתח את התוכנה.
- פתחו את 'קובץ ' בפינה השמאלית העליונה, לאחר מכן ' פתח ' ולאחר מכן 'תמונות ' (איור 10D).
- בחר את הסרטון לניתוח.
- עבור אל קו הבקרה של המצלמה בחלק העליון של תפריט הדו-שיח המעוגן ובחר הפעלה (איור 10A). בחר הפעל כדי להציג את הווידאו שהוקלט ועצור כדי לסיים את הצפייה.
- ניתוח ידני של תדירות פעימות ריסניות (CBF)
- בצע את הערכת CBF באמצעות הקצוות הצידיים בלבד.
- חלקו את הקצוות המרוססים ל-5 אזורים סמוכים בקירוב, שכל אחד מהם בגודל של כ-10 מיקרומטר (איור 11).
- זהו והדמיינו ריסונים או קבוצות ריסונים בקצב פריימים מופחת, ומקסימום 2 מדידות CBF מתבצעות בכל אזור, והתוצאה היא מקסימום 10 מדידות CBF לאורך כל קצה (איור 11).
- רשום את מספר המסגרות הדרוש לקבוצת ריסונים כדי להשלים 5 מחזורי פעימה.
- המר ל- CBF בחישוב פשוט: (CBF = קצב מסגרות הקלטה (Hz) / (מספר מסגרות עבור 5 פעימות) x 5)13,16,30. ריסונים תנועתיים מדווחים כבעלי CBF של 0 הרץ13.
הערה: התאם את קצב הפריימים בעת הפעלת הסרטונים שהוקלטו (איור 10A). זה שימושי במיוחד כאשר ריסונים ניתח להכות לאט מאוד. הגדלת קצב המסגרות מסייעת להגדיר אם הריסים פועמים לאט מאוד או שהם חסרי תנועה. - עבור כל דגימה, חשב את ממוצע CBF כממוצע (SD) או (95% CI) של כל CBF שנרשם בפרופיל הצידי, כולל ריסונים סטטיים.
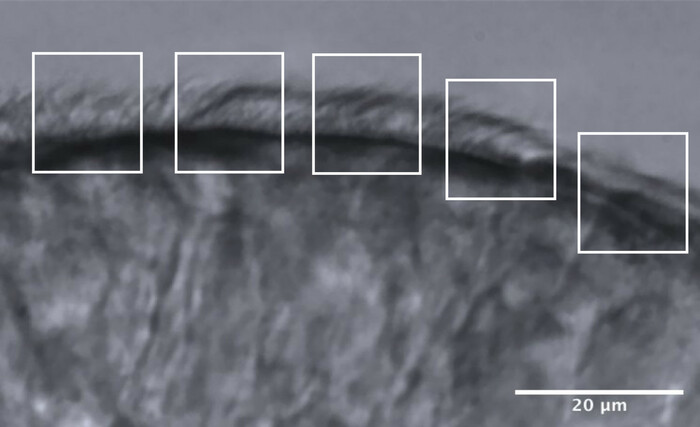
איור 11: תמונה מייצגת של יתרון איכות אופטימלי, והחלוקה ל-5 תחומים כדי לאפשר ניתוח CFA. קצה אפיתל ריסני באיכות אופטימלית מחולק ל-5 אזורים סמוכים בגודל 10 מיקרומטר כל אחד. מקסימום של 2 מדידות CBF (ו -2 הערכת CBP) נעשות בכל אזור, וכתוצאה מכך מקסימום של 10 מדידות CBF (והערכות CBP) לאורך כל קצה. סרגל קנה מידה = 20 מיקרומטר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
- ניתוח ידני של תבנית פעימות ריסניות (CBP)
- כדי להעריך את הסמנים של דיסקינזיה, השתמש בפרופיל הצידי בלבד; השתמש במישורים לכיוון הצופה ומלמעלה כדי לאפיין את סוג CBP13. קיימות שיטות וציונים שונים להערכת CBP. להלן מתוארת השיטה המשמשת במעבדה עם ההגדרה של סמנים של dyskinesia.
- האחוז של כל CBP מובהק בתוך המדגם
- עבור כל ריסונים או קבוצת ריסונים שזוהו ושימשו למדידת CBF (איור 11), בצעו ניתוח CBP בקצב פריימים מופחת: השוו את הנתיב המדויק שנלקח על ידי הריסונים במהלך מחזור פעימות מלא עם CBP נורמלי שנצפה בניתוח DHSV12,30.
- ייחוס CBP מובהק (נורמלי, בלתי תנועתי, נוקשה, מעגלי, אסינכרוני (מכות ריסניות לא מתואמות) או דיסקינטי13) לכל ריסונים או קבוצת ריסונים שנותחו.
- עבור כל מדגם, חשב את האחוז של כל CBP נפרד בתוך המדגם; ה- CBP המיוחס למדגם הוא ה- CBP הדומיננטי שנצפה.
- חשב את 3 הסמנים של dyskinesia.
- חישוב מדד חוסר התנועה (תעש): אחוז ריסוני התנועה בתוך המדגם (מספר CBF=0/המספר הכולל של קריאות CBF במדגם X 100). בטא את תעש כממוצע (SD) או (95% CI)1,16,31.
- חישוב ציון דיסקינזיה (DKS). מחלקים כל קצה מרוסס לרבעים, ונקבע מספר הרבעים עם ריסונים דיסקינטיים (או פועמים באופן חריג). זה מאפשר לחשב DKS בין 0 ל -4 (0: CBP נורמלי בכל הקצה; 1: CBP חריג ב ≤ 25% של ריסונים; 2: CBP חריג ב ≤ 50% של ריסונים; 3: דפוס פעימות חריג ב ≤ 75% של ריסונים; ו 4: CBP חריג בכל ריסונים). חציון DKS (טווח בין-רבעוני) מחושב עבור המדגם16,29.
- חישוב אחוז הפעימות הנורמליות: מוגדר כאחוז ריסונים עם CBP נורמלי בתוך המדגם (מספר קריאות CBP נורמליות / המספר הכולל של קריאות CBP עבור המדגם x100).
תוצאות
כדי להמחיש את יעילות הטכניקה, אנו מציגים את תוצאות CFA בסדרה של 16 מתנדבים בוגרים בריאים (5 גברים, טווח הגילאים 22-54 שנים).
דגימות צחצוח אף מ -14 (4 גברים, טווח הגילאים 24-54 שנים) מתוך סך של 16 מתנדבים סיפקו מספיק קצוות אפיתל מתאימים שעמדו בקריטריוני הבחירה הדרושים לביצוע CFA. מתוך 14 דגימ?...
Discussion
מאמר זה נועד לספק נוהל הפעלה סטנדרטי עבור CFA באמצעות דגימות צחצוח האף, עם התאמות שבוצעו לשיקולי בקרת זיהום מתאימים במהלך מגיפת COVID-19. אבחון PCD הוא מאתגר, וכיום דורש פאנל של בדיקות אבחון שונות, על פי המלצה בינלאומית, כולל מדידת תחמוצת החנקן באף, CFA באמצעות DHSV, ניתוח אולטרה-סטרוקטורלי ריסני באמצ...
Disclosures
למחברים אלה אין מה לחשוף.
Acknowledgements
ברצוננו להודות לז'אן-פרנסואה פאפון, ברונו לואי, אסטל אסקודיה ולכל חברי הצוות של מרכז אבחון PCD בפריז-אסט על זמינותם וקבלת הפנים הלבבית במהלך הביקור במרכז אבחון ה- PCD שלהם, והחילופים הרבים. אנו מודים גם לרוברט הירסט ולכל חברי הצוות במרכז PCD בלסטר על קבלת הפנים והזמן, העצות והמומחיות.
Materials
| Name | Company | Catalog Number | Comments |
| 15 mL conical tubes | FisherScientific | 352096 | 15 ml High-Clarity Polypropylene Conical Tube with lid |
| Amphotericin B | LONZA | 17-836E | Antifungal solution |
| Blakesley-weil nasal forceps | NOVO SURGICAL | E7739-12 | Used to hold the brush to perform the nasal brushing |
| Bronchial cytology brush | CONMED | 129 | Used for nasal brushing |
| Cotton swab | NUOVA APTACA | 2150/SG | Used for COVID-19 testing |
| Digitial high-speed videomicroscopy camera | IDTeu Innovation in motion | CrashCam Mini 1510 | |
| Glass slide | ThermoScientific | 12372098 | Microscope slides used to create the visualization chamber |
| Heated Box | IBIDI cells in focus | 10918 | Used to heat the sample |
| Inverted Light microscope | Zeiss | AXIO Vert.A1 | |
| Lens Heater | TOKAI HIT | TPiE-LH | Used to heat the oil immersion lens |
| Medium 199 (M199), HEPES | TermoFisher Scientific | 12340030 | Cell Culture Medium |
| Motion Studio X64 | IDT Motion | version 2.14.01 | Software |
| Oil | FischerScientific, Carl Zeiss | 11825153 | |
| Rectangular cover slip | VWR | 631-0145 | Used to cover the visualization chamber |
| Spacer (Ispacer) 0.25 mm | Sunjinlab | IS203 | Used for the creation of the hermetic closed visualization chamber |
| Square cover slip | VWR | 631-0122 | Used for the creation of lab-built open visualization chamber |
| Streptomycin/Penicillin | FisherScientific, Gibco | 11548876 | Antiobiotics solution |
References
- Chilvers, M. A., Rutman, A., O'Callaghan, C. Ciliary beat pattern is associated with specific ultrastructural defects in primary ciliary dyskinesia. Journal of Allergy Clinical Immunology. 112 (3), 518-524 (2003).
- Werner, C., Onnebrink, J. G., Omran, H. Diagnosis and management of primary ciliary dyskinesia. Cilia. , 1-9 (2015).
- Kempeneers, C., Chilvers, M. A. To beat, or not to beat, that is question! The spectrum of ciliopathies. Pediatric Pulmonology. 53 (8), 1122 (2018).
- Lucas, J. S., et al. European Respiratory Society guidelines for the diagnosis of primary ciliary dyskinesia. The European Respiratory Journal. 49 (1), (2017).
- Knowles, M. R., Zariwala, M., Leigh, M. Primary Ciliary Dyskinesia. Clinics in chest medicine. 37 (3), 449-461 (2016).
- Shapiro, A. J., et al. Diagnosis, monitoring, and treatment of primary ciliary dyskinesia: PCD foundation consensus recommendations based on state of the art review. Pediatric Pulmonology. , (2016).
- Fitzgerald, D. A., Shapiro, A. J. When to suspect primary ciliary dyskinesia in children. Paediatric Respiratory Reviews. , (2016).
- Shoemark, A., Dell, S., Shapiro, A., Lucas, J. S. ERS and ATS diagnostic guidelines for primary ciliary dyskinesia: similarities and differences in approach to diagnosis. European Respiratory Journal. 54 (3), (2019).
- Mirra, V., Werner, C., Santamaria, F. Primary ciliary dyskinesia: An update on clinical aspects, genetics, diagnosis, and future treatment strategies. Frontiers in Pediatrics. 5, 1-13 (2017).
- Ardura-Garcia, C., et al. Registries and collaborative studies for primary ciliary dyskinesia in Europe. European Respiratory Journal Open Research. 6 (2), (2020).
- Leigh, M. W., et al. Clinical features and associated likelihood of primary ciliary dyskinesia in children and adolescents. Annals of the American Thoracic Society. , (2016).
- Chilvers, M. A., O'Callaghan, C. Analysis of ciliary beat pattern and beat frequency using digital high speed imaging: comparison with the photomultiplier and photodiode methods. Thorax. 55 (4), 314-317 (2000).
- Kempeneers, C., Seaton, C., Garcia Espinosa, B., Chilvers, M. A. Ciliary functional analysis: Beating a path towards standardization. Pediatric Pulmonology. 54 (10), 1627-1638 (2019).
- Barbato, A., et al. Primary ciliary dyskinesia: a consensus statement on diagnostic and treatment approaches in children. The European respiratory journal. 34 (6), 1264-1276 (2009).
- Raidt, J., et al. Ciliary beat pattern and frequency in genetic variants of primary ciliary dyskinesia. European Respiratory Journal. 44 (6), 1579-1588 (2014).
- Kempeneers, C., Seaton, C., Chilvers, M. A. Variation of Ciliary Beat Pattern in Three Different Beating Planes in Healthy Subjects. Chest. 151 (5), 993-1001 (2017).
- Götzinger, F., et al. COVID-19 in children and adolescents in Europe: a multinational, multicentre cohort study. The Lancet Child & Adolescent Health. , (2020).
- Yang, J., et al. Prevalence of comorbidities and its effects in coronavirus disease 2019 patients: A systematic review and meta-analysis. International Journal of Infectious Diseases. 94, 91-95 (2020).
- Brough, H. A., et al. Managing childhood allergies and immunodeficiencies during respiratory virus epidemics - The 2020 COVID-19 pandemic: A statement from the EAACI-section on pediatrics. Pediatric Allergy and Immunology. 31 (5), 442-448 (2020).
- Zou, L., et al. SARS-CoV-2 Viral Load in Upper Respiratory Specimens of Infected Patients. The New England journal of medicine. 382 (12), 1177-1179 (2020).
- van Doremalen, N., et al. Aerosol and Surface Stability of SARS-CoV-2 as Compared with SARS-CoV-1. The New England journal of medicine. 382 (16), 1564-1567 (2020).
- Tran, K., Cimon, K., Severn, M., Pessoa-Silva, C. L., Conly, J. Aerosol generating procedures and risk of transmission of acute respiratory infections to healthcare workers: a systematic review. PloS one. 7 (4), 35797 (2012).
- Van Gerven, L., et al. Personal protection and delivery of rhinologic and endoscopic skull base procedures during the COVID-19 outbreak. Rhinology. 58 (3), 289-294 (2020).
- Marty, F. M., Chen, K., Verrill, K. A. How to Obtain a Nasopharyngeal Swab Specimen. New England Journal of Medicine. 382 (22), 76 (2020).
- Petruzzi, G., et al. COVID-19: Nasal and oropharyngeal swab. Head & Neck. 42, (2020).
- George, A., Prince, M., Coulson, C. Safe nasendoscopy assisted procedure in the post-COVID-19 pandemic era. Clinical Otolaryngology. , (2020).
- Hirst, R. A., et al. Culture of primary ciliary dyskinesia epithelial cells at air-liquid interface can alter ciliary phenotype but remains a robust and informative diagnostic aid. PLoS ONE. 9 (2), (2014).
- Jorissen, M., Willems, T., Van der Schueren, B. Ciliary function analysis for the diagnosis of primary ciliary dyskinesia: advantages of ciliogenesis in culture. Acta oto-laryngologica. 120 (2), 291-295 (2000).
- Thomas, B., Rutman, A., O'Callaghan, C. Disrupted ciliated epithelium shows slower ciliary beat frequency and increased dyskinesia. European Respiratory Journal. 34 (2), 401-404 (2009).
- Chilvers, M. A., Rutman, A., O'Callaghan, C. Functional analysis of cilia and ciliated epithelial ultrastructure in healthy children and young adults. Thorax. 58 (4), 333-338 (2003).
- Stannard, W. A., Chilvers, M. A., Rutman, A. R., Williams, C. D., O'Callaghan, C. Diagnostic testing of patients suspected of primary ciliary dyskinesia. American Journal of Respiratory and Critical Care Medicine. 181 (4), 307-314 (2010).
- Boon, M., et al. Primary ciliary dyskinesia: critical evaluation of clinical symptoms and diagnosis in patients with normal and abnormal ultrastructure. Orphanet Journal of Rare Diseases. 9 (1), 11 (2014).
- Armengot, M., Milara, J., Mata, M., Carda, C., Cortijo, J. Cilia motility and structure in primary and secondary ciliary dyskinesia. American Journal of Rhinology & Allergy. 24 (3), 175-180 (2010).
- Papon, J. F., et al. Quantitative analysis of ciliary beating in primary ciliary dyskinesia: a pilot study. Orphanet Journal of Rare Diseases. 7 (1), 78 (2012).
- Wallmeier, J., et al. Mutations in CCNO and MCIDAS lead to a mucociliary clearance disorder due to reduced generation of multiple motile cilia. Molecular and Cellular Pediatrics. 2, 15 (2015).
- Boon, M., et al. MCIDAS mutations result in a mucociliary clearance disorder with reduced generation of multiple motile cilia. Nature Communications. 5 (6), 4418 (2014).
- Shapiro, A. J., et al. Diagnosis of Primary Ciliary Dyskinesia. An Official American Thoracic Society Clinical Practice Guideline. American Journal of Respiratory and Critical Care Medicine. 197 (12), 24-39 (2018).
- Rubbo, B., et al. Accuracy of high-speed video analysis to diagnose primary ciliary dyskinesia. Chest. (19), 30205 (2019).
- Horani, A., Ferkol, T. W. Advances in the Genetics of Primary Ciliary Dyskinesia. Chest. 154 (3), 645-652 (2018).
- MacCormick, J., Robb, I., Kovesi, T., Carpenter, B. Optimal biopsy techniques in the diagnosis of primary ciliary dyskinesia. The Journal of Otolaryngology. 31 (1), 13-17 (2002).
- Jackson, C. L., et al. Accuracy of diagnostic testing in primary ciliary dyskinesia. European Respiratory Journal. 47 (3), 837-848 (2016).
- Jackson, C. L., Goggin, P. M., Lucas, J. S. Ciliary Beat Pattern Analysis Below 37°C May Increase Risk of Primary Ciliary Dyskinesia Misdiagnosis. Chest. 142 (2), 543-544 (2012).
- Green, A., Smallman, L. A., Logan, A. C., Drake-Lee, A. B. The effect of temperature on nasal ciliary beat frequency. Clinical otolaryngology and allied sciences. 20 (2), 178-180 (1995).
- Clary-Meinesz, C. F., Cosson, J., Huitorel, P., Blaive, B. Temperature effect on the ciliary beat frequency of human nasal and tracheal ciliated cells. Biology of the Cell. 76 (3), 335-338 (1992).
- Smith, C. M., et al. ciliaFA: a research tool for automated, high-throughput measurement of ciliary beat frequency using freely available software. Cilia. 1 (1), 14 (2012).
- Sisson, J. H., Stoner, J. a., Ammons, B. a., Wyatt, T. a. All-digital image capture and whole-field analysis of ciliary beat frequency. Journal of Microscopy. 211, 103-111 (2003).
- Blanchon, S., et al. Deep phenotyping, including quantitative ciliary beating parameters, and extensive genotyping in primary ciliary dyskinesia. Journal of Medical Genetics. , (2019).
- Feriani, L., et al. Assessing the Collective Dynamics of Motile Cilia in Cultures of Human Airway Cells by Multiscale DDM. Biophysical Journal. 113 (1), 109-119 (2017).
- Sears, P. R., Thompson, K., Knowles, M. R., Davis, C. W. Human airway ciliary dynamics. American Journal of Physiology - Lung Cellular and Molecular Physiology. 304 (3), 170-183 (2013).
- Quinn, S. P., et al. Automated identification of abnormal respiratory ciliary motion in nasal biopsies. Science translational medicine. 7 (299), (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved