A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
וידאו-רדיוגרפיה דו-מישורית לחקר שורש כף היד והמפרקים הרדיו-אולנריים הדיסטליים
In This Article
Summary
וידאו-רדיוגרפיה דו-מישורית (BVR) היא טכניקת הדמיה מתקדמת להבנת התנועה התלת מימדית של עצמות השלד והשתלים. בשילוב נפחי תמונה מבוססי צפיפות וצילומי וידאו של הגפה העליונה הדיסטלית, BVR משמש לחקר התנועה in vivo של שורש כף היד והמפרק הרדיו-אולנרי הדיסטלי, כמו גם ניתוחי מפרקים מפרקים.
Abstract
מדידה מדויקת של קינמטיקה של השלד in vivo חיונית להבנת תפקוד תקין של המפרקים, השפעת הפתולוגיה, התקדמות המחלה והשפעות הטיפולים. מערכות מדידה המשתמשות בסמני פני העור כדי להסיק תנועת שלד סיפקו תובנה חשובה לגבי קינמטיקה נורמלית ופתולוגית, עם זאת, לא ניתן להשיג ארתרוקינמטיקה מדויקת באמצעות מערכות אלה, במיוחד במהלך פעילויות דינמיות. בשני העשורים האחרונים, מערכות וידאו-רדיוגרפיה דו-מישורית (BVR) אפשרו לחוקרים רבים לחקור ישירות את קינמטיקה השלד של המפרקים במהלך פעילויות חיי היומיום. כדי ליישם מערכות BVR עבור הגפה העליונה הדיסטלית, צילומי וידיאו של הרדיוס הדיסטלי והיד נרכשים משני מקורות רנטגן מכוילים בזמן שהנבדק מבצע משימה ייעודית. מיקומי גוף קשיח תלת מימדיים (3D) מחושבים ממכשירי הווידיאו באמצעות רישומים מתאימים ביותר של הקרנות מודל תלת מימד לכל תצוגת BVR. המודלים התלת מימדיים הם נפחי תמונה מבוססי צפיפות של העצם הספציפית הנגזרים מנתוני טומוגרפיה ממוחשבת שנרכשו באופן עצמאי. תוך שימוש ביחידות מעבד גרפי ומערכות מחשוב בעלות ביצועים גבוהים, גישת מעקב מבוססת מודל זו הוכחה כמהירה ומדויקת בהערכת הביומכניקה של פרק כף היד והמפרק הרדיו-אולנרי הדיסטלי. במחקר זה, סיכמנו תחילה את המחקרים הקודמים שביססו את ההסכמה התת-מילימטרית והתת-דרגה של BVR עם מערכת לכידת תנועה אופטית במבחנה בהערכת הקינמטיקה של פרק כף היד והמפרק הרדיו-אולנרי הדיסטלי. יתר על כן, השתמשנו ב-BVR כדי לחשב את התנהגות מרכז הסיבוב של מפרק שורש כף היד, להעריך את דפוס הביטוי של מרכיבי השתל זה על זה, ולהעריך את השינוי הדינמי של השונות האולנרית במהלך פרונוסופינציה של האמה. בעתיד, עצמות קרפליות עשויות להילכד בפירוט רב יותר עם תוספת של גלאי רנטגן שטוחים, יותר מקורות רנטגן (כלומר, וידיאו רדיוגרפיה רב-מישורית), או אלגוריתמים מתקדמים של ראייה ממוחשבת.
Introduction
מדידה מדויקת של קינמטיקה של השלד in vivo חיונית להבנת תפקוד מפרקים בריא ומוחלף, השפעת הפתולוגיה, התקדמות המחלה והשפעות הטיפולים. כימות קינמטיקה של השלד באופן לא פולשני על פני המפרק (ארתרוקינמטיקה) הוא חיוני להבנת פתולוגיות ומחלות מפרקים, כגון דלקת מפרקים ניוונית, אך הוא מאתגר מבחינה טכנית. בעבר, טכניקות המשתמשות בסמני פני העור כדי להסיק תנועת שלד סיפקו תובנה חשובה לגבי קינמטיקה בריאה ופתולוגית. עם זאת, לא ניתן להשיג ארתרוקינמטיקה מדויקת באמצעות טכניקות אלה, במיוחד במהלך פעילויות דינמיות כגון פעילויות של חיי היומיום. מערכות אופטיות אלו מוגבלות מטבען ברמת הדיוק בגלל תנועת העור ביחס לעצמות הבסיסיות, מקור הטעות העיקרי בניתוח תנועה אנושית 1,2.
השיטות המתקדמות הנוכחיות לכימות קינמטיקה תלת מימדית (תלת מימדית) של השלד הן מעקב מבוסס תמונה, כלומר, וידאו רדיוגרפיה דו-מימדית (BVR)3 וטומוגרפיה ממוחשבת טורית (CT) נפחים4 והדמיית תהודה מגנטית (MRI)5. למרות שטכנולוגיות תלת מימד רגילות מבוססות CT ו-MRI הן מדויקות ונגישות ביותר בבתי חולים רבים ברחבי העולם, הן אינן מסוגלות למדוד את התנועה הדינמית של המפרקים. טכניקות הדמיה כגון סריקת CT 4D6 ו-MRI7 דינמי פותחו בשנים האחרונות כדי לפתור את החיסרון הזה; עם זאת, שיטות אלו חושפות את המטופלים למינון קרינה גבוה או סובלות מרזולוציה זמנית נמוכה.
בשילוב אלגוריתמים חדשניים של ראייה ממוחשבת ומערכות רנטגן מסורתיות, BVR הוכח כמדויק עבור מפרקים מרובים בבעלי חיים ובבני אדם; נפתר באמצעות אלגוריתמי מעקב מבוססי סמן או מבוססי מודל. גישות מבוססות סמנים עוקבות אחר חרוזי טנטלום המוחדרים לעצמות או לרקמות רכות והן אופטימליות לניסויים בבעלי חיים ובמבחנה. עם זאת, הם פולשניים באופן מונע למחקר בבני אדם. למרבה המזל, שיפורים באלגוריתמי מעקב מבוססי מודל מספקים אלטרנטיבה בת קיימא. גישות מעקב BVR מבוססות מודל בבני אדם כוללות הכנת ערכות התמונות הנפחיות הנרכשות על ידי CT או MRI בתנוחה סטטית ולכידת תנועות העניין בשדה הראייה של שני צילומי רנטגן. רוב יישומי המעקב מבוססי המודלים מייצרים לאחר מכן צילומי רנטגן משוחזרים דיגיטלית (DRR) של העצם או השתל מתמונות ה-CT או ה-MR הסטטיות ומתאימים אותם לווידיאו-רדיוגרפים משופרים באמצעות מדדים המדגימים את הדמיון בין DRRs ל-videoradiographs8. תהליך זה נקרא "מעקב" אחר העצם או השתל.
משתני התפוקה העיקריים של מעקב אחר עצמות או שתלים הם קינמטיקה קשיחה של הגוף, ממנה ניתן לחשב קינמטיקה של מפרקים, התארכות רצועות 9,10, מרווח מפרקים כתחליף לעובי הסחוס11, מגע מפרק12,13 וסמנים ביולוגיים אחרים. לאחרונה, תיעדנו את הדיוק של מעקב BVR מבוסס מודל בחישוב הביומכניקה של שורש כף היד, ניתוח מפרקים כולל של שורש כף היד (TWA) ומפרק רדיואולנרי דיסטלי (DRUJ)14,15. בסעיף הבא מוצג פרוטוקול מפורט של שיטה מאומתת זו לחקר תנועת שורש כף היד, ניתוח מפרק כף היד הכולל והמפרק הרדיו-אולנרי הדיסטלי במהלך משימות שונות. אנו מפלחים את נפחי התמונה מבוססי הצפיפות של העצמות והשתלים מנפחי תמונת ה-CT, עוקבים אחר נפחי התמונה החלקיים הללו בתוך צילומי הווידאו, וקובעים תוצאות כגון מרכז סיבוב, דפוס מגע ושונות אולנרית כדי להדגים את החוזקות והמגבלות של שיטה זו.
Protocol
מחקר זה אושר על ידי מועצת הביקורת המוסדית (IRB) של Lifespan - בית החולים רוד איילנד, IRB מוסמך AAHRPP. בסך הכל 16 מטופלים נתנו הסכמה מדעת חתומה על פי הנחיות המוסד.
1. רכישת נתונים
- טומוגרפיה ממוחשבת (CT)
- הכן את הדגימות או הנבדקים ל-CT.
הערה: לצורך הערכת הדיוק נעשה שימוש ב-6 אמות שלמות מארבע דגימות גופות שלמות (70.5 ± 12.3 שנים, 4 זכויות, 2 נקבות) ואמה אחת (49 שנים, ימין, נקבה) עם ניתוח מפרקים כולל בשורש כף היד. במחקר in vivo 16, נרשמו 10 מתנדבים עם פרקי כף היד בריאים (57.0 ± 5.2 שנים, שמונה נשים, תשע דומיננטיות ביד ימין), ו-6 מטופלים (74.7 ± 5.6 שנים, שתי נשים, שתיים ימניות, ארבעה פרקי כף יד דומיננטיים) שעברו ניתוח מפרק כף היד מלא. - כדי לדמות כל נבדק4, רכשו סריקת CT של האמה הדיסטלית בקוטר איסוף נתונים של 25 ס"מ ושחזרו עם שדה ראייה של 20 ס"מ באמצעות אלגוריתם הקונבולוציה של Bone Plus באמצעות סורק CT קליני בן 16 פרוסות. השתמש בהגדרות צינור של 80 kVp ו- 80 mA. הגבל את חשיפת האמה לכ-7 ס"מ פרוקסימלי של משטח הרדיוס הדיסטלי לפלנגות הדיסטליות.
הערה: במחקר זה, מידות הווקסל של התמונה היו 0.39 × 0.39מ" מ 2 במישור הרוחבי של האמה, ו-0.625 מ"מ לאורך הציר הארוך של האמה. - העברת תמונות ה-CT הנרכשות למחשב המעבדה באמצעות פרוטוקול מאושר על ידי HIPPA בפורמט Digital Imaging and Communications in Medicine (DICOM).
- הכן את הדגימות או הנבדקים ל-CT.
- וידיאורדיוגרפיה דו-מישורית (BVR)
- מערך ניסוי (איור 1). כדי לאפשר קוטר שדה ראייה המסוגל ללכוד את הרדיוס הדיסטלי, האולנה הדיסטלית, העצמות הקרפליות והמטקרפלים, כמו גם פרספקטיבה כדי למזער חסימות גרמיות בתנוחות שונות של שורש כף היד, מקם את מגבירי התמונה (II) מתחת לאמות, והגדר את הזווית ביניהם על 110° (מקורות קרני רנטגן מכוונים כלפי מטה ל-IIs המתאימים בכיוון של 55° ביחס לקרקע).
- צור את צילומי הרנטגן במצב רציף עם הגדרת חשיפה בין 65 ל-75 קילו וולט, בהתאם לנראות העצמות/השתל, ו-80 mA. התאם את מרחקי המקור לתמונה של שני זוגות רנטגן-II בכ-130 ס"מ, ואת מרחקי המקור ליד ב-90 ס"מ.
הערה: במחקר זה הנבדקים לבשו סינר עופרת מגן מפני קרני רנטגן, כיסוי צוואר מגן צווארון בלוטת התריס ומד מינון דיגיטלי במעבדה. כל החוקרים עמדו מאחורי זכוכית מגן עופרת במהלך הניסוי. - מקם משענת או מבנה דומה בין ה-II, והשתמש בו להצבת פריטים (למשל, ידית דלת, פטיש, כד) עבור המצולמים.
- צור את צילומי הרנטגן במצב רציף עם הגדרת חשיפה בין 65 ל-75 קילו וולט, בהתאם לנראות העצמות/השתל, ו-80 mA. התאם את מרחקי המקור לתמונה של שני זוגות רנטגן-II בכ-130 ס"מ, ואת מרחקי המקור ליד ב-90 ס"מ.
- מערך ניסוי (איור 1). כדי לאפשר קוטר שדה ראייה המסוגל ללכוד את הרדיוס הדיסטלי, האולנה הדיסטלית, העצמות הקרפליות והמטקרפלים, כמו גם פרספקטיבה כדי למזער חסימות גרמיות בתנוחות שונות של שורש כף היד, מקם את מגבירי התמונה (II) מתחת לאמות, והגדר את הזווית ביניהם על 110° (מקורות קרני רנטגן מכוונים כלפי מטה ל-IIs המתאימים בכיוון של 55° ביחס לקרקע).
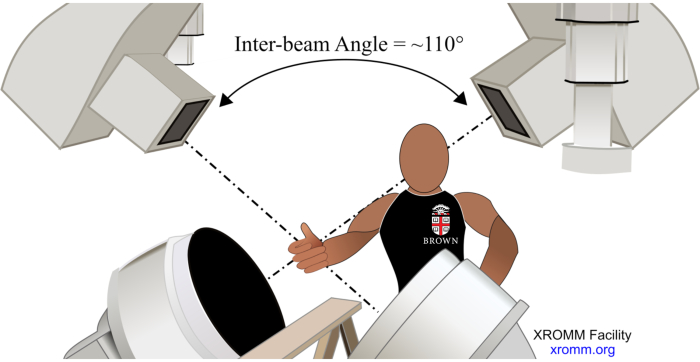
איור 1. מערך ניסיוני. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
- רשת אי-עיוות (איור 2A). מכיוון שהשדות האלקטרומגנטיים החיצוניים משפיעים על התנהגות קרני הרנטגן (כלומר, מסלולי אלקטרונים), התמונות הרדיוגרפיות סובלות מכרית סיכה לא ליניארית ועיוותים בצורת S17. כדי להסיר עיוותים אלה, השתמש בתמונה של חתיכה שטוחה של פח מחורר מדויק (כלומר, רשת ללא עיוות)18,19. הנח רשתות ללא עיוות על ה-IIs וצלם את התמונות שלהם לפני ואחרי נתוני וידאו-רדיוגרפיה. שמור תמונות אלה כתמונות TIFF של 8 סיביות עבור שני מקורות הרנטגן.
- כיול (איור 2B). כיול מקורות הרנטגן הכרחי כדי לחשב את הקואורדינטות התלת-ממדיות של האובייקטים (עצמות או שתלים)20. השתמש בתמונות של אובייקט תלת-ממדי בעל גיאומטריה ידועה, שיש לו מרווחים קבועים בין כדורים אטומים לרדיו, כדי ליצור קשר בין המיקום והכיוון של מקור קרני הרנטגן במרחב התלת-ממדי לבין מרחב התמונה (כלומר, צילומי רנטגן). חפץ קובי (כלומר, קוביית כיול) העשוי מיריעות אקריליות ומרווחים עם כדורי פלדה יעילים ומדויקים עבור הגדרות BVR19.
- צלם צילומי רנטגן של קוביית הכיול18 בכיוונים שונים 4 פעמים לפני ביצוע הניסוי ו-4 פעמים לאחר הניסוי. הכיולים שלאחר הניסוי משמשים לאישור שמערך הניסוי נותר ללא שינוי לאורך כל הניסוי. שמור את כל התמונות כתמונות TIFF של 8 סיביות עבור שני מקורות הרנטגן.
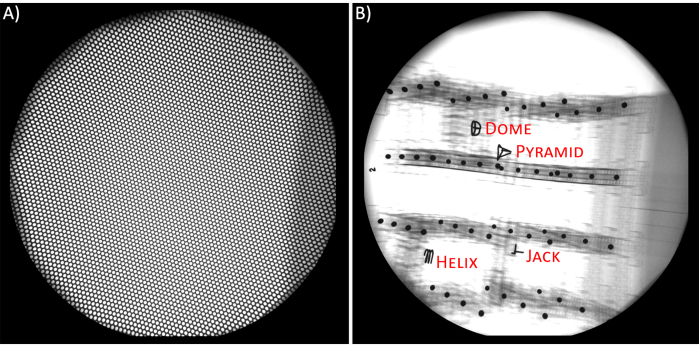
איור 2. א) רשת אי-עיוות. ב) קוביית כיול ופריטי הייחוס שלה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
- תיאור משימות. הגדר משימות שונות כדי ללכוד את תנועת שורש כף היד במהלך הארכת כיפוף, סטייה רדיאלית-אולנרית והיקף16. תאר משימות תנועה של DRUJ כסיבוב האמה מתנוחת אחיזה לפרונציה מלאה או לסופינציה מלאה המוגדרת כסיבוב של ידית דלת ידית T בכיוון השעון ונגד כיוון השעון21. רכוש צילומי וידאו של פרק כף היד בתנוחה הנייטרלית שלו (כלומר, משימה סטטית ניטרלית). צלם את התנוחה הנייטרלית עם גב היד הקופלנר עם גב האמה.
הערה: בתנוחת ההתחלה של כל המשימות, הכתף הייתה בהתקרבות, המרפק נתמך ברמת המפרק, והאמה לא הייתה מוגבלת ובסיבוב הנייטרלי שלה. משימות של הארכת כיפוף וסטייה רדיאלית-אולנרית תוארו כסיבוב כף היד ביחס לצד הוולרי-גבי והצד הרדיאלי-אולנרי של היד, בהתאמה. היקף תואר כתנועת שורש כף היד שמטרתה להשיג טווח תנועה פעיל מקסימלי לכל כיוון. - רכישת וידאו-רדיוגרף. רכוש צילומי וידיאו בקצב של 200 הרץ כאשר מהירות התריס של המצלמה מוגדרת ל-500 מיקרון. הקלט שתי שניות של הדמיה עבור כל משימה כדי לרכוש 2 חזרות. אחסן צילומי וידאו-רדיו שנרכשו מכל מקור רנטגן כסרטון CINE בפורמט של 8 סיביות.
הערה: במחקר זה, צילומי הרנטגן היו בגודל תמונה של 1760×1760 פיקסלים והיו בעלי רזולוציה של כ-0.22 מ"מ×0.22 מ"מ לפיקסל.
הערה: למקורות רנטגן נוכחיים יש אפשרות להגדיל את שדה הראייה (FOV). עם זאת, במחקר זה, לא נעשה שימוש במצב המוגדל שמציעה החומרה. בהתבסס על תיאור המשימה, יכולת זו עשויה לאפשר לך להשיג פלטים ברזולוציה גבוהה יותר. אם נעשה שימוש בתכונה זו, יש ללכוד את שלבי רשת ביטול העיוות והכיול במצב זה.
- לכידת תנועה אופטית (OMC) - מחקר דיוק
- השתמש בפרוטוקול רכישת הנתונים של לכידת תנועה אופטית (OMC) המתואר במחקרים קודמים14,15. חבר ישירות שני אשכולות סמן, כל אחד עם ארבעה כדורי סמן רטרו-רפלקטיביים בקוטר 9.5 מ"מ, לעצמות המטקרפליות והרדיוס השלישיות. לכוד תנועת סמן באמצעות 8 מצלמות לכידת תנועה אופטיות. סנכרן את תחילת קליטת נתוני ה-OMC עם ה-BVR על ידי טריגר חיצוני נמוך פעיל.
2. עיבוד נתונים
- טומוגרפיה ממוחשבת (CT)
- אנונימיזציה של DICOM. הפוך את ה-DICOMs לאנונימיים וייבא אותם לתוכנת עיבוד תמונה למידול תלת מימד (למשל, Mimics Materialise). בתוכנה Mimics Materialise, מסרגל הכלים קובץ , פתח את החלון אנונימי. כאשר החלון החדש נפתח, בחר אנונימיזציה של כל התמונות מהכרטיסייה השמאלית, ולחץ על כפתור אנונימיזציה בפינה השמאלית התחתונה.
- סגמנטציה (איור 3). פלח את העצמות או השתלים המעניינים לפי מתודולוגיה שתוארה קודם לכן 16,22,23.
- בקצרה, בסרגל הכלים Segment , בחר באפשרות Threshold ובחר את ערכות הסף המוגדרות מראש עבור Bone בעת פתיחת החלון. לאחר יצירת מסכת הסף, השתמש באפשרות Split Mask וצבע ידנית את אזורי העצמות או רכיבי השתל.
- כאשר כל האזורים צבועים, לחץ על אישור והמתן עד שהתוכנה תיצור את המסכות עבור כל עצם ורכיב השתל באופן אוטומטי. בדוק את כל המסכות כדי לוודא שהן מכסות את האזורים המיועדים לחלוטין. אם לא, השתמש באפשרות Edit Masks כדי לשנות את האזורים באופן ידני ובזה אחר זה.
הערה: כדי לחקור את מפרק שורש כף היד, יש לפלח את המטאקרפליםה-2 וה-3 ועצמות הרדיוס ולהפריד אותם משאר העצמות. לחלופין, ניתן לפלח את הקפיטט ועצמות אחרות לשלבי העיבוד שלאחר העיבוד.
הערה: כדי לחקור את ה-DRUJ, יש לפלח את הרדיוס והאולנה ולהפריד אותם משאר העצמות.
הערה: עבור השתלים, יש לפלח את הרכיב הרדיאלי ואת הרכיב הקרפלי עם הברגים שלו.
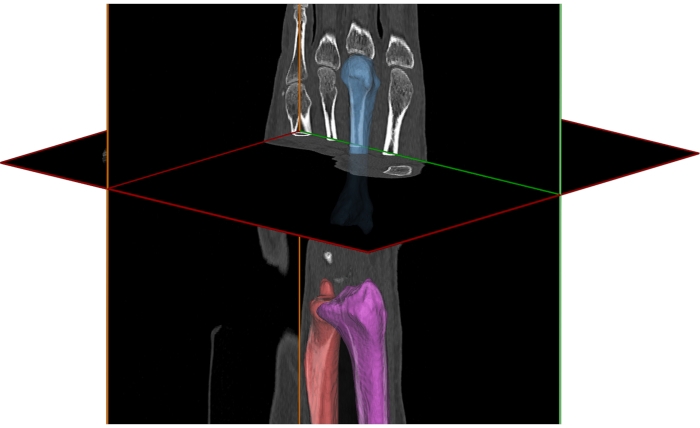
איור 3. תמונת טומוגרפיה ממוחשבת של שורש כף היד ומודלים משוחזרים של רדיוס, מטקרפל שלישי ואולנה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
- סגמנטציה - רכיב רדיאלי בלבד. בשל חפצי פס מבוססי צפיפות של פני השטח של הרכיב הרדיאלי בתמונות ה-CT, לא ניתן לפלח את מודל הרכיב הרדיאלי מהתמונות. לפיכך, השתמש במודל CAD או בסורק משטח תלת מימד כדי ליצור את המודל התלת מימדי של הרכיב הרדיאלי המושתל בשוק. רשום מודל זה לפילוח הגס של הרכיב הרדיאלי באמצעות שיטת ברירת המחדל של Mimics Materialise.
הערה: במחקר זה, השתמשנו בסורק משטח ברזולוציה של 0.1 מ"מ. השתל הונח על שולחן, וסורק התלת מימד הועבר ידנית סביב השתל כדי ללכוד את כל המשטחים החיצוניים. - נפחי תמונות חלקיים. תוכנת המעקב דורשת הזנה של גוף עניין מפולח כנפח תמונה מבוסס צפיפות. כדי ליצור אמצעי אחסון חלקי זה, צור מסיכה מלאה של אמצעי האחסון של התמונה המכילה את כל הערכים האפורים על-ידי בחירה באפשרות סף מסרגל הכלים פלח . התאם את ערכי הסף מערכי האפור המינימלי למקסימום.
- לאחר מכן, השתמש באפשרות אופרטורים בוליאניים , והחסר את הנפח המפולח של העצם או השתל המעניין מהמסכה המלאה שנוצרה. שנה את צבע המסיכה של אמצעי אחסון חלקי זה לשחור (RGB: 0.0/0.0/0.0) מכיוון שתוכנת הרישום מקבלת רק אמצעי אחסון של תמונות בגווני אפור. ייצא את המסיכה כ-DICOM על-ידי בחירה באפשרות Export DICOM... בתוכנה. הפלט הוא נפח תמונה של העצם או השתל המבודדים.
- מודלים תלת מימדיים. המירו את המסיכות המפולחות לדגמי משטחים תלת-ממדיים משולשים מרושתים על-ידי בחירה באפשרות 'חשב תלת-ממד ' עם 'רזולוציה אופטימלית'. ייצאו מודלים אלה בפורמט VRML, המכיל את המיקום התלת-ממדי של קודקודים (נקודות) ואת סדר החיבורים שלהם. המודלים נוצרים לבניית מערכת קואורדינטות והדמיה נוספת.
- עיבוד מקדים של וידאורדיוגרפיה
- XMALab18 ייבוא. עבור כל נושא, צור גירסת ניסיון חדשה בתוכנת XMALab. הקצה את נתיבי התיקיות לתמונות Undistortion Grid ול-8 קבוצות של תמונות כיול בתיבת הדו-שיח New Trial .
הערה: אם מקורות הרנטגן מתהפכים במהלך הלכידה, יש לבדוק את אפשרות ההיפוך בתוכנת XMALab. - דה-דיסטורשן. כדי לבטל עיוותים של צילומי רנטגן, לאחר שגירסת הניסיון נוצרה והתוכנה פתחה את תמונות הרשת בסביבת העבודה Undistortion, לחץ על הלחצן Compute Undistortion . XMALab קובע ומציג באופן אוטומטי את התמונות המעוותות של הרשתות. לאחר שהתוכנה זיהתה את מרכזי כל החורים, שנה את סביבת העבודה בתפריט השמאלי העליון לסביבת העבודה כיול . לקבלת מידע נוסף וסיוע באיתור באגים בבעיות פוטנציאליות, עיין בחומר עזר24.
- כיול. בשלב זה, תוכנת XMALab קובעת את מטריצות הכיול. ב-XMALab, מקורות קרני הרנטגן מעוצבים כמצלמות חור סיכה עם פרמטרים פנימיים וחיצוניים, כגון אורך מוקד, מרכז המקור ומרחקי מקור לתמונה, ושלב הכיול הוא תהליך הקובע את המדדים הללו18. כדי לכייל, בחר כל אחד מ-4 פריטי ההתייחסות הממוקמים בקוביית הכיול עבור כל קבוצות התמונות ועבור כל view. במערך, הפניות אלה היו פירמידה, ג'ק, כיפה וסליל (איור 2B). אם התוכנה לא מוצאת את הנקודות באופן אוטומטי, לחץ על כיול מחשוב. לאחר כיול כל תמונות הכיול, בחר Optimize Camera Setup.
- ייצוא מטריצות כיול. לאחר האופטימיזציה, מיין את כל 8 ערכות הכיול (כלומר, 4 הסטים שנלכדו לפני הניסוי ו-4 הסטים שנלכדו לאחר הניסוי) ובחר את ערכת התמונות עם השגיאה הקטנה ביותר ללא עיוות. מצא ערך זה על ידי לחיצה על אפשרות המידע בפינה השמאלית העליונה של כל חלון כיול. בתמונה עם השגיאה הנמוכה ביותר, ייצא את התמונות על-ידי בחירה באפשרות MayaCams 2.0 מתפריט File-Export . למידע נוסף ולאיתור באגים בבעיות אפשריות, עיין בהפניה20.
- וידאו-רדיוגרפיה ללא עיוות. שנה את סביבת העבודה למעקב אחר סמן וטען את צילומי הווידיאו שצולמו בפורמט CINE על ידי לחיצה על הסמל +. לאחר השלמת תהליך הטעינה, יצא את תמונות הניסיון ללא עיוות על-ידי בחירה באפשרות Undistorted Trial Images מתפריט File-Export .
- XMALab18 ייבוא. עבור כל נושא, צור גירסת ניסיון חדשה בתוכנת XMALab. הקצה את נתיבי התיקיות לתמונות Undistortion Grid ול-8 קבוצות של תמונות כיול בתיבת הדו-שיח New Trial .
- מעקב מבוסס מודל (איור 4)
- שיפור תכונות של צילומי רנטגן/DRR (איור 4A-B). שיפור תכונות התמונה באמצעות פילטרים הוא צעד הכרחי להשגת התאמה מדויקת. הגדר את הפרמטרים של ארבעת המסננים, כולל ניגודיות (זיהוי עוצמה), Sobel (זיהוי קצה), Gaussian (טשטוש/חלק יותר) ו-Sharpen (הדגשת הקצוות) בתוכנה. ניתן לבחור מסננים אלה על ידי לחיצה ימנית על אובייקטי Rad Renderer או DRR Renderer המוצגים בווידג'ט השמאלי העליון.
הערה: במחקר זה, שולי תמונות העצמות בצילומי הרנטגן שופרו באמצעות מסנן סובל עם מקדם קנה מידה של 3 וערך תערובת של 0.4. בנוסף, נעשה שימוש במסנן ניגודיות עם אלפא (עבור ניגודיות תמונה) של 2.5, ובטא (עבור בהירות תמונה) של 0.9 כדי לשפר עוד יותר את איכות צילומי הרנטגן. כדי להתאים את ה-DRRs לצילום הרנטגן, נעשה שימוש בערך עוצמת קרן של 0.35 עם מסנן סובל עם ערך תערובת של 0.1 וגורם קנה מידה של 1.7. - אתחול ידני. הזז את ה-DRR של כל עצם ורכיב באמצעות נקודת הציר שלו כדי להשיג את ההתאמה הטובה ביותר האפשרית בין DRR לצילומי רנטגן. נקודת ציר עוזרת למשתמשים לסובב ולתרגם את ה-DRR שנבחר מהווידג'ט השמאלי התחתון. שלב זה הכרחי מכיוון שיש לאתחל את מיקום העצם או השתל לפחות פעם אחת, ולפחות עבור המסגרת הראשונה, לפני ביצוע האופטימיזציה. לחץ על W כדי להזיז את ה-DRR במצב תרגום ולחץ על E כדי לסובב את ה-DRR.
הערה: שינוי מיקום נקודת הציר אינו הכרחי בדרך כלל, אך הדבר אפשרי באמצעות האפשרות Move Pivot של סרגל הכלים. - אופטימיזציה. לחץ על C או לחץ על כפתור עקוב אחר זרם מסרגל הכלים כדי למצוא את ההתאמה הטובה ביותר בין ה-DRR לצילומי הרנטגן. נוהל ברירת המחדל של התוכנה משתמש בפונקציית העלות של מתאם צולב מנורמל (NCC) ובשיטת אופטימיזציה של נחיל חלקיקים ובהליכי סימפלקס במורד ההר26,27. תהליך זה נקרא גם שלב ההתאמה או המעקב. ניתן לבצע את הליך האופטימיזציה גם באמצעות תיבת הדו-שיח מעקב. לשם כך, לחץ על האפשרות Tracking Dialog מסרגל הכלים. כאשר החלון החדש נפתח, שנה את ממסגרת ולמסגרת ל-0 ולחץ על אישור.
הערה: NCC היא פונקציה המודדת את הדמיון בין צילומי הרנטגן ל-DRR, וערך NCC קרוב יותר ל-0 הראה התאמה טובה יותר. עם זאת, השגת ערך זה תלויה לחלוטין במסנני התמונה ובאיכויות הצילום. ניתן לראות את הערך של NCC ב"חלון המסוף". - תהליך התאמה - מעבר ראשון. לאחר מיטוב אוטומטי של המסגרת הראשונה, פתח את תיבת הדו-שיח Tracking, שנה את From Frame ל- 0 ושנה את To Frame למספר המסגרת האחרון (ניתן למקם אותו בחלק התחתון הימני). תהליך ההתאמה המוגדר כברירת מחדל של התוכנה משתמש במסגרת הנוכחית כמיקום ההתחלתי של ה-DRR עבור תהליך ההתאמה. תהליך האופטימיזציה משתמש בשיטת אופטימיזציה של נחיל חלקיקים (PSO) באזור של 3 מ"מ ו-3° מהמיקום ההתחלתי.
- תהליך התאמה - מעבר סופי (איור 4C). מכיוון שתהליך ההתאמה האוטומטי עלול להיכשל עקב אתחול או מסננים גרועים, בדוק את כל המסגרות באופן ידני כדי לוודא שהאופטימיזציה בוצעה כהלכה. אם ה-DRR וצילומי הרנטגן אינם מותאמים כהלכה, חזור על השלבים המתוארים בסעיף 2.3.2 ו-2.3.3.
הערה: מעקב אחר פרק כף היד בוצע לראשונה עם מודל שכלל את המטאקרפלים השני והשלישי (MC2-MC3) כדי להפחית את ההשפעות של חפיפת עצם ולשפר את דיוק ההתאמה. לאחר איתור מיקום ה-DRR והסיבוב המשולבים בצילומי הרנטגן, מיקומי ה-MC2-MC3 התואמים והאופטימליים הפכו לנפח התמונה החלקי של MC3, והמיקומים הראשוניים של ה-MC3 נזרעו. באמצעות מיקומים מסודרים אלה, ה-MC3 היה במעקב. בדומה ל-MC3, הרדיוס, האולנה, הרכיב הרדיאלי והמרכיב הקרפלי בצילומי הווידיאו במהלך כל המשימות היו גם הם במעקב.
- שיפור תכונות של צילומי רנטגן/DRR (איור 4A-B). שיפור תכונות התמונה באמצעות פילטרים הוא צעד הכרחי להשגת התאמה מדויקת. הגדר את הפרמטרים של ארבעת המסננים, כולל ניגודיות (זיהוי עוצמה), Sobel (זיהוי קצה), Gaussian (טשטוש/חלק יותר) ו-Sharpen (הדגשת הקצוות) בתוכנה. ניתן לבחור מסננים אלה על ידי לחיצה ימנית על אובייקטי Rad Renderer או DRR Renderer המוצגים בווידג'ט השמאלי העליון.
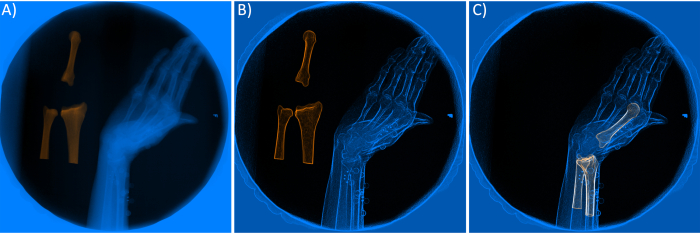
איור 4. א) צילום רנטגן של מקור רנטגן עם צילומי רנטגן משוחזרים דיגיטלית (DRR) של העצמות. ב) צילום רנטגן משופר (מסונן) ו-DRR. ג) DRRs תואמים לאחר תהליך אופטימיזציה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
- הפחתת נתונים. בהתבסס על קצב הפריימים ואיכות התמונות הרדיוגרפיות, ניתן להשתמש בגישות סינון כגון שיטת ממוצע נע (עם טווח של 5 פריימים). לשם כך, מתפריט סרגל הכלים, בחר מעקב-תיבת דו-שיח מתקדמת ולחץ על כפתור חלק . גישה זו שימשה עבור כל הלכידות, במחקר זה.
- ייצוא עמדות עצם/שתלים. לאחר שכל עצם מותאמת לצילומי הרנטגן וכל המסגרות מותאמות, ייצא את מטריצות הטרנספורמציה 4x4 של ה-DRRs בעולם הרנטגן על ידי לחיצה על כפתור שמור מעקב ובחירת פלט פורמט המטריצה. מטריצת טרנספורמציה זו מגדירה את הסיבוב והתרגום של נפח התמונה החלקי של העצם/השתל במערכת הקואורדינטות העולמית המכוילת של קרני רנטגן ויכולה לשמש לעיבוד נוסף וחישוב תנועה. יש להעביר את מערכת הקואורדינטות של נפח התמונה החלקי למערכת הקואורדינטות האנטומית לניתוח ביומכני משמעותי.
3. ניתוח נתונים
- מערכות קואורדינטות (איור 5). כדי לדווח על קינמטיקה, בנה מערכות קואורדינטות (CS) עבור העצמות ורכיבי השתל על סמך ציוני הדרך האנטומיים והגיאומטריים שלהם. לאחר בניית CS אלה, רשום את המודלים שנמצאים ב-CS החדש למודלים פני השטח שנוצרו בסעיף 2.1.4 באמצעות אלגוריתם איטרטיבי של הנקודה הקרובה ביותר. רישום אחד לאחד זה מחשב מטריצת טרנספורמציה חדשה של 4x4 שתשמש לחישובי קינמטיקה.
הערה: במחקר זה, ה-CS עבור הרדיוס, האולנה, המטקרפל השלישי, הרכיב הקרפלי, הרכיב הרדיאלי, מכסה הפוליאתילן והקפיטט נוצרו בשיטות שתוארו קודם לכן 16,22,23.
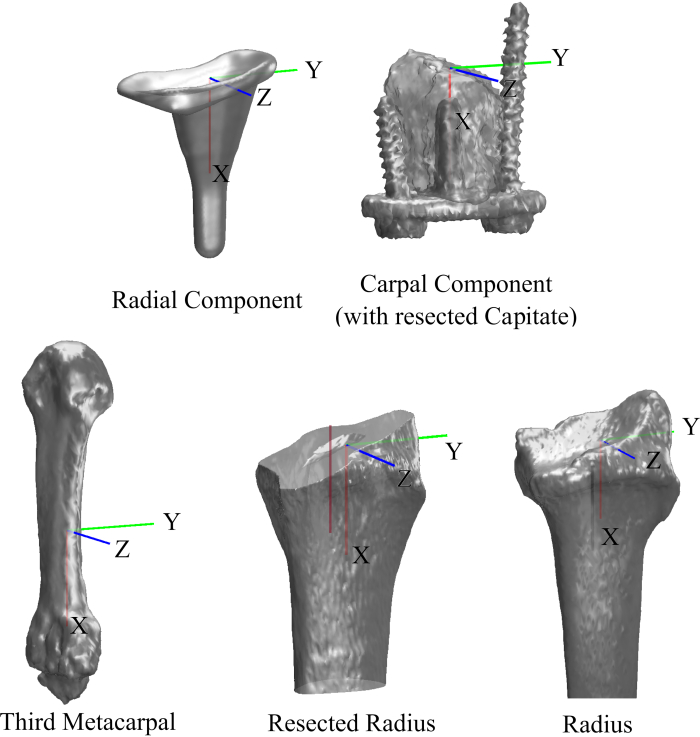
איור 5. מערכות קואורדינטות של העצמות ורכיבי השתל. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
- קינמטיקה. במחקר זה, הגדירו את תנועת שורש כף היד כתנועה של ה-MC3 ביחס לרדיוס, והנתונים הקינמטיים דווחו ביחס למיקום שורש כף היד הנייטרלי.
- עבור ניתוח DRUJ, חשב את פרמטרי ציר התנועה הסליליים (HAM)28 כדי לתאר את הקינמטיקה כתנועה היחסית של רדיוס CS ב-CS האולנרי, ביחס לתנוחה הנייטרלית.
- השתמש בניתוח HAM כדי לקבוע את מרכז הסיבוב (COR) של שורש כף היד בכיפוף-הארכה וסטייה רדיאלית-אולנרית.
- כדי לתאר את ההסטה הפרוקסימלית-דיסטלית החד-ממדית של ה-COR, הגדר את ה-COR המוקרן עבור פרקי כף היד הבריאים כנקודה על הציר המרכזי של עצם הקפיטט שהייתה לה המרחק הקצר ביותר מציר הסיבוב של הבורג16.
- פרק את סיבוב ה-HAM במערכת הקואורדינטות האולנרית באמצעות ציר הבורג HAM, וחשב את הפרונציה (חיובית) והסופינציה (שלילית) של האמה. התנוחה הנייטרלית הוגדרה כאשר פרונציה (PS) הייתה אפס.
- לבסוף, הגדר שונות אולנרית (UV) כמרחק בין הגומה האולנרית לחריץ הסיגמואיד ברדיוס.
- דפוס ביטוי
- חשב דפוסי מגע בין מכסה הפוליאתילן לרכיב הרדיאלי באמצעות קינמטיקה של שורש כף היד ושדות מרחק ספציפיים לרכיב29.
- חשב שדות מרחק עבור כל מודל משטח תלת-ממדי כמערך נפחי של מרחקים חתומים מהמשטח.
- חשב את ערכי הקרבה של שדות המרחק על פני מכסה הפוליאתילן והרכיב הרדיאלי עבור כל תנוחה.
- כדי להשיג את תיקון המגע בין הרכיבים, התאם את ערכי הקרבה הללו לרזולוציה של מערכת הרכישה (סף אי הכללת המרחק נבחר כ-0.70 מ"מ במחקר זה).
- ניתוח סטטיסטי
- השתמש בניתוח בלנד-אלטמן כדי להעריך את הדיוק על ידי הדגמת ההטיה (הבדלים ממוצעים) וגבול ההסכמה של 95% (הטיה ± 1.96SD) בין BVR ל-OMC14, 30.
- השתמש במודלים ליניאריים כלליים (GLM) כדי לתאר את התנהגות מרכז הסיבוב של שורש כף היד הבריא, וכדי למצוא קשר בין השינוי ב-UV ו-PS (UV = p1×PS2 + p2×PS), כאשר p1 ו-p2 היו מקדמים שעברו אופטימיזציה באמצעות רגרסיה ליניארית. השתמש במדד root-mean-squared-error (RMSE) כדי להעריך את דיוק המודל.
תוצאות
הבחירה בתוכנה לרישום תמונות מדו-ממד לתלת-ממד למעקב מבוסס דגמים תלויה בחלקה בגישה ליחידות מעבד גרפי (GPU) ולמערכות מחשוב עתירות ביצועים (HPC). לתוכניות אלו יש צינורות שונים, ונכון לעכשיו, אין מתודולוגיה משותפת בין התוכניות. במחקר זה, אנו משתמשים ב-Autoscoper, תוכנת רישום תמונות דו-?...
Discussion
וידאו-רדיוגרפיה דו-מישורית (BVR) היא שיטה מבוססת תמונה שניתן להשתמש בה למדידת תנועת העצם והשתל בשורש כף היד ובמפרק הרדיו-אולנרי הדיסטלי עם דיוק תת-מילימטרי ותת-דרגתי. במחקרים שתיארנו כאן, נעשה שימוש ב-BVR כדי לזהות דפוס מדויק של COR מוקרן עבור פרק כף יד בריא כמו גם דפוסי מגע TWA. ...
Disclosures
אין לנו ניגוד אינטרסים להצהיר עליו.
Acknowledgements
המחברים רוצים להודות לג'וזפין קלשובן וללורן פארולה על תיקון הפרוטוקול. המחברים רוצים גם להודות לאריקה טבארס ורוהיט בדידה על עזרתם לאורך רכישת הנתונים, ולקלפיט שאה, ארנולד-פיטר וייס וסקוט וולף על עזרתם בפירוש נתונים. מחקר זה התאפשר בתמיכת המכונים הלאומיים לבריאות P30GM122732 (COBRE Bio-engineering Core) ומענק מהקרן האמריקאית לכירורגיה של היד (AFSH).
Materials
| Name | Company | Catalog Number | Comments |
| 3D Surface Scanner | Artec 3D | Artec Space SpiderTM | Luxembourg |
| Autoscoper | Brown University | https://simtk.org/projects/autoscoper | https://doi.org/10.1016/j.jbiomech.2019.05.040 |
| CT Scanner | General Electric (GE) | Lightspeed 16 | Milwaukee, WI, USA |
| Geomagic Wrap 3D | 3DSystems | Version 2017 | Rock Hill, SC, USA |
| Graphics Processing Unit (GPU) | Nvidia | GeForce GTX 1080 | CUDA-enabled GPU |
| High-speed Video Cameras | Phantom | Version 10 | Vision Research, Wayne, NJ, USA |
| Image Intensifier | Dunlee | 40 cm diameter | Aurora, IL, USA |
| ImageJ | Open-source (Brown University) | https://imagej.net/Fiji | https://doi.org/10.1038/nmeth.2019 |
| Matlab | The MathWorks, Inc. | R2017a to R2020a | Natick, MA, USA |
| Mimics | Materialise | Version 19.0 to 22.0 | Leuven, Belgium |
| Motion Capture Cameras | Qualisys | Oqus 5+ | Gothenburg, Sweden |
| Pulsed X-ray Generators | EMD Technologies | EPS 45–80 | Saint-Eustache, Quebec, QC, Canada |
| Undistortion Grid | McMaster-Carr | 9255T641 | Steel Perforated Sheet Staggered Holes, 0.048" Thk, 0.125" Hole Dia, 36" X 40" |
| Wrist Implant (In-vitro Study) | Integra LifeSciences | Universal 2 | Plainsboro, NJ, USA |
| Wrist Implant (In-vivo Study) | Integra LifeSciences | Freedom | Plainsboro, NJ, USA |
| WristViz | Open-source (Brown University) | https://github.com/DavidLaidlaw/WristVisualizer/tree/master | Open-source software |
| X-ray Tubes | Varian Medical Systems | Model G-1086 | Palo Alto, CA, USA |
| XMALab | Open-source (Brown University) | https://www.xromm.org/xmalab/ | https://doi.org/10.1242/jeb.145383 |
References
- Leardini, A., Chiari, L., Croce, U. D., Cappozzo, A. Human movement analysis using stereophotogrammetry: Part 3. Soft tissue artifact assessment and compensation. Gait & Posture. 21 (2), 212-225 (2005).
- Miranda, D. L., Rainbow, M. J., Crisco, J. J., Fleming, B. C. Kinematic differences between optical motion capture and biplanar videoradiography during a jump-cut maneuver. Journal of biomechanics. 46 (3), 567-573 (2013).
- Tashman, S., Anderst, W. In vivo measurement of dynamic joint motion using high speed biplane radiography and CT: application to canine ACL deficiency. Journal of Biomechanical Engineering. 125 (2), 238-245 (2003).
- Moore, D. C., et al. Computed Tomography Image-Based Kinematic Analysis: An Overview. Handbook of Imaging in Biological Mechanics. , 115-126 (2014).
- Fedorov, A., et al. 3D Slicer as an Image Computing Platform for the Quantitative Imaging Network. Magnetic resonance imaging. 30 (9), 1323-1341 (2012).
- Choi, Y. S., et al. Four-dimensional real-time cine images of wrist joint kinematics using dual source CT with minimal time increment scanning. Yonsei medical journal. 54 (4), 1026-1032 (2013).
- Boutin, R. D., et al. Real-Time Magnetic Resonance Imaging (MRI) during Active Wrist Motion-Initial Observations. PLoS ONE. 8 (12), 84004 (2013).
- Miranda, D. L., et al. Static and Dynamic Error of a Biplanar Videoradiography System Using Marker-Based and Markerless Tracking Techniques. Journal of Biomechanical Engineering. 133 (12), 121002-121008 (2011).
- Englander, Z. A., et al. In Vivo Anterior Cruciate Ligament Deformation During a Single-Legged Jump Measured by Magnetic Resonance Imaging and High-Speed Biplanar Radiography , In Vivo Anterior Cruciate Ligament Deformation During a Single-Legged Jump Measured by Magnetic Resonance Imaging and High-Speed Biplanar Radiography. The American Journal of Sports Medicine. 47 (13), 3166-3172 (2019).
- Englander, Z. A., Garrett, W. E., Spritzer, C. E., DeFrate, L. E. In vivo attachment site to attachment site length and strain of the ACL and its bundles during the full gait cycle measured by MRI and high-speed biplanar radiography. Journal of Biomechanics. 98, 109443 (2020).
- Anderst, W. J., Les, C., Tashman, S. In vivo serial joint space measurements during dynamic loading in a canine model of osteoarthritis. Osteoarthritis and cartilage: Osteoarthritis Research Society. 13 (9), 808-816 (2005).
- Bey, M. J., Kline, S. K., Zauel, R., Kolowich, P. A., Lock, T. R. In Vivo Measurement of Glenohumeral Joint Contact Patterns. EURASIP journal on advances in signal processing. 2010, (2010).
- Anderst, W. J., Tashman, S. A method to estimate in vivo dynamic articular surface interaction. Journal of Biomechanics. 36 (9), 1291-1299 (2003).
- Akhbari, B., et al. Accuracy of biplane videoradiography for quantifying dynamic wrist kinematics. Journal of Biomechanics. 92, 120-125 (2019).
- Akhbari, B., et al. Kinematic Accuracy in Tracking Total Wrist Arthroplasty with Biplane Videoradiography using a CT-generated Model. Journal of Biomechanical Engineering. , (2019).
- Akhbari, B., et al. Proximal-distal shift of the center of rotation in a total wrist arthroplasty is more than twice of the healthy wrist. Journal of Orthopaedic Research: Official Publication of the Orthopaedic Research Society. 38 (7), 1575-1586 (2020).
- Wang, J., Blackburn, T. J. The AAPM/RSNA Physics Tutorial for Residents. RadioGraphics. 20 (5), 1471-1477 (2000).
- Knörlein, B. J., Baier, D. B., Gatesy, S. M., Laurence-Chasen, J. D., Brainerd, E. L. Validation of XMALab software for marker-based XROMM. The Journal of Experimental Biology. 219 (23), 3701-3711 (2016).
- Brainerd, E. L., et al. X-ray reconstruction of moving morphology (XROMM): precision, accuracy and applications in comparative biomechanics research. Journal of experimental zoology. Part A, Ecological genetics and physiology. 313 (5), 262-279 (2010).
- X-ray Camera Calibration. XROMM / XMALab / wiki Available from: https://bitbucket.org/xromm/xmalab/wiki/X-ray%20Camera%20Calibration (2020)
- Akhbari, B., et al. Biomechanics of the Distal Radioulnar Joint in In vivo Forearm Pronosupination. Journal of Wrist Surgery. , (2020).
- Akhbari, B., et al. Predicting carpal bone kinematics using an expanded digital database of wrist carpal bone anatomy and kinematics. Journal of Orthopaedic Research: Official Publication of the Orthopaedic Research Society. , (2019).
- Moore, D. C., et al. Three-dimensional in vivo kinematics of the distal radioulnar joint in malunited distal radius fractures. The Journal of Hand Surgery. 27 (2), 233-242 (2002).
- Knörlein, B. J. Correct for Fluoroscope Distortion (X-ray images). XROMM / XMALab / wiki. , (2020).
- . Autoscoper Available from: https://simtk.org/projects/autoscoper (2019)
- Kennedy, J., Eberhart, R. . Particle swarm optimization. , (1995).
- Nelder, J. A., Mead, R. A Simplex Method for Function Minimization. The Computer Journal. 7, 308 (1965).
- Panjabi, M. A Mathematical Approach for three-dimensional analysis of the mechanics of the spine. J Biomechanics. 4, 203-211 (1971).
- Marai, G. E., et al. Estimating joint contact areas and ligament lengths from bone kinematics and surfaces. IEEE transactions on bio-medical engineering. 51 (5), 790-799 (2004).
- Bland, J. M., Altman, D. G. Measuring agreement in method comparison studies. Statistical methods in medical research. 8 (2), 135-160 (1999).
- . Camera calibration With OpenCV Available from: https://docs.opencv.org/master/index.html (2020)
- Anderst, W. J., Lee, J. Y., Kang, J. D. In Vivo Cervical Facet Joint Capsule Deformation During Flexion-Extension. Spine. 39 (8), 514-520 (2014).
- Anderst, W. J., Vaidya, R., Tashman, S. A technique to measure three-dimensional in vivo rotation of fused and adjacent lumbar vertebrae. The Spine Journal. 8 (6), 991-997 (2008).
- Mozingo, J. D., et al. Validation of imaging-based quantification of glenohumeral joint kinematics using an unmodified clinical biplane fluoroscopy system. Journal of Biomechanics. 71, 306-312 (2018).
- Akbari-Shandiz, M., et al. MRI vs CT-based 2D-3D auto-registration accuracy for quantifying shoulder motion using biplane video-radiography. Journal of Biomechanics. 82, 375-380 (2019).
- Bey, M. J., et al. In vivo shoulder function after surgical repair of a torn rotator cuff: glenohumeral joint mechanics, shoulder strength, clinical outcomes, and their interaction. The American journal of sports medicine. 39 (10), 2117-2129 (2011).
- Bey, M. J., Kline, S. K., Zauel, R., Kolowich, P. A., Lock, T. R. In Vivo Measurement of Glenohumeral Joint Contact Patterns. EURASIP journal on advances in signal processing. 2010, (2010).
- Bey, M. J., Zauel, R., Brock, S. K., Tashman, S. Validation of a New Model-Based Tracking Technique for Measuring Three-Dimensional, In Vivo Glenohumeral Joint Kinematics. Journal of biomechanical engineering. 128 (4), 604-609 (2006).
- Fu, E., et al. Elbow Position Affects Distal Radioulnar Joint Kinematics. The Journal of Hand Surgery. 34 (7), 1261-1268 (2009).
- Martin, D. E., et al. Model-Based Tracking of the Hip: Implications for Novel Analyses of Hip Pathology. The Journal of Arthroplasty. 26 (1), 88-97 (2011).
- Miranda, D. L., et al. Static and Dynamic Error of a Biplanar Videoradiography System Using Marker-Based and Markerless Tracking Techniques. Journal of Biomechanical Engineering. 133 (12), 121002-121008 (2011).
- Stentz-Olesen, K., et al. Validation of static and dynamic radiostereometric analysis of the knee joint using bone models from CT data. Bone & Joint Research. 6 (6), 376-384 (2017).
- Anderst, W., Zauel, R., Bishop, J., Demps, E., Tashman, S. Validation of Three-Dimensional Model-Based Tibio-Femoral Tracking During Running. Medical engineering & physics. 31 (1), 10-16 (2009).
- Kessler, S. E., et al. A Direct Comparison of Biplanar Videoradiography and Optical Motion Capture for Foot and Ankle Kinematics. Frontiers in Bioengineering and Biotechnology. 7, 199 (2019).
- Maharaj, J. N., et al. The Reliability of Foot and Ankle Bone and Joint Kinematics Measured With Biplanar Videoradiography and Manual Scientific Rotoscoping. Frontiers in Bioengineering and Biotechnology. 8, 106 (2020).
- Ito, K., et al. Direct assessment of 3D foot bone kinematics using biplanar X-ray fluoroscopy and an automatic model registration method. Journal of Foot and Ankle Research. 8, 21 (2015).
- Wang, B., et al. Accuracy and feasibility of high-speed dual fluoroscopy and model-based tracking to measure in vivo ankle arthrokinematics. Gait & Posture. 41 (4), 888-893 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved