A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
שימוש במערכת GAL4-UAS לגנטיקה תפקודית בגמביה אנופלס
In This Article
Summary
מערכת GAL4-UAS הדו-צדדית היא כלי רב-תכליתי לשינוי ביטוי גנים באופן ספתיוטמפורלי מבוקר המאפשר ניתוח גנטי תפקודי בגמביה אנופלס. ההליכים המתוארים לשימוש במערכת זו הם אסטרטגיית שיבוט סטנדרטית למחצה, סקס וסינון של גלמים עבור סמני חלבון פלואורסצנטיים קיבעון עובר.
Abstract
מערכת GAL4-UAS הדו-צדדית היא כלי רב-תכליתי ורב עוצמה לניתוח גנטי פונקציונלי. המהות של המערכת היא לחצות קווי 'נהג' מהונדסים המבטאים את גורם שעתוק השמרים GAL4 באופן ספציפי לרקמה, עם קווי 'מגיב' מהונדסים הנושאים מבנה הפרעות גן/RNA מועמד שהביטוי שלו נשלט על ידי רצפי הפעלה במעלה הזרם (UAS) הקושרים את GAL4. בצאצאים שלאחר מכן, הגן או מבנה ההשתקה מתבטא אפוא באופן spatiotemporal שנקבע, המאפשר פנוטיפים הנובעים להיות נבזי ותפקוד הגנים להסיק. המערכת הבינארית מאפשרת גמישות בגישות ניסיוניות למסך פנוטיפים הנוצרים על ידי ביטוי טרנסג'ן בדפוסים ספציפיים לרקמות מרובות, גם אם עלויות כושר חמורות מושרות. התאמנו את המערכת הזו לאנופלס גמביה, וקטור המלריה העיקרי באפריקה.
במאמר זה, אנו מספקים חלק מההליכים הנפוצים המשמשים במהלך ניתוח GAL4-UAS. אנו מתארים את קווי AN. gambiae GAL4-UAS שכבר נוצרו, כמו גם את השיבוט של מבני מגיב חדשים עבור upregulation ו RNAi נוקאאוט. אנו מציינים מדריך צעד אחר צעד למין של גולם יתושים כדי ליצור צלבים גנטיים, הכולל גם צאצאי סינון כדי לעקוב אחר ירושה של סמני גנים פלואורסצנטיים המתייגים את הנהג ואת החדרות המגיב. אנו מציגים גם פרוטוקול לפינוי עוברים של גמביה כדי לחקור התפתחות עוברית. לבסוף, אנו מציגים התאמות פוטנציאליות של השיטה ליצירת קווי נהג באמצעות CRISPR/Cas9 החדרה של GAL4 במורד הזרם של גנים היעד.
Introduction
מערכת GAL4-UAS הדו-מפלגתית היא סוס העבודה של אפיון תפקודי של גנים באורגניזם מודל החרקים Drosophila melanogaster1,2,3. כדי להשתמש במערכת GAL4-UAS, קווי נהג מהונדסים, המבטאים את גורם שעתוק השמרים GAL4 תחת שליטה על רצף רגולטורי, נחצים עם קווי מגיב הנושאים מבנה של עניין או הפרעות RNA (RNAi) הנשלט על ידי רצף הפעלה במעלה הזרם (UAS) המוכר על ידי GAL4. צאצאי הצלב הזה מבטאים את הטרנסג'ן של העניין בתבנית מרחבית המוכתבת על ידי האמרגן השולט בביטוי GAL4 (איור 1). פנוטיפים המוצגים על ידי צאצאים של צלבים מגיבים לנהג ניתן להעריך כדי להדגיש את הפונקציה של גנים מועמד. למרות D. melanogaster שימש כדי לבחון גנים של אורגניזמים אחרים4,5,6,7, מערכת GAL4-UAS הותאמה כעת לשימוש חרקים בעלי חשיבות רפואית וחקלאית כדי לספק ניתוח ישיר במינים מעניינים 8,9,10,11,12,13,14.
יתוש מלריה אפריקאי, אנופלס גמביה, מערכת GAL4-UAS נבדקה לראשונה על ידי קו התא co-transfection9. מבנים מרובים נידונו ליעילות בשילובים שונים של זוג ומצאו כי 14 UAS חוזרים על עצמם יחד בתוספת intron מלאכותי קטן (UAS-14i) הציג את הטווח הרחב ביותר של פוטנציאל הפעלה בעת שימוש עם לוח של מנהלי התקנים GAL4. כדי להדגים פונקציונליות vivo, מבנים אלה שימשו אז כדי ליצור שני קווי A. gambiae מהונדסים נפרדים על ידי PiggyBac טרנספורמציה8: קו נהג הנושא GAL4 מונע על ידי מקדם ספציפי midgut, וקו מגיב המכיל הן את לוציפראז וחלבון פלואורסצנטי צהוב משופר (eYFP) גנים תחת ויסות רצפי UAS. פעילות לוציפראז ספציפית במעיים פלואורסצנטיות בצאצאים הצביעו על כך שהמערכת יעילה אנופלס. מאז, קווי נהג נוצרו המבטאים טרנסגנים ברקמות אחרות החשובות לקיבולת וקטורית ועמידות לקוטלי חרקים, כולל oenocytes15 ו hemocytes16, ובתבנית קרובה לכל מקום10. קווי UAS רבים נוצרו גם כדי לאבחן גנים שנחשבו מעורבים בחילוף החומרים ועמידות קוטלי חרקים מתווכים, סינתזת פחמימנים cuticular ולתייג באופן פלואורסצנטי סוגי תאים ורקמות שונים (טבלה 1). עבור קווי המגיב, שילוב מכוון אתר של transgene מבוצע כעת על ידי ΦC31 מזורז recombination חילופי 17,18 כדי לתקן את ההקשר הגנומי של הגנים המוסדרים UAS. בדרך זו, ביטוי טרנסג'ן מנורמל לגבי מיקום הכניסה הגנומית, ומאפשר השוואה מדויקת יותר של ההשפעות הפנוטיפיות של גנים מועמדים שונים.
קווי המגיב שנוצרו עד כה נועדו לבטא את הטרנסג'ן ברמות גבוהות או להפחית ביטוי גנים באמצעות הפרעות RNA (RNAi). בדרך כלל שיבוטי cDNA מותכים לרצף UAS כדי ליצור פלסמידים ביטוי מתאים, אולם רצפים גנומיים מלאים הם גם אפשריים בהנחה שהם לא גדולים מדי עבור שיבוט. כדי ליצור מבנים השתקה, השתמשנו בשלוש שיטות שונות כדי להשיג רצפים הפוכים טנדם מתאים היוצרים dsRNA סיכת ראש הממריץ RNAi. אלה כללו פי.סי.אר היתוך, PCR אסימטרי וסינתזה מסחרית של מבנים סיכת ראש. המשותף לכל שיטה הוא הכללה של רצף אינטרוני בין הרצפים ההפוכים כדי לספק יציבות שיבוט. פלסמידים מגיבים שבהם גן של עניין / RNAi מבנה פותחו15. פלסמידים אלה נושאים גם את אתרי ה- ΦC31 ATTB הנדרשים עבור RMCE (המתואר באדולפי המלווה נייר JoVE המתאר בפירוט את טכניקת ה- RCME). פרוטוקולים המכסים את השלבים החשובים הנדרשים בעת בחירת הרצף להכנסה לאחד הפלסמידים האלה לביטוי יתר כלולים בכתב יד זה. בנוסף, שני פרוטוקולים ליצירת מבנה סיכת ראש RNAi מתוארים ומאוירים.
בעת יצירת קווים חדשים, זיהוי של אנשים מהונדסים נדירים הוא חיוני להתרבות כדי להקים ולתחזק מושבות מהונדסות. והכי חשוב עבור מערכת GAL4-UAS יש צורך להבחין בין קווי המגיב והנהג כדי ליצור צלבים ולזהות צאצאים בודדים הנושאים את שני הטרנסגנים. זה מושג באמצעות גנים שונים דומיננטיים סמן לבחירה מקושרים לנהג קלטות מגיב. לרוב אלה הם גנים סמן פלואורסצנטי כי הם בבירור להבחין באמצעות מסננים אופטיים (למשל, eYFP, eCFP, dsRed). חשוב כי סמנים באים לידי ביטוי בתבנית spatiotemporal ידוע ואמין כמו זה עושה זיהוי של חריגות וזיהום קל יותר. ביטוי גן סמן פלואורסצנטי מוסדר באופן שגרתי על ידי מקדם 3xP3 סינתטי, אשר גורם לביטוי ספציפי עין וגרעעים גחוניים בכל שלבי פיתוח An. gambiae19. סמנים פלואורסצנטיים הנשלטים על ידי 3xP3 כלולים בכל פלסמידים טרנספורמציה המתוארים במאמר זה. פרוטוקול המפרט את השיטות הנפוצות המשמשות לסינון קווי גלם גלם GAL4-UAS פלואורסצנטי כלול כאן.
אחד המרכיבים העיקריים של מערכת GAL4-UAS הוא הצורך לחצות את קווי הנהג והמגיב המסומנים באופן דיפרנציאלי. כדי לעשות את זה זכר ונקבות מכל שורה חייב להיות מופרד לפני ההזדווגות. מבוגרים ניתנים להבחנה בקלות על ידי ראייה, עם זאת, עבור הקמת צלבים גנטיים זה הגיוני להפריד את המינים לפני הופעת מבוגר כדי להבטיח כי ההזדווגות לא התרחשה. הבדל הגודל הכללי בין גולם א. גמביה זכר לנקבה משתנה מדי מכדי להיות שיטה יעילה ומהימנה לקביעת מין20. במקום זאת הבדלים מורפולוגיים ברורים באיברי המין החיצוניים מספקים בסיס אמין למין ב - An. gambiae. במאמר זה, אנו מתארים שיטה אמינה למין גולם An. gambiae כדי להגדיר צלבים מתאימים.
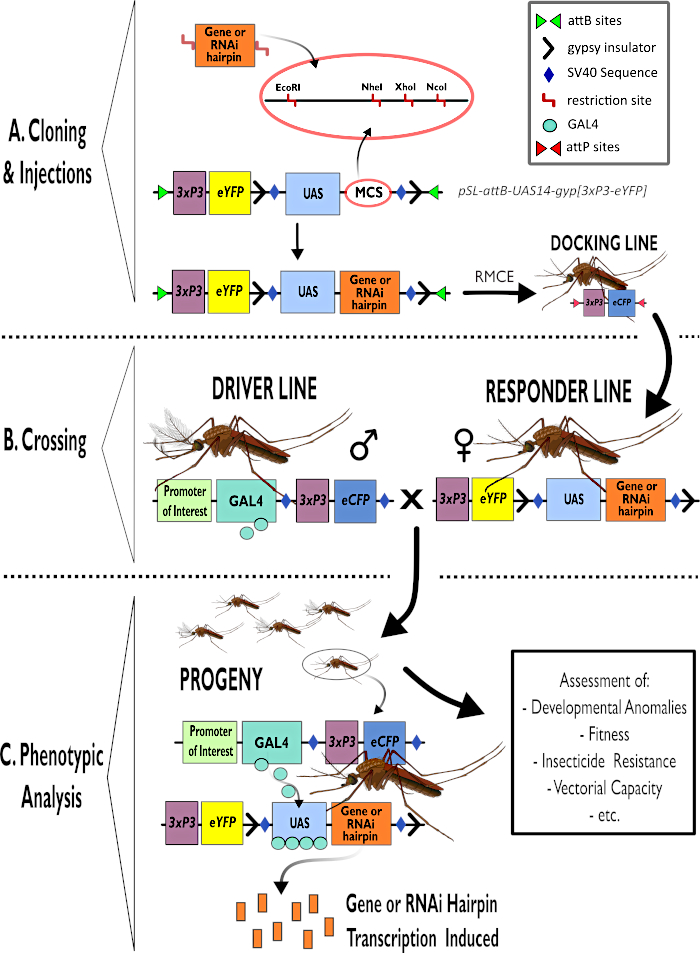
איור 1 - ייצוג דיאגרמתי של תהליך לשימוש במערכת GAL4-UAS הדו-מפלגתית ב-Anopheles gambiae. (A) הרכיבים העיקריים של וקטור לדוגמה (pSL-attB-UAS14-gyp[3xp3-eYFP]) מתוארים, המפרטים את אתרי ההגבלה הזמינים (EcoRI, NheI, XhoI ו- NcoI) בתוך אתרי השיבוט המרובים המתאימים לשימוש כדי להכניס את מבנה סיכת הראש או רצף הקידוד עבור גן העניין. מבנה קו העגינה מתואר גם הוא. (ב) שלב המעבר מומחש המציין את השימוש בזכרים מקו הנהג (נשיאת נהג GAL4 על ידי מקדם עניין ו- eCFP המונע על ידי מקדם 3xP3) ונקבות מקו המגיב (הנושא את גן העניין או מבנה סיכת הראש הנשלט על ידי מקדם UAS וסמן eYFP הנשלט על ידי מקדם 3xP3). (ג) ייצוג דיאגרמתי של ביטוי נהיגה GAL4 של גן העניין בצאצאי הצלב ב- B ורשימה של כמה מהפנוטיפים הטיפוסיים המוערכים. קיצורים: אתר שיבוט מרובים (MCS), החלפת קלטות בתיווך רקומבינאז (RMCE), רצף מפעיל במעלה הזרם (UAS), חלבון פלואורסצנטי צהוב משופר (eYFP), חלבון פלואורסצנטי ציאן משופר (eCFP). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
זהו השימוש בצלבים המספק את האופי הדו-צדדי של מערכת GAL4-UAS, שיש לה יתרונות ברורים על פני גישות ליניאריות יותר. לדוגמה, ניתן להעריך שילובים רבים יותר של קווי נהג ומגיב מאשר היה אפשרי אם היה צורך ליצור ולתחזק קו מהונדס חדש עבור כל שילוב מקדם / גנים. חשוב מכך, הוא מאפשר ניתוח של גנים המייצרים פנוטיפים קטלניים או סטריליים כאשר הביטוי שלהם מוטרד אשר קשה ליצור / לתחזק במערכת ליניארית. פנוטיפים קטלניים כאלה יכולים להתבטא בכל השלבים ההתפתחותיים, בהתאם לתפקוד הגנים ולביטוי spatiotemporal, אך הם נצפים לרוב במהלך התפתחות עוברית. הדמיית התפתחות העובר יתוש דורש ניקוי של chorion אטום אשר מצפה את הביצים. בעקבות שיטות המתוארות ב- Trpiš (1970)21 וקייזר ואח ' (2014)22, אנו מתארים את הפרוטוקולים בהם אנו משתמשים כדי לתקן עוברים, תוך שמירה על שלמות מבנית, והלבנה כדי לנקות את האנדוריון המאפשר הדמיה והפכה מיקרוסקופית.
Protocol
1. תכנון ובניית מבנים של UAS
- עיצוב והרכבה של וקטורים לביטוי גנים מועמד
- קבע את הרצף שישמש לתרוממות גנים מועמדים.
- רצף את cDNA / gDNA מתוך המתח של עניין ולהשוות אותו לרצף שפורסם כדי לאמת את זהותו ולזהות SNPs פוטנציאליים ואתרי הגבלה לעיכול אבחוני.
- ודא כי פריימר קדימה המשמש להגברת גנים מכסה את רצף Kozak המקומי ולהתחיל קודון, במידת הצורך. פריימר עם ~ 10 bp מחייב במעלה הזרם של קודון ההתחלה יקיף את רצף Kozak.
- כלול את קודון העצירה בקטע המוגבר מהפריימר ההפוך ברוב הנסיבות. השתמש ברצפי סיום של 3' המסופקים בווקטורים הפלסמידים המתוארים, או להגביר רצפים גנומיים של גנים מועמדים.
- הזמינו רצפים מסחריים עם הטיית קודון ספציפית אם תרצו.
- השתמש בהליכי תת-קלוניה סטנדרטיים כדי להכניס קלטות גנים לווקטורים של UAS plasmid, למשל, pSL-attB-UAS14-gyp[3xP3-eYFP]15 (איור 1) הן עבור מבני upregulation והן עבור מבני RNAi.
- לייצר יתושים מהונדסים שנוצרו באמצעות ΦC31 recombination החלפת קלטות בתיווך10,17,18,23.
- קבע את הרצף שישמש לתרוממות גנים מועמדים.
- יצירת מבנים סיכת ראש RNAi: הגברה צעד אחד באמצעות PCR אסימטרי PCR15,24
- לחלץ DNA גנומי (gDNA) מנקבה בוגרת An. gambiae נושאת את הגן המועמד הרצוי בשיטת Livak25.
- עצבו את הפריימר הקדמי כך שיקשרו ל-Exon היעד ב-5' של השבר הרצוי המכוון לכיוון האינטרון השכן. עצב את הקצה 3 ' של פריימר גשר להיקשר לסוף האקסון הקודם כדי להגביר את intron. הקצה של ה-5' משלים לשבר קטן של אקסון המטרה מיד לאחר האינטרון.
- הפעל תגובת PCR אסימטרית כמתואר ב-Xiao (2006)24 (איור 2).
- שכפל את מוצר ה- PCR המטוהר לווקטור מתאים הנושא את מקדם ה- UAS (למשל, pSL-attB-UAS14-gyp[3xP3-eYFP]15).
הערה: אנזימים בתוך אתר השיבוט המרובה המתאימים לשכפול pSL-attB-UAS14-gyp[3xP3-eYFP] שכפול15 והשלבים הבאים הנדרשים מצוינים באיור 1. תקציר אנזים יחיד חיוני כמו רק אתר הגבלה אחד מתווסף. Dephosphorylation של plasmid ישפר את יעילות שיבוט.
- לחלץ DNA גנומי (gDNA) מנקבה בוגרת An. gambiae נושאת את הגן המועמד הרצוי בשיטת Livak25.
- בניית מבנים סיכת ראש RNAi: פיוז'ן PCR של cDNA ו- gDNA15
- לחלץ DNA גנומי (gDNA) מנקבה בוגרת An. gambiae נושאת את הגן המועמד הרצוי בשיטת Livak25.
- כלול את gDNA בתגובת PCR כדי להגביר את אזור היעד של רצפי האקסון והאנטרונים יחד (איור 2).
- עצב את הקצה '3' של פריימר קדימה כדי לאגד את רצף האקסון היעד ההפוך כדי להגביר לכיוון רצף intron היעד ואת 5 'סוף לשאת אתר הגבלה כדי להקל על שיבוט.
- עיצוב פריימר הפוך (1) כדי להיקשר לסוף 5 ' של intron ואת 5 'סוף overhang נושא את הבסיסים הראשונים של הרצף הקדמי של האקסון השכן. תפיחה זו משמשת PCR היתוך.
- טהרו את מוצר התגובה הרצוי.
- לחלץ RNA, להסיר DNA באמצעות DNase של ולהכין cDNA מנקבה בוגרת An. gambiae נושאת את הגן המועמד הרצוי בעקבות פרוטוקולי היצרן.
- השתמשו ב-cDNA בתגובת PCR כדי להגביר את אזור היעד של האקסון בלבד (איור 2).
- עיצוב פריימר קדימה (2) כך שקצה ה-3' נקשר בקצה ה-3' של רצף האקסון המשלים והקצה '5 של הפריימר נושא אתר הגבלה לשימוש בשיבוט.
הערה: ניתן להשתמש שוב בפריימר הקדמי מ- 1.3.1.2 בתגובה שנייה זו. עם זאת, משמעות הדבר היא כי תקציר אנזים יחיד הוא חיוני. שימוש בפריימר קדמי שני עם אתר הגבלה שונה יאפשר עיכול כפול אשר עשוי להגביר את יעילות השיבוט. - עיצוב פריימר הפוך (2) - הקצה '3 נקשר לקצה 5 'של האקסון השכן להגביר את האקסון היעד. הקצה של ה-5 נקשר לסוף ה-3 של הגדיל הקדמי של האינטרונים. תפיחה זו משמשת PCR היתוך.
- טהרו את מוצר התגובה הרצוי.
- עיצוב פריימר קדימה (2) כך שקצה ה-3' נקשר בקצה ה-3' של רצף האקסון המשלים והקצה '5 של הפריימר נושא אתר הגבלה לשימוש בשיבוט.
- כלול את המוצרים של שלבים 1.3.1 ו- 1.3.2 כתבניות לתגובת PCR היתוך באמצעות ריכוזים סטנדרטיים עם פריימרים קדמיים 1 ו- 2. לטהר את המוצר הרצוי.
- לעכל את המוצר המטוהר כדי ליצור את overhangs עבור שיבוט. שיבוט לווקטור מתאים במורד הזרם של מקדם UAS. אנזימים מתאימים לשיבוט pSL-attB-UAS14-gyp[3xP3-eYFP]15 והשלבים הבאים הנדרשים מצוינים באיור 1.
- לחלץ DNA גנומי (gDNA) מנקבה בוגרת An. gambiae נושאת את הגן המועמד הרצוי בשיטת Livak25.
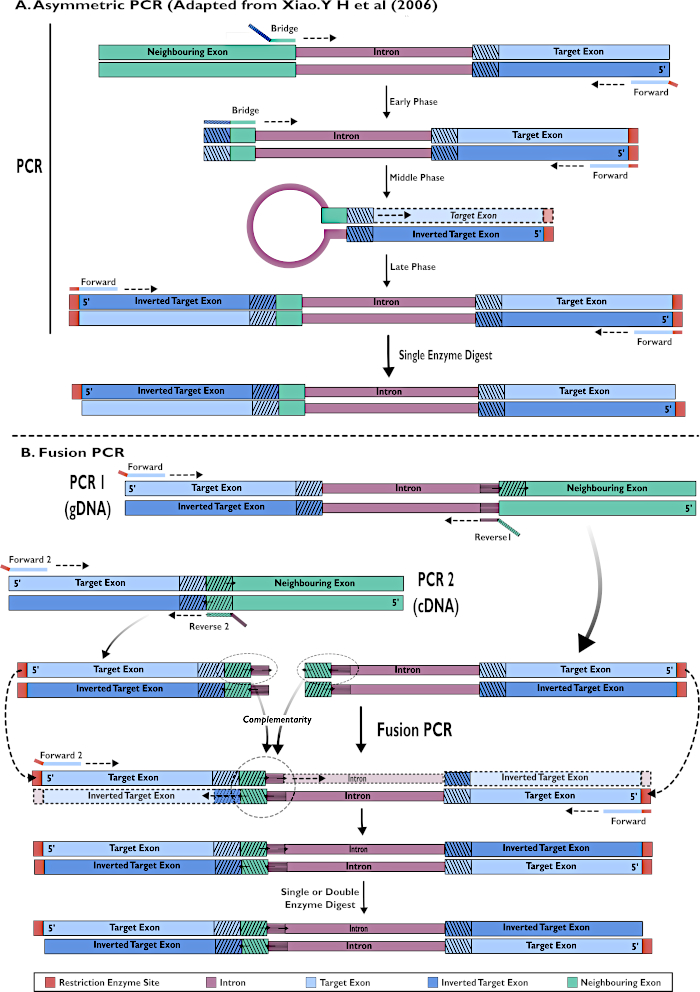
איור 2 - ייצוג דיאגרמתי של יצירת מבני RNAi להכנסה ל- pSL-attB-UAS14-gyp[3xP3-eYFP] בשתי שיטות: (A) PCR אסימטרי שלב יחיד (מותאם מ- Xiao. Y H ואח ' (2006) ו -(B) פי.סי.אר היתוך מרובה שלבים. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
2. הקרנת גלמים של גמביה
- אוסף גלמים לאפיון מיקרוסקופי
הערה: לאורך פרוטוקולים אלה מים מתייחסים מים מזוקקים בתוספת 0.01% מלח בריכה.- עורף יתושים גמביה באמצעות פרוטוקולים סטנדרטיים (למשל, MR426) לשלב הגולם.
זהירות: יש להקפץ שלא לפגוע בגורם לאורך כל התהליך. - לאסוף גלמים על צלחת שטוחה ברורה המתאימה לשימוש עם סטריאוטיקרוסקופ (למשל, צלחת פטרי פלסטיק 100 x 15 מ"מ, הימנעות הקצוות).
הערה: כדי לאסוף גלמים אנו משתמשים 3 מ"ל פלסטיק פסטר pipette עם כ 10 מ"מ לחתוך מהקצה כדי להרחיב את הסוף ולמנוע פגיעה יתושים. הקרנה ומין ניתן להשלים על אנשים, עם זאת, זה איטי מאוד. מומלץ לבצע הקרנה ומין בקבוצות של 50-200 גלמים (גודל הקבוצה האפשרי מוגבל על ידי גודל המנה המשמשת וכפוף להעדפה אישית). אם מספר גדול נבדק, ניתן להגדיל את היעילות על ידי יישור תחילה של גולם בערך 4 עד 5 עמוק בקווים, והזזת גולם היעד אל מחוץ לקו זה. - באמצעות פיפטה פסטר, בזהירות להסיר כמעט את כל המים מסביב הגולם. השאירו מספיק מים סביב גלמים כך שהם למעשה לא יציבים אך ניתן להזיז אותם בקלות עם מברשת עדינה. אם הם הופכים קשים לזוז, ואז להוסיף עוד מים.
הערה: כאשר מספיק מים מוסרים, הגולם ישכב על צדם, ומאפשר הדמיה של העיניים לזיהוי פלואורסצנטיות וזיהוי של איברי מין דימורפיים (איור 4DE).
אזהרה: ודאו שגולם לא יתירק. אם רק נפח קטן מאוד של מים נשאר זה יכול להפחית עוד יותר עם החום מן המנורה של המיקרוסקופ וכאשר לפצל בין בריכות של גלמים. לפעמים יש להוסיף מים נוספים במהלך התהליך באמצעות פיפטה פסטר 3 מ"ל לקבוצה הרצויה.
- עורף יתושים גמביה באמצעות פרוטוקולים סטנדרטיים (למשל, MR426) לשלב הגולם.
- זיהוי של סמנים פלואורסצנטיים בגולם
הערה: השימוש בסטריאוסקופ הגדלה נמוכה מאפשר סינון שדה רחב, מיון יכול להיעשות על מיקרוסקופ מורכב הפוך, אבל צריך להיעשות בנפרד.- בעת הקרנה עבור סמן פלואורסצנטי חשוב תחילה לדעת את דפוסי הביטוי והירושה הצפויים. תן דעתך לאפשרויות הבאות:
- צבעים: קבע אילו מסננים דמיינו את הביטוי.
- תבנית ביטוי ספטיוטמפוראלית: להבין איפה ובאיזה שלב בחיים אתה מצפה לראות ביטוי.
- יחס של פנוטיפים שונים: לקבוע איזה אחוז מהאוכלוסייה צריך לשאת את סמני העניין.
- לבצע הקרנה פלואורסצנטית בחושך, כמו אפילו אור נמוך יכול להפריע ברזולוציה של פלואורסצנטיות. עם זאת, השתמש במנורה לצד הסטריאוסקופ כאשר אור נדרש עבור מניפולציות אחרות.
אזהרה: ודא שסביבת העבודה סביב הסטריאוסקופ הפלואורסצנטי ברורה לפני כיבוי האורות. - הפעל נורה פלואורסצנטי ולהשאיר להתחמם לתקופה המומלצת של היצרן (בדרך כלל 10-15 דקות). בחר את המסנן הנדרש על סטריאוסקופ פלואורסצנטי ובדוק כי יש קרן צבעונית של אור גלוי כי הוא מכוון במרכז צלחת הבמה. אם זה לא נראה או קלוש מאוד הנורה פלואורסצנטית אולי לא התחמם לחלוטין, התריס סגור, או אופטיקה מיקרוסקופ אינם מיושרים היטב.
- באמצעות אור לבן, מרכז את הגולם בשדה הראייה ולהביא אותם לפוקוס. ייתכן שיהיה צורך לשנות הגדלה זו בעת מעבר בין מסננים שונים בהתאם לעוצמת הפלואורסצנטיות.
- בעזרת מברשת צבע מפורטת עדינה יש לוודא כי הגולם שנבדק אינו חופף.
- לכבות את האור הלבן של הסטריאוטוסקופ ולהשתמש המוקד בסדר כדי להביא את האזור של הגולם נושא את הפנוטיפ של עניין לתוך המוקד. תבנית הפלואורסצנטית צריכה להיות גלויה. דוגמאות לפלואורסצנטיות הנשלטת על ידי מקדם 3xP3 מסופקות באיור 3.
- השתמש בהגדלה הנמוכה ביותר שבה הפנוטיפ הפלואורסצנטי הצפוי יכול להיות נבדל באופן אמין מאנשים ללא פלואורסצ'ן.
- עבור זנים עם פלואורסצנטיות בהירה להשתמש באור בהיר בעוצמה נמוכה גם בעת הקרנה, אם האות פלואורסצנטי עדיין ניתן לזיהוי בבירור.
- לאחר סיום ההקרנה הראשונית, סרוק במהירות אוכלוסיות מתחת למסננים אחרים כדי לזהות זיהום פוטנציאלי.
אזהרה: ודא שיש מרחק ברור בין קבוצות של גלמים ממוינים כדי למנוע זיהום על ידי תנועת גלמים. שים לב כי גודל הקבוצות ישתנה כמו גלמים הם sexed וכי המרחקים יכולים להיראות גדולים יותר כאשר מסתכלים תחת הגדלה. יש להקפיד במיוחד כאשר הבריכות אינן נמצאות בשדה הראייה.
- בעת הקרנה עבור סמן פלואורסצנטי חשוב תחילה לדעת את דפוסי הביטוי והירושה הצפויים. תן דעתך לאפשרויות הבאות:
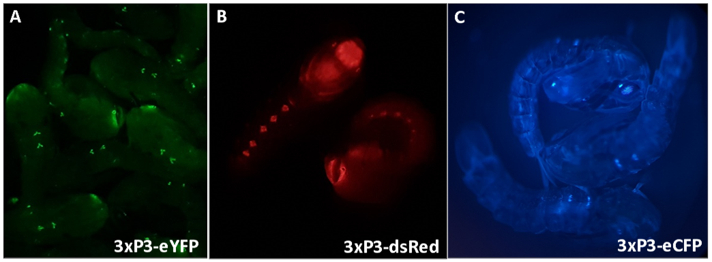
איור 3 - אנופלס גמביה גומה המבטאת סמנים פלואורסצנטיים המונעים על ידי מקדם 3xP3 (A) eYFP, (B) dsRed ו- (C) eCFP. הגדלה: A = 16X, B, C = 20X.
-
גולם סקס
- לאסוף גלמים. הסר מים עודפים, אך ספק מספיק כדי שהשחות האנאליות ייפרדו מעט מאיברי המין כדי לסייע בהדמיה ובאפיון מורפולוגי (איור 4D,E).
- אם כל גולם / e אינם בצד שלהם, להשתמש מברשת צבע מפורט עדין כדי להפוך בעדינות את הגולם ולהזיז את משוטים anal, כך איברי מין חיצוניים ניתן לזהות.
- גלמים נפרדים המבוססים על איברי מין חיצוניים ייחודיים; לזכרים יש צינור ארוך הבולט מקטע הגב הסופי כמחצית מאורכם של המשוטים האנאליים (איור 4B). איברי המין החיצוניים של הגולם הנשי קצרים בהרבה ומנוטרפים (איור 4A).
הערה: לעתים, אם השלד החיצוני הזחלי הרביעי נשאר מחובר או איברי המין החיצוניים נפגעים (איור 4C), זיהוי בטוח של המין קשה יותר. כאשר המין של גולם אינו ברור, מומלץ להשליך אותו. אם יש לשמור על הפרט, יש לאפשר לגולם לצאת בבידוד ומינו נקבע באמצעות תכונות מורפולוגיות למבוגרים. סביר להניח כי אם איברי המין שלה נפגעים הפרט לא יכול להזדווג בהצלחה. - הכינו בריכה לכל מין בקצה השני של המנה לבריכה הלא מחול, מעבירים גלמים מזוהים על פני המנה באמצעות מברשת צבע מפורטת עדינה. סמן את החלק התחתון של המנה שבה יאספו שתי הבריכות כדי לזהות אותן מאוחר יותר.
- כאשר נדרש סינון מיני ופלואורסצנטי, בצע הקרנה פלואורסצנטית תחילה, שכן זהו התהליך המהיר יותר של השניים.
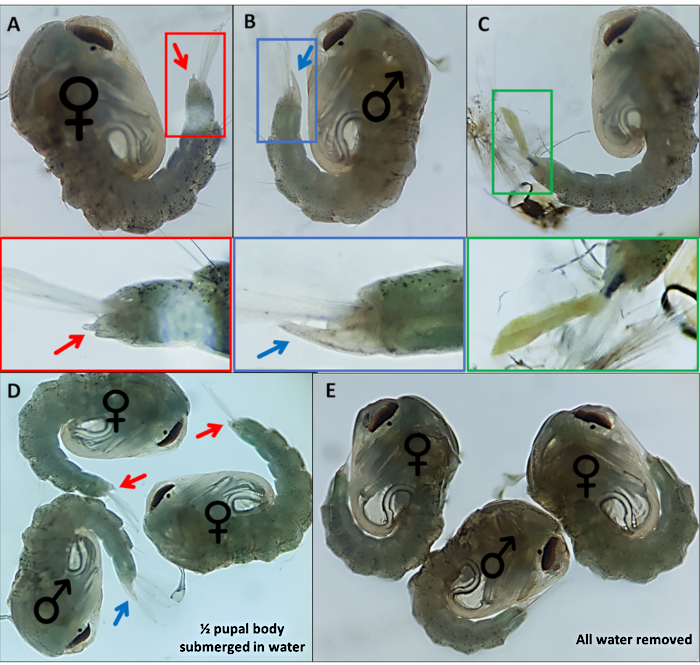
איור 4 , גולם גמביה של אנופלס סקס. גלמים בודדים המציינים את איברי המין החיצוניים של (A) נקבה (B) זכר ו-(C) אדם שלא ניתן לזהות בקלות עקב ניתוק לא שלם של השלד החיצוני. תמונות מוגדלות להלן המדגישות את איברי המין החיצוניים. גולם עם ♀ (נקבה) ו ♂ (זכר) המציין את איברי המין החיצוניים של הגולם עם (D) ~ 50% מהגולם שקוע במים ועם (E) כל המים הוסרו המדגיש את ההבדל בקלות ההדמיה של איברי המין החיצוניים. הגדלה: A,B, C = 40x, D, E = 30x. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
- אישור מין כמבוגרים
- עד ששיעור שגיאה נמוך מאוד הוכח, לאשר סקס גלמים על ידי מורפולוגיה למבוגרים לאחר הופעתה. להפריד גולם מיני לקבוצות של 10 או פחות בצינור ברור 20 מ"ל עם כמה מ"ל של מים, איטום עם כדור של צמר גפן, מתויג עם המין הצפוי ולאפשר לצאת בן לילה.
הערה: מאחר ומבוגרים מועברים למחרת בבוקר אין צורך לספק למבוגרים מתעוררים מזון. - אשר את המין של מבוגרים שהתעוררו באמצעות תכונות מורפולוגיות למחרת.
- אם יש זכרים שנמצאים בקולקציות הנשיות, השליכו את הנקבות, למקרה שכבר התרחשה הזדווגות.
- אם יש נקבות באוסף הגברי, הסר את הנקבה/ים ושמור על הזכרים לחצייה.
- עד ששיעור שגיאה נמוך מאוד הוכח, לאשר סקס גלמים על ידי מורפולוגיה למבוגרים לאחר הופעתה. להפריד גולם מיני לקבוצות של 10 או פחות בצינור ברור 20 מ"ל עם כמה מ"ל של מים, איטום עם כדור של צמר גפן, מתויג עם המין הצפוי ולאפשר לצאת בן לילה.
- הגדרת חוצה מערכת GAL4-UAS
- שאפו את המספר הרצוי של גברים ונשים מבוגרים מהצינורות בשלב 2.4 לכלוב או דלי קטן שהוקם באופן הסטנדרטי לגידול א. גמביה.
הערה: יש להקפיד שלא לפגוע במבוגרים במהלך העברה זו. - השתמש כ 50 נקבות עם מספר שווה של זכרים, כאשר ~ 2000 מבוגרים נדרשים מן הגאצאים.
הערה: כאשר צלב הוא להיות מוזן מספר פעמים כדי ליצור אצוות מרובות עד 200 של כל מין ניתן להגדיר בכלובים 30 ס"מ x 30 ס"מ x 30 ס"מ. כאשר רק מספר קטן של נקבות (<20) זמינים עבור הצלב, אנו מוסיפים ~ 4x את מספר הזכרים כדי להגדיל את הסבירות להזדווגות מוצלחת. - דם להאכיל את הנקבות הצטלבו וצאצאים אחוריים לשלב המתאים, בעקבות פרוטוקולים סטנדרטיים26, כדי לבצע הערכה פנוטיפית (למשל, עמידות לחומרי הדברה, יכולת וקטורית ובדיקות עלות כושר).
- כאשר ההשפעה האימהית של ביטוי טרנסג'ן סבירה, להגדיר צלבים הדדיים של הנהג ואת קווי המגיבים ו- בחן פנוטיפ צפוי.
הערה: צלבים באמצעות 'heterozygous' או אוכלוסיות מעורבות של קווי נהג ומגיב, לייצר צאצאים עם כל אחד מ 4 genotypes אפשרי. זה מספק סוג פראי, UAS בלבד ו- GAL4 רק פקדים, כמו גם transheterozygotes GAL4-UAS שבו לנתח פנוטיפ. אם אוכלוסיות הומוזיגוס נחצו, להגדיר צלבים נוספים כדי לספק פקדים מתאימים להשוות פנוטיפים. יש לסנן את האבן כמעל הפרדת צאצאים הנושאים את שניהם או רק את הסמן, כמו גם תשלילים, להערכה פנוטיפית.
- שאפו את המספר הרצוי של גברים ונשים מבוגרים מהצינורות בשלב 2.4 לכלוב או דלי קטן שהוקם באופן הסטנדרטי לגידול א. גמביה.
- הקמת אוכלוסיות הומוזיגוס מקווים שנוצרו באמצעות RCME הנושאים סמנים פלואורסצנטיים חלופיים
הערה: חיוני כי הסמן הפלואורסצנטי של שני הקווים נמצא באותו מיקום גנומי והם ניתנים להבחנה לחלוטין.- הקם צלב הורים של כ -200 מבוגרים עם מספר שווה של זכרים מסומנים באופן דיפרנציאלי של שורה אחת ונקבות של הקו השני לאחר ההקרנה כדי לבחור אנשים המציגים פלואורסצנטיות ומין נכונים, כמתואר לעיל. כשבוע לאחר מכן דם להאכיל את הצלב באמצעות פרוטוקולים הוקמה26.
- לגדל את צאצאי F1 כדי לגולם באמצעות פרוטוקולים סטנדרטיים ולאסוף גלמים כמתואר קודם לכן.
- מסך לפלורסצנטיות בחירת אלה הנושאים את שני סמני ההורים (transheterozygous). תארגן אינטרקרוס F1 עם הגולם הזה.
- שבוע לאחר מכן, דם להאכיל את נקבות F1 וצאצאים אחוריים לשלב הגועל בעקבות פרוטוקולים סטנדרטיים.
- מסך את הגולם F2 בחירת אלה המציגים רק אחד מהסמנים. אלה יהיו הומוזיגוס להכנסה. רק 25% מהצאצאים יהיו הומוזיגוס עבור כל הכנסה, כדי להבטיח כי מספיק צאצאים גדלים כדי לספק כלוב מלאי (400-500).
הערה: הבחירה של צאצאי transheterozygous חייב להיות קפדני לחלוטין אחרת התהליך הופך מזוהם, הומוזיגוסיות מלאה לא ניתן להשיג. בדוק שוב את כל הצאצאים שנבחרו עבור האינטרקרוס F1.
- הקם צלב הורים של כ -200 מבוגרים עם מספר שווה של זכרים מסומנים באופן דיפרנציאלי של שורה אחת ונקבות של הקו השני לאחר ההקרנה כדי לבחור אנשים המציגים פלואורסצנטיות ומין נכונים, כמתואר לעיל. כשבוע לאחר מכן דם להאכיל את הצלב באמצעות פרוטוקולים הוקמה26.
3. פרוטוקול ניקוי עובר גמביה
-
האכלה ותחזוקה בדם
- עורף יתושים א. גמביה למבוגרים בעקבות פרוטוקולים סטנדרטיים (למשל, MR4).
- האכלת דם 5-7 יום מבוגרים נקבה, להבטיח שרובם שקועים באופן מלא.
זהירות: לאורך פרוטוקול זה עבודה במהירות חיונית כדי להבטיח כי ביצים אינן מורשות להתרוקן.
-
הטלת ביצים מושרה
- 3 ימים לאחר האכלת דם לאסוף ביצים באמצעות הנחת המושרה.
- להרכיב את תא ההסתה.
- ממלאים סיר מזון במים לעומק של כ-5 מ"מ. חבר את הסיר לקצה אחד של צינור פוליפרופילן 50 מ"ל, שנחתך בעבר עם מסור, כך ששני הקצוות פתוחים. (אנו משתמשים בדיסק פלסטיק לסיר (איור 5); עם זאת, ניתן להשתמש במכסה המקורי של הצינור במקום).
- כסו את הקצה השני של צינור הפוליפרופילן החתוך בחומר (צינור/טייץ) או בחלקים של כפפת לטקס המאובטחים ברצועה אלסטית, כך שניתן יהיה להציג מבוגרים אך לא יוכלו לברוח (איור 5). קיימים עיצובים חלופיים אחרים של תאי oviposition וניתן להשתמש בהם26.
- בזהירות להציג 10-15 נקבות (דם מוזן בשלב 3.1.2) לתא oviposition. מכסים את תא ההפלה כדי לייצר חושך ומשאירים למשך 20 דקות.
אזהרה: הימנעו מהזזת סיר ההנחיה לאחר הטלת ביצים כדי למנוע נטישת ביצים וייבושן. - בזהירות לנתק את צינור פוליפרופילן 50 מ"ל מן סיר oviposition, תוך הקפדה לא לשחרר את היתושים. ביצים לבנות צריכות להיות גלויות. בדוק כי הונחו מספיק למטרה שנקבעה. חזור על הפעולה במידת הצורך.
- מכסים את הסיר (להגנה מפני אבק) ומאפשרים לביצים להבשיל לשלב ההתפתחותי של העניין.
- השתמש מברשת צבע מפורטת עדינה כדי לאסוף ביצים מהסיר ומניחים אותם על מים בבלוק זכוכית שנחפר 40 מ"מ.

איור 5 - דוגמה של תא Oviposition (A) פורק כדי להדגיש את הרכיבים ו-(B) שהורכב. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
-
תיקון עוברים
אזהרה: בצע את כל שלבי התיקון (שלב 3.3) במכסה המנוע של האדים עקב שימוש בפורמלדהיד.- הכן פתרון FAA כמתואר קייזר ואח '(2014)22. FAA כולל פורמלדהיד 3.6 M, 0.87 M חומצה אצטית ואתנול מוחלט 8.5 M מורכב עד נפח עם מים מזוקקים (dH2O).
- עבור 10 מ"ל של FAA לשלב 2.68 מ"ל של 13.42 M פורמלדהיד, 4.96 מ"ל של 17.14 M אתנול ו 0.5 מ"ל של 17.4 M חומצה אצטית עם 1.86 מ"ל של H2O מזוקק. ניתן לשמור על קיבוע לפחות 3 חודשים במיכל זכוכית אטום היטב, נשמר בארון כימי ייעודי.
- הסר בזהירות את המים מבלוק הזכוכית עם מיקרופיפט וכסה ביצים ב-500 מיקרו-אל של FAA והתנדנד בעדינות (כ-25 סל"ד) על שייקר מסלולי בטמפרטורת החדר למשך 30 דקות. בשלב זה לא ניתן לראות שינוי צבע.
- יש לשטוף את הביצים ביסודיות במים מזוקקים. בצע שטיפה 15 פעמים כדי להסיר את כל העקבות של פורמלדהיד. באמצעות מיקרופיט 1000 μL, להוסיף ולאחר מכן להסיר 1 מ"ל של dH2O בכל פעם להבטיח לא לפגוע בביצים תוך כדי כך.
- יש לאחסן שפכים מפני שטיפות במיכל נילוק פורמלדהיד ייעודי לסילוק בהתאם להנחיות הבטיחות.
- בשלב זה, ביצים קבועות ניתן לאחסן ב 4 °C (5 °F) לילה במים כדי לשמור אותם hydrated.
- הכן פתרון FAA כמתואר קייזר ואח '(2014)22. FAA כולל פורמלדהיד 3.6 M, 0.87 M חומצה אצטית ואתנול מוחלט 8.5 M מורכב עד נפח עם מים מזוקקים (dH2O).
-
להלבנה עוברית
אזהרה: בצע את כל שלבי ההלבנה (שלב 4) במכסה המנוע אדים בשל שחרור פוטנציאלי של גז כלור כאשר נתרן hypochlorite וחומצה אצטית משולבים.- הכן פתרון להלבנה (פתרון Trpiš - המתואר ב Trpiš (1970)21 ושונה על פי קייזר ואח '(2014)22). תמיסת Trpiš היא 0.59 M נתרן hypochlorite 0.35 M חומצה אצטית מומס H2O מזוקק.
- עבור 10 מ"ל ovolume של פתרון Trpiš, לשלב 2.68 מ"ל של 2.2 M נתרן hypochlorite ו 0.2 מ"ל של 17.4 M חומצה אצטית עם 7.12 מ"ל של H2O מזוקק.
הערה: פתרון Trpiš ניתן לאחסן לפחות 3 חודשים במיכל זכוכית אטום היטב ושמר בארון כימי מאובטח. הפתרון עשוי להיות צריך להיות מערבולת לאחר אחסון תמיד צריך להיפתח במכסה המנוע אדים במקרה של שחרור של גז כלור.
- עבור 10 מ"ל ovolume של פתרון Trpiš, לשלב 2.68 מ"ל של 2.2 M נתרן hypochlorite ו 0.2 מ"ל של 17.4 M חומצה אצטית עם 7.12 מ"ל של H2O מזוקק.
- מכסים ביצים קבועות עם 1 מ"ל של תמיסת Trpiš ודגרה בטמפרטורת החדר במשך 30 דקות. ביצים יתחילו לפתח כתמים חיוורים לאחר כ 5 דקות של דגירה, בסופו של דבר להגיע צבע לבן חלבי פעם פינה.
- יש לשטוף ביצים כמו בשלב 3.3.3 כדי להסיר את תמיסת Trpiš.
- יש לאחסן שפכים במיכל פסולת ייעודי ולהיפטר מעודפי מים במורד הניקוז.
- הכן פתרון להלבנה (פתרון Trpiš - המתואר ב Trpiš (1970)21 ושונה על פי קייזר ואח '(2014)22). תמיסת Trpiš היא 0.59 M נתרן hypochlorite 0.35 M חומצה אצטית מומס H2O מזוקק.
-
אחסון
- יש לאחסן 500 מיקרו-אל של dH2O ולשמור בין 2-8 מעלות צלזיוס למשך מספר ימים. הסר את רוב המים בזהירות לפני צפייה והדמיה על מסה אבל למנוע ייבוש של הביצים על ידי השארת נפח קטן של מים בכוס השעון. זה לא ישבש את צילום הביצים. ניתן להניח ביצים בודדות על שקופית מיקרוסקופ להדמיית הגדלה גבוהה יותר.
תוצאות
ביטוי 3xP3 של eYFP, dsRed ו- eCFP מספק זיהוי אמין, ניתן להבחין בקלות של אנשים בעלי גנים של הסמן המייצרים ביטוי בעיניים ובגרעיני גחון של גומה א. גמביה (איור 3). המורפולוגיה הדיפרנציאלית שנצפית באיברי המין החיצוניים של גברים ונשים המשמשים למין ודוגמה לגולם בלתי מזוהה מודגשות <...
Discussion
הבנת תפקוד גן היתושים חיונית לפיתוח גישות חדשות לשליטה באנופלים ולהשפעת העברת המלריה. מערכת GAL4-UAS המתוארת היא מערכת רב-תכליתית וחזקה לניתוח פונקציונלי של גנים מועמדים ועד כה השתמשנו במערכת כדי לבחון את הבסיס הגנטי של עמידות לחומרי הדברה17 וייצור פחמימנים חמודי?...
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
אנו מודים במימון מ- LSTM ו- IVCC (אדריאנה אדולפי), BBSRC (פרס החוקר החדש (AL), MRC (סטודנט לדוקטורט ל- BCP:MR/P016197/1), Wellcome (מלגת פוסט-דוקטורט של סר הנרי וולקום ל- LG: 215894/Z/19/Z) ששילבו את ניתוח Gal4UAS בהצעות.
Materials
| Name | Company | Catalog Number | Comments |
| 100 x 15 mm plastic Petri dish | SLS | 2175546 | Pack of 10 |
| 1000 µL Gilson Pipette | Gilson | F144059P | |
| 20/25 mL Universal Tubes | Starlab | E1412-3020 | Pack of 400 |
| 3 mL Pasteur Pipettes | SLS | G612398 | Greiner Pasteur pipette 3 mL sterile individually wrapped |
| 50 mL Falcon Tubes | Fisher Scientific | 11512303 | |
| Absolute Ethanol | Fisher Scientific | BP2818-500 | 500 mL |
| Acetic Acid | SLS | 45726-1L-F | 1 L |
| Cages | SLS | E6099 | 30x30x30 with screen port |
| Fine Paint Brushes | Amazon | UKDPB66 | KOLAMOON 9 Pieces Detail Painting Brush Set Miniture Brushes for Watercolor, Acrylic Painting, Oil Painting (Wine Red) |
| Fish food | Amazon | Tetra Min Fish Food, Complete Food for All Tropical Fish for Health, Colour and Vitality, 10 L | |
| Formaldehyde Solution | Sigma Aldrich | F8775 | |
| Mouth Aspirator | John Hock | 612 | |
| Pond Salt | Amazon | Blagdon Guardian Pond Tonic Salt, for Fish Health, Water Quality, General Tonic, pH Buffer, 9.08 kg, treats 9,092 L | |
| Pupae Pots | Cater4you | SP8OZ | 250 pots with lids |
| Small Plastic Buckets | Amazon | 2.5 L White Plastic Pail Complete with White Lid (Pack of 10) | |
| Sodium Hypochlorite | Fisher Scientific | S25552 |
References
- Brand, A. H., Perimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118 (2), 401-415 (1993).
- Duffy, J. B. GAL4 system in drosophila: A fly geneticist's swiss army knife. Journal of Genetics and Development. 34 (1-2), 1-15 (2002).
- Dow, J. A. . ELS. , (2012).
- Edi, C. V., et al. CYP6 P450 Enzymes and ACE-1 Duplication Produce Extreme and Multiple Insecticide Resistance in the Malaria Mosquito Anopheles gambiae. PLoS Genetics. 10 (3), 1004236 (2014).
- Daborn, P. J., et al. Using Drosophila melanogaster to validate metabolism-based insecticide resistance from insect pests. Insect Biochemistry and Molecular Biology. 42 (12), 918-924 (2012).
- Riveron, J. M., et al. Genome-wide transcription and functional analyses reveal heterogeneous molecular mechanisms driving pyrethroids resistance in the major malaria vector Anopheles funestus across Africa. Genes Genomes Genetics. 7 (6), 1819-1832 (2017).
- Riveron, J. M., et al. A single mutation in the GSTe2 gene allows tracking of metabolically based insecticide resistance in a major malaria vector. Genome Biology. 15 (2), (2014).
- Lynd, A., Lycett, G. J. Development of the Bi-Partite Gal4-UAS System in the African Malaria Mosquito, Anopheles gambiae. PLoS ONE. 7 (2), 31552 (2012).
- Lynd, A., Lycett, G. J. Optimization of the Gal4-UAS system in an Anopheles gambiae cell line. Insect Molecular Biology. 20 (5), 599-608 (2011).
- Adolfi, A., Pondeville, E., Lynd, A., Bourgouin, C., Lycett, G. J. Multi-tissue GAL4-mediated gene expression in all Anopheles gambiae life stages using an endogenous polyubiquitin promoter. Insect Biochemistry and Molecular Biology. 96, 1-9 (2018).
- Kokoza, V. A., Raikhel, A. A. Targeted gene expression in the transgenic Aedes aegypti using the binary Gal4-UAS system. Insect Biochemistry and Molecular Biology. 41, 637-644 (2011).
- O'Brochta, D. A., Pilitt, K. L., Harrell, R. A., Aluvihare, C., Alford, R. T. Gal4-based Enhancer-Trapping in the Malaria Mosquito Anopheles stephensi. Genes Genomes Genetics. 2, 21305-21315 (2012).
- Zhao, B., et al. Regulation of the Gut-Specific Carboxypeptidase: A Study Using the Binary Gal4/UAS System in the Mosquito Aedes Aegypti. Insect Biochemistry and Molecular Biology. 54, 1-10 (2014).
- Imamura, M., et al. Targeted Gene Expression Using the GAL4/UAS System in the Silkworm Bombyx mori. Genetics. 165 (3), 1329-1340 (2003).
- Lynd, A., et al. Development of a functional genetic tool for Anopheles gambiae oenocyte characterisation: application to cuticular hydrocarbon synthesis. bioRxiv. , (2019).
- Pondeville, E., et al. Hemocyte-targeted gene expression in the female malaria mosquito using the hemolectin promoter from Drosophila. Insect Biochemistry and Molecular Biology. 120, 103339 (2020).
- Adolfi, A., et al. Functional genetic validation of key genes conferring insecticide resistance in the major African malaria vector, Anopheles gambiae. Proceedings of the National Academy of Sciences of the United States of America. 116 (51), 25764-25772 (2019).
- Pondeville, E., et al. Efficient integrase-mediated site-specific germline transformation of Anopheles gambiae. Nature Protocols. 9 (7), 1698-1712 (2014).
- Horn, C., Schmid, B. G. M., Pogoda, F. S., Wimmer, E. A. Fluorescent transformation markers for insect transgenesis. Insect Biochemistry and Molecular Biology. 32, 1221-1235 (2002).
- Clements, A. . A. Biology of Mosquitoes, Volume 1: Development, Nutrition and Reproduction. 1, (1992).
- Trpiš, M. A new bleaching and decalcifying method for general use in zoology. Canadian Journal of Zoology. 48, 892-893 (1970).
- Kaiser, M. L., Duncan, F. D., Brooke, B. D. Embryonic Development and Rates of Metabolic Activity in Early and Late Hatching Eggs of the Major Malaria Vector Anopheles gambiae. PLoS ONE. 9 (12), 114381 (2014).
- Grigoraki, L., Grau-Bové, X., Yates, H. C., Lycett, G. J., Ranson, H. Isolation and transcriptomic analysis of Anopheles gambiae oenocytes enables the delineation of hydrocarbon biosynthesis. eLife. 9, 58019 (2020).
- Xiao, Y. -. H., Yin, M. -. H., Hou, L., Pei, Y. Direct amplification of intron-containing hairpin RNA construct from genomic DNA. BioTechniques. 41 (5), 548-552 (2006).
- Livak, K. J. Organization and Mapping of a Sequence on the Drosophila melanogaster X and Y Chromosomes That Is Transcribed during Spermatogenesis. Genetics. 107 (4), 611-634 (1984).
- MR4, CDC, NEI & beiResources. . The MR4 Methods in Anopheles Research Laboratory Manual. 5th Edition. , (2015).
- Sik Lee, Y., Carthew, R. W. Making a better RNAi vector for Drosophila: use of intron spacers. Methods. 30 (4), 322-329 (2003).
- Cha-aim, K., Hoshida, H., Fukunaga, T., Akada, R., Peccoud, J. . Gene Synthesis: Methods and Protocols. , 97-110 (2012).
- Cavener, D. R. Comparison of the consensus sequence flanking translational start sites in Drosophila and vertebrates. Nucleic Acids Research. 15 (4), 1353-1361 (1987).
- Wang, Y., Wang, F., Wang, R., Zhao, P., Xia, Q. 2A self-cleaving peptide-based multi-gene expression system in the silkworm Bombyx mori. Scientific Reports. 5, (2015).
- Galizi, R., et al. A synthetic sex ratio distortion system for the control of the human malaria mosquito. Nature Communications. 5, 3977 (2014).
- Kondo, S., et al. Neurochemical organisation of the Drosophila Brain Visualised by Endogenously Tagged Neurotransmitter Receptors. Cell Reports. 30 (1), 284-297 (2020).
- Lee, P. -. T., et al. A gene-specific T2A-GAL4 library for Drosophila. eLife. 7, 35574 (2018).
- Marois, E., et al. High-throughput sorting of mosquito larvae for laboratory studies and for future vector control interventions. Malaria Journal. 11, 302 (2012).
- Crawford, J. E., et al. Efficient production of male Wolbachia-infected Aedes aegypti mosquitoes enables large-scale suppression of wild populations. Nature Biotechnology. 38 (4), 482-492 (2020).
- Goltsev, Y., et al. Developmental and evolutionary basis for drought tolerance of the Anopheles gambiae embryo. Developmental Biology. 330 (2), 462-470 (2009).
- Rezende, G. L., et al. Embryonic desiccation resistance in Aedes aegypti: presumptive role of the chitinized Serosal Cuticle. BMC Developmental Biology. 8 (1), 82 (2008).
- Vargas, H. C. M., Farnesi, L. C., Martins, A. J., Valle, D., Rezende, G. L. Serosal cuticle formation and distinct degrees of desiccation resistance in embryos of the mosquito vectors Aedes aegypti, Anopheles aquasalis and Culex quinquefasciatus. Journal of Insect Physiology. 62, 54-60 (2014).
- Chang, C. -. H., et al. The non-canonical Notch signaling is essential for the control of fertility in Aedes aegypti. PLOS Neglected Tropical Diseases. 12 (3), 0006307 (2018).
- Clemons, A., Flannery, E., Kast, K., Severson, D., Duman-Scheel, M. Immunohistochemical Analysis of Protein Expression during Aedes aegypti Development. Spring Harbor Protocols. 10, 1-4 (2010).
- Juhn, J., James, A. A. Hybridization in situ of Salivary Glands, Ovaries and Embryos of Vector Mosquitoes. Journal of Visualized Experiments. , e3709 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved