Method Article
מיצוי כרומטין מרקמת כבד כימרית קפואה לניתוח משקעים חיסוניים של כרומטין
In This Article
Summary
פרוטוקול זה מתמקד בהכנת כרומטין מרקמות קפואות והוא מתאים ל- Crosslinking Chromatin Immunoprecipitation (X-ChIP) ואחריו ניתוח PCR כמותי (X-ChIP-qPCR) או גישות ריצוף מהדור הבא (X-ChIP-seq).
Abstract
Crosslinking Chromatin Immunoprecipitation (X-ChIP) היא טכניקה נפוצה להערכת רמות סימני היסטון ותפוסת גורמי שעתוק על כרומטין, מארח ו / או פתוגן. הכנת כרומטין מרקמות יוצרת אתגרים נוספים שיש להתגבר עליהם כדי להשיג פרוטוקולים ניתנים לשחזור ואמינים הדומים לאלה המשמשים לתרבית תאים. שיבוש וקיבוע רקמות הם צעדים קריטיים להשגת גזירה יעילה של כרומטין. דו-קיום של סוגי תאים וצבירים שונים עשוי גם לדרוש זמני גזירה שונים כדי להגיע לגודל מקטע אופטימלי ומעכב את יכולת השחזור של הגזירה. מטרת שיטה זו היא להשיג תכשירי כרומטין מארח אמינים וניתנים לשחזור מרקמה קפואה (כבד) המתאימים הן ליישומי ChIP-qPCR והן ליישומי ריצוף מהדור הבא (NGS). ראינו כי השילוב של כתישת רקמת חנקן נוזלית ואחריה הומוגניזציה מוביל ליכולת שחזור מוגברת בהשוואה להומוגניזציה בלבד, שכן הוא מספק תרחיף המורכב בעיקר מתאים בודדים מנותקים הניתנים לגזירה יעילה. יתר על כן, שלב הקיבוע צריך להתבצע תחת סיבוב מתון כדי לספק crosslinking הומוגני. החומר הקבוע מתאים אז לבידוד גרעינים מבוססי חיץ, כדי להפחית את הזיהום של חלבון ציטופלזמי ודנ"א פתוגן ורנ"א (כאשר ישים), תוך הימנעות משיפועי צנטריפוגות גוזלות זמן. הסוניקציה הבאה תשלים ליזה גרעינית ותגזור את הכרומטין, ותפיק טווח גדלים מסוים בהתאם לתנאי הגזירה שנבחרו. טווח הגדלים צריך ליפול בין 100 ל -300 nt עבור יישומי NGS, בעוד שהוא יכול להיות גבוה יותר (300-700 nt) עבור ניתוח ChIP-qPCR. התאמות פרוטוקול כאלה יכולות לשפר מאוד את ניתוח הכרומטין מדגימות רקמות קפואות.
Introduction
מאז גילויו, הבקרה האפיגנטית בתאי יונקים זכתה להכרה הולכת וגוברת1, בהתחשב בכך שהבנת מנגנונים כאלה תספק תובנות מפתח לא רק בביולוגיה של התא, אלא גם בביולוגיה של מחלות וגידולים. יתר על כן, גורמים זיהומיים עשויים גם לגרום לשינויים אפיגנטיים של המארח2 בעוד שמנגנון התא המארח עשוי להשפיע גם על הכרומטין של פתוגנים, כגון נגיפי DNA מתמשכים 3,4. נראה כי משחק גומלין זה בין מארח לפתוגן ממלא תפקיד בהתמדה בזיהום. 2
באמצעות קשר הפיך עם דנ"א, חלבוני היסטון יוצרים קומפלקס הנקרא נוקלאוזום. נוקלאוזומים מגיעים בתורו לרמה גבוהה יותר של ארגון המכונה כרומטין. ידוע כי עיצוב מחדש של כרומטין מווסת באופן הדוק ביטוי גנים, מעניק או מונע גישה לגורמי שעתוק (TFs)5. גורמים אלה יכולים להפעיל או לחסום את גיוס ה-RNA פולימראז II (PolII) למקדמי גנים, ולהשפיע על סינתזת mRNA מתבניתהדנ"א 6. חלבוני היסטון מכילים זנבות7, משני צדי קפל ההיסטון, אשר יכולים להיות כפופים לשינויים שלאחר התרגום (PTM), המאפשרים ויסות הדוק של שעתוק הגן על ידי שינויים מבניים בכרומטין. רוב ה-PTMs של ההיסטון ממוקמים בזנב N-terminus, כאשר אצטילציה ומתילציה הן ה-PTM הנחקרות ביותר, אם כי דווח גם על זרחן8, יוביקוויטינציה9 וריבוסילציה10 . אפיון ומחקר של חלבונים כאלה הוא חיוני כדי לקבל תובנה עמוקה על בקרת גנים.
כיום, יש קומץ שיטות וכלים מבוססים היטב לחקר אינטראקציות ישירות בין דנ"א לחלבון: בדיקת שינוי ניידות אלקטרופורטית (EMSA), בדיקת שמרים היברידית אחת (Y1H) וטביעת רגל DNA11. עם זאת, שיטות אלה מתמקדות כשלעצמן באינטראקציות DNA-חלבון בודדות ואינן ישימות למחקרים ברחבי הגנום. מגבלה נוספת של טכניקות אלה היא היעדר קשר של היסטון עם מקטעי הדנ"א שנחקרו. לפיכך, גישות כאלה אינן אמורות לשקף את המורכבות של מנגנון השעתוק in vivo והן אינן לוקחות בחשבון שינויים מבניים חשובים12 או אנזימים/קו-פקטורים נדרשים אחרים13 שיכולים להשפיע (לקדם או לעכב) את קשירת החלבונים לדנ"א.
הרעיון שקיבוע תאים באמצעות חומרים כמו פורמלדהיד (FA) יכול לספק תמונת מצב in vivo של אינטראקציות חלבון-דנ"א, יצר את הבסיס לפיתוח מבחני משקעים חיסוניים של כרומטין (ChIP)14. זה, יחד עם הזמינות של טכנולוגיית PCR כמותי (qPCR) ושל נוגדנים ספציפיים מאוד, איפשר את הפיתוח של בדיקות ChIP-qPCR. לאחר מכן, הופעתן של טכניקות ריצוף מהדור הבא (NGS), שעלותן הופכת למשתלמת יותר, ויתרה על התאמת ניסויי ChIP עם גישות NGS (ChIP-seq), ובכך סיפקה לחוקרים כלים רבי עוצמה חדשים המאפשרים לחקור את ויסות הכרומטין. בבדיקות אלה, תאים מבודדים או בתרבית מקובעים עם דיסוצינימידיל גלוטרט (DSG) ו / או FA, גרעינים מבודדים, הכרומטין מקוטע ואז מואץ על ידי נוגדן העניין. לאחר מכן, DNA מטוהר ומנותח על ידי גישות PCR או NGS. בניגוד ל-EMSA, Y1H וטביעת רגל של DNA, למבחני ChIP יש את היכולת לספק תמונת מצב גלובלית של אינטראקציה חלבון-דנ"א בתוך התא. זה מציע גמישות ומאפשר ניתוח של מספר מוקדים בתוך אותו מדגם. עם זאת, בשל אופי הבדיקה, ChIP עשוי, בסופו של דבר, לזהות לא רק אינטראקציות ישירות, אלא גם אינטראקציות עקיפות, ולא להציע את הדיוק של השיטות הנ"ל, כאשר מעוניינים אינטראקציות ישירות חלבון-DNA.
פרוטוקולי הכנת כרומטין מחומר תרבית תאים מבוססים היטב15 וניתנים לשחזור רב, ומאפשרים למשתמש להשיג כרומטין המתאים הן לגישות qPCR והן לגישות NGS תוך 1-2 ימי עבודה. עם זאת, השגת כרומטין באיכות גבוהה מרקמות שלמות עדיין מהווה אתגר בגלל הצורך לנתק את התאים בתוך הרקמה תוך השגת קיבוע וגזירה אופטימליים של הכרומטין. בנוסף, ההרכב והמורפולוגיה של סוגי רקמות שונים משתנים, ולכן דורשים התאמה של פרוטוקולים קיימים16,17. השימוש ברקמה שמורה בהקפאה מציע אתגרים נוספים בהשוואה לדגימות טריות. זאת בשל הקושי להשיג השעיה של תא בודד ללא אובדן חומר נרחב. זה מוביל לגזירה לא נכונה, המעכבת יישומים במורד הזרם. עם זאת, גישה לדגימות רקמה קפואה במקום למקבילה הטרייה לא רק מגדילה את גמישות העבודה, אלא גם עשויה לייצג את האפשרות היחידה עבור חוקרים העובדים עם דגימות שמקורן במחקרי אורך או השוואה. פורסמו קומץ פרוטוקולים להכנת כרומטין לרקמות קפואות. אלה מבוססים בעיקר על הפשרת דגימות ואחריה טחינה, דיסוציאציה ידנית / מבוססת מכונה או שלבי כתישת חנקן נוזלי18,19,20.
כאן אנו מתארים שיטת הכנת כרומטיןאופטימלית 15 עבור דגימות כבד קפואות לא קבועות, המשלבת כתישת רקמות בחנקן נוזלי עם הומוגניזציה מזיקה, כדי להשיג גזירת כרומטין הניתנת לשחזור המתאימה לגישות X-ChIP שמטרתן לנתח גנום נגיפי ומארח כאחד.
Protocol
דגימת רקמות מעכברי כבד כימריים אנושיים21 בוצעה בהתאם להנחיית האיחוד האירופי 86/609/EEC ואושרה על ידי הוועדה האתית של העיר ומדינת המבורג בהתאם לעקרונות הצהרת הלסינקי.
1. הכנת ריאגנטים
- הכינו תמיסת גליצין בנפח 1.25 מ' במים נטולי יונים. מסנן סטרילי עם מסנן בגודל נקבוביות 0.22 מיקרומטר. יש לאחסן בטמפרטורה של 4°C.
- הכינו תמיסת נתרן כלורי (NaCl) בנפח 5 מ"מ. יש לאחסן בטמפרטורת החדר.
- הכינו תמיסת CaCl 2: 300 mM CaCl2 ו-10 mM Tris-HCl pH 8 במים נטולי יונים. מסנן סטרילי עם מסנן בגודל נקבוביות 0.22 מיקרומטר ומאוחסן ב- RT.
- הכינו דילול 10% Triton X-100 במים שעברו דה-יוניזציה. יש לאחסן ב-RT.
- הכן מאגר Tris-EDTA: 1 mM EDTA ו- 10 mM Tris pH 8 במים נטולי יונים. יש לאחסן בטמפרטורה של 4°C.
- הכינו את המאגרים הבאים בהתאם לכמות הנדרשת:
- הכינו חיץ A: 50 mM Hepes-KOH pH 7.5, 140 mM NaCl, 1 mM ethylenediaminetetraacetic acid (EDTA), 10% גליצרול, 0.5% NP-40 ו-0.25% Triton X-100 במים נטולי יונים. מסנן סטרילי עם מסנן בגודל נקבוביות 0.22 מיקרומטר. יש לאחסן בטמפרטורה של 4°C.
- הכנת חיץ B: 10 mM Tris-HCl pH 8, 200 mM NaCl, 1mM EDTA, 0.5 mM חומצה אגטזית (EGTA). מסנן סטרילי עם מסנן בגודל נקבוביות 0.22 מיקרומטר. יש לאחסן בטמפרטורה של 4°C.
- הכן חיץ C: 1% SDS, 10 mM EDTA ו- 50 mM Tris-HCl pH 8 במים נטולי יונים. מסנן סטרילי עם מסנן בגודל נקבוביות 0.22 מיקרומטר. יש לאחסן ב-RT.
- הכן מאגר דילול כרומטין: 0.01% SDS, 1.1% Triton X-100, 1.2 mM EDTA, 16.6 mM Tris-HCl pH 8 ו- 166 mM NaCl במים נטולי יונים. מסנן סטרילי עם מסנן בגודל נקבוביות 0.22 מיקרומטר. יש לאחסן בטמפרטורה של 4°C.
2. הכנת החומר
- אספו קרח יבש, קרח וחנקן נוזלי.
אזהרה: יש לטפל בקרח יבש ובחנקן נוזלי בזהירות הנדרשת כדי למנוע כוויות. - מצננים מראש את הצנטריפוגה ב-4°C.
הערה: שלב זה חשוב כדי למנוע פירוק חלבונים ודה-קרוסלינקינג במהלך שלבי הכביסה, שכן זה יפחית את איכות הכרומטין. - שים צלחת סטרילית על קרח יבש ולתת לו להתקרר.
הערה: ודא כי הצלחת גדולה מספיק כדי להקל על תהליך החיתוך. צלחת פטרי 100 מ"מ / צלחת תרבית תאים מומלצת. - מוציאים את aliquot הדרוש של גליצין 1.25 מ 'ולתת לו להגיע RT.
- הוציאו את האליציטוטים הדרושים של חיץ A, B ו- PBS. הוסף פרוטאז ו / או מעכבי deacetylase ו phosphatase כדי להגיע לריכוז פי 1 ולהשאיר אותם על קרח.
- הוציאו את האליציטוט הדרוש של חיץ C ומשאירים אותו ב- RT. אין להוסיף את מעכבי הפרוטאז ו/או הדאצטילאז והפוספטאז עד לציון שונה.
- הוציאו את האליציטוט הדרוש של RT PBS.
אזהרה: מאגר C מכיל סודיום דודציל סולפט (SDS). אמצו את אמצעי הבטיחות המתאימים בעת הכנת החיץ.
הערה: SDS שוקע על קרח, ומעכבי פרוטאז ודאאצטילאז אינם יציבים ב-RT. - מצננים מראש את הטיט היוצק חנקן נוזלי בחדרו, תוך הקפדה על הוראות הספק. מצננים את המתכת בקרח יבש למשך 5 דקות לפחות.
הערה: ניתן להשתמש במרגמה חלופית לזו המוצעת. עם זאת, המכשיר המשמש בפרוטוקול זה, בשל הבנייה המוזרה שלו, מאפשר לעבוד עם כמות קטנה של רקמות ללא הפסד משמעותי במהלך תהליך הריסוק. - מראש מצננים את ההומוגנייזר Dounce עם המזיק A המשויך על קרח.
הערה: Pestle A יש התאמה רופפת עם homogenizer. זה מאפשר להשיג השעיה תא בודד ללא ליזה התא משמעותי.
3. הצלבת רקמות
- חותכים כ 50 מ"ג של רקמה קפואה ישירות על צלחת על קרח יבש בעזרת אזמל פינצטה.
הערה: מומלץ לשמור את האזמל ב- RT, מכיוון שזה יקל על תהליך החיתוך. הימנע מהפעלת לחץ רב מדי על אזמל, שכן זה יגדיל את הסיכון לפזר חתיכות רקמה מחוץ לאזור החיתוך. כדי לציין, 50 מ"ג של רקמה (כבד במקרה זה) צריך להניב סביב 5 מיליון תאים. שימו לב שהלהב החם יפשיר את חוד החנית. עם זאת, בהתחשב בגודל הגדול יחסית של פיסת הרקמה, אמורה להיות לכך השפעה מוגבלת. כאשר חתיכות קטנות יותר נחתכות, זה יכול להיות מועיל להשתמש אזמל קר לשים לב כדי למנוע פיזור של הרקמה. - שים את הרקמה לחתוך צינור 1.5 מ"ל כבר צונן על קרח יבש. הימנעו מהפשרת רקמות.
- העבר את הצינור המכיל את הרקמה לטיט, ותן לו לשבת שם במשך 5 דקות.
הערה: מתן הדגימה לנוח במכתש מוריד את הטמפרטורה שלה (מ -80 ° C ל -196 ° C). זה מגביר את הקשיחות שלה ומקל על שלב הריסוק. - הפעילו לחץ על הדגימה בעזרת המזיק המצונן מראש עד שלא נראים עוד פירורים מוצקים.
הערה: חשוב להימנע מחימום מזיקים על ידי כוחות סיבוב מוגזמים, מכיוון שזה יפשיר את הדגימה. לאחר כל כתישת דגימה נקו את המזיק עם 70% אתנול (EtOH) ותנו לו להתקרר שוב על קרח יבש. - הסר את הצינור המכיל את הדגימה מהטיט והוסף 950 μL של PBS קר כקרח עם המעכבים הנדרשים. פיפטה בעדינות למעלה ולמטה עד הדגימה הוא resuspended לחלוטין. המשך מיד לשלב 3.6.
- העבר את השעיית הרקמה להומוגנייזר והחל 20-30 פעימות עם פסטל A כדי להשיג השעיה עדינה יותר. יש להימנע מהקצפה.
הערה: יש למטב את כמות המשיכות בהתאם לעקביות הרקמה. צעד זה מנתק עוד יותר את אשכולות התאים הקטנים המתקבלים לאחר כתישת. הומוגניזציה לא נכונה עלולה להשפיע על יעילות הגזירה. - מעבירים את ההומוגנט לצינור חדש של 1.5 מ"ל, שכבר מקורר על קרח.
- צנטריפוגה למשך 5 דקות ב 1,300 x גרם ב 4 ° C ובזהירות להסיר את supernatant.
- יש להשהות את הגלולה לחלוטין ב-950 μL של RT PBS על ידי פיפטינג עדין ולהוסיף 63.6 μL של 16% FA נטול MeOH כדי לקבל ריכוז סופי של 1%. המשך מיד לשלב 3.10.
זהירות: FA הוא כימיקל רעיל. טפל בו מתחת למכסה מנוע עם אמצעי בטיחות מתאימים.
הערה: השעיה חלקית עלולה לעורר צבירת תאים במהלך שלב הקיבוע. זה מעכב את הליזיס ואת תהליך הגזירה. - סובב 10 דקות ב- RT. המשך מיד לשלב 3.11
הערה: יש צורך ברוטציה כדי להימנע מצברים. יש לייעל את משך הזמן הדרוש לקיבוע, בהתאם ליעד העניין ולסוג המדגם. חשוב לציין כי זמני קיבוע מוגזמים עלולים לעכב גזירה נכונה. - הוסף 113 μL של 1.25 M גליצין ב- RT כדי לקבל ריכוז סופי של 125 mM וסובב במשך 5 דקות.
הערה: גליצין מרווה את תגובת הקיבוע ונמנע מהצלבת יתר. - צנטריפוגה ב-1,300 x גרם למשך 3 דקות ב-4°C.
- השליכו את הסופרנאטנט והשעו מחדש את הגלולה בזהירות על ידי פיפטציה של 950 מיקרוליטר של PBS קר כקרח עם המעכבים הדרושים.
- צנטריפוגה ב-1,300 x גרם למשך 3 דקות ב-4°C.
- חזור על שלבים 3.13-3.14 והמשך מיד לשלבי בידוד הכרומטין.
4. בידוד כרומטין
- הוסף 950 μL של Buffer A עם המעכבים הדרושים לכדור. מערבבים בעדינות על ידי פיפטינג עד שהגלולה תלויה לחלוטין ומסובבים 10 דקות ב-4°C.
הערה: שלב זה מניח את התרחיף הקבוע של תא בודד, ללא ליזה גרעינית. זה מאפשר להיפטר מדגם של חלבונים cytosolic ו RNAs. הארכת זמן הליזה יכולה להועיל לתאים קשים לליז, ולהגדיל את זמן הטיפול ברקמה. בשלב זה ניתן לבדוק את התכשיר תחת המיקרוסקופ לאחר צביעת טריפאן כחול/DAPI כדי לבדוק את גודל הצבירים ואת הימצאותם של תאים בודדים. עם זאת, ייתכן שלא יהיה קל להעריך את הגרעינים הבודדים בגלל חומר הרקמה הקבוע. - צנטריפוגה ב 2,000 x גרם במשך 5 דקות ב 4 ° C ובזהירות להסיר את supernatant.
- הוסף 950 μL של Buffer B עם המעכבים הדרושים לכדור. מערבבים בעדינות על ידי פיפטינג עד שהגלולה תלויה לחלוטין ומסובבים 10 דקות ב-4°C.
הערה: שלב זה שוטף את חיץ הליזה מהכנת הגרעינים כדי למנוע ליזה בלתי רצויה נוספת. - צנטריפוגה ב 2000 x גרם במשך 5 דקות ב 4 ° C. בינתיים, הוסף את המעכבים הדרושים (כמו שלב 2.5) למאגר C.
- בזהירות להסיר את supernatant.
- הוסף 300 μL של RT buffer C לגלולה ופיפטה במרץ.
- מערבלים את הדגימה במשך 15-30 שניות ומסובבים את הצינור לזמן קצר כדי לאסוף את הטיפות על המכסה.
הערה: שלב זה חשוב כדי לשחרר ולשכב את הגרעינים הקבועים. כדי לשמור על שלמות הדגימה ובו בזמן להימנע ממשקעים SDS, יש לשמור את הדגימה לפני הסוניקציה במדף פלסטיק הנשמר על קרח כדי לשמור על טמפרטורה של 9-11 מעלות צלזיוס.
5. פיצול כרומטין
- העבר את הדגימה לשלוש שפופרות נקיות בעלות אישור סוניקציה של 0.65 מ"ל המבטיחות 100 μL של תרחיף גרעיני ליזה לכל צינור.
הערה: ניתן להשתמש בשפופרות 1.5 מ"ל מאושרות סוניקציה עם נפח מרבי של 300 μL. יש צורך במחזיק ספציפי עבור צינורות אלה. 0.65 מ"ל צריך להציע גזירה הומוגנית יותר בשל נפח קטן יותר של הדגימה לכל צינור. - סוניק את הכרומטין במשך 28 מחזורים בעוצמה גבוהה עם הגדרת 30 שניות ON ו- 30 s OFF. ודא שאמבט הסוניקטור מקורר כראוי (קרח או התקן קירור).
הערה: שלב זה דורש מיטוב כמעט בכל מקרה. על המשתמש לזכור כי הגדלת זמן הגזירה תספק מקטעים קטנים והומוגניים יותר; עם זאת, זה עשוי להגדיל את הסיכוי להוריד את איכות הכרומטין. בחר את מספר המחזורים הנמוך ביותר המספק את גודל המקטע הנדרש. במהלך אופטימיזציה של שלב זה, כדאי לבצע צביעה גרעינית כדי לבדוק אם מספר המחזורים היה מספיק כדי לשקר את רוב הגרעינים. - מעבירים את הכרומטין הסוניק לצינור חדש של 1.5 מ"ל שצונן בעבר על קרח.
- הוסף 30 μL של תמיסה Triton X-100 10% ומערבולת עבור 5-10 שניות.
הערה: Triton X-100 קושר את SDS ומונע משקעים נוספים ב 4 °C (75 °F). הסכום הסופי של Triton X-100 צריך תמיד להיות 1%. - צנטריפוגה ב-16,000 x גרם למשך 15 דקות ב-4°C.
- מעבירים את הסופרנאטנט לצינור נקי של 1.5 מ"ל מקורר מראש על קרח.
- הערה: הסופרנאטנט מכיל את הכרומטין הגזור ואמור להיראות צלול. הגלולה מכילה מנוחות "לא ניתנות לגזירה" והיא אמורה להישאר קטנה למדי (בעיקר חומה במקרה של רקמת כבד). חפשו אינדיקציה לגזירה לא מוצלחת: תמיסת כרומטין שלא הפכה ברורה יותר ומידות גלולות דומות לאלו של שלב 4.5.
6. טיהור DNA
- מעבירים 10-25 מיקרוליטר של כרומטין גזוז לצינור חדש ומוסיפים חיץ C כדי להגיע לנפח סופי של 200 מיקרוליטר. אחסנו את שאר הכרומטין בטמפרטורה של -80°C עד לשימוש נוסף. במידת הצורך, ניתן להפסיק את ההליך בשלב זה ולאחסן את הדגימה ב -20 °C.
- יש להוסיף 8 μL של 5 M NaCl ולדגור לפחות 6 שעות ב-65°C בבלוק חימום תחת רעידות ב-1000 סל"ד.
הערה: שלב זה מבטל את ההצלבה של הכרומטין. בטוח יותר להאריך את ביטול הקרוסלינקינג בן לילה במידת האפשר. הנוכחות של NaCl מייעלת את התהליך. - תן את הדגימות להתקרר ב RT במשך 5 דקות ולהוסיף 2 μL של RNase A.
- יש לדגור במשך שעה אחת ב-37°C תחת רעידות ב-1000 סל"ד.
- הסר את הדגימות מבלוק החימום והוסף 7 μL של 300 mM CaCl 2 ו2 μL של Proteinase K.
- כוונו את בלוק החימום לטמפרטורה של 56°C ודגרו במשך 30 דקות תחת רעידות ב-1000 סל"ד. בינתיים, הכינו צינור הפרדת פאזה אחד לכל דגימה על ידי צנטריפוגה שלהם ב 16,000 x גרם למשך דקה אחת ב 4 ° C.
הערה: צינורות מיוחדים אלה הופכים את הפרדת הפאזה במהלך מיצוי פנול-כלורופורם חומצת גרעין לקלה יותר. - הסר את הצינורות מבלוק החימום ותן להם להתאזן ב- RT למשך 3 דקות.
- העבר 400 μL של הדגימה לצינור הפרדת פאזה צנטריפוגה בעבר.
- הוסף 400 μL של תמיסת אלכוהול פנול-כלורופורם-איזואמיל (PCI) ומערבולת במשך 5 שניות.
זהירות: PCI היא תרכובת נדיפה ורעילה מאוד. אנא טפל בו עם אמצעי הבטיחות הדרושים תחת מכסה אדים. - צנטריפוגה ב 16,000 x גרם במשך 5 דקות ב 4 ° C.
- הוסף 400 μL של כלורופורם ומערבולת במשך 5 שניות.
זהירות: כלורופורם הוא תרכובת נדיפה ורעילה מאוד. אנא טפל בו עם אמצעי הבטיחות הדרושים תחת מכסה אדים.
הערה: שלב זה שוטף שאריות אפשריות של פנול, שעלולות להפריע ליישומי PCR במורד הזרם. - צנטריפוגה ב 16,000 x גרם במשך 5 דקות ב 4 ° C.
- העברת 400 μL של השלב העליון לצינור חדש של 1.5 מ"ל שבו נוספו 24 μL של 5 M NaCl ו 0.75 μL גליקוגן. מערבולת קצרה.
- הוסיפו 1,055 μL של 100% EtOH ומערבלו היטב. הקפידו על ערבוב נכון.
- יש לדגור בטמפרטורה של -80°C למשך שעה אחת או ב-20°C למשך הלילה (ON).
הערה: שלב זה מזרז את הדנ"א החתוך; כדי למקסם את התשואה מומלץ לבחור את הדגירה ON. - צנטריפוגה ב 16,000 x גרם במשך 30 דקות ב 4 ° C.
- בזהירות להסיר את supernatant לשים לב לא להזיז את הכדור.
- הוסף 500 μL של קר 70% EtOH. הטו את הצינור בעדינות כדי לוודא שהגלולה נשטפת.
הערה: שלב זה חיוני כדי להסיר שאריות מלח שעלולות היו לזרז יחד עם חומצות הגרעין. מלחים יכולים להפריע ליישומים אחרים במורד הזרם. - צנטריפוגה ב-16,000 x גרם למשך 15 דקות ב-4°C.
- מוציאים בזהירות את כל הסופרנאטנט ונותנים לגלולה להתייבש ב-RT.
הערה: דגירה של הצינור על בלוק חימום בטמפרטורה של 37°C תקצר את הזמן הדרוש לייבוש. - הוסף 50 μL של תמיסת Tris-EDTA (TE-Buffer) ושים את הצינור על בלוק החימום ב 37 ° C למשך 5-10 דקות תחת רעד ב 300 סל"ד.
הערה: שלב זה מבטיח את המסת הכדור. ניתן להשהות את הפרוטוקול כאן, וניתן לאחסן את הדגימה ב -4 ° C למשך עד שבוע אחד או ב -20 ° C לאחסון ארוך יותר. - בצע ניתוח DNA על ג'ל אגרוז 1%.
7. ניתוח גודל DNA
- הכינו ג'ל אגרוז 1% על ידי ערבוב של 1 גרם אגרוז לכל חיץ ריצה של 100 מ"ל (כלומר, Tris-אצטט-EDTA (TAE) או Tris-borate-EDTA (TBE)). מחממים את המתלה עד שהאגרוז מומס לחלוטין. הוסף 10 μL של EtBr עבור כל 100 מ"ל של תמיסת agarose לפני יציקת תמיסת הג'ל.
זהירות: EtBr הוא חומר intercalating DNA ידוע כמסרטן. אנא טפל בו עם אמצעי הבטיחות הדרושים תחת מכסה אדים.
הערה: מומלץ מאוד להכתים EtBr (ישירות בג'ל או לאחר הריצה). צבעים אחרים שמצלבים דנ"א לא תפקדו היטב בידינו כשעבדנו עם מריחות דנ"א. בארות טעינה צרות מספקות רזולוציה טובה יותר בהשוואה לבארות רחבות יותר. - מערבבים 10 μL של הדגימה עם 2 μL של 6x טעינת צבע. לאחר מכן, לטעון 10 μL של הדגימה בג'ל ולהפעיל אותו עד הרצועה האחרונה של צבע העמסה רץ עבור 2/3 של הג'ל. הקפידו להוסיף סולם DNA.
- צלם את הג'ל ובדוק אם גודל המריחה נופל בטווח עבור היישום הרצוי.
אם הכרומטין עובר את בקרת האיכות, ניתן להשתמש בו ליישומים במורד הזרם.
תוצאות
הכנת כרומטין היא צעד מכריע בהשגת ChIP מוצלח. על מנת להכין כרומטין באיכות טובה מדגימות קפואות, עלינו להבטיח שיבוש רקמות יעיל לפני הקיבוע כדי למנוע נוכחות של גושי רקמות שעלולים לעכב גזירה יעילה. איור 1 מציג צינור מסוכם של הפרוטוקול. כתישה לבדה אינה מספיקה כדי לנתק לחלוטין את הרקמה, מאחר שהיא מייצרת צבירי תאים בגודל משתנה ומעט תאים בודדים (איור 1a). כאשר מקשרים את שלב הריסוק הראשון עם הומוגניזציה של Dounce, כמות גושי הרקמה מופחתת מאוד והנותרים קטנים יותר (איור 1b). לאחר שלבי הקיבוע והליזיס, מספר הגרעינים הבודדים הנראים לעין (איור 1c) גדל, בעוד המראה הכדורי האופייני אובד. לאחר סוניקציה במשך 28 מחזורים, הצביעה הגרעינית (Hoechst 33258/DAPI) לרוב אינה נראית עוד. זהו אכן סימן לגזירה מוצלחת (איור 1d). לאחר דה-קרוסלינקינג של אליקוט כרומטין והדמיה של הדנ"א על ג'ל אגרוז, ניתן לזהות גזירה מוצלחת על-ידי נוכחות של מקטעים בטווח של 100-300 bp. (איור 2a) כמות הדנ"א יכולה להשתנות בהתאם להרכב פיסת הרקמה שהוכנה. כרומטין כזה יכול לשמש בהצלחה עבור ChIP-qPCR. כפי שניתן לראות באיור 2b , הכרומטין יכול להיות מואץ בהצלחה באמצעות נוגדנים H3K4me3, H3K27ac (שינויים הקשורים לגנים פעילים) ו-H3K27me3 (שינוי הקשור לגנים מושתקים). אזורים מקדמי כרומוזום 1 מסגרת קריאה פתוחה 43 (C1orf43), פרוטאזום 20S תת-יחידה בטא 2 (PSMB2) וגליצראלדהיד 3-פוספט דהידרוגנאז (mGapdh) הביאו מועשרים באזורי H3K4me3 ו-H3K27ac בהשוואה לאזורי מקדם הומיאובוקס C13 (HOXC13), הומיאובוקס C12 (HOXC12) ואזורי מקדם גורם שעתוק מיאלין של עכבר 1 (mMyt1) (טבלה 1). הסיבה לכך היא ש-C1orf43, PSMB2 ו-mGapdh מתועתקים באופן קונסטיטוטיבי בכבד, בעוד HOXC13, HOXC12 ו-mMyt1 מושתקים. H3K27me3 מראה התנהגות הפוכה המאשרת את ההצלחה של מבחן ChIP. העובדה שהכבד של עכברים אלה הוא כימרה, אפשרה לנו לנתח הן את הכרומטין והן את הכרומטין האנושי. בנוסף, אותו כרומטין יכול לשמש בהצלחה לניסויי ChIP-seq. לאחר שלב הריצוף, הקריאות יושרו לאינדקס המורכב הן מגנום מורין והן מגנום אנושי כדי להפחית את כמות המקטעים הבלתי מיושרים. לאחר מכן, הקריאות הופרדו לפי מינים ונותחו עוד יותר עם EaSeq22 . עוצמת האות נמדדה לאחר מכן באתר התחלת השעתוק (TSS) של כל גן והתוצאה מויינה לעוצמת אות H3K4me3. איור 3a ואיור 3c מראים נוכחות ניכרת של H3K4me3 ו-H3K27ac ב-TSS עבור חלק ניכר מהגנים בכרומטין-עכבר ובכרומטין. בנוסף לכך, H3K27me3 נוגד קורלציה עם H3K4me3/H3K27ac. H3K27me3 נמצא לכל אורך הגן ולא רק ב-TSS, כמצופה מ-PTM זה. איור 3b ואיור3d מראים את צביר HOXC/HoxC הידוע בכך שהוא מועשר עבור H3K27me3 ואינו פעיל בשעתוק הן בכבד עכבר והן בכבד אנושי. הפרופיל של H3K4me3 ו- H3K27ac מראה שיאים עבור שני PTM אלה בעוד שעוצמת האות של H3K27me3 נוטה להיות נמוכה יותר ומפוזרת יותר.
בשל המורכבות של הכנת הכרומטין, קיבוע יתר עלול לקרות, ליזה או זמן סוניקציה עשויים להיות לא אופטימליים, גושי תאים גדולים עשויים להימשך, או טיפול לקוי של הדגימה יכול להיות לקוי. כל אלה הם אירועים המשפיעים על איכות ההכנה. במקרים מסוימים, העשרה של שברי כרומטין בגודל הנכון עדיין תהיה נוכחת או תועבר לגודל גבוה יותר. במקרים אחרים, ייתכן אובדן חומר עקב ליזה מוקדמת או גזירה לא מוצלחת. איור 4 מראה כמה דוגמאות לתוצאות שליליות ותת-אופטימליות כאלה. נתיבים 3 ו-4 מראים העשרה של גודל השבר בין 200 bp ל-800 bp. עם זאת, ברור כי גודל השבר נע בין 100 bp ל >10,000 bp. בנתיבים 5 ו-6 קיימת העשרה בטווח של 100-250 bp עם אובדן ברור של חומר במהלך ההכנה. זה יכול להסביר מדוע הסוניקציה יצרה רסיסים קטנים יותר. נתיב 7 מראה הכנה מעט לא אופטימלית עם הגדלת טווח השברים, ואילו נתיב 8 מראה אובדן כמעט מוחלט של חומר. זה יכול להיגרם על ידי ליזה גרעינית מוקדמת או דיסוציאציה לא מספקת של רקמות עם אובדן כתוצאה מכך לאחר שלב 5.5.
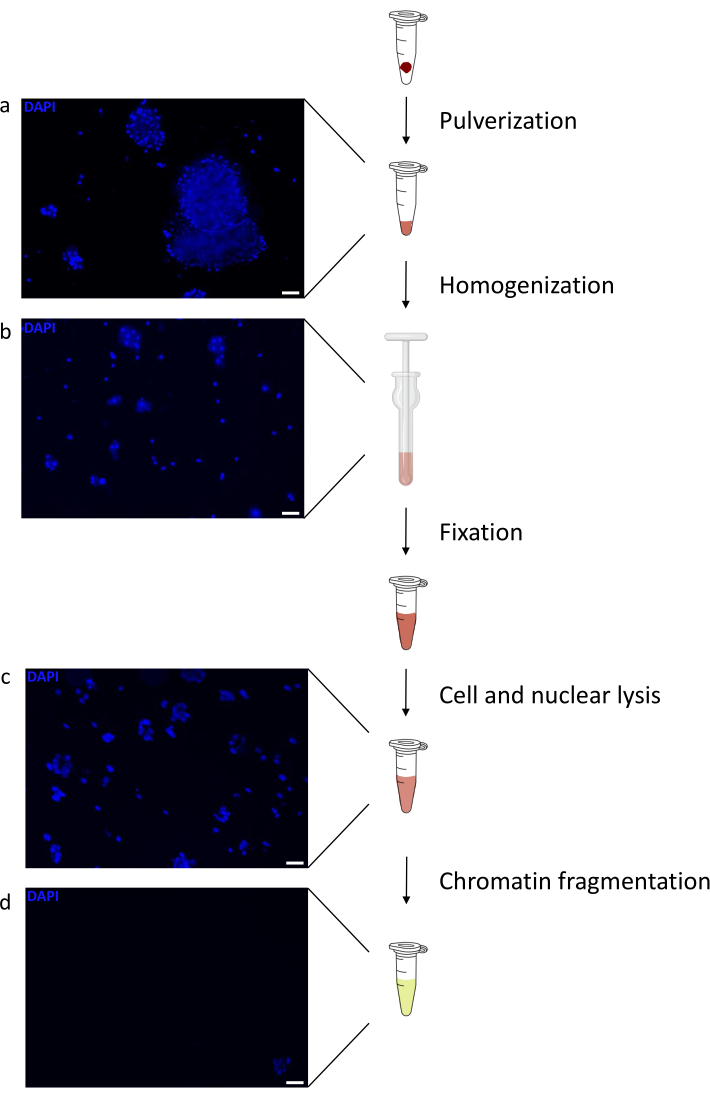
איור 1: סקירה כללית של פרוטוקול הכנת הכרומטין. התמונות צולמו לאחר כתישת רקמות (a), הומוגניזציה ידנית נוספת (b), לאחר ליזה גרעינית (c) ולאחר סוניזציה (לפני צנטריפוגה) (d). צביעה גרעינית בוצעה עם Hoechst 33258/DAPI. סרגל קנה מידה = 200 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
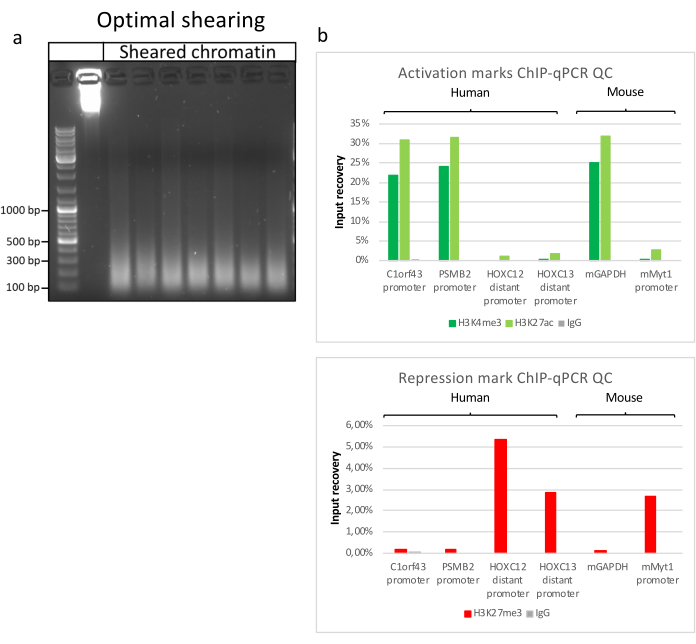
איור 2: גזירת כרומטין מייצגת, ואיכותה מוערכת על-ידי ChIP-qPCR . ג'ל אגרוז 1% עם דגימות כרומטין מקוטעות בהתאם לפרוטוקולים מתכשירי כרומטין שונים. בקרה של כרומטין לא גזוז מתווספת כדי להבטיח שלא תהיה התפרקות כרומטין/דנ"א לפני כן (א). כרומטין גרוס נבדק לאיכות ביצוע בדיקת ChIP-qPCR. נוגדנים H3K4me3, H3K27ac ו- H3K27me3 שימשו כדי לזרז את הכרומטין הטרי. (ב ) ניתוח qPCR בוצע על מקדמים פעילים אנושיים (C1orf43 ו-PSMB2), מורין (Gapdh) ומקדמים לא פעילים אנושיים (HOXC13, HOXC12), מורין (Myt1). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
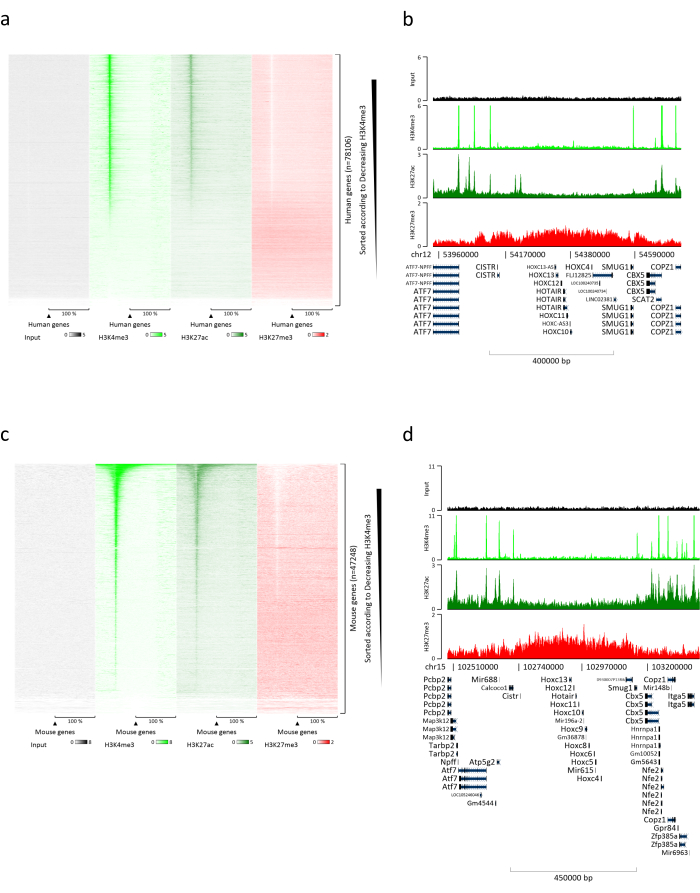
איור 3: ניתוח ChIP-seq מייצג. הקריאות יושרו לאינדקס שנוצר עם גנום אנושי ועכבר (hg19 ו-mm10). לאחר היישור הופרדו קריאות אנושיות וקריאות מורין ונותחו עוד יותר. מפת חום של גנים אנושיים שבהם האות כומת ב-TSS והראה בסדר יורד את עוצמת H3K4me3 (a). דוגמה לצביר גנים אנושי של גנים מדוכאים (אשכול HOX) המוקף בגנים פעילים (b). מפת חום של גנים מורינים שבהם האות כומת ב-TSS והוצג בסדר יורד עבור עוצמת H3K4me3 (c). דוגמה לצביר גנים מורין של גנים מדוכאים (אשכול Hox) המוקף בגנים פעילים (d). כל הנתונים המוצגים נורמלו על ידי EaSeq למיליון קריאות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 4: תכשירי כרומטין לא אופטימליים וכושלים. 1% ג'ל אגרוז עם דגימות כרומטין מקוטעות בהתאם לפרוטוקול. האיור מכיל כרומטין לא גזוז המשמש כבקרה (נתיב 2), גזירה לא אופטימלית (נתיב 3-4), גזירה אופטימלית עם אובדן חומר ברור (נתיב 5-6), גזירה תת-אופטימלית (נתיב 7) ואובדן חומר נרחב (נתיב 8). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
| שם פריימר | רצף | |
| מקדם C1orf43 | קדימה | AGTGGGTGGAGAATGCAGAC |
| הפוך | GAGATTACCCCACCCCATTC | |
| מקדם PSMB2 | קדימה | CTTATTCAACCCCCGACAAA |
| הפוך | GATGAAGGACGGTGAGAGGA | |
| מקדם דיסטלי HOXC13 | קדימה | GAGCCCGAGATTCACTCAAC |
| הפוך | TTATGCCCAGTTTTGGTTTA | |
| מקדם דיסטלי HOXC12 | קדימה | AAAGCTTCCCACTGCAAAGA |
| הפוך | AAATCTGGGGGCGAACTACT | |
| מקדם mGAPDH | קדימה | GGTCCAAAGAGAGGAGAGAG |
| הפוך | GCCCTGCTTATCCAGTCCTA | |
| מקדם mMYT | קדימה | CAGCCCAATTCTAGCCACAT |
| הפוך | CCAAAGCAGGGGAGTAGGAG |
טבלה 1: רשימת פריימרים qPCR עבור גנים פעילים ולא פעילים המשמשים לבדיקות ChIP-qPCR.
Discussion
הכנת כרומטין מרקמה קפואה מהירה נותרה אתגר בגלל מספר השלבים שיש לייעל על מנת להשיג תוצאות ניתנות לשחזור ואמינות. רוב הפרוטוקולים שכבר פורסמו 16,23 דורשים טחינת רקמות לפני הדיסוציאציה הידנית (douncing). ניסינו להימנע ככל האפשר מצעדים שעלולים לעורר פירוק חלבונים לפני קיבוע הדגימה. שלב הריסוק כבר נמצא בשימוש בתכשירי כבד קפואים24 והופך את הדיסוציאציה הידנית לקלה יותר וניתנת לשחזור (ראו איור 2a). עם שימוש במכתש שתוכנן במיוחד עבור צינורות 1.5 מ"ל (ראה פרוטוקולים), אובדן הדגימה במהלך תהליך הריסוק מצטמצם, ומאפשר לעבד כמויות קטנות של רקמה כגון דגימות ביופסיה של הכבד. באופן עקרוני ניתן להשתמש בהומוגניזציה ישירה של רקמות ללא כל שלבי שחיקה; עם זאת, הומוגניזציה של רקמות ללא כתישה קודמת יש שחזור גרוע יותר בניסיון שלנו ואת המראה של בעיות עבור יישומים במורד הזרם היה גבוה יותר (הנתונים לא מוצגים).
רוב הבעיות בהן נתקלים בהכנת כרומטין מרקמות נובעות מאופי הדגימות הללו ומחוסר היכולת לבדוק כראוי אם אשכולות התאים קטנים מספיק לקיבוע מבלי לאבד מאיכותם. יתר על כן, בדיקת כל aliquot בכל שלב יהיה זמן רב להגדיל את הסיכוי של פירוק חלבון.
קיבוע (שלב 3.9) הוא חלק בסיסי ומכריע בהכנת הכרומטין. בשל אופי הרקמה, שלב הקיבוע התעכב עד להומוגניזציה של הרקמה. לשלב קיבוע נדחה כזה יש יתרון לייצר השעיית תאים הומוגנית יותר. עם זאת, אנו מכירים בכך שבמקרה של מטרות רגישות במיוחד למניפולציה, ייתכן שיהיה צורך לבצע את הקיבוע ממש לפני שלב 3.6. זה יעזור להגן על חלבונים רגישים מאוד או PTM, אם כי זה עשוי להגדיל את גודל אשכולות התא, כי כאשר קבוע עלול לגרום לגזירה לא הומוגנית. הריכוז של תמיסת FA המשמשת בפרוטוקול הוא סטנדרטי, עם זאת, ניתן לשנות אותו כדי לנסות לשפר את הקיבוע הכולל. זמן הקיבוע שנבחר כאן משקף גם תנאים סטנדרטיים הנפוצים בתחום. במקרה של ריכוז גבוה יותר של תמיסת הקיבוע, זמן הקיבוע עשוי להיות מופחת, ואילו במקרה של כמות נמוכה יותר יש להגדיל אותו. על המפעיל לקחת בחשבון כי שינוי זמן הקיבוע עלול להוביל לקיבוע יתר של הדגימה או לתת מקום לפירוק חלבון. במקרה של שאיפה לזרז קומפלקסים גדולים (או חלק מהם) ו- TFs, יהיה זה יתרון לבצע קיבוע דו-שלבי באמצעות פתרון DSG ואחריו FA אחד25,26. DSG במקרה זה ייצב אינטראקציות חלבון-חלבון, בעוד פורמלדהיד פועל בעיקר על אינטראקציות DNA-חלבון ישירות27.
על המפעיל לקחת בחשבון את האפשרות ליישם ערכה מבוססת עמודות לטיהור DNA החל משלב 6.7 שהוא מהיר יותר ואינו משתמש בתרכובות רעילות. עם זאת, תמיד תהיה כמות מסוימת של דנ"א לא קשור שיאבד. מסיבה זו, אנו ממליצים להשתמש במיצוי פנול-כלורופורם קלאסי ואחריו משקעים EtOH. יתר על כן, לפני הפעלת ג'ל אגרוז (שלב 7.2) זה יכול להיות מועיל למדוד את ריכוז ה- DNA ולטעון את אותה כמות עבור כל באר כדי לקבל תמונה ברורה יותר.
מגבלה של פרוטוקול זה נובעת מהעובדה שחקרנו והשתמשנו בפרוטוקול זה רק באמצעות דגימות כבד שמקורן בעכברים כימריים אנושיים-כבדים28. כשלעצמו הכבד מורכב מרקמת אפיתל וחיבור29. במקרה של מחלה, רקמה פיברוטית ורקמת שומן עשויים להיות נוכחים30,31 יצירת אתגרים נוספים במהלך הפרעה ברקמות. עם זאת, אנו מכירים בכך שלא ניתן להשתמש בפרוטוקול שלנו על רקמת עצם, שריר ושומן ללא אופטימיזציה של שלבי הדיסוציאציה והסוניקציה. יש לציין כי כל רקמה דורשת אופטימיזציה כלשהי בשל היעדר פרוטוקול המתאים לכולם כמו לדגימות תרבית תאים15. אנו מאמינים, עם זאת, כי עם אופטימיזציה מועטה או ללא אופטימיזציה כלל, פרוטוקול זה יכול להיות מיושם בהצלחה על רקמות אחרות החולקות דמיון עם הכבד בהרכב, כמו ריאות, מעי, קיבה, לבלב או רקמות כליות.
הפרוטוקול שלנו שימש בהצלחה גם לניתוח TFs ושינויים בהיסטון על אפיזום DNA סגור קוולנטית HBV (cccDNA)32. זה פותח את ההזדמנות ליישם גישה כזו עבור גנומים נגיפיים אחרים המשפיעים על הכבד, כגון Cytomegalovirus33 אנושי (hCMV) ו Adenoviruses34 אנושי (HAdV). זה לא נכלל כי ניתן יהיה לנתח וירוסים אחרים DNA להקים זיהום מתמשך ברקמות אחרות כמו Kaposi Sarcoma הרפס וירוס35 (KHSV), הרפס סימפלקס וירוס 36 (HSV1/2) וירוסים פוליומה, וירוס אפשטיין-בר37 (EBV).
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
המחקר נתמך על ידי קרן המחקר הגרמנית (DFG) על ידי מענק למאורה דנדרי (SFB 841 A5) ועל ידי מדינת המבורג עם תוכנית המחקר (LFF-FV44: EPILOG).
ברצוננו להודות לד"ר טאסילו וולץ, איבון לאדיג'ס ואניקה וולמרי על העזרה הטכנית ועל הקריאה הביקורתית של כתב היד. ד"ר תומאס גינתר ופרופ' אדם גרונדהוף על מתן הצעות מועילות מאוד וערכות הפריימר לניתוח ChIP-qPCR.
Materials
| Name | Company | Catalog Number | Comments |
| 0.22µm sterile syringe filter | Labsolute | 7699822 | |
| 1.5 mL Safeseal tubes | Sarstedt | 7,27,06,400 | |
| 6x orange loading dye | Thermofisher | R0631 | |
| Benchtop refrigerated centrifuge | |||
| Bioruptor NGS | Diagenode | ||
| Blade or Scalpel | |||
| Calcium chloride dihydrate | Carl Roth | HN04 | |
| Chloroform | Sigma Aldrich (Merck) | C2432 | |
| cOmplete Protease Inhibitor Cocktail | Roche | 11697498001 | |
| Deacetylase Inhibitor | Active Motif | 37494 | |
| Dounce tissue grinder set | Sigma Aldrich (Merck) | DWK885300-0001-1EA | |
| EDTA 500 mM solution | PanReac AppliChem | A4892 | |
| EGTA | Sigma Aldrich (Merck) | E4378 | |
| EtBr | Carl Roth | 2218 | Concentration 10mg/mL |
| Ethanol absolute | CHEMSOLUTE | 2273 | |
| Glycerol | Sigma Aldrich (Merck) | G9012 | |
| Glycin | Carl Roth | 0079 | |
| Glycogen | Roche | 10901393001 | Concentration: 20mg/mL |
| Heating block | |||
| HEPES | Sigma Aldrich (Merck) | H4034 | |
| LE Agarose | Biozym | 840000 | |
| Liquid nitrogen cooled mini mortar | Bel-Art | H37260-0100 | |
| MeOH free Formaldehyde 16% | Thermofisher | 28908 | |
| NP-40 | Roche | 11332473001 | |
| PBS 1x | Thermofisher | 10010015 | |
| Pefabloc SC-Protease-Inhibitor | Sigma Aldrich (Merck) | 11429868001 | |
| Phase Lock Gel - Heavy | QuantaBio | 2302830 | |
| Phenol:Chloroform:Isoamyl alcohol 25:24:1 | Sigma Aldrich (Merck) | P3803 | |
| Potassium chloride | Carl Roth | 6781 | |
| Potassium hydroxyde | Merck | 105033 | |
| Proteinase K | Lucigen | MPRK092 | Concentration: 50 µg/µL |
| RNAse A | Lucigen | MRNA092 | Concentration: 5 mg/mL |
| SDS 10% solution | PanReac AppliChem | A3950 | |
| Sodium carbonate anhydrous | Carl Roth | A135 | |
| Sodium chloride | Sigma Aldrich (Merck) | S7653 | |
| Sterile Petri dishes | Sarstedt | 83,39,02,500 | |
| Tris-HCl solution | Sigma Aldrich (Merck) | T2694 | |
| Triton-X100 | Sigma Aldrich (Merck) | X100 |
References
- Waddington, C. H., Pantelouris, E. M. Transplantation of nuclei in newt's eggs. Nature. 172 (4388), 1050-1051 (1953).
- Silmon de Monerri, N. C., Kim, K. Pathogens hijack the epigenome: A new twist on host-pathogen interactions. American Journal of Pathology. 184 (4), 897-911 (2014).
- Knipe, D. M., et al. Snapshots: chromatin control of viral infection. Virology. 435 (1), 141-156 (2013).
- Tropberger, P., et al. Mapping of histone modifications in episomal HBV cccDNA uncovers an unusual chromatin organization amenable to epigenetic manipulation. Proceedings of the National Academy of Sciences of the United States of America. 112 (42), 5715-5724 (2015).
- Sproul, D., Gilbert, N., Bickmore, W. A. The role of chromatin structure in regulating the expression of clustered genes. Nature Reviews Genetics. 6 (10), 775-781 (2005).
- Fischle, W., Wang, Y., Allis, C. D. Histone and chromatin cross-talk. Current Opinion in Cell Biology. 15 (2), 172-183 (2003).
- Ling, X., Harkness, T. A., Schultz, M. C., Fisher-Adams, G., Grunstein, M. Yeast histone H3 and H4 amino termini are important for nucleosome assembly in vivo and in vitro: redundant and position-independent functions in assembly but not in gene regulation. Genes & Development. 10 (6), 686-699 (1996).
- Zhang, L., Eugeni, E. E., Parthun, M. R., Freitas, M. A. Identification of novel histone post-translational modifications by peptide mass fingerprinting. Chromosoma. 112 (2), 77-86 (2003).
- Wang, H., et al. Role of histone H2A ubiquitination in Polycomb silencing. Nature. 431 (7010), 873-878 (2004).
- Hassa, P. O., Haenni, S. S., Elser, M., Hottiger, M. O. Nuclear ADP-ribosylation reactions in mammalian cells: where are we today and where are we going. Microbiology and Molecular Biology Reviews. 70 (3), 789-829 (2006).
- Dey, B., et al. DNA-protein interactions: methods for detection and analysis. Molecular and Cellular Biochemistry. 365 (1-2), 279-299 (2012).
- Hager, G. L., McNally, J. G., Misteli, T. Transcription dynamics. Molecular Cell. 35 (6), 741-753 (2009).
- Nagy, Z., Tora, L. Distinct GCN5/PCAF-containing complexes function as co-activators and are involved in transcription factor and global histone acetylation. Oncogene. 26 (37), 5341-5357 (2007).
- Solomon, M. J., Larsen, P. L., Varshavsky, A. Mapping protein-DNA interactions in vivo with formaldehyde: evidence that histone H4 is retained on a highly transcribed gene. Cell. 53 (6), 937-947 (1988).
- Gunther, T., Theiss, J. M., Fischer, N., Grundhoff, A. Investigation of viral and host chromatin by ChIP-PCR or ChIP-Seq analysis. Current Protocols in Microbiology. 40, 11-21 (2016).
- Cotney, J. L., Noonan, J. P. Chromatin immunoprecipitation with fixed animal tissues and preparation for high-throughput sequencing. Cold Spring Harbor Protocols. 2015 (4), 419(2015).
- Haim, Y., Tarnovscki, T., Bashari, D., Rudich, A. A chromatin immunoprecipitation (ChIP) protocol for use in whole human adipose tissue. American Journal of Physiology-Endocrinology and Metabolism. 305 (9), 1172-1177 (2013).
- Castellano-Castillo, D., et al. Chromatin immunoprecipitation improvements for the processing of small frozen pieces of adipose tissue. PLoS One. 13 (2), 0192314(2018).
- Savic, D., Gertz, J., Jain, P., Cooper, G. M., Myers, R. M. Mapping genome-wide transcription factor binding sites in frozen tissues. Epigenetics Chromatin. 6 (1), 30(2013).
- Perna, A., Alberi, L. A. TF-ChIP method for tissue-specific gene targets. Frontiers Cell Neuroscience. 13, 95(2019).
- Allweiss, L., et al. Proliferation of primary human hepatocytes and prevention of hepatitis B virus reinfection efficiently deplete nuclear cccDNA in vivo. Gut. 67 (3), 542-552 (2018).
- Lerdrup, M., Johansen, J. V., Agrawal-Singh, S., Hansen, K. An interactive environment for agile analysis and visualization of ChIP-sequencing data. Nature Structural & Molecular Biology. 23 (4), 349-357 (2016).
- Perna, A., Alberi, L. A. TF-ChIP Method for Tissue-Specific Gene Targets. Frontiers in Cellular Neuroscience. 13, 95(2019).
- Liang, N., Fan, R., Goni, S., Treuter, E. Preparation of Frozen Liver Tissues for Integrated Omics Analysis. Methods in Molecular Biology. 1951, 167-178 (2019).
- Liu, Z., et al. Proteomic and network analysis of human serum albuminome by integrated use of quick crosslinking and two-step precipitation. Scientific Reports. 7 (1), 9856(2017).
- Singh, A. A., et al. Optimized ChIP-seq method facilitates transcription factor profiling in human tumors. Life Science Alliance. 2 (1), 201800115(2019).
- Aoki, T., et al. Bi-functional cross-linking reagents efficiently capture protein-DNA complexes in Drosophila embryos. Fly. 8 (1), 43-51 (2014).
- Allweiss, L., Dandri, M. Experimental in vitro and in vivo models for the study of human hepatitis B virus infection. Journal of Hepatology. 64, 1 Suppl 17-31 (2016).
- Krishna, M. Microscopic anatomy of the liver. Clinics in Liver Disease. 2, Suppl 1 4-7 (2013).
- Tannapfel, A., et al. Histopathological diagnosis of non-alcoholic and alcoholic fatty liver disease. Virchows Archiv. 458 (5), 511-523 (2011).
- Schuppan, D., Afdhal, N. H. Liver cirrhosis. Lancet. 371 (9615), 838-851 (2008).
- Allweiss, L., et al. Therapeutic shutdown of HBV transcripts promotes reappearance of the SMC5/6 complex and silencing of the viral genome in vivo. Gut. , 322571(2021).
- Gerna, G., Kabanova, A., Lilleri, D. Human cytomegalovirus cell tropism and host cell receptors. Vaccines. 7 (3), (2019).
- Echavarria, M. Adenoviruses in immunocompromised hosts. Clinical Microbiology Reviews. 21 (4), 704-715 (2008).
- Frohlich, J., Grundhoff, A. Epigenetic control in Kaposi sarcoma-associated herpesvirus infection and associated disease. Seminars in Immunopathology. 42 (2), 143-157 (2020).
- Nicoll, M. P., Proenca, J. T., Efstathiou, S. The molecular basis of herpes simplex virus latency. FEMS Microbiology Reviews. 36 (3), 684-705 (2012).
- Thorley-Lawson, D. A., Hawkins, J. B., Tracy, S. I., Shapiro, M. The pathogenesis of Epstein-Barr virus persistent infection. Current Opinion in Virology. 3 (3), 227-232 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved