Method Article
תפילת מיופיבר יחיד לבדיקה להערכת פונקציונליות תאי גזע שריר למבוגרים Ex Vivo
In This Article
Summary
בפרוטוקול זה מתוארת שיטת ניתוח מבחנה וניתוח תפקודי לתאי גזע שריריים, המשמרת את רוב האינטראקציות שלהם עם הנישה האנדוגנית שלהם.
Abstract
רקמת שריר השלד הבוגרת מכילה אוכלוסיית תאי גזע החיונית ליכולתה להתחדש. לאחר נזק לשרירים, תאי גזע שריר לעזוב את מצבם העגום ולהפעיל את התוכנית myogenic בסופו של דבר מוביל לתיקון של רקמה פגומה במקביל לחידוש מאגר תאי גזע השריר. גורמים שונים משפיעים על פעילות תאי הגזע של השריר, ביניהם גירויים מהותיים אך גם איתותים מסביבת תאי הגזע של השריר הישיר, נישה של תאי גזע. הבידוד והתרבות של myofibers יחיד עם תאי גזע השריר הקשורים שלהם משמר את רוב האינטראקציה של תא הגזע עם הנישה שלה, ולכן, האפשרות הקרובה ביותר ללמוד פונקציונליות תאי גזע שריר ex vivo. כאן, פרוטוקול לבידוד, תרבית, transfection siRNA וחיסון של תאי גזע שריר על myofibers בהתאמה שלהם מן העכבר EDL (extensor digitorum longus) השרירים מסופקים. התנאים הניסיוניים המתוארים כאן מאפשרים מחקר ומניפולציה של תאי גזע שריר ex vivo כולל חקירה של פעילות מיוגנית ללא צורך מובנה בניסויים בבעלי חיים vivo.
Introduction
שריר השלד במבוגר הוא רקמה פוסט-מיטוטית המורכבת בעיקר ממיאופייברים רב-גרעיניים, שהם תאי האפקטיביות לתנועות מרצון. יש לו יכולת יוצאת דופן להתחדש, תהליך הדומה מיוגנזה עוברית ועובר ליקויים בגיל ובמחלה1. יכולת רגנרטיבית מרשימה זו של שריר השלד תלויה בתאי גזע שריריים (MuSCs), המכונים גם תאי לוויין בשל מיקומם בין הסרקולמה לבין הלמינה הבזלית של myofibers2,3. בתנאי מנוחה MuSCs הם שבתים ומאופיינים בביטוי של גורם שעתוק Pax7 וסמני השהיה כגון Sprouty14,5,6,7,8. עם ההפעלה, למשל, לאחר פציעה, MuSCs לעזוב את המצב העגום ולהגדיל את גורם הרגולציה myogenic MyoD9. ה- Pax7 / MyoD כפול חיובי MuSCs להתרבות ולהבדיל ובכך לייצר תאי מבשר מיוגניים, אשר מכונים לעתים קרובות גם myoblasts. מיובלסטים אלה מבדילים עוד יותר לתוך מיוציטים מוארכים, תהליך במקביל לשינויים מולקולריים ומורפולוגיים, למשל, אובדן Pax7 ועלייה בביטוי מיוגנין10. מיוציטים בסופו של דבר להתיך זה לזה או myofibers הקיים ובכך לתקן את הרקמה הפגועה. חשוב לציין, חלק קטן מתאי גזע השרירים חוזר לתרומת MyoD ומסוגל לחדש את עצמו11. המצב של בידול MuSC והתקדמות מיוגנית ניתן לראות בקלות על ידי חקירה של סמנים מיוגניים כגון Pax7, MyoD ומיוגנין10.
התרבות של myofibers יחיד עם MuSCs הסמוך שלהם היא שיטה מצוינת לחקור פונקציונליות MuSC בסביבה ex vivo מאז MuSCs נשארים בנישה אנדוגנית שלהם12,13. ההתנהגות של MuSCs מווסתת על ידי אותות מהותיים, כמו גם אותות קיצוניים המסופקים על ידי הנישה, מיקום אנטומי מיוחד הכולל רכיבים של המטריצה החוץ תאית (ECM) המקיפה את MuSCs ואת myofiber עצמו. לדוגמה, אחד הרגולטורים הקיצוניים של מייסת MuSC הוא איתות חריץ." כאן, רמזי איתות מתקבלים על ידי MuSCs הן מן myofiber ואת ECM14,15,16. יתר על כן, נישה MuSC חשוב לשלוט על ציר החלוקה של MuSCs ובכך להסדיר את גורל התא של תאי הבת MuSC17,18. באופן סביר, פרמטרים כמו חטיבות MuSC אסימטריות, התקדמות מיוגנית וחידוש עצמי ניתן להעריך באופן ייחודי במערך ניסיוני זה. לדוגמה, אשכול רב-תאי יכול להיווצר כתוצאה מ- MuSC אחד לאחר תקופת תרבות של 72 שעות, אשר ניתן לחקור על התרחשות ואחוז האוכלוסיות המיוגניות המובהקות כגון חידוש עצמי, התפשטות ומבדלים נוספים MuSCs8,19,20,21. מצב הבידול של MuSCs יכול להיקבע על ידי חקירה של הביטוי / ביטוי משותף של Pax7, MyoD ומיוגנין. לאחר 72 שעות של תרבית התאים באשכול יכולים להיות מופלים על ידי הפרמטרים הבאים: Pax7 רק תאים הם MuSCs חידוש עצמי, בעוד Pax7 / MyoD תאים חיוביים כפולים מתרבים / מופעלים MuSCs ותאים מיוגניים מובחנים עוד יותר הם Myogenin חיובי22. יתר על כן, מספרי MuSC או כניסה מחדש לתוך מחזור התא / הפעלה ניתן לחקור בנוסף התקדמות מיוגנית, למשל, באמצעות ניתוחים מבוססי אימונופלואורסצנטיות המבוססים על הפרמטרים שתוארו לעיל.
כאן, המאפיינים הייחודיים של פרוטוקול הבידוד והתרבות של מיופיבר, למשל, שימור האינטראקציה של MuSC עם הנישה שלו, מתוארים. עכבר שלם EDL (extensor digitorum longus) השרירים נותחו בקפידה, מתעכלים על ידי collagenase, ו triturated פיזית כדי להשיג myofibers יחיד עם MuSCs הקשורים שלהם לתרבות נוספת. יתר על כן, הפרוטוקול מתאר את הצעדים כדי להעביר MuSCs עם siRNA עבור ניתוחים פונקציונליים של גנים מועמדים ניתוחים מבוססי אימונופלואורסצנטיות רצופים ללא צורך בבעלי חיים מהונדסים.
Protocol
הקרבת בעלי חיים חייבת להתבצע בהתאם לתקנות הלאומיות לניסויים בבעלי חיים. הפרוטוקול המתואר כאן בוצע בהתאם להנחיות מכון לייבניץ להזדקנות - מכון פריץ ליפמן והנחיית האיחוד האירופי 2010/63/האיחוד האירופי (מספר רישיון לקצירת איברים: O_JvM_18-20). השלבים החיוניים של הפרוטוקול מסוכמים באיור 1.
1. הכנת לוחות תרבות, מדיה ופיפטות פסטר
הערה: כל החומרים והציוד הדרושים לבידוד ותרבות myofibers יחיד צריך להיות סטרילי ככל האפשר. לכן, מומלץ לבודד מיופיברים בודדים מתחת למכסה המנוע הסטרילי למחצה.
- השתמש HS סטרילי (סרום סוס) כדי לצפות לוחות תרבות רקמות. הציפוי מונע את החיבור של מיופיברים בודדים למשטח הפלסטיק. עבור כל עכבר, נדרשות 4 בארות של צלחת 12 באר לבידוד ומספר ייעודי של בארות של צלחת 24 בארות לפולחן. לדגור את בארות של צלחת 12-באר עם 1 מ"ל ואת בארות של צלחת 24-well עם 0.5 מ"ל של HS במשך 5 דקות ב RT (טמפרטורת החדר), ולאחר מכן להסיר את HS ולתת את הצלחות להתייבש עוד 5 דקות.
הערה: HS ניתן לאסוף ולהשתמש מחדש למטרות ציפוי מספר פעמים, אם נשמר סטרילי. - הכן מדיום בידוד מיופיבר על ידי שכשהם DMEM (המדיום של הנשר המותאם של Dulbecco עם 4.5 גרם / ליטר גלוקוז ונתרן פירובט) עם 20% FBS (סרום בקר עוברי), לסנן דרך מסנן 0.22 מיקרומטר. הוסיפו בינוני ללוחות הבידוד מצופים מראש (צלחת 12-well, 2-4 מ"ל בידוד בינוני לבאר) כ 30 דקות לפני הבידוד ושווי משקל בחממה לחה 37 °C עם 5% CO2.
- הכן את רמת מיופיבר בינונית על ידי שכשהם DMEM (המדיום של הנשר המותאם של Dulbecco עם גלוקוז 4.5 גרם / ליטר ונתרן פירובט) עם 20% FBS (סרום בקר עוברי) ותמצית עובר עוף 1%, מסנן דרך מסנן 0.22 מיקרומטר. הוסיפו 0.5 מ"ל בינוני לכל באר של לוחות התרבות המצולים מראש (צלחת 24-well) כ -30 דקות לפני הבידוד ושווים באינקובטור לח של 37 מעלות צלזיוס עם 5% CO2.
- הכן פתרון עיכול קולגנאז על ידי המסת 0.2% (w/v) קולגנאז מסוג 1 (מקלוסטרידיום היסטוליטוטיום) ב- DMEM (המדיום של הנשר המותאם של Dulbecco עם 4.5 גרם / ליטר גלוקוז ונתרן פירובט), מסנן דרך מסנן 0.22 מיקרומטר. עבור שני שרירי EDL(extensor digitorum longus)משתמשים בתמיסת קולגנאז 2.5 מ"ל בצינור תגובה סטרילי של 15 מ"ל. בנוסף, מחממים מראש את הפתרון ~ 10 דקות באמבט מים במחזור ב 37 °C (50 °F) לפני תחילת הבידוד.
- הכן פיפטות פסטר סטריליות לטריטורציה של השרירים מתעכלי הקולגנאז. השתמש בעט יהלום כדי לחתוך את פיפטות פסטר.
- לכל עכבר, יש להשתמש בצינור משעמם אחד גדול עם פתיחה של כ-0.3 ס"מ ואורך של כ-10-12 ס"מ ופיפטת זכוכית שנייה עם פתח קטן של כ-0.1 ס"מ ואורך של כ-22 ס"מ (איור 2F).
- להחליק את הקצוות של שני פיפטות על ידי ליטוש חום עם הלהבה של מבער Bunsen. החזק את קצה הפיפטה במשך 5-10 s לתוך הלהבה בתנועה עדינה כדי לאפשר חלוקת חום שווה עד קצוות הזכוכית החדים להחליק.
- מיד לפני השימוש, מצפים את שני סוגי פיפטות הזכוכית ב- HS סטרילי על ידי מילוי כל הפיפטה עם ~ 2 מ"ל של HS במשך 5 דקות, לאחר מכן, להוציא את HS ולתת את pipettes יבש במשך 5 דקות ב RT.
2. בידוד שרירי EDL ועיכול קולגנאז
- לרסס את כל הציוד עם 70% אתנול כדי למנוע זיהום.
- להקריב את העכבר בהתאם לתקנות הלאומיות לניסויים בבעלי חיים.
- לרסס את אחורי העכבר עם 70% אתנול. השתמש במספריים מעוקלים דקים מוקשים (24 מ"מ חוד החנית) ובמלקחיים עדינים (דומונט 7, מעוקל או ישר) כדי להסיר את העור ולחשוף את השרירים הבסיסיים. הימנע מכל מגע של השרירים הבסיסיים עם פרווה (מגביר את הסיכון לזיהום).
- הסירו את הפאסיה שמסביב עם מלקחיים מעוקלים עדינים מבלי לפגוע בשרירים הבסיסיים(איור 2A). סגור את המלקחיים כדי למנוע כיפוף.
- השתמש במלקחיים מעוקלים כדי לחשוף את הגידים הדיסטליים של ת"א (tibialis anterior) ושריר EDL. כדי להסיר את ת"א, לתפוס את גיד TA דיסטלי עם מלקחיים לחתוך עם מספריים קפיציים Vannas בסדר (5 מ"מ חוד החנית, קוטר קצה 0.35 מ"מ). בזמן שאתם מחזיקים את הת"א על הגיד, מושכים אותה לכיוון הברך וחותכים את השריר קרוב לברך(איור 2B),שריר ה-EDL חשוף כעת.
הערה: ודא שרק גיד ת"א נתפס בשלב זה, אחרת ה- EDL הבסיסי עלול להיפגע. כאשר חותכים את שריר ת"א לוודא כי הגידים בברך ניתן לראות בקלות לאחר מכן. - הרימו את גיד ה-EDL הדיסטלי עם מלקחיים מעוקלים עדינים וחתכו עם מספריים משובחים של ואנס(איור 2C). לחשוף את גיד EDL הפרוקסימלי על ידי משיכה בזהירות EDL לכיוון הברך. חותכים את הגיד הפרוקסימלי עם מספריים קפיציים משובחים של ואנס. העבר את שריר EDL ל 37 °C מחומם מראש 2.5 מ"ל של פתרון העיכול קולגנאז בצינור התגובה 15 מ"ל בשלב 1.4. (איור 2D).
הערה: לבצע חתירה קטנה ברקמת החיבור לברך החיצונית כדי לחשוף באופן מלא את גיד ה- EDL הפרוקסימלי. הקפד רק לתפוס את הגידים ולא למתוח את EDL יותר מדי. - חזור על שלבים 2.3. ל-2.6. עם EDL השני. הוסיפו את שני שרירי ה-EDL לאותו צינור תגובה של 15 מ"ל מלא בתמיסת עיכול קולגנאז 2.5 מ"ל.
- לדגור על שרירי EDL בצינור התגובה ב 37 °C (50 °F) באמבט מים במחזור.
הערה: זמן הדגירה תלוי במספר גורמים, כגון פעילות קולגנאז, גיל העכבר וכמות הרקמה הסיבוטית. זמן הדגירה הטיפוסי לשרירי EDL של עכברים בוגרים (גיל 2-6 חודשים) הוא 1-1.5 שעות לעכברים זקנים (18 חודשים) 1.5-2 שעות. - כדי למנוע עיכול מוגזם של השרירים, לבדוק את השרירים במהלך זמן העיכול. עצרו את העיכול כשהשרירים מתרופפים ומופיברים בודדים נראים לעין(איור 2E). העבירו את השרירים בזהירות עם פיפטה גדולה לבאר הראשונה של צלחת 12 בארות עם 12 בארות עם מדיום בידוד מיופיבר(איור 2G).
3. דיסוציאציה ותרבות מיופיבר
- עבור השלבים הבאים להשתמש במיקרוסקופ משקפת סטריאו, מצויד באופן מועדף עם צלחת חימום (37 °C (37 °F). השתמש פיפטה משעמם גדול כדי לשטוף את השרירים עם מדיום בידוד חם עד myofibers יחיד משתחררים. לנתק את השרירים עם פיפטה נשא גדול עד המספר הרצוי של myofibers צף בחופשיות בפתרון.
הערה: הימנע טריטורציה מוגזמת כדי להפחית את הסיכון של myofibers פגום. באמצעות צלחת חימום עבור דיסוציאציה myofiber מומלץ מאוד מאז הטמפרטורה יורדת במהלך תהליך הבידוד, אשר יגרום למוות myofiber. - העבר myofibers ללא חוזה(איור 2H)עם HS מצופה פיפטה זכוכית משעמם קטן אל השני מלא מדיום בידוד לשטוף פסולת ו כווי (פגום) myofibers(איור 2I).
הערה: כדי למנוע תנועה מופרזת של myofibers מבודד, הם יכולים להיות מועברים לבאר השנייה ולאחר מכן ניתן להמשיך את תהליך trituration. - העבר myofibers שאינם נדבקו הבא (3rd)מלא היטב עם בידוד בינוני לשטוף שוב.
- השתמש פיפטה זכוכית קטן נשא, מצופה HS, כדי להעביר כ 50-100 myofibers שאינם מכווצים ללוח 24 באר המכיל מדיום תרבות myofiber.
- דגירה myofibers ב 37 °C (5 °F), 5% CO2 לזמן ייעודי (96 שעות מקסימום מומלץ).
הערה: MuSCs לחלק פעם אחת גם מישור או apical-בזאלי לאחר 42 שעות של תרבות. בנוסף, לאחר 72 שעות של תרבות MuSCs ליצור אשכולות רב תאיים המורכבים חידוש עצמי, התפשטות או מחויב (מובחן) MuSCs.
4. תעתיק של siRNA
- 4 שעות לאחר בידוד myofiber, להעביר מיופיבר הקשורים MuSCs (50-100 myofibers לא נדבק בבאר אחת של צלחת 24-well מלא 500 μL תרבות מדיום) עם ריאגנט transfection מבוסס שומנים בדם, למשל RNAiMAX על פי פרוטוקול היצרן עם ריכוז סופי של 5 pmol siRNA. לכן, להוסיף 25 μL של Opti-MEM עם הנפח המתאים של siRNA ל 25 μL Opti-MEM המכיל 1.5 μL של ריאגנט transfection. לדגור על תערובת התגובה במשך 5 דקות ולהוסיף אותו אז 500 μL של מדיום תרבות.
הערה: תעתיק שני לאחר 24 שעות או 48 שעות מומלץ לתקופות תרבות ארוכות יותר, למשל, יותר מ 48 שעות. אין צורך בשינוי של מדיום לאחר ההדבקה.
5. קיבעון וכתמים IF
- לחיסון השתמש במיקרוסקופ משקפת סטריאו. כל אמצעי האחסון בשלבים הבאים מותאמים לבאר אחת של צלחת 24-well. בצע את כל השלבים הבאים באמצעות פיפטה קטנה מצופה HS.
- בזהירות להשליך את מדיום תרבות myofiber תוך השארת פתרון כלשהו בבאר (כ 100 μL לכל 24-טוב). עשה זאת עבור כל הצעדים הנוספים אלא אם צוין אחרת כדי לאפשר צף של myofibers. הוסף 500 μL של 2% PFA כדי לתקן את myofibers עם MuSCs הסמוכים שלהם, דגירה במשך 5 דקות בטמפרטורת החדר (RT).
- הסר את supernatant בזהירות לשטוף את myofibers שלוש פעמים עם PBS (pH 7.4, 500 μL במשך 5 דקות ב RT כל אחד).
- הוסף פתרון 500 μL permeabilization (0.1% טריטון X-100, 0.1 M גליצין ב- PBS, pH 7.4), דגירה במשך 10 דקות ב RT.
- הסר את פתרון permeabilization ולהוסיף פתרון חסימת 500 μL (5% HS ב PBS, pH 7.4) עבור 1 שעה ב RT.
הערה: בדוק את פתרון החסימה המומלץ עבור נוגדנים ראשיים כדי למנוע כריכה לא מוגדרת. - הסר את פתרון החסימה והוסף 300 μL של דילול נוגדנים ראשוני (למשל, אנטי-Pax7 (PAX7, DSHB, לא מדולל), אנטי MyoD (שיבוט G-1, סנטה קרוז, 1:200)) לבאר. דגירה ב 4 °C (5 °F) לילה.
- לשטוף שלוש פעמים עם 500 μL של PBS לבאר (5 דקות ב RT).
- הסר PBS ולהוסיף 300 μL של דילול נוגדנים משני (למשל, אנטי עכבר-IgG1-546 ונגד עכבר-IgG2b-488 1:1000) לבאר. דגירה 1 שעה ב RT מוגן מפני אור. עבור השלבים הבאים, מומלץ להפחית את התנאים הקלים.
- לשטוף פעמיים עם 500 μL של PBS לבאר (5 דקות ב RT).
- בצע כתמי DAPI באמצעות 500 μL של הפתרון לבאר (ריכוז DAPI הסופי 10 מיקרוגרם / מ"ל) במשך 5 דקות ב RT.
- לשטוף פעמיים עם 500 μL של PBS לבאר (5 דקות ב RT).
- השתמש בעט הידרופובי כדי לצייר עיגול על מגלשת זכוכית מיקרוסקופית כדי ליצור מחסום דוחה מים שימנע שפיכת נוזל המכיל myofibers. העבר את myofibers בנפח הקטן ביותר האפשרי למגלשת זכוכית מיקרוסקופית ולפזר אותם על שקופית הזכוכית.
הערה: הימנע משיכה פיזית של myofibers מעל שקופית זכוכית מיקרוסקופית מאז זה עלול לגרום חיכוך וכתוצאה מכך ניתוק של אשכולות מן myofibers. - הסר את הנוזל שיורית עם פיפטה פסטר קטן-נשא או 200 μL pipette.
- השתמש בשתי טיפות של מדיום הרכבה מימית לכסות את myofibers עם כיסוי. תן לשקופיות להתייבש לזמן המומלץ על-ידי היצרן. אחסנו את השקופיות ב-4 מעלות צלזיוס בחושך.
תוצאות
פרוטוקול זה מספק הוראות לגזור ותרבות מוצלחות של מיופיברים בודדים עם ה- MuSCs הקשורים שלהם משרירי EDL מורינים. השלבים החיוניים של הפרוטוקול מסוכמים באיור 1. ניתוח זהיר של שרירי ה-EDL(איור 2A-C)הוא קריטי לתשואה גבוהה של מיופיברים בני קיימא. ניתוק שרירים מושג תחילה על ידי עיכול קולגנאז(איור 2D)ואחריו טריטורציה פיזית (איור 2G). מיופיברים שלמים(איור 2H)הם מתורבתים, ואילו יש להוציא את מיופיברים היפרקונטי ומתים(איור 2I)מהתרבות והניתוח.
MuSCs להישאר מיופיבר הקשורים במהלך תהליך הבידוד. כתמי אימונופלואורסצנטיות עבור גורם התמלול Pax7 מזהה ומבדיל 7-9 גרעיני MuSC משפע המיונולי למיופיבר כאשר הם קבועים ישירות לאחר השלמת תהליך הבידוד (איור 3A). איור 3B מציג אזור מוגדל מאיור 3A עם ערוץ Brightfield הנוסף, החושף את המבנה התת-תאי של המיאו-סיביוב ומדגים אות אימונופלואורסצנטיות Pax7 בגרעין של MuSC.
הפעלה והתקדמות מיוגנית של MuSCs הקשורים myofiber ניתן לנתח על ידי ביטוי סמן מיוגני. ניתן למצוא את ה-MuSCs המבודדים (0 שעות), המאופיינים בעיקר בביטוי Pax7 ובהיעדר ביטוי MyoD, ובכך הדומים למצב הומיאוסטטי של In vivo (איור 4, 0 שעות). בשל הליך הניתוח/ניתוק והרכב המדיה של תרבות המיופיבר, ה-MuSCs מפעילים במהירות ומגדילים במהירות את גורם התמלול MyoD כדי להקל על ההתפשטות כפי שניתן לראות ב-42 שעות, כאשר MuSCs עברו את החלוקה הראשונה שלהם (איור 4, 42 שעות). לאחר 72 שעות של תרבות, MuSCs יוצרים אשכולות של צאצאים עם גורלות מיוגניים שונים המקבילים לדפוסי הביטוי של סמנים מיוגניים שונים(איור 4, 72 שעות). Pax7+ רק תאים מתנגדים לבידול והופכים לתאי גזע המתחדשים בעצמם. Pax7+ ו- MyoD+ תאים חיוביים כפולים הם נפוצים, ואילו MyoD + רק תאים התקדמו עוד יותר לאורך שושלת מיוגניים ויבדלו.
מערכת התרבות myofiber מאפשרת התערבות יעילה של פעילות MuSC על ידי התערבויות שונות, אשר אחת מהן היא transfection siRNA כמתואר בפירוט בפרוטוקול זה. כדי לפקח על יעילות ההדבקה של מיופיבר הקשורים MuSCs siRNA שאינו מיקוד באופן פלואורסצנטרי הודבק. Pax7 חיובי MuSCs צבר siRNA ציטופלסמי בצורה דמוית גרגר, המציין ספיגה יעילה (איור 5A). לא נצפו גרגירים פלואורסצנטיים בציטופלסמה של myofibers המצביע על מחסום ספיגה טבעי myofibers ב 4 שעות לאחר הבידוד וכי transfection siRNA במיוחד מטרות MuSCs. כימות של תאי Pax7+ שהודבקו באופן חיובי לכל מיופיבר גילה כי יותר ממחצית מכל ה- MuSCs לקחו כמויות גלויות של siRNA פלואורסצנטי ממש לפני השלמת הסיבוב הראשון של החלוקה ב 24 שעות. מספר תאי Pax7+ שהודבקו עלה עוד יותר עד 74% לאחר 30 שעות(איור 5B). יתר על כן, לא היה הבדל במספר תאי Pax7+ למיופיבר של תנאים שהודבקו או לא הודבקו בשתי נקודות הזמן, מה שמדגים שאין השפעות שליליות על מספרי תאי הגזע עקב הליך ההדבקה(איור 5C).
לסיכום, הפרוטוקול מספק תיאור מפורט של הבידוד והתרבות של מיופיברים בודדים EDL עם תאי גזע השריר הסמוכים שלהם. זה מאפשר לחקור את פעילות תאי גזע שריר הקשורים myofiber ex vivo, למשל, על ידי ניתוחים מבוססי אימונופלואורסצנטיות. מניפולציה של תאי גזע שריר על ידי transfection siRNA יעילה ומספקת בסיס מתודולוגי עבור ניתוחים פונקציונליים.
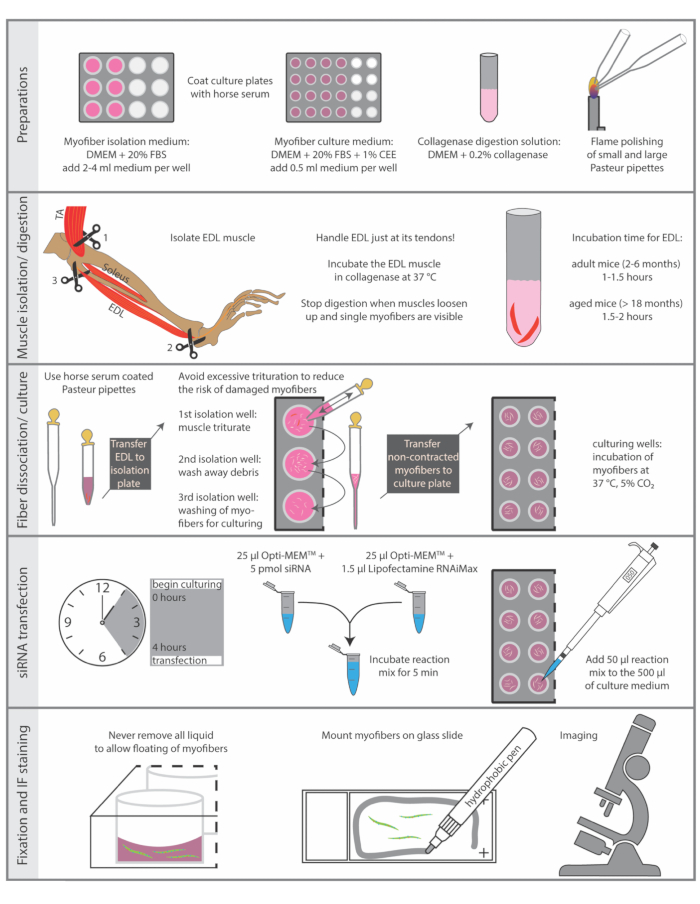
איור 1: סיכום סכמטי של שלבים חיוניים. הצעדים החיוניים של הליך הבידוד והחיסון מסוכמים בנתון זה. קיצורים: DMEM, המדיום של הנשר המותאם של דולבק; FBS, סרום בקר עוברי; CEE, תמצית עובר עוף; ת"א, טיביאליס קהורית; EDL, extensor digitorum longus אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
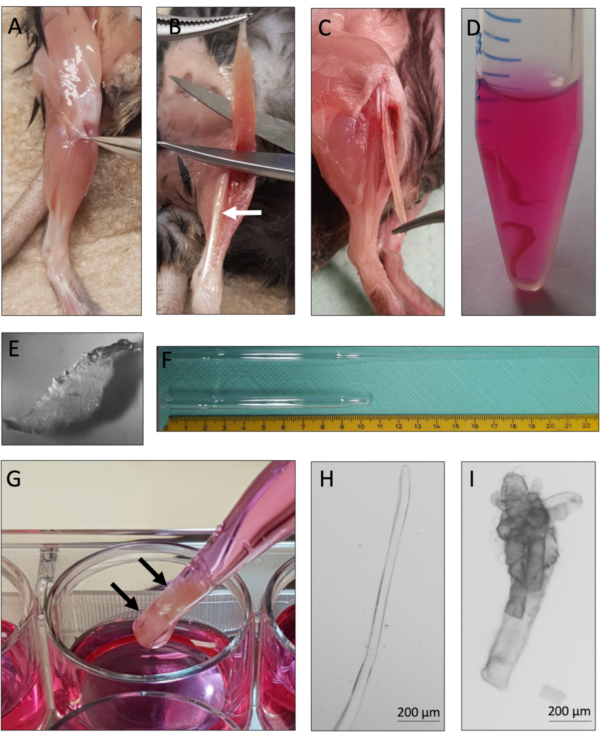
איור 2: ניתוח עכבר EDL ובידוד מיופיבר יחיד. (א)עורו של העכבר האחורי מוסר והשריר המקיף את הפאסיה נשלף כדי לחשוף את שריר ת"א (tibialis anterior). (B)שריר ת"א מוסר כדי לחשוף את שריר EDL (extensor digitorum longus), מסומן על ידי החץ הלבן. (C)שריר ה- EDL נותח על ידי חיתוך הגידים שלו. (D)שני שרירי EDL מתעכלים קולגנאז. (E)מראה של שריר מעוכל קולגנאז עם מיופיברים בודדים גלויים המשתחררים core הרקמה. (ו)פיפטת פסטר גדולה וקטנה עם קנה מידה. (G)שרירי EDL (מסומן על ידי חצים שחורים) הם triturated פיזית באמצעות פיפטה פסטר משעמם גדול. (ח)מיופיברים בודדים שלמים הם דקים ומבריקים וניתן לאסוף אותם בנפרד לתרבות וניתוח. (אני)myofibers hypercontracted ומת אינם מתאימים לתרבות וניתוח. התמונות המיקרוסקופיות של 2H ו-2I צולמו במיקרוסקופ באמצעות מטרה N-Achroplan 5x. סרגלי קנה המידה הם 200 מיקרומטר. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
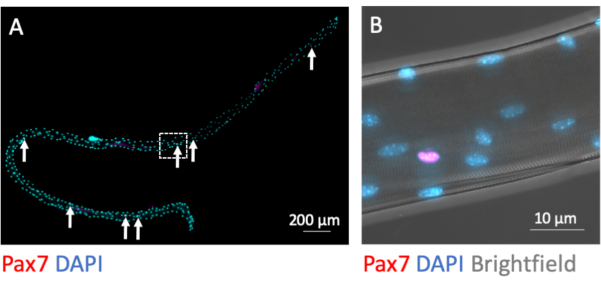
איור 3: תמונה מיקרוסקופית של מיופיבר יחיד שלם עם ה-MuSCs הקשורים אליו. מיופיברים בודדים מ- EDL של עכברי C57BL / 6 צעירים הוכנו ו- PFA קבוע לאחר הבידוד (0 שעות). (A)מכתים אימונופלואורסצנטיות של PAX7 ו- DAPI מזהה תאי גזע שריריים הקשורים למיופיבר (MuSCs, המסומנים בחצים). התמונה המיקרוסקופית צולמה באמצעות האריחים ופונקציית z-stack של מיקרוסקופ המצויד במטרה שמן 40x Plan-Apochromat. סרגל קנה המידה הוא 200 מיקרומטר. (B) הגדלה מ- (A) המציגה את המיונולי, גרעין חיובי אחד של Pax7 ואת התבנית הכהה הבהירה ממבנים מיופיברילריים בבהירפילד. סרגל קנה המידה הוא 10 מיקרומטר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
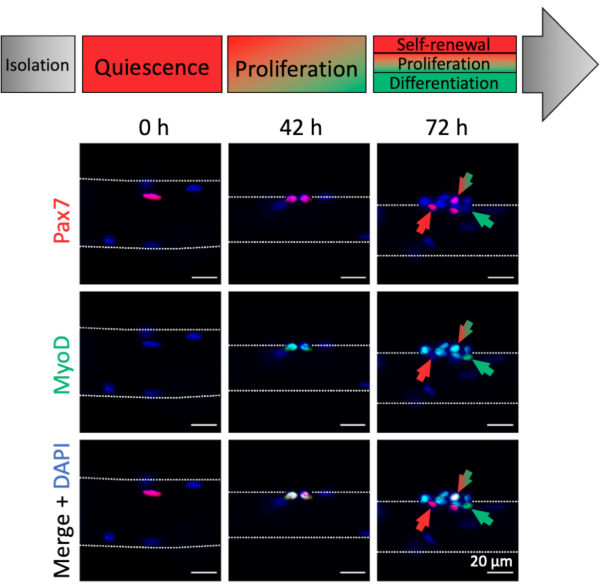
איור 4: תמונות אימונופלואורסצנטיות של הפעלת MuSC והתקדמות מיוגנית במהלך תרבות מיופיבר יחיד. תאי גזע שריריים (MuSCs) של myofibers מבודד טרי (0 h) מייצגים מצב הומיאוסטטי קרוב ל- in vivo quiescence, המאופיין בביטוי של Pax7 וחוסר ביטוי MyoD. במהלך תרבות מיופיבר יחיד רוב MuSCs upregulate MyoD ולהיכנס מחדש למחזור התא כדי להפריד ולהתרבות (42 שעות). לאחר 72 שעות של תרבות ניתן להפלות את גורל ה- MuSC על סמך ביטוי סימון מיוגני. תאים עם ביטוי Pax7 בלבד יתחדשו באופן עצמי (חץ אדום) ואילו Pax7 ו- MyoD תאים חיוביים כפולים (חץ אדום / ירוק) ימשיכו להתרבות. MyoD רק תאים חיוביים (חץ ירוק) התחייבו לבידול מיוגני. תמונות מיקרוסקופיות צולמו באמצעות מיקרוסקופ עם מטרה Plan-Apochromat 20x (0 שעות, 42 שעות) או תוכנית LD-Neofluar 40x (72 שעות). סרגלי קנה מידה הם 20 מיקרומטר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
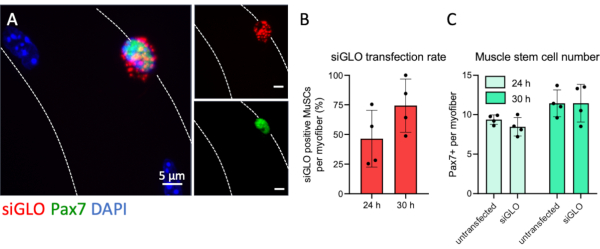
איור 5: טרנספקטציה פלואורסצנטית של מיו-אס-סי וניתוח ספיגה. מיופיברים בודדים של EDL הוכנו והודבקו ב- siRNA (siGLO) עם תווית פלואורסצנטית בעקבות השלבים שסופקו על ידי פרוטוקול זה. (A)הצטברות ציטופלסמטית של גרגירי siGLO במיוחד בתא גזע שריר חיובי Pax7 (MuSC) על מיופיבר יחיד ב 30 שעות של תרבות. התמונה המיקרוסקופית צולמה באמצעות z-stack ופונקציית אפופוטום של מיקרוסקופ עם יעד שמן Plan-Apochromat 100x. מוטות קנה מידה הם 5 מיקרומטר. (B)כימות ספיגת siRNA על ידי תאי גזע שריר חיוביים Pax7 ב 24 או 30 שעות של תרבות. (C)מספר התאים החיוביים של Pax7 לכל מיופיבר יחיד המשווה בין תנאים שאינם נגועים ומחלות מותחות ב ־ 24 או 30 שעות של תרבות. הנתונים מוצגים כממוצע עם סטיית תקן של n = 4 עכברים. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Discussion
כאן מוצגת שיטה לחקור פונקציונלית את תפקידו של גן מסוים ב- MuSCs באמצעות גישה במבחנה. חשוב לציין, במערכת המתוארת כאן MuSCs הם תרבותיים בתנאים, הדומים למצב in vivo ככל האפשר שמירה על רוב האינטראקציות של MuSCs עם הנישה שלהם. זה מושג על ידי פולחן myofibers מבודד עם MuSCs הסמוכים שלהם בתנאים צפים ו transfection siRNA ברציפות. הנהלים של בידוד מיופיבר, התפשטות siRNA וחקירה של אוכלוסיות MuSC במהלך 72 שעות של תרבות באמצעות ניתוחים אימונופלואורסצנטיים מתוארים. יתר על כן, הוכח כי כ -74% מכלל MuSCs הועברו עם siRNA שליטה פלואורסצנטרי לאחר 30 שעות של תרבות.
תשומת לב מיוחדת צריכה להיות ממוקדת על ניתוח זהיר של שריר EDL מאז מתיחה נרחבת, צביטה, או סחיטה יוביל התכווצות ומוות רצופה של myofibers. יתר על כן, חשוב לחקור אשכולות של MuSCs מלפחות 20 myofibers שונים לכל שכפול לכל תנאי. זה הכרחי מאז מספרי MuSC ומאפיינים משתנים בשל קיומו של MuSC תת אוכלוסין. בעת חקירת ההשפעה של siRNA ספציפי על MuSCs באמצעות שיטת התרבות myofiber צף השוואה של המצב עם siRNA מיקוד לבקרת אי-פילוח צריך להתבצע בתוך אותו עכבר ושריר. מומלץ להימנע מהבדלים ספציפיים לעכבר שעשויים לכסות או להגביר את ההשפעות של ה- siRNA. יעילות הנוקאאוט יכולה להיקבע על ידי ניתוחים חיסוניים עם נוגדנים המכוונים נגד גן המטרה באמצעות מיופיברים בודדים עם ה- MuSCs הסמוכים שלהם. אם זו לא אפשרות, ניתן לבדוק את יעילות ההשבתה של siRNA במימובלסטים ראשוניים ואחריו ניתוחים כמותיים של RT-PCR או אימונובלוט. יש לקבוע את היעילות של ה-siRNA לפני ניתוח ההשפעה של ה-siRNA על MuSCs על מיופיברים בודדים. השימוש במאגר חכם המורכב מ-4 siRNAs שונים לעומת מאגר יחיד מגביר את יעילות הנוקאאוט אך גם מגביר את הסיכון לפילוח לא מפורש. יש להשתמש ב- siRNA שאינו מיקוד כפקד. כדי לפקח ישירות על יעילות ההדבקה, ניתן להשתמש בסירנתן שאינה מכוונת באופן פלואורסצנטי כפי שבוצע כאן. נקודת הזמן לתעבורה עם siRNA היא כ -4 שעות לאחר הבידוד, נקודת זמן שבה לאמינה בזאלית המקיפה את ה- MuSCs כבר חדירה לסירנ"א. אם יש לחקור את ההשפעה של siRNA ספציפי על MuSCs לאחר 72 או 96 שעות, מומלץ לבצע טרנספקטציה siRNA שנייה לאחר 24 שעות או 48 שעות כדי לשמור על יעילות נוקאאוט גבוהה.
בדיקת תרבות myofiber מציג יתרונות מגוונים לעומת החקירה של MuSCs עם שיטות תרבות תאים קונבנציונליות. MuSCs להישאר מחובר myofibers במהלך כל תהליך הבידוד, ובכך לשמר את האינטראקציה המכריעה של MuSC עם הנישה שלה19,23,24,25. האינטראקציה המשומרת של MuSCs עם myofiber הוא תנאי מוקדם לחקר השפעות תלויות נישה על פונקציונליות MuSC, אשר לא ניתן לשחזר בתרבויות מיובלסט דו-ממדי קונבנציונאלי. לדוגמה, במהלך הזדקנות MuSCs להציג פגיעה קיבולת מיוגנית וכתוצאה מכך יעילות מופחתת כדי לחדש רקמת שריר לאחר נזק20,26. ליקוי זה מיוחס לפחות חלקית לשינויים בנישה MuSC, בפרט שינויים בהרכב ECM27,28. פרוטוקול תרבות מיופיבר מאפשר את המחקר והפרעה לשינויי נישה חריגים אלה.
בניגוד לשיטה המתוארת כאן, טיהור של MuSCs על ידי טכניקות אימונולאבליזציה ומיון כמו FACS (מיון תאים מופעל פלואורסצנטיות) או MACS (מיון תאים מגנטיים) כרוך בהסרת MuSCs מהנישה שלהם. מעניין, תרבויות 2D של MuSCs מבודדים משרירים מיושנים מאבדים את הרמזים הקיצוניים שלהם ומתנהגים בדומה ל- MuSCs מבודדים משרירים צעירים ובכך לא לשחזר את מצב in vivo כראוי29. יתר על כן, ניתוק מלא של רקמת השריר ותיוג של MuSCs עם סמני פני השטח גורמים לשינויים transcriptomic והפעלה של התאים30,31,32. יתרון נוסף של מערכת התרבות myofiber הוא האפשרות להפריע פונקציונליות MuSC ברמות שונות. מניפולציה של MuSCs על myofibers תרבותי יכול להיות מושגת ביעילות על ידי נוק-אאוט גנים בתיווך siRNA כפי שתואר כאן בפירוט. כמו כן, היישום של תרכובות כימיות או משלוח של חלבונים רקומביננטיים יעיל מאוד להפריע למסלולי תאי גזע20,28. יתר על כן, וקטורים לביטוי רטרו או lentiviral לאפשר את כניסתם של גנים אקסוגניים, כלומר, מוטציות פעילות המרכיבות33. בנוסף, ניתן לחקור את ההשפעה של גורמים קיצוניים על פונקציונליות MuSC במערכת המתוארת כאן, למשל, ניתן להשלים את תנאי התרבות עם supernatant ממקורות פיזיולוגיים או פתולוגיים שונים למודל מצבים שונים כמו cachexia סרטן34,35.
מגבלה אחת של השיטה המתוארת כאן היא העובדה, כי מערכת התרבות myofiber יחיד לא יכול לשחזר לחלוטין את ההשפעה של כל הגורמים המערכתיים או השפעה של סוגי תאים אחרים על MuSCs. כמו כן, הזמן שבו myofibers ניתן לשמור קיימא בתרבות מוגבל ולכן המחקר של תהליכים הקשורים MuSC מתמקד באירועים מוקדמים כמו הפעלה ומחויבות מיוגנית. יתר על כן, החקירה של אינטראקציית MuSC עם תאים נישה אחרים כגון תאי מערכת החיסון או תאי אבות פיברו-אדיפוגניים אינה אפשרית. כדי לחקור השפעות מערכתיות על פונקציונליות MuSC ניתן לבצע ניסויים בפציעות שרירים ואחריו ניתוח של התחדשות שרירים ב vivo או לבצע ניסויי השתלה36,37.
יחד, פרוטוקול הבידוד והתרבות של מיופיבר מספק הזדמנות נהדרת למחקרים גנטיים או מכניים על MuSCs למבוגרים ללא דרישה של מודלים עכבר מהונדסים ויכול להפחית ניסויים בבעלי חיים.
Disclosures
המחברים מצהירים שאין אינטרסים כלכליים מתחרים.
Acknowledgements
אנו מודים לכריסטין פוזר וכריסטינה פיקר על סיוע טכני מצוין וקריאה ביקורתית של כתב היד. עבודה זו נתמכה על ידי מענק מדויטשה פורשונגסגמיינסכאפט ל- JvM (MA-3975/2-1), קרן קרל זייס ודויטשה קרבשילף (DKH-JvM-861005).
Materials
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 488 goat anti-rabbit IgG 2b | ThermoScientific | A-21141 | use 1:1000 for IF |
| Alexa Fluor 546 goat anti-mouse IgG1 | ThermoScientific | A-21123 | use 1:1000 for IF |
| chicken embryo extract | Seralab | CE-650-J | chicken embryo extract containing growth factors etc. |
| collagenase type 1 | Sigma | C0130 | |
| DMEM (Dulbecco’s modified Eagle’s medium with 4.5 g/l glucose and sodium pyruvate) | GibCo | 41966029 | cell culture medium |
| fetal bovine serum | Gibco | 10270-106 | fetal bovine serum |
| horse serum | Gibco | 26050-088 | |
| Lipofectamine RNAiMax | ThermoScientific | 13778150 | transfection reagent |
| MyoD antibody clone G-1 | Santa Cruz | sc-377460 | dilute 1:200 for IF |
| Pax7 antibody | DSHB | PAX7 | use undiluted |
| siGLO Red Transfection Indicator | horizon discovery | D-001630-02-05 | non targeting siRNA |
References
- Henze, H., Jung, M. J., Ahrens, H. E., Steiner, S., von Maltzahn, J. Skeletal muscle aging - Stem cells in the spotlight. Mechanisms of Ageing and Development. 189, 111283 (2020).
- Chang, N. C., Rudnicki, M. A. Satellite cells: the architects of skeletal muscle. Current Topics in Developmental Biology. 107, 161-181 (2014).
- Mauro, A. Satellite cell of skeletal muscle fibers. Journal of Biophysics and Biochemical Cytolology. 9, 493-495 (1961).
- Lepper, C., Partridge, T. A., Fan, C. M. An absolute requirement for Pax7-positive satellite cells in acute injury-induced skeletal muscle regeneration. Development. 138 (17), 3639-3646 (2011).
- Murphy, M. M., Lawson, J. A., Mathew, S. J., Hutcheson, D. A., Kardon, G. Satellite cells, connective tissue fibroblasts and their interactions are crucial for muscle regeneration. Development. 138 (17), 3625-3637 (2011).
- Sambasivan, R., et al. Pax7-expressing satellite cells are indispensable for adult skeletal muscle regeneration. Development. 138 (17), 3647-3656 (2011).
- Seale, P., et al. Pax7 is required for the specification of myogenic satellite cells. Cell. 102 (6), 777-786 (2000).
- Shea, K. L., et al. Sprouty1 regulates reversible quiescence of a self-renewing adult muscle stem cell pool during regeneration. Cell Stem Cell. 6 (2), 117-129 (2010).
- Chal, J., Pourquie, O. Making muscle: skeletal myogenesis in vivo and in vitro. Development. 144 (12), 2104-2122 (2017).
- Schmidt, M., Schuler, S. C., Huttner, S. S., von Eyss, B., von Maltzahn, J. Adult stem cells at work: regenerating skeletal muscle. Cellular and Molecular Life Sciences. 76 (13), 2559-2570 (2019).
- Motohashi, N., Asakura, A. Muscle satellite cell heterogeneity and self-renewal. Frontiers in Cell and Developmental Biology. 2, 1 (2014).
- Huttner, S. S., et al. Isolation and culture of individual myofibers and their adjacent muscle stem cells from aged and adult skeletal muscle. Methods in Molecular Biology. 2045, 25-36 (2019).
- Pasut, A., Jones, A. E., Rudnicki, M. A. Isolation and culture of individual myofibers and their satellite cells from adult skeletal muscle. Journal of Visualized Experiments. (73), e50074 (2013).
- Baghdadi, M. B., et al. Reciprocal signalling by Notch-Collagen V-CALCR retains muscle stem cells in their niche. Nature. 557 (7707), 714-718 (2018).
- Mourikis, P., et al. A critical requirement for notch signaling in maintenance of the quiescent skeletal muscle stem cell state. Stem Cells. 30 (2), 243-252 (2012).
- Pisconti, A., Cornelison, D. D., Olguin, H. C., Antwine, T. L., Olwin, B. B. Syndecan-3 and Notch cooperate in regulating adult myogenesis. Journal of Cell Biology. 190 (3), 427-441 (2010).
- Kuang, S., Kuroda, K., Le Grand, F., Rudnicki, M. A. Asymmetric self-renewal and commitment of satellite stem cells in muscle. Cell. 129 (5), 999-1010 (2007).
- Troy, A., et al. Coordination of satellite cell activation and self-renewal by Par-complex-dependent asymmetric activation of p38alpha/beta MAPK. Cell Stem Cell. 11 (4), 541-553 (2012).
- Chakkalakal, J. V., Jones, K. M., Basson, M. A., Brack, A. S. The aged niche disrupts muscle stem cell quiescence. Nature. 490 (7420), 355-360 (2012).
- Price, F. D., et al. Inhibition of JAK-STAT signaling stimulates adult satellite cell function. Nature Medicine. 20 (10), 1174-1181 (2014).
- Bernet, J. D., et al. p38 MAPK signaling underlies a cell-autonomous loss of stem cell self-renewal in skeletal muscle of aged mice. Nature Medicine. 20 (3), 265-271 (2014).
- Wang, Y. X., Dumont, N. A., Rudnicki, M. A. Muscle stem cells at a glance. Journal of Cell Science. 127, 4543-4548 (2014).
- Bentzinger, C. F., Wang, Y. X., Dumont, N. A., Rudnicki, M. A. Cellular dynamics in the muscle satellite cell niche. EMBO Reports. 14 (12), 1062-1072 (2013).
- Eliazer, S., et al. Wnt4 from the Niche Controls the Mechano-Properties and Quiescent State of Muscle Stem Cells. Cell Stem Cell. 25 (5), 654-665 (2019).
- Goel, A. J., Rieder, M. K., Arnold, H. H., Radice, G. L., Krauss, R. S. Niche cadherins control the quiescence-to-activation transition in muscle stem cells. Cell Reports. 21 (8), 2236-2250 (2017).
- Sousa-Victor, P., et al. Geriatric muscle stem cells switch reversible quiescence into senescence. Nature. 506 (7488), 316-321 (2014).
- Lukjanenko, L., et al. Loss of fibronectin from the aged stem cell niche affects the regenerative capacity of skeletal muscle in mice. Nature Medicine. 22 (8), 897-905 (2016).
- Lukjanenko, L., et al. Aging disrupts muscle stem cell function by impairing matricellular wisp1 secretion from fibro-adipogenic progenitors. Cell Stem Cell. 24 (3), 433-446 (2019).
- Alsharidah, M., et al. Primary human muscle precursor cells obtained from young and old donors produce similar proliferative, differentiation and senescent profiles in culture. Aging Cell. 12 (3), 333-344 (2013).
- Machado, L., et al. In situ fixation redefines quiescence and early activation of skeletal muscle stem cells. Cell Reports. 21 (7), 1982-1993 (2017).
- van Velthoven, C. T. J., de Morree, A., Egner, I. M., Brett, J. O., Rando, T. A. Transcriptional profiling of quiescent muscle stem cells in vivo. Cell Reports. 21 (7), 1994-2004 (2017).
- van Velthoven, C. T. J., Rando, T. A. Stem cell quiescence: Dynamism, restraint, and cellular idling. Cell Stem Cell. 24 (2), 213-225 (2019).
- Judson, R. N., et al. The Hippo pathway member Yap plays a key role in influencing fate decisions in muscle satellite cells. Journal of Cell Science. 125, 6009-6019 (2012).
- He, W. A., et al. NF-kappaB-mediated Pax7 dysregulation in the muscle microenvironment promotes cancer cachexia. Journal of Clinical Investigation. 123 (11), 4821-4835 (2013).
- Schmidt, M., Poser, C., von Maltzahn, J. Wnt7a counteracts cancer cachexia. Molecular Therapy Oncolytics. 16, 134-146 (2020).
- Feige, P., Rudnicki, M. A. Isolation of satellite cells and transplantation into mice for lineage tracing in muscle. Nature Protocols. 15 (3), 1082-1097 (2020).
- Garry, G. A., Antony, M. L., Garry, D. J. Cardiotoxin induced injury and skeletal muscle regeneration. Methods in Molecular Biology. 1460, 61-71 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved