Method Article
מודל פצע Ex vivo אנושי וגישה מוכתמת בהר שלם להערכה מדויקת של תיקון העור
In This Article
Summary
כאן אנו מדגימים טכניקה ממוטבת להערכת תיקון פצעים באמצעות עור אנושי ex vivo בשילוב עם גישה מוכתמת שלם. מתודולוגיה זו מספקת פלטפורמה פרה-קלינית להערכת טיפולים פוטנציאליים לפצעים.
Abstract
פצעים כרוניים שאינם מרפאים, המשפיעים בעיקר על קשישים וחולי סוכרת, הם תחום משמעותי של צורך קליני ללא מענה. למרבה הצער, הטיפולים הנוכחיים בפצעים כרוניים אינם מספקים, בעוד מודלים פרה קליניים זמינים מנבאים בצורה גרועה את היעילות הקלינית של טיפולים חדשים. כאן אנו מתארים תפוקה גבוהה, מודל פרה קליני כדי להעריך היבטים מרובים של התגובה האנושית לתיקון העור. פצעי עובי חלקיים נוצרו בעור ex vivo אנושי ותרבית לאורך קורס זמן ריפוי. ביופסיות פצע עור נאספו קיבוע עבור הליך הכתמת הרכבה כולה. דגימות קבועות נחסמו ודגרו בנוגדנים ראשוניים, עם זיהוי שהושג באמצעות נוגדן משני מצומד פלואורסצנטי. הפצעים היו מוכתמים וצוו באמצעות מיקרוסקופיה קונפוקלית לפני חישוב אחוז סגירת פצעים (אפיתלציה מחדש) בכל ביופסיה. החלת פרוטוקול זה, אנו חושפים כי פצעים excisional 2 מ"מ שנוצרו בעור תורם בריא הם epithelialized מחדש באופן מלא על ידי יום 4-5 לאחר פציעה. להיפך, שיעורי הסגירה של פצעי עור סוכרתיים מופחתים באופן משמעותי, מלווים ברפורמציה של מכשולים מוטרדים. שילוב של פגיעה בעור אנושי עם גישת כתמים חדשנית של הרכבה מלאה מאפשר שיטה מהירה ורבייה לכמת תיקון פצעי ex vivo. באופן קולקטיבי, פרוטוקול זה מספק פלטפורמה אנושית בעלת ערך להערכת האפקטיביות של טיפולים פוטנציאליים בפצעים, תוך שינוי בדיקות ואימות פרה-קליניים.
Introduction
פצעים כרוניים, שאינם מרפאים, הנפוצים מאוד אצל קשישים וחולי סוכרת, הם תחום לא מוערך בעיקר של צורך קליני ללא מענה. פצעים אלה מהווים נטל פיזי ופסיכולוגי גדול למטופלים ועולים לספקי שירותי הבריאות מיליארדים מדי שנה לטיפולב - 1. למרות הבנה משופרת של ביולוגיה הפצע והתקדמות בטכנולוגיה, עד 40% מהפצעים הכרוניים עדיין לא מצליחים להחלים בעקבות הטיפול הסטנדרטי הטוב ביותר2. לכן, 14-26% מהחולים עם כיבים ברגל סוכרת לאחר מכן דורשים קטיעה3, בעוד שיעור התמותה לאחר כריתה של 5 שנים עומד על כ -70%4. כתוצאה מכך, קיימת דרישה דחופה לפתח טיפולים חדשים ויעילים לשיפור איכות החיים של המטופלים תוך הפחתת הנטל הבריאותי המשמעותי שהוטל על ידי פצעי ריפוי ירודים. מודלים פרה-קליניים בעלי חיזוי גרוע נותרים משוכה משמעותית לפיתוח טיפולים חדשים ויעילים.
תיקון פצעים הוא תהליך דינמי ורב פנים הכולל מגוון רחב של סוגי תאים, אינספור רמות תקשורת וסביבת רקמות שמשופצת זמנית. ריפוי העור מושתת על ארבעה שלבי תיקון עיקריים: המוסטזיס, דלקת, התפשטות ושיפוץ מטריצה. שלבים אלה פועלים בסופו של דבר כדי למנוע אובדן דם וזיהום, לסגור את פני השטח הפצע(תהליךהמכונה אפיתלציה מחדש) ולהחזיר את העור למצב לא נפגע 5 . פצעים כרוניים קשורים עם אטיולוגיה מגוונת ופגיעה נרחבת בתהליכיריפוי 6, מה שמסבך עוד יותר את זיהוי המטרות הטיפוליות. עם זאת, מגוון רחב של מודלים פותחו הן כדי ל ל להחיות את הנהגים המולקולריים והתאיים של פתולוגיית הפצע ולבדוק גישות טיפוליות חדשות7.
מודל תיקון הפצע הנפוץ ביותר הוא פצע חריף בעכבר. עכברים הם מאוד מתיחה למחקרים מכניים ולספק מודלים מאומתים של הזדקנות וסוכרת8. למרות הדמיון הכללי המוצג בין עכברים וריפוי אנושי, הבדלים בין המינים במבנה העור ובדינמיקת הריפוי נותרו. משמעות הדבר היא שרוב מחקר הפצעים המוריני אינו מתורגם בקלות למרפאה9. כתוצאה מכך, יש כבר דחיפה לעבר מערכות במבחנה אנושית ex vivo עם ישימות גבוהה ותרגום10,11.
כאן אנו מספקים פרוטוקול מעמיק לביצוע פצעים כריתה בעובי חלקי בעור אנושי ex vivo. אנו גם מתארים את גישת הכתמים שלנו כולה כשיטה ניתנת לשחזור של ריפוי עור אנושי ex vivo. אנו מראים את המסלול של תיקון אפידרמיס (אפיתלציה מחדש) ואת היווצרות המחסום הבא, הערכת קצב סגירת הפצע בעור אנושי בריא לעומת סוכרתי. לבסוף, אנו מדגימים כיצד ניתן להתאים כתמים שלם לשימוש עם מגוון נוגדנים כדי להעריך היבטים שונים של תגובת הריפוי.
Protocol
עור האדם התקבל ממטופלים שעברו ניתוח שחזור בבית החולים קאסל היל ובמרפאת האל רויאל (האל, בריטניה) בהסכמת מטופלים מושכלת בכתב, הנחיות מוסדיות ואישור אתי (LRECs: 17/SC/0220 ו- 19/NE/0150). עור שאינו סוכרתי נאסף מחולים שעברו ניתוח שגרתי (גיל ממוצע = 68). עור סוכרתי נבחר מתורמים שהקימו סוכרת מסוג II והיסטוריה של כיב (גיל ממוצע = 81). דגימות מניתוח הועברו באמצעי תקשורת ותעובדו מיד עם הגעתם למעבדה. כל השלבים הניסיוניים באמצעות רקמה אנושית לא מנוצלת בוצעו ברמת Biosafety Level-2 (BSL-2) בארון בטיחות ביולוגית של זרימת למינאר מסוג II.
1. הכנת מדיה של תרבות העור והכתמת ריאגנטים
הערה: כל הפרטים המרגשים והמתכלים מסופקים בטבלת החומרים. ודא שכל ריאגנטים וציוד המשמשים לעיבוד ותרבות של רקמה אנושית הם סטריליים. לחטא מכשירים לפני השימוש ולחטא עם חומר חיטוי לאחר מגע עם הרקמה. יש לחטא מוצרי פסולת ב-1% חומר חיטוי לפני ההשלכה.
- אמצעי החזקה: תוספת מדיום הנשר המעודכן (DMEM) של דולבק עם 2 מ"מ L-גלוטמין ו-4% (v/v) פתרון אנטישמי-אנטי-ממיקוטי.
- תמיסת המלח המאוזנת של האנק (HBSS) עם אנטיביוטיקה: הוסיפו 4% (v/v) ל-HBSS. יש לאחסן ב-4 °C (70°F) עד לשימוש.
- תמיסת מלח חוצץ פוספט (DPBS) של דולבק: הכן DPBS על ידי המסת 9.6 גרם אבקת DPBS לליטר מים מזוקקים (dH2O). יש לאחסן ולאחסן ב-4 מעלות צלזיוס עד לשימוש.
- מדיה לצמיחת עור אנושי: תוספת DMEM גלוקוז גבוהה עם 2 mM L-גלוטמין, 1% (v/v) פתרון אנטיביוטי אנטי-ממיקוטי ו 10% (v/v) סרום בקר עוברי. יש לאחסן ב-4 °C (70°F) עד לשימוש.
- תיקון לעור: ל 450 מ"ל של dH2O, להוסיף 40 מ"ל של פתרון פורמלדהיד, 10 מ"ל של חומצה אצטית קרחונית, 4.5 גרם של נתרן כלורי ו 0.25 גרם של ברומיד אלקילטרימתילמוניום. יש לאחסן בטמפרטורת החדר (RT) ולהשתמש תוך מספר ימים.
זהירות: קיבוע הוא מסוכן (מגרה ודליק). לטפל בזהירות ולהיפטר דרך מסלול מתאים. - תמיסת מלח חוצץ פוספט (PBS): הכן PBS להכתמה מלאה על-ידי הוספת 6 גרם נתרן כלורי ל-100 מ"ל של תמיסת חיץ פוספט ו-900 מ"ל של dH2O.
- חיץ כביסה מכתים: להמיס 0.5% (v/v) טריטון X-100 ב- PBS.
- מאגר חסימה: הוסף 0.2% (w/v) נתרן אזיד ו 2% (v/v) סרום בעלי חיים כדי להכתים חוצץ לשטוף. יש לאחסן ב-4 מעלות צלזיוס עד שבועיים.
הערה: לחסום בסרום של מינים מארח נוגדנים משניים. נתרן אזיד ימנע צמיחה חיידקית במהלך הדגירה. - פתרון עבודה DAPI: הכן 5 מ"ג / מ"ל מלאי של 4′,6-דיאמידינו-2-פנילינדול (DAPI) בדימתיל סולפוקסיד. לדלל את המניה 1:1,000 בחץ כביסה כתמים כדי לתת פתרון עבודה DAPI 5 מיקרוגרם / mL.
- בלוק Peroxidase: להוסיף 0.3% (v/v) מי חמצן כדי להכתים לשטוף חוצץ. יש לאחסן ב-4 °C (70°F) עד לשימוש. שמור בחושך כדי למנוע פירוק.
- ערכת ABC-HRP:
- נוגדן משני מצומד HRP: 1 טיפה של ארנב ביוטינילאט אנטי עז IgG ב 5 מ"ל של חוצם כתמים. יש לאחסן ב-4 מעלות צלזיוס עד שבועיים.
הערה: הערכה/המשנית שבה נעשה שימוש תהיה תלויה במינים המארחים של הנוגדן העיקרי. - ריאגנט קומפלקס אבידין-ביוטין (ABC): 2 טיפות של ריאגנט A ו-2 טיפות של ריאגנט B ב-5 מ"ל של חיץ כביסה מוכתם. יש להכין ריאגנט ABC לפחות 30 דקות לפני השימוש. יש לאחסן ב-4 מעלות צלזיוס עד שבועיים.
- נוגדן משני מצומד HRP: 1 טיפה של ארנב ביוטינילאט אנטי עז IgG ב 5 מ"ל של חוצם כתמים. יש לאחסן ב-4 מעלות צלזיוס עד שבועיים.
- Peroxidase מצע: 3 טיפות של ריאגנט 1, 2 טיפות של ריאגנט 2, 2 טיפות של ריאגנט 3 ו 2 טיפות של מי חמצן ב 5 מ"ל של dH2O. מצע Peroxidase צריך להיות מוכן טרי מיד לפני השימוש ולא ניתן לאחסן.
2. הכנת העור לפציעה
הערה: שלבים אלה צריכים להתבצע בארון בטיחות ביולוגית של זרימת למינאר מסוג II.
- לאסוף את העור בהחזקת מדיה ולהובלה לארון BSL-2.
- מניחים את צד העור למטה בתוך צלחת פטרי סטרילית 90 מ"מ ולהסיר רקמת שומן עם מספריים סטריליים.
- מניחים את העור בצינור 50 מ"ל המכיל 25 מ"ל של HBSS עם אנטיביוטיקה במשך 10 דקות ב RT. לנער לסירוגין כדי להסיר כל שאריות דם ורקמת שומן.
- חזור על שלב 2.3 באמצעות צינור חדש של 50 מ"ל.
- מניחים את העור בצינור 50 מ"ל טרי המכיל 25 מ"ל של HBSS, הפעם ללא אנטיביוטיקה במשך 10 דקות ב RT. לנער כמו בשלב 2.3.
- בצע שטיפה סופית בעור על ידי הצבת העור בצינור חדש עם 25 מ"ל של DPBS. העור מוכן כעת לפציעה.
3. יצירת פצעי עור אנושיים ex vivo
הערה: שלבים אלה צריכים להתבצע בארון בטיחות ביולוגית של זרימת למינאר מסוג II.
- הכן את מנות תרבית העור לפני הפציעה. בצלחת פטרי 60 מ"מ, עורמים שתי רפידות סופגות סטריליות ומוסיפים 4 מ"ל של מדיית עור אנושית דרך הצד של המנה. מניחים קרום מסנן ניילון סטרילי על ערימת הפנקס הסופג.
הערה: ניתן לשנות את מדיה בעור בהתאם לתנאי הטיפול הנדרשים. עד שלושה מגרשי פצעים עשויים להיות תרבותיים על כל ערימה. - יבש את הצד העורי של העור על גזה סטרילית בצלחת פטרי 90 מ"מ כדי להסיר DPBS שיורית.
הערה: זה מונע מהעור להחליק סביב בעת הפציעה. - מניחים את צד העור על מכסה צלחת פטרי נקי 90 מ"מ ומטפנים את האפידרמיס יבש עם גזה סטרילית טרייה.
הערה: קל יותר לפצוע את העור במכסה צלחת פטרי מאשר הבסיס. העבודה הבאה צריכה להתבצע במהירות כדי למנוע את העור מתייבש. - מחזיקים את העור מתוח, לוחצים על אגרוף ביופסיה 2 מ"מ על העור ומסובבים בעדינות. אין להכות לחלוטין דרך העור.
הערה: פצעי עובי חלקיים נועדו להכות דרך האפידרמיס ובחלקו לתוך הדרמיס. ייתכנו שונות בין תורם לתורם ומשתכן לאתר בכוח הנדרש ליצירת פצע העובי החלקי. - השתמש במלקחי רקמה מעוקלת כדי להרים כל צד של הפצע 2 מ"מ וו מספריים קשתית מעוקלת תחת הפצע 2 מ"מ לחתוך אותו באופן אחיד.
- ביופסיה סביב הפצע המרכזי 2 מ"מ באמצעות אגרוף ביופסיה 6 מ"מ כדי ליצור explant 6 מ"מ עם פצע עובי חלקי 2 מ"מ במרכז.
הערה: אגרוף ביופסיה 6 מ"מ עשוי לשמש כדי להבקיע את העור כדי לסמן איפה כל פצע 2 מ"מ צריך להיות. יש להצטרר לא לחדור את הרקמה לחלוטין. צור explants פצע בדפוס חלת דבש כדי להפחית בזבוז. - מניחים פצע explants אפידרמיס בצד למעלה על מחסנית ממברנה מסנן ניילון (מוכן בשלב 3.1).
הערה: בעת טיפול explants הפצע, להיזהר לא לפגוע בפצע המרכזי. השתמש במלקחיים קטנים והרימו כל מסלק בצדדים מנוגדים. - פצעי דגירה ב 32-37 °C (5% CO2) באטמוספירה לחה (90-95%) במשך 1-7 ימים. החלף את המדיה כל 2-3 ימים.
4. הכתמת הרכבה שלמה של פצעי ex vivo
הערה: סעיף זה מתאר שיטות הכתמת אימונופלואורסידאז. מערבבים את כל הריאגנטים היטב לפני השימוש.
- שיטת כתמי פלואורסצנטית
- לאסוף explants פצעים 1.5 מ"ל צינורות microcentrifuge המכיל 500 μL של עור קיבוע ודגרה ב 4 °C (5 °F) לילה.
הערה: הקיבוי המשמש בפרוטוקול זה פועל היטב עבור הנוגדנים המתוארים. אופטימיזציה תידרש עבור נוגדנים אחרים. קיבוע רקמות שיותר מ-24 שעות עלול להוביל לקיבוע יתר. - למחרת להסיר את הקיבעון ולהחליף עם 1 מ"ל של חוצץ לשטוף כתמים. ביופסיות ניתן לאחסן חוצץ כביסה כתמים ב 4 °C (70 °F) עד שבועיים לפני הכתם.
הערה: עבור כל שלבי חיץ לשטוף, להשתמש פיפטה סרולוגית או טיפ פיפטה, תוך כדי קפיד לא לפגוע בפצע. - שאפו את חיץ הכביסה הכתימה ולבצע שטיפה אחת נוספת עם 1 מ"ל של חוצץ כביסה כתמים.
- חשב את כמות מאגר החסימה הנדרש עבור שלבים 4.1.5-4.1.6 (מספר הדגימות x 300 μL = כמות מאגר חסימה ב- μL). הפוך מאגר נוסף במידת הצורך.
- הוסף 150 μL של חסימת מאגר לכל מדגם ודגרה במשך 1 שעה ב RT. עבור כל שלבי הכתמים, ודאו שכל דגימה מכוסה מספיק וכי אין בועות המכסות את פני השטח של פצע הביופסיה.
הערה: צעד זה ואילך יכול להתבצע בצינורות מיקרוצנטריפוגה 1.5 מ"ל או בצלחת 48 באר. אם משתמשים בצלחת 48 באר, לדגור על הפצעים עם הפנים כלפי מטה בכל באר. - לדלל את הנוגדן העיקרי במאגר החסימה הנותר.
הערה: קרטין נגד עכבר 14 (K14) מדולל 1:1,000 בחסימה מאגר עובד טוב. מטב שלב זה לשימוש עם נוגדנים אחרים או בדיקות מרובות. - שאפו את מאגר החסימה והוסיפו 150 נוגדן ראשי של μL לכל צינור באר /מיקרוצנטריפוגה. דגירה פצע explants בנוגדן העיקרי ב 4 °C (5 °F) לילה.
- למחרת, לשאוף את הנוגדן העיקרי ולשטוף במאגר לשטוף כתמים המכיל 0.2% נתרן אזיד עבור 1 שעה ב RT (500 μL לדגימה).
- בצע שלושה צעדי שטיפה נוספים באמצעות חיץ כביסה כתמים (30 דקות לכביסה, 500 μL לדגימה).
- לדלל את הנוגדן המשני מצומד פלואורסצנטית במאגר כביסה כתמים (למשל, עז נגד עכבר 488 בשעה 1:400 דילול).
- חשב את הכמות הנדרשת של נוגדן משני (מספר הדגימות x 150 μL = כמות ב- μL).
- הוסף 150 μL של נוגדן משני לכל צינור באר / microcentrifuge. דגירה במשך שעה ב- RT. בצע את שלבי הדגירה 4.1.10 - 4.1.16 בחושך מכיוון שהנוגדן המשני רגיש לאור.
הערה: שלב זה יכול להתבצע בשעה 4 °C (75 °F) בלילה במידת הצורך. מטב את הריכוז של נוגדן משני הנדרש עבור אות נאות וכתמים ברקע מוגבל. - הסר את הנוגדן המשני ולבצע 3 x 30 דקות שטיפות עם חוצץ כביסה כתמים (500 μL לדגימה).
- מחק את מאגר השטיפה שנותר וחשב את כמות פתרון העבודה של DAPI הנדרש (לפי שלב 4.1.11).
- תטען כל הסבר עם 150 μL של פתרון עבודה DAPI במשך 10 דקות ב- RT.
הערה: DAPI יהיה להכתים גרעיני תא כחול. צבע Hoechst יכול לשמש כחלופה DAPI. - בצע שתי שטיפות סופיות של 30 דקות עם חיץ כביסה מכתים (500 μL לדגימה). ביופסיות ניתן לאחסן חוצץ לשטוף כתמים ב 4 °C (7 °F) בחושך עד שבועיים לפני הדמיה.
- לאסוף explants פצעים 1.5 מ"ל צינורות microcentrifuge המכיל 500 μL של עור קיבוע ודגרה ב 4 °C (5 °F) לילה.
- שיטת הכתמת ברייטפילד.
- בצע שלבים 4.1.1 - 4.1.3.
- פעילות פרוקסידאז אנדוגני להרוות עם בלוק peroxidase ב 4 °C (50 °F) לילה.
הערה: שלב זה חשוב בעת שימוש בנוגדן מצומד HRP כדי להפחית כתמי רקע לא ספציפיים מהרקמה. רקמה בעלת כלי דם גבוהים תכיל פעילות פרוקסידאז אנדוגני יותר. - יש להשליך את גוש peroxidase ולשטוף פעמיים למשך 30 דקות במאגר שטיפת כתמים.
- בצע שלבים 4.1.4 - 4.1.8.
הערה: כביסה לאחר שלב 4.1.7 חשובה במיוחד להסרת נתרן אזיד מהדגימות. אם נתרן אזיד לא יוסר כראוי, הוא ינטרל את HRP ויפריע לגילוי כתמים. - הוסף 150 μL HRP מצומד נוגדן משני לכל צינור באר / microcentrifuge ודגורה לילה ב 4 °C (55 °F) או 1 שעה ב RT.
- הסר את הנוגדן המשני ולבצע 3 x 30 דקות שטיפות במאגר לשטוף כתמים.
- הוסף 150 μL ABC ריאגנט לכל צינור באר / microcentrifuge ודגורה לילה ב 4 °C (70 °F) או שעה אחת ב RT.
- שאפו את ריאגנט ABC ולבצע 3 x 30 דקות שטיפות חוצץ כביסה כתמים.
- הוסף מצע 150 μL peroxidase למסביר אחד וקבע את הזמן הדרוש לזיהוי שינוי צבע מורגש.
הערה: בחר מדגם שבו צפויים כתמים חזקים. במקרה זה, טבעת אדומה כדי להראות את האפידרמיס הנודד (K14). 3,3'-diaminobenzidine-4, או כל מצע כרומוגני מתאים אחר, עשוי לשמש כתחליף למצע פרוקסידאז זה. - לאחר שנצפית שינוי צבע, הסר את המצע של peroxidase והחלף ב- 1 מ"ל של dH2O.
- חזור על זיהוי מצע peroxidase עבור explants האחרים, דגירה לזמן שנקבע בשלב 4.2.11.
- יש לשטוף את כל המסלקים עם 1 מ"ל של dH2O כדי להסיר את שאריות המצע של פרוקסידאז. למרות explants עשוי להיות מאוחסן עד שבוע אחד ב 4 °C (5 °F) לפני הדמיה, עדיף לדמיין אותם בהקדם האפשרי כדי למנוע שטיפה של מצע peroxidase לתוך dH2O לאורך זמן.
5. הדמיה וכימות
- הדמיה פלואורסצנטית
הערה: הדמיה פלואורסצנטית מתבצעת באמצעות מיקרוסקופ סריקת לייזר קונפוקל. עם זאת, מיקרוסקופ פלואורסצנטי הפוך עשוי להספיק לרכישת תמונות 2D כדי לכמת את שיעורי סגירת הפצע. בעת בחירת נוגדנים משניים, ודא כי פלואורכרום שנבחר תואם עם ספקטרום העירור והפליטה של ציוד מיקרוסקופיה זמין.- השתמש במיקרוסקופ סריקת לייזר קונפוקלי המצויד בתוכנת רכישה של 2.5x, פי 10 ו-20x, שלב ממונע x-y-z, מצלמה דיגיטלית ותוכנת רכישה. הפעל את גלאי האור המשודר (TPMT) כדי לאפשר הדמיה קלה של כל ביופסיה ולאפשר מדידה של סגירת פצעים מוחלטת. לחלופין, למדוד כל פצע באמצעות מיקרוסקופיה Brightfield בעקבות הדמיית פלואורסצנטיות.
- מניחים בסיס צלחת פטרי 60 מ"מ על פלטפורמת ההדמיה ומוסיפים שכבה דקה (כ-1 מ"ל) של DPBS.
הערה: אם נעשה שימוש ביותר מדי DPBS, הביופסיה תסתובב במהלך ההדמיה. לחלופין, יש להשתמש בצלחת 48 באר אם יש מחזיק צלחת זמין. - השתמש במלקחיים קטנים של רקמות כדי להעביר מלקחיים פצעים מבארות / צינורות microcentrifuge לצלחת פטרי המכילה DPBS. מניחים את צד פצע הביופסיה בצלחת הפטרי.
- השתמש בעין ובמנורת פלורסנט כדי לאתר ולהתמקד בפצע. אם בועות לכודות מתחת לדגימה בשדה הראייה, להרים את הפצע עם מלקחיים רקמה ולמקם מחדש.
- הגדר את תוכנת ההדמיה, והבטח גודל חור סיכה שווה בין ערוצים לקונפוקליטיות אופטימלית. עבור זאת, בדוק את הערך של יחידה אוורירית אחת עבור כל ערוץ ובחר את הערך הגדול ביותר. בחר מהירות סריקה, איכות תמונה וממוצע.
הערה: הפלואורכום של הנוגדנים המשניים הצומדים והכתם הנגדי הנבחר (למשל, DAPI) יכתיבו את הערוצים הנדרשים. - הפעל את תוכנת הרכישה החיה והתאם את עוצמת הלייזר והרווח של כל ערוץ לרמות הנדרשות כדי לדמיין כתמים. הפחת את רעשי הרקע על-ידי הגדלת ההיסט הדיגיטלי.
- מקם את הפצע במרכז מישור ההדמיה.
הערה: אם הפצע אינו ממלא את התמונה כולה עקב שימוש במטרה קטנה יותר או יצירת פצע גדול יותר, לקחת פאנל של תמונות ולתפור אותם יחד (באופן ידני או עם פונקציית אריח בתוכנת ההדמיה הרלוונטית). - לרכוש תמונות של ביופסיות הפצע. השתמש באותן הגדרות הדמיה בין explants.
הערה: תמונות בהספק גבוה יותר יאפשרו הערכה של מבני רקמות וביטוי ומיקום של סמן תאי. - לאסוף ערימות Z סדרתי דרך הפצע, במיוחד כאשר הרקמה אינה שטוחה לחלוטין נגד צלחת פטרי. השתמש בתוכנת ניתוח כדי לכווץ את מחסנית Z לתמונת הקרנה אחת בעוצמה המרבית.
- הדמיית ברייטפילד
הערה: הדמיית ברייטפילד של ביופסיות מוכתמות אימונופרוקסידאז יכולה להתבצע במספר דרכים.- הדמיית מיקרוסקופ הפוכה: הכן את מסלקי הפצע להדמיה על ידי הצבתם בצלחת פטרי /טוב מתואר בשלבים 5.1.2-5.1.3. רכשו תמונות דיגיטליות תחת תאורת Brightfield במיקרוסקופ הפוך המצויד במצלמה דיגיטלית. תפרו יחד תמונות מרובות במידת הצורך.
- הדמיית מיקרוסקופ דיגיטלי אלחוטי: השתמש במיקרוסקופ דיגיטלי אלחוטי המחובר לטלפון או למחשב נייד כדי להשיג תמונות באיכות גבוהה באופן חסכוני. מניחים explants פצע בצד על כמה רקמה ולהסיר כל שאריות dH2O (או מכתים לשטוף חוצץ) מאחסון מדגם. מקם את הפצע במרכז שדה הראייה של המיקרוסקופ. השג תמונות באמצעות המצלמה המחוברת.
- כימות
הערה: ניתן לכמת את סגירת פצעי האחוזים בכל תוכנה המאפשרת לצייר ולמדוד צורות חופשיות. ניתן להשתמש ב- ImageJ לביצוע כימות באופן הבא:- פתח את התמונה לכימות בתוכנת ImageJ.
- השתמש בכלי הצורה החופשית כדי לצייר סביב החלק החיצוני של הפצע מחדש epithelialized שבו הוא פוגש את העור הרגיל. הקש M (או ניתוח | מדידה) כדי להשיג מדידת אזור 'חיצוני'.
הערה: מרקם רקמת הפצע מחדש שונה מעור רגיל. אין צורך לשנות את קנה המידה של התמונות לפני ניתוח מסוג זה. - השתמש בכלי הצורה החופשית כדי לצייר סביב אזור הפצע הפתוח. זה המקום שבו הפצע הפתוח פוגש את הקצה הפנימי של הרקמה מחדש epithelializing. הקש M (או ניתוח | מדידה) כדי לרכוש מדידת אזור 'פנימית'.
- השתמש במשוואה הבאה כדי להסיק אחוזים של אפיתל מחדש/סגירת פצעים:
% סגירת מעגל = (אזור הפצע החיצוני - אזור הפצע הפנימי) / (אזור הפצע החיצוני) x 100
הערה: ניתן להסיק כיסוי אזור אחוזים של נוגדנים באותו אופן (למשל, K14) או כאחוז מכלל שטח הפצע. עוצמת האחוזים יכולה גם לספק מידע חצי כמותי על ביטוי ברמת הרקמה של סמנים בעלי עניין, בעוד הדמיה בהספק גבוה מציגה נתוני ביטוי ברמה התאית.
תוצאות
בדו"ח זה, אנו מציגים גישה חדשה של פציעת עור ex vivo וגישה מוכתמת שלם כדי להעריך גורמים המשפיעים על תגובת תיקון העור האנושי. איור 1A מציג שרטוט של הצינור הפרוצדורלי, שניתן לבצע תוך 3-10 ימים, בהתאם לזמני הדגירה של הפצע. פצעי העובי החלקיים מתורבתים על ערימות ממברנה באוויר : ממשק ממברנה וניתן לאסוף עבור כתמים הרכבה מלאה, מוטבע פרפין או OCT בינוני עבור היסתולוגיה כללית, או קפוא בחנקן נוזלי לניתוח ביוכימי (איור 1B). בדרך כלל אנו יוצרים פצעי עובי חלקיים 2 מ"מ במרכז של explants 6 מ"מ. עם זאת, גודל הפצע ואת explant שמסביב עשוי להשתנות בהתאם לדרישות. הליך ההרכבה כולה הותאם בהצלחה הן לשיטות ההכתמה של אימונופרוקסידאז והן לשיטות הכתמת אימונופלואורסצנטיות(איור 1C).
אימונופלואורסצנטיות מאפשרת לתחבול רקמות עם נוגדנים מרובים. בשביל זה, אנו ממליצים להשתמש בנוגדנים ראשוניים שגדלו במינים שונים, ונוגדנים משניים מצומדים בפלורסצנטריות כדי להגביל את התגובה בין המינים. ריכוזי נוגדנים ודקות יהיה צורך אופטימיזציה. אם נצפתה כתמי רקע, הפחיתו את ריכוזי הנוגדנים, הגבירו את שלבי הכביסה והוסיפו מאגר חסימה לנוגדן המשני. ניתן להעריך ישירות את הכדאיות של הרקמה הטרייה עם צבעי כדאיות מסחרית (ראה טבלת חומרים). אנו גם מראים כי רקמה עשויה להיות קבועה לאחר הכתמת הכדאיות ותמונה בהצלחה כאשר הוא מתאים כמעט (איור 1D).
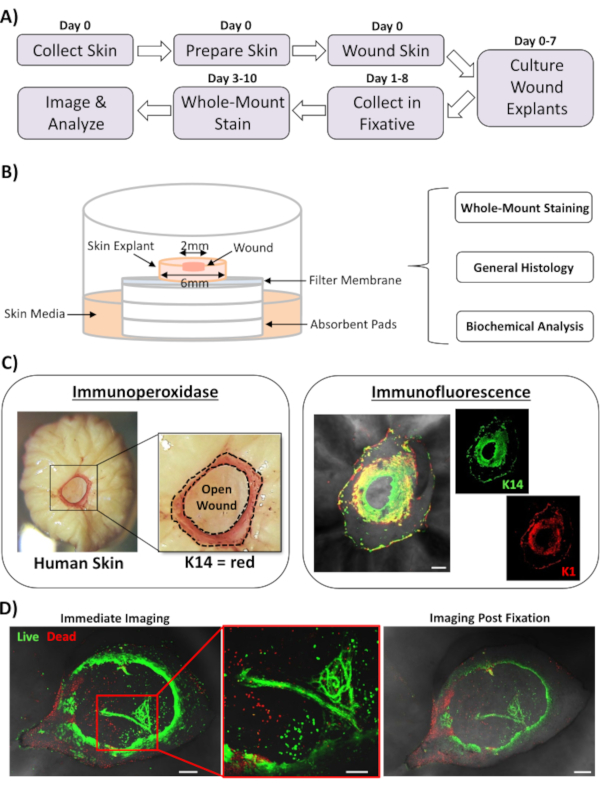
איור 1: הגישה האנושית של פציעת אקס ויוו והכתמת הרכבה מלאה. (א)צינור המתאר את זרימת העבודה הפרוצדורלית מאיסוף עור וביצוע פצעי ex vivo, להכתמת רקמות וניתוח נתונים. (B)תרשים המדגים את מערכת תרבית פצעי העור של ex vivo האנושי עם ניתוחים המבוצעים באופן שגרתי על הרקמה. (C)ניתן להשתמש בהכתמה מלאה באמצעות טכניקות אימונופרוקסידאז ואימונופלואורסצנטיות. K14 = קרטין 14. (D)רקמה חיה עשויה להיות מוכתמת בצבעי כדאיות מסחרית ותמונה בהצלחה לאחר קיבעון. בר = 100 מיקרומטר. כתמים אלה בוצעו בעור שאינו סוכרתי. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
השימוש הנפוץ ביותר עבור הכתמת כל הרכבה של פצעים הוא לקבוע את שיעור סגירת הפצע באופן רב יותר מאשר ניתן לספק באמצעות חתך היסתולוגי. סגירת האחוזים כותמה כאחוזי אפיתל מחדש של משטח הפצע, כפי שהוכח באיור 2A. כיסוי אזור אחוז של סמנים ספציפיים ניתן למדוד מאזור הפצע הכולל או כאחוז של הפצע מחדש epithelialized. אפיינו ריפוי בעור בריא (לא סוכרתי) לעומת סוכרתי לאורך שבעה ימים, ואספנו פצעים בכל יום לאחר הפציעה (תמונות מייצגות, איור 2B). פצעי עור בריאים נסגרו לאורך זמן כצפוי, עם סגירה מלאה שנצפו ברוב הדגימות ביום 4-5. להיפך, פצעי עור סוכרתיים לא הצליחו להיסגר במלואם בתוך תקופת הניתוח בת שבעת הימים(איור 2C). עיכוב משמעותי בסגירת הפצע נצפה בין פצעי עור בריאים לחולי סוכרת כאשר משווים את שיעורי הריפוי בכל נקודת זמן לאחר הפציעה (P < 0.001 עד יום 6, P < 0.05 ביום 6 ו P < 0.05 ל P < 0.001 ביום 7).
לאחר הערכה של שיעורי סגירת הפצע הכוללים; מדדנו את אחוז כל אזור הפצע (האזור החיצוני באיור 2A)שבו ניתן היה לדמיין תאים חיוביים K14 (כתמים ירוקים באיור 2B). באופן מעניין, ראינו שבפצעי עור בריאים של ex vivo, כתמי K14 הגיעו לשיאם ביום 2 ואז ירדו במהירות (משמעות בכל נקודת זמן לעומת שיא היום 2, איור 2D). זה משקף ככל הנראה היווצרות מחדש של מחסום האפידרמיס המוקדם, למעט חדירת נוגדנים K14 דרך שכבות אפידרמיס מובחנות (ראו סכמטי איור 2E). במהלך תהליך האפיתל מחדש, שכבת בזאלי (K14+ve) קרטינוציטים נודדים פנימה מעל הפצע הפתוח, כך שהאפידרמיס קרוב יותר לקצה הפצע החיצוני נוצר מוקדם יותר מהאפידרמיס קרוב יותר לקצה הפצע הפנימי (חזית נודדת). בעוד הקצה הקדמי של האפידרמיס החדש שנוצר ממשיך לנדוד כדי לסגור את הפצע הפתוח הנותר, האפידרמיס החיצוני מתחיל להבדיל כדי לתקן את שכבות האפידרמיס האחרות. בריפוי מוקדם, היינו מצפים לראות את רוב האזור האפיתל מחדש מורכב מתאי בזאלי (K14+ve), ואילו בתיקון מאוחר יותר מכתים K14 הולך לאיבוד כמו האפידרמיס מבדיל מבחוץ פנימה (ראה תמונות הר שלם באיור 2E). לכן, הירידה בהכתמת K14 המוצגת באיור 2D (חצים כלפי מטה) תואמת עם הבחנה אפידרמית מוגברת. מעניין, כתמי K14 גלויים הגיעו לשיא מוקדם יותר בריא (יום 2) לעומת סוכרת (יום 4) פצעים, עוד יותר מדגים כי אפיתלציה מחדש בידול אפידרמיס לאחר מכן מתעכבים פצעי עור סוכרתיים.
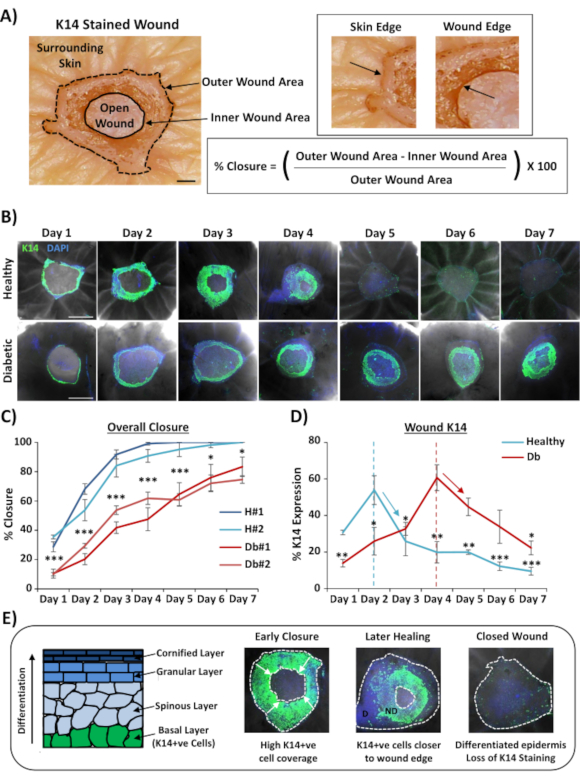
איור 2: כתמים בהר שלם חושפים שיעורי ריפוי מדאיגים בעור סוכרתי לעומת בריא. (A)השיטה המשמשת לכימות סגירת פצעים ממדידות פצעים פנימיות וחיצוניות. תמונות ברייטפילד מראות קרטין 14 (K14) מכתים באדום. בר = 300 מיקרומטר. (B) תמונות מייצגות של ריפוי לאורך זמן (יום לאחר פציעה) בעור בריא וחולי סוכרת. בר = 500 מיקרומטר. K14 = ירוק. DAPI = גרעינים כחולים. (C)כימות שיעורי סגירת הפצע (אחוזים מחדש epithelialization) מראה כי פצעי ex vivo מעור בריא לסגור באופן משמעותי מהר יותר מאשר פצעי ex vivo מעור סוכרתי. H = בריא. Db = סוכרת. (D)אחוז K14 מכתים פסגות מוקדם יותר בעור בריא לעומת סוכרתי ולאחר מכן יורד בקנה אחד עם בידול אפידרמיס מוגבר (חצים למטה). (ה)K14 (תא אפידרמיס בזאלי) מכתים הולך לאיבוד כמו האפידרמיס מבדיל. D = מובחן. ND = לא מובחן. קווים מנוקדים לבנים מתארים קצוות פצע פנימיים וחיכוניים. חצים לבנים = כיוון ההעברה. n = 6 פצעים לכל תורם, לנקודת זמן. ממוצע +/- SEM. * = P < 0.05, ** = P < 0.01 ו- *** = P < 0.001. בריא וחולי סוכרת בהשוואה בכל נקודת זמן ריפוי ב- C (ערך P להשוואה פחות משמעותית). שינוי זמני בהכתמת K14 בהשוואה לשיא עבור כל תורם ב- D. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
לאחר מכן השתמשנו בהכתמה מלאה כדי לחקור ביטוי רקמות ולוקליזציה של סמנים אחרים הקשורים לפצעים בעור שאינו סוכרתי (איור 3). כל הנוגדנים המשמשים וריכוז העבודה שלהם מסופקים בטבלת החומרים. כלי הדם בפצע הפתוח מוכתמים באופן חיובי בנוגדן שרירים חלק אלפא (a-SMA), המשמש בשילוב עם K14 כדי לתאר את הקצוות האפידרמליים בתמונות בהספק נמוך יותר (איור 3A). מטריצת העור הוכתמה בנוגדנים נגד סוג קולגן I (COL 1) ופיברונקטין (Fn). כאן נצפתה קולגן כשפע של סיבים עבים, בעוד סיבי פיברונקטין היו דלילים, גליים ודקים(איור 3A). גישת הכתמים שלנו בהרכבה כולה מסוגלת גם לספק רזולוציה ברמת התא של כתמים, כפי שהודגם עבור קרטינוציטים חיוביים K14(איור 3B).
לבסוף, אנו מראים כי פצעי ex vivo אנושיים יש תאי מערכת החיסון המקומיים, עם תאי Langerhans זוהו סביב אפידרמיס שנוצר לאחרונה ביום 3 לאחר פציעה (איור 3C). ואכן, תוצאות אלה מצביעות על כך שניתן להשתמש בהכתמה של הרכבה מלאה כדי לחקור תכונות מרכזיות של תגובת הריפוי, כולל דלקת, התפשטות, והמטריצה החוץ-תאית (איור 4A). יחד, הנתונים שלנו חושפים כי הליך הכתמת העור ex vivo המשולב והליך הכתמת הרכבה מלאה הוא שיטה תקפה להערכת היבטים שונים של תיקון עור אנושי בריא וחולה סוכרתי (פתולוגי).
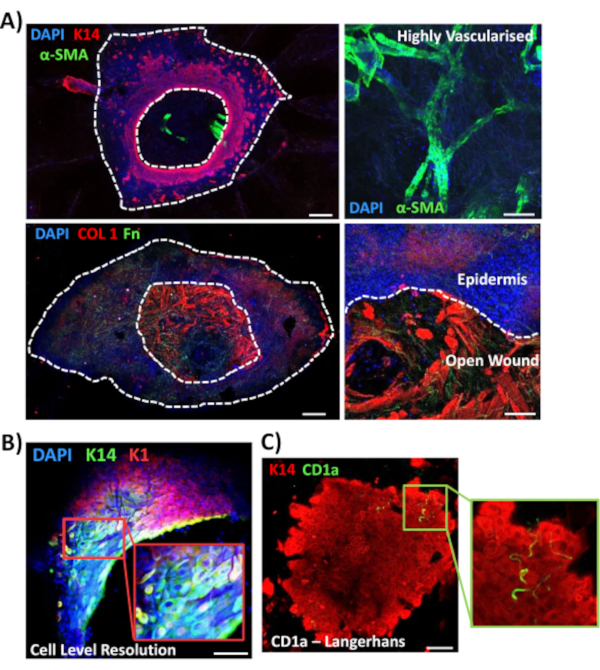
איור 3: אופטימיזציה של גישת הכתמים של הרכבה מלאה לשימוש עם נוגדנים אחרים. (A)כלי הדם הוכתמו באקטין שרירים חלק אלפא (α-SMA, ירוק) וקרטין 14 (K14, אדום), בעוד סיבי מטריצה היו מוכתמים בקולגן I (COL 1, אדום) ופיברונקטין (Fn, ירוק). (B)הליך ההרכבה כולה מספק רזולוציה של לוקליזציה ברמת התא עד לרמת התא (K14, ירוק; קיי-1, אדום). (C)CD1a + ve Langerhans תאים (ירוק) נצפו באפידרמיס שנוצר לאחרונה. DAPI = גרעינים כחולים. בר = 100 מיקרומטר. קווים מנוקדים לבנים מראים קצוות פצע פנימיים וחיציניים ופצע נפרד מאפידרמיס. כתמים אלה בוצעו בעור שאינו סוכרתי. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
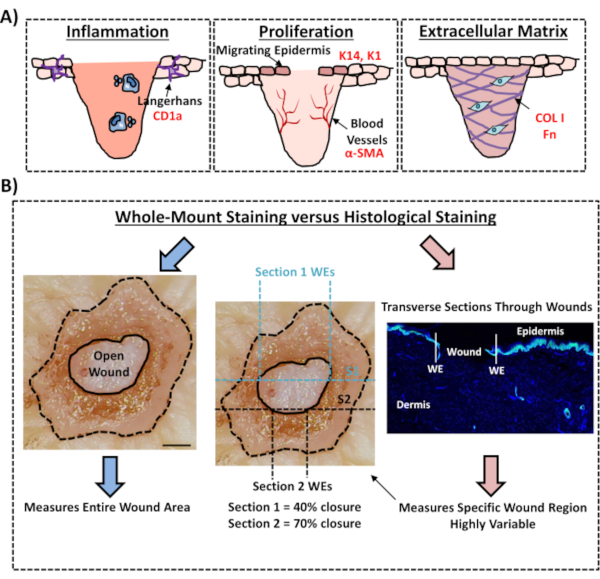
איור 4: תוקף הליך הכתמת הרכבה מלאה להערכת ריפוי פצעים. (א)איור המתאר כיצד טכניקת הכתמת ההרכבה כולה יכולה להעריך תהליכים רלוונטיים לפצעים. נוגדנים בשימוש = טקסט אדום. K14 = קרטין 14. COL 1 = קולגן 1. Fn = פיברונקטין. (B)הליך הכתמת הרכבה מלאה (חצים כחולים) מציג פחות שונות למדידות סגירת פצעים מאשר ניתוח היסתולוגי סטנדרטי (חצים אדומים). S1 = סעיף 1. אנחנו = קצה הפצע. בר = 300 מיקרומטר. כתמים אלה בוצעו בעור שאינו סוכרתי. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Discussion
בפרוטוקול ניסיוני זה, אנו מתארים שיטה ממוטבת להערכת סגירת פצעים בעור ex vivo אנושי באמצעות כתמי רקמות להרכבה מלאה. זהו משאב חשוב כדי לאפשר הערכה קריטית של טיפולים פצע פוטנציאלי, ולספק הבנה טובה יותר של התגובה לתיקון הפצע האנושי. פרסמנו הערכת ריפוי בפצעי עור ex vivo בעבר12,13, עדיין בדוחות אלה הגישה מכתימה הר כולו לא שימש למדידת סגירת פצע. כתמים בהרכבה מלאה קלים בהרבה ודורשים פחות ניסיון טכני מאשר היסתולוגיה סטנדרטית, הכוללת הטמעה של פרפין או OCT וחתך של דגימות. הליך ההרכבה כולה גם מפחית את השונות הניסיונית, ומאפשר כימות של הפצע כולו ולא רק מקטע רוחבי אחד במיקום מוגדר בתוך הרקמה (ראו איור 4B להמחשה השוואתית). אנו תומכים באופן מלא בחשיבות של כימות ריפוי של כל מבנה הפצע הלא סימטרי, כפי שמתואר בבירור על ידי ריאה ודאנוולד לפצעים חריפים מורינים14. מחברים אלה הראו את החשיבות של חתך סדרתי בפצעים מווסתים ויוו למדידות ניתנות לשחזור ומדויקות של מורפולוגיה הפצע. חתך סדרתי יכול להיות מיושם באותה מידה על פצעי ex vivo אנושיים; עם זאת, לכימות מדויק של סגירת פצעים ואפיתלציה מחדש, כתמים שלם תפוקה גבוהה צריך להיות השיטה המועדפת. אנו מציינים כי פרוטוקול הכתמה שלם זה צריך להיות תואם גם עם עיבוד עוקב (שעווה או OCT) לניתוח היסתולוגי מסורתי.
כתמים בהרכבה שלמה אינם נטולי חסרונות. אמנם הוא מאפשר רבייה גבוהה יותר בניסויים לריפוי פצעים, אך הוא דורש שימוש ביותר רקמות לניתוח מאשר טכניקות היסטולוגיות סטנדרטיות. זה עשוי להיות בעיה שבה הגישה לרקמות מוגבלת, במיוחד כאשר נוגדנים מרובים צריכים להיות מוערכים. גישה חלופית תהיה להשתמש בשיטת פציעה סינג'ית שבה רוחב הפצע אחיד יחסית והשונות מצטמצמת (כפי שמוצג בפצעי עכבר ואדם15,16). עם זאת, פצעים כריתה נשארים ישימים יותר לרוב סוגי הפצעים הפתולוגיים17.
במחקר זה, פצעי עובי חלקי 2 מ"מ נוצרו במרכז של 6 מ"מ עור explants. שיטה זו עשויה להיות מותאמת לפצעים כריתתיים אלטרנטיביים וגדלים מסבירים במעמקי עור שונים18. בנוסף, הכוח הנדרש ליצירת פצעים ישתנה בין תורמים, שם העור המזדקן ידרוש פחות כוח לביופסיה. כמו כן, נמנע משימוש בעור המציג סימני מתיחה בולטים או שינויים מבניים אחרים. אימתנו מגוון נוגדנים כדי לשקול היבטים שונים של תגובת הריפוי ex vivo. פרוטוקול זה עשוי לשמש גם עם נוגדנים אחרים הקשורים לעור, שבו ריכוזי נוגדנים זמני דגירה יהיה צורך אופטימיזציה. עם זאת, אנו מאמינים הפרוטוקול שלנו מתאים ביותר לכימות מוחלט של סגירת פצע מוחלט, ואחריו הערכה מרחבית של חלבונים ספציפיים של עניין. בעוד הר מלא מספק רזולוציה מופחתת של אימונולוקלization לעומת ניתוח היסתולוגי סטנדרטי של מקטעי רקמות, הוא מספק מידע תלת-ממדי נוסף שחסר בהצטולוגיה דו-ממדית סטנדרטית.
אזהרה אחת של הערכת ריפוי בעור ex vivo לעומת מודלים vivo היא כי הוא חסר תגובה מערכתית. היבט חשוב של תיקון הפצע הוא דלקת וגרגר רקמות לאחר מכן, אשר נגרמת על ידי זרם של תאים דלקתיים ותאי אנדותל מן vasculature19. למרות מגבלה זו, עור ex vivo עדיין מספק recapitulation טוב יותר של ריפוי קליני מאשר בדיקות פצע מבוססות תא. ניסויי במבחנה באופן כללי כוללים monolayers סוג תא יחיד או תרבויות משותפות גדל על פלסטיק תרבית רקמות, בעוד עור ex vivo מספק סביבה מקומית לחקור את התנהגות התא. לאחרונה, מספר מערכות שווה ערך לעור הופיעו, שם העור גדל בסביבת מעבדה מטריצה מלאכותית ותאי עור מבודדים20,21. למרות מודלים אלה לחקות עור אנושי טוב יותר מאשר רוב גישות במבחנה, הם עדיין לא לגמרי לדמות את סביבת הרקמה המקומית והם בדרך כלל שבירים מדי כדי לפגוע ברבייה. בנוסף, אנחנו (ואחרים) הוכחנו כי רקמת העור האנושית ex vivo שומרת על תאי מערכת החיסון המקומיים, אשר ללא ספק יתרום לתיקון22,23. עבודה עתידית צריכה כעת להתמקד בהרחבת הכדאיות והאימונו-כשירות של מודל ex vivo להערכת ריפוי בשלב מאוחר24. אפשרות אחת היא קידום נוסף של טכנולוגיות מבטיחות של איברים על שבב המסוגלות להאריך את הכדאיות של הרקמות ולשמור על ארכיטקטורת עור מקומית עד שבועיים בתרבות25. מודלים Ex vivo החלו גם לשקול את החשיבות של התגובה הדלקתית בעור על ידי שילוב מוצלח של תאים חיסוניים, כגון נויטרופילים, לתוך הרקמה המארחת26 או הזרקת רקמה מארחת עם נוגדנים כדי לעורר תגובה חיסונית27. אנו צופים כי ממצאים אלה יסללו את הדרך לפיתוח שיטות מעודנות ותרגום יותר בעתיד.
יתרון מרכזי בשימוש בעור ex vivo למדידת סגירת פצע הוא היכולת להשוות שיעורי ריפוי בריא (למשל, לא סוכרתי) לעומת פתולוגי (למשל, סוכרתי או מיושן) רקמה. כאן הראינו כי אפיתל מחדש היווצרות מחסום אכן לקויים בפצעי ex vivo סוכרתיים לעומת בריאים. ואכן, זה מספק מסלול להערכה פרה קלינית של תיקון פתולוגי, שבו הזדקנות וסוכרת הם גורמי סיכון עיקריים לפיתוח פצעים כרוניים1. בעוד מודלים פתולוגיים במבחנה קיימים, כגון תאים מבודדים מרקמה מיושנת וחולה סוכרת, או תאים בתרבית גלוקוז גבוהה כדי לחקות היפרגליקמיה28,29, תאים אלה יכולים לאבד במהירות את הפנוטיפ שלהם לאחר שהוסרו ממיקרו-סביבה in vivo. מרכיב חשוב בסביבת הריפוי הפתולוגית הקיצונית הוא מטריצת העור, אשר משתנה הן בהזדקנות והן בסוכרת30. ואכן, מטריצה מטרידה זו משפיעה על התנהגותם של פיברובלסטים מקומייםותמימים 31,32. לכן, לא ניתן להמעיט בחשיבות של לימוד תאים בסביבת הרקמה המארחת שלהם.
לסיכום, הפרוטוקול שלנו מספק פלטפורמה חשובה לכמת מחדש אפיתל הפצע האנושי, לחקור גורמים רגולטוריים ולבחון את התוקף והיעילות של טיפולים פוטנציאליים12,13. בעוד שבדיקות פרה-קליניות עדיין דורשות גישות vivo, אסטרטגיה משולבת באמצעות רקמה אנושית ex vivo ופצעים ב- vivo murine צריכים לחדד את המסלול הטרום קליני, ובכך להפחית את השימוש בבעלי חיים תוך הגדלת יכולת התרגום בין המינים.
Disclosures
המחברים אינם מצהירים על ניגודי עניינים.
Acknowledgements
ברצוננו להודות למר פאולו מטוצ'י ולמר ג'ורג' סמית על שסיפקו רקמת מטופל. אנו גם מודים לגברת אמבר רוז סטפורד על סיוע באיסוף רקמות ובערעור דייזי על אספקת מתקני מעבדה.
Materials
| Name | Company | Catalog Number | Comments |
| 50 mL Falcon Tubes | Falcon | 352070 | For skin washing |
| 1.5 ml TubeOne Microcentrifuge Tubes, Natural (Sterile) | Starlab | S1615-5510 | For whole-mount staining |
| 48-Well CytoOne Plate, TC-Treated | Starlab | CC7682-7548 | For whole-mount staining |
| Acetic Acid Glacial | Fisher Chemical | A/0400/PB15 | Part of fixative |
| Alkyltrimethylammonium Bromide | Sigma-Aldrich | M7635 | Part of fixative |
| Anti-Alpha Smooth Muscle Actin Antibody [1A4] | Abcam | ab7817 | Stains blood vessels |
| Anti-Collagen I Antibody | Abcam | ab34710 | Stains collagen |
| Anti-Cytokeratin 14 Antibody [LL002] | Abcam | ab7800 | Stains epidermis |
| CD1A Antibody (CTB6) | Santa Cruz Biotechnology | sc-5265 | Stains Langerhans cells |
| DAPI (4',6-diamidino-2-phenylindole, dihydrochloride) | Thermo Fisher Scientific | 62247 | Counterstain for cell nuclei |
| Falcon 60mm Petri dishes | Falcon | 353004 | Human ex vivo culture |
| Fibronectin Antibody (EP5) | Santa Cruz Biotechnology | sc-8422 | Stains fibronectin |
| Formaldehyde, Extra Pure, Solution 37-41%, SLR | Fisher Chemical | F/1501/PB17 | Part of fixative |
| Gauze Swabs | Medisave | CS1650 | To clean skin |
| Gibco™ Antibiotic-Antimycotic Solution | Thermo Fisher Scientific | 15240062 | Human ex vivo culture |
| Gibco DMEM, high glucose, no glutamine | Thermo Fisher Scientific | 11960044 | Human ex vivo culture |
| Gibco Fetal Bovine Serum | Thermo Fisher Scientific | 10500064 | Human ex vivo culture |
| Gibco HBSS, no calcium, no magnesium | Thermo Fisher Scientific | 14170088 | Human ex vivo culture |
| Gibco L-Glutamine (200 mM) | Thermo Fisher Scientific | 25030081 | Human ex vivo culture |
| Hydrogen Peroxide | Sigma-Aldrich | H1009-100ML | For immunoperoxidase staining |
| ImageJ Software | National Institutes of Health | N/A | For image analysis |
| Invitrogen IgG (H+L) Cross-Adsorbed Goat anti-Mouse, Alexa Fluor 488 | Thermo Fisher Scientific | A11001 | Secondary antibody used depends on required fluorochromes and primary antibody |
| Invitrogen IgG (H+L) Cross-Adsorbed Goat anti-Rabbit, Alexa Fluor 594 | Thermo Fisher Scientific | A11012 | Secondary antibody used depends on required fluorochromes and primary antibody |
| Invitrogen LIVE/DEAD Viability/Cytotoxicity Kit, for mammalian cells | Thermo Fisher Scientific | L3224 | For viability assessment of tissue |
| Iris Forceps, 10 cm, Curved, 1x2 teeth | World Precision Instruments | 15917 | To create wounds |
| Iris Scissors, 11 cm, Curved, SuperCut, Tungsten Carbide | World Precision Instruments | 501264 | To create wounds |
| Iris Scissors, 11 cm, Straight, SuperCut, Tungsten Carbide | World Precision Instruments | 501263 | To remove adipose tissue |
| Keratin 1 Polyclonal Antibody, Purified | Biolegend | 905201 | Stains epidermis |
| Keratin 14 Polyclonal Antibody, Purified | Biolegend | 905301 | Stains epidermis |
| LSM 710 Confocal Laser Scanning Microscope | Carl Zeiss | Discontinued | For fluorescent imaging |
| Merck Millipore Absorbent pads | Merck Millipore | AP10045S0 | Human ex vivo culture |
| Merck Millipore Nylon Hydrophilic Membrane Filters | Merck Millipore | HNWP04700 | Human ex vivo culture |
| Normal Goat Serum Solution | Vector Laboratories | S-1000-20 | Animal serum used depends on secondary antibody |
| Phosphate Buffer Solution | Sigma-Aldrich | P3619 | For wash buffer |
| Sodium Azide | Sigma-Aldrich | S2002 | For blocking buffer |
| Sodium Chloride | Fisher Bioreagents | BP358-212 | Part of fixative |
| Sterilisation Pouches | Medisave | SH3710 | To sterilise instruments |
| Stiefel 2mm biopsy punches | Medisave | BI0500 | For partial thickness wound |
| Stiefel 6mm biopsy punches | Medisave | BI2000 | For outer explant |
| Thermo Scientific Sterilin Standard 90mm Petri Dishes | Thermo Fisher Scientific | 101VR20 | To prepare skin |
| Triton X-100 | Fisher Chemical | T/3751/08 | For wash buffer |
| VECTASTAIN Elite ABC-HRP Kit, Peroxidase (Rabbit IgG) | Vector Laboratories | PK-6101 | For immunoperoxidase staining; HRP kit used depends on primary antibody |
| Vector NovaRED Substrate Kit, Peroxidase (HRP) | Vector Laboratories | SK-4800 | For immunoperoxidase staining |
| Wireless Digital Microscope | Jiusion | N/A | For brightfield imaging |
References
- Lindholm, C., Searle, R. Wound management for the 21st century: combining effectiveness and efficiency. International Wound Journal. 13, 5-15 (2016).
- Guest, J. F., et al. Health economic burden that different wound types impose on the UK's National Health Service. International Wound Journal. 14 (2), 322-330 (2017).
- Guest, J. F., Fuller, G. W., Vowden, P. Diabetic foot ulcer management in clinical practice in the UK: costs and outcomes. International Wound Journal. 15 (1), 43-52 (2018).
- López-Valverde, M. E., et al. Perioperative and long-term all-cause mortality in patients with diabetes who underwent a lower extremity amputation. Diabetes Research and Clinical Practice. 141, 175-180 (2018).
- Wilkinson, H. N., Hardman, M. J. The role of estrogen in cutaneous ageing and repair. Maturitas. 103, 60-64 (2017).
- Frykberg, R. G., Banks, J. Challenges in the treatment of chronic wounds. Advances in Wound Care. 4 (9), 560-582 (2015).
- Wilkinson, H. N., Hardman, M. J. Wound healing: cellular mechanisms and pathological outcomes. Open Biology. 10 (9), 200223 (2020).
- Ansell, D. M., Holden, K. A., Hardman, M. J. Animal models of wound repair: Are they cutting it. Experimental Dermatology. 21 (8), 581-585 (2012).
- Elliot, S., Wikramanayake, T. C., Jozic, I., Tomic-Canic, M. A modeling conundrum: murine models for cutaneous wound healing. Journal of Investigative Dermatology. 138 (4), 736-740 (2018).
- Mazio, C., et al. Pre-vascularized dermis model for fast and functional anastomosis with host vasculature. Biomaterials. 192, 159-170 (2019).
- Wilkinson, H. N., Iveson, S., Catherall, P., Hardman, M. J. A novel silver bioactive glass elicits antimicrobial efficacy against Pseudomonas aeruginosa and Staphylococcus aureus in an ex vivo skin wound biofilm model. Frontiers in Microbiology. 9, 1450 (2018).
- Wilkinson, H. N., et al. Elevated local senescence in diabetic wound healing is linked to pathological repair via CXCR2. Journal of Investigative Dermatology. 139 (5), 1171-1181 (2019).
- Wilkinson, H. N., et al. Tissue iron promotes wound repair via M2 macrophage polarization and the chemokine (CC motif) ligands 17 and 22. The American Journal of Pathology. 189 (11), 2196-2208 (2019).
- Rhea, L., Dunnwald, M. Murine excisional wound healing model and histological morphometric wound analysis. Journal of Visualized Experiments. 162, e61616 (2020).
- Ansell, D. M., Campbell, L., Thomason, H. A., Brass, A., Hardman, M. J. A statistical analysis of murine incisional and excisional acute wound models. Wound Repair and Regeneration. 22 (2), 281-287 (2014).
- Rizzo, A. E., Beckett, L. A., Baier, B. S., Isseroff, R. R. The linear excisional wound: an improved model for human ex vivo wound epithelialization studies. Skin Research and Technology. 18 (1), 125-132 (2012).
- Olsson, M., et al. The humanistic and economic burden of chronic wounds: a systematic review. Wound Repair and Regeneration. 27 (1), 114-125 (2019).
- Mendoza-Garcia, J., Sebastian, A., Alonso-Rasgado, T., Bayat, A. Optimization of an ex vivo wound healing model in the adult human skin: Functional evaluation using photodynamic therapy. Wound Repair and Regeneration. 23 (5), 685-702 (2015).
- Brownhill, V. R., et al. Pre-clinical assessment of single-use negative pressure wound therapy during in vivo porcine wound healing. Advances in Wound Care. , (2020).
- Diekmann, J., et al. A three-dimensional skin equivalent reflecting some aspects of in vivo aged skin. Experimental Dermatology. 25 (1), 56-61 (2016).
- Vidal Yucha, S. E., Tamamoto, K. A., Nguyen, H., Cairns, D. M., Kaplan, D. L. Human skin equivalents demonstrate need for neuro-immuno-cutaneous system. Advanced Biosystems. 3 (1), 1800283 (2019).
- Dijkgraaf, F. E., et al. Tissue patrol by resident memory CD8+ T cells in human skin. Nature Immunology. 20 (6), 756-764 (2019).
- He, X., de Oliveira, V. L., Keijsers, R., Joosten, I., Koenen, H. J. Lymphocyte isolation from human skin for phenotypic analysis and ex vivo cell culture. Journal of Visualized Experiments. (110), e52564 (2016).
- Pupovac, A., et al. Toward immunocompetent 3D skin models. Advanced Healthcare Materials. 7 (12), 1701405 (2018).
- Ataç, B., et al. Skin and hair on-a-chip: in vitro skin models versus ex vivo tissue maintenance with dynamic perfusion. Lab on a Chip. 13 (18), 3555-3561 (2013).
- Kim, J. J., et al. A microscale, full-thickness, human skin on a chip assay simulating neutrophil responses to skin infection and antibiotic treatments. Lab on a Chip. 19 (18), 3094-3103 (2019).
- Jardet, C., et al. Development and characterization of a human Th17-driven ex vivo skin inflammation model. Experimental Dermatology. 29 (10), 993-1003 (2020).
- Chen, J. L., et al. Metformin attenuates diabetes-induced tau hyperphosphorylation in vitro and in vivo by enhancing autophagic clearance. Experimental Neurology. 311, 44-56 (2019).
- Demirovic, D., Rattan, S. I. Curcumin induces stress response and hormetically modulates wound healing ability of human skin fibroblasts undergoing ageing in vitro. Biogerontology. 12 (5), 437-444 (2011).
- Wilkinson, H. N., Hardman, M. J. Wound senescence: A functional link between diabetes and ageing. Experimental Dermatology. 30 (1), 68-73 (2020).
- Fisher, G. J., et al. Collagen fragmentation promotes oxidative stress and elevates matrix metalloproteinase-1 in fibroblasts in aged human skin. The American Journal of Pathology. 174 (1), 101-114 (2009).
- Quan, T., Little, E., Quan, H., Voorhees, J. J., Fisher, G. J. Elevated matrix metalloproteinases and collagen fragmentation in photodamaged human skin: impact of altered extracellular matrix microenvironment on dermal fibroblast function. Journal of Investigative Dermatology. 133 (5), 1362 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved