Method Article
חרוזים טעינת חלבונים וחומצות גרעין לתוך תאים אנושיים חסידים
In This Article
Summary
העמסת חרוזים מכניסה חלבונים, פלסמידים וחלקיקים לתאי יונקים חסידים. טכניקת טעינת תאים זו זולה, מהירה ואינה משפיעה באופן מהותי על תקינות התא. הוא מתאים ביותר להדמיה של תאים חיים.
Abstract
ניסויים רבים בהדמיה של תאים חיים משתמשים בחלקיקים אקסוגניים (למשל, פפטידים, נוגדנים, חרוזים) כדי לתייג או לתפקד בתוך התאים. עם זאת, החדרת חלבונים לתוך תא על פני הממברנה שלה קשה. הבחירה המוגבלת של השיטות הנוכחיות נאבקת ביעילות נמוכה, דורשת ציוד יקר ותובעני מבחינה טכנית, או פונקציות בתוך פרמטרים צרים. כאן, אנו מתארים טכניקה פשוטה וחסכונית יחסית לטעינת דנ"א, רנ"א וחלבונים לתאים אנושיים חיים. העמסת חרוזים מאפשרת הפרעה מכנית זמנית לקרום התא, ומאפשרת למקרומולקולים להיכנס לתאי יונקים חיים ודבקים. בפחות מ-0.01 דולר לניסוי, טעינת חרוזים היא שיטת טעינת התאים הזולה ביותר הזמינה. יתר על כן, טעינת חרוזים אינה מלחיצה תאים באופן משמעותי או משפיעה על הכדאיות או ההתפשטות שלהם. כתב יד זה מתאר את השלבים של הליך טעינת החרוזים, ההתאמות, הווריאציות והמגבלות הטכניות. מתודולוגיה זו מתאימה במיוחד להדמיית תאים חיים אך מספקת פתרון מעשי ליישומים אחרים הדורשים הכנסת חלבונים, חרוזים, RNA או פלסמידים לתאי יונקים חיים ודבקים.
Introduction
טעינת מקרומולקולים לתאי יונקים מחייבת מתודולוגיה המאפשרת להם לחצות את קרום הפלזמה של התא1. מספר שיטות יכולות להכניס פלסמידים לתאי יונקים באמצעות טרנספקטציה, כולל טרנספקטציה ליפוזומית2 והעברת דיתילאמינואתיל-דקסטרן3. עם זאת, שיטות לטעינת חלבונים או חלקיקים אטומים לממברנה לתאים מוגבלות יותר.
מספר טכניקות עקפו את המשוכה הקשה הזו באמצעות אסטרטגיות שונות. ראשית, מיקרו-נסיגה מעבירה חלקיקים דרך מיקרופיט לתאים חיים תחת מיקרוסקופ4. אמנם ניתן לטעון את השיטה הנשלטת ביותר ופחות פולשנית, טכניקה זו היא תפוקה נמוכה יחסית כי תאים חייבים להיות טעונים אחד אחד. יתר על כן, microinjection דורש ציוד מיוחד והוא תובעני מבחינה טכנית.
שנית, אלקטרופורציה היא דרך להזריק חלבונים אלקטרו לתאים באמצעות הפרעה ממברנה הנגרמת מתח5,6,7. עם זאת, שיטה זו שוב דורשת ציוד מיוחד ויקר, וההלם יכול לגרום ללחץ תאים ותמותה. יתר על כן, תאים חייבים להיות טריפסינציה לפני electroporation ולאחר מכן נשתל, הגבלת מסגרת הזמן שבה תאים ניתן לחקור לאחר אלקטרופורציה.
שלישית, קרום התא עשוי להשתנות כימית עבור זמני, הפיך permeabilization8,9. טעינת סטרפטוליסין-O מכניסה אנדוטוקסין לקרומי התא, היוצר נקבוביות זמניות, ומאפשרת לחלקיקים אקסוגניים אטומים לקרום, כולל חלבונים ופלסטיות DNA, להיכנס לתאים10. לאחר התאוששות של 2 שעות, כמחצית מהתאים מתקנים את הנקבוביות האלה ומפסיקים את הפנמת החלקיקים מהפתרון. עם זאת, טכניקה זו דורשת זמן התאוששות ארוך והוא אינו עולה בקנה אחד עם סוגי תאים שאינם יכולים לסבול אנדוטוקסינים.
רביעית, הפרעה מכנית מעמיסה חלקיקים לתאים באמצעות הפרעה פיזית של קרום התא11. זה יכול להיעשות בדרכים מרובות, כולל גירוד, גירוד, וחרוזים מתגלגלים על גבי תאים12,13. כבר בשנת 1987, חרוזים שימשו לטעינת חלבונים לתאיםמכנית 14. לאחרונה, טכניקת טעינת החרוזים עברה אופטימיזציה והותאמה מעבר לחלבונים כדי לכלול טעינה של פלסמידים ורנ"א, כמתואר כאן.
העמסת חרוזים היא שיטה קלה, זולה ומהירה לטעינת חלבונים ופלסטידים לתאים אנושיים חסידים. חרוזי זכוכית מגולגלים לזמן קצר על גבי תאים, ומשבשים באופן זמני את הממברנה התאית שלהם. זה מאפשר לחלקיקים בתמיסה להיכנס. כמו טעינת חרוזים יש יעילות נמוכה, זה מתאים ביותר עבור מולקולה אחת או ניסויים מיקרוסקופיה של תא יחיד. העמסת חרוזים יכולה להכניס מגוון רחב של חלבונים, כולל נוגדנים מקוטעים (Fab),15,16 חלבונים מטוהרים כמו scFvs,17 inbodies,18,19, או חלבוני מעיל mRNA, למשל, חלבון שכבת MS2 (MCP)20,21. ניתן להוסיף וקטורים לביטוי פלסמיד גם לתמיסת החלבון ולהעמיס חרוזים בו זמנית22,23,24,25.
מעבר לחלבונים ולפלסמידים, מולקולות גדולות כמו 250 ננומטר חרוזי פוליסטירן הוכנסו לתאים באמצעות טעינת חרוזים (תקשורת אישית). טעינת חרוזים זולה להפליא, עולה פחות מ-0.01 דולר לניסוי בחומרים ולא דורשת ציוד יקר נוסף. העלות מופחתת עוד יותר על ידי מזעור כמות הבדיקות המשמשות לניסוי מכיוון שרק התאים במיקרווול המרכזי בקוטר 14 מ"מ של תא הדמיה נטענים. יש לציין כי אזור הטעינה המוגבל פירושו כי טעינת חרוזים אינה אידיאלית עבור טעינת תא בצובר.
כתב יד זה מציג את תהליך טעינת החרוזים, כולל כיצד לבנות את מנגנון טעינת החרוזים ולבצע ניסוי. הוא מראה כי חלבונים, RNA ו- DNA יכולים להיות נטענים לסוגי תאים שונים וכי שני חלבונים שונים, בו זמנית טעונים חרוזים יש ריכוזי תאים מתואמים מאוד ושונות נמוכה יחסית. כמו כן נדונים וריאציות בפרוטוקול המבוססות על סוג התא וטעינת חלבון, פלסמיד או RNA. למרות חרוזים נחשבים לנקב ולשבש את קרום התא, בעת ביצוע כראוי, תהליך טעינת חרוזים פורק רק מספר קטן של תאים מתחתית תא ההדמיה. לאחר תקופת התאוששות קצרה, התאים ממשיכים לגדול ולהתחלק. מתודולוגיה זו אידיאלית לניסויים במיקרוסקופיה של תאים חיים, כולל מעקב אחר חלבון חד-מולקולה ורנ"א, זיהוי שינויים לאחר תרגום, התבוננות במנגנונים תאיים דינמיים, או ניטור לוקליזציה תת-תאית15,16,22,26,27.
Protocol
1. חרוזי זכוכית נקיים, מעוקרים ויבשים כדי למנוע גושים ולהבטיח אפילו התפשטות על גבי התאים.
- לחטא כ 5 מ"ל של חרוזי זכוכית נתרן הידרוקסיד (NaOH). למדוד את החרוזים בצינור חרוטי 50 מ"ל. יש להוסיף 25 מ"ל של 2 M NaOH ולערבב בעדינות באמצעות שייקר או סיבוב למשך 2 שעות.
- דקאנט NaOH, שמירה על חרוזים רבים ככל האפשר. אם החרוזים נמצאים בהשעיה, לסובב את הצינור של חרוזים לזמן קצר בצנטריפוגה (1 דקות ב ~ 1000 ×,טמפרטורת החדר).
- לשטוף את החרוזים ביסודיות עם מים ברמת תרבית התא עד pH הוא נייטרלי (להשתמש ברצועת בדיקת pH על האלנט כדי לאשר pH נייטרלי). תקבעו את המים בכל פעם, כמו קודם.
- לשטוף את החרוזים ביסודיות עם 100% אתנול 2-3x. דקאנט האתנול בכל פעם, כמו קודם.
- ייבש את החרוזים. מפזרים את החרוזים ליצירת שכבה דקה בתוך מיכל סטרילי (כגון צלחת פטרי 10 ס"מ). משאירים את המיכל פתוח, תן את האוויר חרוזים יבש בארון בטיחות ביולוגית לילה. ודא כי החרוזים יבשים לחלוטין על ידי הקשה או לנער בעדינות את המיכל ולבדוק כי החרוזים יש מרקם חולי ללא גושים או מתקלף.
- UV-לעקר את החרוזים היבשים במשך 15 דקות.
2. להרכיב את מנגנון מטעין החרוזים.
- הדק חלקת רשת (פוליפרופילן או חומר שווה ערך, פתחי 105 מיקרומטר כדי לאפשר לחרוזים לעבור דרכם) כדי לכסות את כל הפתח של תא ההחזקה של החרוזים בנייר דבק או מהדק את הרשת בין הקצות הזכריים והנקביים של תא הדמיה רב-תכליתי (איור 1A).
- UV-לעקר את המנגנון במשך 15 דקות. מוסיפים את החרוזים למנגנון ולאטום אותו בחוזקה עם סרט שעווה.
הערה: חיוני כי החרוזים נקיים ויבשים לחלוטין בשלב זה. הם צריכים להיות משוחררים ולהיראות חוליים ללא גושים. אם הם לא מופיעים כך, לשטוף מחדש ולייבש לחלוטין את החרוזים. - יש לאחסן את המנגנון במיכל אטום ויבש המיובש בג'ל סיליקה או במדיום ייבוש אחר. אם החרוזים הופכים לחים, אשר יהיה גלוי על ידי גושי חרוזים, יבש ביסודיות לעקר את מטעין החרוזים ולהחליף עם חרוזים טריים.
הערה: כל אמצעי הזהירות הללו ימנעו מכל עובש או חיידק לגדול על או סביב החרוזים בתוך מטעין החרוזים. מנגנון מטעין החרוזים יכול להתבצע בדרכים שונות. ראה את הפרטים בדיון.
3. הכינו תאים בתחתית זכוכית של תאים דבקים.
- תאי יונקים דבקים זרעים על תא זכוכית 35 מ"מ בתחתית. ודא כי התאים הם כ 80% מפגש בזמן טעינת חרוזים. (ראה טבלה 1 לקבלת מידע נוסף אודות סוגי תאים שונים והערות על האפקטיביות של טעינת חרוזים בסוגי תאים שונים.)
הערה: תאים יכולים להיות זרע רק microwell במרכז התא כדי לחסוך כמה תאים משמשים. - לדגור על התאים בתנאים נורמליים עד שהם דבקים לחלוטין בכוס.
הערה: חיוני כי צפיפות התא גבוהה מספיק וכי התאים דבקים בבטחה על הזכוכית. אם דרישות אלה אינן מתקיימות, סביר להניח שתאים יתקלף במהלך טעינת חרוזים. ניתן להאריך את ציר הזמן בין זריעת תאים לטעינת חרוזים כדי להבטיח הידבקות ומפגש נאותים של התא.
4. תאי טעינת חרוזים
הערה: במידת הצורך, לשטוף את התאים בקצרה עם תמיסת מלח חוצץ פוספט (PBS) ולאחר מכן להוסיף 2 מ"ל של המדיום האופטימלי. דגירה במשך 30 דקות לפחות.
- הפוך פתרון של 3-8 μL המכיל את plasmids הרצוי, חלבון, ו/או חלקיקים. השתמש ~ 1 מיקרוגרם (0.1-1 pmol) של כל סוג של plasmid ו ~ 0.5 מיקרוגרם (0.01 נמול) של חלבון, בהתאם לדרישות ניסיוניות. השתמש צינור שמירה נמוכה עבור חלבונים, כך שהם לא נשארים מאחור על קירות הצינור. הביאו את הפתרון למינימום של 3 מיקרו-אל עם PBS, והתאמו את נפח הפתרון כך שיצפה את כל שטח התאים שיש לטעון (כלומר, המיקרווול של התא, איור 1B).
- מערבבים את הפתרון ביסודיות על ידי צנרת למעלה ולמטה ו / או הבהוב הצינור. סובבו בקצרה את הפתרון לתחתית הצינור במיקרו-פוגה על השולחן.
- מעבירים את תמיסת העמסת החרוזים ואת תא התאים למכסה המנוע של תרבית הרקמות. בצע את השלבים הנותרים במכסה המנוע תרבית הרקמות באמצעות טכניקה סטרילית.
- הסר את המדיום מהתאים ולאחסן אותו באופן זמני בצינור סטרילי. שאפו בעדינות את כל המדיום מסביב לשולי התא, הטה את התא בזווית של כ-45° והסר את טיפת המדיה הנותרת במיקרווול המרכזי. במהלך הסרה בינונית, הקפד להימנע מלתת קצה פיפטה לגעת בכוס, אשר עלול לגרום קילוף תא ואובדן. עבור במהירות לשלב הבא כך שהתאים לא יתייבשו לאורך זמן.
- מעבירים בעדינות את תמיסת העמסת החרוזים על מיקרווול הזכוכית במרכז התא. אופציונלי: דגירה עם נדנדה עדינה במשך ~ 30 s מבלי לאפשר לתא להתייבש לחלוטין.
- פזרו בעדינות שכבת מונו-שכבתית של חרוזי זכוכית על גבי התאים, רצוי באמצעות מנגנון העמסת חרוזים(איור 1A). ודא כי החרוזים לכסות את התאים ב microwell התחתון זכוכית לחלוטין.
- צובטים את התא בשתי אצבעות, מקישים עליו על משטח מכסה המנוע על ידי הרמתו ~ 2 אינץ 'והורדתו בחוזקה. השתמש בכוח שווה בערך כדי להפיל את המנה מגובה זה. חזור על הפעולה עבור סך של ~ 10 הקשות.
הערה: ודאו שהברזים לא יקלפו את התאים באופן משמעותי. ניתן למטב הקשה עבור סוג התא. אם התאים נטענים בצורה גרועה, הקש חזק יותר; עם זאת, אם תאים רבים מתקלפים, הקש בקלילות רבה יותר. - מוסיפים בעדינות בחזרה בינוני לתא על ידי צנרת איטית על צד הפלסטיק של התא. נסה לשאוף כל חרוזים צפים מבלי להפריע לתאים. הוסף מדיה מחוממת מראש בשלב זה אם הוסרה יותר מדי. לדגור על התאים במשך 0.5-2 שעות באינקובטור.
- לחטא את מטעין החרוזים למשך 15 דקות לפני החזרתו לאחסון בתנאי יובש.
- הוסף צבע (למשל, כתם ליגנד DAPI או HaloTag, במידת הצורך בניסוי) לתאים לפי הפרוטוקול המומלץ של היצרן.
- לשטוף את התאים 3x עם בינוני לפני הדמיה כדי להסיר את החרוזים ואת רכיבי טעינה עודף בפתרון. הימנע צנרת ישירות על תאים כדי למנוע מהם קילוף.
5. הדמיה של התאים הטעונים על חרוזים
- תמונה התאים מיד או כאשר נדרש על ידי הניסוי. השתמש במיקרוסקופ המסוגל ללכוד פלואורסצנטיות (לייזרים או מקור אור מונוכרומטי). ודא שאורכי הגל של העירור מתאימים לפלורופור או לצבע שנבחרו (לדוגמה, אור אורך גל של 488 ננומטר לחלבון פלואורסצנטי ירוק (GFP)).
הערה: חלבונים טעונים חרוזים עשויים להיות בתמונה לאחר התאים התאוששו (ברגע 30 דקות טעינה לאחר טעינה עבור קווי התא המתוארים כאן). ביטוי Plasmid לוקח ≥2 h בהתאם לרכיבים וקטוריים של ביטוי (איור 1C, והסבר נוסף בדיון). הדמיה של תאים עמוסי חרוזים יכולה להתבצע על כל מיקרוסקופ המצויד במקורות הפלואורסצנטיים המתאימים הקשורים לבדיקות טעונות, מצלמה המסוגלת ללכוד תמונות פלואורסצנטיות, כגון התקן מטען מכפיל אלקטרונים (EMCCD) או מצלמת מוליך למחצה משלימה מדעית של תחמוצת מתכת (sCMOS), וחממה לשליטה בטמפרטורה, בלחות ובפחמן דו-חמצני. לקבלת מדריך למיקרוסקופיה פלואורסצנטית, עיין ב- 27.
תוצאות
היישום הנפוץ ביותר של טעינת חרוזים הוא להכניס סוג אחד או יותר של חלבון לתאים אנושיים חסידים. כדי להמחיש זאת, התאים היו עמוסים חרוזים עם פתרון של חלבון Fab מצומד Cy3 ו- Alexa488. למרות שלא כל תא במיקרווול היה טעון בחרדים, התאים שהיו טעונים כמעט תמיד היו גם חלבונים Cy3 וגם Alexa488 המסומנים יחד(איור 2A). על פי הערכה מוקדמת יותר, כאשר 0.5 מיקרוגרם של Fab מדולל ב 4 microliters הואחרוז טעון 29, כמו איור 2A, כל תא טעון עם בערך 106 מולקולות Fab.
Plasmid DNA קידוד GFP (1 מיקרוגרם של DNA plasmid, 1.8 μL של פתרון 557 ng / μL) ו 0.5 מיקרוגרם של Cy3-labeled Fab הוכנס גם לתאים באמצעות טעינת חרוזים ולאחר מכן התבטא ודמיין(איור 2B). פלואורסצנטיות GFP הצביעה על כך שפלסמיד קידוד GFP לא רק נטען לתאים אלא גם התבטא. לכן, באותו תא, טעינת חרוזים יכולה להציג בדיקה חלבון (למשל, Cy3-labeled Fab) וכתב plasmid (למשל, GFP), כפי שבוצע במעבדה זו בעבר22,23,24. קבענו כי 40% מהתאים היו עמוסים בחלבון Fab ו-21% מהתאים הטעונים על חרוזים הביעו את הפלסמיד הטעון המשותף, כפי שמוצג בשדות הראייה הייצוגיים באיור 2B. בדרך כלל, כל תא טעון עם 1-2 מיקרוגרם של plasmid, בערך באותה כמות כמו lipofection.
תאים עמוסי חרוזים מבטאים רמות שונות של פלסמידים(איור 2C,D). כדי למדוד זאת באופן ספציפי, השתמשנו בבדיקת פישר רציו כדי להשוות את ההפצות של נתוני עוצמת החלבון והפלסטיד. התוצאות הראו כי למרות חלבונים 1 ו 2 היו התפלגות עוצמה דומה (p = ~ 1), כל חלבון היה התפלגות קטנה משמעותית מאשר plasmid (p = 3.2e-6 ו 1.8e-5). למרות שזה יכול להיות בגלל שונות כמה plasmids נטענים לכל תא, המקור הגדול יותר של שונות עשוי לנבוע מן השלבים הרבים הנדרשים עבור ביטוי plasmid שעשויים להשתנות מאוד בין תאים, כולל ייבוא לתוך גרעין התא, שעתוק, ותרגום. לעומת זאת, רמות החלבונים הטעונים בחרוזים היו שונות קלה בין תאים לתא, ורמות שני חלבונים טעונים בו זמנית היו מתואמות מאוד זה עם זה(איור 2D,E).
ביטוי Plasmid ניתן לראות כבר 2-4 שעות לאחר טעינת חרוזים, אך עשוי להתרחש מאוחר יותר בהתאם מתי מתקבל ביטוי plasmid אופטימלי. אנו ממליצים לבצע קורס זמן כדי לקבוע את חלון הביטוי הטוב ביותר עבור פלסמיד ספציפי המשתרע על פני 2-24 שעות לאחר טעינת חרוזים. זה יכול להיעשות בתא אחד עם הדמיה מסגרת זמן ארוכה או על ידי טעינת חרוזים ותאים מרובים מדהים. תאים עמוסי חרוזים נשארים דבקים ובריאים מספיק כדי לגדול ולחלק. תאי U2OS אנושיים עמוסי חרוזים צולמו ישירות לפני, מיד לאחר מכן, ו-24 שעות לאחר טעינת חרוזים. לטעינת חרוזים נכונה לא הייתה כמעט השפעה ניכרת על מספר התאים או על המורפולוגיה שלהם, כפי שמוצג באיור 3A (משמאל, באמצע).
לעומת זאת, טעינת חרוזים גרועה עם יותר מדי חרוזים וכוח הקשה מוגזם מתוארת באיור 3B. זה גרם לאובדן תאים רב (כתמים גדולים של שעון הכיסוי ללא תאים ותאים מנותקים, צפים, מחוץ לפוקוס), מורפולוגיה לקויה של תאים (תאים המופיעים מעוגלים ודבקים בצורה גרועה), ואשכולות של חרוזים שנותרו על שעון הכיסוי לאחר טעינת חרוזים. למרות שהתאים נחשבים לנזק מכני במהלך טעינת חרוזים, התאים גדלו והתרבו בתא הטעון כראוי, כפי שמעיד המספר המוגבר של תאים 24 שעות לאחר טעינת חרוזים (איור 3A,נכון). ניתן להעריך את ההשפעה על הכדאיות של התא באמצעות מגוון של עשיות, כגון 3-(4,5-דימתילתיאזול-2-yl)-2,5-דיפנילטטרזוליום ברומיד (MTT) , כדי להשוות חרוזים טעונים לתאים טעונים מדומה30. יתר על כן, עבודה זו והקודמת מראות כי התאים הטעונים בחרוזים עוברים חלוקת תאים (איור 3C וסרטון משלים 1), ותזמון המיטוזה אינו מושפע מטעינת חרוזים31,המשמשת כראיה נוספת לבריאות התא המתמשכת לאחר טעינת חרוזים.
טעינת חרוזים היא טכניקה רב-תכליתית, המתאימה למספר קווי תאים דבקים ומקרומולקולים שונים. כאן, מגוון זה הוכח על ידי טעינת קווי תא RPE1 ו- HeLa עם Fab (איור 4A,B). טבלה 1 מספקת דוגמאות נוספות לטעינת חרוזים בשורות תאים שונים, במעבדה זו ומעבר לה, ומצביעה על כמה מההבדלים הניואנסים בין פרוטוקולי טעינת חרוזים ממעבדות אחרות. ראוי לציין, הקוטר של חרוזי זכוכית המשמשים לטעינה משתנה מאוד בין מעבדות, אם כי הטעינה היעילה ביותר נמצאה עבור חרוזים קטנים, בקוטר 75 מיקרומטר בכמה שורות תא14. יתר על כן, מעבדה זו החלה חרוז טעינת RNA גם כן (נתונים לא הראו). איור 4C מציג תא U2OS מייצג טעון עם צימק 9mer Cy5-RNA ו- Cy3-DNA 28mer יחד.
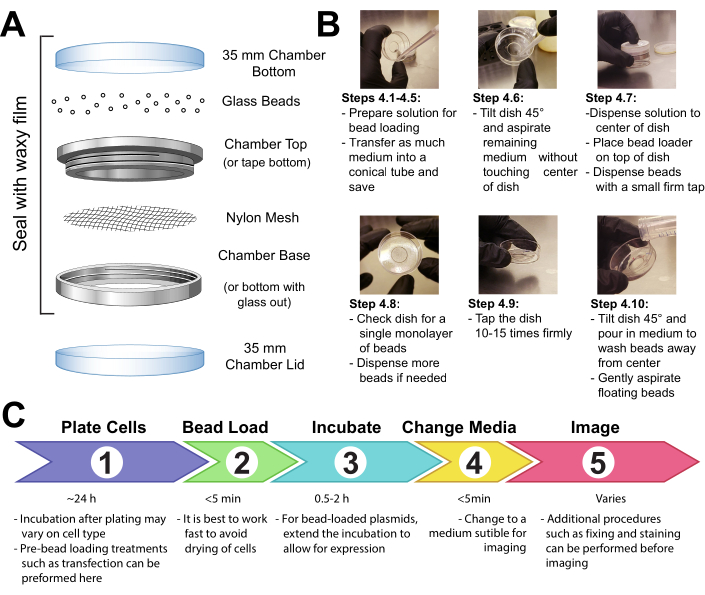
איור 1: מנגנון טעינת חרוזים, טכניקה וציר זמן אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
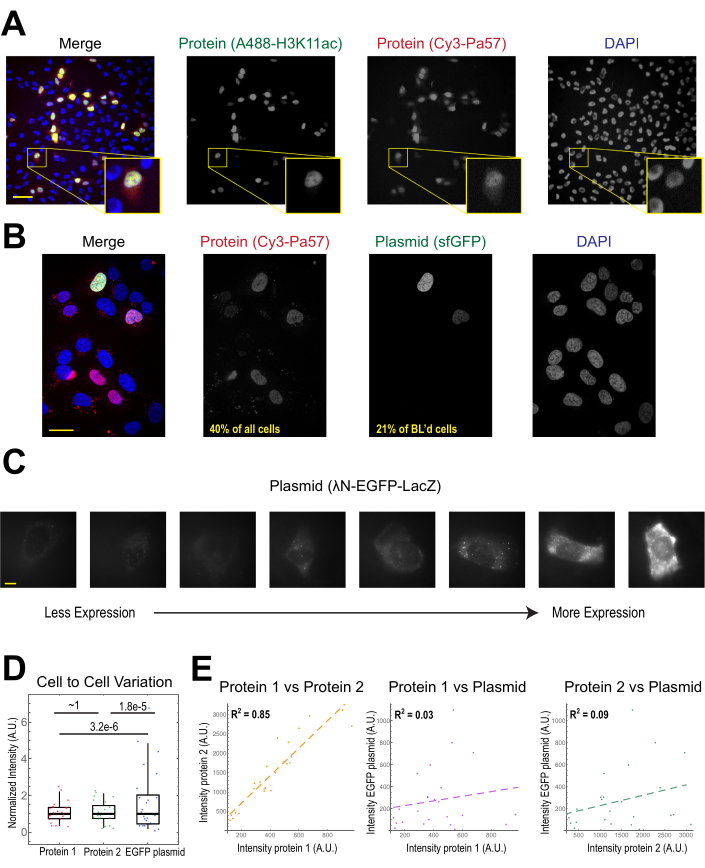
איור 2. טעינת חרוזים מציגה שונות נמוכה בריכוז החלבון אך שונות גבוהה בביטוי פלסמיד. (A)תאים היו עמוסים חרוזים עם 0.5 מיקרוגרם של כל אחד Alexa488-מצומד נגד H3K27 אצטיל Fab (ירוק) ו Cy3-מצומד אנטי RNAPII-Serine 5-זרחן Fab (אדום) ב 4 μL של פתרון טעינת חרוזים. התאים היו מוכתמים ב- DAPI (כחול) ולאחר מכן צולמו באופן מיידי. מוטות קנה מידה = 20 מיקרומטר. (B)תאים היו עמוסים חרוזים עם 0.5 מיקרוגרם של חלבון Fab (Cy3-מצומד נגד RNAPII-Serine 5-זרחן חלבון, אדום) ו 1 מיקרוגרם של תיקיית-על קידוד plasmid GFP-H2B (ירוק) ב 4 μL של פתרון טעינת חרוזים. לאחר 24 שעות, התאים היו מוכתמים DAPI (כחול) ותמונה חיה. חטיפי קנה מידה = 30 מיקרומטר. (C-E) חלבון 1 (JF646-HaloLigand-Label-MCP), חלבון 2 (Cy3-מצומד נגד דגל Fab), ו EGFP קידוד פלסמיד (λN-EGFP-LacZ) היו חרוזים טעונים יחד לתאים. העוצמה הכוללת בכל ערוץ פלואורסצנטי נמדדה בתיקון 1.3 x 1.3 מיקרומטר בציטופלסמה של כל תא. N = 25 תאים. (C)תאים מייצגים המבטאים את הפלסמיד טעון החרוזים, λN-EGFP-LacZ. אותם תנאי הדמיה ועוצמות שימשו עבור כל התאים. כתמים הם אגרגטים של החלבון המבוטא. מוטות קנה מידה = 10 מיקרומטר. (D)התרשים מציג את העוצמה הכוללת של כל תא של חלבון 1, חלבון 2 או EGFP המבוטא מהפלסטיד. כל ערוץ היה מנורמל לחציון. ערכי P מתוקנים בונפרוני חושבו על ידי בדיקת פישר רציו כדי לקבוע אם התפלגות נתוני עוצמת החלבון או הפלסמיד יש את אותה שונות. כל נקודה מייצגת תא. (E)עוצמות הכוללות של שני החלבונים, החלבון 1 והפלסטיד, או החלבון 2 והפלסטיד, זוממות זו נגד זו. ערכי R2 מחושבים מוצגים. כל נקודה מייצגת תא. קיצורים: DAPI = 4′,6-דיאמידינו-2-פנילינדול; EGFP = חלבון פלואורסצנטי ירוק משופר; A.U. = יחידות שרירותיות; MCP = חלבון מעיל MS2; RNAPII = RNA פולימראז II. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
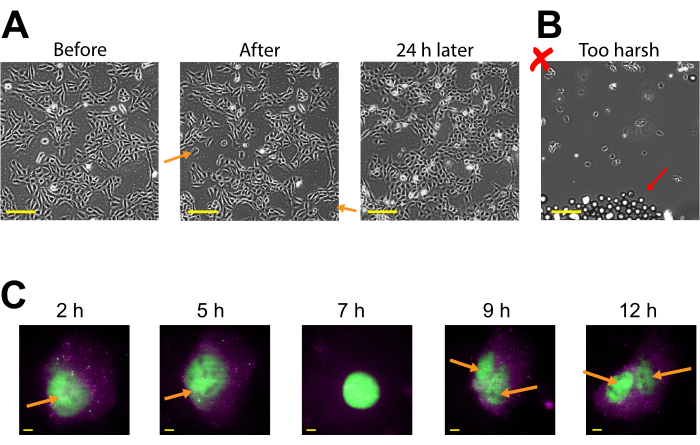
איור 3: תאים עמוסי חרוזים נשארים דבקים ובריאים מספיק כדי לגדול ולחלק. (A)תאי U2OS היו עמוסים ב-0.5 מיקרוגרם של Cy3-מצומד נגד FLAG Fab ב-4 מיקרו-לן של פתרון טעינת חרוזים. התאים צולמו ישירות לפני, מיד לאחר טעינת חרוזים, ו 24 שעות לאחר טעינת חרוזים. חצים כתומים מזהים אזורים שבהם תאים מתקלפים במהלך טעינת חרוזים. סרגלי קנה מידה = 2 מ"מ. (B)תמונה מייצגת של תאי U2OS עמוסים ברכיבים מ- (A) אך עם הקשה קשה וחרוזים רבים מדי. החץ האדום מזהה חרוזי זכוכית נוספים. סרגל קנה מידה = 2 מ"מ. (C)תאי U2OS נטענו עם 1.5 מיקרוגרם של 14.4 kbp plasmid smFLAG-KDM5B-15xBoxB-24xMS2, 0.5 מיקרוגרם של Cy3-מצומד נגד דגל Fab (ירוק), 130 ננוגרם של HaloTag-MCP (מגנטה) ב 8 μL של פתרון טעינת חרוזים. ממש לפני ההדמיה, ההילה-טאג היה מוכתם ב- JF646-HaloLigand. לולאות הגזע MS2 של ה- mRNA המתומללות מהכתב פלסמיד מסומנות על ידי MCP (כתמי מגנטה), וחלבון הכתב המתורגם בתרגום FLAG מסומן על ידי אנטי-FLAG Fab (קולוקליזציה ירוקה ל- mRNA). חלבון בוגר עם תווית פאב ממקם את הגרעין. תא זה היה בתמונה 4-15 שעות לאחר טעינת חרוזים. חצים צהובים מזהים את גרעין התא לפני ואת הגרעינים לאחר חלוקת התא. סרגלי קנה מידה = 5 מיקרומטר. קיצור: MCP = חלבון מעיל MS2. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
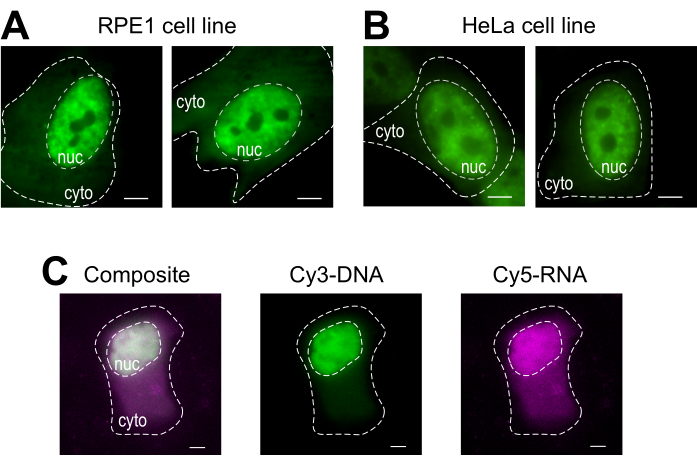
איור 4: וריאציות בחומר הטעינה של סוג התא של פרוטוקול טעינת החרוזים. (א-ב) תאי RPE1 (A) ו- HeLa(B)היו עמוסים ב-1.5 מיקרוגרם של חלבון Fab גרעיני (אנטי-RNAPII-Serine 5-זרחן) ב-4 מיקרו-לן של פתרון טעינה. גרעין כל תא (nuc) וציטופלזם (ציטו) מסומנים. תאים צולמו 6 שעות לאחר שנטענו על ידי חרוזים. מוטות קנה מידה = 5 מיקרומטר. (C)תאי U2OS אנושיים היו עמוסים חרוזים הן Cy5-RNA 9mer (מגנטה) והן Cy3-DNA 28mer (ירוק) אוליגוס, 10 פיקומולים של כל אחד, ב 4 μL של פתרון טעינת חרוזים. תאים צולמו 4 שעות לאחר שנטענו על ידי חרוזים. כל גרעיני התא מסומנים על-ידי קו מקווקו. סרגלי קנה מידה = 5 מיקרומטר. קיצורים: RNAPII = RNA פולימראז II. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
| שורת תא | סוג תא | יעילות טעינת חרוזים | הערות/הפניה |
| תאי גזע (אנושיים) | תאי גזע עובריים | קשה | *תאים רבים מתקלפים במהלך טעינת חרוזים אם מצופים על צלחות מצופות ג'לטין |
| HEK 293 | תאי כליה עובריים אנושיים | קשה | *צריך להניח מטריצת ג'ל לפני טעינת החרוזים. הקש בעדינות בעת טעינת חרוזים בהתחלה. |
| נוירונים (חולדה) | נוירונים עובריים ראשוניים (e-18), מנותקים | מאוד לא יעיל | *טעינת חרוזים יעילה של נוירונים לא נצפתה באמצעות פרוטוקול טעינת חרוזים סטנדרטי זה. זה יכול להיות בגלל האופי הלא דבק של נוירונים או מנזק כתוצאה מכך לתהליכים עצביים. |
| MDCK (כלב) | תאי כליות של כלבים מאדין-דארבי | ראה מקניל ווורדר (1987)14 | *טעינת חרוזים ביעילות נמוכה14 |
| U2OS (אנושי) | אוסטאוסרקומה | פרוטוקול טעינת חרוזים סטנדרטי | |
| הלה (אנושי) | סרטן צוואר הרחם | פרוטוקול טעינת חרוזים סטנדרטי | |
| RPE1 (אנושי) | תאי אפיתל מונצחים עם hTERT | פרוטוקול טעינת חרוזים סטנדרטי | |
| HFF (אנושי) | פיברובלסטים מעורלה ראשונית | ראה בסטיירו ואח ' (2009)31 | *פרוטוקול הטיה שונה במקום הקשה על31 |
| BALB/c 3T3, NIH 3T3 ו-Swiss 3T3 (עכבר) | פיברובלסטים עובריים | ראה גילמור ורומר (1996)32, אמרסון ואח ' (2014)33 ומקניל ווורדר (1987)14 | *425-600 חרוזי זכוכית מיקרומטרדיווחו 32 |
| *200-300 מיקרומטר חרוזי זכוכית33 | |||
| *חרוזי זכוכית 75 מיקרומטר נתנו תוצאות טובות יותר מ 400 מיקרומטר14 | |||
| DM (מונטג'אק הודי) | פיברובלסטים לעור | ראה מנדרס, קימורה וקוק (1999)34 | |
| צ'ו (אוגר) | תאי שחלות דמויי אפיתל | ראה מדולה ובלמונט (2003)35 | *425-600 מיקרומטר חרוזי זכוכית35 |
| BAE (שור) | תאי אנדותל אבי העורקים בקר (BAEC-11) | ראה מקניל ווורדר (1987)14 | *חרוזי זכוכית 75 מיקרומטר נתנו תוצאות טובות יותר מ 400 מיקרומטר14 |
| PtK-2 (פוטומוס טרידקליליס) | תאי כליה אפיתל | ראה מקניל ווורדר (1987)14 | *חרוזי זכוכית 75 מיקרומטר נתנו תוצאות טובות יותר מ 400 מיקרומטר14 |
| HUVEC (אנושי) | תאי אנדותל וריד טבור | ראה גילמור ורומר (1996)32 | *425-600 מיקרומטר חרוזי זכוכית32 |
| J774 ו- J774.2 (עכבר) | תאי מקרופאג' מונוציטים | ראה בקר ואח ' (2005)36 ומקניל ווורדר (1987)14 | *תסיסה עדינה (במקום הקשה) וחרוזי זכוכית 425-600 מיקרומטר36 |
| MS-5 (עכבר) | תאי מח עצם סטרומיים | ראה מולנאר ואח' (2003)37 | |
| WPE1-NB11 (אנושי) | תאי אפיתל הערמונית | ראה גילמור ורומר (1996)32 ו | *425-600 מיקרומטר חרוזי זכוכית32 |
| אמרסון ואח' (2014)33 | *200-300 מיקרומטר חרוזי זכוכית33 |
טבלה 1: טעינת חרוזים בשורות תאים שונים. עבור שורות התא שעדיין לא נטענו במעבדה זו, הפניות והערות על וריאציות בפרוטוקול מסופקות.
וידאו משלים 1: דוגמה לתא טעון חרוזים העובר חלוקת תאים. תאי U2OS נטענו עם 1.5 מיקרוגרם של 14.4 kbp plasmid smFLAG-KDM5B-15xBoxB-24xMS2, 0.5 מיקרוגרם של Cy3-מצומד אנטי-FLAG Fab (ירוק), 130 ננוגרם של HaloTag-MCP (מגנטה) ב 8 μL של פתרון טעינת חרוזים. ממש לפני ההדמיה, ההילה-טאג היה מוכתם ב- JF646-HaloLigand. לולאות הגזע MS2 של ה- mRNA המתומללות מהכתב פלסמיד מסומנות על ידי MCP (כתמי מגנטה), וחלבון כתב מתורגם מתויג על ידי FLAG מסומן באמצעות אנטי-FLAG Fab (קולוקליזציה ירוקה ל- mRNA). חלבון בוגר עם תווית פאב ממקם את הגרעין. תא זה היה בתמונה 4-15 שעות לאחר טעינת חרוזים. סרגל קנה מידה = 10 מיקרומטר. קיצור: MCP = חלבון מעיל MS2. אנא לחץ כאן כדי להוריד וידאו זה.
Discussion
טכניקת טעינת החרוזים המתוארת כאן היא שיטה חסכונית וחסכונית בזמן להכנסת מקרומולקולים וחלקיקים אחרים לתאים דבקים. תהליך רב-תכליתי זה יכול לטעון חלבון (איור 2A)15,16,26,27, שילוב של חלבון ו plasmids ( איור2B,C)22,25, RNA ( איור4C), 100 ו 250 ננומטר חרוזים פוליסטירן (התכתבות אישית), צבעים סינתטיים39 או נקודות קוונטיות34,40 . טעינת חרוזים עשויה להיות היכולת לטעון סוגים אחרים של חלקיקים בלתי חדירים ממברנה גם כן. היישום הנפוץ ביותר שלה הוא לטעינת נוגדנים או Fabs כדי למקד אפיטופים אנדוגניים, כגון שינויים לאחר תרגום (PTMs), לתאים חיים. מטרות, כגון PTMs, לעתים קרובות קשה לתייג בתאים חיים ללא מבוסס PTM ספציפי, גנטית מקודד בדיקות41,42. לעומת זאת, טעינת חרוזים יכולה להכניס סוגים מרובים של בדיקות, כתבים או כלים מולקולריים אחרים יחד לאותו תא לניטור קריאות מרובות בו זמנית. אנו צופים כי טעינת חרוזים תהיה טכניקה שימושית לטעינת מגוון של macromolecules או חלקיקים.
יתרון מרכזי של טעינת חרוזים הוא העלות הנמוכה: כל ניסוי עולה פחות מ 0.01 USD. ניתן נעשה בקלות באמצעות חומרים זולים שעולים בסך הכל ~ $ 150, וזה פחות יקר באופן משמעותי מכל שיטת טעינת תאים אחרת. ניתן להפחית עוד יותר את עלותו של מנגנון מטעין חרוזים אל מתחת ל-10 דולר על ידי החלפת תא המתכת לשימוש חוזר בתא פלסטיק. בשביל זה, או לקדוח חור בתא 35 מ"מ או להסיר את הזכוכית מתא זכוכית 35 מ"מ תחתון, ולאחר מכן להדק את הרשת במקום עם סרט. במקום מנגנון, טעינת חרוזים יכולה אפילו להתבצע באמצעות קצה פיפטה רחב נשא 1000 μL כדי לסקופ ומפזרים חרוזים על תאים, אם כי וריאציה זו מקשה על מפזרים monolayer של חרוזים על תאים (שלב 4.6).
יתרון נוסף של טעינת חרוזים הוא שהתאים יכולים לשמור על מורפולוגיה כללית נורמלית, להתאושש במהירות ולהמשיך לגדול ולחלק, לפחות עבור תאי U2OS, RPE1 ו- HeLa שנחקרו כאן ולקווי התאים האחרים שנחקרו במקומות אחרים (איור 3; איור 4א,ב'; וידאו משלים 1; ושולחן 1)31. במהלך טעינת חרוזים, תאים עוברים לחץ פיזי ולפעמים מחלצים ומתקלפים (כ -5% מהתאים מתקלפים בתנאים אופטימליים, אך אובדן תאים גדול יותר יכול לקרות אם טעינת חרוזים מבוצעת בעוצמה רבה מדי או יותר מדי חרוזי זכוכית נטענים על גבי התאים, כפי שמתואר באיור 3B). עם זאת, תאים עמוסי חרוזים שנותרו מחוברים לכיסוי נראים בדרך כלל בריאים וניתן לדמיין אותם כבר 30 דקות לאחר טעינת חרוזים (איור 3A). בדרך כלל אנו מאפשרים לתאים תקופת התאוששות של 30 דקות, אך צופים כי הדמיה מוקדמת יותר לאחר טעינת חרוזים היא אפשרית.
החיסרון העיקרי של טכניקה זו הוא שהתאים צריכים להיות מסוגלים לעמוד בלחץ פיזי קל במהלך הטעינה ולהישאר דבקים בבטחה בכיסוי. קווי תאים או תאים לא דבקים/לא דבקים הגדלים על לוחות מצופים (למשל, HEK ותאי גזע) מתנתקים לעתים קרובות בעת הקשה עדינה במהלך טעינת חרוזים. יתר על כן, הניסיון הראה כי נוירונים ראשוניים רגישים מדי עבור טעינת חרוזים.
טעינת חרוזים מתאימה ביותר לניסויים חד-תאיים או חד-תאיים. מניסיוננו, טעינת חרוזים יש בערך 20-40% יעילות טעינת חלבון, ~ 20% של תאים חרוזים גם ביטא plasmid טעון במשותף (איור 2A,B). לכן, פלסמידים טעינת חרוזים עשוי להיות פחות יעיל עבור ביטוי חלבון מאשר חרוז טעינת חלבונים מטוהרים כי plasmids חייב לא רק להיכנס לתאים אלא גם לבוא לידי ביטוי (אשר כרוך, בין היתר, ייבוא גרעיני, שעתוק, ותרגום, כל אחד מהם יכול להפחית את יעילות הביטוי). ניתן לעקוף את היעילות הנמוכה של ביטוי פלסמיד טעון חרוזים באמצעות פרוטוקולי טרנספקטיון חלופיים, כגון ליפופקטיון, לפני טעינת חלבונים או בדיקות16,27. בנוסף, דגירה של תאים במדיה אופטימלית למשך 30 דקות לפני טעינת חרוזים עשויה לסייע בביטוי פלסמיד. בשל ביטוי פלסמיד נמוך, טעינת חרוזים לא שימשה לעתים קרובות כחלופה transfection מבוסס ליפופקטיון במעבדה זו. היוצא מן הכלל היחיד הוא כאשר חלבון מטוהר, כגון Fab, הוא להיות טעון במשותף, ובמקרה זה זה די נוח לחרוז-לטעון את החלבון plasmid באותו זמן. יתר על כן, עבור תאים שאינם מגיבים או סובלניים ליפופקטיון, טעינת חרוזים עשויה לספק שיטה חלופית, אם כי יעילות נמוכה, לביטוי פלסמיד חולף.
Disclosures
למחברים אין ניגודי עניינים לחשוף.
Acknowledgements
אנו מודים לחברי מעבדת סטסביץ' על אינספור שיחות שעזרו לשפר ולפתח פרוטוקול זה. באופן ספציפי, ד"ר לינדה פוררו וד"ר פיל פוקס לעצה על חרוזים טעינת סוגי תאים שונים. ברצוננו להודות מקרב לב לד"ר יוקו היאשי-טקאנאקה, ד"ר יוקו סאטו וד"ר הירושי קימורה על ששיתפו את פרוטוקול טעינת חרוזי הזכוכית שלהם. אנו מודים מאוד לד"ר אשוק פראסאד וד"ר דייגו קראף על ששיתפו בנדיבות את פרוטוקולי טעינת החרוזים שלהם להכנסת חלקיקים אנאורגניים לתאים. אנו מודים לד"ר טראוויס סנדרס, קרייג מרשל וד"ר תומאס סנטאנג'לו על ששיתפו בנדיבות את ריאגנט הרנ"א שלהם. ALK, MNS, CAC, GG ו- TJS נתמכו על ידי מענק המכונים הלאומיים לבריאות (NIH) R35GM119728 ומענק הקריירה של הקרן הלאומית למדע (NSF) MCB-1845761, שניהם ל- TJS. CAC נתמך גם על ידי פרס NSF NRT DGE-1450032.
Materials
| Name | Company | Catalog Number | Comments |
| 10 cm cell culture dishes | VWR | 82050-916 | Use to culture cells |
| 35 mm cell culture dishes | Falcon | 353001 | Use to construct bead loader |
| Attofluor Cell Chamber | Thermo Fisher Scientific | A7816 | Use to construct the custom bead loader |
| DMEM, high glucose, no glutamine | Thermo Fisher Scientific | 11960069 | Use in general cell culture |
| Drierite Indicating Absorbents | Thermo Fisher Scientific | 07-578-3B | Store the bead loader in a desiccator with these absorbent pellets |
| Fetal Bovine Serum | Atlas Biologics | F-0050-A | Use in general cell culture and as a supplement before bead loading |
| Glass beads, acid washed, ≤106 µm* | Millipore Sigma | G4649 | Sprinkle on cells to bead load plasmid DNA and proteins |
| Glass bottom dishes, 35 mm, #1.5, 14 mm glass | MatTek Corporation | P35G-1.5-14-C | Seed cells onto these chambers for imaging |
| L-Glutamine-200 mM | Thermo Fisher Scientific | 25030081 | Use to make DMEM + media |
| Opti-MEM, Reduced Serum Medium | Thermo Fisher Scientific | 31985070 | Optimal media for incubating cells before bead loading (optional step) |
| Parafilm | VWR | 52858-032 | waxy film used to construct bead loader |
| Penicillin-Streptomycin | Thermo Fisher Scientific | 15140-122 | Use to make DMEM + media |
| Phenol-free DMEM | Thermo Fisher Scientific | 31053036 | Use on cells before imaging |
| Phosphate Buffered Saline (PBS) | Thermo Fisher Scientific | AM9625 | Working stock of sterile 1X PBS |
| Sodium Hydroxide (NaOH) | Thermo Fisher Scientific | S318-500 | Use 2 M solution to wash glass beads |
| Spectra Mesh Woven Filters, Polypropylene, 105 µm opening | Spectrum Labs | 148496 | Use to construct bead loader |
| Trypsin | Thermo Fisher Scientific | 25300062 | Use in general cell culture |
References
- Stewart, M. P., et al. In vitro and ex vivo strategies for intracellular delivery. Nature. 538 (7624), 183-192 (2016).
- Felgner, P. L., et al. Lipofection: a highly efficient, lipid-mediated DNA-transfection procedure. Proceedings of the National Academy of Sciences of the United States of America. 84 (21), 7413-7417 (1987).
- Schenborn, E. T., Goiffon, V. DEAE-dextran tansfection of mammalian cultured cells. Methods in Molecular Biology. 130, 147-153 (2000).
- Celis, J. E. Microinjection of somatic cells with micropipettes: comparison with other transfer techniques. Biochemical Journal. 223 (2), 281-291 (1984).
- Chakrabarti, R., Wylie, D. E., Schuster, S. M. Transfer of monoclonal antibodies into mammalian cells by electroporation. Journal of Biological Chemistry. 264 (26), 15494-15500 (1989).
- Wilson, A. K., Horwitz, J., De Lanerolle, P. Evaluation of the electroinjection method for introducing proteins into living cells. American Journal of Physiology. 260 (2), 355-363 (1991).
- Potter, H. Transfection by electroporation. Current Protocols in Molecular Biology. 62 (1), 1-6 (2003).
- Fawell, S., et al. Tat-mediated delivery of heterologous proteins into cells. Proceedings of the National Academy of Sciences of the United States of America. 91 (2), 664-668 (1994).
- Prior, T. I., FitzGerald, D. J., Pastan, I. Translocation mediated by domain II of Pseudomonas exotoxin A: transport of barnase into the cytosol. Biochemistry. 31 (14), 3555-3559 (1992).
- Walev, I., et al. Delivery of proteins into living cells by reversible membrane permeabilization with streptolysin-O. Proceedings of the National Academy of Sciences of the United States of America. 98 (6), 3185-3190 (2001).
- Pitchiaya, S., Androsavich, J. R., Walter, N. G. Intracellular single molecule microscopy reveals two kinetically distinct pathways for microRNA assembly. EMBO Reports. 13 (8), 709-715 (2012).
- McNeil, P. L., Murphy, R. F., Lanni, F., Taylor, D. L. A method for incorporating macromolecules into adherent cells. The Journal of Cell Biology. 98 (4), 1556-1564 (1984).
- Ortiz, D., Baldwin, M. M., Lucas, J. J. Transient correction of genetic defects in cultured animal cells by introduction of functional proteins. Molecular and Cellular Biology. 7 (8), 3012-3017 (1987).
- McNeil, P. L., Warder, E. Glass beads load macromolecules into living cells. Journal of Cell Science. 88 (5), 669-678 (1987).
- Hayashi-Takanaka, Y., et al. Tracking epigenetic histone modifications in single cells using Fab-based live endogenous modification labeling. Nucleic Acids Research. 39 (15), 6475-6488 (2011).
- Morisaki, T., et al. Real-time quantification of single RNA translation dynamics in living cells. Science. 352 (6292), 1425-1429 (2016).
- Tanenbaum, M. E., Gilbert, L. A., Qi, L. S., Weissman, J. S., Vale, R. D. A protein-tagging system for signal amplification in gene expression and fluorescence imaging. Cell. 159 (3), 635-646 (2014).
- Zhao, N., et al. A genetically encoded probe for imaging nascent and mature HA-tagged proteins in vivo. Nature Communications. 10 (1), 2947(2019).
- Jedlitzke, B., Mootz, H. D. Photocaged nanobodies delivered into cells for light activation of biological processes. ChemPhotoChem. 5 (1), 22-25 (2021).
- Coulon, A., et al. Kinetic competition during the transcription cycle results in stochastic RNA processing. eLife. 3, 03939(2014).
- Pichon, X., Robert, M. -C., Bertrand, E., Singer, R. H., Tutucci, E. New generations of MS2 variants and MCP fusions to detect single mRNAs in living eukaryotic cells. Methods in Molecular Biology. 2166, 121-144 (2020).
- Koch, A., et al. Quantifying the dynamics of IRES and cap translation with single-molecule resolution in live cells. Nature Structural & Molecular Biology. 27, 1095-1104 (2020).
- Moon, S. L., et al. Multicolor single-molecule tracking of mRNA interactions with RNP granules. Nature cell biology. 21 (2), 162-168 (2019).
- Moon, S. L. Coupling of translation quality control and mRNA targeting to stress granules. Journal of Cell Biology. 219 (8), 202004120(2020).
- Cialek, C. A., et al. Imaging translational control by Argonaute with single-molecule resolution in live cells. bioRxiv. , (2021).
- Forero-Quintero, L. S., et al. Live-cell imaging reveals the spatiotemporal organization of endogenous RNA polymerase II phosphorylation at a single gene. bioRxiv. , (2020).
- Lyon, K., Aguilera, L. U., Morisaki, T., Munsky, B., Stasevich, T. J. Live-cell single RNA imaging reveals bursts of translational frameshifting. Molecular Cell. 75 (1), 172-183 (2019).
- JoVE. Introduction to Fluorescence Microscopy. General Laboratory Techniques. JoVE Science Education Database. , JoVE. Cambridge, MA. (2021).
- Hayashi-Takanaka, Y., Yamagata, K., Nozaki, N., Kimura, H. Visualizing histone modifications in living cells: spatiotemporal dynamics of H3 phosphorylation during interphase. Journal of Cell Biology. 187 (6), 781-790 (2009).
- Kumar, P., Nagarajan, A., Uchil, P. D. Analysis of cell viability by the MTT assay. Cold Spring Harbor Protocols. 2018 (6), (2018).
- Stasevich, T. J., et al. Regulation of RNA polymerase II activation by histone acetylation in single living cells. Nature. 516 (7530), 272-275 (2014).
- Besteiro, S., Michelin, A., Poncet, J., Dubremetz, J. -F., Lebrun, M. Export of a Toxoplasma gondii rhoptry neck protein complex at the host cell membrane to form the moving junction during invasion. PLOS Pathogens. 5 (2), 1000309(2009).
- Gilmore, A. P., Romer, L. H. Inhibition of focal adhesion kinase (FAK) signaling in focal adhesions decreases cell motility and proliferation. Molecular Biology of the Cell. 7 (8), 1209-1224 (1996).
- Emerson, N. T., Hsia, C. -H., Rafalska-Metcalf, I. U., Yang, H. Mechanodelivery of nanoparticles to the cytoplasm of living cells. Nanoscale. 6 (9), 4538-4543 (2014).
- Manders, E. M. M., Kimura, H., Cook, P. R. Direct imaging of DNA in living cells reveals the dynamics of chromosome formation. Journal of Cell Biology. 144 (5), 813-822 (1999).
- Memedula, S., Belmont, A. S. Sequential recruitment of HAT and SWI/SNF components to condensed chromatin by VP16. Current Biology. 13 (3), 241-246 (2003).
- Becker, T., Volchuk, A., Rothman, J. E. Differential use of endoplasmic reticulum membrane for phagocytosis in J774 macrophages. Proceedings of the National Academy of Sciences of the United States of America. 102 (11), 4022-4026 (2005).
- Molenaar, C., et al. Visualizing telomere dynamics in living mammalian cells using PNA probes. The EMBO Journal. 22 (24), 6631-6641 (2003).
- Jones, S. A., Shim, S. -H., He, J., Zhuang, X. Fast, three-dimensional super-resolution imaging of live cells. Nature Methods. 8 (6), 499-505 (2011).
- Sabri, A., Xu, X., Krapf, W. M. Elucidating the origin of heterogeneous anomalous diffusion in the cytoplasm of mammalian cells. Physical Review Letters. 125 (5), 053901(2020).
- Sato, Y., et al. Genetically encoded system to track histone modification in vivo. Scientific Reports. 3, 2436(2013).
- Sato, Y., Stasevich, T. J., Kimura, H. Visualizing the dynamics of inactive X chromosomes in living cells using antibody-based fluorescent probes. X-Chromosome Inactivation. Methods in Molecular Biology. 1861, Humana. New York, NY, USA. 91-102 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved