A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מודל השתלת הינדימבה הטרוטופית חלקית בחולדות
* These authors contributed equally
In This Article
Summary
מאמר זה מציג פרוטוקול השתלת דש אוסטאומיו-עורית הטרוטופית חלקית בחולדות ותוצאותיו הפוטנציאליות במעקב אמצע הטווח.
Abstract
הקצאות מרוכבים וסקולריים (VCA) מייצגות את אפשרות השחזור המתקדמת ביותר עבור חולים ללא אפשרויות כירורגיות אוטולוגיות לאחר פגם מורכב ברקמה. השתלות פנים ויד שינו את חייהם של מטופלים מעוותים, והעניקו להם איבר חברתי אסתטי ותפקודי חדש. למרות התוצאות המבטיחות, VCA עדיין לא מתפקד כראוי עקב תחלואה חיסונית לכל החיים וסיבוכים זיהומיים. החולדה היא מודל חייתי אידיאלי למחקרי ויוו החוקרים מסלולים אימונולוגיים ומנגנוני דחייה של השתלים. חולדות נמצאות בשימוש נרחב גם בטכניקות שימור שתלים מרוכבים חדשניים, כולל זלוף ומחקרי הקפאה. מודלים המשמשים ל- VCA בחולדות חייבים להיות ניתנים לשחזור, אמינים ויעילים עם תחלואה ותמותה נמוכות לאחר הניתוח. הליכי השתלת גפיים הטרוטופיים עומדים בקריטריונים אלה וקלים יותר לביצוע מאשר השתלות גפיים אורתוטופיות. שליטה במודלים מיקרוכירורגיים של מכרסמים דורשת ניסיון מוצק במיקרו-כירורגיה ובטיפול בבעלי חיים. להלן הוא דיווח מודל אמין לשחזור של השתלת דש אוסטאומיו-עורית הטרוטופית חלקית בחולדות, התוצאות לאחר הניתוח, ואת האמצעים למניעת סיבוכים פוטנציאליים.
Introduction
במהלך שני העשורים האחרונים, VCA התפתח כטיפול מהפכני עבורחוליםהסובלים עיוות חמור כולל פנים 1 , קטיעות הגפיים העליונות2,הפין3,ופגמים מורכבים אחרים ברקמה4,5. עם זאת, ההשלכות של דיכוי חיסוני לכל החיים עדיין מעכבות יישום רחב יותר של ניתוחי שחזור מורכבים אלה. מחקר בסיסי חיוני לשיפור אסטרטגיות נגד דחייה. הגדלת זמן שימור VCA חיונית גם כדי לשפר את לוגיסטיקת ההשתלה ולהגדיל את מאגר התורמים (כמו תורמי VCA חייבים למלא יותר קריטריונים מאשר תורמי איברים מוצקים, כולל גוון העור, גודל אנטומי, מין). בהקשר זה, השתלות גפי חולדה נמצאים בשימוש נרחב במחקרים על הדחייה החיסונית של allografts6,7, פרוטוקולי אינדוקציהסובלנות חדשנית 8, ומחקרי שימור9,10,11. לפיכך, מודלים VCA אלה הם מרכיב מפתח לשלוט במחקר תרגום VCA.
מדפים אוסטאומיו-עוריים תוארו בספרות כמודלים אמינים לחקר VCA בחולדות8,12,13,14. למרות השתלות אורתוטופיות בכל הגפיים מאפשרות הערכה ארוכת טווח של תפקוד השתל, זהו הליך גוזל זמן הקשור לתחלואה גבוהה יותר לאחר הניתוח ושיעורי תמותה14. לעומת זאת, מודלים להשתלת גפיים הטרוטופית אינם פונקציונליים, אך מאפשרים מחקרים לשחזור ב- VCA. תוצאות לאחר הניתוח ניתן לצפות באופן אמין לפני תחילתו של מחקר השתלת VCA חולדה. מחקר זה מדווח על מודל השתלת דש אוסטאוטומיו-עורית חלקית בחולדה הכולל תוצאות וסיבוכים אפשריים תכופים שיכולים להתעורר תוך ניתוחית ולאחר הניתוח במהלך תקופת מעקב של שלושה שבועות.
Protocol
כל בעלי החיים קיבלו טיפול הומני בהתאם למדריך NIH לטיפול ושימוש בחיות מעבדה. הוועדה המוסדית לטיפול ושימוש בבעלי חיים (IACUC-protocol 2017N000184) והמשרד לבדיקת שימוש בבעלי חיים (ACURO) אישרו את כל הפרוטוקולים של בעלי חיים. חולדות לואיס זכר מלידה (250-400 גרם) שימשו לכל הניסויים.
1. ניתוח
- תירדים את חולדות לואיס באמצעות שאיפת איזופלוריין. לגרום להרדמה עם 5% איזופלוראן בתא האינדוקציה, ולשמור על הרדמה עם 1.5-3% שאיפת איזופלוראן דרך חרוט נשימה.
- יש למרוח חומר סיכה לעיניים לפני הניתוח בהליכי הישרדות. מגלחים את האתר הכירורגי, מטפלים בקרם דפילטורי, משפשפים ווילונות עם וילונות סטריליים.
- אשר הרדמה מלאה עם בדיקת צביטת הבוהן לפני ההסתה באופן קבוע במהלך ההליך. נטר את קצב הלב והנשימה לאורך כל ההליך. לכל הניתוחים, יש לשמור על תנאים סטריליים באמצעות מכשירים סטריליים, אספקה, וילונות וכפפות. עיין בטבלת החומרים לקבלת רשימת הכלים המשמשים להליכים.
2. רכש חלקי של זכות תורם
- לעשות פירוק היקפי של העור מעל הקרסול בשליש הדיסטלי של הרגל.
- שלד וצרוב את העורק הספני ואת הענף הסופי של העורק הפופליטי באמצעות מלקחיים דו קוטביים. לצרוב ולחתוך את הגסטרוקנמיוס, סולאוס, טיביאליס, שרירי עצם הירך עד לעצם הטיבית נחשפת.
- בצע 2.5 ס"מ קיסם בקמט מפשעתי ימין. לנתח את כרית השומן מפשעתי ולנטרל אותו distally לחשוף את כלי הירך. השתמש מפסק fishhook כדי לתפוס את הרצועה המעשרתית ואת מלקחיים הידוק להחזיק את כרית השומן מפשעתית distally.
הערה: כרית השומן המ מפשעתי כלולה בקציר הגפה החלקית. - לנתח את כלי הירך, להתאים אישית ענפי מרפי (ענפים בטחוניים שריריים עמוקים הממוקמים בדרך כלל באמצע הדרך בין הרצועה המגינית לענף האפיגסטרי), וליגת עם 8-0 קשרי ניילון.
- הפריניזציה החולדה התורמת עם 100 IU / קילוגרם הפרין, מוזרק בווריד גב הפין באמצעות מחט 27.5 G.
- השלם את רסיס העור סביב הירך.
- לצרוב את שרירי הזרוע ואת שרירי gluteus superficialis באמצעות מלקחיים דו קוטביים. לצרוב ולחתוך את העצב הסיאטי באורך הירך האמצעי. לחשוף את עצם הירך בסמיכות ברמה של פסגת הירך האחורית.
הערה: שרירי אדקטור ושרירי הארבע ראשי נשארים מחוץ לרכש. הפדיקור המנומנם נשמר. - כלי הירך ליגייט עם 8/0 קשרי ניילון ברמה של הרצועה המגינית. בצע עורקים על עורק הירך ממש מתחת לקשירה ולהרחיב כדי לאפשר החדרה של אנגיו-קטטר 24 G.
- לצרוב ולחתוך את השריר הנותר מתחת לפדיקור, לחשוף את הצד האחורי של עצם הירך.
- חותכים את השוקה ועצם הירך באמצעות חותך עצם קרוב ומנוצל ככל האפשר, בהתאמה (באורך בינוני).
- לשטוף את אחורי חלקית עם 2 מ"ל של תמיסת מלח הפרין (100 IU / mL) כדי להשיג זרימה ורידית ברורה. יש לאחסן על הקרח בגאזה סטרילית עד להעברת מיקרו-כלי דם(איור 1).
- בעוד החיה נמצאת תחת הרדמה כללית, לבצע המתת חסד על ידי דממה עד החיה מראה שום סימן של חיים (אין תנועה נשימתית ואין פעימות לב).

איור 1: עכברוש שנקטף חלקית. אנגיוקט 24 גרם מוכנס לעורק הירך, מוכן להעברת מיקרו-וסקולרית הטרוטופית. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
3. ניתוח נמען
- לפני החתך, לגלח את החלק האחורי של הצוואר, ולנהל buprenorphine 0.01-0.05 מ"ג / קילוגרם תת עורית. מניחים את החולדה בתנוחה על כרית חימום.
- בצע 2.5 ס"מ קיסם בקמט מפשעתי ימין. לנתח את כרית השומן מפשעתי ולהישען אותו distally לחשוף את כלי הירך. השתמש וו כדי לבטל את הרצועה המעשרית ואת מלקחיים הידוק להחזיק את כרית השומן מפשעתית distally.
- לנתח את כלי הירך, להתאים אישית את ענפי מרפי, ולגבש עם קשרי ניילון 8/0.
- ליגת את שני כלי הדם מעל כלי האפיגסטרי באמצעות 8/0 קשרי ניילון. מניחים מהדקי קירוב בסמיכות ומרחיבים את קצות כלי השיט; יש לשטוף עם תמיסת מלח הפרין.
- לעשות חתך באגף השמאלי מעל הירך, וליצור כיס תת עורי עם מנהרה תת עורית לקמט מפשעתי.
הערה: ההסתה נעשית מעל טווח התנועה של הירך כדי להבטיח כי החיה שומרת על תנועה אחורית נורמלית. בנוסף, שמירה על גשר עורי בין סבך השתל לאתר העברת המיקרו-כלי דם מאפשרת קיבוע טוב יותר של השתל(איור 2). - מניחים את החלק הפרוקסימלי של הגפה החלקית ואת כרית השומן המשתנה דרך המנהרה התת עורית להעברת מיקרו וסקולריים. בצע anastomoses ורידים ועורקים באמצעות תפרי ניילון 10/0. הסר את שני מלחצי הקירוב, ובחן revascularization של האיבר. בצע "בדיקת חליבה" על שני כלי הדם כדי להעריך את הפטישות של כל anastomosis.
הערה: שמונה עד תשעה תפרים נחוצים בדרך כלל עבור anastomosis ורידים, 6 תפרים בממוצע עבור anastomosis עורקים. - לעשות קיסם עור אורך בצד המתיווך של הגפה המושתלת, ולהכניס את השתל. הסר עור עודף של השתל, ולסגור את הפצע עם תפרים נפרדים תפר ריצה באמצעות תפרים 4/0 נספג.
- תפרו יחד את רפידות השומן המשתנה של הגפה המושתלת ואת המטופל באמצעות שני תפרים נספגים נפרדים, וסגרו את הקמט המשרתי בסוף ממש לאחר בדיקה אחרונה של אנסטומיזים מיקרווסקולריים.
הערה: רפידות שומן מפשעתיות נתפרות בחוזקה כדי להוסיף שכבת הגנה של שומן מעל anastomoses ולהבטיח מיקום מאובטח של השתל ואת הפדיקור שלה. סגירה קפדנית עדיפה על ריפוי פצעים; זה גם מונע דימום שיורית מהפצע ומקטין את הסיכון של השחתה עצמית. - לפצות על אובדן נוזלים תת עורית עם 1-3 מ"ל של מלוחים על פי כמות הדימום perioperative.
- מניחים צווארון אליזבתני סביב צוואר החיה, ומחילים 2 תפרים רופפים על העור כדי לשמור עליו בתנוחה הנכונה.
- הפסיקו את שאיפת האיזופלוראן, ועקבו אחר החיה ברציפות על משטח התחממות עד להכרה מלאה ואמבולטורית.
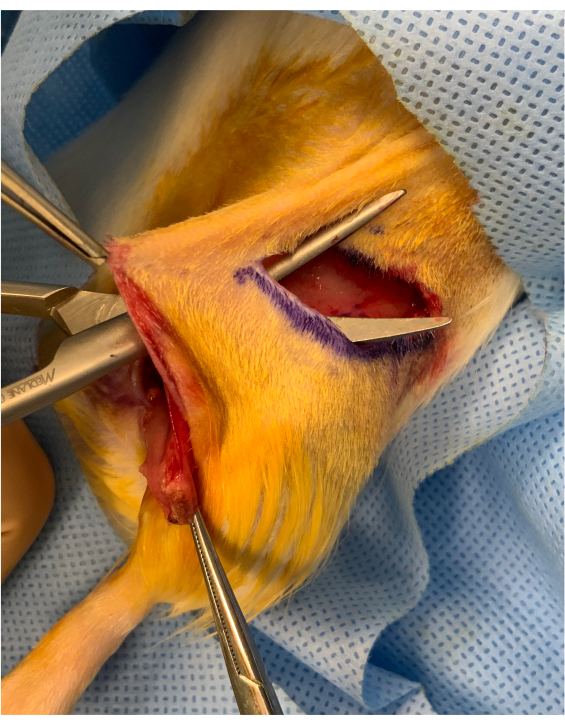
איור 2: תמונה פריופרטיבית לפני תחילת הגפה האוסטאומיו-עורית. גשר עורי של כ 1 ס"מ נשמר בין חתך קמט מפשעתי לבין תחילת השתל מעל הירך. השתל ממוקם מתחת לגשר, שמירה על יציבות להעברת מיקרווסקולרי. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
4. טיפול לאחר הניתוח
- לפקח על החיה פעמיים ביום במשך 72 שעות, ולאחר מכן פעם ביום עד יום לאחר הניתוח (POD) 7, ולאחר מכן פעמיים בשבוע.
הערה: יש להתאים את הניטור למצב החיה והשתל (עיניים חיוורות עשויות לדרוש נוזלים משלימים, כתמי פורפירין כאינדיקטור לכאב בעלי חיים, צבע / טמפרטורה של שתל חריג), ויש לדון בטיפול נוסף עם הווטרינר. דיור יחיד נדרש לחולדות המקבל במהלך כל תקופת הלימודים כדי למנוע כל נזק לשתל. - בצע משככי משכך משכך עם הזרקה תת עורית של buprenorphine ו/או תרופה אנטי דלקתית לא סטרואידים על פי הנחיות IACUC.
- להעריך את השתל, ולבצע בדיקה גופנית מדי יום עם תמונות באמצעות אותו מכשיר.
הערה: שימוש בקרם להסרת שיער על עור השתל מועיל להערכה טובה יותר של צבע העור של ההשתלה.
תוצאות
במחקר יחיד מפעיל זה, 30 השתלות גפיים חלקיות הטרוטופיות סינגני בוצעו. הצלחה הוגדרה ביום 21 לאחר הניתוח כהיעדר כישלון VCA או סיבוכים הדורשים המתת חסד. ההתפתחות הרגילה של השתל מיוצגת באיור 3. משך הזמן הממוצע לרכש חלקי של גפיים ושתלים בנמען היה 35 ו-105 דקות, בהתאמה; זמן האיסכמיה הממוצ...
Discussion
מודלים להשתלת גפיים אורתוטופיים במכרסמים תוארו בספרות15,16,17; עם זאת, הם דורשים תיקון עצבים, חיבור מחדש של השרירים, אוסטאוסינתזה מושלמת של עצם הירך, אשר יכול להיות צעד קשה מאוד. מודלים אלה קשורים גם עם שיעור תחלואה ותמותה גבוה יותר במכרסמים
Disclosures
למחברים אין גילויים.
Acknowledgements
עבודה זו נתמכה על ידי משרדו של עוזר שר ההגנה לענייני בריאות באמצעות תוכנית המחקר הרפואי בהנחיית הקונגרס תחת פרס מס '. W81XWH-17-1-0680. דעות, פרשנויות, מסקנות והמלצות הן של המחברים ואינן בהכרח מאושרות על ידי משרד ההגנה.
Materials
| Name | Company | Catalog Number | Comments |
| 24 GA angiocatheter | BD Insyte Autoguard | 381412 | |
| 4-0 suture Black monofilament non absorbable suture | Ethicon | 1667 | Used to suture the E-collar to the back of the neck |
| 4-0 suture Coated Vicryl Plus Antibacterial | Ethicon | VCP496 | |
| Adson Tissue Forceps, 11 cm, 1 x 2 Teeth with Tying Platform | ASSI | ASSI.ATK26426 | |
| Bipolar cords | ASSI | 228000C | |
| Black Polyamide Monofilament USP 10-0, 4 mm 3/8c | AROSurgical | T04A10N07-13 | Used to perform the microvascular anastomoses |
| Buprenorphine HCl | Pharmaceutical, Inc | 42023-179-01 | |
| Dilating Forceps | Fine science tools (FST) | 18131-12 | |
| Dissecting Scissors 15 cm, Round Handle 8 mm diameter, Straight Slender Tapered Blade 7 mm, Lipshultz Pattern | ASSI | ASSI.SAS15RVL | |
| Double Micro Clamps 5.5 x 1.5 mm | Fine science tools (FST) | 18040-22 | |
| Elizabethan collar | Braintree Scientific | EC-R1 | |
| Forceps 13.5 cm long, Flat Handle, 9 mm wide Straight Tips 0.1 mm diameter (x2) | ASSI | ASSI.JFL31 | |
| Halsey Micro Needle Holder | Fine science tools (FST) | 12500-12 | |
| Heparin Lock Flush Solution, USP, 100 units/mL | BD PosiFlush | 306424 | |
| Isoflurane | Patterson Veterinary | 14043-704-06 | |
| Jewelers Bipolar Forceps Non Stick 11 cm, straight pointed tip, 0.25 mm tip diameter | ASSI | ASSI.BPNS11223 | |
| Lone Star Elastic Stays | CooperSurgical | 3314-8G | Used to retract the inguinal ligament for femoral vessels dissection |
| Lone Star Self-Retaining Retractors | CooperSurgical | 3301G | |
| Micro-Mosquito Hemostats | Fine science tools (FST) | 13010-12 | Used to retract the inguinal fat pad distally |
| Needle Holder, 15 cm Round Handle, 8 mm diameter, Superfine Curved Jaw 0.2 mm tip diameter, without lock | ASSI | ASSI.B1582 | |
| Nylon Suture Black Monolfilament 8-0, 6.5 mm 3/8c | Ethilon | 2808G | Used to ligate collateral branches on the femoral vessels |
| Offset Bone Nippers | Fine science tools (FST) | 16101-10 | |
| S&T Vascular Clamps 5.5 x 1.5 mm | Fine science tools (FST) | 00398-02 | |
| Walton scissors | Fine science tools (FST) | 14077-09 |
References
- Lanteiri, L., et al. Feasibility, reproducibility, risks and benefits of face transplantation: a prospective study of outcomes. American Journal of Transplantation. 11 (2), 367-378 (2011).
- Park, S. H., Eun, S. C., Kwon, S. T. Hand transplantation: current status and immunologic obstacles. Experimental and Clinical Transplantation. 17 (1), 97-104 (2019).
- Cetrulo, C. L., et al. Penis transplantation: first US experience. Annals of Surgery. 267 (5), 983-988 (2018).
- Grajek, M., et al. First complex allotransplantation of neck organs: larynx, trachea, pharynx, esophagus, thyroid, parathyroid glands, and anterior cervical wall: a case report. Annals of Surgery. 266 (2), 19-24 (2017).
- Pribaz, J. J., Caterson, E. J. Evolution and limitations of conventional autologous reconstruction of the head and neck. Journal of Craniofacial Surgery. 24 (1), 99-107 (2013).
- Lipson, R. A., et al. Vascularized limb transplantation in the rat. I. Results with syngeneic grafts. Transplantation. 35 (4), 293-299 (1983).
- Lipson, R. A., et al. Vascularized limb transplantation in the rat. II. Results with allogeneic grafts. Transplantation. 35 (4), 300-304 (1983).
- Adamson, L. A., et al. A modified model of hindlimb osteomyocutaneous flap for the study of tolerance to composite tissue allografts. Microsurgery. 27 (7), 630-636 (2007).
- Arav, A., Friedman, O., Natan, Y., Gur, E., Shani, N. Rat hindlimb cryopreservation and transplantation: a step toward "organ banking". American Journal of Transplantation. 17 (11), 2820-2828 (2017).
- Gok, E., et al. Development of an ex-situ limb perfusion system for a rodent model. ASAIO Journal. 65 (2), 167-172 (2019).
- Gok, E., Rojas-Pena, A., Bartlett, R. H., Ozer, K. Rodent skeletal muscle metabolomic changes associated with static cold storage. Transplantation Proceedings. 51 (3), 979-986 (2019).
- Brandacher, G., Grahammer, J., Sucher, R., Lee, W. P. Animal models for basic and translational research in reconstructive transplantation. Birth Defects Research. Part C, Embryo Today. 96 (1), 39-50 (2012).
- Fleissig, Y., et al. Modified heterotopic hindlimb osteomyocutaneous flap model in the rat for translational vascularized composite allotransplantation research. Journal of Visualized Experiments: JoVE. (146), e59458 (2019).
- Ulusal, A. E., Ulusal, B. G., Hung, L. M., Wei, F. C. Heterotopic hindlimb allotransplantation in rats: an alternative model for immunological research in composite-tissue allotransplantation. Microsurgery. 25 (5), 410-414 (2005).
- Jang, Y., Park, Y. E., Yun, C. W., Kim, D. H., Chung, H. The vest-collar as a rodent collar to prevent licking and scratching during experiments. Lab Anim. 50 (4), 296-304 (2016).
- Kern, B., et al. A novel rodent orthotopic forelimb transplantation model that allows for reliable assessment of functional recovery resulting from nerve regeneration. American Journal of Transplantation. 17 (3), 622-634 (2017).
- Perez-Abadia, G., et al. Low-dose immunosuppression in a rat hind-limb transplantation model. Transplant International. 16 (12), 835-842 (2003).
- Sucher, R., et al. Orthotopic hind-limb transplantation in rats. Journal of Visualized Experiments. (41), e2022 (2010).
- Fleissig, Y. Y., Beare, J. E., LeBlanc, A. J., Kaufman, C. L. Evolution of the rat hind limb transplant as an experimental model of vascularized composite allotransplantation: Approaches and advantages. SAGE Open Medicine. 8, 2050312120968721 (2020).
- Lindboe, C. F., Presthus, J. Effects of denervation, immobilization and cachexia on fibre size in the anterior tibial muscle of the rat. Acta Neuropathologica. 66 (1), 42-51 (1985).
- Nazzal, J. A., Johnson, T. S., Gordon, C. R., Randolph, M. A., Lee, W. P. Heterotopic limb allotransplantation model to study skin rejection in the rat. Microsurgery. 24 (6), 448-453 (2004).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved