A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
פינצטה אופטית לחקר אינטראקציות בין RNA לחלבון בוויסות התרגום
In This Article
Summary
פרוטוקול זה מציג זרימת עבודה ניסיונית מלאה לחקר אינטראקציות חלבון RNA באמצעות פינצטה אופטית. מספר הגדרות ניסיוניות אפשריות מתארות כולל שילוב של פינצטה אופטית עם מיקרוסקופיה קונפוקלית.
Abstract
RNA מאמצת קפלים מבניים מגוונים, החיוניים לתפקודיו ובכך יכולים להשפיע על תהליכים מגוונים בתא. בנוסף, המבנה והתפקוד של RNA יכול להיות מווסת על ידי גורמים טרנס-משחק שונים, כגון חלבונים, מטבוליטים או RNAs אחרים. מולקולות RNA משניות מסגרת, למשל, הן RNAs תקינים הממוקמים באזורי קידוד, אשר מכוונים את הריבוזומים למסגרת קריאה פתוחה חלופית, ובכך פועלים כמתגי גנים. הם עשויים גם לאמץ קפלים שונים לאחר קשירה לחלבונים או גורמים טרנס אחרים. כדי לנתח את תפקידם של חלבונים מחייבי RNA בתרגום וכיצד הם מווסתים את מבנה הרנ"א ואת היציבות, חיוני ללמוד את יחסי הגומלין והמכניים של מתחמי חלבון RNA אלה בו זמנית. עבודה זו ממחישה כיצד להשתמש פינצטה אופטית מצמידה מולקולה אחת-פלואורסצנטית כדי לחקור את הנוף הקונפורמציה והתרמודינמי של מתחמי חלבון RNA ברזולוציה גבוהה. כדוגמה, האינטראקציה של ה- SARS-CoV-2 מתוכנתת מסגרת ריבוזומלית אלמנט עם גורם טרנס-משחק איזופורם קצר של חלבון אנטי ויראלי באצבע אבץ הוא פירט. בנוסף, ריבוזומים המסומנים בפלואורסצנטיות היו במעקב באמצעות יחידת הקונפוציה, אשר בסופו של דבר תאפשר את חקר התארכות התרגום. בדיקת OT בשילוב פלואורסצנטיות יכולה להיות מיושמת באופן נרחב כדי לחקור מתחמי חלבון RNA מגוונים או גורמים טרנס-משחק המסדירים תרגום ויכול להקל על מחקרים של ויסות גנים מבוססי RNA.
Introduction
העברת מידע גנטי מדנ"א לחלבונים באמצעות mRNAs הוא תהליך ביוכימי מורכב, אשר מוסדר במדויק בכל הרמות באמצעות אינטראקציות מקרומולקולריות בתוך תאים. לוויסות תרגומי, אינטראקציות בין חלבון RNA מעניקות תפקיד קריטי להגיב במהירות לגירויים ולאותות שונים1,2. אינטראקציות מסוימות של חלבון RNA משפיעות על יציבות ה-mRNA ובכך משנות את הזמן ש-RNA פעיל מבחינה תרגומית. אינטראקציות אחרות של חלבון RNA קשורות למנגנוני recoding כגון קריאת עצירת קודון, עקיפת או מיזוג מסגרת ריבוזומלי מתוכנת (PRF)3,4,5,6,7. לאחרונה, מספר חלבונים מחייבי RNA (RBPs) הוכחו לקיים אינטראקציה עם אלמנטים mRNA מגרה ומכונות התרגום כדי להכתיב מתי וכמה recoding יתרחש בתא7,8,9,10,11. לכן, כדי לנתח את התפקיד של חלבונים מחייבי RNA בתרגום וכיצד הם לווסתים מבנה RNA ויציבות, זה חיוני ללמוד את עקרונות האינטראקציה ואת המאפיינים המכניים של מתחמי חלבון RNA אלה בפירוט.
עשרות שנים של עבודה הניחו את היסודות לחקר תהליך התרגום הרב-שלבי ורב-מרכיבים, הנשען על תקשורת מורכבת בין רכיבי הרנ"א והחלבון של מכונות התרגום כדי להשיג מהירות ודיוק12,13,14. צעד מכריע הבא בהבנת אירועים רגולטוריים מורכבים הוא קביעת הכוחות, צירי הזמן ודטרמיננטות מבניות במהלך התרגום בדיוק גבוה12,15,16,17. חקר הדינמיקה הקונפורמציה של RNA ובמיוחד האופן שבו גורמי עזר טרנס-פועלים על מבנה הרנ"א במהלך התרגום הוארו עוד יותר על ידי הופעתם של כלים חד-מולקולתיים, כולל פינצטה אופטית או מגלי גל במצב אפס16,17,18,19,20,21,22,23,24 25,26.
פינצטה אופטית (OT) מייצגת טכניקה מדויקת ביותר של מולקולה אחת, אשר יושמה כדי לחקור סוגים רבים של תהליכים דינמיים תלויי RNA כולל שעתוק, ותרגום26,27,28,29,30,31,32. השימוש בפינצטה אופטית אפשר לבחן אינטראקציות מולקולריות, מבני חומצות גרעין ומאפיינים תרמודינמיים, קינטיקה ואנרגטיה של תהליכים אלה בפירוט16,17,22,33,34,35,36,37,38,39 . פינצטה אופטית מבוססת על מלכוד של עצמים מיקרוסקופיים עם קרן לייזר ממוקדת. בניסוי OT טיפוסי, מולקולת העניין קשורה בין שני חרוזים שקופים (בדרך כלל פוליסטירן) (איור 1A)27. חרוזים אלה נתפסים לאחר מכן על ידי מלכודות אופטיות, אשר מתנהגים כמו מעיינות. לפיכך, ניתן לחשב את הכוח המופעל על המולקולה בהתבסס על תזוזת החרוז ממרכז קרן הלייזר הממוקדת (מרכז המלכודת). לאחרונה, פינצטה אופטית שולבה עם מיקרוסקופיה קונפוקלית (איור 1B), המאפשרת מדידות פלואורסצנטיות או העברת אנרגיית תהודה של פורסטר (FRET)40,41,42. זה פותח שדה חדש לגמרי של ניסויים אפשריים המאפשרים מדידה סימולטונית, ולכן, מתאם מדויק של ספקטרוסקופיה כוח נתוני פלואורסצנטיות.
כאן, אנו מדגימים ניסויים באמצעות פינצטה אופטית בשילוב עם מיקרוסקופיה קונפוקלית כדי לחקור אינטראקציות חלבון-RNA המסדירות את המסגרת התרגומית. בין המטרה לבין המחזק, תא זרימה עם חמישה ערוצים מאפשר יישום מדגם רציף עם זרימת למינאר. דרך הערוצים המיקרופלואידיים, ניתן להזריק רכיבים שונים ישירות, מה שמקטין את זמן הידיים, כמו גם מאפשר צריכת מדגם קטנה מאוד לאורך הניסוי.
ראשית, מוצעת הנחיה בסיסית לסיוע בתכנון ניסויי OT ונוצבים יתרונות כמו גם מלכודות של מערכונים שונים. לאחר מכן, הכנת דגימות וזרימות עבודה ניסיוניות מתוארות, ונדפק פרוטוקול לניתוח הנתונים. כדי לייצג דוגמה, אנו מתארים את התוצאות שהתקבלו מניסויי מתיחת RNA כדי לחקור את אלמנט ה-RNA של SARS-CoV-2 (איור 2A) עם גורם הטרנס-משחק האיזופורם הקצר של חלבון אנטי-ויראלי באצבע אבץ (ZAP), המשנה את התרגום של ה-RNA הנגיפי ממסגרת קריאה חלופית43. בנוסף, הוא הוכיח כי ריבוזומים תווית פלואורסצנטית ניתן להשתמש זה OT confocal assay, אשר יהיה שימושי כדי לפקח על העיבוד ואת המהירות של מכונות התרגום. השיטה המוצגת כאן יכולה לשמש כדי לבדוק במהירות את ההשפעה של מאגרים שונים, ליגנדים או רכיבים תאיים אחרים כדי ללמוד היבטים שונים של התרגום. לבסוף, נדונים מלכודות ניסיוניות נפוצות וכיצד לפתור אותן. להלן כמה נקודות מכריעות בעיצוב ניסיוני.
עיצוב מבנה
באופן עקרוני, קיימות שתי גישות נפוצות ליצירת מבנה RNA תואם OT. הגישה הראשונה משתמשת במולקולת RNA ארוכה, המרוכזת בידיות דנ"א משלימות, ובכך מניבה מבנה המורכב משני אזורים היברידיים של רנ"א/דנ"א המאגפים רצף RNA חד-גדילי באמצע (איור 2B). גישה זו מועסקת ברוב ניסויי ה- OT RNA33,44,45.
הגישה השנייה מנצלת ידיות dsDNA עם overhangs קצר (סביב 20 nt) 15,17. ההכלאות האלה מהויברידיות עם מולקולת הרנ"א. למרות שהוא מסובך יותר בעיצוב, השימוש בידיות dsDNA מתגבר על חלק מהמגבלות של מערכת ה- DNA / RNA-היברידית. באופן עקרוני, אפילו ידיות ארוכות מאוד (>10kb) ניתן ליישם, וזה נוח יותר למדידות confocal. בנוסף, ניתן לקשור את מולקולת ה-RNA לידיות DNA כדי להגביר את יציבות הרצועה.
אסטרטגיית סימון קצה
המבנה חייב להיות קשור חרוזים באמצעות אינטראקציה מולקולרית חזקה. אמנם יש גישות זמינות עבור מליטה covalent של ידיות חרוזים46, אינטראקציות חזקות אך לא קוולנטי כגון סטרפטבידין-ביוטין ו דיגוקסיגנין-נוגדן משמשים בדרך כלל בניסויי OT15,33,35,45. בפרוטוקול המתואר, המבנה מסומן ביוטין או דיגוקסיגנין, והחרוזים מצופים בסטרפטבידין או בנוגדנים נגד דיגוקסיגנין, בהתאמה (איור 1A). גישה זו תתאים להחלת כוחות עד כ-60 pN (לכל חבל)47. יתר על כן, השימוש באסטרטגיות תיוג שונות של 5' ו-3' מאפשר לקבוע את הכיוון של הרצועה שנוצרה בין החרוזים17.
תיוג חלבונים למדידות פלואורסצנטיות
עבור הדמיה קונפוקלית, ישנן מספר גישות נפוצות עבור תיוג פלואורסצנטיות. לדוגמה, פלואורופורים יכולים להיות מחוברים באופן קוולנטי לשאריות חומצות אמינו שנמצאות באופן מקורי בחלבונים או מוצגות על ידי מוטגנזה מכוונת אתר באמצעות קבוצה אורגנית תגובתית. צבע תיול או אמין-תגובתי יכול לשמש לתיוג של שאריות ציסטאין וליצין, בהתאמה. ישנן מספר שיטות הגנה הפיכות כדי להגדיל את הספציפיות של labeling48,49, אולם חלבונים מקומיים בדרך כלל יסומנו בשאריות מרובות. למרות שהגודל הקטן של הפלורופור עשוי להעניק יתרון, תיוג לא ספציפי עלול להפריע לפעילות החלבון ולכן עוצמת האות עשויה להשתנות 49. כמו כן, בהתאם לעוצמת האות יעילות התיוג עשוי להיות שונה בין ניסויים שונים. לכן, יש לבצע בדיקת פעילות לפני הניסוי.
במקרה שחלבון העניין מכיל תג N-או C-terminal, כגון תג שלו או תג סטרפטופון, תיוג ספציפי של תגים אלה מייצג גישה פופולרית אחרת. יתר על כן, תיוג ממוקד תג מקטין את הסיכוי של פלואורופור מפריע לפעילות החלבון יכול לשפר את המסיסות49. עם זאת, תיוג ספציפי לתג בדרך כלל מניב חלבונים מונו-פלואורופור שכותרתו, אשר עשוי להיות מאתגר לזהות. דרך נוספת של תיוג ספציפי יכולה להתבצע על ידי שימוש בנוגדנים.
הגדרת מיקרופלואידיקה
השילוב של OT עם מערכת מיקרופלואידיקה מאפשר מעבר מהיר בין תנאי ניסוי שונים. יתר על כן, מערכות נוכחיות מנצלות את השמירה על זרימת למינאר בתוך תא הזרימה, אשר מונע ערבוב של נוזלים מערוצים אחרים בכיוון הניצב ביחס לכיוון הזרימה. לכן, זרימת למינאר היא יתרון במיוחד עבור העיצוב הניסיוני. נכון לעכשיו, תאי זרימה עם עד 5 ערוצים נמצאים בדרך כלל (איור 3).
Protocol
1. הכנת מדגם
- שכפל את רצף העניין בווקטור המכיל את שברי הדנ"א של למבדה, המשמשים כרצפי הידית (איור 2)43,50.
- תחילה צור תבנית DNA לתמלול במבחנה לאחר מכן באמצעות PCR (איור 2B; תגובה 1). בשלב PCR זה, מקדם T7 מתווסף בקצה 5 ' של מולקולת ה- DNA תחושה32,33,43,50. הגדר את תגובת ה- PCR לפי טבלה 1. הפעל את PCR ב 50 aliquots μL עם מחזורים מתאימים התרמוציקלר.
- הכן את נקודות האחיזה בשתי תגובות PCR נפרדות (טבלה 1, איור 2B; תגובה 2 ו-3). ראשית, ליצור את הידית 5 'על ידי PCR. לאחר מכן, ליצור את הידית 3 ' ובו זמנית לתייג אותו עם digoxigenin באמצעות 5 ' digoxigenin תווית פריימר 32,33,43,50.
- לאחר ה- PCR, לטהר את ה- DNA באמצעות עמודות ספין סיליקה.
- בצע את תגובת תמלול במבחנה באמצעות T7 RNA פולימראז (טבלה 2)32,33,43,50. לדגור על התגובה ב 37 °C (2-4 שעות בהתאם לאורך הרנ"א. לאחר מכן, הוסף DNase I לתגובה ודגר ב 37 °C (37 °F) במשך 30 דקות כדי לעכל את תבנית ה- DNA. טהר את ה- RNA באמצעות עמודות ספין סיליקה.
- במהלך תגובת התיוג של ידית 5' (טבלה 3), הוסף ביוטין-16-dUTP בקצה 3 ' של הידית על ידי T4 DNA פולימראז38,50. בצע את התגובה בטמפרטורת החדר במשך 1-2 שעות. לאחר מכן, לטהר את ה- DNA באמצעות עמודות ספין סיליקה.
הערה: מאחר שיש לתייג את המזהה הייחודי של 5' בקצה 3' (איור 2B), אין אפשרות לבצע את התיוג במהלך ה-PCR. - ערבבו את הרכיבים שהוזכרו לעיל - ידית בגודל 5' (3' המסומנת בביוטין), ידית 3' (5' המסומנת בדיגוקסיגנין) ו-RNA - ביחס טוחנת של 1:1:1 במאגר חישול (80% פורממיד, 400 מ"מ NaCl, 40 mM HEPES, pH 7.5, 0.5 mM EDTA, pH 8), כדי להשיג את היברידית ה-RNA/DNA הרצויה (טבלה 4). מחממים את תערובת החישול עד 85 מעלות צלזיוס במשך 10 דקות ואז מתקררים לאט ל -4 מעלות צלזיוס.
- מערבבים את המדגם המחושג עם 1/10 נפח של 3 M נתרן אצטט (pH 5), 3 כרכים של אתנול קר כקרח ודגרה ב -80 °C לפחות 1 שעה או ב -20 °C בלילה.
- צנטריפוגות הדגימות ב 15,000 × גרם במשך 30 דקות ב 4 °C (50 °F). להשליך את supernatant ולייבש את הכדור (בדרך כלל לא גלוי) תחת ואקום.
- לבסוף, resuspend, הכדור ב 50 μL של מים ללא RNase ולעשות aliquots. לאחסן את aliquots ב -80 °C (80 °F) עד לשימוש. לאחסון לטווח קצר, ניתן לאחסן את הדגימות גם ב-20 °C (50 °F).
2. התקנת מכשיר
הערה: הפרוטוקול הבא ממוטב עבור מכשיר פינצטה אופטי מסחרי C-Trap מחברת LUMICKS. לכן, התאמות לשלבים המוצגים עשויות להיות נחוצות בעת שימוש במכשירי פינצטה אופטיים אחרים. אם לא נעשה שימוש, מערכת microfluidics של המכונה נשמרת אקונומיקה (פתרון היפוכלוריט נתרן) ויש לשטוף לפני השימוש.
- יש להשליך את אקונומיקה ולמלא את המזרקים במ"ל אחד של מים ללא RNase.
- הוסף 50 μL של 0.5 M נתרן thiosulfate לפחות 1 מ"ל של מים ללא RNase ולשטוף ביסודיות את המערכת (1 בר, לפחות 0.5 מ"ל) כדי לחסל את אקונומיקה הנותרת במערכת.
- השליכו את תמיסת הנתרן תיסולפט מהמזרקים. החלף מזרקים במזרקים טריים ושטוף את המערכת עם לפחות 0.5 מ"ל של מים ללא RNase.
הערה: היזהר, כי מערכת microfluidics אף פעם לא פועל יבש כדי למנוע בועות אוויר במערכת. - שים 2 טיפות של שמן טבילה (אינדקס שבירה של 1.33) או כ 70 μL של מים על גבי המטרה.
- מקם את תא הזרימה בתוך מסגרת ההחזקה במקומו.
- שים 2 טיפות של שמן טבילה (אינדקס שבירה של 1.51) על גבי תא הזרימה.
- תדליק את מכשיר הלייזר במכונת פינצטה. ברגע שהוא פועל, הפעל את לייזר ההשמנה בממשק התוכנה ב- 100%.
- באמצעות מצלמות אבחון (Z-finder), להתאים את ציר Z לאמצע התא בין השתקפויות השני והשלישי (ממשקים) שבו טבעות השסע הן הגדולות ביותר, על ידי הפיכת בורג מיקרו.
הערה: בכל פעם שהמטרה מועברת קרוב יותר לתא המדידה ומישור המוקד של המטרה חוצה את הממשק בין שני שלבים, ניתן לזהות השתקפות במצב Z-finder. ישנם 4 ממשקים אפשריים: (i) שמן מים / טבילה וזכוכית תחתונה (ii) זכוכית תחתונה וחיץ בתוך החדר (iii) חוצץ בתוך התא וזכוכית עליונה (iv) זכוכית עליונה ושמן טבילה עבור מחזק. - כוונן את מיקום המרוכז (הגדר לייזר לכידה לכ-50%) כך שהמרוכז נוגע בשמן הטבילה מעל תא המדידה.
- התאם את המוקד על-ידי תנועה איטית כלפי מטה/למעלה עם הממקד, כך ש- 10 רצועות אור מוצגות במצב הירח (מצלמות אבחון).
3. מדידה לדוגמה
- חרוזים מצופים אנטי דיגוקסיגנין (AD) עם מבנים מדגם (3 μL של 0.1% (w /v) השעיית חרוזים AD + 4 μL של מדגם) ועם 1 μL של מעכבי RNase ו 8 μL של חיץ בדיקה (300 mM KCl, 5 mM MgCl2, 20 mM HEPES, pH 7.6, 0.05% Tween 20, 5 mM DTT) ב RT במשך 10-20 דקות. לאחר הדגירה, לדלל את המדגם ב 500 μL של חוצץ אסאי.
הערה: מומלץ להוסיף אוכלי חמצן, במיוחד במהלך מדידות פלואורסצנטיות למאגר על מנת למנוע נזק חמצוני. כאן נעשה שימוש במערכת נבלות חמצן המכילה גלוקוז (8.3 מ"ג/מ"ל), אוקסידאז גלוקוז (40 U/mL) וקטלאז (185 U/mL). - יש לערבב 0.8 μL של 1% (w/v) חרוזים מצופים סטרפטאבידין (SA) עם 1 מ"ל של חיץ אסאי.
- יש להשליך מים מהמזרקים ולמלא את המזרקים במתלים/פתרונות בהתאמה. לשטוף לפחות 2 דקות בערך 1 בר, ולאחר מכן להתחיל לתפוס חרוזים.
הערה: בהתאם להפעלה הניסיונית, ניתן להשתמש בסידורי ערוצים שונים (איור 3). בדרך כלל, ערוץ זרימה אחד מלא בחרוזים אנטי דיגוקסיגנין הנושאים את מולקולת ה- RNA. ערוץ שני מלא חרוזים מצופים סטרפטאבין. ערוץ המאגר משמש ליצירת התותחים. ניתן להשתמש בערוץ רביעי כדי לטעון את חלבון כריכת הרנ"א (איור 3C), או לחילופין להוסיף RBP ישירות בערוץ המאגר (איור 3B). - כדי ללכוד את החרוזים, הזז את המלכודות האופטיות זו מזו. מהלך ראשון לערוץ AD ולתפוס חרוז AD במלכודת 1. לאחר מכן, העבר את הבמה לערוץ SA ותפס חרוז SA יחיד במלכודת 2.
הערה: נסה להישאר בממשק של ערוצי המאגר והחרוזים כדי להימנע מאובדן החרוז שכבר נתפס, או כדי למנוע לתפוס חרוזים מרובים באותה מלכודת. - לאחר החרוזים בגודל הנכון נלכדים, עבור לערוץ המאגר והפסק את זרימת למינאר. לאחר מכן, בצע כיול כוח כדי לבדוק נוקשות מלכודת. ערכי הנוקשות המתאימים אינם אמורים להיות שונים בציר x/y ביותר מ- 10-15%.
הערה: התאימו את עוצמת הלייזר או את פיצול הלייזר בין המלכודות בהתאם לגודל החרוזים. כיול כוח אינו חייב להיעשות עבור כל זוג חרוזים כל עוד תבניות החרוזים תואמות (ציון הדמיון > 0.9). עם זאת, זה צריך להתבצע באופן קבוע, או לפחות בכל פעם תנאי בדיקה משתנים. - התחל לדוג קשר על ידי הזזת החרוזים קרוב זה לזה, המתנה של כמה שניות ולאחר מכן הזזתם בחזרה זה מזה, חזור על הפעולה עד שנוצר קשר. היווצרות קשירה גורמת לעלייה של כוח מדוד על משיכת שני החרוזים אחד מהשני.
הערה: כדי למנוע היווצרות של צמיגים מרובים, החרוזים לא צריך להיות מועבר קרוב מדי. עם תפיסת קשר בין שני החרוזים, ניתן לבדוק את איכות הרצועה על ידי מציאת הרמה המתוחה. הרמה צריכה להיות בין 50 ל 60 pN עבור קשר אחד. - עם קבלת חבל, התחל את המדידה. בהתאם לתופעה שנחקרה יש לבחור הגדרות מדידה שונות (איור 1B-D).
הערה: בדרך כלל בתחילת הניסוי, ניסוי רמפה כוח נערך כדי לבדוק את איכות הרצועה ולחקור את ההתנהגות. לאחר מכן, ניתן גם להתחיל את הניסויים הקבועים או העמדה הקבועה כדי ללמוד את המעברים של המדינה עוד יותר. לאחר ביצוע מספר מספיק של מדידות במדגם RNA כדי לקבוע את אופן הפעולה שלה, ניתן להוסיף גורמים מסומנים למערכת כדי לבצע מדידות קונפוקליות. - כדי לבצע מדידות פלואורסצנטיות, הפעל את הלייזרים הקונפוקליים ויחידת מונה הפוטוסים במכשיר פינצטה אופטי.
- הפעל את לייזר העירור של אורך הגל הרצוי בממשק התוכנה והגדר את כוח הלייזר ל -5% ומעלה, בהתאם לפלורופור.
הערה: אמנם לא למדוד נמוך יותר את הגדרת הכוח של לייזר עירור ל 0% כדי למנוע photodamage מוגזם לדגימה. - התחל להדמיה של הדגימה באמצעות פונקציות תמונה של התוכנה.
הערה: כדי לקבל תמונות ממוקדות היטב, יש ליישר את המישור המוקדי של המיקרוסקופ הקונפוקלי והמלכודות האופטיות. לשם כך, ניתן להשתמש בפלואורסצנטיות של חרוזי הפוליסטירן בערוץ הלייזר הכחול. המישור המוקדי של מלכודות אופטיות מוזז למעלה או למטה בציר z עד שתמונת החרוזים מגיעה לקוטר הגבוה ביותר שלה. במצב זה, ניתן למדוד את אות הפלואורסצנטיות מהמולקולה קשורה בין החרוזים. - כדי להשתמש בפונקציית kymograph, ציין את מיקום ה- x-y של ציר הקמיוגרפיה כך שהוא מאפשר זיהוי של הרצועה בין החרוזים.
- לאורך כל המדידה, הרכב המאגר יכול להשתנות בקלות על ידי העברת החרוזים לערוצים שונים או על ידי שינוי המאגר המסופק במערכת microfluidics.
4. ניתוח נתונים
- עיבוד מקדים של נתונים גולמיים
- באמצעות קובץ Script פשוט, צמצם את הנתונים הגולמיים מספיק כדי (i) לאפשר עיבוד נתונים מהיר יותר לאחר מכן, אך (ii) עדיין מכיל את כל המידע הקריטי (איור 4A). בדרך כלל, 100-5000 הרץ מתאים למטרה זו.
הערה: תדירות איסוף הנתונים בניסויי פינצטה אופטיים היא לעתים קרובות גבוהה יותר מהנדרש לניתוח - בניסויים המוצגים, תדירות איסוף הנתונים מוגדרת ל- 78 125 הרץ כברירת מחדל. מכיוון ששטח האחסון מוגבל, נוח וחסך זמן להפחית את קצב הדגימה של הנתונים. כאן, הנתונים הגולמיים הופחתו על ידי גורם של 30. - לאחר מכן, השתמש במסנן אותות כדי להפחית את רעש מדידת התדר הגבוה מהאות (איור 4A). התאם את מידת הסינון ואת פרמטרי תדירות הניתוק בהתאם כדי למטב את תפוקת הנתונים של ניסויים שונים (איור 5).
הערה: בין מסנני אותות, מסנן Butterworth51 הוא אחד הנפוצים ביותר בשימוש. סקריפט פיתון בהתאמה אישית המאפשר עיבוד מקדים של נתונים גולמיים מסופק בנתונים המשלימים. יש למטב פרמטרים של דגימת הפחתה וסינון אותות (תדירות ניתוק, דרגת סינון) לניסויים שונים.
- באמצעות קובץ Script פשוט, צמצם את הנתונים הגולמיים מספיק כדי (i) לאפשר עיבוד נתונים מהיר יותר לאחר מכן, אך (ii) עדיין מכיל את כל המידע הקריטי (איור 4A). בדרך כלל, 100-5000 הרץ מתאים למטרה זו.
- לניתוח נתונים של רמפה כוחית, השתמש בשלבים הבאים.
- סמן את השלבים באופן ידני על-ידי חיפוש נקודות מתאימות בעלילת מסלול הכוח או באמצעות קבצי Script שנכתבו בהתאמה אישית. צעדי פתיח מאופיינים בירידה פתאומית בכוח בשילוב עם עלייה במרחק בעקומת מרחק הכוח (FD).
- לאחר שאירועים מתפתחים מסומנים, התאימו לאזורים שונים בעקומת ה-FD באמצעות דגמים מתאימים (איור 4D).
הערה: עבור האזור לפני השלב הראשון המתפתח, הרצועה יכולה להיחשב "כפולה גדילה" והוא מתאים בדרך כלל באמצעות מודל שרשרת דמוי תולעת להגברה (WLC)47,52,53. החלקים לאחר האירוע המתפתח הראשון נחשבים לשילוב של נוקלאוטידים דו-גדיליים (ידיות) ונוקלאוטידים חד-גדיליים (מולקולת RNA נפרשת). לכן, התאמת נתונים היא מורכבת יותר - בדרך כלל שילוב של 2 דגמי WLC או דגמי WLC ורשת משותפת חופשית (FJC) מועסקים 36,39,52. דגם WLC להרחבה כולל שני פרמטרי התאמה עיקריים אורך קווי המתאר (LC) ואורך ההתמדה (LP). אורך קווי המתאר מתאים לאורך המולקולה הנמתחת במלואה ואורך ההתמדה מגדיר את תכונות הכיפוף של מולקולת העניין. ניתן לתאר את המודל באמצעות המשוואה הבאה (1). ניתן להשתמש ב- WLC כדי לדגמן את ההתנהגות של אזורים מקופלים כמו גם אזורים נפתחים, אם כי עבור כל אחד מהם יש להשתמש במודל נפרד עם פרמטרים שונים.
(1)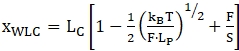
כאשר x הוא הארכה, LC הוא אורך קווי מתאר, F הוא כוח, LP הוא אורך התמדה, kB הוא קבוע בולטסמן, T הוא טמפרטורה תרמודינמית, ו S הוא מודולוס מתיחה.
המודל השני שנקרא שרשרת מפרקים חופשיים (FJC) משמש בדרך כלל לתיאור התנהגות של אזורים נטושים בודדים. הוא משתמש בפרמטרים דומים של הפולימרים אך מתייחס לכל יחידה של "שרשרת" כמו מוט נוקשה, כאן המתאים לנוקלאוטידים של האזור התקוע היחיד שנפתח. המשוואה הבאה (2) מתארת מודל זה:
(2)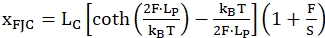
הערה: המעבדה שלנו פיתחה לאחרונה אלגוריתם המאפשר עיבוד אצווה של נתוני רמפה כוח גלם בשם "פינצטה אופטית מעשית ניתוח TOol (POTATO)54." האלגוריתם מדגם ומסנן את הנתונים, ואז הוא מזהה שלבי התגלות אפשריים ולבסוף מבצע התאמת נתונים. תפוח האדמה בנוי בממשק משתמש גרפי ידידותי למשתמש (GUI) (https://github.com/REMI-HIRI/POTATO).
- עבד נתונים בעלי כוח קבוע באופן הבא:
הערה: ניתן להחיל את ההוראות הבאות באופן אנלוגי על נתוני מיקום קבוע.- לנתוני הכוח הקבוע, התווו את המרחק לאורך זמן (איור 5). היסטוגרמה המציגה את התדירות (סופרת) של קונפורמציות שונות על פני השינוי היחסי בעמדה היא דרך שימושית לאפיין מצבים דומיננטיים וקטנים שונים (איור 7).
- התאם את ההיסטוגרמה באמצעות פונקציות גאוסיות (מרובות) כדי להעריך את האחוז הכולל של קונפורמרים בודדים בכוח נתון (איור 7C). הגאוס מתאים, המיקום הממוצע, וסטיית התקן מתארת את היחסים הקשורים לכוח בין אוכלוסיות שונות.
הערה: סקריפט פיתון בהתאמה אישית המאפשר עיבוד מראש והתאמה גאוסית דו-מודלית בסיסית של נתונים בעלי כוח קבוע מסופק בנתונים המשלימים. פרמטרים (תדירות ניתוק, מדרגת סינון, אמצעים צפויים, ערכי סטיית תקן ומשרות) צריכים להיות ממוטבים לניסויים שונים. - לאחר מכן, השתמש במודל מרקוב הנסתר כדי לנתח עוד יותר את המדינות, אשר עשוי לחשוף מתווכים מתקפלים נוספים (קונפורמרים)55. לקבלת מידע נוסף על כוח קבוע ומודל מרקוב מוסתר, ניתן להתייחס 55,56,57,58.
תוצאות
בסעיף זה, המיקוד ניתן בעיקר על מדידות של אינטראקציות חלבון RNA/ ליגנד על ידי פינצטה אופטי פלואורסצנטית. לתיאור של ניסויי פינצטה אופטיים כלליים של RNA ותוצאות מייצגות מתאימות, ראה 32. לדיון מפורט יותר באינטראקציות בין RNA לחלבון DNA, ראו גם 1,2,26,59,60.
Discussion
כאן, אנו מדגימים את השימוש פינצטה אופטית בשילוב פלואורסצנטיות כדי לחקור אינטראקציות והתנהגות דינמית של מולקולות RNA עם ליגנדים שונים. להלן, נדונים צעדים קריטיים ומגבלות של הטכניקה הנוכחית.
שלבים קריטיים בפרוטוקול
באשר לשיטות רבות אחרות, איכות המדגם היא מרכזית כד?...
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
אנו מודים לאנויה קייב וליוני פרופ' רדמונד סמית על סקירה ביקורתית של כתב היד. אנו מודים לטטיאנה קוך על הסיוע הטכני המומחה. אנו מודים לקריסטינה פקרקובה על העזרה בהקלטת סרטונים ניסיוניים. העבודה במעבדה שלנו נתמכת על ידי איגוד הלמהולץ ומימון ממועצת המחקר האירופית (ERC) גרנט 948636 (ל- NC).
Materials
| Name | Company | Catalog Number | Comments |
| Bacterial Strains | |||
| E. coli HB101 | lab collection | N/A | cloning of the vectors |
| Chemicals and enzymes | |||
| Sodium chloride | Sigma-Aldrich | 31424 | Buffers |
| Biotin-16-dUTP | Roche | 11093070910 | Biotinylation |
| BSA | Sigma-Aldrich | A4737 | Buffers |
| Catalase | Lumicks | N/A | Oxygen scavanger system |
| Dithiothreitol (DTT) | Melford Labs | D11000 | Buffers |
| DNAse I from bovine pancreas | Sigma-Aldrich | D4527 | in vitro transcription |
| dNTPs | Th.Geyer | 11786181 | PCR |
| EDTA | Sigma-Aldrich | E9884 | Buffers |
| Formamide | Sigma-Aldrich | 11814320001 | Buffers |
| Glucose | Sigma-Aldrich | G8270-1KG | Oxygen scavanger system |
| Glucose-oxidase | Lumicks | N/A | Oxygen scavanger system |
| HEPES | Carl Roth | HN78.3 | Buffers |
| Magnesium chloride | Carl Roth | 2189.1 | Buffers |
| Phusion DNA polymerase | NEB | M0530L | Gibson assembly, cloning |
| Potassium chloride | Merck | 529552-1KG | Buffers |
| PrimeSTAR GXL DNA Polymerase | Takara Bio Clontech | R050A | PCR |
| Pyrophosphotase, thermostabile, inorganic | NEB | M0296L | in vitro transcription |
| RNase Inhibitor | Molox | 1000379515 | Buffers |
| rNTPS | life technologies | R0481 | in vitro transcription |
| Sodium thiosulophate | Sigma-Aldrich | S6672-500G | Bleach deactivation |
| Sytox Green | Lumicks | N/A | confocal measurements |
| T4 DNA Polymerase | NEB | M0203S | Biotinylation |
| T5 exonuclease | NEB | M0363S | Gibson assembly, cloning |
| T7 RNA polymerase | Produced in-house | N/A | in vitro transcription |
| Taq DNA polymerase | NEB | M0267S | PCR |
| Taq ligase | Biozym | L6060L | Gibson assembly, cloning |
| TWEEN 20 BioXtra | Sigma-Aldrich | P7949 | Buffers |
| Kits | |||
| Monolith Protein Labeling Kit RED-NHS 2nd Generation (Amine Reactive) | Nanotemper | MO-L011 | Used for ribosome labeling |
| Purefrex 2.0 | GeneFrontier | PF201-0.25-EX | Ribosomes used for the labeling |
| Oligonucleotides | |||
| 5' handle T7 forward | Microsynth | custom order | 5’ - CTTAATACGACTCACTATAGGTC CTTTCTGTGGACGCC - 3’, used to generate OT in vitro transcription template in PCR 1 |
| 3’ handle reverse | Microsynth | custom order | 5' - GTCAAAGTGCGCCCCGTTATCC - 3', used to generate OT in vitro transcription template in PCR 1 |
| 5' handle forward | Microsynth | custom order | 5' - TCCTTTCTGTGGACGCCGC - 3' , used to generate 5' handle in PCR 2 |
| 5’ handle reverse | Microsynth | custom order | 5’ - CATAAATACCTCTTTACTAATATA TATACCTTCGTAAGCTAGCGT - 3’, used to generate 5' handle in PCR 2 |
| 3’ handle forward | Microsynth | custom order | 5' - ATCCTGCAACCTGCTCTTCGCC AG - 3', used to generate 3' handle in PCR 3 |
| 3’ handle reverse 5’labeled with digoxigenin | Microsynth | custom order | 5' -[Dig]-GTCAAAGTGCGCCCCGTTATCC - 3', used to generate 3' handle in PCR 3 |
| DNA vectors | |||
| pMZ_OT | produced in-house | N/A | further description in "Structural studies of Cardiovirus 2A protein reveal the molecular basis for RNA recognition and translational control" Chris H. Hill, Sawsan Napthine, Lukas Pekarek, Anuja Kibe, Andrew E. Firth, Stephen C. Graham, Neva Caliskan, Ian Brierley bioRxiv 2020.08.11.245035; doi: https://doi.org/10.1101/2020.08.11.245035 |
| Software and Algorithms | |||
| Atom | https://atom.io/packages/ide-python | N/A | |
| Bluelake | Lumicks | N/A | |
| Graphpad | https://www.graphpad.com/ | N/A | |
| InkScape 0.92.3 | https://inkscape.org/ | N/A | |
| Matlab | https://www.mathworks.com/products/matlab.html | N/A | |
| POTATO | https://github.com/lpekarek/POTATO.git | N/A | |
| RNAstructure | https://rna.urmc.rochester.edu/RNAstructure.html | N/A | |
| Spyder | https://www.spyder-ide.org/ | N/A | |
| Other | |||
| Streptavidin Coated Polystyrene Particles, 1.5-1.9 µm, 5 ml, 1.0% w/v | Spherotech | SVP-15-5 | |
| Anti-digoxigenin Coated Polystyrene Particles, 2.0-2.4 µm, 2 ml, 0.1% w/v | Spherotech | DIGP-20-2 | |
| Syringes | VWR | TERUMO SS+03L1 | |
| Devices | |||
| C-trap | Lumicks | N/A | optical tweezers coupled with confocal microscopy |
References
- Balcerak, A., Trebinska-Stryjewska, A., Konopinski, R., Wakula, M., Grzybowska, E. A. RNA-protein interactions: disorder, moonlighting and junk contribute to eukaryotic complexity. Open Biology. 9 (6), 190096 (2019).
- Armaos, A., Zacco, E., Sanchez de Groot, N., Tartaglia, G. G. RNA-protein interactions: Central players in coordination of regulatory networks. BioEssays. 43 (2), 2000118 (2021).
- Firth, A. E., Brierley, I. Non-canonical translation in RNA viruses. Journal of General Virology. 93, 1385-1409 (2012).
- Caliskan, N., Peske, F., Rodnina, M. V. Changed in translation: mRNA recoding by −1 programmed ribosomal frameshifting. Trends in Biochemical Sciences. 40 (5), 265-274 (2015).
- Jaafar, Z. A., Kieft, J. S. Viral RNA structure-based strategies to manipulate translation. Nature Reviews Microbiology. 17 (2), 110-123 (2019).
- Eswarappa, S. M., et al. Programmed translational readthrough generates antiangiogenic VEGF-Ax. Cell. 157 (7), 1605-1618 (2014).
- Rodnina, M. V., et al. Translational recoding: canonical translation mechanisms reinterpreted. Nucleic Acids Research. 48 (3), 1056-1067 (2020).
- Li, Y., et al. Transactivation of programmed ribosomal frameshifting by a viral protein. Proceedings of the National Academy of Sciences. 111 (21), 2172 (2014).
- Napthine, S., et al. Protein-directed ribosomal frameshifting temporally regulates gene expression. Nature Communications. 8 (1), 15582 (2017).
- Patel, A., et al. Molecular characterization of the RNA-protein complex directing -2/-1 programmed ribosomal frameshifting during arterivirus replicase expression. Journal of Biological Chemistry. 295 (52), 17904-17921 (2020).
- Napthine, S., Bell, S., Hill, C. H., Brierley, I., Firth, A. E. Characterization of the stimulators of protein-directed ribosomal frameshifting in Theiler's murine encephalomyelitis virus. Nucleic Acids Research. 47 (15), 8207-8223 (2019).
- Marshall, R. A., Aitken, C. E., Dorywalska, M., Puglisi, J. D. Translation at the Single-Molecule Level. Annual Review of Biochemistry. 77 (1), 177-203 (2008).
- Rodnina, M. V. The ribosome in action: Tuning of translational efficiency and protein folding. Protein science : A publication of the Protein Society. 25 (8), 1390-1406 (2016).
- Rodnina, M. V., Fischer, N., Maracci, C., Stark, H. Ribosome dynamics during decoding. Philosophical Transactions of Royal Society of London B Biological Sciences. 372 (1716), (2017).
- Yan, S., Wen, J. D., Bustamante, C., Tinoco, I. Ribosome excursions during mRNA translocation mediate broad branching of frameshift pathways. Cell. 160 (5), 870-881 (2015).
- Liu, T., et al. Direct measurement of the mechanical work during translocation by the ribosome. eLife. 3, 03406 (2014).
- Desai, V. P., et al. Co-temporal force and fluorescence measurements reveal a ribosomal gear shift mechanism of translation regulation by structured mRNAs. Molecular Cell. 75 (5), 1007-1019 (2019).
- Choi, J., O'Loughlin, S., Atkins, J. F., Puglisi, J. D. The energy landscape of -1 ribosomal frameshifting. Science Advances. 6 (1), (2020).
- Prabhakar, A., Puglisi, E. V., Puglisi, J. D. Single-molecule fluorescence applied to translation. Cold Spring Harbor Perspectives in Biology. 11 (1), 032714 (2019).
- Bao, C., et al. mRNA stem-loops can pause the ribosome by hindering A-site tRNA binding. Elife. 9, 55799 (2020).
- Chen, J., Tsai, A., O'Leary, S. E., Petrov, A., Puglisi, J. D. Unraveling the dynamics of ribosome translocation. Current Opinion in Structural Biology. 22 (6), 804-814 (2012).
- Qu, X., et al. The ribosome uses two active mechanisms to unwind messenger RNA during translation. Nature. 475 (7354), 118-121 (2011).
- Zheng, Q., et al. Ultra-stable organic fluorophores for single-molecule research. Chemical Society Reviews. 43 (4), 1044-1056 (2014).
- Blanchard, S. C. Single-molecule observations of ribosome function. Current Opinion in Structural Biology. 19 (1), 103-109 (2009).
- Juette, M. F., et al. The bright future of single-molecule fluorescence imaging. Current Opinion in Chemical Biology. 20, 103-111 (2014).
- McCauley, M. J., Williams, M. C. Mechanisms of DNA binding determined in optical tweezers experiments. Biopolymers. 85 (2), 154-168 (2007).
- Ashkin, A., Dziedzic, J. M., Bjorkholm, J. E., Chu, S. Observation of a single-beam gradient force optical trap for dielectric particles. Optics Letters. 11 (5), 288-290 (1986).
- Bustamante, C., Smith, S. B., Liphardt, J., Smith, D. Single-molecule studies of DNA mechanics. Current Opinion in Structural Biology. 10 (3), 279-285 (2000).
- Choudhary, D., Mossa, A., Jadhav, M., Cecconi, C. Bio-molecular applications of recent developments in optical tweezers. Biomolecules. 9 (1), 23 (2019).
- Moffitt, J. R., Chemla, Y. R., Smith, S. B., Bustamante, C. Recent advances in optical tweezers. Annual Reviews of Biochemistry. 77, 205-228 (2008).
- Li, P. T. X., Vieregg, J., Tinoco, I. How RNA Unfolds and Refolds. Annual Review of Biochemistry. 77 (1), 77-100 (2008).
- Stephenson, W., Wan, G., Tenenbaum, S. A., Li, P. T. Nanomanipulation of single RNA molecules by optical tweezers. Journal of Visualized Experiments. (90), e51542 (2014).
- Halma, M. T. J., Ritchie, D. B., Cappellano, T. R., Neupane, K., Woodside, M. T. Complex dynamics under tension in a high-efficiency frameshift stimulatory structure. Proceedings of the National Academy of Sciences. 116 (39), 19500 (2019).
- Hansen, T. M., Reihani, S. N. S., Oddershede, L. B., Sørensen, M. A. Correlation between mechanical strength of messenger RNA pseudoknots and ribosomal frameshifting. Proceedings of the National Academy of Sciences of the United States of America. 104 (14), 5830-5835 (2007).
- Zhong, Z., et al. Mechanical unfolding kinetics of the SRV-1 gag-pro mRNA pseudoknot: possible implications for -1 ribosomal frameshifting stimulation. Science Reports. 6, 39549 (2016).
- McCauley, M. J., Rouzina, I., Li, J., Núñez, M. E., Williams, M. C. Significant differences in RNA structure destabilization by HIV-1 GagDp6 and NCp7 proteins. Viruses. 12 (5), 484 (2020).
- de Messieres, M., et al. Single-molecule measurements of the CCR5 mRNA unfolding pathways. Biophysics Journal. 106 (1), 244-252 (2014).
- Yang, L., et al. Single-molecule mechanical folding and unfolding of RNA hairpins: Effects of single A-U to A·C pair substitutions and single proton binding and implications for mRNA structure-induced -1 ribosomal frameshifting. Journal of American Chemical Society. 140 (26), 8172-8184 (2018).
- McCauley, M. J., et al. Targeted binding of nucleocapsid protein transforms the folding landscape of HIV-1 TAR RNA. Proceedings of the National Academy of Sciences of the United States of America. 112 (44), 13555-13560 (2015).
- Whitley, K. D., Comstock, M. J., Chemla, Y. R. High-resolution "Fleezers": Dual-trap optical tweezers combined with single-molecule fluorescence detection. Methods in Molecular Biology. 1486, 183-256 (2017).
- Yerramilli, V. S., Kim, K. H. Labeling RNAs in live cells using malachite green aptamer scaffolds as fluorescent probes. ACS Synthetic Biology. 7 (3), 758-766 (2018).
- Gross, P., Farge, G., Peterman, E. J., Wuite, G. J. Combining optical tweezers, single-molecule fluorescence microscopy, and microfluidics for studies of DNA-protein interactions. Methods in Enzymology. 475, 427-453 (2010).
- Zimmer, M. M., et al. The short isoform of the host antiviral protein ZAP acts as an inhibitor of SARS-CoV-2 programmed ribosomal frameshifting. Nature Communications. 12 (1), 7193 (2021).
- Neupane, K., Yu, H., Foster, D. A. N., Wang, F., Woodside, M. T. Single-molecule force spectroscopy of the add adenine riboswitch relates folding to regulatory mechanism. Nucleic acids research. 39 (17), 7677-7687 (2011).
- Ritchie, D. B., Soong, J., Sikkema, W. K., Woodside, M. T. Anti-frameshifting ligand reduces the conformational plasticity of the SARS virus pseudoknot. Journal of the American Chemical Society. 136 (6), 2196-2199 (2014).
- Janissen, R., et al. Invincible DNA tethers: covalent DNA anchoring for enhanced temporal and force stability in magnetic tweezers experiments. Nucleic Acids Research. 42 (18), 137 (2014).
- Smith, S. B., Cui, Y., Bustamante, C. Overstretching B-DNA: The elastic response of individual double-stranded and single-stranded DNA molecules. Science. 271 (5250), 795 (1996).
- Puljung, M. C., Zagotta, W. N. Labeling of specific cysteines in proteins using reversible metal protection. Biophysical Journal. 100 (10), 2513-2521 (2011).
- Toseland, C. P. Fluorescent labeling and modification of proteins. Journal of Chemical Biology. 6 (3), 85-95 (2013).
- Hill, C. H., et al. Structural and molecular basis for Cardiovirus 2A protein as a viral gene expression switch. Nature Communications. 12 (1), 7166 (2021).
- Butterworth, S. On the theory of filter amplifiers. Experimental Wireless and the Wireless Engineer. 7, 536-541 (1930).
- Wang, M. D., Yin, H., Landick, R., Gelles, J., Block, S. M. Stretching DNA with optical tweezers. Biophysics Journal. 72 (3), 1335-1346 (1997).
- Mukhortava, A., et al. Structural heterogeneity of attC integron recombination sites revealed by optical tweezers. Nucleic Acids Research. 47 (4), 1861-1870 (2019).
- Buck, S., Pekarek, L., Caliskan, N. POTATO: An automated pipeline for batch analysis of optical tweezers data. bioRxiv. , (2021).
- Zhang, Y., Jiao, J., Rebane, A. A. Hidden Markov modeling with detailed balance and its application to single protein folding. Biophysical Journal. 111 (10), 2110-2124 (2016).
- Sgouralis, I., Pressé, S. An introduction to infinite HMMs for single-molecule data analysis. Biophysics Journal. 112 (10), 2021-2029 (2017).
- Müllner, F. E., Syed, S., Selvin, P. R., Sigworth, F. J. Improved hidden Markov models for molecular motors, part 1: basic theory. Biophysical Journal. 99 (11), 3684-3695 (2010).
- Elms, P. J., Chodera, J. D., Bustamante, C. J., Marqusee, S. Limitations of constant-force-feedback experiments. Biophysical Journal. 103 (7), 1490-1499 (2012).
- Re, A., Joshi, T., Kulberkyte, E., Morris, Q., Workman, C. T. RNA-protein interactions: an overview. Methods Molecular Biology. 1097, 491-521 (2014).
- Jankowsky, E., Harris, M. E. Specificity and nonspecificity in RNA-protein interactions. Nature reviews. Molecular Cell Biology. 16 (9), 533-544 (2015).
- Lim, F., Peabody, D. S. RNA recognition site of PP7 coat protein. Nucleic Acids Research. 30 (19), 4138-4144 (2002).
- Sunbul, M., Jäschke, A. SRB-2: a promiscuous rainbow aptamer for live-cell RNA imaging. Nucleic Acids Research. 46 (18), 110 (2018).
- Sanchez de Groot, N., et al. RNA structure drives interaction with proteins. Nature Communications. 10 (1), 3246 (2019).
- Zeffman, A., Hassard, S., Varani, G., Lever, A. The major HIV-1 packaging signal is an extended bulged stem loop whose structure is altered on interaction with the Gag polyprotein. Journal of Molecular Biology. 297 (4), 877-893 (2000).
- Mangeol, P., et al. Probing ribosomal protein-RNA interactions with an external force. Proceedings of the National Academy of Sciences. 108 (45), 18272 (2011).
- Luo, X., et al. Molecular mechanism of RNA recognition by Zinc-Finger antiviral protein. Cell Reports. 30 (1), 46-52 (2020).
- Qu, X., Lancaster, L., Noller, H. F., Bustamante, C., Tinoco, I. Ribosomal protein S1 unwinds double-stranded RNA in multiple steps. Proceedings of the National Academy of Science U. S. A. 109 (36), 14458-14463 (2012).
- Chandra, V., Hannan, Z., Xu, H., Mandal, M. Single-molecule analysis reveals multi-state folding of a guanine riboswitch. Nature Chemical Biology. 13 (2), 194-201 (2017).
- Savinov, A., Perez, C. F., Block, S. M. Single-molecule studies of riboswitch folding. Biochimica et Biophysica Acta. 1839 (10), 1030-1045 (2014).
- Kelly, J. A., et al. Structural and functional conservation of the programmed ribosomal frameshift signal of SARS coronavirus 2 (SARS-CoV-2). Journal of Biological Chemistry. 295 (31), 10741-10748 (2020).
- Neupane, K., et al. Structural dynamics of single SARS-CoV-2 pseudoknot molecules reveal topologically distinct conformers. Nature Communications. 12 (1), 4749 (2021).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Zheng, Q., Jockusch, S., Zhou, Z., Blanchard, S. C. The contribution of reactive oxygen species to the photobleaching of organic fluorophores. Photochemistry and Photobiology. 90 (2), 448-454 (2014).
- Deerinck, T. J. The application of fluorescent quantum dots to confocal, multiphoton, and electron microscopic imaging. Toxicologic Pathology. 36 (1), 112-116 (2008).
- Rill, N., Mukhortava, A., Lorenz, S., Tessmer, I. Alkyltransferase-like protein clusters scan DNA rapidly over long distances and recruit NER to alkyl-DNA lesions. Proceedings of the National Academy of Science U. S. A. 117 (17), 9318-9328 (2020).
- Swoboda, M., et al. Enzymatic oxygen scavenging for photostability without pH drop in single-molecule experiments. ACS Nano. 6 (7), 6364-6369 (2012).
- Aitken, C. E., Marshall, R. A., Puglisi, J. D. An oxygen scavenging system for improvement of dye stability in single-molecule fluorescence experiments. Biophysical Journal. 94 (5), 1826-1835 (2008).
- Wen, J. -. D., et al. Force unfolding kinetics of RNA using optical tweezers. I. Effects of experimental variables on measured results. Biophysical journal. 92 (9), 2996-3009 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved