Method Article
PCR טיפה דיגיטלית כדי לזהות מוטציות indels באוכלוסיות יתושים אנופלין מהונדס גנטית
In This Article
Summary
פרוטוקול זה מספק את השלבים החל מיצוי DNA ועד לערך ניסיוני עבור PCR טיפה דיגיטלית (ddPCR), כולל ניתוח לזיהוי וכימות של אירועי הצטרפות קצה לא הומולוגיים (NHEJ) באתרי יעד לאחר מחשוף Cas9 המושרה על ידי gRNA ותיקון DNA. שימושים אחרים בשיטה זו כוללים יישומים כגון זיהוי פולימורפיזם ואימות וריאנט עריכת גנים.
Abstract
ההתקדמות האחרונה בגנומיקה של יתושים וטכנולוגיות הנדסה גנטית טיפחה צורך בשיטות מהירות ויעילות לאיתור וריאציות ממוקדות של רצף דנ"א בקנה מידה גדול. באופן ספציפי, זיהוי הוספות ומחיקות (indels) באתרים בעריכת גנים שנוצרו על-ידי CRISPR מדריך RNA (gRNA)/Cas9 בתיווך הצטרפות קצה לא הומולוגית (NHEJ) חשוב להערכת הנאמנות של mutagenesis ואת התדירות של שינויים לא מכוונים. אנו מתארים כאן פרוטוקול עבור PCR טיפה דיגיטלית (ddPCR) כי הוא מתאים היטב לניתוח NHEJ תפוקה גבוהה. בעוד ששיטה זו אינה מפיקה נתונים המזהים וריאציית רצף בודדת, היא מספקת הערכה כמותית של וריאציית הרצף בתוך אוכלוסייה. בנוסף, עם משאבים מתאימים, פרוטוקול זה יכול להיות מיושם בהגדרת מעבדה באתר שדה בקלות רבה יותר מאשר הדור הבא או רצף Sanger. ל-ddPCR יש גם זמן מהיר יותר לתוצאות מאשר לאחת מהשיטות הללו, המאפשר ניתוח מהיר ומלא יותר של שונות גנטית באוכלוסיות בר במהלך ניסויי שדה של אורגניזמים מהונדסים גנטית.
Introduction
כונני גנים יש פוטנציאל עצום לשלוט אוכלוסיות חרקים של רלוונטיות רפואית וחקלאית1,2,3,4,5. לדוגמה, מערכות כונן גנים המבוססות על גרעיני CRISPR Cas ו- RNAs מנחים (gRNAs) יכולות לשמש לשינוי אוכלוסיות יתושים וקטוריות על ידי החדרת תכונות המעניקות refractoriness לטפילי מלריה המובילים להעברה מופחתת ופחותמחלות 1,4,5. מערכת כונן הגנים מעתיקה את עצמה ואת התכונה הקשורה מכרומוזום הומולוגי אחד למשנהו בתאי הנבט הטרום-מיוטיים, וזה מבטיח שרוב הצאצאים יירשו את הכונן וייצרו את הפוטנציאל לשינוי אוכלוסין ארוך טווח ובר קיימא בתחום. עם זאת, חיסרון אחד של שיטות מבוססות Cas / gRNA הוא האפשרות של יצירת מוטציות הכנסה ומחיקה (indel) באמצעות תיקון DNA הצטרפות קצה לא הומולוגית (NHEJ), וכתוצאה מכך יצירת אללים עמידים בפני כונן, אשר כאשר הצטבר לתדר גבוה מספיק באוכלוסייה, יכול לעצור את מערכת הכונן מלהפיץ1,2,3,4 . פרוטוקול זה מפרט שיטה בעלת תפוקה גבוהה ואמינה שיכולה לקבוע את השכיחות ואת הכמות היחסית של מוטציות בלתי-יציבות, הן ברמת האוכלוסייה והן ברמה האישית, במהלך כונן גנים מבוסס Cas/gRNA.
שיטות רצף מהדור הבא (NGS) מספקות רזולוציית רצף שאין דומה לה. עם זאת, העלות והדרישות הטכניות הקשורות ל- NGS אוסרות על בדיקות שגרתיות ומגבילים את השימוש בה כשיטת תפוקה גבוהה להערכת indels6,7,8. שיטות כימות PCR מסורתיות שימשו זה זמן רב כהליך ההערכה הסטנדרטי עבור indels גנום; עם זאת, שיטות אלה הן עבודה אינטנסיבית, לקחת זמן רב כדי להשיג נתונים, ויש להם רמה גבוהה של שונות. PCR Digital-Droplet (ddPCR) הוכח כרגיש יותר בזיהוי מוטציות מאשר רצף Sanger ביישומים מסוימים ויש לו מגבלת זיהוי נמוכה יותר מאשר NGS ביישומים אחרים6,7,8,9. יתר על כן, העלות להערכת ערכת מדגם וזמן סיבוב להשגת תוצאות היא פחות יקרה ומהירה יותר, בהתאמה, עבור ddPCR מאשר רצף סנגר או NGS9. באמצעות מערכת בדיקה כפולה, הבדיקה של Drop-Off מזהה אללים של NHEJ בהתבסס על היעדר רצף מסוג פראי (WT) באתר החיתוך Cas9 המיועד ל- GRNA. ב-assay זה, אמפליך קצר כולל אתר החיתוך החזוי של מערכת מבוססת Cas / gRNA מוגבר עם זוג פריימר ספציפי. בדיקה פלואורסצנטית אחת נועדה להיקשר לאזור שמור של האמפליקון וגשוש פלואורסצנטי אחר מזהה את רצף WT של אתר החיתוך. בנוכחות אלל NHEJ, האחרון לא ייקשר אמפלייקון.
השימוש ב- ddPCR מספק את היכולת לעצב פריימרים למחיקות יעד, הבדלים והוספות של זוג בסיס יחיד, שיאפשרו יצירת פרופיל NHEJ באוכלוסיית יתושים9. בהתחשב בתכונות אטרקטיביות אלה, יצרנו פרוטוקול עבור ddPCR לזיהוי תפוקה גבוהה של indels שנוצרו ממערכת כונן גנים מבוססת Cas / gRNA יתושים.
Protocol
1. מיצוי דנ"א
- הכן EDTA / גרעין ליסיס חוצץ (EDTA / NLS) עם היחס של 500 μL של NLS ו 120 μL של EDTA לכל מדגם. התאם קנה מידה עבור דגימות מרובות. מצננים את התערובת על קרח.
הערה: הפתרון יהפוך מעונן תוך 2-5 דקות כאשר הוא מצונן בהתאם לנפח. - הומוגניזציה דגימת יתוש באמצעות homogenizer מכני עבור 10-15 s בצינור microcentrifuge 1.5 מ"ל מלא 600 μL של EDTA / NLS צונן; מערבבים היטב.
- הוסיפו לצינור 17.5 מיקרו-אל של 20 מ"ג/מ"ל של פרוטאינאז K וערבבו היטב.
- דגירה לילה ב 55 °C (55 °F). לחלופין, לדגור את המדגם ב 55 °C (55 °F) במשך 3 שעות עם רועד מערבולת המדגם כל 1 שעה.
- הוסף 200 μL של פתרון משקעים חלבון לדגימת טמפרטורת החדר מערבולת במרץ עבור 20 s.
- מצננים את הדגימה במשך 5 דקות על קרח.
- צנטריפוגה הדגימה לחלבונים כדוריים ב 15,890 RCF במשך 4 דקות.
- בזהירות לשאוף את supernatant אשר מכיל את ה- DNA ולהעביר אותו צינור microcentrifuge 1.5 מ"ל נקי המכיל 600 μL של איזופרופנול.
- מערבבים בעדינות את התמיסה על ידי היפוך הצינור 5-10 פעמים. צנטריפוגה לדקה אחת ב-15,890 RCF. בזהירות decant supernatant תוך שמירה על כדורי ה- DNA.
- הוסף 600 μL של טמפרטורת החדר 70% אתנול. לשטוף את ה- DNA גלולה על ידי היפוך עדין של הצינור.
- צנטריפוגה לדקה אחת ב-15,890 RCF. הסר בזהירות את supernatant על ידי שאיפה באמצעות קצה פיפטה זכוכית.
- הפוך את הצינור על נייר סופג נקי וייבש את הכדור במשך 10-15 דקות.
- resuspend DNA עם מים באיכות PCR. השתמש 20 μL לדגימת יתוש בודדת או 100 μL עבור 10 יתושים מ pooled.
הערה: שיטות מיצוי DNA עבור דגימות יתושים באמצעות ערכה זמינה מסחרית (ראה טבלה של חומרים ) מותאמיםמן ה- DNA הגנומי המבודד של היצרן מתאי תרבות רקמות ופרוטוקול רקמת בעלי חיים.
2. תגובות ddPCR והכנת דור טיפות
- לכמת דנ"א באמצעות פלואורומטר.
הערה: עבור הבדיקה הנפתחת, מומלץ להשתמש בטווח של 3,000-30,000 עותקי גנום הפלואידים לכל תגובה, אשר נועד לזהות אירועי NHEJ עם בדיקה תיוג HEX שנקשר לרצף WT של אתר החיתוך הממוקד ולא יעבור (שחרור) אם יש מחיקה או הכנסה באתר היעד, המציין את נוכחותה של גרסה של NHEJ. - חשב את מספר העותק באמצעות משקל הגנום הפלואיד וריכוז ה- DNA בתמצית. זה נעשה על ידי הכפלת הריכוז של ה- DNA שחולץ על ידי הנפח המשמש להשגת מסת ה- DNA הכוללת, ולאחר מכן חלוקתה לפי משקל הגנום ההפלואידי. ודא כי אמצעי האחסון שנוסף הוא בין 1-10 μL. לדלל לפי הצורך כדי להיות בטווח העתקת הגנום ההפלואידי המומלץ.
הערה: גנום פלואיד אחד אנופלס גמביה מוערך להיות 0.27 pg לכל יתוש מבוגר10. - עיצוב פריימרים ובדיקות. עיצוב פריימרים אוליגונוקלאוטיד קדימה ואחורה עם טמפרטורת התמיתה פריימר (Tm) בטווח של 55-60 °C (55-60 °F) המאגפים את הקצוות של 5'- ו -3 'של אתר היעד gRNA המייצר אמפליקון של 150-400 bp.
- HEX (Hexachloro-fluorescein) -תווית בדיקה לזיהוי NHEJ: עיצוב אוליגונוקלאוטיד של ~ 15-20 bp אורך משלים לאתר היעד ולהוסיף את ה- HEX-בדיקה ל 5 '-סוף ו BHQ1 (BLack חור Quencher 1) לסוף 3 '. Tm של גשושית הידרוליזה צריך להיות 3-10 °C (50 °F) גבוה יותר מאשר Tm של פריימרים.
- FAM (6-carboxyfluorescein)-שכותרתו בדיקה לעיון WT: עיצוב oligonucleotide ~ 15-20 bp אורך משלים לאתר גנום שמור רחוק (כ 25 bp) מאתר היעד ולהוסיף את FAM-בדיקה 5'-end ו BHQ1 עד הסוף 3 '. Tm של גשושית הידרוליזה צריך להיות 3-10 °C (50 °F) גבוה יותר מאשר Tm של פריימרים.
3. הכנת תגובת PCR
- הכן 25 μL של תערובת מדגם ddPCR עם הרכיבים הבאים: ddPCR supermix עבור בדיקות (ללא UTP): 12.5 μL, פריימרים קדימה ואחורה (10 מיקרומטר): 1 μL כל אחד, בדיקות HEX / FAM (10 מיקרומטר): 0.625 μL כל אחד, DNA: 1-5 μL (3,750-37,500 עותקים של גנום הפלואיד) ומים: עד 25 μL.
- מערבבים ביסודיות את התגובות על ידי מערבולת או צנרת ריפלוקס (למעלה ולמטה) (20x).
הערה: אם התגובות הן בצלחת 96-well, pipette את כל הנפח למעלה ולמטה 20 פעמים במקום מערבולת כדי למנוע היווצרות בועה. - צנטריפוגות בקצרה את הדגימות כדי ליישב את התערובת בתחתית הצינור או היטב.
הערה: ודאו שהתגובות בטמפרטורת החדר עבור דור הטיפות. הכן 1x של תערובת ddPCR עבור בארות נוספות / לא בשימוש בכל מחסנית (לכל מחסנית יש 8 בארות).
4. דור טיפות
- באמצעות pipette רב ערוצי 50 μL, לטעון 20 μL של תערובת דגימת ddPCR לתוך השורה האמצעית של המחסנית(איור 1A,למעלה).
- טען 70 μL של השמן לשורה התחתונה. טען 20 μL של 1x ddPCR supermix לתוך בארות שאינן בשימוש.
הערה: אל תציג בועות. - מניחים את האטם נוגע רק בקצוות, תוך הימנעות מהאזור הקסם המרכזי(איור 1B).
- מניחים את הצלחת בבטחה בגנרטור טיפה ולסגור את הכיסוי כדי להתחיל את הריצה.
- באמצעות פיפטה רב ערוצית, להעביר 40 μL של תערובת emersion מהשורה העליונה של המחסנית(איור 1A,למטה) לתוך צלחת 96-well.
- צייר מדגם נוזלי עבור 3-5 s בזווית של 45-30°. לגרש את התערובת לאט במשך מעל 3 s בזווית של 45 ° לתוך הצד של הבאר, ומאפשר לו לטפטף במורד הצד. זה בסדר ללכת לתחנה השנייה (גירוש מוחלט) של הפיפטה כדי לגרש את כל הנוזל.
- באמצעות אטמי חום רדיד אלומיניום, לאטום את הצלחות במשך 5 s ב 180 °C (5 °F).
5. פי.סי.אר
- הניחו את הלוח האטום על התרמוציקלר (איור 1C) והגדירו את תנאי ה- PCR המומלצים אם הם פועלים בהתאם להנחיות ההורדה של NHEJ כדלקמן:
- דנטורציה ראשונית ב 95 °C (75 °F) במשך 10 דקות.
- הגדר 40 מחזורים של 94 °C (70 °F) עבור 30 °C כדי denature, 55 °C (55 °F) במשך 1 דקות עד חין, ו 60 °C (70 °F) במשך 2 דקות כדי להאריך.
- החזק ב 98 °C (70 °F) במשך 10 דקות.
- החזק ב 4 °C (5 °F).
הערה: טמפרטורת חישול עבור פריימרים ספציפיים וערכות בדיקה עשוי להיות ממוטב באמצעות שיפוע תרמי. השתמש בקצב הרמפה של 2 °C (50°) לחודש עבור כל השלבים. יש להתאים את תנאי ה-PCR בהתאם לכל עיצוב ותפאורה ניסיוניים.
6. קריאת טיפות
- מקם את הצלחת בבטחה בקורא הטיפות עם A-1 היטב בפינה השמאלית העליונה (פינה חלקה, שלושת האחרים הם קצה) (איור 1D).
- הגדרת הלוח בתוכנית: הגדרת FAM כערוץ הייחוס הידוע ו- HEX כערוץ הלא ידוע(איור 2A).
- הפעל את ניסוי הקריאה טיפה כימות ישיר. לאחר סיום הריצה, שנה את סוג הניסוי ל-Drop-off (DOF) עבור הניתוח (איור 2A).
7. ניתוח
- ייעד את הפרמטרים הניסיוניים הנכונים (איור 2A): מידע לדוגמה, SuperMix, שם יעד (WT או NHEJ), סוג יעד (Ref או לא ידוע), אות Ch1 (HEX או FAM), Signal Ch2 (HEX או FAM) והגדר באופן ידני את הסף לספירת טיפות (מומלץ מעל 10,000 לתוצאות אמינות). התוכנה תבצע את רוב הניתוח עם הפרמטר המיועד.
- בדוק את ספירת הטיפות בכרטיסיה טיפה; ודא שכולם מעל 10,000(איור 2B).
- בדוק משרעת 1 D להפרדת אותות יעילה מתשלילים.
- בעורך הלוחות, סמן את כל הצלחת והגדר את סוג הניסוי כדי להשיל.
- הגדר את יעד WT כהפניה, וייעד ערוץ אחד עבור FAM ואת ערוץ שני עבור HEX.
- הגדר את יעד NHEJ כלא ידוע, וייעד את ערוץ 1 עבור FAM ואת ערוץ 2 כאפס.
- בכרטיסיה משרעת דו-ממדית, הגדר את סף האשכול עם כלי הגרף עבור כל דגימה. שקול את הזנב המשויך לאשכול WT; זה נורמלי לבדיקות NHEJ(איור 3A).
הערה: תחת הכרטיסיה יחס, לחץ על סמל גלגל השיניים מהימין השמאלי העליון של הגרף. בחר את שפע חלקי. הגרף יתווה כעת נקודה המתאימה לאחוז אירועי NHEJ (איור 3B).
תוצאות
יישום של הליך זה מופיע Carballar-Lejarazú ואח'9. בדיקת ההורדה של ddPCR משתמשת בשתי בדיקות פלואורסצנטיות כדי להבחין ברצף WT ונפחי אי-די: גשושית FAM נקשרת לרצף שמור בתוך האמפליקון, ואילו הגשושית HEX מכוונת לרצף ה- WT של האתר הממוקד(איור 4A). בנוכחות אי-דל, גשושית HEX לא תיקשר. תוצאות מייצגות ניתן למצוא באיור 2, טבלה 1, ושולחן 2 של קרבאלאר-לג'ארזו ואח '9. באמצעות פרוטוקול זה, הוכח כי ddPCR מזהה מגוון רחב של אירועי CRISPR-Cas9 המושרים ב- NHEJ ולכומת את תדר NHEJ במדגם בודד או מ ומאוחסן. 15 דגימות שונות של 10 יתושים כל אחת הכילו אללים שונים של NHEJ (טבלה 2 של קרבלאר-לג'ארזו ואח'9). אלה נותחו עם ddPCR באמצעות הפרוטוקול והפרמטרים שהוצגו כאן. תוצאות טבלה19 מראות כי כל 15 הדגימות נשאו 100% אללים לא לידיים כפי שזוהו על ידי אסיפת ההורדה(איור 4B). בניסוי אחר, 11 דגימות של יתושי WT ויתושים NHEJ עם אחוזי NHEJ שונים (0%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, ו -100%) נבדקו עם פרוטוקול ddPCR זה, והתוצאות (איור 2; Carballar- Lejarazú ואח '9) הראה כי האחוז שזוהה קרוב לטכניקה השוואתית של זיהוי איdel על ידי ניתוח Amplicon (איור 4C).

איור 1: תפאורה והליך ניסיוניים. (A)הכנת מחסנית לייצור טיפות. (למעלה) דוגמאות מתמלאות בשורה האמצעית של המחסנית, בעוד שמן מתמלא בשורה התחתונה. (למטה) שורה עליונה מלאה בטיפות אמולסיה לאחר יצירת טיפות. (B)גנרטור טיפה עם מחסנית מלאה בדגימה ומכוסה אטם במקום. (C)צלחת 96-באר מכוסה חותם רדיד אלומיניום ב Thermo-Cycler. (D)קורא טיפות עם צלחת 96 היטב במקום עם כיסוי מתכת נצמד מעל הצלחת כדי לאבטח אותו. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
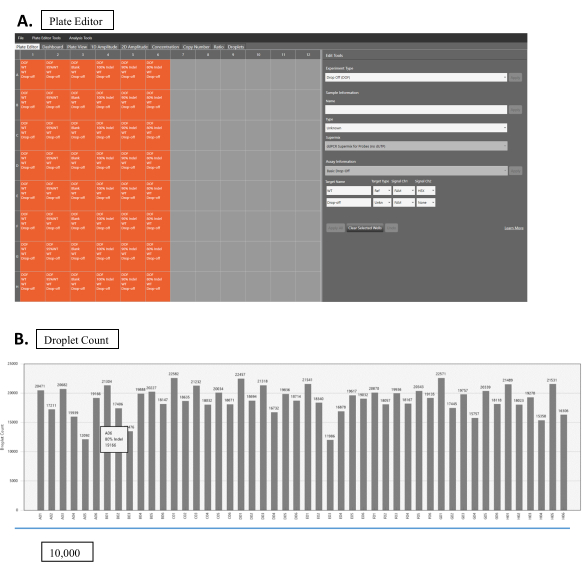
איור 2: קריאת טיפות. (A)ממשק תוכנה לקריאת טיפות. קופסאות כתומות מראות בארות עם דוגמאות. קופסאות אפורות הן בארות ריקות. פרמטרים ניסיוניים מוגדרים בחלונית 'עריכת כלים' (צד ימין). ניתן לערוך כל דוגמה על-ידי לחיצה על התיבה לדוגמה המתאימה. בחר שחרור (DOF) עבור סוג ניסיוני. במידע לדוגמה, מלא את המידע המתאים עבור השם והסוגשל הדגימה , כמו גם SuperMix. בחר את ההורדה הבסיסית עבור מידע ה- Assay. עבור מדגם WT, בחר WT עבור שם היעד, Ref עבור סוג יעד, וגם FAM ו- HEX עבור אות Ch1 ו- Ch2, בהתאמה. עבור דוגמאות NHEJ, מלא את השם המתאים עבור שם היעד, בחר לא ידוע עבור סוג היעדובחר FAM עבור אותות Ch1. השאר אות Ch2 ב-None. (B)תוצאות ספירת טיפות עבור דגימות מרובות. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
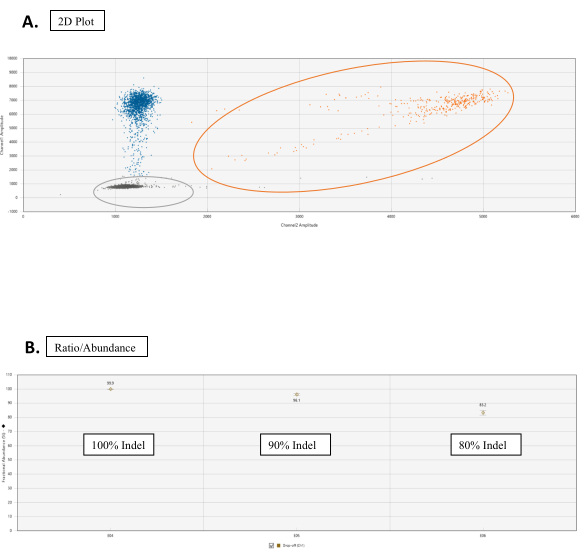
איור 3: ניתוח ירידה. (A)חלקת אשכול 2D לספירת הטיפות של אללס WT ו- NHEJ. בכרטיסיה משרעת דו-פלט, כל הטיפות אינן מסווגות כברירת מחדל. באיור זה, צבעים מוקצים באופן ידני להבחנה. אשכול הנקודות הכתומות הוא ספירת אלל WT המתקבלת על ידי כריכה של בדיקות FAM ו- HEX ברצף הייחוס וברצף אתר היעד, בהתאמה. נקודות כחולות מייצגות עשרות טיפות בעלות איגוד FAM לרצף הייחוס אך ללא איגוד HEX ברצף אתר היעד (ומכאן מסירה של HEX). נקודות אפורות הן טיפות ריקות שאין בהן איגוד FAM או HEX. (B)גרפי יחס/שפע של אירועי NHEJ. תחת הכרטיסיה יחס, בחר שפע שברים עבור גרף עם אחוז הכתב של אירועי NHEJ. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
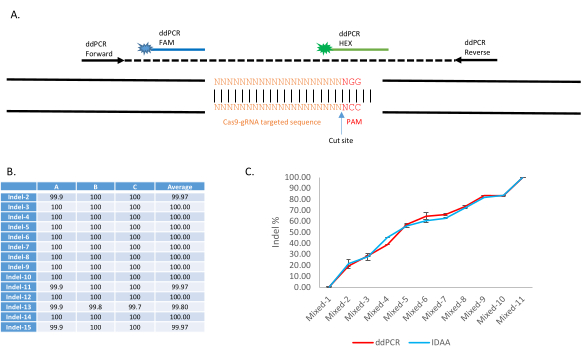
איור 4: יישום של בדיקת מסירה עם ddPCR לזיהוי וכימות לא הומולוגיים של הצטרפות קצה בקו האנופלים המהונדסים, AsMCRkh1. (A)מצגת סכמטית של בדיקת ההורדה של ddPCR כדי לזהות מוטציות באתר דנ"א ממוקד עם מערכת בדיקה כפולה. אמפליסון של 150-400 bp מוגבר עם פריימרים קדימה והפוך. בדיקה בעלת תווית FAM מתוכננת להיקשר לרצף שמור של האמפליקון, בעוד שגשושית עם תווית HEX מיועדת להיקשר לאתר היעד של WT gRNA. (ב)זיהוי סוגים שונים של indels עם ddPCR. 15 בריכות של 10 יתושי AsMCRkh1 שכל אחת מהן מכילה סוגים שונים של אי-די- אל, כולל החדרה, מחיקה והחלפה, נותחו בבדיקת ההורדה של ddPCR. פרטים על מוטציות ורצפים ניתן למצוא בטבלה 2 ושולחן S3 של Carballar ואח' . 9.(C)כימות של NHEJ בדגימות מעורבות של יתושי AsMCRkh1 ו- WT ביחסים שונים (10:0, 9:1, 8:2, 7:3, 6:4, 5:5, 4:6, 3:7, 2:8, 1:9 ו- 0:10) באמצעות ddPCR וטכניקה מושוות של זיהוי אינד על ידי ניתוח אמפלייקון9. תמונות שעובדו מ Carballar-Lejarazú ואח 'ביוטכנולוגיה. 68(4):172-179 (2020)9. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
| פריימר/בדיקה | רצף (5' » 3') |
| פריימר קדמי של ddPCR | ATGATCAAATGTCGACCG |
| פריימר הפוך של ddPCR | ACCGTACTGGTTGAACA |
| ddPCR HEX Probe (BHQ1) | [HEX]-TTCTACGGGCAGC-[BHQ1] |
| ddPCR FAM Probe (BHQ1) | [6FAM]-CCACGTGGGGTCGAAGG-[BHQ1] |
| HEX: Hexachloro-fluorescein, FAM: 6-קרבוקסיפלואורסצ'ין, BHQ: חור שחור Quencher | |
טבלה 1: רצפים של פריימרים ובדיקות.
Discussion
PCR טיפה דיגיטלית היא שיטה יעילה כדי לקבוע את נוכחותם של אללים indel הנובעים מאירועי NHEJ במערכת כונן גנים מבוסס Cas / gRNA ומאפשר כימות של התדירות של אללים אלה אצל יחידים או אוכלוסיות. כמה שלבים של הפרוטוקול צריך להיות אחריו עם טיפול מיוחד כדי להשיג תוצאות אמינות. ראשית, מיצוי ה- DNA הגנומי צריך להתבצע בקפידה כדי להבטיח איכות גבוהה וכמות מספקת. מיצוי טוב יאפשר קביעה מדויקת של העתקי הגנום הפלוידים לכל תגובה. מניסיוננו, ערכה זמינה מסחרית (ראה טבלת חומרים)סיפקה עקירות DNA באיכות גבוהה באופן עקבי. עם זאת, עקירות של יתושים בודדים יכול להוכיח להיות מאתגר במיוחד כמו גלולה DNA הופך להיות קשה לדמיין והוא יכול בקלות להישאב עם supernatant אם לא זהיר. שנית, פריימרים ובדיקות חייבים להיות מתוכננים בקפידה. לפני השלמת ניסוי ddPCR, ודא כי פריימרים מעוצבים לגרום מוצר PCR יחיד על ידי ביצוע תחילה PCR מסורתי ודמיון מוצר אחד באמצעות אלקטרופורזה ג'ל. יש גם לתכנן את בדיקת הייחוס FAM כך שהיא משלימה לרצף שמור ביותר. זה יבטיח זיהוי מדויק של אללים WT ברחבי אוכלוסייה מגוונת. שילובי פריימר /בדיקה עבור כל ניסוי ייחודי יהיו תנאי תרמוציקלר שונים, ומומלץ לייעל תנאים אלה באמצעות שיפוע תרמי.
קיימות שיטות אחרות לזיהוי התראות, כגון ריצוף Sanger או NGS. רצף סנגר מוגבל מכיוון שיש לו גבול נמוך יותר של זיהוי וכוח גילוי נמוך כדי לזהות גרסאות חדשניות. רצף סנגר הוא גם עבודה אינטנסיבית ואינו תפוקה גבוהה. בהשוואה לרצף של סנגר, ל- NGS אין את אותן מגבלות של רגישות נמוכה, כוח גילוי ותפוקה. יתרון נוסף של NGS הוא יכולתה לזהות מגוון מוטציות מפולימורפיזם נוקלאוטיד יחיד (SNPs) לסידור מחדש. עם זאת, NGS היא שיטה יקרה יותר וגוזלת זמן ביישום קביעת דליים הקשורים Cas9/gRNA מכיוון שיש רק אזור יעד אחד של עניין, והוא מתאים ביותר עבור ניתוחים גדולים יותר ברחבי הגנום. בהשוואה לשיטות הנ"ל, ddPCR הוא תפוקה גבוהה ויש לו זמן סיבוב מהיר. אם החומרים והמכשירים של ddPCR זמינים בתוך הבית, ניתן לעבד 96 דגימות תוך 1-2 ימים, מה שהופך אותו מתאים לניתוח מהיר של ניסויים גדולים של אורגניזמים שעברו שינוי ב- Cas9/ gRNA.
בעוד יתרונות רבים קיימים עבור ddPCR יש גם מגבלות. ראשית, ציוד ddPCR אינו זמין לעתים קרובות בסביבת מעבדה עצמאית. ציוד ddPCR עשוי להיות זמין באופן משותף במוסדות מחקר גדולים יותר, אך זה אינו מאפשר קלות של ייצור נתונים וניתוח מחוץ למוסד. שנית, בניגוד לחלופות, ddPCR אינו מספק את הרצפים הייחודיים הבודדים של מוטציות indel מזוהות. PCR טיפה דיגיטלית יספק את התדירות של מוטציות indel בתוך האוכלוסייה, אבל ללא הרצף, אי אפשר לקבוע אם indels הנוכחי נוטים יותר לשמר או לעכב את הפונקציה של הגן של עניין. שיטת ddPCR אולי מתאימה ביותר לנתח אוכלוסיות בר לאחר ניסוי שחרור שדה של אורגניזם כונן מבוסס Cas9 / gRNA מכיוון שהיא יכולה לקבוע ביעילות את תדירות הכניסה של הטרנסג'ן לאוכלוסייה הילידית ואת דור ההטבעות בתוך האוכלוסייה קרוב לזמן אמת. בשל זמן ההסתובבות המהיר של ddPCR, יהיה זה אפשרי לבצע דגימה ולנתח את האוכלוסייה באזור ניסוי שדה שבועי אם חומרים היו זמינים באופן מקומי. עלויות ההפעלה לרכישה, ייבוא והקמה של ציוד ddPCR יהיו גבוהות במעבדות מרוחקות, אך היתרונות של היכולת להעריך בקפדנות אוכלוסייה פראית כפי שהיא עוברת שינוי ממערכת כונן יצדיקו את העלויות.
Disclosures
למחברים אין גילויים.
Acknowledgements
המימון ניתן על ידי יוזמת מלריה של אוניברסיטת קליפורניה אירוויין. AAJ הוא פרופסור דונלד ברן באוניברסיטת קליפורניה, אירווין.
Materials
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| ddPCR Super Mix for Probes (no dUTP) | Bio-Rad | 1863024 | |
| DNA extraction reagent (e.g. Wizard Genomic DNA Purification kit) | Promega | A1120 | |
| EDTA (pH 8.0) | Invitrogen | AM9260G | |
| Ethanol, 200 Proof | Thermo Fisher Scientific | A4094 | |
| Isopropanol (Certified ACS) | Thermo Fisher Scientific | A416-500 | |
| Nuclei Lysis Solution (NLS) (Wizard Genomic DNA Purification kit) | Promega | A1120 | |
| PCR-grade Water | Any certified PCR-grade water can be used | ||
| Protein Precipitation Solution (Wizard Genomic DNA Purification kit) | Promega | A1120 | |
| Proteinase K 20 mg/mL | Thermo Fisher Scientific | AM2546 | |
| Materials | |||
| ddPCR 96-Well Plate | Bio-Rad | 12001925 | |
| Droplet Generator DG8 Cartridge and Gaskets | Bio-Rad | 1864007 | |
| Droplet Generation Oil for probes | Bio-Rad | 1863005 | |
| Fluorescent probes (e.g. FAM/HEX probes) | Sigma-Aldrich | N/A | Probes are experiment specific and can be purchased from any certified seller available. |
| Forward and Reverse oligonucleotide primers | Sigma-Aldrich | N/A | Primers are experiment specific and can be purchased from any certified seller available. |
| Equipment | |||
| C1000 Touch Thermal Cycler | Bio-Rad | 1851148 | Can use other Thermo cycler with gradient function and deep well |
References
- Gantz, V. M., et al. Highly efficient Cas9-mediated gene drive for population modification of the malaria vector mosquito Anopheles stephensi. Proceedings of the National Academy of Sciences of the United States of America. 112 (49), 6736-6743 (2015).
- Hammond, A., et al. A CRISPR-Cas9 gene drive system targeting female reproduction in the malaria mosquito vector Anopheles gambiae. Nature Biotechnology. 34, 78-83 (2016).
- Courtier-Orgogozo, V., Morizot, B., Boëte, C. Agricultural pest control with CRISPR-based gene drive: time for public debate: Should we use gene drive for pest control. EMBO Reports. 18 (6), 878-880 (2017).
- Carballar-Lejarazú, R., et al. Next-generation gene drive for population modification of the malaria vector mosquito, Anopheles gambiae. Proceedings of the National Academy of Sciences of the United States of America. 117 (37), 22805-22814 (2020).
- Adolfi, A., et al. Efficient population modification gene-drive rescue system in the malaria mosquito Anopheles stephensi. Nature Communications. 11, 5553 (2020).
- Wang, Z., et al. Comparison of droplet digital PCR and direct Sanger sequencing for the detection of the BRAFV600E mutation in papillary thyroid carcinoma. Journal of Clinical Laboratory Analysis. 33 (6), 22902 (2019).
- Dong, L., Wang, S., Fu, B., Wang, J. Evaluation of droplet digital PCR and next generation sequencing for characterizing DNA reference material for KRAS mutation detection. Scientific Reports. 8 (1), 9650 (2018).
- Bell, C. C., Magor, G. W., Gillinder, K. R., Perkins, A. C. A high-throughput screening strategy for detecting CRISPR_Cas9 induced mutations using next-generation sequencing. BMC Genomics. 15 (1), 1002 (2014).
- Carballar-Lejarazú, R., Kelsey, A., Pham, T. B., Bennett, E. P., James, A. A. Digital droplet PCR and IDAA for the detection of CRISPR indel edits in the malaria species Anopheles stephensi. Biotechniques. 68 (4), 172-179 (2020).
- Holt, R. A., et al. The genome sequence of the malaria mosquito Anopheles gambiae. Science. 298 (5591), 129-149 (2002).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved