A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מדידות העברת אנרגיה תהודה Förster בתאי צמח חיים
In This Article
Summary
פרוטוקול מסופק להגדרת מיקרוסקופ סטנדרטי לסריקת לייזר קונפוקלית למדידות העברת אנרגיה תהודה של vivo Förster, ולאחריו הערכת נתונים.
Abstract
ניסויי העברת אנרגיית תהודה (FRET) מבוססי פליטה רגישים נעשים בקלות אך תלויים במערך המיקרוסקופי. מיקרוסקופי סריקת לייזר קונפוקליים הפכו לסוס עבודה לביולוגים. מערכות מסחריות מציעות גמישות גבוהה בהתאמת כוח לייזר וברגישות לגלאיים ולעתים קרובות משלבות גלאים שונים כדי להשיג את התמונה המושלמת. עם זאת, ההשוואה של נתונים מבוססי עוצמה מניסויים והגדרות שונות היא לעתים קרובות בלתי אפשרית בשל גמישות זו. נהלים ידידותיים לביולוגים הם יתרון ומאפשרים התאמה פשוטה ואמינה של הגדרות לייזר וגלאי.
יתר על כן, כמו ניסויי FRET בתאים חיים מושפעים השונות ביטוי חלבון ויחסי מקבל תורם, רמות ביטוי חלבון חייב להיחשב להערכת נתונים. מתואר כאן פרוטוקול פשוט למדידות FRET אמינות ושחזוריות, כולל שגרות להערכת ביטוי חלבון והתאמה של עוצמת הלייזר והגדרות הגלאי. הערכת נתונים תבוצע על ידי כיול עם היתוך פלואורופור של יעילות FRET ידועה. כדי לשפר את הפשטות, גורמי תיקון הושוו כי הושגו בתאים ועל ידי מדידת חלבונים פלואורסצנטיים רקומביננטיים.
Introduction
העברת אנרגיית תהודה Förster ((F)RET) הוא נצפה בדרך כלל על ידי ספקטרוסקופיה פלואורסצנטית, אם כי התהליך עצמו אינו מוגבל להתרחש בין פלואורופורים. צימוד הדיפול-דיפול הבסיסי פשוט דורש מולקולת תורם פולטת אור ומקבל סופג אור. זה נגזר מהחופה הספקטרלית הנדרשת אינטגרל J של פליטת התורם מנורמל וספקטרום ספיגת מקבל1. עם זאת, מכיוון ש-RET מתחרה בפלואורסצנטיות, העברת האנרגיה הופכת למדידה על ידי שינויים בפליטת פלואורסצנטיות: RET גורמת להרוות תורמים ולפליטת קבלים רגישה.
RET מבוסס פלואורופור זכה לכינוי העברת אנרגיית תהודה פלואורסצנטית (FRET) כדי להפריד אותו מהעברת אנרגיית תהודה ביו-לומינציה (BRET). RET תלוי מאוד על המרחק בין התורם ומקבל, אשר נמצא באופן נרחב בטווח של 0.5-10 nm2 ולכן, באותו טווח כמו מידות החלבונים והמתחמים שלהם. שנית, RET תלויה בקאפה בכיוון דיפול-דיפול בריבוע. בשילוב עם העובדה כי חופש סיבובי של פלואורופורים הקשורים לחלבון ניתן להזניח בשל המשקל המולקולרי ואת הרפיה סיבובית איטית, RET מאפשר ניתוח של שינויים קונפורמיים3.
מה שמכונה רדיוס Förster מבוסס על אינטגרל החפיפה הספקטרלית וטווח אורך הגל של החפיפה, כך שכרומופורים סופגי אור אדום גורמים לראדי Förster ארוך יותר מאשר צבעים סופגי אור כחולים. מכיוון שהטווח הדינמי של מדידות FRET מוגבל ב- 0.5 × R0 ו- 1.5 × R0, לזוג FRET ECFP-EYFP יש טווח דינמי של 2.5-7.3 ננומטר בשל R0 של 4.9 nm4.
הבהירות של פלואורופור ניתנת על ידי תוצר מקדם ההכחדה הטוחנת שלו והתשואה הקוונטית שלו. עבור מדידות FRET, כדאי לבחור פלואורופורים של בהירות כמעט דומה. זה משפר את הזיהוי של מרווה תורם ופליטת קבלה רגישה. זה גם מעדיף את הכיול של מערכת המיקרוסקופיה. כשמסתכלים על זוגות FRET הנפוצים של חלבוני ציאן ופלואורסצנטי, הבהירות הנמוכה יותר של חלבוני הציאן פלואורסצנטיים הופכת לברורה (איור 1A).
עם זאת, אורך החיים של המקבל חייב להיות נמוך יותר מחייו של התורם, הבטחת הזמינות של הקבלן להעברת אנרגיה. אם חייו של המקבל עולים על חייו של התורם, המקבל עשוי עדיין להיות במצב הנרגש כאשר התורם מתרגש שוב. חלבונים פלואורסצנטיים ציאן מתקדמים כגון mTurquoise מראים אורך חיים ממושך ובכך תורמים להסתברות מוגברת של FRET (איור 1B). ההסתברות של FRET תלויה גם במקדם ההכחדה הטוחנת של המקבל.
Protocol
הערה: עבור הפרוטוקול הבא, הארכה ארעית של protoplasts בוצעה, כפי שתואר קודם לכן12. תיאור קצר ניתן להלן.
1. עבירה חולפת של פרוטופלסטים
- חותכים ~ 4 גרם של עלים בריאים של Arabidopsis thaliana ecotype קולומביה לפרוסות 1 מ"מ ולהעביר אותם ל 20 מ"ל של פתרון אנזימים (1.5% צלולאז; 0.4% macerozyme; 0.1% אלבומין סרום בקר שבר V; 0.4 M מניטול; 20 mM KCl; 20 mM 2-(N-מורפולינו)חומצה אתנולנית (MES), pH 5.7; 10 mM CaCl2).
- לחדור ואקום פרוסות העלה ואחריו דגירה עם תסיסה במשך 2 שעות בטמפרטורת החדר. לקצור את התאים על ידי צנטריפוגה במשך 3 דקות ב 100 × גרם.
- לשטוף את הפרוטופלסטים עם פתרון W5 (154 mM NaCl; 125 מ"מ CaCl2; 5 mM KCl; 2 mM MES, pH 5.7) ולהיעלות אותם מחדש בפתרון MMG (0.4 M מניטול; 15 מ"מ MgCl2; 4 mM MES, pH 5.7).
- בצע את transfection במגלשה 8-באר על ידי הלם אוסמוטי בנוכחות פוליאתילנגליקול (PEG) 4000. לערבב 20 μL של השעיית protoplast עם 5 μL של DNA plasmid (5 מיקרוגרם / μL) ו 25 μL של פתרון PEG (0.2 M מניטול, 0.1 M CaCl2, 40% PEG 4000).
- הפוך את ההלם האוסמוטי על ידי הסתגלות עדינה של התנאים האוסמוטיים.
הערה: מלבד מדגם העניין, הביטוי של תורם בלבד ומקבל בלבד נדרש כדי לקבוע את הדימום הספקטרלי של התורם ואת הקבלה, בהתאמה. חלבון היתוך של התורם והמקבל חייב לבוא לידי ביטוי גם למטרות כיול. ביטוי החלבון הפלואורסצנטי היה בשליטתו של מקדם פסיפס כרובית 35S (pCaMV35S). עבור כל המדידות, נעשה שימוש בשני מיקרוסקופים לסריקת לייזר קונפוקליים (LSM1 ו- LSM2). ל- LSM1 יש שני סוגים של גלאים: עבור מדידות FRET, אות התורם זוהה על ידי גלאי GaAsP, בעוד FRET ופליטת acceptor נרשמו עם photomultiplier. LSM2 יש שני photomultipliers, אשר שימשו לאיתור של תורם, FRET, ופליטת acceptor.
2. התאמת לייזר
הערה: כאן, קווים 458 ננומטר ו 514 ננומטר של לייזר ארגון-יון הוחלו לניתוח FRET בין חלבון ציאן פלואורסצנטי משופר (ECFP)- וחלבונים פלואורסצנטיים צהובים משופרים (EYFP). לרכישת נתונים ניתנים לשחזור, שני הקווים הותאמו לעוצמה דומה. זה הושג על ידי או פוטומולטילייר שידור או מצב השתקפות.
- התאמת לייזר עם פוטומוליפלייר שידור
- השתמש בבאר ריקה להתאמה.
- בחרו 'מצב סריקת שורות' ותצוגת היסטוגרמה.
- להקטין את עוצמת הלייזר למינימום, ולהתאים את רווח הגלאי לרעשי רקע הניתנים לזיהוי.
- הגדל את עוצמת הלייזר בשלבים של 0.5% ורשום את האות המתאים.
- החל את השגרה עבור שני קווי לייזר.
- התאמת לייזר עם מצב השתקפות
- השתמש בבאר ריקה להתאמה.
- החל מסנן השתקפות, עבור את מצב ההשתקפות, אם הוא זמין.
- ודא כי טווח גל הגל גלאי מכסה את אורך הגל של הלייזר.
- בחר את מצב סריקת הקו ואת תצוגת היסטוגרמה.
- להקטין את עוצמת הלייזר למינימום, ולהתאים את רווח הגלאי לרעשי רקע הניתנים לזיהוי.
- הזז את המטרה למיקום הנמוך ביותר.
- הזז את המטרה למעלה עד להשתקפות של כיסוי גלוי.
- הגדל את עוצמת הלייזר בשלבים של 0.5% ורשום את האות המתאים.
- החל את השגרה עבור שני קווי לייזר.
- הערכת נתונים
- סמן את הנתונים בכרטיסיה ומיין את הנתונים לפי עוצמות אותות.
- התווה את עוצמת האות כנגד כוח הלייזר היחסי.
- בחר עוצמות לייזר המביאות לעוצמת אותות דומה.
3. התאמת פוטומוליפליירים
הערה: לאחר התאמת לייזר, photomultipliers הותאמו לרווחים בודדים כדי לקבל רגישות דומה. כיול זה נעשה עם קו הלייזר 514 ננומטר, שנמצא במרכז טווח העניין אורך הגל.
- השתמש בבאר ריקה להתאמה.
- החל מסנן השתקפות ועבר למצב השתקפות אם הוא זמין.
- ודא כי טווח גל הגל הגל גלאי מכסה את אורך הגל של הלייזר (514 ננומטר).
- בחר את מצב סריקת הקו ואת תצוגת היסטוגרמה.
- הפחיתו את רווח הגלאי לחצי מהמקסימום, והתאמו את עוצמת הלייזר לרעשי רקע הניתנים לזיהוי.
- הזז את המטרה למיקום הנמוך ביותר.
- הזז את המטרה למעלה עד להשתקפות של כיסוי גלוי.
- הגדל את רווח הגלאי בשלבים של 50 עד 100 V ורשום את האות המתאים.
- החל שלבים 3.1 עד 3.8 עבור שני הגלאים.
- הערכת נתונים
- התווה את העוצמה נגד רווח הגלאי עבור כל גלאי.
- בחר את רווחי הגלאי הבודד כדי לקבל רגישות דומה.
4. רכישת תמונה FRET
הערה: התחל עם דוגמה של עניין להגדרת רכישת תמונה.
- בחר את המסננים המתאימים / מראות dichroic, למשל, מראה dichroic כפול MBS 458/514 עבור ECFP/ EYFP זוג FRET. השתמש באותה שיקוף dichroic עבור כל הערוצים כדי לאפשר סריקה שורה אחר שורה. בחר מטרת טבילת מים להדמיה של תאים חיים. בחר 12 סיביות או 16 סיביות סריקה ומהירות סריקה מתונה.
- הגדר את טווח הזיהוי, רצוי 470-510 ננומטר לזיהוי תורמים ו 530-600 ננומטר לזיהוי קבל /FRET במקרה של ECFP /EYFP. בעת שימוש בלייזר דיודה של 445 ננומטר או 440 ננומטר, השתמש ב- 450 עד 510 ננומטר כטווח הזיהוי. במקרה של מפצל קרן אקוסטו-אופטי (AOBS), הגדר זיהוי תורמים בטווח של 450 עד 500 ננומטר כדי למנוע זיהוי מקבל לא רצוי.
- החל את הגדרת הגלאי לפי 3.10.2.
- החל את הגדרת הלייזר על פי 2.3.2. תקן את עוצמת הלייזר בהתבסס על שולחן כוח הלייזר שהושג, במידת הצורך. ודא שיחס האות לרעש מכסה את כל הטווח הדינמי של הגלאים (עוצמה הנעה בין 0 ל- 4095 לסריקה של 12 סיביות).
- שמור על עוצמות לייזר ורווחי גלאי קבועים. השתמש בקוטר חור הסיכה לכוונון עדין.
הערה: זכור כי שינויים בקוטר חור הסיכה משפיעים על הרזולוציה המרחבית. - בצע את המדידות (צלם תמונות של לפחות 20 תאים).
5. קביעת תיקונים צולבים
הערה: תאים המבטאים רק את התורם או את המקבל נדרשים לקבוע דימום ספקטרלי תורם (DSBT) ומקבל דימום ספקטרלי (ASBT), בהתאמה. שמור את אותן הגדרות המתוארות בסעיף 4.
- בצע מדידות FRET עם תאים המבטאים את פלואורופור התורם.
- בצע מדידות FRET עם תאים המבטאים את פלואורופור הקבלה.
6. כיול המדידות לפי במילר ואח' 13
הערה: נדרשים תאים המבטאים היתוך של יעילות FRET ידועה. כאן, ECFP-5 aa-EYFP-היתוך עם יעילות FRET של 0.46 שימש4. שמור את אותן הגדרות המתוארות בסעיף 4.
- ביצוע מדידות FRET עם תאים המבטאים את ההיתוך התורם-מקבל
7. הערכת נתונים
- השג פרופילי שורות של התאים, והבטח שכל פרופיל מכיל לא יותר מתא אחד. שמור את הפרופילים כקבצי טקסט.
- יבא את קבצי הטקסט לגיליון אלקטרוני באמצעות האפשרות ייבוא קובץ טקסט במקטע נתונים .
- קרא את הערכים המרביים על-ידי החלת הפונקציה Max .
- פרט את הערכים המתקבלים בטבלה, ערוך עמודה כל אחד עבור מזהה פליטת תורמים, IF של פליטת FRET, IA של פליטת נמענים ולפחות ארבע ערכות נתונים: תורם בלבד, מקבל בלבד, היתוך ומקבל תורם ומדידה.
הערה: עירור של התורם גם גורם עירור ישיר של הקבלה וגורם ASBT המתואר על ידי ערך α. - חשב את ערכי α של ASBT באמצעות ערכת הנתונים של המקבל בלבד באמצעות משוואה (1).
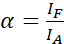 (1)
(1)
הערה: השתמש בחציון של כל ערכי α במשוואות הבאות. התורם מראה ספקטרום פליטה רחב המביא להצלבה פליטה עם פליטה רגישה של המקבל. DSBT זה ניתן על-ידי ערך β. - חשב את ערכי β של דימום ספקטרלי של התורם באמצעות משוואה (2).
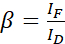 (2)
(2)
הערה: השתמש בחציון של כל ערכי β במשוואות הבאות. גורם הכיול מתאר את הקשר הליניארי של מרווה תורם שמקורו ב- FRET ופליטה רגישה של המקבל. השתמש בחציונים של 7.5 ו- 7.6 במשוואות הבאות. - חשב את גורמי הכיול ξ עם ערכת הנתונים של היתוך מקבל התורם ויעילות FRET E (0.46) באמצעות משוואה (3).
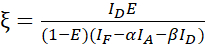 (3)
(3)
הערה: השתמש בחציון של כל ערכי ξ במשוואות הבאות. - חשב את יעילות FRET של זוג החלבון של עניין באמצעות משוואות (4) ו (5).
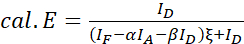 (4)
(4)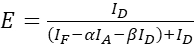 (5)
(5) - הערכת ההשפעות של חוזק הביטוי ו/או יחס מקבל התורם: התווה את סכום תעודת הזהות, ההנפקה ו- IA כנגד יעילות FRET. ביצוע רגרסיה ליניארית; שים לב שכי שהגרף תלול יותר וה-R2 גבוה יותר, כך ההשפעה של רמת הביטוי גבוהה יותר או גדולה יותר, ההבדל בין שפע התורמים והמקבלים.
תוצאות
התאמה של המיקרוסקופ לסריקת לייזר קונפוקלית
התאמת הלייזר חשפה עלייה ליניארית בפליטה בעוצמת לייזר גוברת (איור 2 ושולחן 1). כצפוי עבור לייזרים ארגון-יון, פליטת קו 514 ננומטר היה הרבה יותר גבוה מאשר פליטה של קו 458 ננומטר, כפי שמעיד מדרון תלול יותר. בניסויים הבא?...
Discussion
מרווה תורם ופליטת קבלה רגישה מאופיינים במערכת יחסים ליניארית המאפשרת חישוב מבוסס תורם או קבלה של FRET. הגורמים המתאימים של ליניאריות נקראים גורם G (תורם לקבל) או xi (מקבל לתורם), שהם ערכים הדדיים4. מדידת FRET בין חלבונים פלואורסצנטיים על ידי מיקרוסקופיית פלואורסצנטית דורשת לעתים קר?...
Disclosures
אנו מוודאים כי כל המחברים חשפו כל ניגוד אינטרסים ואין להם אינטרסים פיננסיים מתחרים.
Acknowledgements
הניסויים בוצעו בפלטפורמה הטכנולוגית ליור מיקרוסקופיה (LiMiTec) של הפקולטה לביולוגיה, אוניברסיטת בילפלד. עבודה זו מומנה על ידי אוניברסיטת בילפלד.
Materials
| Name | Company | Catalog Number | Comments |
| 8-well slides | Ibidi | 80821 | |
| Immersion oil Immersol W2010 | Zeiss | 444969-0000-000 | refraction index of water |
| LSM 1: AxioObserver with LSM 780 scan head, confocal laser scanning microscope | Zeiss | ||
| LSM 2: AxioObserver with LSM 5 scan head, confocal laser scanning microscope | Zeiss |
References
- Lakowicz, J. R. . Principles of Fluorescent Spectroscopy. Third Edition. , (2006).
- Clegg, R. M. Förster resonance energy transfer- FRET what it is, why do it, and how it's done. Laboratory Techniques in Biochemistry and Molecular Biology. 33, 1-57 (2009).
- Vogel, S. S., Nguyen, T. A., vander Meer, B. W., Blank, P. S. The impact of heterogeneity and dark acceptor states on FRET: implications for using fluorescent protein donors and acceptors. PLoS ONE. 7, 49593 (2012).
- Müller, S. M., Galliardt, H., Schneider, J., Barisas, B. G., Seidel, T. Quantification of Förster resonance energy transfer by monitoring sensitized emission in living plant cells. Frontiers in Plant Science. 4, 413 (2013).
- Gadella, T. W. J., vander Krogt, G. N., Bisseling, T. GFP-based FRET-microscopy in living plant cells. Trends in Plant Science. 4, 287-291 (1999).
- Van Rheenen, J., Langeslag, M., Jalink, K. Correcting confocal acquisition to optimize imaging of fluorescence resonance energy transfer by sensitized emission. Biophysical Journal. 86, 2517-2529 (2004).
- Seidel, T., Golldack, D., Dietz, K. J. Mapping of C-termini of V-ATPase subunits by in vivo-FRET measurements. FEBS Letters. 579, 4374-4382 (2005).
- Seidel, T., Schnitzer, D., Golldack, D., Sauer, M., Dietz, K. J. Organelle-specific iso-enzymes of plant V-ATPase as revealed by in vivo-FRET. BMC Cell Biology. 9, 28 (2008).
- Schnitzer, D., Seidel, T., Sander, T., Golldack, D., Dietz, K. J. The cellular energization state affects peripheral stalk stability of plant vacuolar H+-ATPase and impairs vacuolar acidification. Plant Cell Physiology. 52, 946-956 (2011).
- Roshchina, V. V. Vital autofluorescence: application to the study of plant living cells. International Journal of Spectroscopy. 2012, 124672 (2012).
- Holtorf, S., Apel, K., Bohlmann, H. Comparison of different constitutive and inducible promoters for the overexpression of transgenes in Arabidopsis thaliana. Plant Molecular Biology. 29, 637-646 (1995).
- Seidel, T., et al. Colocalization and FRET-analysis of subunits c and a of the vacuolar H+-ATPase in living plant cells. Journal of Biotechnology. 112 (1-2), 165-175 (2004).
- Beemiller, P., Hoppe, A. D., Swanson, J. A. A phosphatidylinositol-3-kinase-dependent signal transition regulates ARF1 and ARF6 during FCγ receptor-mediated phagocytosis. PLoS Biology. 4, 162 (2006).
- Lambert, T. J. FPbase: a community-editable fluorescent protein database. Nature Methods. 16, 277-278 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved