A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מיקרוסקופיה פלואורסצנטית להפנמת ATP בתיווך מקמפונוציטוזיס בתאי גידול אנושיים ועכברים קסנוגרפטים
* These authors contributed equally
In This Article
Summary
פיתחנו שיטה הניתנת לשחזור כדי לדמיין את ההפנמה של אדנוסין טריפוספט פלואורסצנטי לא הידרוליזנטי (ATP), תחליף ATP, עם רזולוציה תאית גבוהה. אימתנו את השיטה שלנו באמצעות במבחנה עצמאית ובקווי תאי גידול אנושיים של vivo ועכברים חיסוניים קסנוגרפטים עם רקמת גידול אנושית.
Abstract
אדנוסין טריפוספט (ATP), כולל ATP חוץ תאי (eATP), הוכח לשחק תפקידים משמעותיים בהיבטים שונים של tumorigenesis, כגון עמידות לתרופות, מעבר אפיתל-mesenchymal (EMT), גרורות. eATP תוך-טבעי הוא 103 עד10 פעמים גבוה יותר בריכוז מאשר ברקמות רגילות. בעוד eATP מתפקד כשליח כדי להפעיל איתות purinergic עבור אינדוקציה EMT, הוא גם מופנם על ידי תאים סרטניים באמצעות macropinocytosis upregulated, סוג מסוים של אנדוציטוזיס, כדי לבצע מגוון רחב של פונקציות ביולוגיות. פונקציות אלה כוללות מתן אנרגיה לתגובות ביוכימיות הדורשות ATP, תרומת קבוצות פוספט במהלך העברת אותות, והקלה או האצה של ביטוי גנים כקופקטור תמלול. ATP זמין, והמחקר שלו בסרטן ובתחומים אחרים ללא ספק יגדל. עם זאת, מחקר eATP נשאר בשלב מוקדם, ושאלות לא פתורות נשארות ללא מענה לפני שניתן יהיה לפענח לחלוטין את הפעילויות החשובות והרב-תכליתיות שמפעילים eATP ו-ATP תאי מופנמ.
תרומות המעבדות של מחברים אלה למחקרי eATP מוקדמים אלה כוללות הדמיה מיקרוסקופית של ATP פלואורסצנטי לא הידרוליזנטי, יחד עם דקסטרנס פלואורסצנטי במשקל גבוה ונמוך, המשמשים כמעקבי מאקרופינוציטוזיס ואנדוציטוזיס, כמו גם מעכבי אנדוציטוזיס שונים, כדי לפקח ולאפיין את תהליך ההפנמה eATP. שיטת הדמיה זו הוחלה על קווי תאים של גידול ועל עכברים חיסוניים, קסנוגרפט עם גידולים סרטניים אנושיים, כדי לחקור הפנמה eATP במבחנה וב- vivo. מאמר זה מתאר את פרוטוקולי ההפנמה של הפריה ויוו, בדגש על שינוי ותנאי בדיקת מדוקפינוציטוזיס-/אנדוציטוזיס בתיווך eATP ניתן לבצע בהצלחה במערכות שונות.
Introduction
ספיגה אופורטוניסטית של חומרים מזינים חוץ תאיים תוך-סרטיים (כלומר) הוכרזה לאחרונה כסימן היכר מרכזי לחילוף החומרים של הסרטן1. אחד החומרים המזינים החשובים האלה הוא ATP, כמו הריכוז של ieATP הוא 103 ו10 4 פעמים גבוה יותר מזה שנמצא ברקמות רגילות, בטווח של כמה מאות מיקרומטרים עד mM נמוך2,3,4,5. כמולקולת אנרגיה ואיתות מרכזית, ATP ממלא תפקיד מרכזי בחילוף החומרים התאי בתאים סרטניים ובריאים6,7,8. ATP חוץ תאי מעורב לא רק צמיחת תאים סרטניים, אבל זה גם מקדם עמידות לתרופות9. בעבר פונקציות לא מזוהות של ATP, כגון פעילות הידרוטרופית, זוהו לאחרונה, ובכך לסבך מעורבות ATP במחלות כגוןאלצהיימר 10. ואכן, נראה שההבנה שלנו לגבי ATP ותפקודיו בתאים סרטניים, תאים בריאים ותאים חולים אחרים רחוקה מלהיות שלמה. עם זאת, בשל חוסר היציבות של ATP ושיעורי מחזור גבוהים בתאים, זה מאתגר מבחינה טכנית לפקח על התנועה של ATP על פני קרום התא לתוך התא.
כדי לטפל בבעיה זו ולמלא את הצורך של אזור מחקר זה, פותחה שיטה שבה ATP פלואורסצנטי לא הידרוליזה (NHF-ATP) (איור 1) שימש תחליף כדי לדמיין את ההפנמה של ATP ולבחון את הלוקליזציה המרחבית התארית של ATP מופנם, הן במבחנה והן ב- vivo11,12 . NHF-ATP הוכח כתחליף ATP אנדוגני לחקור את תנועת ATP על פני קרום התא של בעלי חיים, הן בקווי תאים סרטניים והן ברקמת הגידול האנושית xenografted על עכברים חיסוניים11,12. יתר על כן, מתן מעכבי macropinocytosis לתאים חסם הפנמה eATP, דבר המצביע על כך ספיגה תאית של eATP כרוך מנגנון מקרופינוציטוטי9,11,12. פרוטוקול זה מאפשר חיסון קולבל נגד חלבונים ספציפיים לתא ובכך זיהוי של איזה סוג תא מפנים NHF-ATP. באמצעות קסנוגרפטים של גידול ויוו ומיקרוסקופיה ברזולוציה גבוהה, ניתן לדמיין את NHF-ATP באופן מרחבי על פני דגימת הרקמה ואפילו בתוך תא אחד. שיטות אלה מאפשרות גם ניתוח כמותי, כגון אחוז ספיגת התאים, מספר שלל מקרופינוציטוטי וקינטיקה של הפנמה. מאמר זה מתאר בפירוט כיצד NHF-ATP, עובד לבד או יחד עם אנדוציטוזיס-tracer דקסטרנסים פלואורסצנטיים13,14,15,16, ניתן להשתמש בהגדרות ניסיוניות שונות כדי ללמוד הפנמה של ATP ולוקליזציה תאית, לאחר הפנמה בתאים.

איור 1: מבנים של ATP פלואורסצנטי בלתי ניתן להידור וטטראמתיל-רודמין המסומנים במשקל מולקולרי גבוה של דקסטרן פלואורסצנטי. (A)מבנה של NHF-ATP. (B)ייצוג סכמטי של HMWFD. קיצורים: ATP = אדנוסין טריפוספט; NHF-ATP = ATP פלואורסצנטי לא הידרוליזל; TMR = טטרם אתילרודמין; HMWFD = משקל מולקולרי גבוה דקסטרן פלואורסצנטי. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Access restricted. Please log in or start a trial to view this content.
Protocol
כל ההליכים שדווחו כאן בוצעו בהתאם ל- IACUC של אוניברסיטת אוהיו ועם ה- NIH.
1. מבחר ATP פלואורסצנטי בלתי ניתן להידורה (NHF-ATP) ו- dextrans
- בחר מעקב NHF-ATP(איור 1A)ואנדוציטוזיס במשקל גבוה ונמוך, דקסטרנים פלואורו-מולקולריים בעלי משקל מולקולרי גבוה ונמוך (TMR-HMWFD ו- TMR-LMWFD) (איור 1B), בהתבסס על אורכי גל הפליטה המועדפים (למשל, מערכת הדמיה המצוידת במסננים מתאימים) ותהליך האנדוציטוזיס הספציפי שיש לחקור.
2. מחקרי לוקליזציה של ATP, במבחנה (איור 2)
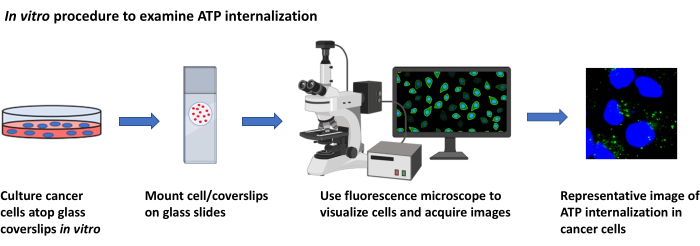
איור 2: הליך הפריה בוחן לבחינת הפנמת ATP. ייצוג סכמטי של הפרוטוקול כדי לדמיין את ההפנמה של ATP חוץ תאי בתאים סרטניים בתרבית באמצעות מיקרוסקופיה פלואורסצנטית. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
- תרבית תאים והכנת תאים
הערה: בצע תרבית תאים בתנאים סטריליים במכסה המנוע של תרבית הרקמות.- הכן את מדיום הנשר המותנה (DMEM) של Dulbecco, המכיל 10% (v/v) סרום בקר עוברי (FBS) ו-1% (v/v) פניצילין/סטרפטומיצין (להלן DMEM/FBS), תמיסת מלח סטרילית חוצצת פוספט (PBS) ו-0.25% חומצה טריפסין/אתילנדימינטראטראצטית (EDTA), באמבט מים של 37 מעלות צלזיוס.
- תרבית תאים סרטניים אנושיים DMEM / FBS בצלחת תרבית רקמות 100 מ"מ. לשמור על התאים באינקובטור להגדיר 37 °C (5°F) עם 5% CO2 אטמוספרה.
- כאשר התאים מגיעים למפגש, מעבר התאים על ידי הסרת המדיום התרבותי תחילה. לאחר מכן, לשטוף את המנה עם 5 מ"ל של PBS סטרילי, להסיר את PBS, ולהוסיף 3 מ"ל של 0.25% טריפסין. דגירה ב 37 °C (5° C) באטמוספירה CO2 במשך 5 דקות.
- לאחזר את המנה, ולאחר מכן להוסיף 6 מ"ל של DMEM / FBS כדי לעצור את טריפסיניזציה. העבר את התאים בהשעיה לצינור חרוט 15 מ"ל וצנטריפוגה ב 800 × גרם במשך 5 דקות כדי גלולה את התאים.
- לאחר צנטריפוגה, לשאוף supernatant ולהשתמש 10 מ"ל של DMEM / FBS כדי resuspend גלולה התא על ידי pipetting.
- ספירת צפיפות התאים והישימות באמצעות המוציטומטר. השתמש ב- DMEM/FBS כדי לדלל את ההשעיה של התא לצפיפות של ~ 7.5 × 104 תאים/מ"ל.
- הכנת כיסויים ותאי זריעה
- יש לשטוף 12 מ"מ מכסים עם 70% אתנול ולנגב אותם בזהירות עם מגבוני משימה עדינים. לחטא את כיסויי ואת זוג אחד של מלקחיים באמצעות autoclaving.
- במכסה המנוע של תרבית הרקמות, השתמשו במלקחיים כדי למקם כיסוי אחד לתוך כל באר של צלחת תרבית רקמות 24-well.
הערה: מאוחר יותר, כיסוי, עם תאים, יותקן ישירות על שקופית מיקרוסקופ להדמיה. - מחלקים 300 μL של השעיית התא (תאים ב- DMEM/FBS), בצפיפות זריעה של ~ 2.5 × 104 תאים לבאר, לתוך הלוח 24-באר המכיל את כיסויים מעוקרים. דגירה בתנאים סטריליים ב 37 °C (5% CO2 זרימה.
- רעב לתאים
- עשרים וארבע שעות לאחר הזריעה, להסיר את DMEM / FBS מכל באר. הוסיפו מיד 300 מיקרו-אל של DMEM נטול סרום מחמם מראש לכל באר כדי להרעיב את התאים בסרום למשך 15-18 שעות כדי לגרום לספיגת חומרים מזינים חוץ-תאיים.
הערה: תקופת הרעב של 15-18 שעות היא פרמטר קריטי.
- עשרים וארבע שעות לאחר הזריעה, להסיר את DMEM / FBS מכל באר. הוסיפו מיד 300 מיקרו-אל של DMEM נטול סרום מחמם מראש לכל באר כדי להרעיב את התאים בסרום למשך 15-18 שעות כדי לגרום לספיגת חומרים מזינים חוץ-תאיים.
- הכנת פתרונות NHF-ATP ו- HMWFD/LMWFD
- השתמש באיזון אנליטי כדי לשקול משקל מולקולרי גבוה (70 kDa) TMR-dextran פלואורסצנטי (TMR-HMWFD, 1 מ"ג/מ"ל), מעקב להדמיית מקרופאינוזומים, או NHF-ATP (10 מיקרומול/ליטר) ב- DMEM ללא סרום בצינור מיקרוצנטריפוגה בגודל 1.5 מ"ל. מניחים את הצינורות, מוגנים מפני אור, באמבט מים 37 °C (37 °F) במשך 15 דקות.
- צנטריפוגה ב 12,000 × גרם במשך 5 דקות בטמפרטורת החדר. העבירו בזהירות את הסופר-נט הצלול לצינור מיקרוצנטריפוגה חדש של 1.5 מ"ל, והותירו כל גלולה או פסולת ללא פגע כדי להסיר גבישים בלתי מסיסים.
- הוסף את הפתרונות בשלב 2.4.1 לתאים בכל באר, ודגר את התאים במשך 30 דקות ב 37 °C (7 °F).
הערה: אם פתרונות HMWFD ו- NHF-ATP צריכים להיות מעורבים לדגירה משותפת עם התאים, הכינו את שני הפתרונות פי 2 מהריכוזים הסופיים. הפתרונות יהיו מעורבים בהמשך ביחס של 1:1 כדי להשיג את ריכוזי העבודה המדויקים הסופיים. הימנע אור כמו ריאגנטים רגישים לאור.
- טיפול בתאים וקבוע
- בצלחת 24-well טרי, לחלק 500 μL של PBS מחמם מראש לתוך כל חמש בארות.
- לאחר דגירה של התא, יש לאסוף בזהירות כל כיסוי באמצעות מלקחיים. יש לשטוף כל כיסוי על ידי טבילה ב-500 מיקרו-אל של PBS מוזהר מראש. חזור חמש פעמים באמצעות חמש בארות מלאות PBS.
הערה: שטיפה עדינה של תאים על כיסויים היא קריטית להצלחת הניסוי הזה. - לאחר שטיפת PBS הסופית, הקש על כיסוי על מגבון משימה עדין כדי לספוג PBS נוסף ולהעביר את כיסוי מיד לקור (4 °C) 3.7% פורמלדהיד, טעון מראש בצלחת 24 טוב. תקן את התאים במשך 15 דקות בטמפרטורת החדר.
- בזמן שהתאים מתוקנים, שקופיות מיקרוסקופ נקיות מראש עם 70% אתנול. הסר את כיסויי מהבארות ולהרכיב אותם על השקופיות, באמצעות 5 μL של מדיום הרכבה מימית המכיל את הכתם הגרעיני 4′,6-diamidino-2-פנילינדול (DAPI), לכל כיסוי. כתם בעדינות PBS עודף עם מגבת נייר או לנגב משימה עדינה.
- מיקרוסקופיה פלואורסצנטית ורכישת תמונה
- שעתיים עד 24 שעות לאחר השלבים לעיל, ללכוד תמונות של תאים והפנמת HMWFD ו / או NHF-ATP באמצעות מערכת הדמיית אפיפלואורסצנטיות ותוכנה לרכישת נתונים.
הערה: תת-סעיף זה מתאר שלבים לרכישת תמונות באמצעות מיקרוסקופ ניקון NiU, המצויד ביכולת הדמיית אפיפלואורסצנטיות, ותוכנת ניקון NIS Elements. עם זאת, ניתן להשתמש במערכות הדמיה דומות אחרות ובתוכנות רכישה אחרות. בצע את הוראות ההפעלה של היצרן.- מקם את השקופית על הבמה של מיקרוסקופ אפיפלואורסצנטי זקוף במצב משקפת. גש לתוכנית ההדמיה.
- בחר את המטרה 10x, התאם את הבמה להגדרת המוקד וסרוק את השקופית משמאל לימין באופן נחשי כדי לזהות את אזורי העניין.
הערה: זיהוי אזורים מעניינים ישתנה בין סוגי תאים, עם כמה קווי תאים / סוגי סרטן המציגים דרגות שונות ומובחנות של TMR-HMWFD ו / או ספיגת NHF-ATP. - בחר את המטרה 40x ועבור ממצב משקפת למצב לכידת תמונה, באמצעות הלחצן הדו-מצבי במיקרוסקופ.
- לחץ על סמל איכות חיה בתוכנית ההדמיה כדי להציג ולאחר מכן לרכוש תמונות.
- באמצעות החלונית OC בסרגל הכלים ביאורים ומדידות, הגדר את פרמטרי החשיפה עבור כל קוביית מסנן או ערוץ פלואורסצנטי.
הערה: בחר את זמן החשיפה המתאים עבור כל ערוץ, מכיוון שעוצמות האות שונות. לדוגמה, בחר זמן חשיפה של 200 אלפיות שני עבור DAPI, 2 s עבור HMWFD ו- 4 s עבור NHF-ATP. לאחר שזמן החשיפה נקבע לכל ערוץ, השתמש בהגדרה זו עבור כל התמונות, לכל ערוץ, עם טיפול או מצבים שונים. - לאחר הגדרת הגדרות החשיפה עבור כל ערוץ, השתמש בסרגל הכלים לרכישה רב-ערוצית כדי להשיג תמונה תלת-ערוצית עם הגדרות החשיפה המוגדרות.
הערה: רכישת תמונה באמצעות מצב רכישת ND רב-ערוצי מאפשרת לכידת תמונה אוטומטית עבור כל ערוץ באותו שדה תצוגה. התריס נסגר באופן אוטומטי בין שינויי צריח. - לחלופין, רכשו תמונות מרובות ערוצים באופן ידני על-ידי התנדנדות בין קוביות מסנן, קביעת זמן החשיפה, תריס סגירה/פתיחה בין רכישת תמונה עבור כל ערוץ, והנחת יתר של כל תמונה שצולמה עבור ערוצים בודדים.
הערה: מצב הרכישה של ND הופך תהליך זה לאוטומטי ומספק תמונות ממוזגות. - שמור את התמונה כקובץ .nd2 (תבנית Nikon Elements שומרת מטה-נתונים). שמור קבצי TIF, כולל תמונת הערוץ הממוזגת ותמונות ערוץ בודדות.
הערה: ניתן להשתמש בקבצי TIF עם מבחר רחב יותר של יישומי תוכנה. - השתמש בתכונה ספירת אובייקטים בסרגל הכלים ניתוח כדי לספור את מספר התאים החיוביים NHF-ATP-, TMR-HMWFD ו/או TMR-LMWFD-חיוביים בקובץ תמונה .nd2 שנשמר.
- יצא את הנתונים לגיליון אלקטרוני באמצעות תוכנית הניתוח.
- שעתיים עד 24 שעות לאחר השלבים לעיל, ללכוד תמונות של תאים והפנמת HMWFD ו / או NHF-ATP באמצעות מערכת הדמיית אפיפלואורסצנטיות ותוכנה לרכישת נתונים.
- כימות וניתוח נתונים
- עבור כל תנאי שנטען, תמונה 50 עד 100 תאים לכימות. באמצעות תוכנת ניתוח הנתונים (תוכנה הכלולה במערכת הדמיית האפיפלואורסצנטיות או בתוכנה אחרת), לספור ולחשב את המספר הממוצע של שלשלות פלואורסצנטיות לתא.
- השתמש בשיטות סטטיסטיות מתאימות כדי לנתח את התוצאות הממותתות.
3. הפנמת ATP בגידולים, ex vivo (איור 3)

איור 3: הליך ויוו לבחינת הפנמת ATP. ייצוג סכמטי של הפרוטוקול כדי לדמיין את ההפנמה של ATP חוץ תאי ב xenografts הגידול באמצעות קריוזקציה ומיקרוסקופיה פלואורסצנטית. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
- הכנת תרביות תאים להשתלות
- לגדל תאים סרטניים ל 80% מפגש ב 37 °C ב 225 ס"מ2 בקבוקון, באמצעות DMEM בתוספת FBS, לריכוז סופי של 10% (v/v) ופניצילין / סטרפטומיצין ב 1% (v / v).
- לשטוף את התאים פעמיים עם 10 מ"ל של PBS. חם מראש 0.25% טריפסין / EDTA כדי 37 °C (50 °F). הוסף 8 מ"ל של טריפסין / EDTA ודגרה ב 37 °C (7 °F) במשך 2 דקות.
- ברגע התאים מתחילים להתנתק מתחתית הבקבוקון, להשתמש פיפטה סרולוגית סטרילית 10 מ"ל כדי להוסיף 8 מ"ל של DMEM / FBS. שאפו פעמיים להסיט כל תאים חסידים. השתמש pipette כדי להעביר את התאים המנותקים מן הבקבוקון לתוך צינור חרוט 50 מ"ל.
- הוסף 10 מ"ל של DMEM / FBS באמצעות pipette 10 מ"ל, ולאסוף את כל התאים הצפים הנותרים באותו צינור חרוט 50 מ"ל.
- צנטריפוגה השעיית התא ב 600 × גרם,4 °C (50 °F) במשך 4 דקות. הסר את supernatant ו resuspend התאים 1 מ"ל של PBS קר כקרח.
- תספור את צפיפות התאים באמצעות המוציטים. שמור את השעיית התא על קרח בזמן הספירה.
- צנטריפוגה השעיית התא ב 600 × גרם,4 °C (50 °F) במשך 4 דקות. הסר את supernatant ולהשעות את התאים PBS קר כקרח, כך צפיפות התא הופך 5 × 106 תאים לכל 100 μL של PBS. העבר את ההשעיה התאית לצינור מיקרוצנטריפוגה 1.5 מ"ל.
- הזרקה תת עורית של תאים סרטניים להתפתחות גידול קסנוגרפט
- השתמש מזרק ללא לטקס (1 מ"ל) עם מחט דאייה מדויקת (27 G מחט) להזרקת תאים סרטניים.
- העבר את ההשעיה התא (5 × 106 ב 100 μL של PBS) לצינור microcentrifuge 1.5mL. משוך את התאים למזרק.
- בחר אתר הזרקה על אגף של עכבר חיסוני (עירום), ונקה בעדינות את העור באמצעות 75% אתנול. נגב את האתנול העודף עם מגבון משימה עדין.
- להזרקה תת עורית, יש להחזיק את המחט בזווית של כ-10 מעלות לעור. הכנס את קצה המחט, צד משופע למעלה, ממש מתחת לעור, כך שרק 1-2 מ"מ של המחט גלוי מחוץ לעור. מחלקים את התאים מהמזרק לאט מעל כ-10.
- לאחר הזרקת הנפח כולו, להמשיך להחזיק את המחט במקום עבור 3-5 s, ולאחר מכן למשוך את המחט ולהשתמש באצבע כדי להפעיל לחץ עדין אך מוצק על אתר ההזרקה במשך 3-5 שניות נוספות כדי למנוע דליפה של התוכן המוזרק.
- לנטר ולמדוד את צמיחת הגידול באמצעות calipers ורנייה עד הגידולים להגיע נפח של 200-500 מ"מ3.
- הכנת פתרונות HMWFD ו- NHF-ATP לשימוש בפירוק לאחר הגידול
- יש להמיס 300 μL של 16 מ"ג/מ"ל HMWFD ב-DMEM (בינוני תרבות) ללא סרום, דגירה באמבט מים של 37 מעלות צלזיוס למשך 30 דקות, וצנטריפוגה ב-12,000 × גרם למשך 5 דקות כמתואר לעיל. העבר את הפתרון לצינור מיקרוצנטריפוגה 1.5 מ"ל.
- הוסף 40 μL של מלאי אנלוגי NHF-ATP (1 mM) ל 160 μL של DMEM ללא סרום כדי להכין פתרון NHF-ATP 0.2 מ"מ.
- הכנת בארות ניסיוניות
הערה: עיצוב ניסיוני זה יבחן את ההפנמה התארית של HMWFD + NHF-ATP, מה שמעיד על ספיגה על ידי מקרופאינוזומים.- הכן את הבארות כדלקמן: ובכן #1, בקרה: 200 μL של DMEM ללא סרום; ובכן #2, בקרה: 100 μL של 16 מ"ג / מ"ל LMWFD + 100 μL של DMEM ללא סרום = 200 μL של 8 מ"ג / מ"ל LMWFD; ובכן #3, בקרה: 100 μL של 0.2 mM NHF-ATP + 100 μL של DMEM ללא סרום = 200 μL של 0.1 mM NHF-ATP; ובכן # 4; ניסיוני: 100 μL של 16 מ"ג / מ"ל HMWFD + 100 μL של 0.2m NHF-ATP = 200 μL של 0.1 mM NHF-ATP ו 8 מ"ג / מ"ל HMWFD.
- הכנת רקמות גידול
- המתת חסד את העכבר על ידי נקע צוואר הרחם או על פי הפרוטוקול שאושר על ידי IACUC.
- השתמש באזמל בגודל 10 כדי לחתוך את הגידולים המבודדים בעובי של ~ 500-1,000 מיקרומטר.
- לדגור את פרוסות הגידול ב- DMEM ללא סרום בתוספת 100 מיקרומטר NHF-ATP ו/או 8 מ"ג/מ"ל H/LMWFD בצינורות מיקרוצנטריפוגה למשך 40 דקות ב-37 °C עם 5% CO2 זרימה.
הערה: לאחר הדגירה, חילוף החומרים של רקמת הגידול גורם לצבע המדיום להשתנות. - לשטוף את הרקמות ב 37 °C PBS מוזהר מראש (2 מ"ל עבור כל שטיפה בצלחת 24-well).
- מעבירים את הרקמה לצלחת חדשה בת 24 באר עם PBS טרי שחום מראש, שוטפים וחוזרים על הפעולה ארבע פעמים עם רעד עדין.
- הטמעת קריו (הכנת בלוקי רקמות קפואות)
- הכן תוויות זיהוי עבור כל גידול להיות נקטף. חותכים חתיכת סרט מעבדה 2 ס"מ ומקפלים לשניים, צדי דבק יחד, לאורך. השתמש בעט סימון כדי לתייג את התג, למשל, עם מספר זיהוי עכבר/גידול.
- הכן הטמעת תבניות על ידי הנחת תבניות רקמת נירוסטה ישירות על קרח יבש.
הערה: קרח יבש עלול לגרום לכוויות קור, לכוויות ולחנק. ללבוש כפפות מבודדות בעת טיפול בקרח יבש. יש להשתמש בקרח יבש באזור מאוורר היטב. אין לאחסן קרח יבש במיכל אטום היטב. במקום זאת, יש לאחסן במיכל (כגון מקרר קלקר) המאפשר לגז לברוח. - בזמן שהתבנית מצמררת, מניחים בריכה קטנה של מדיום מקפיא רקמות לתוך צלחת תרבית רקמות של 10 מ"מ. ודא כי הנפח מספיק כדי להטביע את רקמת הגידול כי יהיה שנקטף.
- השתמש בכף מחוררת כדי לאסוף את רקמת הגידול שנכרתה ומיד למקם את הרקמה לתוך מדיום קפוא, להבטיח כי הרקמה שקועה. באמצעות הכף המחוררת, מגלגלים בעדינות את הרקמה במדיום המקפיא, ומבטיחים שהמדיום רוחץ את כל משטחי הרקמה.
- מעבירים בזהירות את הרקמה לתבנית המטביעה המכילה את המדיום המקפיא. מניחים את תג התווית המתאים אנכית לתוך מדיום/תבנית הקפאה להקפאה במקום. ודא שהתווית הכתובה גלויה מחוץ למדיום.
- כאשר ההקפאה הושלמה (בינוני קפוא הופך אטום-לבן), להסיר את בלוק הרקמה מן התבנית, מניחים אותו על קרח יבש, ולחזור על כל גידול. לאחסן את בלוקי הרקמה ב -80 °C (80 °F) במשך מספר חודשים לפני הליך cryosectioning.
- הכנת שקופיות של דגימות רקמות
- כדי למקסם את הסיכוי למצוא תאים חיוביים להפנמה ויש אזורי רקמות מייצגים יותר, לאסוף cryosections סדרתי ב -18 כדי -20 °C באמצעות cryostat.
- כלי קריוסטאט Prechill (להב, סכין גילוח, צלחת אנטי רול, מחזיק צ'אק רקמות, מברשת צבע) ולשקם את בלוקי רקמת הגידול על ידי הצבתם בתא cryostat ב -18 עד -20 °C (50 °F). הגדר את זווית מחזיק הלהב ל-5-10 מעלות. חותכים בזהירות את בלוק הרקמה, לפי הצורך, עם סכין גילוח, ומרכיבים אותו על מחזיק הצ'אק באמצעות מדיום הקפאת רקמות כ"דבק".
- נעל את מחזיק הצ'אק במיקום האנכי ביחידת המיקרוטומים, המתקדמת למרחק שנקבע (למשל, 10 מיקרומטר) עם כל סיבוב של כננת היד. מקם את צלחת האנטי רול לנוח ממש מעל גובה הלהב. כדי למנוע קרלינג רקמות לפני קידום המיקרוטום, החלק בזהירות את האגודל מעל הקצה התחתון של בלוק הרקמה.
- ככל שהמיקרוטומיה מתקדמת וקטע הרקמה נופל על צלחת המתכת, השתמש במכחול כדי להנחות את קטע הרקמה ולפרוח את הרקמה, במידת הצורך.
- רחף עם שקופית המיקרוסקופ מעל מקטע הרקמה מבלי לגעת כך שהמקטע יימשך לשקופית.
הערה: להבי Cryostat (פרופיל גבוה, חד) הם חדים מאוד ועלולים לגרום לפציעה חמורה. השתמש בזהירות בעת טיפול בלהבים והפעלת הקריוסטט. השתמש מגן להב, אם זמין. נדרשת הכשרה מתאימה. - פורסים את הגידול לחלקים בעובי של 10 מיקרומטר. העבר מיד את המקטעים הפרוסים לשקופית מיקרוסקופ זכוכית טעונה חיובית.
הערה: עבור מקטעים טוריים, אסוף תחילה מקטע בעובי 10 מיקרומטר לפינה השמאלית העליונה של כל אחת משמונה שקופיות טעונות חיוביות. לקדם את cryostat דרך הבאים 100-200 מיקרומטר של רקמה, ולהשליך את הרקמה. העבר מיד את כל החלקים הפרוסים לשקופיות מיקרוסקופ זכוכית. - לאחר מכן, לאסוף עוד קטע בעובי 10 מיקרומטר, ליד קטע הרקמה שהוצב בעבר, עבור כל אחת משמונה השקופיות. חזור על תהליך איסוף סדרתי זה עד שכל אחת משמונה השקופיות מכילה שמונה מקטעי רקמות, כל אחד 100-200 מיקרומטר זה מזה. שמור את מקטעי הרקמה בחושך כדי לשמר פלואורסצנטיות.
הערה: מקטעי רקמות בשקופיות ניתן לאחסן בתיבת שקופית ב - -80 °C (80 °F) למשך מספר חודשים.
- כדי למקסם את הסיכוי למצוא תאים חיוביים להפנמה ויש אזורי רקמות מייצגים יותר, לאסוף cryosections סדרתי ב -18 כדי -20 °C באמצעות cryostat.
- קיבוע שקופיות רקמות
- שלב קריטי: תקן את מקטעי הרקמות ב-95% אתנול ב-18 עד -20 °C (5 דקות).
- לשטוף את החלק הקבוע במשך 5 דקות עם טמפרטורת החדר PBS, ולאחר מכן לעלות את מקטעי הגידול הקבועים תחת כיסוי זכוכית באמצעות 10 μL של מדיום הרכבה מימית עם DAPI.
- 12 עד 24 שעות לאחר הרכבה, לבחון את מקטעי הגידול הקבוע על ידי מיקרוסקופיה פלואורסצנטית ולרכוש תמונות, כמתואר עבור התאים בתרבית לעיל.
- מיקרוסקופיה פלואורסצנטית ורכישת תמונה
- זהה אזורים מעניינים ורכוש תמונות, כמתואר בסעיף 2.6.
- כימות וניתוח נתונים
- לכמת את התאים וליישם ניתוחים סטטיסטיים מתאימים, כמו בסעיף 2.7.
4. הפנמת ATP בגידולים, ב- vivo
- הכן תרביות תאים להשתלות כמתואר בסעיף 3.1.
- הזרקה תת עורית של תאים סרטניים להתפתחות גידול קסנוגרפט
- צור גידולים קסנוגרפט כמתואר בסעיף 3.2.
- הזרקת ATP ו/או דקסטרן לגידולי קסנוגרפט
- הכן את פתרונות הטיפול של DMEM (רכב) או 8 מ"ג / מ"ל HMWFD או LMWFD, עם או בלי NHF-ATP (100 מיקרומטר) ב- DMEM, כמתואר לעיל.
- השתמש מזרק 1 מ"ל כדי לאסוף 50 μL של פתרון טיפול אחד ולהזריק את הפתרון ישירות לתוך כל גידול קסנוגרפט. חזור על ההליך עבור ארבעה שכפולים ביולוגיים של כל טיפול.
- קציר רקמות והטבעת קריו
- הכן תוויות זיהוי עבור כל גידול להיות נקטף. חותכים חתיכת סרט מעבדה 2 ס"מ ומקפלים לשניים, צדי דבק יחד, לאורך. השתמש בעט סימון כדי לתייג את התג, למשל, עם מספר זיהוי עכבר/גידול.
- כ 5 דקות לאחר הזרקה, להרדים את העכבר על ידי נקע צוואר הרחם או על פי פרוטוקול שאושר IACUC.
- באמצעות אזמל בגודל 10, לבצע חתוך סמוך לגידול בערך בניצב לכיוון הזרקת המחט. השתמש במלקחיים ומספריים כירורגיות כדי לכרות את רקמת הגידול מהרקמה שמסביב.
- מחלקים את הגידול לשניים עד ארבעה 1 ס"מ2 חתיכות, בהתאם לגודל הגידול הכולל.
- הכן את תבניות ההטבעה והטמיע את הרקמה, כמתואר לעיל בסעיף 3.6. ודא כי זמן הקציר, מהזרקת דקסטרן תוך-מוראלי להטבעת קריו, הוא לא יותר מ 7-8 דקות.
- הכנת שקופיות של דגימות רקמות
- לאסוף מקטעי גידול סדרתי, כמתואר בסעיף 3.7.
- קיבוע שקופיות רקמות
- תקן את הרקמה, כמתואר בסעיף 3.8.
- מיקרוסקופיה פלואורסצנטית ורכישת תמונה
- זהה את אזורי העניין ורכוש תמונות, כמתואר בסעיף 2.6.
- כימות וניתוח נתונים
- לכמת את התאים וליישם ניתוחים סטטיסטיים מתאימים, כמתואר בסעיף 2.7.
Access restricted. Please log in or start a trial to view this content.
תוצאות
מחקר במבחנה
הפנמה תאית של NHF-ATP הודגמה על ידי לוקליזציה משותפת של NHF-ATP עם HMWFD או LMWFD (איור 4). ההצלחה של הליך זה מסתמכת בעיקר על השימוש בריכוזים מתאימים של NHF-ATP ו dextrans ועל קביעת הסוגים המתאימים של dextrans (פולי-ליסין לעומת נייטרלי). לדוגמה, כדי לחקור מקרופינ?...
Access restricted. Please log in or start a trial to view this content.
Discussion
פותחה שיטה לניתוח מרחבי, זמני וכמותי של הפנמה תאית של ATP שאינו הידרוליזליזה. שיטה זו ישימה באופן נרחב לשימוש במערכות ביולוגיות מגוונות, לרבות מודלים גידוליים שונים, אשר עבורם אנו מספקים הדרכה טכנית ונתונים מייצגים. כדי להשיג נתונים הניתנים לפרשנות במהלך מחקרי הפנמת ATP של vivo (סעיף 4 של ה...
Access restricted. Please log in or start a trial to view this content.
Disclosures
המחברים מצהירים שאין אינטרסים מתחרים.
Acknowledgements
ההקפאה בוצעה באתר בליבת ההיסטופתולוגיה של אוניברסיטת אוהיו. עבודה זו נתמכה בחלקה על ידי קרנות סטארט-אפ (המכללה לאמנויות ומדעים של אוניברסיטת אוהיו) ל- C Nielsen; מענק NIH R15 CA242177-01 ופרס RSAC ל X חן.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| A549 cells, human lung epithelial, carcinoma | National Cancer Institute | n/a | Less expensive source |
| Acetone | Fisher Scientific | S25904 | |
| Aluminum foil, Reynolds | Grainger | 6CHG6 | |
| Aqueous Mounting Medium, ProLong Gold Anti-fade Reagent | ThermoFisher | P36930 | |
| ATP analog | Jena Biosciences | NK-101 | |
| Autoclave, sterilizer | Grainger | 33ZZ40 | |
| Blades, cryostat, high profile | C. L. Sturkey, Inc. | DT554550 | |
| Calipers, vernier | Grainger | 4KU77 | |
| Cell medium, Ham's Nutrient Mixture F12, serum-free | Millipore Sigma | 51651C-1000ML | |
| Centrifuge, refrigerated with swinging bucket rotor | Eppendorf | 5810R | |
| Chloroform | Acros Organics | 423555000 | |
| Conical tube, 15 mL | VWR | 21008-216 | |
| Conical tube, 50 mL | VWR | 21008-242 | |
| Coverslips, glass, 12 mm | Corning | 2975-245 | |
| Cryostat, Leica CM1950 | Leica Biosystems | CM1950 | |
| Delicate task wipe, Kim Wipes | Kimberly-Clark | 34155 | |
| Dextran, Lysine fixable, High Molecular Weight (HMW) | Invitrogen | D1818 | MW = 70,000, Tetramethylrhodamine |
| Dextran, Neutral, High Molecular Weight (HMW) | Invitrogen | D1819 | |
| Dulbecco's Modified Eagle Medium (DMEM), serum-free | Fisher Scientific | 11885076 | |
| Dry ice | Local delivery | Custom order | |
| Epifluorescent imaging system, Nikon NiU and Nikon NIS Elements acquisition software | Nikon | Custom order | |
| Ethanol | Fisher Scientific | BP2818-4 | |
| Fetal bovine serum (FBS) | ThermoFisher | 16000044 | |
| Forceps, Dumont #7, curved | Fine Science Tools | 11274-20 | |
| Forceps, Dumont #5, straight | Fine Science Tools | 11254-20 | |
| Gloves (small, medium, large) | Microflex | N191, N192, N193 | |
| Gloves, MAPA Temp-Ice 700 Thermal (for handling dry ice) | Fisher Scientific | 19-046-563 | |
| Hemocytometer | Daigger | EF16034F EA | |
| Incubator, cell culture | Eppendorf | Galaxy 170 S | |
| Labelling tape | Fisher Scientific | 159015R | |
| Marking pen, Sharpie (ultra-fine) | Staples | 642736 | |
| Mice, immunodeficient (Nu/J) | Jackson Laboratory | 2019 | |
| Microcentrifuge, accuSpin Micro17 | Fisher Scientific | 13-100-675 | |
| Microcentrifgue tubes, Eppendorf tubes (1.5 mL) | Axygen | MCT-150-C | |
| Microscope slide box | Fisher Scientific | 50-751-4983 | |
| Needle, 27 gauge | Becton-Dickinson | 752 0071 | |
| Paintbrush | Grainger | 39AL12 | |
| Paper towels | Staples | 33550 | |
| Paraformaldehyde | Acros Organics | 416785000 | |
| Penicillin/Streptomycin | Gibco | 15140122 | |
| Perforated spoon, 15 mm diameter, 135 mm length | Roboz Surgical Instrument Co. | RS-6162 | |
| Phosphate buffered saline (PBS) | Fisher Scientific | BP3991 | |
| Pipet tips (10 μL) | Fisher Scientific | 02-707-438 | |
| Pipet tips (200 μL) | Fisher Scientific | 02-707-411 | |
| Pipet tips (1000 μL) | Fisher Scientific | 02-707-403 | |
| Pipets, serological (10 mL) | VWR | 89130-910 | |
| Pippetor, Gilson P2 | Daigger | EF9930A | |
| Pipettor Starter Kit, Gilson (2-10 μL, 20-200 μL, 200-1000 μL) | Daigger | EF9931A | |
| Platform shaker - orbital, benchtop | Cole-Parmer | EW-51710-23 | |
| Positively-charged microscope slides, Superfrost | Fisher Scientific | 12-550-15 | |
| Scalpel, size 10, Surgical Design, Inc. | Fisher Scientific | 22-079-707 | |
| Scissors, surgical - sharp, curved | Fine Science Tools | 14005-12 | |
| Software for image analysis, Nikon Elements | Nikon | Custom order | |
| Software for image analysis, ImageJ (FIJI) | National Institutes of Health | n/a | Download online (free) |
| Specimen disc 30 mm (chuck holder), cryostat accessory | Leica Biosystems | 14047740044 | |
| Staining tray, 245 mm BioAssay Dish | Corning | 431111 | |
| Syringe, 1 cc | Becton-Dickinson | 309623 | |
| Tape, laboratory, 19 mm width | Fisher Scientific | 15-901-5R | |
| Timer | Fisher Scientific | 14-649-17 | |
| Tissue culture dish, 100 x 15 mm diameter | Fisher Scientific | 08-757-100D | |
| Tissue culture flask, 225 cm2 | ThermoFisher | 159933 | |
| Tissue culture plate, 24-well | Becton-Dickinson | 353226 | |
| Tissue embedding mold, stainless steel | Tissue Tek | 4161 | |
| Tissue Freezing Medium, Optimal Cutting Temperature (OCT) | Fisher Scientific | 4585 | |
| Trypsin-EDTA (ethylenediaminetetraacetic acid), 0.25% | Gibco | 25200072 | |
| Water bath, Precision GP 2S | ThermoFisher | TSGP2S |
References
- Pavlova, N. N., Thompson, C. B. The emerging hallmarks of cancer metabolism. Cell Metabolism. 23 (1), 27-47 (2016).
- Pellegatti, P., et al. Increased level of extracellular ATP at tumor sites: in vivo imaging with plasma membrane luciferase. PLoS ONE. 3, 25992008(2008).
- Falzoni, S., Donvito, G., Di Virgilio, F. Detecting adenosine triphosphate in the pericellular space. Interface Focus. 3 (3), 20120101(2013).
- Michaud, M., et al. Autophagy-dependent anticancer immune responses induced by chemotherapeutic agents in mice. Science. 334, 1573-1577 (2011).
- Wilhelm, K., et al. Graft-versus-host disease is enhanced by extracellular ATP activating P2X7R. Nature Medicine. 16, 1434-1438 (2010).
- Vander Heiden, M. G., Cantley, L. C., Thompson, C. B. Understanding the Warburg effect: the metabolic requirements of cell proliferation. Science. 324, 1029-1033 (2009).
- Cairns, R. A., Harris, I. S., Mak, T. W. Regulation of cancer cell metabolism. Nature Reviews Cancer. 11, 85-95 (2011).
- Chen, X., Qian, Y., Wu, S. The Warburg effect: evolving interpretations of an established concept. Free Radical Biology & Medicine. 79, 253-263 (2015).
- Wang, X., et al. Extracellular ATP, as an energy and phosphorylating molecule, induces different types of drug resistances in cancer cells through ATP internalization and intracellular ATP level increase. Oncotarget. 8 (5), 87860-87877 (2017).
- Patel, A., et al. ATP as a biological hydrotrope. Science. 356, 753-756 (2017).
- Qian, Y., et al. Extracellular ATP is internalized by macropinocytosis and induces intracellular ATP increase and drug resistance in cancer cells. Cancer Letters. 351, 242-251 (2014).
- Qian, Y., Wang, X., Li, Y., Cao, Y., Chen, X. Extracellular ATP a new player in cancer metabolism: NSCLC cells internalize ATP in vitro and in vivo using multiple endocytic mechanisms. Molecular Cancer Research. 14, 1087-1096 (2016).
- Commisso, C., et al. Macropinocytosis of protein is an amino acid supply route in Ras-transformed cells. Nature. 497, 633-637 (2013).
- Li, L., et al. The effect of the size of fluorescent dextran on its endocytic pathway. Cell Biology International. 39, 531-539 (2015).
- Yanagawa, Y., Matsumoto, M., Togashi, H. Enhanced dendritic cell antigen uptake via alpha2 adrenoceptor-mediated PI3K activation following brief exposure to noradrenaline. Journal of Immunology. 185, 5762-5768 (2010).
- Hoppe, H. C., et al. Antimalarial quinolines and artemisinin inhibit endocytosis in Plasmodium falciparum. Antimicrobial Agents & Chemotherapy. 48, 2370-2378 (2004).
- Chaudry, I. H. Does ATP cross the cell plasma membrane. Yale Journal of Biology & Medicine. 55, 1-10 (1982).
- Pant, H. C., Terakawa, S., Yoshioka, T., Tasaki, I., Gainer, H. Evidence for the utilization of extracellular [gamma-32P]ATP for the phosphorylation of intracellular proteins in the squid giant axon. Biochimica et Biophysica Acta. 582, 107-114 (1979).
- Chaudry, I. H., Baue, A. E. Further evidence for ATP uptake by rat tissues. Biochimica et Biophysica Acta. 628, 336-342 (1980).
- Koppenol, W. H., Bounds, P. L., Dang, C. V. Otto Warburg's contributions to current concepts of cancer metabolism. Nature Reviews Cancer. 11, 325-337 (2011).
- Dang, C. V. Links between metabolism and cancer. Genes & Development. 26, 877-890 (2012).
- Israelsen, W. J., Vander Heiden, M. G. ATP consumption promotes cancer metabolism. Cell. 143, 669-671 (2010).
- Koster, J. C., Permutt, M. A., Nichols, C. G. Diabetes and insulin secretion: the ATP-sensitive K+ channel (K ATP) connection. Diabetes. 54, 3065-3072 (2005).
- Szendroedi, J., et al. Muscle mitochondrial ATP synthesis and glucose transport/phosphorylation in type 2 diabetes. PLoS Medicine. 4, 154(2007).
- Miyamoto, S., et al. Mass spectrometry imaging reveals elevated glomerular ATP/AMP in diabetes/obesity and identifies sphingomyelin as a possible mediator. EBioMedicine. 7, 121-134 (2016).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved