A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
אבלציות נפח עמוקות ומבוקרות מרחביות באמצעות מיקרוסקופ דו-פוטון בגסטרולה דג הזברה
In This Article
Summary
התפתחות עוברית דורשת תיאום בקנה מידה גדול של תנועת תאים. אבלציה תלת-ממדית של עירור דו-פוטון מאפשרת אבלציה תלת-ממדית מבוקרת מרחבית של קבוצות גדולות של תאים עמוקים. בנוסף, טכניקה זו יכולה לחקור את התגובה של תאים נודדים באופן קולקטיבי ב vivo להסתבכויות בסביבה המכנית שלהם.
Abstract
מורפוגנזה כרוכה בתנועות תאים רבות כדי לארגן תאים לתוך רקמות ואיברים. לפיתוח תקין, כל התנועות האלה צריכות להיות מתואמות היטב, וצבירת ראיות מצביעה על כך שזה מושג, לפחות בחלקו, באמצעות אינטראקציות מכניות. בדיקת זה בעובר דורשת בעיות פיזיות ישירות. אבלציות לייזר הן אפשרות בשימוש הולך וגדל המאפשרת להקל על אילוצים מכניים או בידוד פיזי של שתי אוכלוסיות תאים זו מזו. עם זאת, אבלציות רבות מבוצעות עם לייזר אולטרה סגול (UV), המציע רזולוציה צירית מוגבלת וחדירת רקמות. שיטה מתוארת כאן כדי לנפח נפחים עמוקים, משמעותיים ומוגדרים היטב באמצעות מיקרוסקופ של שני פוטונים. אבלציות מודגמות בקו דגי זברה מהונדס המבטא את החלבון הפלואורסצנטי הירוק במסנדונדורם צירי ומשמשות לניתוק המסנדודרם צירי מבלי להשפיע על הקטודרם המשתרע יתר על המידה או על תא החלמון הבסיסי. התנהגות התא מנוטרת על-ידי הדמיה חיה לפני ואחרי אבלציה. פרוטוקול אבלציה יכול לשמש בשלבים התפתחותיים שונים, על כל סוג תא או רקמה, בקשקשים הנעים בין כמה מיקרונים ליותר ממאה מיקרון.
Introduction
אינטראקציות בין תאים ממלאות תפקידים חיוניים בהתפתחות. תאים מספקים אותות לכך שהשכנים הישירים שלהם, או התאים רחוקים יותר, יכולים לתפוס, ובכך להשפיע על גורלם ו /או התנהגותם. רבים מהאותות האלה הם כימיים בטבע. לדוגמה, באירועי אינדוקציה מאופיינים היטב, קבוצת תאים אחת מייצרת מולקולות מפוזרות המשפיעות על גורלה של אוכלוסיית תאים אחרת1. אותות אחרים, לעומת זאת, הם מכניים; תאים מפעילים כוחות ואילוצים על שכניהם, שהשכנים תופסים ומגיבים ל2.
דרך אחת ללמוד את החשיבות של אינטראקציות תא-תאים אלה ב vivo היא לחסל כמה תאים ולבחון את ההתפתחות הבאה. למרבה הצער, הטכניקות הזמינות כדי להסיר או להרוס תאים מוגבלים. תאים ניתן להסיר בניתוח3,4, באמצעות מחטים או חוטים קטנים, אבל טיפולים כאלה הם פולשניים, לא מדויקים מאוד, ובדרך כלל מבוצעים תחת סטריאוטיקרוסקופ, מניעת הדמיה מיידית תחת מיקרוסקופ. יתר על כן, מיקוד תאים עמוקים מרמז פירסינג חור ברקמות overlying, יצירת מוטרדים לא רצויים. רגישים לאור מקודדים גנטית, כגון KillerRed, שימשו כדי לגרום למוות תאים באמצעות תאורת אור5. רגישים לאור הם כרומופורים המייצרים מינים של חמצן תגובתי על הקרנת אור. המגבלה העיקרית שלהם היא שהם דורשים תאורת אור ארוכה (סביב 15 דקות), אשר עשוי להיות קשה להשיג אם תאים נעים, וכי הם לגרום למוות תאים באמצעות אפופטוזיס, אשר אינו מיידי.
לבסוף, אבלציות לייזר פותחו בשימוש נרחב ב -15 השנים האחרונות6,7,8,9,10,11,12. קרן לייזר מתמקדת בתא/רקמה הממוקדים. זה גורמת אבלציה שלה באמצעות חימום, photoablation, או אבלציה הנגרמת על ידי פלזמה; התהליך המעורב תלוי בצפיפות הכוח וזמן החשיפה13. רוב פרוטוקולי אבלציה להשתמש לייזרי UV עבור האנרגיה הגבוהה שלהם. עם זאת, אור UV נספג ומפוזר על ידי רקמות ביולוגיות. לכן, מיקוד תאים עמוקים דורש כוח לייזר גבוה, אשר לאחר מכן גורמת נזקים ברקמות שטחיות יותר, מחוץ למטוס. זה מגביל את השימוש בלייזר UV למבנים שטחיים ומסביר את הרזולוציה האקסית הנמוכה יחסית שלהם. אופטיקה לא ליניארית (מה שנקרא מיקרוסקופיה דו-פוטונית) משתמשת במאפיינים לא ליניאריים של אור כדי לרגש פלואורופור עם שני פוטונים של כחצי אנרגיה בתחום האינפרא אדום. כאשר מוחל על אבלציות, יש לזה שלושה יתרונות עיקריים. ראשית, אור האינפרא אדום מפוזר פחות ונספג פחות מאור UV על ידי רקמות ביולוגיות14, ומאפשר להגיע למבנים עמוקים יותר מבלי להגדיל את כוח הלייזר הנדרש. שנית, השימוש בלייזר פעום פמטו-שניות מספק צפיפות הספק גבוהה מאוד, ויוצר אבלציה באמצעות אינדוקציה של פלזמה, אשר, בניגוד לחימום, אינו מתפזר מרחבי15. שלישית, צפיפות הכוח הגורמת להיווצרות פלזמה מגיעה בנקודת המוקד בלבד. הודות למאפיינים אלה, ניתן להשתמש בבלציות לייזר של שני פוטונים כדי למקד במדויק תאים עמוקים מבלי להשפיע על סביבת הרקמה שמסביב.
הגירות קולקטיביות הן דוגמה מצוינת לתהליכים התפתחותיים שבהם אינטראקציות בין תאים הן בסיסיות. העברות קולקטיביות מוגדרות כהעברות תאים שבהן תאים שכנים משפיעים על אופן הפעולה של תא אחד16. אופי האינטראקציות הללו (כימיות או מכניות) וכיצד הן משפיעות על נדידת תאים יכולים להשתנות מאוד ולעתים קרובות אינו מובן לחלוטין. היכולת להסיר תאים ולבחון כיצד זה משפיע על האחרים היא קריטית בפענוח נוסף של תהליכים קיבוציים אלה. לפני מספר שנים קבענו — באמצעות גישות כירורגיות — שהנדידה של הפוסטר במהלך בגרות דגי הזברה היא נדידה קולקטיבית17. הפולסטר הוא קבוצה של תאים המהווה את התאים ההפנמה הראשונה בצד העור של העובר18. תאים אלה, המסומנים בירוק בקו הטרנסגני Tg(gsc:GFP), ממוקמים עמוק בעובר, מתחת למספר שכבות של תאי אפיבלסט. במהלך ההסתעפות, קבוצה זו מובילה את הרחבת המסודרמה צירית, נודדת מהמארגן העוברי לקוטב החייתי19,20,21,22,23 (איור 1A). קבענו שתאים דורשים מגע עם שכניהם כדי לכוון את נדידתם לכיוון עמוד החיה. עם זאת, הבנה טובה יותר של הבסיסים התאיים והמולקולריים של הגירה קולקטיבית זו כרוכה בהסרת תאים מסוימים כדי לראות כיצד זה משפיע על הנותרים. לכן פיתחנו אבלציות של נפחים גדולים ועמוקים באמצעות מערך מיקרוסקופיה של שני פוטונים. כאן, אנו מדגימים את השימוש בפרוטוקול זה כדי לנתק את הפולסטר באמצעו ולבחון את ההשלכות על נדידת תאים על ידי מעקב אחר גרעינים המסומנים עם Histone2B-mCherry.
Protocol
כל עבודות החיות אושרו על ידי ועדת האתיקה N 59 ו Ministère de l'Education Nationale, de l'Enseignement Supérieur et de la Recherche תחת מספר הקובץ APAFIS#15859-2018051710341011v3. חלק מהצעדים המתוארים להלן ספציפיים לציוד ולתוכנה שלנו, אך ניתן להתאים אותם בקלות לציוד שונה.
1. הכנת הזרקה
- הכן 75 מ"ל של 1% תמיסה אגרוז בעובר בינוני (EM).
- מניחים את התבנית בהזרקה בצלחת פטרי 90 מ"מ ויוצקים כ 50 מ"ל של אגרוז, מספיק עבור התבנית לצוף. תן לאגורוז להתמצק ולהסיר את תבנית ההזרקה.
- מכינים מנה מצופה אגרוז על ידי מזיגת 1 מ"ל של אגרוז בצלחת פטרי 30 מ"מ.
- הכן 4 μL של 30 ng / μL Histone2B-mשרי mRNA פתרון על ידי דילול פתרון המלאי במים ללא RNase ולשמור על קרח.
הערה: יש להקפיד ללבוש כפפות תוך מניפולציה mRNA כדי למנוע השפלה בתיווך RNase. - משוך מחט הזרקה מניב באמצעות משיכת מיקרופיפט.
2. הכנת עוברים
- לאחר שהדגים מטילים ביצים, אוספים, שוטפים וקוצרים בצלחת פטרי 90 מ"מ ב- EM. מניחים את העוברים באינקובטור של 28 °C (28°F).
- המתן 20 דקות עד שהתא הראשון יהפוך לגלוי.
- מעבירים 30 עוברים לצלחת ההזרקה המלאה ב-EM. סוחטים עוברים בחריצים באמצעות מלקחיים מעט קהים ומכוונים אותם עם מוט החיות למעלה.
- באמצעות קצה microloader, למלא מחט הזרקה עם 2 μL של פתרון mRNA. הכנס את המחט למחזיק נימי להציב מיקרו מניפולטור מחובר צינורות פוליטרפלואורואתילן (PTFE) למזרק אוויר.
- מתחת לסטריאומיקוסקופ, בזהירות לשבור את קצה המחט.
- הזרק את תמיסה mRNA בעוברים שלב תא אחד על ידי החדרת המחט בתא.
הערה: אמצעי האחסון המוזרק הוא כשליש מנפח התא. - מניחים בחזרה עוברים מוזרקים באינקובטור 28 °C (28°F).
3. הכנת מיקרוסקופ שני פוטונים
הערה: שני לייזרים משמשים בפרוטוקול זה. אחד משמש לתמונה GFP (ב 920 ננומטר) ולבצע אבלציות (ב 820 ננומטר). זה ייקרא לייזר ירוק / אבלציה. השני משמש ב 1160 ננומטר כדי לדמיין mCherry. זה ייקרא הלייזר האדום.
- הגדר את לייזר ירוק / אבלציה ל 820 ננומטר (אורך גל אבלציה) ואת הלייזר האדום ל 1160 ננומטר (עירור mCherry).
- באמצעות מראות ניידות בנתיב האופטי, ישרו ירוק/אבלציה ואלומות לייזר אדומות הן בכניסה והן ביציאה מראש הסריקה.
הערה: פעולה זו מגבירה את מיקוד קרן הלייזר וממזערת את נפח המוקד עבור עירור ו אבלציה. - מדוד את העוצמה המרבית של לייזר ירוק/ אבלציה ב 820 ננומטר תחת המטרה. כדי לעשות זאת, למקם את מד הכוח מתחת למטרה, לסגור את התא השחור, להגדיר כוח לייזר ירוק / אבלציה ל 100%, ולפתוח את התריסים. חשב את אחוז כוח הלייזר הדרוש כדי להגיע ל-300 מגוואט.
- החזירו את הלייזר הירוק/אבלציה ל-920 ננומטר (עירור GFP) והגדירו את כוח הלייזר ל-7%. תקבע את כוח הלייזר האדום ל-15%.
- הפעל גלאי צינורות אפי-פוטומוליפלייר (PMT) עבור קווים ירוקים ואדומים; הגדר את רגישות PMT של הקו הירוק והאדום ל-65.
- הגדר את שדה הראייה ל- 400 x 400 מיקרומטר, רזולוציית תמונה ל- 512 x 512 פיקסלים ותדר סריקה ל- 800 הרץ.
- בחרו במצב הדמיית Timelapse תלת-ממדית . לאחר מכן, צור תיקיה והפעל שמירה אוטומטית עבור נתונים לאחר כל רכישה.
- להרכיב את תא החימום ולהגדיר אותו ל 28 °C (70 °F). המתינו לפחות 10 דקות עד התא והמטרה להתחמם.
4. הרכבה על העובר
- תחת סטריאמפיקוסקופ פלואורסצנטי, לזהות עוברים ב 70% אפיבולי להביע GFP.
הערה: בחר עוברים עם אות בהיר במסודרם צירי וללא פלואורסצנטיות רקע לאיכות הדמיה טובה יותר. - מעבירים בין שלושה לארבעה עוברים נבחרים בצלחת מצופה אגרוז (שלב 1.3) באמצעות פיפטת פסטר מפלסטיק ומניחים אותם בקפידה באמצעות מלקחיים עדינים.
הערה: עוברים dechorionated הם עדינים מאוד יתפרץ במגע עם אוויר או פלסטיק. - יוצקים 1 מ"ל של 0.2% אגרוז ב 1x פניצילין-סטרפטומיצין EM ב בקבוקון זכוכית קטן. מניחים את הקרבון בתנור בלוק יבש שחומם מראש 42 °C..
הערה: השלבים הבאים חייבים להתבצע במהירות כדי לאפשר כיוון עובר לפני סטים agarose. - מעבירים עובר dechorionated ב בקבוקון זכוכית אגרוז 0.2% באמצעות פיפטה זכוכית מלוטשת אש. יש להחריד לא להוסיף יותר מדי EM באגרוז כדי למנוע דילול זה. השליכו את ה-EM הנותר מהפיפטה ושאפו את העובר בחזרה יחד עם מספיק אגרוז כדי לכסות את החלקה של צלחת התחתונה של הזכוכית לפני שהעובר נופל מהפיפטה.
- לפוצץ את האגורוז ואת העובר על שקופית הזכוכית של המנה. יש להקפיד לא לתת לעובר לגעת באוויר או בצד הפלסטיק של המנה. לאחר מכן, מלאו את התא סביב מגלשת הזכוכית באגרוז.
- השתמשו בריס כדי לכוון את העובר כך שהאזור המיועד יהיה בחלק העליון (איור 1B).
הערה: בעת מכוון עוברים, יש להקפיד לגעת רק ב- blastoderm, ולא בחלמון השברירי מאוד. אגרוז (Agarose) תקבע כדקה אחת, בהתאם לטמפרטורת החדר. - המתן ~ 5 דקות עבור agarose להגדיר לחלוטין, ולאחר מכן להוסיף כמה טיפות של פניצילין-סטרפטומיצין EM.
5. איתור העובר והדמיה טרום אבלציה
- מניחים את צלחת התחתונה של הכוס מתחת למטרה בתא המחומם. לטבול את המטרה פניצילין-סטרפטומיצין EM ולסגור את התא מחומם.
- הזז את המחוון כדי להגדיר את נתיב האור למשקפת. לאחר מכן, באמצעות משקפת, מנורות פלואורסצנטיות ובקרת במה, למצוא עובר ולהגדיר את המוקד על פני השטח של העובר.
- כבה את מנורת הפלואורסצנטיות, הגדר את נתיב האור ל- PMTs וסגור את התא השחור.
הערה: היזהר לכבות את כל מקורות האור בתא השחור מכיוון שהוא עלול לפגוע ב- PMTs. - התחל הדמיה חיה ולאתר מסודרם צירי. התאם את כוחות הלייזר הירוקים/אבלציה והאדומים כך שיהיה להם אות טוב (כלומר, בין 1,000 ל-20,000 פוטונים לפיקסל לאזורי ביטוי GFP). השתמש בערוץ האדום כדי להזיז את הבמה לחלק העליון של העובר ולהגדיר מיקום זה כ- Z = 0.
- בחר שלב זמן של דקה אחת ו- Z-שלב של 2 מיקרומטר. קורס Z של 110 מיקרומטר מספיק כדי להקיף את כל הפולסטר והוא נרכש בתוך פחות מ 1 דקות עם הגדרות אלה. הגדר את הפרוסה הראשונה 15 מיקרומטר מעל mesoderm צירי (בectoderm שטחי יותר).
הערה: הפולסטר נע לאורך קו מעוקל כך שהפתח התחתון של מחסנית Z צריך להיות מוגדר 30 מיקרומטר עמוק יותר מהמיקום העמוק ביותר של הפולסטר כדי להתאים לתנועה שלו במהלך הדמיית זמן-לשגות (איור 1E). - הקלט 10-15 דקות של סרט טרום אבלציה.
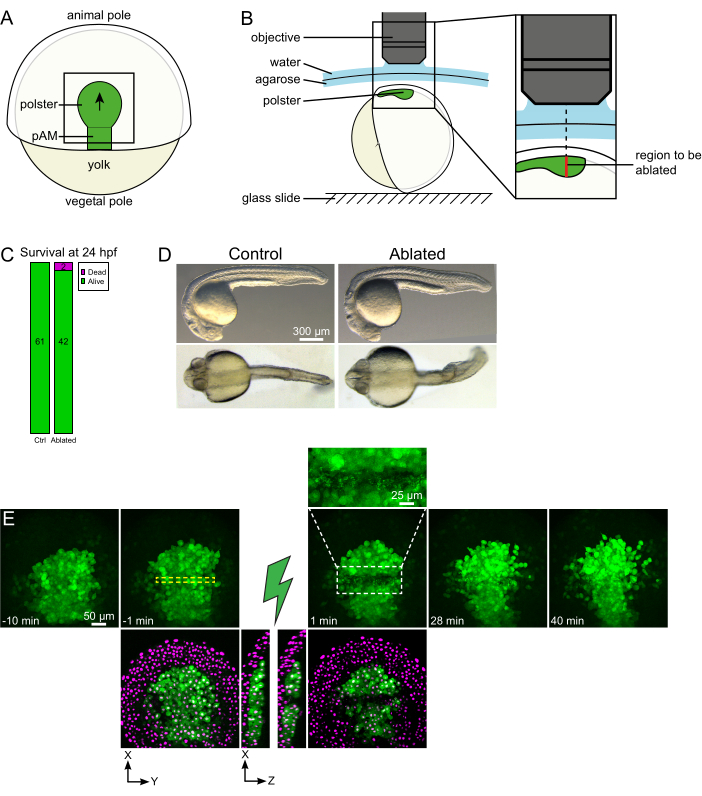
איור 1: תוצאה מוצלחת של אבלציות לייזר. (א) ערכה של עובר גסטריולט ב-70% אפיבולי בתצוגה גדושה; pAM: מסודרם צירי אחורי; החץ השחור מסמן את כיוון העברת הפולסטר; ריבוע שחור מציין שדה ראייה טיפוסי עבור אבלציות בפולסטר. (ב) תוכנית הרכבה עוברית לניתוק פולסטר. מבט לרוחב. העובר מותקן כך שמישור הפולסטר מאונך לציר האופטי. (C) הישרדות ו-(D) מורפולוגיה של שליטה ועוברים אבלים ב 24 שעות לאחר ההפריה. סרגל קנה המידה הוא 300 מיקרומטר. (E) רצף זמן מ אבלציה בלייזר בפולסטר של עובר Tg (gsc:GFP) המבטא Histone2B-mCherry. תצוגות עם הערוץ הירוק בלבד הן תחזיות מרביות. תקריב מציג את האזור אבלה המכיל פסולת תאים. תצוגות עם ערוצי ירוק ואדום (המוצגים כ- magenta) הן פרוסות XY ו- XZ לפני ואחרי אבלציה (הברק הירוק מייצג אבלציה). פרוסות XZ מראות כי הרקמות המוגזמות (גרעיני מגנטה ללא ביטוי GFP) לא הושפעו מההבלציה של מבנים בסיסיים. התיבה המקווקות הצהובה תואמת את ה- ROI שנבחר לטיפול בבלציה בלייזר. סרגל קנה המידה הוא 50 מיקרומטר בנופים גדולים ו 25 מיקרומטר בתקריב. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
6. מיקום היעד ונבל לייזר
- אתר את קווי המתאר של הפולסטר בהדמיה חיה, ובאמצעות הכלי אזור מעניין אלקטרו-אופטי (EOM ROI), צייר מלבן גדול של 20 פיקסלים (15 מיקרומטר) המשתרע על פני רוחב הפולסטר. הניחו את המלבן הזה באמצע הפולסטר (איור 1E).
- שים לב למיקום צירי של המישורים הגבוהים והנמוכים ביותר המכילים תאי פולסטר. אבלציות יבוצעו כל 10 מיקרומטר בין שני המטוסים האלה. יש לדאוג כי ROI אינו חופף את תא החלמון על כל המטוסים האלה.
- מקם את הבמה במיקום Z הנמוך ביותר של מרווח הזמן. אבלציות חייבות להתבצע מלמטה למעלה כמו פסולת לספוג אור.
- הגדר את אורך הגל של הלייזר הירוק/אבלציה ל- 820 ננומטר והגדר את אחוז הכוח כדי להשיג כוח יציאה של 300 mW (שלב 3.3).
- הגדר את תדר ההדמיה ל- 200 הרץ.
- הגדר EOM של הדמיית לייזר ירוק/אבלציה ל- 0 ובחר מצב טיפול על תנאי.
- הפעל את EOM ולהגדיר את הטיפול להתחיל מיד (לאחר 0 מסגרת).
- הגדר את מצב ההדמיה כ-Timelapse ובבטל את הפעלת שמירה אוטומטית.
- הגדר את שלב הזמן למצב מהיר.
- הגדר את מספר מסגרות הטיפול ומספר המסגרות לערך המתאים לעומק היעד (טבלה 1).
| עומק (מיקרומטר) | מסגרות טיפול |
| -30 | 1 |
| -35 | 1-2 |
| -40 | 1-2 |
| -45 | 2 |
| -50 | 2-3 |
| -55 | 3 |
| -60 | 3-4 |
| -65 | 4 |
| -70 | 4 |
| -75 | 4-5 |
| -80 | 4-5 |
| -85 | 5 |
| -90 | 5 |
| -95 | 5-6 |
| -100 | 6 |
| -105 | 6 |
טבלה 1: מספר מוצע של מסגרות טיפול בלייזר כפונקציה של עומק תאים ממוקד בעובר (0 הוא פני השטח של העובר).
- תתחילו להדמיה. הרכישה שחורה כמו התריס PMT נסגר במהלך טיפול EOM.
- מעבר שלב למיקום Z הבא של הרשימה (שלב 6.2).
- חזור על שלבים 6.10 עד 6.12 עד להגעה לראש הפולסטר.
7. אימות והדמיה לאחר אבלציה
- הגדר את הלייזר הירוק/אבלציה ל-920 ננומטר ו-5% כוח. הגדר את EOM הדמיית לייזר ירוק/אבלציה ל- 100 ובחר את מצב Fullfield .
- הגדר את תדר ההדמיה ל- 800 הרץ.
- עבור על כל הערימה במצב חי כדי לבדוק אם כל מטוס כבר ablated. אם זה לא המקרה, חזור לשלב 6.2.
הערה: אבלציה לפעמים מאפשרת שינוי אנכי של רקמות שכנות, כך שייתכן שיהיה להגדיר מחדש את מחסנית Z. - הגדר את מצב ההדמיה ל- Timelapse תלת-ממדי והפעל מחדש את שמירה אוטומטית. הקלט 40-60 דקות של סרט שלאחר אבלציה.
- בדוק, בסרט שלאחר אבלציה, אם התאים הממוקדים היו מבולבלים ביעילות. שחזור פלואורסצנטיות, או תאים ממוקדים התופסים מקום ומונעים מתאי העוקבים לנוע דרכם, מצביעים על כך שתאים ממוקדים היו רק מולבן ולא אבלטי (איור 1E ואיור 2A).
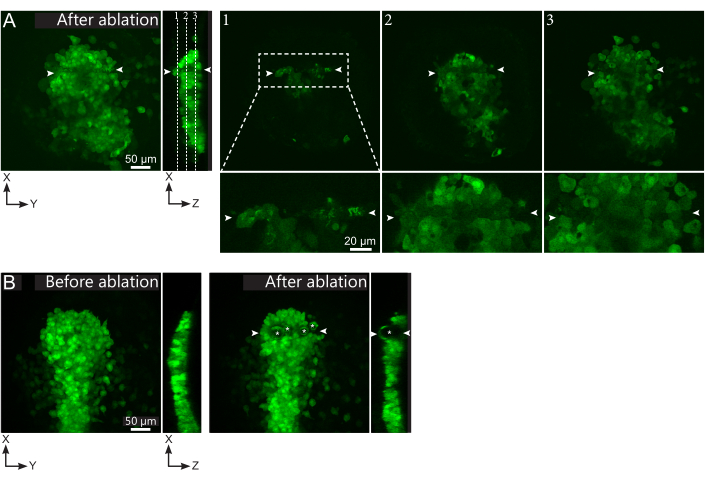
איור 2: תוצאות שליליות של אבלציות לייזר. (A) דוגמאות אופייניות לכשלים פוטנציאליים בבלציה בלייזר. תצוגות XY גדולות הן תחזיות מרביות, תצוגת XZ היא מקטע משוחזר. אזור שטופלו בלייזר ממוקם בין שני ראשי החצים הלבנים. שלושה מטוסי מוקד מסומנים בחלק המשוחזר ומוצגים מימין. הם מתאימים לשלושה סוגים שונים של כשלים. מישור 1 מראה שהתאים מעל הפולסטר התהפכו. זה יכול להיות מזוהה על ידי נוכחות של פסולת autofluorescent על מישור מוקד זה (ראה תקריב) מעל פולסטר (ראה מיקום של מטוס 1 על החלק המשוחזר). סביר להניח שהסי נתון זה נובע מהגדרה שגויה של האזור שיש לבלום. מישור 2 מראה תאים שהלבינו אך לא הולבנו. ניתן לזהות אותם כאות הפלואורסצנטיות הנמוכה שעדיין חושף קווי המתאר של התאים שלמים (ראו תקריב). מטוס 3 מציג תאים שלמים, שבקושי מולבן על ידי טיפול לייזר. זה יכול לנבוע הגדרה שגויה של האזור להיות ablated או מטיפול לקוי. במצבים המתוארים במטוסים 2 ו -3, ניתן ליישם מחדש את הטיפול אבלציה לתאים ממוקדים שאינם אבלים. סרגל קנה המידה הוא 50 מיקרומטר בנופים גדולים ו 20 מיקרומטר בתקריבים. (B) דוגמה טיפוסית של בועות (מסומן כוכביות לבנות) שנוצר על ידי cavitation בגלל טיפול לייזר אינטנסיבי מדי. בועות כאלה אינן מוגבלות למישור Z, לפעמים אפילו משתרעות על הגובה המלא של הפולסטר, מעוותות רקמות שכנות. סרגל קנה המידה הוא 50 מיקרומטר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
8. ניתוח נתונים
- פתח סדרת זמן לשגות עם תוכנת ניתוח התמונה והגדר את גודל הפיקסלים הנכון.
- בפונקציה Spot , הגדר את גודל האובייקט ל- 10 מיקרומטר, מכיוון שזהו גודל הגרעין הממוצע במהלך ההגדלה. לאחר מכן, הפעל את הפונקציה Spot כדי לזהות את הגרעינים ולעקוב אחריהם.
הערה: ניתן לשפר מעט את הזיהוי על-ידי התחשבות ברזולוציה הצירית התחתונה, המתאימה לצורה אליפסואידית באורך 12 מיקרומטר לאורך ציר Z. - השתמש במסננים כדי להסיר תוצאות חיוביות שגויות. בקו Tg(Gsc:GFP), תאים מהציר העוברי וכמה תאים אנדודרמליים מסומנים בירוק. לפיכך, סינון בעוצמה ירוקה מאפשר בחירה מהירה של תאים אלה (איור 3A).
- הגדר את המרחק המרבי בין נקודות רצופות לערך התואם למהירות התאים.
הערה: היזהר לשקול את מרווח הזמן בין שתי מסגרות. תאי פולסטר נודדים במהירות של 2.8 ± 0.8 מיקרומטר/דקה. לפיכך, מתן אפשרות 4 מיקרומטר של תזוזה מקסימלית במשך שלב זמן של 1 דקות מסיר את רוב המסלולים החפץ. - מתן אפשרות לפערים על-פני נקודות זמן אחת או שתיים מספק רצועות רציפות ארוכות יותר, אך עשוי להציג שגיאות מעקב. אם גרעין אינו מזוהה כראוי בנקודה חד-פעמית, שקול להפעיל מחדש זיהוי ספוט עם פרמטרים/מסננים שונים.
- בדוק חזותית רצועות, ובמידת הצורך, תקן אותן.
- יצא את התוצאות כקובץ .xlsx. עבד את הקובץ באמצעות שגרות גיליון אלקטרוני שפורסמו24 (איור 3B) ושגרות מותאמות אישית בתוכנת ניתוח נתונים (זמינה על פי בקשה).
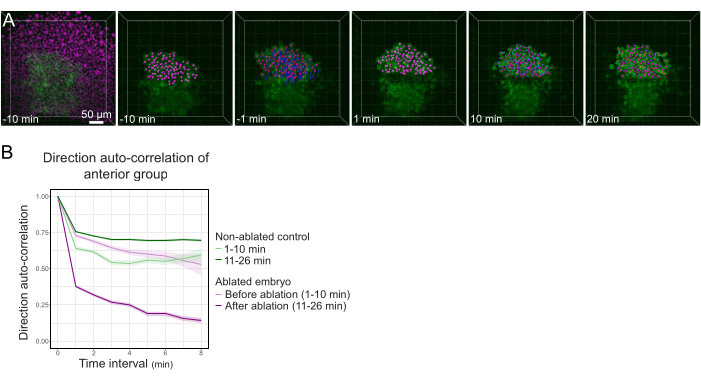
איור 3: בידוד המחצית האחורית של הפולסטר משפיע על כיוון התא. (A) 3D משחזר עובר Tg(gsc:GFP) המבטא את Histone2B-mCherry (מוצג במגנטה), לפני ואחרי אבלציה בלייזר ניתוק הפולסטר באמצעו. גרעינים השייכים לחצי האחורי של הפולסטר מסומנים בנקודה מגנטה ומעקב לאורך זמן לפני ואחרי אבלציה (ראה סרט S1). סרגל קנה המידה הוא 50 מיקרומטר. (B) כמדד להתמדה בנדידה, המתאם האוטומטי של התאים השייכים לחלקו הימני של הפולסטר לפני ואחרי אבלציה. תאים מציגים תנועה רציפה לפני אבלציה, אשר פוחתת באופן דרסטי לאחר אבלציה, המציין אובדן של העברה קולקטיבית. המתאם האוטומטי של הכיוון נמדד גם בתאים היוצרים את החצי האחורי של הפולסטר של עובר לא אבלטי, כפקד. מעטפות התרשים מציינות שגיאה סטנדרטית. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
תוצאות
כדי לנתק את הפולסטר באמצעו, עובר Tg (gsc:GFP), שהוזרק עם Histone2B-mCherry mRNAs הותקן בשלב 70% אפיבולי, כמתואר בשלב 4. הפולסטר זוהה על ידי ביטוי GFP, והעובר הותקן כך שמישור הפולסטר מאונך לציר האופטי (איור 1B). הטיית העובר הרחק מעמדה זו תסבך את ההליך. האור יצטרך לעבור דרך רקמות נוספות כדי להגי...
Discussion
כאן, אנו מתארים פרוטוקול המשתמש באופטיקה לא ליניארית כדי לבצע אבלציות נפח עמוקות ומוגדרות היטב. השלב הקריטי ביותר של הפרוטוקול הוא למצוא תנאי טיפול המספקים מספיק אנרגיה כדי לאפשר אבלציות, אבל לא יותר מדי אנרגיה, כדי למנוע פסולת מוגזמת או cavitation. כמות האנרגיה המועברת באתר היעד תלויה בעיקר ב:...
Disclosures
המחברים מצהירים שאין אינטרסים מתחרים.
Acknowledgements
אנו מודים לאמילי מננט על טיפול בדגים, למתקן הביו-הדמיה הפוליטכני, ובמיוחד לפייר מהו, על הסיוע בהדמיה חיה על הציוד שלהם שנתמך בחלקו על ידי Région Ile-de-France (ביניים) ו- Agence Nationale de la Recherche (ANR-11-EQPX-0029 Morphoscope2, ANR-10-INBS-04 צרפת BioImaging). עבודה זו נתמכה על ידי מענקי ANR 15-CE13-0016-1, 18-CE13-0024, 20-CE13-0016, ותוכנית המחקר והחדשנות Horizon 2020 של האיחוד האירופי תחת הסכם המענק מארי Skłodowska-Curie No 840201, המיניסטר דה ל'אנסנסיגנציה Supérieur et de la Recherche והמרכז הלאומי דה לה רשצ'ה סיאנטיפיק.
Materials
| Name | Company | Catalog Number | Comments |
| 25x water immersion objective | Olympus | XLPLN25XWMP2 | |
| Agarose | PanReac AppliChem | A8963,0500 | |
| Data analysis software : Matlab | Math Works | ||
| Electro-optic modulator (EOM) | ConOptics | 350-80LA | |
| Embryo Medium (EM) solution | Westerfield, M. The Zebrafish Book. A Guide for the Laboratory Use of Zebrafish (Danio rerio), 5th Edition. University of Oregon Press, Eugene (Book). (2000). | ||
| Environmental chamber chamber | Okolab | H201-T-UNIT-BL | |
| EOM driver | ConOptics | 302RM | |
| Fluorescence source | Lumencor | SOLA | |
| Glass bottom dishes | MatTek | P35G-0-10-C | |
| Glass capillaries | Harvard Apparatus | 300085 | Outside diameter 1.0 mm, inside diameter 0.58 mm |
| Glass pipettes | Volac | D810 | Tip should be fire polished |
| Green/ablation laser | Spectra Physics | Mai Tai HP DeepSee | |
| Histone2B-mCherry mRNA | Synthesized from pCS2-H2B-mCherry plasmid (Dumortier& al. 2012) | ||
| Image analysis software: IMARIS | Bitplane | ||
| ImSpector software | Abberior Instruments Development Team | ||
| Injection mold | Adapative Science Tools | I-34 | |
| Microloader tips | Eppendorf | 5242956003 | |
| Micromanipulator | Narishige | MN-151 | |
| Micropipette puller | Sutter | P-1000 | |
| mMESSAGE mMACHINE SP6 Transcription Kit | Invitrogen | AM1340 | |
| Penicillin-Streptomycin | Thermofisher | 15140-122 | 10 000 units penicillin and 10 mgstreptomycin per ml |
| Photomultiplier tube (PMT) | Hammamatsu | H7422-40 | |
| PicoPump (Air injector) | World Precision Instrument | PV820 | |
| Red laser | Spectra Physics | OPO/Insight DeepSee | |
| RNAse free water for injection | Sigma | W3500 | |
| Spreadsheet software: Excel | Microsoft | ||
| Stereomicroscope | Nikon | SMZ18 | |
| Tg(gsc:GFP) zebrafish line | Doitsidou, M. et al. Guidance of primordial germ cell migration by the chemokine SDF-1. Cell. 111 (5), 647–59, doi: doi.org/10.1016/S0092-8674(02)01135-2 (2002). | ||
| TriM Scope II microscope | La Vision Biotech |
References
- Slack, J. M. W. Embryonic induction. Mechanisms of Development. 41 (2-3), 91-107 (1993).
- Fernandez-Sanchez, M. -. E., Brunet, T., Röper, J. -. C., Farge, E. Mechanotransduction's impact on animal development, evolution, and tumorigenesis. Annual Review of Cell and Developmental Biology. 31, 373-397 (2015).
- Shih, J., Fraser, S. E. Characterizing the zebrafish organizer: microsurgical analysis at the early-shield stage. Development. 122 (4), 1313-1322 (1996).
- Selleck, M. A. J. Culture and microsurgical manipulation of the early avian embryo. Methods in Cell Biology. 51 (51), 1-21 (1996).
- Bulina, M. E., et al. A genetically encoded photosensitizer. Nature Biotechnology. 24 (1), 95-99 (2006).
- Fang-Yen, C., Gabel, C. V., Samuel, A. D. T., Bargmann, C. I., Avery, L. Laser microsurgery in Caenorhabditis elegans. Methods in Cell Biology. 107, 177-206 (2012).
- Colombelli, J., Grill, S. W., Stelzer, E. H. K. Ultraviolet diffraction limited nanosurgery of live biological tissues. Review of Scientific Instruments. 75 (2), 472-478 (2004).
- Smutny, M., Behrndt, M., Campinho, P., Ruprecht, V., Heisenberg, C. -. P. UV laser ablation to measure cell and tissue-generated forces in the zebrafish embryo in vivo and ex vivo. Methods in Molecular Biology. 1189, 219-235 (2015).
- Behrndt, M., et al. Forces driving epithelial spreading in zebrafish gastrulation. Science. 338 (6104), 257-260 (2012).
- Volpe, B. A., Fotino, T. H., Steiner, A. B. Confocal microscope-based laser ablation and regeneration assay in zebrafish interneuromast cells. Journal of Visualized Experiments: JoVE. (159), (2020).
- Bonnet, I., et al. Mechanical state, material properties and continuous description of an epithelial tissue. Journal of the Royal Society, Interface. 9 (75), 2614-2623 (2012).
- Rauzi, M., Lenne, P. F., Lecuit, T. Planar polarized actomyosin contractile flows control epithelial junction remodelling. Nature. 468 (7327), 1110-1115 (2010).
- Niemz, M. H. . Laser-Tissue Interactions. Encyclopedia of Biomaterials and Biomedical Engineering, Second Edition - Four Volume Set. , (2019).
- Smith, A. M., Mancini, M. C., Nie, S. Bioimaging: second window for in vivo imaging. Nature Nanotechnology. 4 (11), 710-711 (2009).
- Rauzi, M., Lenne, P. -. F. Cortical forces in cell shape changes and tissue morphogenesis. Current Topics in Developmental Biology. 95, 93-144 (2011).
- Theveneau, E., David, N. B. Migrations cellulaires collectives. Medecine/Sciences. 30 (8-9), 751-757 (2014).
- Dumortier, J. G., Martin, S., Meyer, D., Rosa, F. M., David, N. B. Collective mesendoderm migration relies on an intrinsic directionality signal transmitted through cell contacts. Proceedings of the National Academy of Sciences of the United States of America. 109 (42), 16945-16950 (2012).
- Solnica-Krezel, L., Stemple, D. L., Driever, W. Transparent things: cell fates and cell movements during early embryogenesis of zebrafish. BioEssays. 17 (11), 931-939 (1995).
- Montero, J. -. A., Kilian, B., Chan, J., Bayliss, P. E., Heisenberg, C. -. P. Phosphoinositide 3-kinase is required for process outgrowth and cell polarization of gastrulating mesendodermal cells. Current Biology. 13 (15), 1279-1289 (2003).
- Ulrich, F., et al. Slb/Wnt11 controls hypoblast cell migration and morphogenesis at the onset of zebrafish gastrulation. Development. 130 (22), 5375-5384 (2003).
- Kai, M., Heisenberg, C. -. P., Tada, M. Sphingosine-1-phosphate receptors regulate individual cell behaviours underlying the directed migration of prechordal plate progenitor cells during zebrafish gastrulation. Development. 135 (18), 3043-3051 (2008).
- Smutny, M., et al. Friction forces position the neural anlage. Nature Cell Biology. 19 (4), 306-317 (2017).
- Johansson, M., Giger, F. A., Fielding, T., Houart, C. Dkk1 controls cell-cell interaction through regulation of non-nuclear β-Catenin pools. Developmental Cell. 51 (6), 775-786 (2019).
- Gorelik, R., Gautreau, A. Quantitative and unbiased analysis of directional persistence in cell migration. Nature Protocols. 9 (8), 1931-1943 (2014).
- Grill, S. W., Howard, J., Schäffer, E., Stelzer, E. H. K., Hyman, A. A. The distribution of active force generators controls mitotic spindle position. Science. 301 (5632), 518-521 (2003).
- Desprat, N., Supatto, W., Pouille, P. -. A. A., Beaurepaire, E., Farge, E. Tissue deformation modulates twist expression to determine anterior midgut differentiation in Drosophila embryos. Developmental Cell. 15 (3), 470-477 (2008).
- Farhadifar, R., Röper, J. -. C., Aigouy, B., Eaton, S., Jülicher, F. The influence of cell mechanics, cell-cell interactions, and proliferation on epithelial packing. Current Biology. 17 (24), 2095-2104 (2007).
- Willier, B. H., Oppenheimer, J. M. . Foundations of Experimental Embryology. , (1964).
- Ashby, W. J., Zijlstra, A. Established and novel methods of interrogating two-dimensional cell migration. Integrative Biology: Quantitative Biosciences from Nano to Macro. 4 (11), 1338-1350 (2012).
- Bosze, B., et al. Pcdh18a regulates endocytosis of E-cadherin during axial mesoderm development in zebrafish. Histochemistry and Cell Biology. 154 (5), 463-480 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved