A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מערכת תרבית אוטומטית לשימוש בבדיקות פרה-קליניות של טיפולים מכווני מארח לשחפת
In This Article
Summary
כימות מהיר ויעיל של גדילת שחפת M. תוך תאית הוא חיוני להמשך טיפולים משופרים נגד שחפת ( שחפת ). פרוטוקול זה מתאר בדיקת זיהוי קולורימטרית מבוססת מרק באמצעות מערכת תרבית נוזלית אוטומטית כדי לכמת את גידול ה-Mtb במקרופאגים שטופלו בטיפולים מוכווני מארח מועמדים.
Abstract
מיקובקטריום שחפת (Mtb), הגורם הסיבתי לשחפת, היה גורם התמותה המשמעותי ביותר ממחלות זיהומיות בעולם עד להופעת COVID-19. Mtb התפתח כדי להתמיד בסביבה התוך-תאית שלו, להתחמק מהגנות המארח, ופיתח עמידות לתרופות רבות נגד שחפת. גישה אחת לפתרון עמידות היא זיהוי תרופות מאושרות קיימות שיגבירו את התגובה החיסונית של המארח ל-Mtb. לאחר מכן ניתן יהיה לשנות את ייעודן של תרופות אלה כטיפולים משלימים המכוונים על ידי מארח (HDT) כדי לקצר את זמן הטיפול ולסייע להתגבר על עמידות לאנטיביוטיקה.
כימות של גידול Mtb תוך-תאי במקרופאגים הוא היבט מכריע בהערכת HDT פוטנציאלי. תקן הזהב למדידת גידול Mtb הוא ספירת יחידות יוצרות מושבה (CFU) על לוחות אגר. זוהי בדיקה איטית, עתירת עבודה, שאינה מתאימה לסינון מהיר של תרופות. בפרוטוקול זה, מערכת תרבית אוטומטית, מבוססת מרק, המשמשת בדרך כלל יותר לאיתור Mtb בדגימות קליניות, הותאמה לסינון פרה-קליני של טיפולים מכווני מארח. הוערכה יכולתה של מערכת בדיקת התרבית הנוזלית לחקור גידול Mtb תוך-תאי במקרופאגים שטופלו ב-HDT. ה-HDTs שנבדקו על יכולתם לעכב צמיחת Mtb היו חומצה רטינואית כל-טרנסית (AtRA), הן בתמיסה והן במיקרו-חלקיקים של פולי(חומצה לקטית-קו-גליקולית) (PLGA) והשילוב של אינטרפרון-גמא ולינזוליד. היתרונות של טכניקה אוטומטית זו המבוססת על תרבית נוזלית על פני שיטת CFU כוללים פשטות התקנה, הכנה פחות עתירת עבודה וזמן מהיר יותר לתוצאות (5-12 ימים לעומת 21 ימים או יותר עבור צלחות אגר).
Introduction
מיקובקטריום שחפת (Mtb), הגורם הסיבתי לשחפת, היה הרוצח המשמעותי ביותר למחלות זיהומיות בעולם בשנת 20191. כדי להתחמק מהגנות המארח, Mtb חותר תחת הפעילות המיקובקטריאלית של תאי מערכת החיסון המולדת כגון מקרופאגים ותאים דנדריטיים (DCs), ומאפשר לו להתמיד תוך תאית ולהשתכפל2. היעדר חיסון יעיל למניעת שחפת ריאתית למבוגרים והופעתם הגוברת של זנים עמידים לתרופות מדגישים את הצורך הדחוף בטיפולים חדשים.
טיפולים משלימים המכוונים על ידי מארח (HDT) יכולים לקצר את זמן הטיפול ולעזור להתגבר על התנגדות3. הערכה פרה-קלינית של מועמדי HDT במבחנה כדי לקבוע פעילות מיקובקטריצידלית בתוך מקרופאגים מסתמכת לעתים קרובות על כימות של גידול Mtb על ידי יחידות יוצרות מושבה (CFU) על צלחות אגר מוצקות. זוהי בדיקה איטית, עתירת עבודה, שאינה מתאימה לסינון מהיר של תרופות. מערכות זיהוי מיקרוביאליות אוטומטיות מבוססות מרק, הזמינות מסחרית, נפוצות יותר במעבדות מיקרוביולוגיה קליניות לזיהוי ובדיקת רגישות לתרופות של Mtb ומינים מיקובקטריאליים אחרים בדגימות קליניות4. מכשירים אלה מודדים גדילה בעקיפין על סמך הפעילות המטבולית החיידקית המובילה לשינויים פיזיים במדיית התרבית (שינוי ברמות CO 2 או O2 או לחץ) המנוטרים לאורך זמן5. הקריאה היא זמן לחיוביות (TPP), שבעבר הוכח כי היא מתואמת עם Mtb CFU בדגימות כיח של חולי שחפת בתגובה לטיפול 6,7 ובליזטים של ריאה וטחול מורין נגועים8. בנוסף, נעשה שימוש במערכות לזיהוי תרביות נוזליות כדי למדוד את ההשפעה של טיפולים קונבנציונליים המכוונים לפתוגנים על צמיחת מיקובקטריה בתרבית אקסנית ומקרופאגים בתרבית 9,10. המכשיר שימש גם כדי לחקור את היכולת המולדת של תאים דנדריטיים ושל מקרופאגים אלוואולריים לשלוט בצמיחה תוך-תאית של Mtb11,12. פרוטוקול ניסיוני זה מדגים כי ניתן להתאים מערכת אבחון של תרבית נוזלית לביצוע בדיקות סקר פרה-קליניות של HDT לשחפת במקרופאגים בתרבית. בהשוואה לספירה של CFU, היתרון העיקרי של טכניקה זו הוא שהיא מפחיתה במידה ניכרת את העבודה הניסיונית ואת הזמן הדרוש לכימות גדילה/הישרדות של מיקובקטריאליים תוך-תאיים. טכניקה זו מסתמכת על גישה לכלי תרבית אוטומטי שניתן להשתמש בו כדי להעריך את הישרדות המיקובקטריאליים התוך-תאיים בתאי מערכת החיסון שטופלו במגוון רחב של ריאגנטים פרמקולוגיים המכוונים לתפקודים תאיים כדי להגביר את חסינות המארח.
Access restricted. Please log in or start a trial to view this content.
Protocol
הניסויים המתוארים בפרוטוקול זה בוצעו באמצעות זן H37Ra מוחלש של Mtb, אשר ניתן לטפל בו במעבדת הכלה רמה 2. כל המניפולציות של מיקובקטריה חיה בוצעו בארון הבטיחות הביולוגי מסוג II (BSC). הליכים ניסיוניים נועדו למזער את הדור של אירוסולים. תרבית תאים אאוקריוטים (תאי THP-1) בוצעה גם ב-BSC מדרגה II. המעבדה ביצעה הערכת סיכונים והבטיחה כי כל ההליכים יבוצעו בהתאם לתקנות הבטיחות הביולוגית המוסדית והארצית. קו התאים המונוציטי האנושי THP-1 שימש לביצוע השיטה כמתואר (שלב 1). התאים מתמיינים למקרופאגים לאחר גירוי עם פורבול 12-מיריסטאט 13-אצטט (PMA) לפני זיהום במיקובקטריה.
1. תרבית תאים
- הפיצו מלאי זרעים H37Ra כדי לרשום שלב בציר Middlebrook 7H9 (MB) בתוספת העשרת אלבומין-דקסטרוז-קטלאז (ADC) (10%) ו-0.05% פוליסורבט 80. יש לאחסן מלאי H37Ra ב-1 מ"ל במקפיא בטמפרטורה של -80°C למשך עד שנה.
- הפשירו בקבוקון של 1 מ"ל של Mtb-H37Ra והעבירו אותו לבקבוקון T25 עם מכסה מסנן המכיל 9 מ"ל של מרק נוסף MB כשבוע לפני הניסוי המתוכנן. דגירה ב-37 מעלות צלזיוס במשך 5-7 ימים באינקובטור סטטי.
- לגדל תאי THP-1 ב-RPMI-1640 בתוספת 10% סרום עגל עוברי ללא חום (שלם (c)RPMI) בבקבוק T75 באינקובטור לח CO 2 ב-5% CO2/37 °C ותת-תרבית פעמיים בשבוע כדי לשמור על צפיפות של פחות מ-1 x 106 תאים למ"ל.
- התמינו תאי THP-1 למקרופאגים 3 ימים לפני ההדבקה על ידי פיפטינג עדין של תאים מספר פעמים באמצעות פיפטה סרולוגית בבקבוקי T75 כדי לפזר את כל הגושים ולהניח אותם בצינור חרוטי של 50 מ"ל.
- תאים צנטריפוגים בגודל 300 x g למשך 10 דקות בטמפרטורת החדר, מסירים את הסופר-נטנט, ומניחים בעדינות את הכדור ב-2 מ"ל של RPMI. בצע ספירת תאים כדי להעריך תאים/מ"ל.
- זרע 2 מ"ל של מקרופאגים THP-1 ב-12 צלחות תרבית רקמה בצפיפות של 100,000 תאים/מ"ל ב-cRPMI עם 100 ננוגרם/מ"ל PMA למשך 72 שעות. הסר את המדיום המכיל PMA מהתאים וחדש עם cRPMI טרי לפני זיהום Mtb.
- הגדר לוחות נפרדים עבור כל נקודת זמן נדרשת.
- תאי זרעים באותה צפיפות (100,000 תאים/מ"ל) בשקופיות של 2 תאי זכוכית כדי לקבוע את ריבוי הזיהום (MOI).
- מניחים באינקובטור 5% CO2 לח למשך 3 ימים ב 37 מעלות צלזיוס.
2. כימות קליטת MTB
- קביעת ספיגת MTB על ידי מקרופאגים (MOI)
- הגדר את ארון הבטיחות הביולוגי Class II (BSC) ביום ההדבקה ועבוד על שתי שכבות של נייר טישו כדי לתפוס כל נזילה. הגדירו מיכלי פסולת להשלכה בהתאם לתקנות המקומיות.
- הסר 6-8 מ"ל של תרבית מיקובקטריאלית מבקבוק T25 והעבר אותו לצינור פוליפרופילן של 15 מ"ל.
הערה: ניתן להשתמש בצינורות בנפח קטן יותר לניסויים קטנים יותר. - צנטריפוגה את הצינור בצנטריפוגה ספסל בטמפרטורת החדר למשך 10 דקות ב 2890 x גרם.
- הסר בזהירות את הצינור מהצנטריפוגה והעבר אותו לארון הבטיחות הביולוגי. המתן דקה אחת כדי לאפשר לחיידקים לשקוע.
- שפכו את חומר החיטוי לתוך מיכל ההשלכה של חומר החיטוי, שפופרת הסיכום והרחיקו את החיידקים בתווך הנותר על ידי הקשה על צד הצינור. המתן דקה אחת כדי לאפשר לחיידקים לשקוע.
- מוסיפים 2 מ"ל של cRPMI שחומם מראש, מערבבים בעדינות ומעבירים לצינור חרוטי של 50 מ"ל.
- יש להשעות את המיקובקטריה בזהירות רבה באמצעות מחט של 25 גרם ומזרק של 5 מ"ל. כדי לבצע החייאה, משכו את תרחיף המיקובקטריה לתוך המזרק ופלטו בעדינות רבה לאורך דופן הצינור כדי למזער את ייצור האירוסול. חזור על 6-8 פעמים.
הערה: נקוט זהירות מרבית מכיוון שמדובר בתרבית בצפיפות גבוהה של מיקובקטריה. כדי למנוע את הסיכון של פגיעה במקל המחט, השתמש במחטים קהות במידת האפשר, ומזרקי Luer. - השליכו את המחט והמזרק במיכל חדים ב- BSC.
- העבירו את המתלים לצינור מיקרופוגה בגודל 2 מ"ל (עם מכסה הברגה) וצנטריפוגה בטמפרטורת החדר למשך 3 דקות ב-100 x גרם כדי לגלגל את כל הגושים שנותרו. החזירו את הצינור לארון הבטיחות והמתינו דקה אחת כדי לאפשר לחיידקים לשקוע.
- העבר את 1-1.5 המ"ל העליונים של הסופרנטנט לצינור חדש. יש להשליך את השפופרת המקורית לדלי הפסולת המכיל חומר חיטוי. מערבבים היטב ומוסיפים כמויות שונות של מתלה המיקובקטריאלי (למשל, 5, 25, 50, 150 μL) למגלשות תא הזכוכית של 2 בארות ודוגרים במשך 3 שעות באינקובטור CO2 בטמפרטורה של 37 מעלות צלזיוס.
- צביעה על חיידקים מהירים חומצית (AFB)
הערה: לאחר דגירה של 3 שעות, המקרופאגים נשטפים ומקובעים עם פרפורמלדהיד כדי להשבית מיקובקטריה. לאחר מכן, השקופיות מוכתמות באמצעות ערכת Auramine O שעברה שינוי (ראו טבלת חומרים) כדי להעריך מיקובקטריה פאגוציטוזה לכל תא. בשל דופן תא השעווה שלהם, מיקובקטריה שומרים על צבע האורמין לאחר שטיפת חומצה-אלכוהול. גרעיני המקרופאגים מוכתמים לאחר מכן ב-Hoechst. שיטה זו מאפשרת לספור את מספר החיידקים הפאגוציטוזים לכל תא ומשמשת לקביעת ריבוי הזיהום (MOI) של המקרופאגים.- הסר את המדיום ממגלשת תא הזכוכית לאחר צנרת למעלה ולמטה שלוש פעמים כדי לעקור חיידקים שלא טופלו פאגוציטוזה.
- לשטוף פעם אחת עם 2 מ"ל של PBS בטמפרטורת החדר.
- מלאי חנות של 4% paraformaldehyde, מומס PBS ב aliquots ב -20 °C (70 °F) עד 6 חודשים. להפשיר אליקוט של 4% פרפורמלדהיד מיד לפני השימוש. יש לדלל ל-2% פרפורמלדהיד עם PBS ולהוסיף 2 מ"ל לכל באר.
- דגירה במשך 10 דקות בטמפרטורת החדר. ניתן להסיר את מגלשת תא הזכוכית מארון הבטיחות בשלב זה לצורך צביעה.
- שטפו את המגלשה מתחת לזרם עדין של מי ברז.
- יש לפזר מספיק אורמין על המגלשה כדי לכסות את התאים באמצעות פיפטה להעברת פלסטיק ולדגירה למשך דקה אחת בטמפרטורת החדר בחושך (לכסות בנייר אלומיניום).
- שטפו את עודפי הצבע מהמגלשה עם מי ברז והוסיפו את מסיר הצבעים / quencher למשך דקה אחת בחושך.
- שטפו את העודפים במי ברז ודגרו במשך 15 דקות בטמפרטורת החדר עם Hoechst 33342 (10 מיקרוגרם/מ"ל ב-PBS) בחושך.
- שטפו את כתם ההוכסט במי ברז, הסירו את התאים, נקזזו עודפי מים מהמגלשה, הוסיפו טיפת אנטיפדה וכיסוי, ויייבשו באוויר.
- בחן את השקופית מתחת למיקרוסקופ הפלואורסצנטי באמצעות המטרה 100x שמן. מיקובקטריה תזרח בירוק מתחת למסנן FITC. הגרעינים מתנוססים בכחול מתחת למסנן DAPI (איור 1C).
- קבע את MOI על ידי ספירת מספר המיקובקטריה פאגוציטוזה לכל תא ואחוז התאים הנגועים.
- חשב את נפח ההשעיה המיקובקטריאלית הדרושה להשגת ה- MOI הנדרש בהתבסס על שטח הפנים של באר בצלחת; לדוגמה, שטח הפנים של שקופיות תא הזכוכית ששימשו בניסוי זה הוא 4 ס"מ2. MOI נמוך (כ-1-2 בצילי לתא) רצוי לניסויים הנערכים במשך מספר ימים (למשל, 5 ימים).
- זיהום של מקרופאגים
- ערבבו היטב את תרחיף המיקובקטריה והוסיפו את הכמות הדרושה לתאים על לוחות של 12 בארות לאחר שנקבע הנפח הדרוש להשגת ה-MOI הרצוי.
- דגירה ב-37 מעלות צלזיוס למשך 3 שעות כדי לאפשר למיקובקטריה להיות פאגוציטוזה.
- הסר חיידקים חוץ תאיים על ידי שטיפת הבארות עם RPMI חם או HBSS מספר פעמים.
- שים את המקרופאגים בבאר אחת (דגימה של 3 שעות) כדי לקבוע את אחוז הזמן לחיוביות (TTP) של האינוקולום הראשוני (דגימה של 3 שעות) כמתואר בשלב 3 להלן.
- הוסף cRPMI טרי ואת מינוני התרופה הנדרשים או בקרת רכב לבארות הנותרות, לדגור את הצלחות בחממת CO2 ב 37 מעלות צלזיוס לזמן הדרוש (תלוי בתכנון הניסוי אבל בדרך כלל במספר מרווחים בין 1 ל 8 ימים).
3. קצירת דגימות למערכת זיהוי תרבית נוזלית
הערה: ביום ההדבקה, מיקובקטריה חוץ-תאית מוסרת על-ידי שטיפה, ומיקובקטריה תוך-תאית נקטפת על-ידי תזה של באר אחת של מקרופאגים (דגימה של 3 שעות) כדי לקבוע את הכמות הראשונית של פאגוציטוזה כבקרה בסיסית לזיהום. בזמנים שלאחר מכן משולבים גם המדיום, ליזאט התאים וגם השטיפות כדי למדוד את הצמיחה המיקובקטריאלית הכוללת. ניתן גם להעריך צמיחה חוץ-תאית ותוך-תאית בנפרד במידת הצורך.
- קציר דגימה של 3 שעות כדי לקבוע TTP
- יש לשטוף מיקובקטריה חוץ-תאית מכל הבארות לאחר 3 השעות הראשונות של הזיהום כמתואר בשלב 2.3.3. הוסף 1 מ"ל של מדיה טרייה לבאר הבקרה של 3 שעות כדי להשוות את עוצמת הקול של ליזאט עם אלה של נקודות זמן מאוחרות יותר.
הערה: ראה שלב 3.2.7 אם יש להוציא מיקובקטריה חוץ-תאית מהניתוח.
- יש לשטוף מיקובקטריה חוץ-תאית מכל הבארות לאחר 3 השעות הראשונות של הזיהום כמתואר בשלב 2.3.3. הוסף 1 מ"ל של מדיה טרייה לבאר הבקרה של 3 שעות כדי להשוות את עוצמת הקול של ליזאט עם אלה של נקודות זמן מאוחרות יותר.
- איסוף דגימות
- בקבוקי מרק MB חמים ותרבית כלי נגינה כדי להביא אותם לטמפרטורת החדר.
- העבר את המדיום מצלחת 12 הבאר לצינורות החרוטיים המסומנים המתאימים.
- הוסף 500 μL של מאגר ליזיס סטרילי (0.1% Triton x-100 ב- PBS מסונן דרך מסנן סטרילי של 0.2 מיקרומטר) לכל באר למשך 10 דקות.
- מגרדים בעדינות את התאים מהבאר עם מגרד סטרילי ומשלבים עם המדיום בצינור החרוטי המתאים.
- לשטוף את הבאר עם 0.5 מ"ל של PBS סטרילי ולהעביר את הצינור המתאים.
- מעבירים בעדינות כל דגימה דרך מחט ומזרק (25 גרם) 6-8 פעמים כדי לפרק את הגושים. לדלל דגימות 1:10 במרק MB; 100 μL מדגם + 900 μL MB בינוני.
- בזמנים/ימים הנדרשים (בדרך כלל בין 1 ל-8 ימים), קצרו את הדגימות הנותרות על ידי ביצוע השלבים 3.2.1-3.2.6 לעיל.
הערה: החוקרים עשויים להעדיף להוציא מיקובקטריה חוץ-תאית מהניתוח שלהם, ובמקרה זה, בשלב 3.2.2 לעיל, התווך מכל באר מושלך, ומקרופאגים נשטפים מספר פעמים לפני הוספת מאגר תזה.
- בקבוקי תרבית מכשירים לחיסון וטעינה
הערה: פרטים על כלי התרבית הנוזלית והחומרים המתכלים הקשורים אליו מסופקים בטבלת החומרים.- יש לעקר את פקק הגומי של בקבוק תרבית המכשיר בנייר טישו ספוג ב-70% אלכוהול ולאפשר לו להתייבש באוויר.
הערה: שלב זה צריך להתבצע ב- BSC. - הכינו את הבקבוקים על ידי העברת כמות מספקת של תוספי תזונה עבור כל הדגימות לתוך צינור חרוטי (0.5 מ"ל/בקבוק). השתמשו במחט ובמזרק כדי להזריק 0.5 מ"ל של תוסף תזונה לבקבוק תרבית המכשירים.
- פיפטה 500 μL של הדגימה המדוללת (1:10) לתוך צינור 1 מ"ל עם תחתית V.
- השתמש במחט ובמזרק כדי להזריק את הדגימה של 500 μL לתוך בקבוק תרבית המכשיר שהוקצה.
- יש לעקר את פקק הגומי של בקבוק תרבית המכשיר בנייר טישו ספוג ב-70% אלכוהול ולאפשר לו להתייבש באוויר. נגבו את הבקבוקים עם נייר טישו ספוג ב-70% אלכוהול לפני הוצאתם מה-BSC.
- העבירו בזהירות בקבוקים מארון הבטיחות הביולוגית למכשיר הטעינה.
- לחץ על לחצן הטעינה במערכת זיהוי מיקרוביאלית אוטומטית.
- סרוק את הברקודים על בקבוקי תרבית מכשירים והכנס את הבקבוקים לחממה של מערכת הגילוי בטמפרטורה של 37 מעלות צלזיוס למשך עד 42 יום. קרא והקלט את הזמן שנדרש כדי להגיע לחיוביות ממסך המכשיר.
הערה: הברקוד מאפשר למכשיר לזהות את הבקבוק ולקשר קריאות השתקפות עם בקבוק מסוים. - חשב את זמן האחוזים לחיוביות (TTP) על-ידי השוואת ה-TTP של האינוקולום התוך-תאי הראשוני (יום 0) לזה של מקרופאגים שגודלו בתרבית עבור הזמנים שצוינו. שינוי חיובי באחוז TTP פירושו צמיחה מיקובקטריאלית13.
לדוגמה, עבור היום השלישי:
אחוז השינוי בזמן לחיוביות =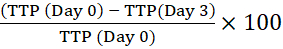
- יש לעקר את פקק הגומי של בקבוק תרבית המכשיר בנייר טישו ספוג ב-70% אלכוהול ולאפשר לו להתייבש באוויר.
Access restricted. Please log in or start a trial to view this content.
תוצאות
מכשיר התרבית הנוזלית האוטומטי ששימש במחקר זה מנטר רמות CO2 כל 10 דקות. שינוי צבע בחיישן בתחתית בקבוק המכשיר נמדד באופן צבעוני ומתבטא כיחידות רפלקציה. לאחר מכן, תוכנת המכשיר מיישמת אלגוריתמי זיהוי כדי לחשב את הזמן לחיוביות (TTP), כלומר את מספר הימים מהחיסון ועד שהתרביות מסומנות כחיוביות (<...
Access restricted. Please log in or start a trial to view this content.
Discussion
החוקרים השתמשו בשיטת התרבית הנוזלית המתוארת בפרוטוקול זה כדי לעקוב אחר צמיחת Mtb במקרופאגים שמקורם במונוציטים ובמקרופאגים אלוואולריים ובתאי THP-1 הממוינים ב-PMA11,16,17. טכניקה זו יכולה גם להיות שונה לשימוש עם תאים שאינם דבקים12. לא?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
עבודה זו מומנה על ידי קרן המדע של אירלנד (SFI 08/RFP/BMT1689), המועצה לחקר הבריאות באירלנד [HRA-POR/2012/4 ו-HRA-POR-2015-1145] וקרן בית החולים רויאל סיטי אוף דבלין.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| IX51 Fluorescent Microscope | Olympus, Japan | N/A | AFB detection and imaging |
| 2 mL microtube, flat bottom, screw cap, sterile | Sarstedt, North Carolina, USA | 72.694.006 | Mtb infection of macropahges |
| 5 mL syringe, Luer lock | BD Biosciences, San Jose, CA, USA | SZR-150-031K | Mtb infection of macropahges/CFU |
| 50 mL tube, sterile | Sarstedt, North Carolina, USA | 62.547.254 | Mtb infection of macropahges |
| all-trans-Retinoic Acid (ATRA) ≥98% (HPLC) | Sigma Aldrich, Missouri, USA | R2625 | Host directed therapy candidate |
| BacT/ALERT 3D Microbial Detection System | Biomerieux ( Hampshire, UK) | 247001 | Broth-based colormetric detection system |
| BACT/ALERT MP BACT/ALERT MP Nutrient Supplement | Biomerieux ( Hampshire, UK) | 414997 | Broth-based colormetric detection assay |
| BACT/ALERT MP culture bottles | Biomerieux ( Hampshire, UK) | 419744 | Broth-based colormetric detection assay |
| BD BBL Middlebrook ADC Enrichment, 20 mL | BD Biosciences, San Jose, CA, USA | M0553 | Mycobacterium liquid culture |
| BD BBL Middlebrook OADC Enrichment, 20mL | BD Biosciences, San Jose, CA, USA | M0678 | Colony Forming Units |
| Cell scraper, 25 cm | Sarstedt, North Carolina, USA | 83.1830 | Harvest of lmacrophage lysates |
| Corning Syringe Filter, 0.2 µm | Corning Incorporated, Germany | 431219 | Sterilization of lysis buffer |
| Cover glass (borosilicate), 24 x 50 mm, #1.5 thickness | VWR International Limited | 631 - 0147 | |
| Cycloheximide, from microbial | Sigma Aldrich, Missouri, USA | C7698 | Colony Forming Units |
| Dako Fluorescent Mounting Medium | Agilent Technologies Ireland Limited | S3023 | Antifade mounting medium |
| Dulbecco’s Phosphate Buffered Saline | Sigma Aldrich, Missouri, USA | D8537 | Mtb infection of macropahges |
| Fetal Bovine Serum, Gibco | Thermo Fisher, Massachusetts, USA | 10270106 | Macrophage cell culture |
| Glycerol, Difco | BD Biosciences, San Jose, CA, USA | 228220 | Colony Forming Units |
| Hoescht 33342 (bisBenzimide H 33342 trihydrochloride) | Sigma Aldrich, Missouri, USA | B2261 | Nuclear stain |
| IFNγ, recombinant human | R&D Systems Inc, Minnesota, USA | 285-IF | Host directed therapy candidate |
| Labtek 2-well chamber slide, sterile, Nunc | Thermo Fisher, Massachusetts, USA | TKT-210-150R | Mtb infection of macropahges |
| L-Asparagine, anhydrous | Sigma Aldrich, Missouri, USA | A4159 | Colony Forming Units |
| Linezolid | Sigma Aldrich, Missouri, USA | PZ0014 | Antibiotic |
| Microlance Hypodermic Needle 25 G | BD Biosciences, San Jose, CA, USA | 300400 | Mtb infection of macropahges/CFU |
| Middlebrook 7H10 Agar Base | BD Biosciences, San Jose, CA, USA | M0303 | Colony Forming Units |
| Middlebrook 7H9 Broth Base | BD Biosciences, San Jose, CA, USA | M0178 | Mycobacterium liquid culture |
| Modified Auramine O Stain and Decolourizer | Scientific Device Laboratory, IL, USA | 345-250 | AFB stain |
| Paraformaldehyde | Sigma Aldrich, Missouri, USA | 158127 | Mtb infection of macropahges |
| Petri dishes, 92 x 16mm (20/bag) | Sarstedt, North Carolina, USA | 82.1473.001 | Colony Forming Units |
| Phorbol 12-myristate 13-acetate (PMA) | Sigma Aldrich, Missouri, USA | P8139 | Macrophage cell culture |
| Polysorbate 80, Difco | BD Biosciences, San Jose, CA, USA | 231181 | Mycobacterium liquid culture |
| RPMI-1640, Gibco | Thermo Fisher, Massachusetts, USA | 52400025 | Macrophage cell culture |
| Sterile Cell Spreader, L-Shaped | Fisherbrand, Thermo Fisher, MA, USA | RB-44103 | Colony Forming Units |
| T25 TC flask, angled neck, filter cap, sterile, Nunc | Thermo Fisher, Massachusetts, USA | 156367 | Mycobacterium liquid culture |
| THP-1 cell line | ATCC, Virginia, USA | ATCC TIB-202 | Macrophage cell culture |
References
- WHO. Global Tuberculosis Report. World Health Organization. , Geneva. (2020).
- Russell, D. G. Mycobacterium tuberculosis and the intimate discourse of a chronic infection. Immunological Reviews. 240 (1), 252-268 (2011).
- Young, C., Walzl, G., Du Plessis, N. Therapeutic host-directed strategies to improve outcome in tuberculosis. Mucosal Immunology. 13 (2), 190-204 (2020).
- Angeby, K. A., et al. Evaluation of the BacT/ALERT 3D system for recovery and drug susceptibility testing of Mycobacterium tuberculosis. Clinical Microbiology and Infection. 9 (11), 1148-1152 (2003).
- Asmar, S., Drancourt, M. Rapid culture-based diagnosis of pulmonary tuberculosis in developed and developing countries. Frontiers in Microbiology. 6, 1184(2015).
- Diacon, A. H., et al. Time to liquid culture positivity can substitute for colony counting on agar plates in early bactericidal activity studies of antituberculosis agents. Clinical Microbiology and Infection. 18 (7), 711-717 (2012).
- Diacon, A. H., et al. Time to positivity in liquid culture predicts colony forming unit counts of Mycobacterium tuberculosis in sputum specimens. Tuberculosis. 94 (2), Edinburgh. 148-151 (2014).
- O'Sullivan, D. M., et al. Evaluation of liquid culture for quantitation of Mycobacterium tuberculosis in murine models. Vaccine. 25 (49), 8203-8205 (2007).
- Heinrichs, M., et al. Mycobacterium tuberculosis Strains H37ra and H37rv have equivalent minimum inhibitory concentrations to most antituberculosis drugs. International Journal of Mycobacteriology. 7 (2), 156-161 (2018).
- Sorrentino, F., et al. Development of an intracellular screen for new compounds able to inhibit mycobacterium tuberculosis growth in human macrophages. Antimicrobial Agents and Chemotherapy. 60 (1), 640-645 (2016).
- O'Leary, S. M., et al. Cigarette smoking impairs human pulmonary immunity to Mycobacterium tuberculosis. American Journal of Respiratory and Critical Care Medicine. 190 (12), 1430-1436 (2014).
- Ryan, R. C., O'Sullivan, M. P., Keane, J. Mycobacterium tuberculosis infection induces non-apoptotic cell death of human dendritic cells. BMC Microbiology. 11, 237(2011).
- Keane, J., Remold, H. G., Kornfeld, H. Virulent mycobacterium tuberculosis strains evade apoptosis of infected alveolar macrophages. The Journal of Immunology. 164 (4), 2016-2020 (2000).
- Gao, X. F., Yang, Z. W., Li, J. Adjunctive therapy with interferon-gamma for the treatment of pulmonary tuberculosis: a systematic review. International Journal of Infectious Diseases. 15 (9), 594-600 (2011).
- Thorpe, T. C., et al. BacT/Alert: an automated colorimetric microbial detection system. Journal of Clinical Microbiology. 28 (7), 1608-1612 (1990).
- Gleeson, L. E., et al. Cutting edge: Mycobacterium tuberculosis induces aerobic glycolysis in human alveolar macrophages that is required for control of intracellular bacillary replication. The Journal of Immunology. 196 (6), 2444-2449 (2016).
- O'Connor, G., et al. Inhalable poly(lactic-co-glycolic acid) (PLGA) microparticles encapsulating all-trans-Retinoic acid (ATRA) as a host-directed, adjunctive treatment for Mycobacterium tuberculosis infection. European Journal of Pharmaceutics and Biopharmaceutics. 134, 153-165 (2019).
- O'Connor, G., et al. Sharpening nature's tools for efficient tuberculosis control: A review of the potential role and development of host-directed therapies and strategies for targeted respiratory delivery. Advanced Drug Delivery Reviews. 102, 33-54 (2016).
- Rodriguez, D. C., Ocampo, M., Salazar, L. M., Patarroyo, M. A. Quantifying intracellular Mycobacterium tuberculosis: An essential issue for in vitro assays. Microbiologyopen. 7 (2), 00588(2018).
- Ortalo-Magne, A., et al. Molecular composition of the outermost capsular material of the tubercle bacillus. Microbiology. 141, Reading. Pt 7 1609-1620 (1995).
- Stokes, R. W., et al. The glycan-rich outer layer of the cell wall of Mycobacterium tuberculosis acts as an antiphagocytic capsule limiting the association of the bacterium with macrophages. Infection and Immunity. 72 (10), 5676-5686 (2004).
- O'Sullivan, M. P., O'Leary, S., Kelly, D. M., Keane, J. A caspase-independent pathway mediates macrophage cell death in response to Mycobacterium tuberculosis infection. Infection and Immunity. 75 (4), 1984-1993 (2007).
- Cheon, S. H., et al. Bactericidal activity in whole blood as a potential surrogate marker of immunity after vaccination against tuberculosis. Clinical and Diagnostic Laboratory Immunology. 9 (4), 901-907 (2002).
- Nathan, C., Barry, C. E. TB drug development: immunology at the table. Immunological Reviews. 264 (1), 308-318 (2015).
- Bowness, R., et al. The relationship between Mycobacterium tuberculosis MGIT time to positivity and cfu in sputum samples demonstrates changing bacterial phenotypes potentially reflecting the impact of chemotherapy on critical sub-populations. Journal of Antimicrobial Chemotherapy. 70 (2), 448-455 (2015).
- Basu Roy, R., et al. An auto-luminescent fluorescent BCG whole blood assay to enable evaluation of paediatric mycobacterial responses using minimal blood volumes. Frontiers in Pediatrics. 7, 151(2019).
- Christophe, T., et al. High content screening identifies decaprenyl-phosphoribose 2' epimerase as a target for intracellular antimycobacterial inhibitors. PLoS Pathogens. 5 (10), 1000645(2009).
- Franzblau, S. G., et al. Comprehensive analysis of methods used for the evaluation of compounds against Mycobacterium tuberculosis. Tuberculosis. 92 (6), Edinburgh. 453-488 (2012).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved