Method Article
ייצור יחידות מוטוריות אנושיות עם צמתים נוירו-שריריים פונקציונליים במכשירים מיקרופלואידיים
In This Article
Summary
אנו מתארים שיטה ליצירת יחידות מוטוריות אנושיות במכשירים מיקרופלואידיים זמינים מסחרית על ידי שיתוף פולחן נוירונים מוטוריים המושרה תאי גזע פלוריפוטנטים עם מיוטיובים ראשוניים אנושיים וכתוצאה מכך היווצרות של צמתים עצביים שריריים פעילים מבחינה תפקודית.
Abstract
צמתים עצביים-שריריים (NMJs) הם סינפסות מיוחדות בין האקסון של הנוירון המוטורי התחתון לבין השריר המקלה על מעורבות התכווצות השרירים. בהפרעות נוירון מוטוריות, כגון טרשת אמיוטרופית לרוחב (ALS) ניוון שרירי עמוד השדרה (SMA), NMJs להתנוון, וכתוצאה מכך ניוון שרירים ושיתוק פרוגרסיבי. המנגנון הבסיסי של ניוון NMJ אינו ידוע, בעיקר בשל היעדר מודלים מחקריים לתרגום. מחקר זה נועד ליצור מודל הפריה רב-תכליתי ושחזורי של יחידת מנוע אנושית עם NMJs פונקציונליים. לכן, תאי גזע פלוריפוטנטים המושרים על ידי האדם (hiPSC) נגזר נוירונים מוטוריים ומוזיאנגיובלסט ראשוני אנושי (MAB) שמקורם myotubes היו תרבית משותפת במכשירים מיקרופלואידיים זמינים מסחרית. השימוש בתאים זעירים מבודדים באופן נוזלי מאפשר תחזוקה של מיקרו-סביבה ספציפית לתא תוך מתן אפשרות למגע בין תא לתא באמצעות מיקרוגרובים. על ידי החלת שיפוע כימי ונפחי, הצמיחה של נוירונים מוטוריים-neurites באמצעות microgrooves קידום אינטראקציה myotube ואת היווצרות של NMJs היו מגורה. NMJs אלה זוהו אימונוציטוכימית באמצעות לוקליזציה משותפת של נוירון מוטורי סמן סינפטופיזין (SYP) וסמן קולטן אצטילכולין פוסט-סינפטי (AChR) α-בנגרוטוקסין (Btx) על מיוטיובים ומאופיין מורפולוגית באמצעות מיקרוסקופיית אלקטרונים סריקה (SEM). הפונקציונליות של NMJs אושרה על ידי מדידת תגובות סידן myotubes עם depolarization של הנוירונים המוטוריים. היחידה המוטורית שנוצרת באמצעות מכשירים מיקרופלואידיים סטנדרטיים וטכנולוגיית תאי גזע יכולה לסייע במחקר עתידי המתמקד ב- NMJs בבריאות ובמחלות.
Introduction
NMJs להקל על התקשורת בין נוירונים מוטורי עמוד השדרה התחתון סיבי שריר השלד באמצעות שחרור של נוירוטרנסמיטורים1. בהפרעות נוירון מוטוריות כמו ALS ו- SMA, NMJs מתנוונים, מה שגורם להפרעה בתקשורת עם השרירים2,3,4,5,6,7. התוצאה היא שחולים מאבדים בהדרגה את תפקוד השרירים שלהם, מה שגורם להם להיות קשורים לכיסא גלגלים ובסופו של דבר תלויים בתמיכה נשימתית עקב ניוון מתקדם של קבוצות שרירים חיוניות כמו הסרעפת. המנגנונים הבסיסיים המדויקים האחראים לאובדן העמוק הזה של NMJs בהפרעות אלה אינם ידועים. מחקרים רבים נעשו על מודלים של בעלי חיים מהונדסים, אשר נתן לנו כמה תובנות על הפתוגנזה של ניוון NMJ5,6,8,9,10,11. עם זאת, כדי להבין באופן מלא את הפתולוגיה ולנטרל את denervation, חשוב שתהיה מערכת אנושית, המאפשרת נגישות מלאה.
כאן, הפרוטוקול מתאר דרך פשוטה יחסית ליצור NMJs אנושי באמצעות פולחן משותף של נוירונים מוטוריים שמקורם hiPSC ומיוטיובים שמקורם MAB ראשוני אנושי באמצעות מכשירים מיקרופלואידיים זמינים מסחרית. השימוש במיקרופלואידיקה כדי לקוטב ולבודד באופן נוזלי את הסומסה והאקסונים של נוירונים ידוע מאז התיאור הראשון של תאי 'קמפנוט' 12 בסוף שנות השבעים. מאז, עיצובים מיקרופלואידיים נוספים מפוברקים, כולל אפשרויות מסחריות. ההתקנים המשמשים בפרוטוקול זה מכילים שני תאים, וכל תא מורכב משתי בארות המחוברות לערוץ13. שני התאים משוקפים ומחוברים למספר מיקרוגרובים. מיקרוגרובים אלה יש גודל המאפשר צמיחת נוריט תוך שמירה על בידוד נוזלי בין שני התאים באמצעות לחץ הידרוסטטי נימי13,14. באמצעות מערכת זו, ניתן לתרבות נוירונים מוטוריים בתא אחד ותאי שריר בתא השני, כל אחד במדיום התרבות הספציפי שלהם, תוך עדיין להקל על חיבור פיזי באמצעות neurites עובר דרך microgrooves ומעורבות עם תאי השריר. מודל זה מספק מערכת במבחנה נגישה ומותאמת לחלוטין של יחידה מוטורית אנושית, אשר ניתן להשתמש בה כדי ללמוד פתולוגיה NMJ מוקדם במחלות כמו ALS ו- SMA.
Protocol
הסכמה מדעת בכתב התקבלה מכל הנבדקים, שסיפקו את הדגימות שלהם לדור IPSC וקצירת MAB. ההליך אושר על ידי ועדת האתיקה הרפואית של בית החולים האוניברסיטאי לובן (n° S5732-ML11268) ועל ידי ועדת האתיקה המחקרית העיקרית של בריטניה כחלק מפרויקט StemBANCC. כל ריאגנטים וציוד המשמשים בפרוטוקול זה מפורטים בטבלת החומרים ויש להשתמש בהם סטריליים. יש לחמם את המדיה לטמפרטורת החדר (RT) לפני השימוש, אלא אם צוין אחרת. לקבלת סקירה כללית של פרוטוקול התרבות המשותפת, ראה איור 1.
1. הבחנה בין אבות נוירון מוטורי מ- IPSCs
- בצע את פרוטוקול בידול הנוירון המוטורי15, מותאם ממחקר קודם16, עד להגעה למצב 10 אבות עצביים (NPCs). על פי מסגרת הזמן של הפרוטוקול, הבידול הוא יזם ביום שני (יום 0), אשר תוצאות יום 10 NPCs ביום חמישי.
- Cryopreserve יום 10 NPCs בהחלפת סרום נוק-אאוט עם 10% דימתיל סולפוקסיד (DMSO) בצפיפות של 2 x 106- 4 x 106 תאים לכל ממתקין.
זהירות: DMSO רעיל: ידית במכסה אדים עם ציוד מגן אישי.
הערה: כ -50% מהיום 10 NPCs צפויים להיות חיוניים עם הפשרה. עצור את פרוטוקול בידול הנוירון המוטורי במצב זה 'יום 10 NPC' ו cryopreserveserv את NPCs כדי ליצור מספר רב של NPCs, אשר ניתן בנקאות ולהשתמש מאוחר יותר, הפחתת אורך ציר הזמן הכולל של פרוטוקול תרבות משותפת מ 28 ימים ל 19 ימים בסך הכל.
2. נגזרת ותחזוקה של MABs אנושי
הערה: MABs הם תאי גזע מזנכימליים הקשורים לכלי הדם, שבמקרה זה נקצרו מביופסיות שהתקבלו מתורם בריא בן 58. מקורות מסחריים חלופיים זמינים. הפרוטוקול להשגת MABs מוסבר בקצרה. לקבלת מידע נוסף, עיין בפרוטוקול המפורט17. יש לחמם את כל מדיית MAB ל-37 °C (70°F).
- טחון את רקמת הביופסיה ודגרה על קולגן (מעור עגל) מצופה 6 ס"מ מנות במדיום צמיחה (טבלה 1) במשך 2 שבועות. לשנות את המדיום כל 4 ימים.
- להכנת ציפוי קולגן, יש להמיס 100 מ"ג קולגן ב-20 מ"ל של חומצה אצטית 0.1 M. לקולגן לוקח זמן להתמוסס, אז הניחו את התערובת על משטח נדנדה למשך הלילה ב-RT. למחרת, למעלה עם 80 מ"ל של ddH2O לנפח סופי של 100 מ"ל.
זהירות: חומצה אצטית רעילה; ידית במכסה אדים עם ציוד מגן אישי.
הערה: קולגן מציפוי עור עגל ניתן לעשות שימוש חוזר עד פי 5. יש לאחסן ב-4 °C (75°F). - מצפים את כל פני השטח של המנה או את הבקבוק עם קולגן, לסגור ולדגירה במשך 20 דקות ב RT בתוך זרימת למינאר. לאחר 20 דקות, לשחזר את הקולגן במיכל טרי, לסגור את המנה הריקה / בקבוקון ולהשאיר במשך 10 דקות ב RT בזרימת למינאר.
- מעבירים את המנה/הבקבוקון לאינקובטור לדגירה למשך הלילה (או לפחות 6 שעות) (37 מעלות צלזיוס, 5% CO2). יש לשטוף 5x עם תמיסת מלח עם חוצץ פוספט של דולבק ללא סידן או מגנזיום (DPBS) לפני ציפוי תאים.
- להכנת ציפוי קולגן, יש להמיס 100 מ"ג קולגן ב-20 מ"ל של חומצה אצטית 0.1 M. לקולגן לוקח זמן להתמוסס, אז הניחו את התערובת על משטח נדנדה למשך הלילה ב-RT. למחרת, למעלה עם 80 מ"ל של ddH2O לנפח סופי של 100 מ"ל.
- לאחר 14 ימים, FACS (מיון תאים מופעלים פלואורסצנטית) למיין את MABs עבור פוספטאז אלקליין אנושי 17 ואחריו התרחבות נוספת. שמרו על ה-MABs על צלוחיות T75 מצופות קולגן במדיום הצמיחה ושנו את מדיום הצמיחה כל יומיים (10 מ"ל לבקבוקון).
- Cryopreserve, מעבר או זרע MABs במכשירים כאשר מגיעים למפגש של 70%.
הערה: MABs לאבד את הפוטנציאל המיוגניים שלהם עקב היתוך ספונטני על מגע בין תא לתא. הקפד לא לחרוג 70% מפגש בעת הרחבת MABs. בקבוק T75 אחד מכיל כ-600,000-800,000 תאים, אותם ניתן להקריע ב-100,000 תאים לכל בקבוקון. מאוחר יותר ניתן להפשיר כל בקבוקון ולזרוע בקבוקון T75 להרחבה. - כדי לעבור MABs, בעדינות לשטוף אותם פעם אחת עם 7 מ"ל של DPBS ולאחר מכן דגירה ב 7 מ"ל של פתרון ניתוק MAB במשך 3 דקות ב 37 °C ב 5% CO2 כדי לנתק את התאים.
- לנטרל את פתרון ניתוק MAB עם 7 מ"ל של מדיום הצמיחה, בעדינות לגרד את התאים, ולהעביר את ההשעיה התא לצינור צנטריפוגה 50 מ"ל. יש לשטוף בעדינות את הבקבוקון עם תוספת של 5 מ"ל של מדיום הצמיחה כדי לאסוף MABs שעשויים להישאר.
- צנטריפוגה מתלה התא במשך 3 דקות ב 300 x g, ולאחר מכן לעבור ישירות בקבוק T75 מצופה קולגן חדש להרחבה, cryopreserve בתחליפי סרום נוק-אאוט עם 10% DMSO או לספור לזרוע במכשיר microfluidic.
הערה: מעברים מבוצעים 1x-2x בשבוע להרחבת התא עד מספר מעבר מקסימלי של 13. לאחר הניתוק, MABs מופיעים כדוריים וגדולים בצורתם כאשר הם נבדקים מתחת למיקרוסקופ.
3. הכנת מכשירים מיקרופלואידיים שהורכבו מראש - יום 9
הערה: הפרוטוקול מותאם מפרוטוקול התקן הנוירון של יצרן המיקרופלואידים והותאם לשימוש בהתקני סיליקון שהורכבו מראש ובסיליקון. כאן, התקנים שהורכבו מראש משמשים לחיסון (ICC) ולהקלטות חולפות סידן של תאים חיים, בעוד התקני סיליקון משמשים עבור SEM. ציר הזמן של הפרוטוקול עוקב אחר ציר הזמן של פרוטוקול בידול הנוירון המוטורי.
- הכן את המכשירים microfluidic יום לפני זריעת תאים, כמו ציפוי צריך לדגור בן לילה. על פי פרוטוקול הנוירון המוטורי, זה יהיה יום רביעי. הוסיפו ~10 מ"ל של 70%-100% אתנול לצלחת פטרי 10 ס"מ. השתמש במלקחיים כדי להעביר את המכשיר מהמכולה לצלחת פטרי לעיקור.
- שקועים את המכשיר באתנול במשך 10 s ומעבירים את המכשיר עם מלקחיים לפיסת נייר לאוויר יבש בזרימת למינאר במשך ~ 30 דקות. הפוך את ההתקן מספר פעמים כדי לאפשר לשני הצדדים להתייבש. כאשר המכשיר יבש, השתמש במלקחיים כדי להעביר כל מכשיר לצלחת פטרי בודדת 10 ס"מ לטיפול קל
זהירות: אתנול רעיל; ידית במכסה אדים עם ציוד מגן אישי - יש לצפות את המכשיר בפולי-L-אורניתין (אש"ף) (100 מיקרוגרם/מ"ל) ב-DPBS ולדגירה ב-37 °C (5°F), 5% CO2 למשך 3 שעות.
- השתמש פיפטה P200 כדי להוסיף 100 μL של אש"ף ב- DPBS למעלה טוב כמו קרוב לפתיחת הערוץ ככל האפשר ולהתבונן בנוזל העובר מהבאר העליונה דרך הערוץ לבאר התחתונה. לאחר מכן, להוסיף 100 μL של אש"ף ב- DPBS לבאר התחתונה.
- חזור על הפעולה בצד השני של microgrooves ולסיים על ידי הוספת 100 μL בצד אחד של המכשיר כדי ליצור מעבר צבע נפח בין שני הצדדים שיקוף של המכשיר כדי לצפות את microgrooves (למשל, בצד ימין 200 μL, צד שמאל 300 μL). לאחר 3 שעות, לשטוף את המכשיר 3x במשך 5 דקות עם DPBS. השתמש במערכת יניקה במידת הצורך.
הערה: הקפד להימנע מכל היווצרות בועת אוויר בערוצים בכל נקודה במהלך ציפוי או פולחן של התאים. אפילו בועות קטנות יתרחבו תוך זמן קצר, ובכך יעכבו את הציפוי, זריעת התאים או זרימת המדיה ברחבי הערוץ. אם הנוזל נעצר בערוץ במהלך הציפוי, יש להזרים את פתרון אש"ף ישירות לערוץ משני הצדדים. אם בועות עדיין קיימות, השתמש 200 μL של DPBS כדי לשטוף את הערוץ ולחזור על תהליך הציפוי כאמור לעיל בשלבים 3.3.1-3.3.2. אם בועות מופיעות לאחר זריעת תאים, אי אפשר לשחזר את המכשיר, כמו ריקון הערוץ יפגע בתאים.
- יש לצפות את המכשיר עם למינין (20 מיקרוגרם/מ"ל) במדיום נוירו-בזל ולדגירה למשך הלילה ב-37 °C (5°F), 5% CO2. בצע את אותן הוראות לציפוי אש"ף החל מהשלבים 3.3.1-3.3.2.
- למחרת, להשתמש פיפטה P200 ולמקם את הקצה בבאר מול פתיחת הערוץ כדי להסיר את ציפוי למינין מן הבארות. הוסף DPBS לכל בארות ולהשאיר את המכשירים עם DPBS בזרימת למינאר ב RT עבור זריעת תאים.
הערה: מנקודה זו ואילך, חשוב לא להסיר נוזל (ציפוי למינין, DPBS, מדיה, פתרון קיבעון וכו ') ישירות מן הערוצים, כמו זה עלול לגרום להיווצרות בועת אוויר. בדוק תמיד את ההתקנים מתחת למיקרוסקופ לפני זריעת תאים.
4. הכנת מכשירים מיקרופלואידיים מסיליקון - יום 9
- הכן את המכשירים microfluidic סיליקון יום לפני זריעת תאים, כמו ציפוי צריך לדגור בן לילה. על פי פרוטוקול הנוירון המוטורי, זה יהיה יום רביעי.
- הוסיפו ~10 מ"ל של 70%-100% אתנול לצלחת פטרי 10 ס"מ. השתמש במלקחיים כדי להעביר את המכשיר מהמכל לצלחת פטרי לעיקור. שקועים את המכשיר באתנול במשך 10 s ומעבירים עם מלקחיים לבאר בצלחת 6-באר לאוויר יבש בזרימת למינאר במשך ~ 30 דקות. מקם את ההתקן על צידו כדי לאפשר לכל הצדדים להתייבש.
- חתוך את גליונות ה- SEM לגודל ההתקן (השאר כמה מ"מ בכל צד). חזור על העיקור כאמור לעיל בשלב 4.1.1. לאחר מכן, מעבירים עם מלקחיים לצלחת פטרי 10 ס"מ לייבוש. שניים-שלושה יריעות SEM יתאימו למנה אחת.
- יש לצפות את המכשירים ואת גליונות ה-SEM עם אש"ף (100 מיקרוגרם/מ"ל) ב-DPBS ולדגירה ב-37 °C (5°F), 5% CO2 למשך 3 שעות.
- הוסף 1 מ"ל של אש"ף ב- DPBS לבאר לכל מכשיר בלוח 6 הבאר. ודא שהמכשיר צף על גבי פתרון אש"ף עם צד הערוץ והמיקרוגרוב הפונה כלפי מטה אל הנוזל. הוסיפו 10 מ"ל של אש"ף בצלחת פטרי 10 ס"מ והשתמשו במלקחיים כדי לדחוף את יריעות ה-SEM לנוזל.
הערה: גליונות SEM יצופו בדרך כלל על גבי פתרון הציפוי. לפני הרכבת ההתקן ואת הגיליון, סובב את גיליון ה- SEM כך שהמשטח, שהיה במגע עם אש"ף, יצור קשר עם הערוץ ועל פני השטח של המיקרוגרוב של ההתקן. - לאחר 3 שעות, לשטוף את המכשיר ואת יריעות SEM 2x במשך 5 דקות עם DPBS ואחריו לשטוף שוב במשך 5 דקות עם מים סטריליים. השתמש במערכת יניקה במידת הצורך. מעבירים כל גיליון SEM לצלחת פטרי בודדת בגודל 10 ס"מ לטיפול קל.
הערה: שני המכשירים וגליונות SEM צריכים להיות יבשים לחלוטין לפני ההרכבה. השטיפה הסופית עם מים סטריליים מסירה גבישי מלח פוטנציאליים מה- DPBS, מה שעלול לעכב את ההרכבה.
- הוסף 1 מ"ל של אש"ף ב- DPBS לבאר לכל מכשיר בלוח 6 הבאר. ודא שהמכשיר צף על גבי פתרון אש"ף עם צד הערוץ והמיקרוגרוב הפונה כלפי מטה אל הנוזל. הוסיפו 10 מ"ל של אש"ף בצלחת פטרי 10 ס"מ והשתמשו במלקחיים כדי לדחוף את יריעות ה-SEM לנוזל.
- לעבוד תחת מיקרוסקופ בזרימת למינאר. השתמש במלקחיים כדי להרכיב את התקן הסיליקון עם צד הערוץ והמיקרוגרוב כלפי מטה בזווית של 90° על גיליון ה- SEM, מה שמבטיח שכל הצדדים מיושרים. לחץ קלות כלפי מטה על ההתקן כדי להקפיד לאטום לא רק את הקצוות החיצוניים אלא גם סביב בארות, ערוצים ומיקרוגרובים.
הערה: אזורים מלוכדים ייראו אפורים, ואילו אזורים שטרם הותקן יופיעו ברורים מתחת למיקרוסקופ. ודא כי כל האזורים אטומים היטב ללא בועות אוויר כדי למנוע ניתוק של המכשיר במהלך culturing. במקרה של פסולת או גבישי מלח החוסמים הרכבה, יש לשטוף מחדש הן את גיליון ה- SEM והן את ההתקן במים סטריליים ויבש לפני שתנסה שוב לבצע את הליך ההרכבה. אם המיקרוגרובים נראים מעוותים מלחיצה קשה מדי על ההתקן, הסר את ההתקן לחלוטין מגיליון ה- SEM ונסה שוב להרכיב. היזהר בעת ציפוי ושינוי מדיה לאחר טעינת ההתקן. - לעבוד תחת מיקרוסקופ בזרימת למינאר. יש לצפות את המכשיר עם למינין (20 מיקרוגרם/מ"ל) במדיום נוירו-בזל ולדגירה למשך הלילה ב-37 °C (5°F), 5% CO2.
הערה: דגירה לילית מקשה את מכשיר הסיליקון וחותמת אותו עוד יותר על גיליון SEM.- השתמש פיפטה P200 כדי להוסיף 100 μL של פתרון למינין למעלה טוב כמו קרוב לפתיחת הערוץ ככל האפשר ולהתבונן בנוזל העובר מהבאר העליונה דרך הערוץ לבאר התחתונה. בדוק אם יש דליפה סביב הבאר והתעל.
- לאחר מכן, להוסיף 100 μL של פתרון למינין לבאר התחתונה ולבדוק דליפה. חזור על הפעולה בצד השני של microgrooves ולסיים עם 100 μL נוסף בצד אחד של המכשיר כדי ליצור מעבר צבע נפח בין שני הצדדים שיקוף של המכשיר כדי לצפות את microgrooves (למשל, בצד ימין 200 μL, צד שמאל 300 μL).
הערה: במקרה של דליפה, להסיר את ציפוי למינין, לפרק את המכשיר ואת יריעות SEM ולשטוף את שניהם במים סטריליים. תן להם להתייבש ולחזור על הפעולה מהשלב 4.3 ואילך. - למחרת, להסיר את הציפוי מן הבארות עם פיפטה P200 על ידי מיקום הקצה בבאר מול פתיחת הערוץ. הוסף DPBS לכל בארות ולהשאיר את המכשירים עם DPBS בזרימת למינאר ב RT עבור זריעת תאים.
הערה: מנקודה זו ואילך, לא להסיר נוזל (ציפוי למינין, DPBS, מדיה, פתרון קיבוע, וכו ') ישירות מן הערוצים, כמו זה עלול לגרום להיווצרות בועת אוויר. בדוק תמיד את ההתקנים מתחת למיקרוסקופ לפני זריעת תאים.
5. ציפוי של NPCs במכשירים מיקרופלואידיים - יום 10
הערה: על פי פרוטוקול בידול נוירון מוטורי15, ציפוי של יום 10 NPCs מתרחש ביום חמישי.
- השתמש יום מנותק טרי 10 NPCs15, או להפשיר 1-2 בקבוקונים של NPCs הבנקאות לכל 10 מ"ל של יום 10 נוירון מוטורי בינוני (טבלה 2 ושולחן 3) עם מעכב ROCK (10 μL / mL) פתרון, וצנטריפוגה מתלה התא ב 100 x גרם במשך 4 דקות.
- resuspend גלולה התא ב 500-1000 μL של יום 10 נוירון מוטורי בינוני עם מעכב ROCK (10 μL / mL) פתרון ולספור את התאים החיים באמצעות כל שיטת ספירה מועדפת.
הערה: כפי שצוין להלן, הקפד להתאים מחדש את NPC לכמות הנכונה של מדיה כדי להתאים לאמצעי אחסון זריעה אופטימלי. - הסר DPBS משתי בארות בצד אחד של microgrooves במכשיר עם פיפטה P200 וזרע 250,000 NPCs לכל התקן ב 60-100 μL של יום 10 מדיה נוירון מוטורי.
- בחלק הימני העליון, זרע 30-50 μL של השעיית התא (125,000 תאים) קרוב לפתיחת הערוץ בזווית של 45° ולגרור את הנוזל הנותר בעדינות לאורך רצפת הבאר לכיוון מרכז הבאר עם קצה פיפטה.
- השהה למשך מספר שניות כדי לאפשר להשעיית התא לזרום דרך הערוץ לפני חזרה על כך בבאר התחתונה (125,000 תאים ב 30-50 μL). השתמש בעט כדי לסמן את הצד הזרע "NPC" או שווה ערך לכיוון קל של ההתקן ללא מיקרוסקופ.
- לדגור על המכשיר ב 37 °C (5 °C), 5% CO2 במשך 5 דקות כדי לאפשר חיבור לתא לפני ציפוי הבארות שני זרעים עם יום נוסף 10 בינוני נוירון מוטורי (סה"כ 200 μL / טוב) ודגורה שוב ב 37 °C (5%CO2.
הערה: כל באר יכולה להכיל 200 μL. זריעת תאים הן בבארות והן בערוצים מבטיחה מבנה חזק של התרבות, מה שמפחית את הסיכון לניתוק תאים במהלך שינויי מדיה. אפשר לזרוע פחות תאים רק בערוץ. עם זאת, פעולה זו תהפוך את התרבות לפגיעה יותר לאמצעי האחסון הנוכחי דרך הערוצים במהלך כל שינוי בינוני.
- השתמש בפיפטת P200 כדי להסיר DPBS משתי הבארות בצד השני של microgrooves מול NPCs זרע טרי. להוסיף 200 μL / well של יום 10 מדיה נוירון מוטורי ולחכות כמה שניות בין באר עליונה לתחתית כדי לאפשר למדיה לזרום דרך הערוץ. לאחר מכן, להוסיף 6 מ"ל של DPBS לכל צלחת 10 ס"מ סביב המכשיר כדי למנוע אידוי של המדיום במהלך הדגירה.
הערה: הוסף DPBS נוספים סביב ההתקן במהלך תקופת התרבות במידת הצורך. - בצע שינוי בינוני מלא של נוירון מוטורי בשני התאים של המכשיר ביום 11 (יום שישי), יום 14 (יום שני), ויום 16 (רביעי) (טבלה 2 ושולחן 3). הוסף תוספי מדיה טריים ביום השינוי הבינוני.
הערה: מנקודה זו ואילך, בצע את כל השינויים הבינוניים עם פיפטה P200. תמיד למקם את קצה pipette מן הערוץ בקצה הבאר ולא להסיר נוזל ישירות מן הערוץ. היזהר לא לנתק את התקני הסיליקון. הסרה והוספת אמצעי צריך להיעשות לאט כדי למנוע ניתוק תאים.- הסר בזהירות את כל המדיה בשתי הבארות עם NPCs על-ידי מיקום קצה הפיפטה P200 בקצה התחתון של קיר הבאר מול פתח הערוץ. לאט להוסיף 50-100 μL של נוירון מוטורי טרי בינוני לבאר העליונה על ידי מיקום קצה פיפטה P200 בקצה העליון של קיר הבאר מול פתיחת הערוץ.
- השהה לכמה שניות כדי לאפשר למדיום לזרום דרך הערוץ לפני הוספת 50-100 μL של נוירון מוטורי בינוני לבאר התחתונה. חזור על תהליך זה בזהירות עד ששתי בארות מכילות 200 μL / well. חזור על הפעולה בצד ללא תאים.
6. ציפוי של MAB במכשירים מיקרופלואידיים - יום 17
- כ-7 ימים לפני זריעת MABs במכשירים המיקרופלואידיים (היום העשירי של בידול הנוירונים המוטוריים), מפשירים את ה-MABs וזרעים אותם במדיום הצמיחה (טבלה 1) בבקבוק T75 מצופה קולגן כדי לאפשר הרחבה מספקת של התא. ראה סעיף 2.
- ביום 17 של בידול הנוירון המוטורי (יום חמישי), לנתק MABs כפי שהוסבר בשלב 2.4, resuspend גלולה התא ~ 500 μL של בינוני צמיחה ולספור את התאים החיים באמצעות כל שיטת ספירה מועדפת.
הערה: כפי שצוין להלן, הקפד לתתבן מחדש את ה- MABs לכמות המדיה הנכונה כדי להתאים לאמצעי הזריעה האופטימלי. - הסר את מדיום הנוירון המוטורי בצד הלא מנוצח של המיקרוגרובים במכשיר עם פיפטה P200, לשטוף בעדינות עם DPBS, ולזרוע 200,000 MABs למכשיר ב 60-100 μL של בינוני צמיחה.
- בחלק הימני העליון, זרע 30-50 μL של השעיית תא (100,000 תאים) קרוב לפתיחת הערוץ בזווית של 45° ולגרור את הנוזל הנותר בעדינות לאורך רצפת הבאר לכיוון מרכז הבאר עם קצה pipette. השהה למשך מספר שניות כדי לאפשר את זרימת התאים דרך הערוץ לפני החזרה בבאר התחתונה (100,000 תאים ב 30-50 μL).
- לדגור על המכשיר ב 37 °C ,5% CO2 במשך 5 דקות כדי לאפשר חיבור לתא לפני ציפוי שתי בארות זרעים MAB טרי עם מדיום צמיחה נוסף (סה"כ 200 μL / טוב). דגירה שוב ב 37 °C (5°F), 5% CO2.
הערה: אין צורך בשינוי בינוני ביום 17 בצד הנוירון המוטורי של המכשיר. יום 17 שינוי בינוני על פי שיטת בידול הנוירון המוטורי שפורסמה בעבר15 מבוצע במקום זאת ביום 18 (יום שישי).
7. יישום של שיפוע נפחי וכימוטקטי כדי לקדם את הצמיחה של נוירונים מוטוריים neurites לכיוון תא MAB
- ביום 18, לבצע שינוי בינוני מלא בצד הנוירון המוטורי עם יום 18 נוירון מוטורי בינוני (200 μL / well). בצע את ההוראות לשינויים בינוניים המוזכרים בשלבים 5.5.1-5.5.2. הפעל את בידול MAB בתא MAB של ההתקן (טבלה 2 וטבלה 4).
- יש לשטוף בזהירות את תאי ה- MAB פעם אחת עם DPBS לפני הוספת מדיום בידול MAB מחומם מראש (טבלה 4) בתוספת 0.01 מיקרוגרם / מ"ל של אגרין אנושי (200 μL / well).
הערה: MABs יהיה מיזוג וליצור myotubes רב-גרעיני במהלך הזמן של שבוע אחד.
- יש לשטוף בזהירות את תאי ה- MAB פעם אחת עם DPBS לפני הוספת מדיום בידול MAB מחומם מראש (טבלה 4) בתוספת 0.01 מיקרוגרם / מ"ל של אגרין אנושי (200 μL / well).
- ביום 21, על פי פרוטוקול בידול הנוירון המוטורי (יום שני), ליזום את שיפוע כימי נפחי (טבלה 2 ושולחן 3).
- הוסף 200 μL / well של מדיום תאי נוירון מוטורי עם 30 ננוגרם / מ"ל של גורם נוירוטרופי נגזר במוח (BDNF), גורם נוירוטרופי נגזר קו גליה (GDNF) וגורם נוירוטרופי ciliary (CNTF), אגרין אנושי (0.01 מיקרוגרם / מ"ל), למינין (20 מיקרוגרם / מ"ל) לתא myotube (שהוגדר בעבר כתא MAB). הוסף בינוני בזאלי נוירון מוטורי (100 μL / well) ללא גורמי גדילה לתא הנוירון המוטורי.
- חזור על שלב 7.2 בכל יום שני עד היום 28 של בידול הנוירון המוטורי. בסופי שבוע אין צורך בשינוי תקשורתי.
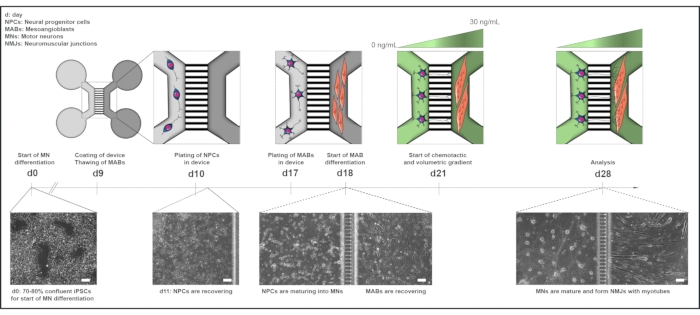
איור 1: סקירה סכמטית של פרוטוקול יחידת המנוע בהתקנים מיקרופלואידיים. ציר זמן בידול וסקירה של תרבות משותפת מיום 0 ליום 28 בהתאם לציר הזמן של פרוטוקול בידול הנוירונים המוטוריים22. הבחנה נוירון מוטורי מ iPSCs הוא יזם ביום 0 ומבוצע כאמור בעבר עבור 10 הימים הבאים15. ביום התשיעי, המכשיר מעוקר ומצפה באש"ף-למינין. MABs מופשרים להרחבה בבקבוקונים T75. ביום 10, הנוירון המוטורי-NPCs מצופים הן בבארות והן בערוץ של תא אחד (אפור בהיר) של המכשיר, שם ההבחנה שלהם לנוירונים מוטוריים נמשכת במשך שבוע. MABs מצופים הן בארות והן בערוץ של התא הנגדי (אפור כהה) ביום 17. ביום ה-18, החלה הבחנה בין MABs ל- myotubes. ביום 21, שיפוע נפחי וכימוטקאטי הוקם כדי לקדם קיטוב נוירון-נויריט מוטורי באמצעות microgrooves של המכשיר. תא הנוירונים המוטורי קיבל 100 μL / well של מדיום בזאלי נוירון מוטורי ללא גורמי גדילה (תא ירוק בהיר), בעוד תא myotube קיבל 200 μL / well של מדיום תאי נוירון מוטורי עם 30 ננוגרם / מ"ל של גורמי גדילה (תא ירוק כהה) (טבלה 2 ושולחן 3). התרבות ממשיכה בשיפוע נפחי וכימוטקטי במשך 7 ימים נוספים עד לניתוח ביום 28. תמונות של שדות בהירים מראות מורפולוגיה של תאים ביום 0, ביום ה-11, ביום ה-18 וביום ה-28 בתרביתות במכשירים מיקרופלואידיים שהורכבו מראש. מוט קנה מידה, 100 מיקרומטר. נתון זה שונה מסטוקלנד דיטלאו, ק. ואח' 18. איורים סלולריים שונו מתוך שרת חכם רפואי Art22. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
8. קיבעון ו-ICC
הערה: כל הצעדים צריכים להיעשות בזהירות כדי למנוע ניתוק של תרביות עצביות. אין להסיר נוזל מהערוצים בשלבים הבאים.
- ביצוע קיבעון במכסה אדים או בזרימת למינאר: יש לשטוף בזהירות את כל האורות בהתקן פעם אחת עם DPBS לפני הקיבעון. תיקון באמצעות 4 % paraformaldehyde (PFA) ב- DPBS במשך 15-20 דקות ב RT בזרימת למינאר (100 μL / well).
אזהרה: PFA רעיל: ידית במכסה אדים עם ציוד מגן אישי.- בזהירות להוסיף 100 μL לבאר העליונה של המכשיר ולחכות כמה שניות כדי לאפשר פתרון הקיבעון לזרום דרך הערוץ לפני הוספת 100 μL לבאר התחתונה. חזור על הפעולה בצד השני. לאחר הדגירה, להסיר פתרון PFA ולשטוף בעדינות 3x במשך 5 דקות עם DPBS. להשאיר 200 μL / גם DPBS לאחסון ולאטום את צלחת פטרי 10 ס"מ עם parafilm לאחסן ב 4 °C (70 °F) עד ניסוי ICC.
הערה: ודאו שההתקנים אינם מתייבשים במהלך האחסון.
- בזהירות להוסיף 100 μL לבאר העליונה של המכשיר ולחכות כמה שניות כדי לאפשר פתרון הקיבעון לזרום דרך הערוץ לפני הוספת 100 μL לבאר התחתונה. חזור על הפעולה בצד השני. לאחר הדגירה, להסיר פתרון PFA ולשטוף בעדינות 3x במשך 5 דקות עם DPBS. להשאיר 200 μL / גם DPBS לאחסון ולאטום את צלחת פטרי 10 ס"מ עם parafilm לאחסן ב 4 °C (70 °F) עד ניסוי ICC.
- לדגור על התאים עם פתרון permeabilization (100 μL / well) של 0.1% טריטון X-100 ב- DPBS במשך 20 דקות ב RT ביום 1 של הליך ICC. הסר את פתרון permeabilization, ולהוסיף 5% סרום חמור רגיל ב 0.1% טריטון X-100 / DPBS פתרון (100 μL / טוב) במשך 30 דקות ב RT.
- הסר את פתרון סרום החמורים הרגיל 5%, ודגירה התקנים עם נוגדנים ראשוניים (שולחן החומרים) בסרום חמור רגיל 2% ב 0.1% פתרון Triton X-100 /DPBS ודגרה ב 4 °C (5 °F) פתרון 0.1% Triton X-100 /DPBS ודגרה ב 4 °C (5 °F).
- יישום מעבר צבע של אמצעי אחסון. הוסף 100 μL / באר של פתרון נוגדנים בצד אחד של microgrooves ו 150 μL / גם בצד השני (500 μL סה"כ לכל מכשיר).
הערה: ניתן להשתמש בנוגדנים שונים משני צדי המיקרוגרובים. במקרה זה, אין ליישם שיפוע נפח עם נוגדנים ראשוניים או משניים על פני מיקרוגרובים כדי לקיים את הבידוד הנוזלי בין תאים. הנויריטים במיקרוגרובים לא יוכתמו ללא השיפוע.
- יישום מעבר צבע של אמצעי אחסון. הוסף 100 μL / באר של פתרון נוגדנים בצד אחד של microgrooves ו 150 μL / גם בצד השני (500 μL סה"כ לכל מכשיר).
- למחרת (יום 2 של הליך ICC), להסיר את הנוגדנים העיקריים ולשטוף בזהירות את המכשיר 3x במשך 5 דקות עם 0.1% טריטון X-100 / DPBS פתרון.
הערה: בתרבויות הניתנות להסרה בקלות, ניתן להחליף כביסה 3x למשך 5 דקות ב-1x למשך 30 דקות. - עבודה בחושך מעתה והלאה, כמו נוגדנים משניים (שולחן החומרים) הם רגישים לאור. תאי דגירה עם נוגדנים משניים בסרום חמור רגיל 2% בפתרון Triton X-100/DPBS 0.1% ל-1 שעות ב-RT. יש ליישם שיפוע נפח כאמור בשלב 8.3.1. לאחר הדגירה, להסיר את הנוגדנים המשניים לשטוף 3x במשך 5 דקות עם DPBS.
- תייג את ה- DNA הגרעיני עם DAPI ב- DPBS (100 μL/ well) למשך 20 דקות ב- RT ואחריו 3x-4x של 5 דקות כביסה עם פתרון Triton X-100/DPBS 0.1% . הסר את פתרון Triton X-100/DPBS 0.1% מכל בארות ותן לתרבות להתייבש למשך מספר שניות לפני הוספת טיפה אחת של מדיה תלויה פלואורסצנטית בכל באר לאטום.
הערה: שמור את ההתקנים אופקיים למשך 24 שעות לפחות כדי לאפשר להגדיר את מדיית ההרכבה. לאחר 24 שעות, ניתן לאחסן את ההתקנים במארז שקופיות ב- 4 °C (70 °F). - תמונה בערימות z עם מיקרוסקופ הפוך.
- כדי לדמיין NMJs, להשתמש במטרה 40x כדי לאתר את myotubes מסומן עם נוגדן myotube (שולחן החומרים) ולבצע הקלטות z-מחסנית כדי להבטיח הדמיה רקמה עצבית myotube. צמו תמונות מרובות למקרה שה-myotube גדול מדי כדי להתאים למסגרת אחת.
- לכימות NMJ, ספרו ידנית את מספר הלוקליזציה המשותפת בין סמן פרזינפטי עצבי לבין סמן AChR דרך כל ערימת z. נרמל את מספר לוקליזציה משותפת למספר myotubes הנוכחי בערימת z.
9. קיבעון והכנת המכשיר עבור SEM
הערה: בעת החלפת נוזלים, שמור תמיד כמות קטנה כדי לכסות את התרבות כדי למנוע קריסת תאים. פרוטוקול זה משתמש בחומרים רעילים מאוד, והוא נדרש לעבוד עם ציוד מגן אישי במכסה המנוע אדים במהלך כל התהליך.
- קיבוע ופירוק: הכינו 2.5% גלוטרלדהיד טרי (GA) במאגר נתרן קקודילט בנפח 0.1 מ' (pH 7.6), מסננים עם מסנן 0.2 מיקרומטר ומחממים עד 37 °C (50 °F).
זהירות: GA ונתרן קקודילאט רעילים: ידית במכסה אדים עם ציוד מגן אישי.- בזהירות לשטוף את המכשיר פעם אחת עם DPBS כדי להסיר את פסולת מדיה ותא ולאחר מכן קידומת עם פתרון GA במשך 15 דקות ב RT.
- השתמש באזמל כדי לחתוך בזהירות את גיליון ה- SEM להיקף ההתקן תוך ייצול ההתקן במלקחיים. הקפד לא לנתק את ההתקן בעת החיתוך. מעבירים את המכשיר ואת גיליון ה-SEM בעזרת מלקחיים לצלחת פטרי 3 ס"מ ומניחים את צלחת 3 ס"מ בצלחת 10 ס"מ לטיפול קל.
- לאחר 15 דקות של קידומת, הסר בזהירות את ההתקן מגיליון SEM באמצעות מלקחיים. נתק את ההתקן בפינה אחת והסר אותו באיטיות בכיוון אלכסוני לכיוון הפינה הנגדית. שים לב לתאים מתנתקים מההתקן.
- הוסף פתרון GA נוסף כדי לכסות את כל גיליון SEM בצלחת 3 ס"מ ולהמשיך קיבוע בסך הכל 2 שעות ב RT או לילה ב 4 °C (50 °F).
הערה: דחוף בעדינות את גיליון ה- SEM מתחת לתמיסת GA במלקחיים על-ידי הימנעות ממשטחים המכוסים בתא.
- המשך בפרוטוקול רגיל עבור SEM. בקצרה, דגירה ב osmium tetroxide ואחריו התייבשות עם סדרה מדורגת של אתנול. הכנס גיליון SEM למחזיק כיסוי לייבוש נקודות קריטיות והרכב על ספחי תמיכה עבור מדבקות פחמן וציפוי. השתמש במיקרוסקופ אלקטרונים סורק כדי לדמות במתח מואץ של 5 kV ומרחק עבודה של 7 מ"מ.
10. הערכת פונקציונליות NMJ באמצעות הדמיית סידן של תאים חיים
- הכן התקנים: רענן את תא myotube עם 200 μL / well של יום 18 מוטורי נוירון בזאלי מדיום עם 30 ננוגרם / מ"ל של BDNF, GDNF, ו- CNTF ואת תא הנוירון המוטורי עם 200 μL / well של מדיום בזאלי נוירון מוטורי ללא גורמי גדילה (טבלה 2 ושולחן 3).
- הוסף Fluo-4 AM צבע מדולל ממס צבע Fluo-4 לתא myoTube בריכוז הסופי של 5 מיקרומטר ודגורת המכשיר בחושך ב 37 °C (5°F), 5% CO2 במשך 25 דקות. בעוד המכשיר נמצא תחת דגירה, לדלל אשלגן כלורי במדיום בזאלי נוירון מוטורי ללא גורמי גדילה בריכוז הסופי של 450 mM.
הערה: Fluo-4 AM הוא אינדיקטור סידן, אשר מציג עלייה פלואורסצנטיות על כריכת סידן. תעבדו בחושך מעתה והלאה, מכיוון שהצבע רגיש לאור. - לאחר 25 דקות, לרענן את תא myotube עם 200 μL / well של יום 18 מוטורי נוירון בזאלי מדיום עם 30 ננוגרם / מ"ל של BDNF, GDNF, ו- CNTF ואת תא הנוירון המוטורי עם 100 μL / well של מדיום בזאלי נוירון מוטורי ללא גורמי גדילה כדי להקים מחדש את שיפוע כימי נפחי.
- כדי לחסום את NMJs, להשלים את בינוני תא myotube עם 19 מיקרומטר של AChR אנטגוניסט אנטגוניסט טובוקריני הידרוכלוריד פנטהידראט.
אזהרה: טובוקרין הידרוכלוריד פנטהידראט רעיל: ידית במכסה המנוע אדים עם ציוד מגן אישי.
- הוסף Fluo-4 AM צבע מדולל ממס צבע Fluo-4 לתא myoTube בריכוז הסופי של 5 מיקרומטר ודגורת המכשיר בחושך ב 37 °C (5°F), 5% CO2 במשך 25 דקות. בעוד המכשיר נמצא תחת דגירה, לדלל אשלגן כלורי במדיום בזאלי נוירון מוטורי ללא גורמי גדילה בריכוז הסופי של 450 mM.
- בצע הקלטות עם מיקרוסקופ קונפוקלי הפוך המצויד באינקובטור המותאם ל- 37 °C (5°F), 5% CO2.
- עם מטרה של פי 10, השתמש בערוץ השדה הבהיר כדי לאתר את myotubes בתא myotube. התאם את כוח הלייזר, השגה וקזז עבור ערוץ 488 לרמה שבה פלואורסצנטיות פלו-4 מסמנת את המיוטיוב הבודד.
הערה: תוצאות מייצגות נרכשו על ידי התאמת פסי הגלילה בהגדרות A1 של התוכנה להספק לייזר של 5%, רווח של 60 (HV) והקזזה של 0.
- עם מטרה של פי 10, השתמש בערוץ השדה הבהיר כדי לאתר את myotubes בתא myotube. התאם את כוח הלייזר, השגה וקזז עבור ערוץ 488 לרמה שבה פלואורסצנטיות פלו-4 מסמנת את המיוטיוב הבודד.
- הגדר את זמן ההקלטה לדקה אחת עם מרווחי זמן של 1 שניות. שיא עבור 5-10 s יש בסיס, ואחריו מיד מגרה נוירונים מוטוריים עם פתרון אשלגן כלורי.
- לאחר 5-10 s לתוך ההקלטה, לאט להוסיף 25 μL של פתרון אשלגן כלורי לבאר אחת של תא הנוירון המוטורי כדי להגיע לריכוז סופי של 50 mM.
הערה: הימנע הוספת פתרון אשלגן כלורי מהר מדי מאז זה ייצור גל דרך הערוץ, גרימת חפצים על ההקלטה.
- לאחר 5-10 s לתוך ההקלטה, לאט להוסיף 25 μL של פתרון אשלגן כלורי לבאר אחת של תא הנוירון המוטורי כדי להגיע לריכוז סופי של 50 mM.
- להקליט את תא myotube עם גירוי נוירון מוטורי פעמיים עם הפסקה של 2 דקות, ואחריו גירוי ישיר עם 25 μL אשלגן כלורי פתרון של תא myotube כדי להעריך פעילות myotube ישיר ללא תלות של נוירון מוטורי depolarisation.
- לכימותים, הקיפו כל מיוטיוב באופן ידני עם תוכנת ההקלטה וניתחו את עוצמת הפלואורסצנטית של Fluo-4 לאורך פרק הזמן של דקה אחת. כדי לקבוע את העלייה בזרם הסידן, הפחת את הערך הבסיסי הממוצע (כלומר, ממוצע מ-10 השניות הראשונות לפני גירוי האשלגן כלורי) מערך השיא לאחר גירוי עם אשלגן כלורי. התוצאות הייצוגיות נרכשו באמצעות כלי מדידת הזמן של התוכנה.
תוצאות
ייצור NMJs במכשירים מיקרופלואידיים
כדי ליצור יחידת מנוע אנושית עם NMJs פונקציונלי במכשירים מיקרופלואידיים זמינים מסחרית, נוירונים מוטוריים נגזר IPSC אנושי מיוטיוב אנושי שמקורו MAB שימשו. איכות החומר התא ההתחלתי חשובה, ובמיוחד יכולת ההיתוך של ה- MABs לתוך myotubes היא קריטית לתוצאה מוצלחת של פרוטוקול זה. MABs קל לשמור בתרבות. עם זאת, חשוב להעריך את יכולת ההיתוך של כל אצווה לפני החלתם על המכשירים המיקרופלואידיים (איור משלים 1A,B)18. כל אצוות, אשר אינם מראים היווצרות myotube לאחר 10 ימים של בידול, לא צריך לשמש. מדד ההיתוך באיור 1B המשלים נקבע על ידי חישוב אחוז הגרעינים בתוך myotubes חיובי עבור כל סמן myotube של המספר הכולל של גרעינים לכל תמונה. גילינו שמדד היתוך של כ-8% הספיק לתרבות המשותפת שלנו ביצירת NMJs.
זה תמיד חשוב להתחיל הבחנה נוירון מוטורי מתרבות טהורה של IPSCs. כמה שהקלט טהור יותר, כך התוצאה טהורה יותר. פרוטוקול בידול הנוירון המוטורי מייצר תרביות נוירונים מוטוריים, שהם בדרך כלל 85%-95% חיוביים עבור סמני נוירונים מוטוריים (איור משלים 1C,D)18. התאים הנותרים יהיו בדרך כלל תאים מבשרים לא מובחן, אשר במקרים מסוימים יעברו התפשטות נרחבת ובכך יש השפעה שלילית על איכות התרבות. כדי לקבל את התוצאה הטובה ביותר של פרוטוקול זה, יעילות בידול הנוירון המוטורי צריך להיות מוערך לפני החלת היום 10 נוירון מוטורי-NPCs לתוך המכשיר. בנוסף, בדיקת איכות NPC יכולה להתבצע ביום 11 כדי להעריך את הביטוי של סמן NPC אוליג2 (איור משלים 1E,F).
בתחילה, הנוירון המוטורי-NPCs וה- MABs היו מצופים באותה נקודת זמן ביום 10. כאן, בידול MAB החל ביום 11. שיפוע הנפח וגורמי הצמיחה המיושמים ביום ה -14 אפשר לנו להעריך את היווצרות NMJ ביום 21, ובכך לקצר את הפרוטוקול בשבוע אחד. מעניין, אנו יכולים לצפות היווצרות NMJ אופייני על ידי ICC (איור משלים 2A). עם זאת, לא הצלחנו להשיג פלט פונקציונלי באמצעות הקלטות סידן של תאים חיים בשלב מוקדם כל כך של בידול הנוירון המוטורי (נתונים לא הראו). הגענו למסקנה כי הנוירונים המוטוריים עדיין לא היו בוגרים מספיק כדי ליצור חיבורי NMJ פונקציונליים עם myotubes, למרות המורפולוגיה NMJ נראה מבטיח. זה עולה בקנה אחד עם התצפיות הקודמות שלנו כי פוטנציאל פעולה ספונטני נוירונים מוטוריים, שנרשם באמצעות ניתוח אלקטרופיזיולוגי מהדק תיקון, להתרחש רק ביום 35 של הבחנה נוירון מוטורי15.
בנוסף, ניסינו להאריך את ההבשלה של הנוירונים המוטוריים, כמו גם את הקיימות של התרבות המשותפת, על ידי התבגרות הנוירונים המוטוריים במכשיר במשך שבועיים (יום 24), לפני ציפוי ה- MABs. למרבה הצער, כמות גדולה של נוירון מוטורי ספונטני נויריט חוצה דרך microgrooves נצפתה, אשר הביא עיכוב של התקשרות MAB (איור 2B משלימה). בשל היעדר היווצרות מיוטיוב בערוץ, לא הצלחנו לזהות NMJs ביום 36 ולכן יישמנו את הפרוטוקול בן 28 הימים (איור 1).
זיהוי, כימות ואפיון מורפולוגי של NMJs במבחנה
לאחר ביצוע הפרוטוקול בן 28 הימים (איור 1), ניתן היה להשיג NMJs מתפקדים במלואם. הן ב- vivo והן במבחנה, NMJs מאופיינים אימונוהיסטו - או אימונוציטוכימיים באמצעות לוקליזציה משותפת של סמן פרסינפטי וסמן פוסט-סינפטי. במחקר זה, נעשה שימוש בשילוב של שרשרת כבדה neurofilament (NEFH) ו- SYP כשילוב סמן פרזינפטי, אשר אפשר את הבא של נויריט יחיד מן הסומה של הנוירון המוטורי לכיוון התהליך הדיסטלי ביותר. בצד השריר, Btx נמצא בשימוש נרחב כסמן פוסט-סינפטי עבור AChRs, והיה גם בשימוש במחקר זה. התוספת של אגרין למינין מקדמת את קיבוץ ה- AChRs בסרקולמה19,20,21, מה שמקל על זיהוי AChRs במבחנה וגם מגדיל את מספר ה- AChRs וה- NMJs הנוכחי18.
על מנת לאתר ולחשב את NMJs באופן לא משוחד, כל מיוטיוב מזוהה באמצעות שרשרת כבדה מיוסין (MyHC) חיוביות ומצולם בערימות z בהגדלה של פי 40 באמצעות מיקרוסקופ קונפוקלי הפוך. במשך זמן רב מאוד myotubes, ערימות z מרובות נרכשו. עבור ניתוח תמונה, מספר הה לוקליזציה המשותפת בין NEFH/SYP ל-Btx נספר באופן ידני דרך כל ערימת z, ומספר הה לוקליזציה המשותפת מנורמל למספר המיוטיובים הקיימים בערימת z (איור 2A-C)18. לא לכל מיוטיוב יהיו NMJs, כפי שניתן לראות במכמת מיוטיוב פנימי (איור 2D). כתוצאה מכך, חשוב לבצע גישת הקלטה משוחדת, שבה כל myotubes הם בתמונה, ללא תלות בנוכחות Btx.
ניתן לזהות שני סוגים של מורפולוגיות במערכת במבחנה זו. ה- NMJs מופיעים כנקודת מגע יחידה NMJs, שבה נויריט נוגע באשכול של AChRs בנקודת אינטראקציה אחת, או NMJs של נקודות מגע מרובות, שבהן נויריט יתפרס ויעסוק באשכול AChR על פני משטח גדול יותר. ניתן לזהות שתי מורפולוגיות אלה הן מבחינה חיסונית (איור 2A)18 והן עם SEM (איור 2B)18, וניתן לכמת אותן גם (איור 2C)18. בסך הכל, נקודות המגע המרובות מקלות על חיבור רחב יותר באמצעות הטמעת שרירים גדולה, המצביעה על היווצרות NMJ בוגרת יותר. לעומת זאת, נקודת המגע היחידה NMJs נחשבים פחות בוגרים בשל המצב ההתפתחותי המוקדם של התרבות.
הערכה פונקציונלית של NMJs במבחנה
כדי להעריך את הפונקציונליות של ה-NMJs, נעשה שימוש בהקלטות חולפות של סידן בתא חי (איור 3)18. תוך ניצול המערכת המבודדת הנוזלית של המכשירים המיקרופלואידיים, הצד הסומה של הנוירון המוטורי היה מגורה בריכוז גבוה (50 מ"מ) של אשלגן כלורי ובו זמנית רשם זרם של סידן במיאוטובים, שהיו עמוסים בצבע פלואו-4 הרגיש לסידן (איור 3A). כמעט מיד עם הפעלת הנוירון המוטורי, יכולנו לצפות בזרם סידן במיאוטובים באמצעות היווצרות גל אופיינית, המאשרת חיבור פונקציונלי דרך הנוירון המוטורי-נויריט והמיוטיוב (איור 3A-C)18. לא נצפו גלי סידן ספונטניים או התכווצויות מיוטיוב ספונטניות, אם כי נצפתה התכווצות myotube עם גירוי ישיר עם אשלגן כלורי נצפתה. הספציפיות של החיבור אושרה עוד יותר על ידי הוספת אנטגוניסט AChR תחרותי, הידרוכלוריד פנטהידרט טובוקריני (DTC) לתא myotube (איור 3A), אשר הביא לעיכוב של זרם סידן (איור 3C). השפעה זו אישרה כי הקשר בין נוירונים מוטוריים ו myotubes הביא NMJs פונקציונלי לחלוטין. כדי להעריך את מספר myotubes פעיל באמצעות גירוי NMJ, תא myotube היה מגורה ישירות עם אשלגן כלורי כדי לזהות את המספר הכולל של myotubes פעיל בתא זה. כ-70% מהמיוטיוב היו פעילים באמצעות הפעלה מגרה נוירונים מוטוריים עם אשלגן כלורי (איור 3D)18.
תוצאות אלה מאשרות את היווצרות NMJ האופטימלית, מספר, מורפולוגיה, ופונקציונליות באמצעות פולחן משותף של נוירונים מוטוריים נגזר IPSC ו myotubes נגזר MAB במהלך פרוטוקול 28 יום.
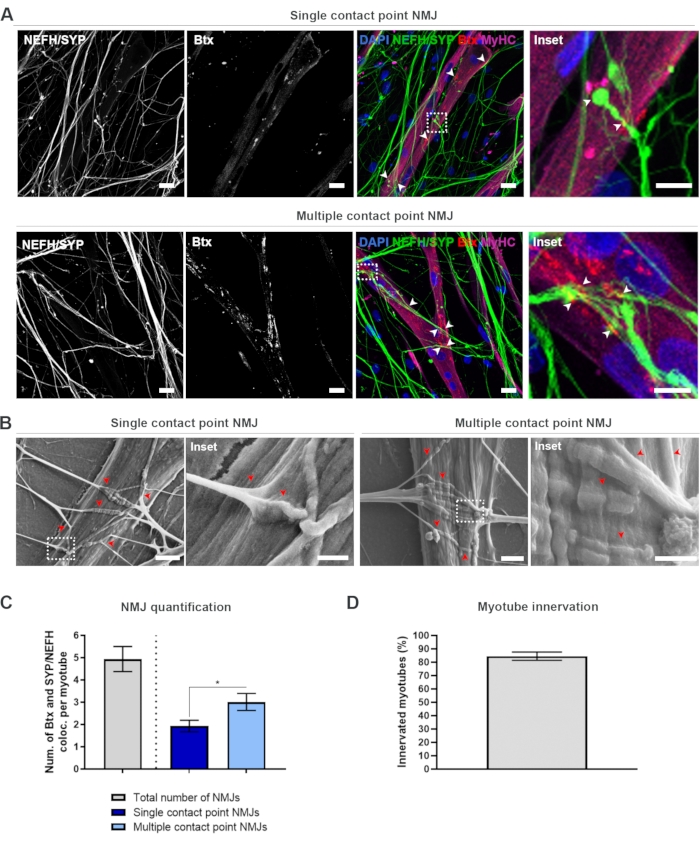
איור 2: היווצרות NMJ במכשירים מיקרופלואידיים. (A) מיקרוגרפים קונפוצליים של היווצרות NMJ במכשירים מיקרופלואידיים שהורכבו מראש ביום 28. NMJs מזוהים באמצעות לוקליזציה משותפת (ראשי חץ) של סמנים presynaptic (NEFH ו- SYP) וסמן AChR postsynaptic (Btx) על מיוטיובים מוכתמים MyHC. NMJs מזוהים מורפולוגית באמצעות היווצרות נקודת מגע אחת או מרובה בין נויטרים ואשכולות AChR. גרעיני תווית DAPI. סרגל קנה מידה, 25 מיקרומטר. Inset מציג הגדלה של NMJ. סרגל קנה מידה Inset, 10 מיקרומטר. (B) SEM של מורפולוגיה NMJ במכשירים מיקרופלואידיים סיליקון ביום 28. ראשי חץ מתארים הטמעת נויריט לתוך myotube. מוט קנה מידה, 2 מיקרומטר. Inset מציג הגדלה של NMJ. סרגל קנה מידה Inset, 1 מיקרומטר. (C) כימות של המספר הכולל של NMJs לכל myotube, כמו גם את מספר נקודות מגע בודדות ומספרים NMJs לכל myotube. גרף מוצג כממוצע ± שגיאה סטנדרטית של הממוצע מארבעה שכפולים ביולוגיים. משמעות סטטיסטית נקבעת במבחן מאן-ויטני עם * p < 0.05. (ד) כימות אחוז המיאוטובים הפנימיים. גרף מוצג כממוצע ± שגיאה סטנדרטית של הממוצע מארבעה שכפולים ביולוגיים. נתון זה שונה מסטוקלנד דיטלאו, ק. ואח' 18. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
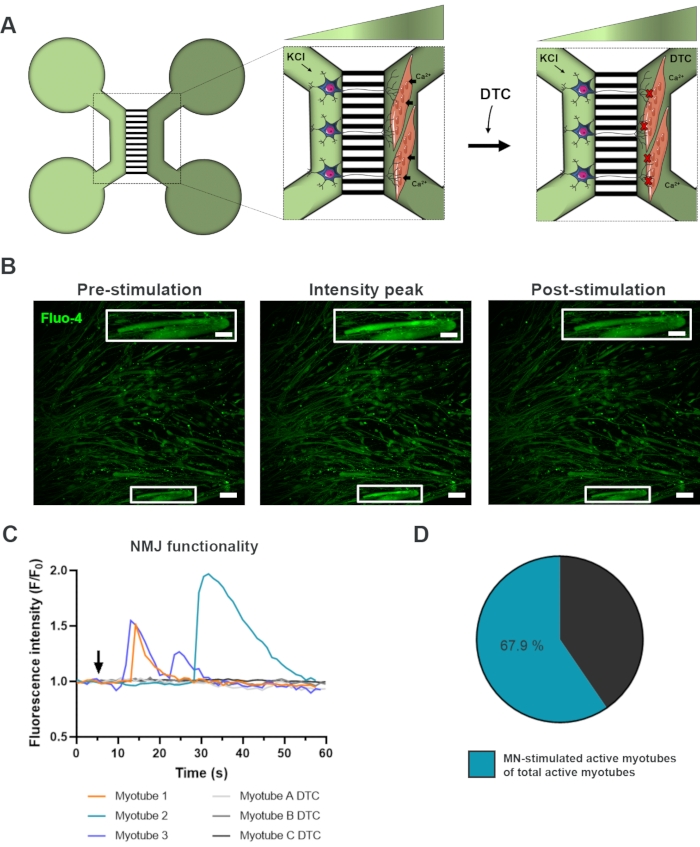
איור 3: אישור פונקציונליות NMJ. (א) איור סכמטי של הקלטות סידן חולפות של תאים חיים של פונקציונליות NMJ בהתקנים מיקרופלואידיים שהורכבו מראש ביום 28 לפני ואחרי חסימת NMJ עם טובוקרין (DTC)22. נוירונים מוטוריים בתא הירוק הבהיר מגורים עם 50 mM אשלגן כלורי (KCl), מה שגורם לתגובה תאית של נוירון מוטורי דרך הנוריטים. זה מעורר זרם של סידן (Ca2+) ב myotubes, אשר מסומנים עם צבע פלו-4 רגיש סידן (תא ירוק כהה). (B) מיקרוגרפים פלואורסצנטיים פלואו-4 של טרום גירוי, שיא אינטנסיביות ולאחר גירוי של myotube המתאר גל של עלייה סידן תאי על גירוי נוירון מוטורי עם KCl. Inset מראה הגדלה של myotube פעיל פנימי. מוטות קנה מידה, 100 מיקרומטר. סרגל קנה מידה Inset, 200 מיקרומטר. (C) עקומות זרם סידן נציגות myotubes לאחר גירוי נוירון מוטורי עם KCl (חץ) המאשר פונקציונליות NMJ. Myotube 1-3 להראות עקומות סידן אופייניות דרך נוירון מוטורי-myotube innervation, בעוד myotube A-C DTC מתאר עקומות לאחר חסימת NMJ עם DTC. (D) יחס של מיוטיוב פעיל מגורה נוירון מוטורי על המספר הכולל של myotubes פעיל. נתון זה שונה מסטוקלנד דיטלאו, ק. ואח' 18. איורים סלולריים שונו מתוך שרת חכם רפואי Art22. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
איור משלים 1: אימות נוירון מוטורי, מדד היתוך MAB ובקרת איכות NPC. (א) תמונות קונפוקליות של מיוטיוב שמקורן ב- MAB 10 ימים לאחר תחילת הבידול. מיוטיוב מסומנים עם סמני מיוטיוב: דסמין, MyHC, מיוגנין (MyoG) וטטין. גרעינים מוכתמים ב- DAPI. סרגל קנה מידה, 100 מיקרומטר. (B) כימות של מדד היתוך MAB 10 ימים לאחר תחילת בידול. עם הרעב, MABs מתמזגים למיוטיובים רב-גרעיניים, שהיו מכומתים עבור חיוביות סמן myotube (AB +). גרף מתאר שגיאה סטנדרטית ± של הממוצע משלושה שכפולים ביולוגיים. (C) תמונות קונפוקליות של נוירונים מוטוריים שמקורם ב- iPSC ביום 28 של בידול, המסומנים בסמני נוירון מוטורי NEFH, כולין אצטילטרנספראז (ChAT) ואי -1 בנוסף לסמן פאן-עצבי βII-טובולין (טובולין). גרעינים מוכתמים ב- DAPI. מוטות קנה מידה, 75 מיקרומטר. (D) כימות של מספר התאים, אשר חיוביים עבור נוירון מוטורי וסמנים פאן-עצביים (AB +). גרף מתאר שגיאה סטנדרטית ± של הממוצע משלושה שכפולים ביולוגיים. (ה) תמונות קונפוקליות של NPCs שמקורם ב- iPSC ביום 11 של בידול נוירונים מוטוריים, המסומנים עם סמן NPC אוליג2 וסמן פאן-עצבי βII-טובולין (טובולין). גרעינים מוכתמים ב- DAPI. מוטות קנה מידה, 50 מיקרומטר. (ו) כימות של מספר NPC, אשר חיוביים עבור אוליג2 ו βIII-טובולין (AB+). גרף מתאר שגיאה סטנדרטית ± של הממוצע משלושה שכפולים ביולוגיים. נתון זה שונה מסטוקלנד דיטלאו, ק. ואח' 18. נא לחץ כאן כדי להוריד קובץ זה.
איור משלים 2: אופטימיזציה של פרוטוקול תרבות משותפת (A) תמונות קונפוקליות של היווצרות NMJ ביום 21 של בידול נוירונים מוטוריים, כאשר MABs נזרעים באותה נקודת זמן כמו NPCs ביום 10. NMJs מזוהים באמצעות לוקליזציה משותפת (ראשי חץ) של סמנים presynaptic (NEFH ו- SYP) וסמן AChR postsynaptic (Btx) על מיוטיובים מוכתמים MyHC. סרגל קנה מידה (משמאל), 10 מיקרומטר. סרגל קנה מידה (מימין), 5 מיקרומטר. (B) תמונת שדה בהיר של ערוץ myotube ביום 24 המתארת מעבר נוירון-נויריט מוטורי ספונטני המעכב את ההתקשרות של MABs. סרגל קנה מידה, 100 מיקרומטר. אנא לחץ כאן כדי להוריד קובץ זה.
| מגיב | ריכוז מלאי | ריכוז סופי |
| IMDM | 1x | 80% |
| סרום בקר עוברי | 15% | |
| פניצילין/סטרפטומיצין | 5000 U/mL | 0.5% |
| ל-גלוטמין | 50x | 1% |
| נתרן פירובט | 100 מ"ר | 1% |
| חומצות אמינו לא חיוניות | 100x | 1% |
| אינסולין העברה סלניום | 100x | 1% |
| bFGF (נוסף טרי) | 50 מיקרוגרם/מ"ל | 5 ננוגרם/מ"ל |
טבלה 1: אמצעי צמיחה MAB. בינוני יכול להימשך 2 שבועות ב 4 °C .bFGF מתווסף טרי ביום השימוש.
| מגיב | ריכוז מלאי | ריכוז סופי |
| DMEM/F12 | 50% | |
| מדיום עצבי | 50% | |
| פניצילין/סטרפטומיצין | 5000 U/mL | 1% |
| ל-גלוטמין | 50x | 0.5 % |
| תוספת N-2 | 100x | 1% |
| B-27 ללא ויטמין A | 50x | 2% |
| β-מרקפטונול | 50 מ"ר | 0.1% |
| חומצה אסקורבית | 200 מיקרומטר | 0.5 מיקרומטר |
טבלה 2: מדיום בזאלי נוירון מוטורי. בינוני יכול להימשך 4 שבועות ב 4 °C (5 °F).
| יום | מגיב | ריכוז מלאי | ריכוז סופי | תא |
| יום 10/11 | אגוניסט חלקלק | 10 מ"ר | 500 ננומטר | הן |
| חומצה רטינואית | 1 מ"מ | 0.1 מיקרומטר | ||
| DAPT | 100 מ"ר | 10 מיקרומטר | ||
| BDNF | 0.1 מ"ג/מ"ל | 10 ננוגרם לונג/מ"ל | ||
| GDNF | 0.1 מ"ג/מ"ל | 10 ננוגרם לונג/מ"ל | ||
| יום 14 | DAPT | 100 מ"ר | 20 מיקרומטר | הן |
| BDNF | 0.1 מ"ג/מ"ל | 10 ננוגרם לונג/מ"ל | ||
| GDNF | 0.1 מ"ג/מ"ל | 10 ננוגרם לונג/מ"ל | ||
| יום 16 | DAPT | 100 מ"ר | 20 מיקרומטר | הן |
| BDNF | 0.1 מ"ג/מ"ל | 10 ננוגרם לונג/מ"ל | ||
| GDNF | 0.1 מ"ג/מ"ל | 10 ננוגרם לונג/מ"ל | ||
| CNTF | 0.1 מ"ג/מ"ל | 10 ננוגרם לונג/מ"ל | ||
| יום 18 | BDNF | 0.1 מ"ג/מ"ל | 10 ננוגרם לונג/מ"ל | נוירון מוטורי |
| GDNF | 0.1 מ"ג/מ"ל | 10 ננוגרם לונג/מ"ל | ||
| CNTF | 0.1 מ"ג/מ"ל | 10 ננוגרם לונג/מ"ל | ||
| יום 21+ | BDNF | 0.1 מ"ג/מ"ל | 30 ננוגרם/מ"ל | מיוטיוב |
| GDNF | 0.1 מ"ג/מ"ל | 30 ננוגרם/מ"ל | ||
| CNTF | 0.1 מ"ג/מ"ל | 30 ננוגרם/מ"ל | ||
| אגרין | 50 מיקרוגרם/מ"ל | 0,01 מיקרוגרם/מ"ל | ||
| למינין | 1 מ"ג/מ"ל | 20 מיקרוגרם/מ"ל | ||
| יום 21+ | אין תוספים | נוירון מוטורי |
טבלה 3: נוירון מוטורי תוספי מזון בינוני. תוספי מזון מתווספים טרי ביום השימוש למדיום בזאלי נוירון מוטורי.
| יום | מגיב | ריכוז מלאי | ריכוז סופי | תא |
| יום 18 | DMEM/F12 | 97% | MAB | |
| נתרן פירובט | 100 מ"ר | 1% | ||
| סרום סוס | 2% | |||
| אגרין | 50 מיקרוגרם/מ"ל | 0.01 מיקרוגרם/מ"ל |
טבלה 4: בינוני בידול MAB. בינוני יכול להימשך 2 שבועות ב 4 °C (5 °F). אגרין מתווסף טרי ביום השימוש.
Discussion
הפרוטוקול מתאר שיטה קלה יחסית לשימוש, המייצרת יחידות מוטוריות אנושיות עם NMJs פונקציונליים במכשירים מיקרופלואידיים זמינים מסחרית בפחות מ -30 יום. הוא מתואר כיצד ניתן להעריך את NMJs באופן מורפולוגי באמצעות טכניקות סטנדרטיות כגון ICC ו- SEM ופונקציונלית באמצעות הקלטות סידן של תאים חיים.
יתרון גדול של פרוטוקול זה הוא השימוש בטכנולוגיית תאי גזע. זה מאפשר הסתגלות מלאה שבה NMJs ניתן להעריך הן בריאות ומחלות, ללא תלות בפרופיל התורם. המודל הוכיח כבר מוצלח ומועיל במחקר ALS, שם זיהינו ליקויים במספרי נויריט, גידול מחדש ו- NMJ כפנוטיפים חדשניים עקב מוטציות בגן FUS18. עם מודל זה, ניתן להרחיב את המחקר כך שיכלול צורות ספורדיות של ALS, שם האטיולוגיה אינה ידועה, באמצעות IPSCs מחולים ALS ספורדיים. זה מספק יתרון על פני מודלים בעלי חיים מסורתיים, אשר מסתמכים על ביטוי יתר מהונדס של גנים מוטציה כדי recapitulate מחלות אנושיות23,24. בנוסף, המערכת האנושית המלאה שלנו מאפשרת recapitulation פוטנציאלי של פיזיולוגיה ומחלות ספציפיות לאדם. מחקרים קודמים הדגימו את ההבדלים בין מכרסם לבין מורפולוגיה אנושית NMJ25, אשר מציע כי יש ליישם זהירות בעת שימוש מכרסמים לטיפול בפתולוגיה NMJ אנושית. למרות שמערכת זו היא התקנה במבחנה פשוטה יחסית, אשר חסרה את המורכבות של מודל in vivo, ניתן היה להוכיח כי המורפולוגיה NMJ המוצגת במכשירים microfluidic דומה NMJs של קטיעה אנושית25. יתר על כן, מודל זה מאפשר הערכת NMJ במהלך היווצרות NMJ והתבגרות, פוטנציאל לחשוף פנוטיפים מחלה מוקדמת, אשר נעדרים, בלתי מזוהה, או התעלמו בדגימות שלאחר המוות אנושי.
MABs לספק אפשרות תקפה כדי ליצור myotubes, אם כי ההישרדות המוגבלת שלהם של 10 ימים היא חיסרון של המערכת. ההישרדות myotube מסתמך על החיבור שלהם אל פני השטח, אשר ככל הנראה נפגע על ידי התכווצויות ספונטניות של myofibers. לאחר יותר מעשרה ימים, רוב המיוטיובים יתנתקו, מה שהופך את תרבות NMJ לבלתי שמיש. באופן אידיאלי, myotubes ייווצרו iPSCs גם כן. עם זאת, הפרוטוקולים הנוכחיים הוכחו כקשים לשחזור26 בשל שונות במדד ההיתוך27,28,29,30.
באמצעות מכשירים מיקרופלואידיים זמינים מסחרית, יצרנו מערכת סטנדרטית, אשר נגישה באופן מלא. דגמי NMJ אחרים קיימים31,32,33,34,35,36,37,38,39,40,41,42. עם זאת, הם מסתמכים בדרך כלל על תאים בודדים, אשר חסרים מידור ובידוד נוזלי בין סוגי תאים, או על כלי תרבות בהתאמה אישית, אשר מוריד את הזמינות ואולי גם את הרבייה. ניתן לרכוש את המכשירים המיקרופלואידיים המשמשים לפרוטוקול זה עם מיקרוגרובים באורכים שונים, המאפשרים ניתוח נוסף כגון הובלה אקסונית43,44 או אקסוטומיה18,45,46 חקירות. הבידוד הנוזלי בין התאים מאפשר עוד יותר טיפול תרופתי ממודר של נוירונים מוטוריים או מיוטיוב, אשר יכול להיות חיובי בפיתוח הטיפול. חברות נוספות המתמחות במיקרופלואידיקה צמחו, שנפתחו למבחר גדול של עיצוב ותכונות של מכשירים, מה שמקדם עוד יותר את הנגישות למחקר במבחנה.
לסיכום, פיתחנו פרוטוקול המספק שיטה אמינה, רב-תכליתית וקלה לתרבות יחידות מוטוריות אנושיות עם NMJs פונקציונליים.
Disclosures
L.V.D.B. יש פטנט על השימוש מעכבי HDAC במחלת Charcot-Marie-שן (US-2013227717-A1), הוא מייסד שותף מדעי של אוגוסטין Therapeutics, וחבר בוועדה המדעית המייעצת שלה. המחברים האחרים מצהירים שאין אינטרסים מתחרים.
Acknowledgements
המחברים מודים ניקי קורתאוט וסבסטיאן Munck מ LiMoNe, קבוצת מחקר נוירוביולוגיה מולקולרית (VIB-KU Leuven) על עצתם על הקלטות פלואורסצנטיות חולפת סידן תאים חיים. מחקר זה נתמך על ידי ועדת פולברייט לבלגיה ולוקסמבורג, KU Leuven (C1 וקרן "פתיחת העתיד"), VIB, הסוכנות לחדשנות על ידי מדע וטכנולוגיה (IWT; SBO-iPSCAF), "הקרן למחקר מדעי פלנדריה" (FWO-Vlaanderen), TARGET ALS, ה-ALS Liga België (תרופה ל- ALS), ממשלת בלגיה (תוכנית פולנים משיכה בין-אוניברסיטאית P7/16 ביוזמת משרד מדיניות המדע הפדרלי בבלגיה), קרן תיירי לטרון ו"האגודה Belge contre les Maladies neuro-Musculaires" (ABMM). T.V. ו J.B. נתמכים על ידי מלגות Ph.D. שהוענקו על ידי FWO-Vlaanderen.
Materials
| Name | Company | Catalog Number | Comments |
| α-bungarotoxin (Btx) Alexa fluor 555 | Thermo Fisher Scientific | B35451 | Antibody (1:1000) |
| Acetic Acid | CHEM-Lab NV | CL00.0116.1000 | Coating component. H226, H314. P280 |
| Aclar 33C sheet (SEM sheet) | Electron Microscopy Sciences | 50425-25 | Thickness: 7.8 mil |
| Agrin (recombinant human protein) | R&D systems | 6624-AG-050 | Media supplement |
| Alexa fluor IgG (H+L) 488 donkey-anti rabbit | Thermo Fisher Scientific | A21206 | Antibody (1:1000) |
| Alexa fluor IgG (H+L) 555 donkey-anti goat | Thermo Fisher Scientific | A21432 | Antibody (1:1000) |
| Alexa fluor IgG (H+L) 555 donkey-anti mouse | Thermo Fisher Scientific | A31570 | Antibody (1:1000) |
| Alexa fluor IgG (H+L) 647 donkey-anti mouse | Thermo Fisher Scientific | A31571 | Antibody (1:1000) |
| Ascorbic acid | Sigma | A4403 | Media component |
| βIII-tubulin (Tubulin) | Abcam | ab7751 | Antibody (1:500) |
| β-mercaptoethanol | Thermo Fisher Scientific | 31350010 | Media component. H317. P280. |
| B-27 without vitamin A | Thermo Fisher Scientific | 12587-010 | Media component |
| BDNF (brain-derived neurotrophic factor) | Peprotech | 450-02B | Growth factor |
| bFGF (recombinant human basic fibroblast growth factor) | Peprotech | 100-18B | Growth factor |
| Choline acetyltransferase (ChAT) | Millipore | ab144P | Antibody (1:500) |
| Collagen from calfskin | Thermo Fisher Scientific | 17104019 | Coating component |
| CNTF (ciliary neurotrophic factor) | Peprotech | 450-13B | Growth factor |
| DAPI Nucblue Live Cell Stain ReadyProbes reagent | Thermo Fisher Scientific | R37605 | Immunocytochemistry component |
| DAPT | Tocris Bioscience | 2634 | Media supplement |
| Desmin | Abcam | Ab15200 | Antibody (1:200) |
| DMEM/F12 | Thermo Fisher Scientific | 11330032 | Media component |
| DMSO | Sigma | D2650-100ML | Cryopreservation component. H315, H319, H335. P280. |
| Dulbecco's phosphate-buffered saline (DPBS) | Thermo Fisher Scientific | 14190250 | no calcium, no magnesium |
| Ethanol | VWR | 20.821.296 | Sterilization. H225. P280 |
| Fetal bovine serum | Thermo Fisher Scientific | 10270106 | Media component |
| Fluo-4 AM live cell dye | Thermo Fisher Scientific | F14201 | Calcium imaging dye |
| Fluorescence Mounting Medium | Dako | S3023 | Immunocytochemistry component |
| GDNF (glial cell line-derived neurotrophic factor) | Peprotech | 450-10B | Growth factor |
| Glutaraldehyde | Agar Scientific | R1020 | Fixation component. EUH071, H301, H314, H317, H330, H334, H410. P280. |
| Horse serum | Thermo Fisher Scientific | 16050122 | Media component |
| Human alkaline phosphatase | R&D systems | MAB1448 | Antibody |
| ImageJ software | NIH | ICC analysis | |
| IMDM | Thermo Fisher Scientific | 12440053 | Media component |
| Insulin transferrin selenium | Thermo Fisher Scientific | 41400045 | Media component |
| Islet-1 | Millipore | ab4326 | Antibody (1:400) |
| Knockout serum replacement | Thermo Fisher Scientific | 10828-028 | Cryopreservation component |
| Laminin from Engelbreth-Holm-Swarm murine sarcoma basement membrane | Sigma | L2020-1MG | Coating component and media supplement |
| Leica SP8 DMI8 confocal microscope | Leica | ICC confocal microscopy | |
| L-glutamine | Thermo Fisher Scientific | 25030-024 | Media component |
| Myogenin (MyoG) | Abcam | Ab124800 | Antibody (1:500) |
| Myosin heavy chain (MyHC) | In-house, SCIL | Antibody (1:20) | |
| N-2 supplement | Thermo Fisher Scientific | 17502-048 | Media component |
| Neurobasal medium | Thermo Fisher Scientific | 21103049 | Coating and media component |
| Neurofilament heavy chain (NEFH) | Abcam | AB8135 | Antibody (1:1000) |
| Nikon A1R confocal microscope | Nikon | Live-cell calcium imaging microscopy | |
| NIS-Elements AR 4.30.02 software | Nikon | Live-cell calcium imaging analysis | |
| Non-essential amino acids | Thermo Fisher Scientific | 11140050 | Media component |
| Normal donkey serum | Sigma | D9663-10ML | Immunocytochemistry component |
| Olig2 | IBL | 18953 | Antibody (1:1000) |
| Parafilm M | Sigma | P7793-1EA | Storing equipment |
| Paraformaldehyde | Thermo Fisher Scientific | 28908 | Fixation component. H302, H312, H315, H317, H319, H332, H335, H341, H350. P280. |
| Penicillin/Streptomycin (5000 U/mL) | Thermo Fisher Scientific | 15070063 | Media component |
| Petri dish (3 cm) | nunc | 153066 | Diameter: 3 cm |
| Petri dish (10 cm) | Sarstedt | 833.902 | Diameter: 10 cm |
| Plate (6-well) | Cellstar Greiner bio-one | 657160 | Culture plate |
| Pluronic F-127 | Thermo Fisher Scientific | P3000MP | Fluo-4 dye solvent |
| Poly-L-ornithine (PLO) | Sigma | P3655-100MG | Coating component |
| Potassium chloride | CHEM-Lab NV | CL00.1133.1000 | Calcium imaging reagent |
| Retinoic acid | Sigma | R2625 | Media supplement. H302, H315, H360FD, H410. P280. |
| RevitaCell supplement | Thermo Fisher Scientific | A2644501 | ROCK inhibitor solution |
| Smoothened agonist | Merch Millipore | 566660 | Media supplement |
| Sodium cacodylate buffer | Sigma | C0250 | Fixation component. H301, H331, H350, H410. P280. |
| Sodium pyruvate | Life Technologies | 11360-070 | Media component |
| Synaptophysin (SYP) | Cell Signaling | 5461S | Antibody (1:1000) |
| T75 flask | Sigma | CLS3276 | Culture plate |
| Titin | Developmental Studies Hybridoma Bank | 9D10 | Antibody (1:300) |
| Triton X-100 | Sigma | T8787-250ML | Immunocytochemistry component. H302, H315, H318, H319, H410, H411. P280 |
| TrypLE express | Thermo Fisher Scientific | 12605010 | MAB dissociation solution |
| Tubocyrarine hydrochloride pentahydrate | Sigma | T2379-100G | Acetylcholine receptor blocker. H301. P280. |
| XonaChips pre-assembled microfluidic device | Xona Microfluidics | XC150 | Microgroove length: 150 μm |
| Xona Silicone microfluidics device | Xona Microfluidics | SND75 | Microgroove length: 75 μm |
References
- Plomp, J. J. Neuromuscular junction physiology and pathophysiology. Myasthenia Gravis and Related Disorders. Kaminski, H. J., Kusner, L. L. , Springer International Publishing. 1-12 (2018).
- Dadon-Nachum, M., Melamed, E., Offen, D. The 'dying-back' phenomenon of motor neurons in ALS. Journal of Molecular Neuroscience. 43 (3), 470-477 (2010).
- Murray, L. M., Talbot, K., Gillingwater, T. H. Neuromuscular synaptic vulnerability in motor neuron disease: Amyotrophic lateral sclerosis and spinal muscular atrophy. Neuropathology and Applied Neurobiology. 36 (2), 133-156 (2010).
- Rowland, L. P., Shneider, N. A. Amyotrophic lateral sclerosis. The New England Journal of Medicine. 344 (22), 1688-1700 (2001).
- Fischer, L. R., et al. Amyotrophic lateral sclerosis is a distal axonopathy: Evidence in mice and man. Experimental Neurology. 185 (2), 232-240 (2004).
- Martineau, É, Di Polo, A., Van de Velde, C., Robitaille, R. Dynamic neuromuscular remodeling precedes motor-unit loss in a mouse model of ALS. eLife. 7, 41973(2018).
- Sleigh, J. N., Gillingwater, T. H., Talbot, K. The contribution of mouse models to understanding the pathogenesis of spinal muscular atrophy. Disease Models and Mechanisms. 4 (4), 457-467 (2011).
- Nair, G., et al. Diffusion tensor imaging reveals regional differences in the cervical spinal cord in amyotrophic lateral sclerosis. NeuroImage. 53 (2), 576-583 (2010).
- So, E., et al. Mitochondrial abnormalities and disruption of the neuromuscular junction precede the clinical phenotype and motor neuron loss in hFUSWT transgenic mice. Human Molecular Genetics. 27 (3), 463-474 (2018).
- Tallon, C., Russell, K. A., Sakhalkar, S., Andrapallayal, N., Farah, M. H. Length-dependent axo-terminal degeneration at the neuromuscular synapses of type II muscle in SOD1 mice. Neuroscience. 312, 179-189 (2016).
- Walker, A. K., et al. Functional recovery in new mouse models of ALS/FTLD after clearance of pathological cytoplasmic TDP-43. Acta Neuropathologica. 130 (5), 643-660 (2015).
- Campenot, R. B. Local control of neurite development by nerve growth factor. Proceedings of the National Academy of Sciences of the United States of America. 74 (10), 4516-4519 (1977).
- Taylor, A. M., et al. A microfluidic culture platform for CNS axonal injury, regeneration and transport. Nature Methods. 2 (8), 599-605 (2005).
- Taylor, A. M., et al. Microfluidic multicompartment device for neuroscience research. Langmuir. 19 (5), 1551-1556 (2003).
- Guo, W., et al. HDAC6 inhibition reverses axonal transport defects in motor neurons derived from FUS-ALS patients. Nature Communications. 8 (1), 861(2017).
- Maury, Y., et al. Combinatorial analysis of developmental cues efficiently converts human pluripotent stem cells into multiple neuronal subtypes. Nature Biotechnology. 33 (1), 89-96 (2014).
- Giacomazzi, G., et al. Isolation of mesoangioblasts: A subset of pericytes with myogenic potential. Pericytes: Methods and Protocols. Péault, B. M. , Springer, US. 155-167 (2021).
- Stoklund Dittlau, K., et al. Human motor units in microfluidic devices are impaired by FUS mutations and improved by HDAC6 inhibition. Stem Cell Reports. , (2021).
- Afshar Bakooshli, M., et al. A 3D culture model of innervated human skeletal muscle enables studies of the adult neuromuscular junction. eLife. 8, 44530(2019).
- Burkin, D. J., Kim, J. E., Gu, M., Kaufman, S. J. Laminin and alpha 7 beta 1 integrin regulate agrin-induced clustering of acetylcholine receptors. Journal of Cell Science. 113 (16), 2877-2886 (2000).
- Zhang, B. G. X., et al. Combination of agrin and laminin increase acetylcholine receptor clustering and enhance functional neuromuscular junction formation In vitro. Developmental Neurobiology. 76 (5), 551-565 (2016).
- Smart Servier Medical Art. , Available from: https://smart.servier.com/ (2021).
- Morrice, J. R., Gregory-Evans, C. Y., Shaw, C. A. Animal models of amyotrophic lateral sclerosis: A comparison of model validity. Neural Regeneration Research. 13 (12), 2050-2054 (2018).
- Greek, R., Hansen, L. A. Questions regarding the predictive value of one evolved complex adaptive system for a second: Exemplified by the SOD1 mouse. Progress in Biophysics and Molecular Biology. 113 (2), 231-253 (2013).
- Jones, R. A., et al. Cellular and Molecular Anatomy of the Human Neuromuscular Junction. Cell Reports. 21 (9), 2348-2356 (2017).
- Jiwlawat, N., Lynch, E., Jeffrey, J., Van Dyke, J. M., Suzuki, M. Current progress and challenges for skeletal muscle differentiation from human pluripotent stem cells using transgene-free approaches. Stem Cells International. , 6241681(2018).
- Chal, J., et al. Generation of human muscle fibers and satellite-like cells from human pluripotent stem cells in vitro. Nature Protocols. 11 (10), 1833-1850 (2016).
- vander Wal, E., et al. Large-scale expansion of human iPSC-derived skeletal muscle cells for disease modeling and cell-based therapeutic strategies. Stem Cell Reports. 10 (6), 1975-1990 (2018).
- Choi, I. Y., et al. Concordant but varied phenotypes among duchenne muscular dystrophy patient-specific myoblasts derived using a human iPSC-based model. Cell Reports. 15 (10), 2301-2312 (2016).
- Choi, I. Y., Lim, H. T., Che, Y. H., Lee, G., Kim, Y. J. Inhibition of the combinatorial signaling of transforming growth factor-beta and NOTCH promotes myotube formation progenitor cells. Cells. 10 (7), 1649(2021).
- Demestre, M., et al. Formation and characterisation of neuromuscular junctions between hiPSC derived motoneurons and myotubes. Stem Cell Research. 15 (2), 328-336 (2015).
- Guo, X., Gonzalez, M., Stancescu, M., Vandenburgh, H. H., Hickman, J. J. Neuromuscular junction formation between human stem cell-derived motoneurons and human skeletal muscle in a defined system. Biomaterials. 32 (36), 9602-9611 (2011).
- Zahavi, E. E., et al. A compartmentalized microfluidic neuromuscular co-culture system reveals spatial aspects of GDNF functions. Journal of Cell Science. 128 (6), 1241-1252 (2015).
- Vila, O. F., et al. Quantification of human neuromuscular function through optogenetics. Theranostics. 9 (5), 1232-1246 (2019).
- Lin, C. Y., et al. IPSC-derived functional human neuromuscular junctions model the pathophysiology of neuromuscular diseases. JCI Insight. 4 (18), 124299(2019).
- Puttonen, K. A., et al. Generation of functional neuromuscular junctions from human pluripotent stem cell lines. Frontiers in Cellular Neuroscience. 9, 473(2015).
- Umbach, J. A., Adams, K. L., Gundersen, C. B., Novitch, B. G. Functional neuromuscular junctions formed by embryonic stem cell-derived motor neurons. PLoS ONE. 7, 36049(2012).
- Bellmann, J., et al. A customizable microfluidic platform for medium-throughput modeling of neuromuscular circuits. Biomaterials. 225, 119537(2019).
- Mills, R., et al. Neurturin is a PGC-1α1-controlled myokine that promotes motor neuron recruitment and neuromuscular junction formation. Molecular Metabolism. 7, 12-22 (2018).
- Osaki, T., Uzel, S. G. M., Kamm, R. D. Microphysiological 3D model of amyotrophic lateral sclerosis (ALS) from human iPS-derived muscle cells and optogenetic motor neurons. Science Advances. 4 (10), (2018).
- Santhanam, N., et al. Stem cell derived phenotypic human neuromuscular junction model for dose-response evaluation of therapeutics. Biomaterials. 166, 64-78 (2018).
- Southam, K. A., King, A. E., Blizzard, C. A., McCormack, G. H., Dickson, T. C. Microfluidic primary culture model of the lower motor neuron-neuromuscular junction circuit. Journal of Neuroscience Methods. 218 (2), 164-169 (2013).
- Naumann, M., et al. Impaired DNA damage response signaling by FUS-NLS mutations leads to neurodegeneration and FUS aggregate formation. Nature Communications. 9 (1), 335(2018).
- Altman, T., Maimon, R., Ionescu, A., Pery, T. G., Perlson, E. Axonal transport of organelles in motor neuron cultures using microfluidic chambers system. Journal of Visualized Experiments. (159), e60993(2020).
- Nijssen, J., Aguila, J., Hoogstraaten, R., Kee, N., Hedlund, E. Axon-seq decodes the motor axon transcriptome and its modulation in response to ALS. Stem Cell Reports. 11 (6), 1565-1578 (2018).
- Melamed, Z., et al. Premature polyadenylation-mediated loss of stathmin-2 is a hallmark of TDP-43-dependent neurodegeneration. Nature Neuroscience. 22 (2), 180-190 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved