Method Article
ייצור חלקיקי שומנים טעונים siRNA באמצעות מכשיר מיקרופלואידי
In This Article
Summary
מיקרופלוידי מבוסס שומנים ננו חלקיקים (LNP) שיטות הייצור משכו תשומת לב במערכות אספקת תרופות (DDSs), כולל אספקת RNA. פרוטוקול זה מתאר את הייצור, ייצור LNP (siRNA טעון LNP) ותהליכי הערכת LNP באמצעות המכשיר המיקרופלואידי המקורי שלנו בשם iLiNP.
Abstract
הפיתוח של חלקיקי שומנים שומנים פונקציונליים (LNPs) הוא אחד האתגרים העיקריים בתחום של מערכות אספקת תרופות (DDS). לאחרונה, מערכות אספקת רנ"א מבוססות LNP, כלומר, LNPs טעון RNA משכו תשומת לב לטיפול RNA. בפרט, חיסוני LNP טעונים ב- mRNA אושרו כדי למנוע COVID-19, ובכך הובילו לשינוי הפרדיגמה לקראת פיתוח ננו-תרופות מהדור הבא. עבור ננו-רפואה המבוססת על LNP, גודל ה- LNP הוא גורם משמעותי בשליטה על ייחוס ביולוגי LNP וביצועי LNP. לכן, טכניקת בקרת גודל LNP מדויקת היא הכרחית עבור תהליך הייצור של LNP. כאן, אנו מדווחים על פרוטוקול לייצור LNP מבוקר גודל באמצעות מכשיר microfluidic, בשם iLiNP. siRNA טעון LNPs מיוצרים גם באמצעות מכשיר iLiNP ומוערך על ידי ניסוי במבחנה . תוצאות מייצגות מוצגות עבור גודל LNP, כולל LNPs טעון siRNA, Z-פוטנציאל, יעילות אנקפסולציה siRNA, ציטוטוקסיות, ופעילות השתקת גנים היעד.
Introduction
חלקיק שומנים בדם (LNP) הוא אחד nanocarriers הנפוץ ביותר עבור מערכות אספקת RNA. לאחרונה, LNPs טעון mRNA אושרו כחיסונים למניעת COVID-191,2,3. בדרך כלל, הגודל של LNP ממלא תפקיד מכריע בביצועי מערכות הייחוס הביולוגי ואספקת התרופות (DDS), כולל השתקת גנים או ביטוי חלבון4,5,6. לכן, נדרשת שיטת בקרת גודל LNP מדויקת עבור תהליך הייצור של LNP.
לייצור LNPs מבוקר גודל, מכשירים microfluidic משכו תשומת לב לאורך השנים7. בשנת 2018, מינהל המזון והתרופות האמריקאי (FDA) הראשון שאושר על ידי SIRNA -טעון LNPs (למשל, Onpattro) פותח באמצעות המכשיר microfluidic8,9. בשיטת הייצור LNP המבוססת על מיקרופלואידים, פתרון שומנים בדם ופתרון מימי מוכנסים בנפרד למכשיר המיקרופלואידי, ולאחר מכן מעורבבים במיקרו-ערוצים. כדי לשפר את יעילות הערבוב, התקן המערבל הכאוטי שימש לייצור LNP10,11,12. מכשיר המערבל הכאוטי מאפשר לייצר LNPs בגודל מסוים.
מכשיר מיקרופלואידי פשוט, בשם ייצור חלקיקי שומנים פולשניים (iLiNP), מצויד במבנים מבלבלים, פותח כדי לשלוט בגודל LNP בדיוק 13,14. בהשוואה למכשיר המערבל הכאוטי, מכשיר iLiNP הצליח לשלוט בגודל ה- LNP שנע בין 20 ל -100 ננומטר במרווחי זמן של 10 ננומטר. בנוסף, התקן iLiNP ייצר LNPs6 טעון siRNA, LNPs טעון mRNA15, LNPs טעון ריבונוקלאופרוטאין16, ו LNPs דמוי אקסוזום 17. מטרת מאמר זה היא להציג את תהליך הייצור וה- LNP הטעון של התקן iLiNP ולתאר את תהליך הערכת ה- LNP המיוצר על ידי התקן iLiNP.
Protocol
1. ייצור מכשיר iLiNP
הערה: התקן iLiNP מפוברק בשיטת הליתוגרפיה הרכה הסטנדרטית18. פרוטוקול הייצור המפורט דווח בעבר 10,13.
- ייצור עובש SU-8
- יוצקים SU-8 3050 על רקיק סיליקון 3 אינץ '. יש לטוות את רקיק הסיליקון כדי להשיג שכבת SU-8 בעובי 100 מיקרומטר.
- אופים את רקיק הסיליקון על ידי הצבה על פלטה חשמלית בטמפרטורה של 65 מעלות צלזיוס למשך 5 דקות ו-95 מעלות צלזיוס למשך 45 דקות.
- לאחר האפייה, מניחים את רקיק הסיליקון על הבמה של מערכת ליטוגרפיה ללא מסכה שולחנית.
- לחשוף את רקיק הסיליקון לאור UV ב 365 ננומטר עבור 1.5 שניות לכל עמדה אחת.
הערה: בניסוי זה נעשה שימוש במערכת ליטוגרפיה ללא מסיכה שולחנית. המערכת חושפת באופן אוטומטי אור UV באזור הקרנה מחולק (מיקום אחד) של המיקרו-ערוצים. - לאחר הקרנת UV, אופים את רקיק הסיליקון על הכיריים ב 65 °C (65 °F) במשך 1 דקות ו 95 °C (5 °F) במשך 5 דקות.
- מצננים את רקיק הסיליקון, ולאחר מכן משרים מפתח SU-8 למשך 15 דקות כדי להסיר SU-8 שלא נחשף.
- טפלו בעובש SU-8 בעזרת סילאן מסוג טריכלורו (1H, 1H, 2H, 2H-perfluorooctyl) באמצעות מייבש ומשאבת ואקום.
- ייצור של התקן iLiNP
- ערבבו את בסיס הסיליקון ואת חומר הריפוי פולידימתילסילוקסן (PDMS) ביחס של 10:1 (w/w).
- מורידים את התערובת באמצעות משאבת ואקום ומייבש.
הערה: PDMS היה degassed באמצעות משאבת ואקום במשך 10 דקות בטמפרטורת החדר. - יוצקים את PDMS degassed על תבנית SU-8 בצלחת פטרי 100 מ"מ עד 0.5 עד 1 ס"מ עובי, ואחריו אפייה בתנור ב 80 °C (80 °F) במשך 1 שעות.
- מצננים את התבנית, ולאחר מכן מקלפים את מצע PDMS מתבנית SU-8 באמצעות פינצטה.
- ניקוב שלושה חורים (0.5 מ"מ) במצע PDMS. קשרו את מצע ה-PDMS ואת שקופית הזכוכית באמצעות מנקה פלזמת חמצן לבניית התקן iLiNP (ראו איור 1)13.
- חברו שלושה נימי PEEK (מזהה 0.3 מ"מ, מנת יתר 0.5 מ"מ) למפרצונים ולשקע של התקן iLiNP ורפאו באמצעות דבק-על.
הערה: אורך נימי PEEK ניתן לכוונון ותלוי בניסוי.
2. הכנת פתרונות שומנים בדם
- הכן פתרונות שומנים בדם/אתנול: 13.4 מ"מ 1-פלמיטויל-2-אולואיל-sn-גליצרו-3-פוספוצוצולין (POPC), 10 מ"מ 1,2-Distearoyl-sn-glycero-3-phosphocholine (DSPC), 20 מ"מ 1,2-dioleoyloxy-3-trimethylammonium propane (DOTAP), 5 mM 1,2-dimyristoyl-rac-glycero-3-methoxypolyethylene glycol-2000 (DMG-PEG2k), ו 20 מ"מ כולסטרול. אחסן את פתרונות המלאי בטמפרטורה של -20 °C לפני הניסוי.
- כדי לייצר את ה-LNPs הטעונים ב-siRNA, יש לערבב את פתרונות DOTAP, DSPC, כולסטרול ו-DMG-PEG2k ביחס טוחן של 50/10/38.5/1.5. ריכוז השומנים הכולל מותאם ל 8 מ"מ.
3. הכנת פתרונות מימיים
- הכן פתרונות מימיים: 154 mM NaCl (מלוחים), 25 מ"מ מאגר אצטט ב pH 4.0 באמצעות מים מזוקקים ללא DNase / RNase.
- סנן את הפתרונות באמצעות מסנני ממברנה בגודל 0.2 מיקרומטר או מסנני מזרק.
4. הכנת פתרון siRNA/ חיץ
- להמיס 70 מיקרוגרם של siGL4 לתוך 1 מ"ל של 25 mM מאגר אצטט (pH 4.0).
הערה: siGL4 משמש עבור נוקאאוט של הגן לוציפראז.
5. הגדרת התקן iLiNP וייצור של LNPs
הערה: ראו איור 1 לשרטוטים.
- מלא מזרקי זכוכית 1 מ"ל עם שומנים בדם ופתרונות מימיים (משלבים 3.1 ו 4.1 במזרקים בודדים), בהתאמה.
הערה: התאם את נפח השומנים ואת נפח הפתרון מימית בהתאם לכמות הנדרשת עבור ניסוי הערכת LNP. - חבר את מזרקי הזכוכית לנימי PEEK באמצעות מחברי מזרק.
- הגדר את קצב הזרימה של השומנים ופתרונות מימיים.
הערה: יחס קצב הזרימה (FRR) של השלב מימי לשלב השומנים נע בין 3:1 ל 9:1. - הצג את השומנים ואת פתרונות מימית בנפרד לתוך מכשיר iLiNP באמצעות משאבות מזרק.
- אסוף מתלים מסוג LNP במיקרו-טיוב מהשקע של מכשיר iLiNP (איור 1).
6. דיאליזה של השעיית LNP ומדידת גודל LNP
- Dialyze ההשעיה LNP באמצעות קרום דיאליזה (12−14 kDa MW ניתוקים) ב 4 °C (66 °F) בלילה נגד מלוחים או D-PBS עבור POPC LNPs ו- LNPs טעון siRNA, בהתאמה.
הערה: POPC אינו מומס לתוך תמיסת מלח (ראה 2.1). פתרון POPC/אתנול מדולל עם תמיסת מלח במכשיר iLiNP. - לאסוף את ההשעיות LNP דיאליז במיקרו-צינוריות.
- פיפטה 20-30 μL של השעיית LNP לתא מיקרו קוורץ.
- מדוד את גודל ה- LNP, התפלגות גודל LNP ואינדקס הפולידיספרסיה על-ידי פיזור אור דינמי (DLS).
7. מדידת פוטנציאל Z של LNP
הערה: למדידת פוטנציאל Z, נעשה שימוש במנתח חלקיקים (ראה טבלת חומרים) בהתאם להוראת היצרן.
- לדלל את ההשעיה LNP שהתקבלה משלב 6.1, 35 פעמים עם 10 mM HEPES חוצץ (pH 7.4).
- פיפטה 700 עד 1000 μL של השעיית LNP מדולל לתא נימי.
- מדוד את פוטנציאל ה- Z בהתאם להוראת היצרן.
8. יעילות אנקפסולציה siRNA על ידי RiboGreen assay
הערה: בדיקת ריבוגרין מבוצעת כדי להעריך את אנקפסולציית siRNA לתוך LNPs19. בדיקת ריבוגרין יכולה למדוד את כמות ה- RNAs בתוך ומחוץ ל- LNPs עם / ללא פעילי שטח (למשל, TritonX-100).
- לדלל 2 מ"ג / מ"ל של siGL4 עם 10 mM HEPES חיץ (pH 7.4) ל 500 ng / mL siGL4 פתרון.
- הכן את סדרת הדילול (0, 12.5, 25, 50, 100, 200 ננוגרם/מ"ל) של פתרון siGL4 כדי ליצור עקומת כיול עבור דגימות טריטון (+) וטריטון (-).
- לדלל את ההשעיה LNP 100 פעמים עם 10 mM HEPES חוצץ (pH 7.4).
- ערבבו את הדברים הבאים עבור פתרון טריטון (+): 980 μL של 10 mM HEPES (pH 7.4), 20 μL של 10% w / v TritonX-100, ו 1.25 μL של ריבוגרין עבור 10 בארות של מיקרופלאט 96-well.
- ערבבו את הדברים הבאים עבור פתרון טריטון (-) : 1000 μL של 10 mM HEPES (pH 7.4) ו 1.25 μL של ריבוגרין עבור 10 בארות של מיקרו-לוחית 96-well.
- Pipette 100 μL של סדרת הדילול של פתרון siGL4 ומתלי LNP מדוללים לתוך הבארות של מיקרופלט שחור 96-well.
הערה: סדרת הדילול של פתרון siGL4 והשעיות LNP מדוללות חולקו לארבעה מיקרווולים לכל תנאי. - פיפטה 100 μL של פתרון הזיהוי (TritonX-100 (+) או טריטון (-)) לתוך הבארות.
הערה: פתרון האיתור (TritonX-100 (+)) חולק לשתי בארות לכל דגימה לכל תנאי, ופתרון TritonX-100 (-) חולק לשתי הבארות הנותרות לכל מצב מדגם. - לדגור על המיקרו-לוחית במשך 5 דקות בטמפרטורת החדר.
- מדוד את עוצמת הפלואורסצנטיות באמצעות קורא מיקרופלט באורך גל של 475 ננומטר.
- חשב את יעילות אנקפסולציית siRNA מהמשוואה הבאה19.
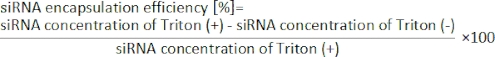
9. תרבות תאים
- הכן מדיום צמיחה המכיל DMEM, מומת בחום 10% FBS, 100 U / mL פניצילין, 100 מיקרוגרם / מ"ל סטרפטומיצין, ו 400 מיקרוגרם / מ"ל G418.
- תרבית HeLa תאים ביציבות ביטוי גחלילית ו Renilla לוציפראז (HeLa-dluc) בצלחת תרבית תאים 100 מ"מ TC מטופלת המכילה את מדיום הצמיחה ב 37 °C (5° C) בחממה 5% CO2 .
10. בדיקת הכדאיות של התא
- זרע 100 μL של השעיה של תאי HeLa במדיום הצמיחה (6 x 103 תאים / טוב) במיקרופלטה 96-well.
הערה: תאים נספרו באמצעות לוח מונה תאים ומיקרוסקופ. - לדגור על המיקרו-לוחית ל-24 שעות בטמפרטורה של 37 מעלות צלזיוס בחממה של 5% CO2 .
- לדלל את LNPs טעון siRNA עם DMEM (FBS (-)) בריכוזים של 10 ו 100 nM siRNAs.
- פטר 100 μL של השעיית LNP טעון siRNA מדולל לכל באר.
- לדגור על המיקרו-לוחית ל-4 שעות בטמפרטורה של 37 מעלות צלזיוס בחממה של 5% CO2 .
- הסר את מתלי LNP והוסף 100 μL של DMEM (FBS (+)).
- לדגור על המיקרו-לוחית ל-20 שעות בטמפרטורה של 37 מעלות צלזיוס בחממה של 5% CO2 .
- מדוד את הכדאיות של התא באמצעות ערכה זמינה מסחרית בהתאם לפרוטוקול היצרן.
הערה: D-PBS (-) שימש כפקד השלילי.
11. בדיקת נוקאאוט גן לוציפראז
- זרע 75 μL של השעיה של תאי HeLa במדיום הצמיחה (4.5 x 103 תאים / טוב) במיקרו-לוחית 96-well.
- לדגור על המיקרו-לוחית ל-24 שעות בטמפרטורה של 37 מעלות צלזיוס בחממה של 5% CO2 .
- לדלל את LNPs טעון siRNA עם DMEM (FBS (-)) בריכוזים של 10 ו 100 nM siRNAs.
- חלוק 75 μL של ההשעיה LNP טעון siRNA מדולל לכל באר אחת.
- לדגור על המיקרו-לוחית ל-4 שעות בטמפרטורה של 37 מעלות צלזיוס בחממה של 5% CO2 .
- הסר את מתלי LNP והוסף 75 μL של DMEM (FBS (+)).
- לדגור על המיקרו-לוחית ל-20 שעות בטמפרטורה של 37 מעלות צלזיוס בחממה של 5% CO2 .
- מדוד את ביטוי הלוציפראז באמצעות ערכה זמינה מסחרית בהתאם לפרוטוקול היצרן.
הערה: השתמשנו ב- D-PBS (-) כפקד השלילי.
תוצאות
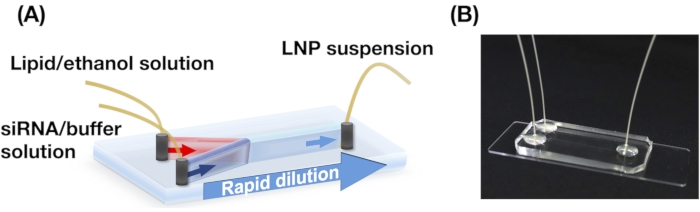
איור 2A,B מציג את התפלגות גודל ה-POPC LNP המיוצרת בתנאי זרימה שונים. שיטת ההכנה LNP המבוססת על מיקרופלואידים יכולה לשלוט בגודל של LNPs על ידי תנאי הזרימה כגון קצב הזרימה הכולל (TFR) וה- FRR. בהשוואה למכשירים המיקרופלואידיים הטיפוסיים, כולל התקן המערבל הכאוטי והמכשיר המיקרופלוידי המתמקד בזרימה, התקן iLiNP איפשר בקרת גודל LNP מדויקת הנעה בין 20 ל-100 ננומטר (איור 2). LNPs בגודל קטן נוצרו בתנאי קצב זרימה כולל גבוה. בנוסף, גדלי LNP שנוצרו ב- FRR של 5 היו קטנים יותר מאלה של FRR של 3, ללא קשר לקצב הזרימה הכולל13.
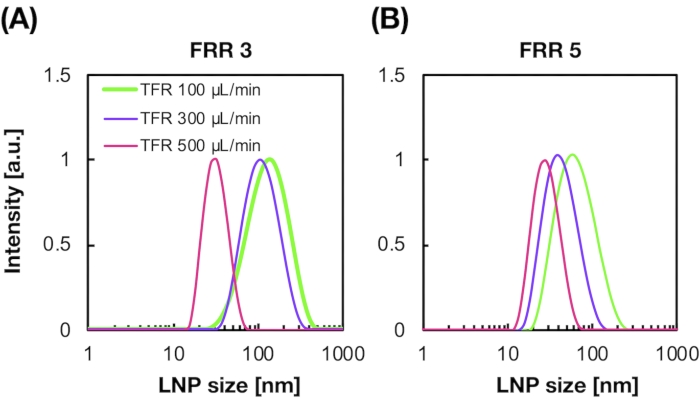
LNPs טעונים siRNA הוכנו גם באמצעות מכשיר iLiNP (איור 3A). להכנת LNP טעון siRNA, DOTAP, שומנים קטיוניים, שימש לתמצת את siRNA לתוך LNPs ביעילות. התקן iLiNP ייצר רכיבי LNPs קטיוניים בגודל 90 ננומטר עם חלוקה צרה (איור 3A, B). יעילות אנקפסולציית siRNA הייתה 95% בגלל האינטראקציה האלקטרוסטטית בין השומנים הקטיוניים לבין siRNAs טעון שלילית (איור 3C).
ציטוטוקסיות ופעילות השתקת הגנים של 90 ננומטר של רכיבי LNP טעונים בסירנ"א בגודל 90 ננומטר הוערכו כפי שמוצג באיור 4 ובאיור 5. SIRNA טעון LNPs עשה להראות ציטוטוקסיות במינון של 10 ו 100 ננומטר siRNA. אישרנו גם כי רמת הביטוי של לוציפראז ירדה בהתאם לריכוז siRNA. LNPs טעון siRNA הדחיק 80% ביטוי לוציפראז במינון של 100 ננומטר siRNA. ההשפעה של גודל LNP על פעילות השתקת הגנים דווחה בעבר 6,13,17.
איור 1: (A) איור סכמטי ו-(ב) תמונה של התקן iLiNP. מכשיר iLiNP כולל PDMS ומצעי זכוכית. התקן iLiNP מחובר לנימי PEEK עם דבק-על. השומנים ופתרונות siRNA /buffer מוכנסים בנפרד למכשיר iLiNP באמצעות משאבות מזרק. ההשעיה של LNP נאספה במיקרו-טיוב. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
איור 2: התפלגות גודל POPC LNP המיוצרת על-ידי התקן iLiNP ביחסי קצב הזרימה השונים (FRR). גודל POPC LNP נמדד על-ידי פיזור אור דינמי (DLS). ה- POPC LNPs מוכנים על-ידי שינוי קצב הזרימה הכולל וה- FRR: (A) 3 FRR ו- (B) 5 FRR. LNPs בגודל קטן נוצרים בתנאי קצב זרימה כולל גבוה. בנוסף, גדלי LNP שנוצרו ב- FRR של 5 היו קטנים יותר מאלה ב- FRR של 3. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
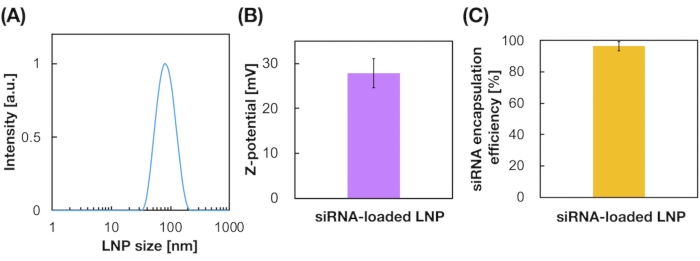
איור 3: אפיון של LNPs טעון siRNA. (A) התפלגות גודל של LNPs טעון siRNA. siRNAs (siGL4) הם encapsulated לתוך LNPs על ידי אינטראקציה אלקטרוסטטית בין השומנים הקטיוניים (DOTAP) ו siRNAs טעון שלילית. (B) Z-פוטנציאל של LNPs טעון siRNA. ההשעיה LNP היה מדולל עם 10 mM HEPES חוצץ (pH 7.4) לפני המדידה. הנתונים מיוצגים כממוצע ± SD (סטיית תקן). n = 3. (C) יעילות אנקפסולציה siRNA של LNPs מבוסס DOTAP. יעילות האנקפסולציה נקבעה על ידי בדיקת ריבוגרין. הנתונים מיוצגים כממוצע ± SD. n = 3. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
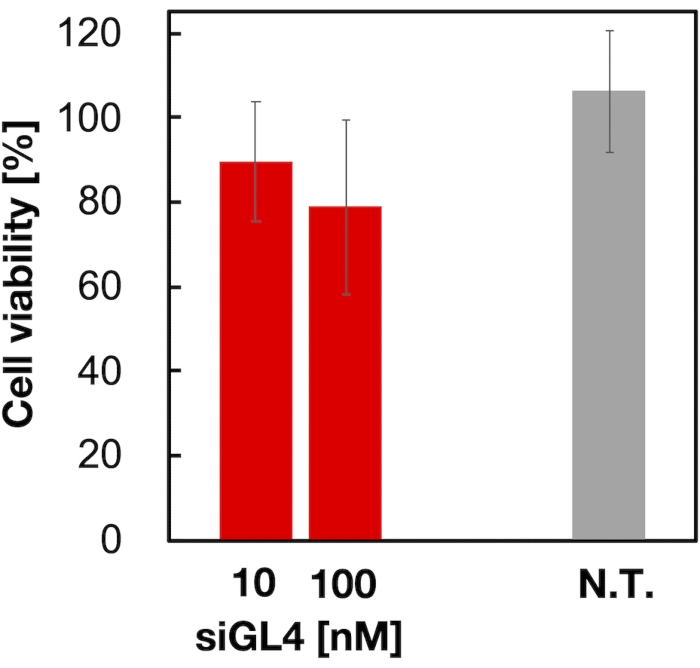
איור 4: ציטוטוקסיות של ה-LNPs הטעונים ב-siRNA. LNPs טעון siRNA היו מדוללים עם DMEM (FBS (-)) כדי להשיג את ריכוזי siGL4 של 10 ו 100 nM. ההשעיות LNP מתווספות לתאי HeLa-dLuc ודגרות במשך 4 שעות בטמפרטורה של 37 מעלות צלזיוס בחממה של 5% CO2 . N.T.: לא מטופל (D-PBS(-)). הנתונים מיוצגים כממוצע ± SD. n = 3. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
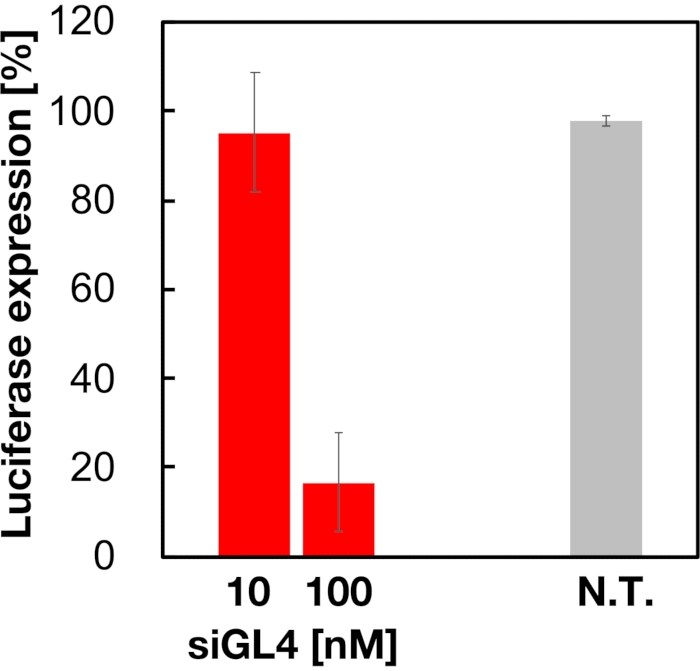
איור 5: פעילות נוקאאוט גנים לוציפראז מטופלת עם LNPs טעון siRNA. LNPs טעון siRNA מוכנים באותו אופן כמו בדיקת הכדאיות התא. רמת הביטוי לוציפראז נמדדת באמצעות מערכת בדיקת לוציפראז כפולה. N.T.: לא מטופל (D-PBS(-)). הנתונים מיוצגים כממוצע ± SD. n = 3. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Discussion
גודל ה-LNP משפיע על הייחוס הביולוגי של LNP, על אפקט האנטי-גידולים ועל ביצועי השתקת הגנים. לכן, שיטת בקרת גודל LNP היא טכניקה משמעותית לייצור ננו-רפואה DDS, כולל מערכות אספקת RNA. מטרתו של מאמר זה היא להציג את התקן iLiNP לכוונון בגודל מדויק של LNPs ויישומו לייצור LNPs טעון siRNA. התקן iLiNP הצליח לשלוט בגודל ה-LNP שנע בין 20 ל-100 ננומטר (איור 2)13. כאשר תנאי הזרימה, כגון קצב הזרימה הכולל וה- FRR משתנים כדי לשלוט בגודל LNP, יש לאסוף את ההשעיה של LNP לאחר כ- 5 עד 10 שניות כדי לייצב את זרימת הפתרון. מתלה LNP שנאסף מהשקע של התקן iLiNP היה dialyzed מיד נגד פתרון המאגר כדי להסיר אתנול ולמנוע הצטברות LNP.
בקרת גודל LNP היא אחד האתגרים העיקריים בתחום ה- DDS. בדרך כלל, תהליך הייצור קונבנציונלי LNP, כגון שיטת הידרציה סרט השומנים, צריך תהליך כוונון גודל לאחר הפקת LNP20. מצד שני, שיטת הייצור LNPs מבוסס microfluidic יכול לייצר את LNPs נשלט גודל על ידי החדרת השומנים ופתרונות מימיים לתוך המכשיר microfluidic6,11,13. למרות תהליך הדיאליזה נדרש כדי להסיר אתנול מן ההשעיה LNP, תהליך מתמשך על ידי המכשיר microfluidic יחד עם מערכת הזרימה משיק מבטיח את האוטומציה של תהליך הייצור LNP14. על פי הספרות, גדלי POPC LNP היו 50-60 ננומטר ו 30-60 ננומטר, עבור המכשיר המיקרופלוידי ממוקד הזרימה21 והתקן המערבל הכאוטי, בהתאמה10. בהשוואה להתקנים מיקרופלואידיים אחרים, התקן iLiNP מאפשר בקרת גודל POPC LNP בטווח רחב של 20 עד 100 ננומטר.
תהליך הייצור של מכשיר iLiNP המועסק היה הליתוגרפיה הרכה הסטנדרטית. לכן, מכשיר iLiNP יכול להיות מיוצר באופן המוני על ידי טכניקת אב טיפוס מהירה ולמנוע זיהום צולב של פתרונות באמצעות מכשיר חד פעמי. התקן iLiNP יכול לייצר LNPs טעון siRNA באותו אופן כמו שיטת הייצור POPC LNP. עבור שיטת הייצור של LNP באמצעות התקן iLiNP, המשתמש אינו דורש הליכים מסובכים. מסיבות אלה, שיטת הייצור LNP מבוססת המיקרופלואידית, כולל התקן iLiNP, צפויה להיות מועסקת כשיטת הייצור הסטנדרטית של LNP. הפרוטוקול של נייר זה יכול להיות מותאם להתקנים מיקרופלואידיים אחרים לייצור LNP. בנוסף, הייצור של LNPs טעון mRNA מופעל גם על ידי שינוי פתרון siRNA / מאגר לפתרון מאגר המכיל mRNAs.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי JST, CREST גרנט מספר JPMJCR17H1, יפן, JST, פרסטו גרנט מספר JPMJPR19K8, יפן, JST, SCORE, יפן, חינוך מיוחד והוצאות מחקר ממשרד החינוך, התרבות, הספורט, המדע והטכנולוגיה, JSPS KAKENHI מענק מספר JP19KK0140, וקרן המדע והטכנולוגיה Iketani.
Materials
| Name | Company | Catalog Number | Comments |
| 1-palmitoyl-2-oleoyl-sn-glycero-3-phosphocholine (POPC) | NOF Corp. | MC-6081 | |
| 1,2-dimyristoyl-rac-glycero-3-methoxypolyethylene glycol-2000 (DMG-PEG2K) | NOF Corp. | GM-020 | |
| 1,2-dioleoyloxy-3-trimethylammonium propane (DOTAP) | NOF Corp. | CL-8181TA | |
| 1,2-Distearoyl-sn-glycero-3-phosphocholinev (DSPC) | NOF Corp. | MC-8080 | |
| 10 x D-PBS (-) | FUJIFILM Wako Pure Chemical Corp. | 048-29805 | |
| Acetic acid | FUJIFILM Wako Pure Chemical Corp. | 017-00251 | |
| CellTiter-Blue Cell Viability Assay | Promega | G8081 | |
| cholesterol | Sigma-Aldrich | C8667-5G | |
| Desktop maskless lithography system | NEOARK CORPORATION | DDB-701-DL4 | |
| Dialysis membrane | Repligen | 132697 | |
| Dual-Glo Luciferase Assay System | Promega | E2940 | |
| Fetal bovine serum (FBS) | Thermo Fisher Scientific | Lot: 42G6587K | |
| G418 | Nacalai Tesque | 08973-14 | |
| Glass substrate | Matsunami Glass Ind., Ltd. | S1111 | |
| Glass syringe | Hamilton | GASSTIGHT 1002 | |
| HeLa cell | HeLa-dluc cells were provided from Dr. Yusuke Sato at Hokkaido University | ||
| HEPES | FUJIFILM Wako Pure Chemical Corp. | 342-01375 | |
| Low-glucose Dulbecco’s modified Eagle medium (DMEM) | Sigma-Aldrich | D6046-500ML | |
| Oxygen plasma cleaner | Femto Science | CUTE-1MP/R | |
| Penicillin–streptomycin, trypsin (2.5%) | Thermo Fisher Scientific | 15140122 | |
| Quant-iT RiboGreen RNA Reagent | Thermo Fisher Scientific | R11491 | |
| siGL4 | Hokkaido System Science Co., Ltd | The sense and antisense strand sequences of siGL4 are 5'-CCGUCGUAUUCGUGAGCAATsT -3' and 5'-UUGCUCACGAAUACGACGGTsT -3', respectively. | |
| Silicon wafer | GTC | ||
| SILPOT 184 W/C (PDMS) | Dow Corning Toray Co., Ltd. | silicone base and curing agent are included | |
| Sodium acetate | FUJIFILM Wako Pure Chemical Corp. | 192-01075 | |
| Sodium chloride | FUJIFILM Wako Pure Chemical Corp. | 191-01665 | |
| SU-8 3050 | Nippon Kyaku Co., Ltd. | ||
| Syringe connector | Institute of microchemical Technology Co., Ltd. | ISC-011 | |
| Syringe pump | Chemyx | CX07200 | |
| trichloro(1H,1H,2H,2H-perfluorooctyl)silane | Sigma-Aldrich | 448931-10G | |
| TritonX-100 | Nacalai Tesque | 35501-15 | |
| UltraPure DNase/RNase-Free Distilled Water | Thermo Fisher Scientific | 10977015 | |
| Zetasizer Nano ZS | Malvern Instruments | ZEN3600 |
References
- Schoenmaker, L., et al. mRNA-lipid nanoparticle COVID-19 vaccines: Structure and stability. International Journal of Pharmaceutics. 601, 120586 (2021).
- Chung, Y. H., Beiss, V., Fiering, S. N., Steinmetz, N. F. COVID-19 Vaccine frontrunners and their nanotechnology design. ACS Nano. 14 (10), 12522-12537 (2020).
- Dong, Y., et al. A systematic review of SARS-CoV-2 vaccine candidates. Signal Transduction and Targeted Therapy. 5 (1), 237 (2020).
- Cabral, H., et al. Accumulation of sub-100 nm polymeric micelles in poorly permeable tumours depends on size. Nature Nanotechnology. 6 (12), 815-823 (2011).
- Sato, Y., et al. Elucidation of the physicochemical properties and potency of siRNA-loaded small-sized lipid nanoparticles for siRNA delivery. Journal of Controlled Release. 229, 48-57 (2016).
- Kimura, N., et al. Three-dimensional, symmetrically assembled microfluidic device for lipid nanoparticle production. RSC Advances. 11 (3), 1430-1439 (2021).
- Maeki, M., Kimura, N., Sato, Y., Harashima, H., Tokeshi, M. Advances in microfluidics for lipid nanoparticles and extracellular vesicles and applications in drug delivery systems. Advanced Drug Delivery Reviews. 128, 84-100 (2018).
- Akinc, A., et al. The Onpattro story and the clinical translation of nanomedicines containing nucleic acid-based drugs. Nature Nanotechnology. 14 (12), 1084-1087 (2019).
- Kulkarni, J. A., Witzigmann, D., Chen, S., Cullis, P. R., vander Meel, R. Lipid nanoparticle technology for clinical translation of siRNA therapeutics. Accounts of Chemical Research. 52 (9), 2435-2444 (2019).
- Maeki, M., et al. Understanding the formation mechanism of lipid nanoparticles in microfluidic devices with chaotic micromixers. PLoS One. 12 (11), 0187962 (2017).
- Maeki, M., et al. A strategy for synthesis of lipid nanoparticles using microfluidic devices with a mixer structure. RSC Advances. 5 (57), 46181-46185 (2015).
- Belliveau, N. M., et al. Microfluidic synthesis of highly potent limit-size lipid nanoparticles for in vivo delivery of siRNA. Molecular Therapy - Nucleic Acids. 1, 37 (2012).
- Kimura, N., et al. Development of the iLiNP Device: Fine Tuning the Lipid Nanoparticle Size within 10 nm for Drug Delivery. ACS Omega. 3 (5), 5044-5051 (2018).
- Kimura, N., et al. Development of a microfluidic-based post-treatment process for size-controlled lipid nanoparticles and application to siRNA delivery. ACS Applied Materials & Interfaces. 12 (30), 34011-34020 (2020).
- Hashiba, A., et al. The use of design of experiments with multiple responses to determine optimal formulations for in vivo hepatic mRNA delivery. Journal of Controlled Release. 327, 467-476 (2020).
- Suzuki, Y., et al. Lipid nanoparticles loaded with ribonucleoprotein-oligonucleotide complexes synthesized using a microfluidic device exhibit robust genome editing and hepatitis B virus inhibition. Journal of Controlled Release. 330, 61-71 (2020).
- Kimura, N., Maeki, M., Ishida, A., Tani, H., Tokeshi, M. One-step production using a microfluidic device of highly biocompatible size-controlled noncationic exosome-like nanoparticles for RNA delivery. ACS Applied Bio Materials. 4 (2), 1783-1793 (2021).
- Deng, T., Wu, H., Brittain, S. T., Whitesides, G. M. Prototyping of masks, masters, and stamps/molds for soft lithography using an office printer and photographic reduction. Analytical Chemistry. 72 (14), 3176-3180 (2000).
- Sato, Y., et al. A pH-sensitive cationic lipid facilitates the delivery of liposomal siRNA and gene silencing activity in vitro and in vivo. Journal of Controlled Release. 163 (3), 267-276 (2012).
- Ong, S. G., Chitneni, M., Lee, K. S., Ming, L. C., Yuen, K. H. Evaluation of extrusion technique for nanosizing liposomes. Pharmaceutics. 8 (4), (2016).
- Mijajlovic, M., Wright, D., Zivkovic, V., Bi, J. X., Biggs, M. J. Microfluidic hydrodynamic focusing based synthesis of POPC liposomes for model biological systems. Colloids and Surfaces B: Biointerfaces. 104, 276-281 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved