Method Article
ייצור יעיל וניתן להרחבה של גרסאות ציד אנושיות באורך מלא בתאי יונקים באמצעות מערכת ביטוי חולפת
In This Article
Summary
אנו מספקים פרוטוקולים מדרגיים המכסים תכנון מבנה, טרנספקציה חולפת, וביטוי וטיהור של גרסאות של חלבון ציד אנושי באורך מלא בתאי HEK293.
Abstract
צידטין באורך מלא (FL HTT) הוא חלבון גדול (aa 1-3,144), המתבטא בכל מקום, המכיל פוליגלוטמין (polyQ) עם מסה של כ-350 kDa. בעוד שהתפקוד התאי של FL HTT אינו מובן לחלוטין, התפשטות מוטנטית של מערכת הפוליQ מעל ~36 חוזרת קשורה למחלת הנטינגטון (HD), כאשר אורך הפוליQ נמצא בקורלציה בערך עם גיל ההתפרצות. כדי להבין טוב יותר את השפעת המבנה על תפקוד המוטציה HTT (mHTT), נדרשות כמויות גדולות של החלבון. ייצור תת-מיליגרם של FL HTT בתאי יונקים הושג באמצעות ביטוי קו תאים יציבים הניתן להשראה של דוקסיציקלין. עם זאת, לייצור חלבונים מקווי תאים יציבים יש מגבלות שניתן להתגבר עליהן באמצעות שיטות טרנספקציה חולפות.
מאמר זה מציג שיטה חזקה לייצור כמות נמוכה של מיליגרם של FL HTT וגרסאותיו מפלסמידים ממוטבים לקודון על ידי טרנספקציה חולפת באמצעות פוליאתילנימין (PEI). השיטה ניתנת להרחבה (>10 מ"ג) ומניבה באופן עקבי 1-2 מ"ג/ליטר של תרבית תאים של FL HTT מטוהר מאוד. בהתאם לדוחות קודמים, מצב הפתרון המטוהר של FL HTT נמצא כדינמי ביותר; לחלבון יש נטייה ליצור דימרים ואוליגומרים מסדר גבוה. מפתח להאטת היווצרות אוליגומרים הוא עבודה מהירה כדי לבודד את השברים המונומריים מהשברים הדימריים והאוליגומריים מסדר גבוה במהלך הכרומטוגרפיה של אי הכללת גודל.
כרומטוגרפיה של אי הכללת גודל עם פיזור אור רב-זוויתי (SEC-MALS) שימשה לניתוח הדימר והתוכן האוליגומרי מסדר גבוה יותר של HTT מטוהר. לא נצפתה קורלציה בין אורך הפוליQ של FL HTT (Q23, Q48 ו-Q73) לבין תכולת האוליגומרים. המבנה שנמחק מ-exon1 (aa 91-3,144) הראה נטייה דומה לאוליגומריזציה ל-FL HTT (aa 1-3,144). שיטות ייצור, טיהור ואפיון על ידי SEC/MALS-refractive index (RI), נתרן דודצילסולפט-פוליאקרילאמיד ג'ל אלקטרופורזה (SDS-PAGE), כתם מערבי, דף מקורי ו- Blue Native PAGE מתוארים כאן.
Introduction
מחלת הנטינגטון (HD) היא מחלה נוירודגנרטיבית נדירה המאופיינת בעיקר בתנועה מוטורית לא יציבה ולא רצונית, כמו גם בשינויים קוגניטיביים ופסיכיאטריים, כגון שינויים באישיות ואדישות 1,2. HD קשורה להרחבה של מערכת ה-CAG החוזרת הממוקמת באקסון 1 של הגן huntingtin (HTT) ליותר מ-35 חזרות, עם מספר גבוה יותר של חזרות CAG בקורלציה עם התפרצות מוקדמת יותר של המחלה 3,4. התוצר התרגומי של HTT, חלבון הנטינגטון (HTT), מעורב בחיוניות העצבית ובהתפתחות המוח 5,6,7,8,9.
HTT הוא חלבון פיגומים המדווח כמשתתף במגוון רחב של תהליכים תאיים, הובלת שלפוחית, חלוקת תאים, סיליוגנזה ואוטופגיה10,11. עם זאת, הפתוגנזה המולקולרית של HD אינה ברורה לחלוטין, וזיהוי של אינטראקטורים חלבוניים מרכזיים המתווכים את ההשפעה הפתולוגית של mHTT מורחב polyQ חסר. חלק מהמחקרים מצביעים על רווח של תפקוד רעיל מ-mHTT המונע על ידי נטיית האוליגומריזציה של חלבון ה-HTT המורחב, שכן אגרגטים של HTT זוהו בתאי עצב ובגליה בחולי HD ובמודלים של בעלי חיים של המחלה 12,13,14,15,16,17 . כדי לתדלק את חקירת התפקוד והמבנה של גרסאות FL HTT ו-mHTT ולספק לחוקרים תקני חלבון באיכות גבוהה לפיתוח בדיקות, יש צורך באספקה חזקה ומדרגית של חלבון רקומביננטי הומוגני.
בשל גודלו (aa 1-3,144, מספור המבוסס על אורך polyQ23), חוסר יציבות פרוטאוליטית ונטייה לצבירה, FL HTT הוכח כקשה לביטוי ולבידוד כחלבון מסיס. בעבר, אזור אקסון 1 (aa 2-90) של HTT התבטא וטוהר בקנה מידה גדול באמצעות תגים שונים שיכולים להגדיל את המסיסות של החלבון ב Escherichia coli18,19,20. FL HTT בא לידי ביטוי וטוהר לראשונה במערכת ביטוי תאי חרקים באמצעות baculovirus 21,22, ומבנים של מיקרוסקופיית אלקטרונים 30 Å (EM) ברזולוציה נמוכה של FL Q23-HTT ו-Q78-HTT בעלי קשרים כימיים דווחו23. החקירה של מבנה HTT התקדמה עוד יותר כאשר הייצור של FL Q17, Q46 ו- Q128-HTT עם שינויים פוסט-טרנסלציוניים מקוריים (PTMs) הושג בתאים אנושיים באמצעות קווי תאים יציבים או מערכות ביטוי אדנו-וירוס24. מחקרים אלה מצביעים על כך שלמרות ש- HTT מטוהר קיים בעיקר במצב המונומרי, הוא גם נוטה ליצור אוליגומרים מסדר גבוה ואגרגטים.
אולטרה-צנטריפוגציה אנליטית של FL Q128-HTT, עם אזור פוליQ מורחב מאוד, העניקה יותר שברים אוליגומריים ואגרגטים מאשר החלבון עם אזור הפוליQהלא מורחב 24. באמצעות קו תאים יציב, אסטרטגיה הותאמה בהצלחה לייצוב FL HTT על ידי ביטוי משותף עם שותף האינטראקציה HAP40. מבנה קריו-EM של קומפלקס FL HTT ו-HAP40 נפתר ברזולוציה ממוצעת של 4 Å באמצעות קומפלקס החלבון המטוהר (PDB:6EZ8)25. אסטרטגיית ביטוי משותף זו הותאמה בהצלחה למערכת baculovirus, וסדרה של גרסאות HTT באיכות גבוהה עם אורכי polyQ שונים בוטאו וטוהרו מתאי חרקים26. מאז, יותר מבני cryo-EM של קומפלקס HTT עם אורכי polyQ משתנים ומבני HAP40 ורזולוציה גבוהה יותר נפתרו והופקדו בבסיס נתוני החלבון27,28 (PDB: 7DXK, 7DXH, 6X9O).
ביצענו אופטימיזציה של שיטת טרנספקציה וביטוי בתאי HEK293, תוך שימוש בפוליאתילנימין (PEI), לביטוי חולף מהיר של FL HTT. כהוכחה עקרונית, גרסאות FL HTT המכילות 23 גלוטמינים (FL Q23-HTT) טוהרו לראשונה ואופיינו באמצעות שינוי של שיטת טיהור שתוארה קודםלכן 24. שיטת העברה חולפת זו היא נוחה, יעילה מאוד ומדרגית; הוא יכול לייצר HTT מטוהר עם תפוקות של 1-2 מ"ג/ליטר, בדומה לשיטת קו התאים היציב שדווחה24. מאחר שהחלבון מיוצר בקו תאים אנושי, ל-HTT המיוצר יש סיכוי גבוה יותר להיות PTMs אנושיים מקומיים כאשר הוא נתון לניתוח פרוטאומיקה של ספקטרומטריית מסה 11,29,30,31. כמויות מיליגרם של גרסאות FL Q48-HTT, FL Q73-HTT ו-exon1-deleted (ΔExon1-HTT) של FL HTT יוצרו, מה שמוכיח כי שיטת הביטוי החולפת שימושית במיוחד בייצור מהיר של גרסאות חלופיות של HTT מבלי להיות תלויים במאמץ הגוזל זמן הנדרש להקמת קווי תאים יציבים לייצור.
הפרוטוקול הבא מדגים את השיטה הסטנדרטית המשמשת במעבדה של מחברים אלה לתרבית תאים, טרנספקציה, טיהור חלבונים ואפיון חלבונים לאחר טיהור כדי לייצר FL Q23-HTT מתרבית תאים של 2 ליטר. ניתן להרחיב את הפרוטוקול לתרביות גדולות יותר או להתאים אותו לטיהור גרסאות HTT אחרות. עד 10 תרביות תאי L של FL HTT ומוטציות שונות באתר או חיתוך של הומולוגים HTT ו- HTT בוצעו בהצלחה במעבדה תוך שימוש באותו פרוטוקול. FL HTT מטוהר מכיל אחוז גבוה של מונומרים יחד עם דימרים ואוליגומרים מסדר גבוה יותר. אותו פרופיל מצטבר נצפה בין הגרסאות המיוצרות (Q23, Q48, Q73 ונמחק Exon1). מכיוון שצבירה יכולה להתרחש כאשר לא ננקטת זהירות נכונה, נערך מחקר פורמולציה ויציבות הפשרה בהקפאה כדי לזהות את התנאים הטובים ביותר לטיפול בחלבונים. שיטות, כגון Blue Native PAGE ו-SEC/MALS-RI, מתוארות גם כדי לנתח את תוכן האוליגומרים של HTT כחלק מתהליך בקרת האיכות. כדי להועיל לקהילת המחקר של HD, פלסמידים וחלבוני HTT שתוארו במחקר זה מופקדים גם במאגר הקהילתי HD במכון קוריאל (www.coriell.org/1/CHDI).
Protocol
1. תכנון וייצור מבנים לביטוי יונקים HTT המתויגים ב- FLAG
- אחזר את רצף החלבון HTT האנושי באורך מלא (P42858) מהמרכז הלאומי למידע ביוטכנולוגי (https://www.ncbi.nlm.nih.gov/).
הערה: חוקרים צריכים להכיר את ארגוני התחום של HTT ולשמור על מבנה הליבה התלת-ממדי של HTT בעת תכנון מבנים עבור מוטנטים של HTT. - בקש שירות סינתזת גנים כדי לבצע אופטימיזציה של קודון לביטוי תאים אנושיים בהתבסס על הרצף של P42858. שנה את מספר הפוליQ מ- Q16 לאורך Q הרצוי (Q23 נבחר כמבנה הראשון כאן) וסנתז את הגן HTT באורך מלא.
הערה: מבנה Q23-HTT המסונתז באורך מלא הממוטב לקודון נמסר כתוספת בפלסמיד pUC18 במחקר זה. - אופציונלי: הוסף תכונות כדי להקל על השיבוט של אורכי Q שונים וטיהור במבנים.
הערה: אתר ביקוע של נגיף חריטת טבק (TEV) ותג טיהור דגל (AAAENLYFQGDYKDDDDK) נוספו לקצה מסוף C של המבנים. שני אתרי HindIII תוכננו במבנים כך שיכללו את אזור הפוליQ (רצף חלבונים מתורגם אינו משתנה על ידי הצגת אתרי HindIII). זה מאפשר לחוקר לשנות את אורך Q של HTT על ידי הגבלת העיכול והקשירת האנזים מבלי לסנתז מחדש את גן ה-HTT המלא.
2. שכפלו את מבנה ה-HTT המסונתז ל-pcDNA3.1.
- יש לעכל 5 מיקרוגרם של pUC18-Q23-HTT ו-5 מיקרוגרם של pcDNA3.1 באמצעות 2 μL של NheI ו-PmeI כל אחד בטמפרטורה של 37°C למשך שעתיים.
- הפעל ג'ל אגרוז 0.5% w/v וטהר את שבר Q23-HTT ואת וקטור pcDNA3.1 המעוכל באמצעות ערכת מיצוי ג'ל אגרוז. כמותיים את ריכוזי הדנ"א המטוהר על ידי OD280 באמצעות ספקטרומטר UV שיכול למדוד מיקרוליטרים של דגימות.
הערה: OD260/280 הנע בין 1.8 ל- 2.0 נצפה בדרך כלל. FL HTT מסונתז מסופק כתוספת עם NheI ו- PmeI בשני הקצוות בפלסמיד pUC18. השתמש באנזימי הגבלה אחרים אם HTT מסונתז בצורה שונה. - השתמש ב-10 ננוגרם של וקטור pcDNA3.1 מעוכל בתגובה. ליגייט של הדנ"א המטוהר ביחס טוחנות של 1:1 (HTT:pcDNA3.1) בתגובה של 10 מיקרו-ליטר בטמפרטורת החדר למשך 5 דקות באמצעות ליגאז DNA T4.
- הפוך את המוצר המקשר לתאי E. coli מוסמכים (ראה טבלת החומרים) באמצעות הפרוטוקול שצוין על ידי יצרן הליגאז.
- לאסוף 6 מושבות בודדות ולעשות תרביות לילה ב 4-6 מ"ל של LB בתוספת 100 מיקרוגרם / מ"ל carbenicillin ב 37 מעלות צלזיוס.
- להקצות 1 מ"ל מכל תרבות לילה. הוסיפו גליצרול ל-25% v/v ושמרו את מלאי הגליצרול בטמפרטורה של -80°C. טהר את תרבות הלילה הנותרת באמצעות ערכת הכנה מינימלית בהתאם לשלבים המפורטים במדריך למשתמש.
- רצף את כל הפלסמידים באמצעות פריימרים ריצוף המשתרעים על פני אזור השעתוק של הפלסמיד. בחר מלאי גליצרול אחד שיש לו את הרצף הנכון כמלאי הגליצרול הראשי והשלך את השאר.
- אופציונלי: בקש שירות סינתזת גנים כדי לסנתז דנ"א עם אורכי Q שונים (Q48, Q73 ו- Exon1) המשתרעים על פני שני אתרי HindIII בפלסמיד pcDNA3.1-Q23-HTT. עכלו את pcDNA3.1-Q23-HTT ואת הדנ"א המסונתזים החדשים באמצעות HindIII, ושחזרו עליהם עם ליגאז T4 כמו בשלבים 2.2-2.7 כדי ליצור FL HTT עם אורכי polyQ שונים בפלסמיד pcDNA3.1.
הערה: מבני פלסמיד ששימשו במחקר זה זמינים גם ישירות ממאגר קהילת HD במכון קוריאל (www.coriell.org/1/CHDI); ראה את טבלת החומרים.
3. GIGA להכין דנ"א פלסמיד ללא אנדוטוקסין עבור טרנספקציה בקנה מידה גדול
- פזרו את מלאי הגליצרול החיידקי של pcDNA3.1-Q23-HTT-TEV-FLAG על צלחת אגר LB עם קרבניצ'ילין (100 מיקרוגרם/מ"ל). דגירה על הצלחת ב 37 מעלות צלזיוס במשך 16-24 שעות עד מושבות בודדות מופיעים.
- להרים מושבה אחת, לחסן תרבית סטרטר של 5 מ"ל במדיום עשיר שפותחה להגברת פלסמיד עם קרבניצ'ילין (100 מיקרוגרם/מ"ל), ולגדול ב-37 מעלות צלזיוס למשך 8 שעות.
- בחר ערכת טיהור פלסמידים GIGA ללא אנדוטוקסין. בצע את השלבים המתוארים במדריך של ערכת GIGA פלסמיד כדי לטהר את הפלסמיד pcDNA3.1-Q23-HTT-TEV-FLAG פלסטיד.
- מדוד את רמות האנדוטוקסין של פלסמיד באמצעות ערכת כימות אנדוטוקסין המבוססת על לימולוס אמבוציט (LAL). בצע את ההליך שצוין במדריך היצרן.
הערה: טיהור פלסמידים באיכות גבוהה וברמת אנדוטוקסין נמוכה הוא חיוני להשגת יעילות העברה טובה. באמצעות פרוטוקול זה ניתן להשיג 20-40 מ"ג של פלסמיד (צורה על-קולית >80%) לכל L של תרבית חיידקים בריכוזי פלסמיד > 4 מ"ג/מ"ל. פלסמיד מטוהר כראוי צריך להיות בעל רמת אנדוטוקסין < 30 EU/mg. OD260/280 הנע בין 1.8 ל-2.0 נצפה בדרך כלל.
4. טרנספקציה בקנה מידה גדול של 2 ליטר של תאי HEK293 על ידי פוליאתילנימין (PEI)
- הוסיפו 1 גרם של PEI 25K עד 1 ליטר מים נטולי אנדוטוקסין תוך ערבוב. התאימו את ה-pH ל-2.0 באמצעות 100 mM HCl וערבבו עד שכל ה-PEI 25K מתמוסס. התאם את ה- pH ל- 7.0 באמצעות פתרון NaOH של 100 mM וסנן דרך מסנן של 0.2 מיקרומטר. Aliquot ולאחסן ב -20 °C (75 °F) עד שנה.
הערה: ניתן לשמור על Aliquots של PEI בטמפרטורה של 4 מעלות צלזיוס למשך עד שבועיים, אך לעולם אין להקפיא אותם מחדש לאחר ההפשרה. - להפיץ תאי HEK293 במדיום הגדילה (ראו טבלת חומרים) בתוספת פניצילין-סטרפטומיצין (ריכוז סופי של 5 U/mL לפניצילין ו-5 מיקרוגרם/מ"ל לסטרפטומיצין) באינקובטור שייקר לח בטמפרטורה של 37 מעלות צלזיוס, 90 סל"ד, 5% CO2 למשך 18-24 שעות. לדלל את התאים ל-2 ליטר בצפיפות של ~1.2 × 106 תאים /מ"ל באמצעות מדיום הגידול ב-5 L Erlenmeyer צלוחיות יום אחד לפני ההעברה.
- המשך לגדל את התאים ב 37 מעלות צלזיוס, 90 סל"ד, 5% CO2 במשך 18-24 שעות. מדוד את פרמטרי התא באמצעות מונה תאים אוטומטי המסוגל למדוד את צפיפות התאים ואת הכדאיות שלהם בהתאם למדריך למשתמש.
הערה: צפיפות התאים צריכה להכפיל את עצמה, והכדאיות צריכה להיות >95%. צפיפות התאים לפני הטרנספקציה צריכה להיות בערך 2.0 × 10 6-2.4 × 106 תאים למ"ל. יש לדלל את התאים לצפיפות הרצויה לפני ההעברה בעת הצורך. - חשב את כמויות הפלסמיד וה- PEI הנדרשות לביצוע ההעברה; השתמש 1 מ"ג של פלסמיד ו 3 מ"ג של PEI עבור transfection של כל ליטר של תרבית תאים. הקצו 2 מ"ג פלסמיד ו-6 מ"ג PEI הדרושים להעברה של 2 ליטר.
- יש לדלל את הפלסמיד וה-PEI בנפרד לנפח של מי מלח חצובים בפוספטים השווהל-1 /20 מהנפח הכולל של תרבית התאים (100 מ"ל כל אחד להעברה של 2 ליטר) ולדגירה בטמפרטורת החדר למשך 5 דקות. מערבבים את הפלסמיד המדולל וה-PEI על ידי מערבולת עדינה ודוגרים על התערובת בטמפרטורת החדר למשך 30 דקות.
הערה: התערובת תיראה מעט מעוננת לאחר הדגירה. - מוסיפים את התערובת לתרבית התאים ומערבלים בעדינות כדי לערבב אותם.
- לגדל את התאים ב 37 מעלות צלזיוס, 5% CO2, 90 סל"ד במשך 24 שעות.
- יש להוסיף 2 M תמיסת נתרן בוטיראט לריכוז סופי של 2 mM. הוסף 1:1000 (v/v) סוכן אנטי-גוש ו-1:1000 (v/v) אנטי-פום לתרבית.
- העבירו את הבקבוקון לאינקובטור שייקר לח בטמפרטורה של 32 מעלות צלזיוס, 90 סל"ד, 5% CO2, והמשיכו לגדול במשך 48 שעות.
- מדוד את הפרמטרים של התא, כולל צפיפות תאים וכדאיות, באמצעות מונה התאים האוטומטי בהתאם למדריך למשתמש.
- העברה של 2.0 × 106 תאים (Vol = 2.0 × 106/צפיפות תאים) בצינור מיקרוצנטריפוגה. גלולו את התאים ב-2,000 × גרם למשך דקה אחת בצנטריפוגה לכתם מערבי בקטע 5.
- קציר התאים על ידי צנטריפוגה ב 2,000 × גרם במשך 30 דקות ולאחסן את כדור התא ב -80 מעלות צלזיוס לפני טיהור.
5. SDS-PAGE וכתם מערבי של ליזאט תאי HEK293 להערכת רמת הביטוי HTT
- קח אליקוט של 2.0 × 106 תאים שהוקפאו בעבר (שלב 4.11) מהטרנספקציה בקנה מידה גדול של תרבית תאים HEK293. הוסיפו 250 μL של תמיסת מלח טריס-בופר (TBS) בתוספת 50 מיקרוגרם/מ"ל דיגטונין, 5 mM EDTA וקוקטייל מעכב פרוטאז אחד, ושעו מחדש את כדור התא על ידי שאיפה מספר פעמים באמצעות פיפטה.
- סובב את הצינורות בעדינות במשך 30 דקות ב 4 מעלות צלזיוס באמצעות מינירוטטור כדי lyse את התאים. גלולה את החומר הבלתי מסיס על ידי צנטריפוגה ב 17,000 × גרם במשך 5 דקות.
- יש להוסיף 1/3מהנפח של חיץ העמסת ליתיום דודצילסולפט (LDS) מפחית פי 4 לסופרנטנט ולחמם ב-70°C למשך 10 דקות.
- טען 5-20 μL של ליזאט תאים על ג'ל PAGE תלת-אצטט 3-8% משודר מראש. באמצעות מאגר הריצה 1x Tris-acetate SDS התואם לג'ל, הפעל את הג'ל במצב מתח קבוע ב- 150 V למשך 60 דקות.
הערה: Tris-acetate SDS-PAGE שימש לניתוח FL HTT מכיוון שהוא מייצר רזולוציה גבוהה יותר מאשר סוגים אחרים של SDS-PAGE עבור חלבונים עם משקל מולקולרי מעל 300 kDa. חלבונים ששימשו במחקר זה זמינים גם ישירות ממאגר קהילת HD במכון קוריאל (www.coriell.org/1/CHDI); ראה את טבלת החומרים. - כדי לבצע הכתמה מערבית, הרכיבו כריך העברה באמצעות נייר העברה עבה בעל שיווי משקל, קרום פלואוריד פוליווינילידן (PVDF) המופעל על ידי מתנול וג'ל SDS-PAGE. מעבירים את החלבונים לקרום ה-PVDF באמצעות כתם מערבי חצי יבש על פי המדריך למשתמש של היצרן.
הערה: בדרך כלל, 20-30 דקות ב-135 mA מספיקות לממברנה בגודל 10 ס"מ על 10 ס"מ. - יש לפרק את כריך ההעברה ולחסום את הממברנה ב-TBST (20 mM Tris pH 7.4, 150 mM NaCl ו-0.1% v/v Tween-20) בתוספת 5% חלב ללא שומן.
- דגירה של הממברנה על נדנדה למשך שעה אחת בטמפרטורת החדר עם 15 מ"ל של נוגדן ראשוני (דילול של 1:2,500 עבור נוגדן חד שבטי נגד FLAG ונוגדן 1:2,000 עבור כל הנוגדנים הראשוניים האחרים).
הערה: נוגדנים עיקריים ששימשו במחקר זה הם אנטי-דגל M2, MAB5492, MAB5490, MAB2166, MAB3E10, MAB4E10, MAB2168, MAB8A4 (ראה טבלת החומרים). - לשטוף את הממברנה 3 x 5 דקות באמצעות 30-50 מ"ל של TBST.
- דגירה של הממברנה על נדנדה עם נוגדן IgG משני של עז מצומדת צבע פלואורסצנטי נגד עכברים ב-1:15,000, בטמפרטורת החדר, ב-15 מ"ל של TBST המכיל 5% חלב יבש w/v.
- דמיינו את רצועות הכתמים המערביות על מדמיין פלואורסצנטי באמצעות אורך הגל הספציפי לנוגדן המשני. כמותיות אות הרצועה באמצעות התוכנה המלווה את התמונה לפי מדריך המשתמש.
הערה: ניתן לבצע כתם מערבי כמותי באמצעות HTT מטוהר כסטנדרט. טווח סטנדרטי ליניארי של HTT הוא ספציפי למכשיר והוקם במעבדה זו מ-25 ננוגרם ל-250 ננוגרם של HTT לכל נתיב באמצעות נוגדן אנטי-FLAG. הכתם המערבי של HTT צריך להיות נקי מהשפלה; רמת ביטוי HTT כוללת של 2-4 pg/cell נצפית בדרך כלל. עיין בפרוטוקול32 שפורסם בעבר לקבלת פרטים על אופן ביצוע כתם מערבי כמותי.
6. טיהור מהיר של כרומטוגרפיה נוזלית של חלבון (FPLC) של HTT באמצעות עמודה נגד FLAG ו- SEC
- טיהור נגד דגלים
- הערך את כמות שרף FLAG הדרושה לטיהור (בדרך כלל, 12 מ"ל של שרף זיקה נגד FLAG M2 לטיהור של 2-4 ליטר של תרבית תאים מותמרים). ארוז 12-25 מ"ל של שרף נגד FLAG על עמודה ריקה (ראה טבלת חומרים) באמצעות FPLC בקצב זרימה של 4 מ"ל/דקה באמצעות מאגר A (טבלה 1). התאם את גובה הבוכנה, כך שלא יהיה רווח בין קצה הבוכנה לבין מצע השרף.
- באמצעות יחס של 10 מ"ל של Lysis Buffer לכל 1 גרם של כדורית תא, הפשיר והשהה את כדור התא במאגר Lysis קר (טבלה 1).
- מעבירים את תרחיף התא פעם אחת דרך הומוגנייזר בעל גזירה גבוהה ב-10,000 psi. הבהירו את הליזאט על ידי צנטריפוגה ב-20,000 × גרם למשך שעה אחת בצנטריפוגה המצוידת ברוטור תואם בעל זווית קבועה.
- תכנת את ה- FPLC (עיין בטבלת החומרים עבור התוכנה המשמשת במחקר) והפעל את הרצפים הבאים.
- טען את הליזאט המובהר באמצעות משאבת הדגימה.
- יש לשטוף ב-4 עמודות (CVs) של מאגר A (טבלה 1).
- יש לשטוף עם 4 קורות חיים של מאגר B (טבלה 1).
- יש לשטוף עם 8 קורות חיים של מאגר C (טבלה 1).
- יש לשטוף עם 3 קורות חיים של חיץ D (טבלה 1).
- יש לשטוף עם 3 קורות חיים של מאגר אלוציון (טבלה 1).
- נתח 10 μL של שברי השיא באמצעות SDS-PAGE. אסוף ושלב את שברי השיא עם הטוהר הרצוי. שמור ~ 50 μL של eluates המשולב לניתוח SDS-PAGE.
הערה: בדרך כלל, יופיע שיא יחיד, וכל השברים המוזכרים בשיא מכילים ~ 90% HTT טהור. - צור מחדש עמודה נגד FLAG באמצעות 5 קורות חיים של מאגר התחדשות (טבלה 1) ושיווי משקל מחדש של העמודה באמצעות 5 קורות חיים של מאגר A.
הערה: ניתן לעשות שימוש חוזר בשרף Anti-FLAG עד חמש פעמים או עד שהתפוקה היחסית/ליטר יורדת ל-50% מהטיהור הראשון.
- טיהור עמודת אי הכללת גודל (SEC) באמצעות עמודת SEC
- Preequilibated עמודת SEC המאפשרת הפרדה של חלבונים בעלי משקל מולקולרי (MW) > 500 kDa (ראה טבלת חומרים עבור העמודה שבה נעשה שימוש) באמצעות 2 × CV של SEC Buffer (טבלה 1).
- טען ישירות את ה-anti-FLAG eluate (משלב 6.1.5) באמצעות סופרלופ של 50 מ"ל. הפעל 1.2 קורות חיים × של מאגר SEC לכל זריקה. הפעל את הפרדת ה- SEC למשך הלילה ב- 4 ° C.
הערה: ניתן לטעון עד 5 מ"ל או 15 מ"ל של דגימת חלבון על עמודות ה-SEC שנבחרו במחקר זה. תכנת את ה- FPLC כך שניתן יהיה לבצע הזרקות מרובות באופן אוטומטי. סקריפטים של שיטות לדוגמה כלולים גם כקובץ משלים 1 וקובץ משלים 2. - השווה את פרופיל האלוציה לפרופיל האלוציה הסטנדרטי של HTT כדי להבחין בין פסגות מונומר, דימר ואוליגומריים בעלי סדר גבוה יותר. מאגר את שברי ה- HTT המונומריים בהתבסס על פרופיל ה- elution של עמודת ה- SEC. אם תרצה, איחד בנפרד את שברי ה-HTT האוליגומריים והדימריים בעלי הסדר הגבוה יותר.
- רכז את חלבון ה-HTT במאגר באמצעות רכז צנטריפוגלי של 100 kDa בטמפרטורה של 4 מעלות צלזיוס. חשב את ריכוזי החלבונים על ידי חלוקת ערכי OD280 שלהם במקדמי ההכחדה המתאימים (מקדמי ההכחדה התיאורטיים של Q23-HTT, Q48-HTT, Q73-HTT ו- ΔExon1-HTT הם 0.776, 0.769, 0.762 ו- 0.798 (מ"ג / מ"ל)-1 ס"מ-1, בהתאמה, לצורך החישוב). שמור על ריכוז HTT ≤ 1.0 מ"ג / מ"ל.
הערה: חיוני לעקוב אחר תהליך הריכוז מכיוון שריכוז יתר יגרום לצבירה. - Aliquot חלבון HTT מטוהר בצינורות microcentrifuge בטוח קריו בנפח < 100 μL. הבזק להקפיא את aliquots באמצעות חנקן נוזלי ולאחסן אותם ב -80 °C.
7. HPLC SEC-MALS-dRI אנליטי לניתוח פולידיספרסיות HTT
- בצע את כל ה- SEC-MALS האנליטי ב- 4 °C במערכת כרומטוגרפיה נוזלית (HPLC) בעלת ביצועים גבוהים בשילוב עם גלאי UV, גלאי פיזור אור רב-זוויתי וגלאי אינדקס שבירה דיפרנציאלי (dRI).
- לפני חיבור עמודת UHPLC למערכת, נקה את המשאבה ואת הגלאים במים מסוננים (0.1 מיקרומטר) ברמת HPLC.
- חבר את עמודת UHPLC (עיין בטבלת החומרים של העמודה שבה נעשה שימוש) למערכת. שיווי משקל העמודה עם מים מסוננים (0.1 מיקרומטר) ולאחר מכן מאגר SEC-MALS (טבלה 1) עד שכל אותות הגלאי מגיעים לנקודת ההתחלה.
- להזריק 2 μL של אלבומין בסרום בקר (BSA) של 6 מ"ג/מ"ל (BSA) בקצב זרימה של 0.3 מ"ל/דקה למשך 15 דקות לכל זריקה ולבדוק את איכות הנתונים. בצע נורמליזציה, יישור שיא ותיקון הרחבת פס בהתבסס על פרופיל BSA, וצור תבנית עבור הריצות הבאות של דוגמת HTT.
- הפשיר במהירות בקבוקון של דגימת FL Q23-HTT באמבט מים בטמפרטורת החדר באמצעות מצוף. סנן את ה-HTT דרך מסנן ספין של 0.1 מיקרומטר. הזריקו 2-4 מיקרון של דגימת HTT ופעלו במשך 15 דקות ב-4 מעלות צלזיוס בקצב זרימה של 0.3 מ"ל/דקה.
- נתח את הנתונים הכרומטוגרפיים ונתוני פיזור האור באמצעות התוכנה הנלווית (ראה טבלת החומרים). השתמש בגלאי dRI כגלאי ריכוז והשתמש ב- 0.185 כתוספת מקדם השבירה (dn/dc) עבור HTT. צור עלילת Zimm כדי לקבוע את המסה המולקולרית הממוצעת במשקל עבור כלשיא 33,34.
הערה: תוספת מקדם השבירה של HTT מחושבת כ- 0.185 באמצעות תוכנת SEDFIT35 של התוכנית ורצף חומצות האמינו העיקריות של HTT כקלט.
הערה: מונומר HTT MW נקבע על ידי SEC-MALS ב ~ 370 kDa ± 30 kDa. HTT מטוהר בדרך כלל יש תוכן מונומר בין 60 ל 75% (במעבדה זו). תוכן מונומר נמוך עשוי להצביע על כך שיש לנקוט משנה זהירות בטיפול כדי למנוע צבירה.
8. דף מקורי כחול לניתוח פולידיספרסיות HTT
- הכן 1 ליטר של מאגר אנודה על ידי ערבוב 50 מ"ל של 20x מאגר ריצה של דף מקורי כחול (ראה טבלת חומרים) עם 950 מ"ל של H 2 O. הכן 2ליטר של חיץ קתודי כחול כהה על ידי ערבוב 100 מ"ל של 20x מאגר ריצה של דף מקורי כחול ו-100 מ"ל של תוסף קתודי PAGE כחול מקורי (20x) עם 1,800 מ"ל של H2O. צנן את המאגרים ל-4 מעלות צלזיוס לפני השימוש.
- הפשיר במהירות בקבוקון של דגימת FL Q23-HTT באמבט מים בטמפרטורת החדר באמצעות מצוף. יש לשמור את החלבון המופשר על הקרח לפני השימוש.
- יש לערבב 5 מיקרוגרם של FL Q23-HTT (~1 מ"ג/מ"ל), 1 μL של תוסף G250 של 0.5%, 2.5 μL של 4x מאגר דגימת Blue Native PAGE, ומים כדי להביא את הנפח הסופי ל-10 μL.
- טען את דגימת FL Q23-HTT המעורבת על ג'ל Bis-Tris משונן מראש של 3-12%. העמיסו 7.5 מיקרון של תקן החלבון הלא מוכתם באותו ג'ל כמו התקן.
- מלא את החלק הקדמי של הטנק עם חיץ קתודה כחול כהה ואת החלק האחורי של הטנק עם חיץ אנודה.
הערה: מלא את המאגרים לאחר טעינת הדגימה כדי לאפשר תצוגה חזותית קלה בעת טעינת הדגימות. - הפעל את הג'ל ב 150 V במשך 120 דקות בחדר קר.
- הרטיבו את הג'ל עם תמיסת Destaining (טבלה 1) עד לצפייה בפסים; מעבירים את הג'ל למים. דמיינו ותעדו את הג'ל בתחנת הדמיה.
הערה: Blue Native PAGE תוכנן במקור לניתוח חלבוני ממברנה. הוא הותאם במעבדה זו כשיטה חלופית להערכת התוכן המונומרי של HTT. הוא נקשר לאזורים ההידרופוביים של HTT ומונע ממנו ליצור אגרגטים בתנאי חיץ ללא חומר ניקוי. דף מקורי מסורתי ללא שימוש ב-Coomassie blue G250 גורם ל-HTT ליצור אוליגומרים ואגרגטים מסיסים, ככל הנראה בשל הכיסים ההידרופוביים הרבים הקיימים ב-HTT.
9. דף SDS ואחריו Coomassie או כתם כסף כדי לנתח טוהר HTT
- הוסף מאגר דגימת LDS פי 4 ומגיב מפחית פי 10 ל-FL Q23-HTT מטוהר כדי שהריכוז הסופי של מאגר הטעינה והפחתת הריאגנטים יהיה פי 1.
- מחממים את הדגימה על בלוק חימום יבש בטמפרטורה של 70°C למשך 10 דקות.
- יש לטעון עד 1 מיקרוגרם חלבון לכל באר על ג'ל 3-8% טריס אצטט ולהפעיל ב-150 וולט למשך שעה אחת באמצעות מאגר ריצה Tris-acetate SDS.
הערה: חלבונים ששימשו במחקר זה זמינים גם ישירות ממאגר קהילת HD במכון קוריאל (www.coriell.org/1/CHDI); ראה את טבלת החומרים. - כתם קומאסי
- לשטוף את הג'ל עם H2O במשך 5 דקות.
- הכתימו את הג'ל בתמיסת הצביעה של Coomassie (טבלה 1) על ידי נדנדת הג'ל ב-30 מ"ל של תמיסת צביעה למשך 15 דקות.
- הסר את הכתמים על ידי נדנדת הג'ל ב-50 מ"ל של H2O למשך 5 דקות. דמיינו ותעדו את הג'ל המוכתם בקומסי בתחנת הדמיה.
- כתם כסף באמצעות ערכת כתמי כסף מסחרית.
- לאחר SDS-PAGE, תקן את הג'ל באמצעות פתרון תיקון (טבלה 1) למשך שעה עד לילה בטמפרטורת החדר.
- יש לבצע את הכתם, לכבס ולפתח בהתאם להוראות הערכה.
- עצור את שלב הפיתוח מיד ברגע שהרצועות מגיעות לעוצמה הרצויה.
- תעדו את הג'ל במערכת תיעוד ג'ל המצוידת במקור אור נראה.
הערה: HTT מטוהר ב >95% ניתן לזהות על ידי Coomassie והכתמת כסף עם פרוטוקול זה. עיין בפרוטוקול32 שפורסם בעבר לקבלת פרטים על אופן ביצוע ניתוח חלבונים כמותי.
תוצאות
וקטור ביטוי חולף (pcDNA3.1-Q23-HTT-TEV-FLAG, איור 1A) מתוכנן לייצור מהיר בתאי יונקים של FL Q23-HTT (aa 1-3,144, בהתבסס על מספור Q23). מבנה זה כולל את התכונות שנועדו ליצור במהירות מבנים שונים של מוטציות HTT על ידי שיבוט קלטות, להקל על טיהור חלבון HTT לאיכות גבוהה והומוגניות עם צעדים כרומטוגרפיים מינימליים, ויש להם אפשרות לייצר FL HTT לא מתויג. רשימת התכונות כוללת 1. ניתן להשתמש באתרי עיכול ההגבלה של HindIII, המקיפים את חזרת CAG באקסון HTT 1, כדי ליצור מוטנטים של FL HTT עם מתיחה polyQ באורכים שונים על ידי עיכול וקשירת אנזים הגבלה; 2. הקצה C-terminal של FL HTT מתויג עם אפיטופ FLAG עם אתר זיהוי פרוטאז TEV לטיהור זיקה שלב אחד של FL HTT עם טוהר גבוה ויצירה אופציונלית של חלבון FL HTT ללא תגים באמצעות מחשוף פרוטאז TEV; 3. רצף FL HTT ממוטב לקודון לשימוש בקודון תאים אנושיים לביטוי ברמה גבוהה בתאי HEK293. וקטור pcDNA 3.1 (+) משמש כעמוד השדרה של המבנה כדי לנצל את פעילות ההפעלה השעתוק הגבוהה של מקדם ה-CMV בקווי תאים של יונקים.
באמצעות שימוש ב-pcDNA3.1-Q23-HTT-TEV-FLAG כתבנית ההתחלה, המבנים Q48 ו-Q73 FL HTT הופקו על-ידי סינתזה של מקטעי דנ"א באורך Q מתאים המשתרעים על פני שני אתרי אנזימי הגבלה HindIII והחלפת אותו אזור בתבנית. המוטציה ΔExon1 של FL HTT (aa 91-3,144) (איור 1B) הופקה באמצעות פריימרים המכוונים לשאריות שנמחקו המשתרעות על פני אזור אקסון 1 בתבנית. תאי HEK293 שעברו טרנספקציה עם pcDNA3.1-Q23-HTT-TEV-FLAG באמצעות PEI גודלו בבקבוקי שייקר בנפח 5 ליטר מתחת ל-5% CO2. טיהור טיפוסי בקנה מידה גדול משתמש בכדור תאים 2-10 L המכיל 6.0 × 10 9-3.0 × 1010 תאים. לפני שממשיכים לטיהור, רמת הביטוי של HTT מכל טרנספקציה הוערכה על ידי כתם מערבי כמותי באמצעות HTT רקומביננטי מטוהר המתויג כ- FLAG כנוגדן סטנדרטי ונוגדן אנטי FLAG כנוגדן הראשון. כדורים עם רמת ביטוי HTT מוערכת של ≥2 pg HTT / תא שימשו לטיהור.
טיהור של FL HTT מורכב מתהליך עמודה בן שני שלבים, תחילה עם טיהור זיקה נגד FLAG ולאחר מכן עם SEC על עמודת סינון ג'ל עם טווח הפרדה מתאים ל-HTT (איור 2A; ראו טבלת חומרים לדוגמה). לאחר שני השלבים, HTT הושג בטוהר מדגם של >95%, כפי שנקבע על ידי SDS-PAGE עם כחול Coomassie ותוכן מונומר של >65% המבוסס על SEC-MALS אנליטי. מכיוון שגם לזמן טיהור ממושך וגם לטמפרטורה יש השפעה שלילית על תוכן המונומר הסופי של HTT, נעשה שימוש ב-FPLC בשני שלבי הטיהור כדי למזער את הטיפול ולהשיג איכות דגימה עקבית. המזהם העיקרי במהלך הטיהור נגד FLAG היה המלווה Hsp70 כפי שנקבע על ידי ספקטרומטריית מסות (איור 2B, נתיב 2). זה עולה בקנה אחד עם הממצא כי Hsp70 מטוהר בשיתוף עם FL HTT המתבטא ביציבות בקווי תאים אנושיים24, מה שמרמז על כך ש- Hsp70 עשוי להיות מייצב נפוץ עבור FL HTT in vivo.
ניתן לסלק את זיהום Hsp70 על-ידי שטיפה נרחבת עם מגנזיום כלוריד ו-ATP במהלך שלב טיהור הזיקה נגד FLAG (איור 2B, נתיב 1). עם הסרת Hsp70, FL HTT נוטה ליצור אוליגומרים בעלי סדר גבוה יותר24 ויש לשמור עליו בריכוז ≤ 1 מ"ג/מ"ל. שלב הריכוז לפני SEC יכול לעתים קרובות לגרום לצבירה משמעותית. לכן, השיטה הטובה ביותר היא לטעון ישירות שברי שיא מטיהור אנטי-FLAG לעמודת אי הכללת הגודל מבלי להתרכז. לאחר SEC, הדגימה רוכזה ל-≤1 מ"ג/מ"ל להתאוששות מרבית של FL HTT מונומרי. כמות ה-HTT שהתאוששה מכל שלב טיהור הוערכה על ידי כתם כחול של Coomassie או כתם מערבי כמותי באמצעות FL HTT מטוהר כתקן כימות (טבלה 2). התפוקה האופיינית של חלבוני FL HTT מטוהרים המיוצרים בשיטה המתוארת היא כ-1 מ"ג/ליטר של תרבית תאים, אך היא עשויה לרדת הרבה מתחת לזו (טבלה 3) עקב השתנות אצווה לאצווה, או אם נעשה שימוש חוזר בשרף הטיהור נגד FLAG מספר פעמים.
ביטוי יתר של FL HTT יכול לגרום לפיצול של החלבון22. FL Q23-HTT המיוצר על ידי השיטה המתוארת כאן נפתר כפס יחיד עם MW הנכון של 350 kDa על ידי SDS PAGE, מוכתם על ידי Coomassie G250 או על ידי צביעת כסף (איור 2C). על ידי כתם מערבי, FL Q23-HTT הגיב עם נוגדנים שגודלו כנגד אפיטופים בטרמינל N, במסוף C ובכמה תחומי ביניים, ללא פסים נוספים הקשורים לשברים, מה שמצביע על כך שהחלבון בודד ללא חתכים משמעותיים הניתנים לזיהוי (איור 3A). גרסאות אורך הפוליQ של FL HTT Q23, Q48 ו-Q73 הגיבו כצפוי בכתם המערבי, והראו אות חזק יותר ויותר עבור mAb MW1 מכוון polyQ בקורלציה עם הגדלת אורך Q: Q23-HTT < Q48-HTT < Q73-HTT (איור 3B). לא נצפה אות עבור ΔExon1-HTT (aa 91-3,144) כאשר נחקר עם הנוגדנים MW1 ו-MAB549, המכוונים לאקסון מסוף N 1 (איור 3B).
SEC-MALS שימש לניתוח מצב הצבירה והמסה המולקולרית של חלבון HTT מטוהר. הדגימות נותחו על ידי SEC אנליטית המנוטרת על ידי גלאי UV, MALS ו- dRI. המסה הטוחנת המוחלטת המתקבלת מ- SEC-MALS אינה תלויה בצורת המולקולות33,34; לכן, SEC-MALS מספק הערכה בלתי משוחדת של MW עבור שברים מונומריים ואוליגומריים כאשר הם מופרדים היטב. מבין עמודות ה-HPLC שנבדקו, עמודת ה-SEC (ראו טבלת החומרים) הראתה רזולוציה מספקת בין מונומר HTT לדימר, כך שניתן יהיה להבחין בין מסות טוחנות (איור 4). ריכוז החלבון נקבע על ידי זיהוי dRI. דרגות מקדם השבירה (dn/dc) של FL HTT הן 0.1853 מ"ל/גרם כפי שחושב על ידי תוכנת SEDFIT35. דפוסי אלוטיון SEC אנליטיים דומים נצפו עבור ΔExon1 HTT (91-3,144), FL Q23, Q48 ו-Q73 HTT (1-3,144), שכל אחד מהם מורכב מפסגת מונומר גדולה עם פסגות דימריות ואוליגומריות קלות (טבלה 4). MW המחושב עבור הצורה המונומרית גדול יותר מה- MW התיאורטי. זה נגרם ככל הנראה על ידי מינים חופפים מפסגות אוליגומריות מסודרות יותר וטעויות הנובעות מאותות dRI חלשים מכיוון שחלבוני HTT נשמרים בריכוז נמוך כדי למנוע יצירת אוליגומרים בעלי סדר גבוה יותר. על ידי שילוב פסגות UV של מספר קבוצות של גרסאות FL HTT מטוהרות, לא נצפה מתאם ברור בין אורך polyQ לפרופיל המצטבר (טבלה 4).
בנוסף ל- SEC האנליטי, בוצע PAGE מקורי מסורתי כדי לקבוע אם ניתן להשתמש בו כשיטה משלימה לאפיון המצב האוליגומרי FL HTT. אוליגומרים בעלי סדר גבוה יותר נפתרו באמצעות 3-8% ג'ל טריס-אצטט באמצעות חיץ מקומי ללא חומר ניקוי. FL HTT מטוהר מ-SEC הראה מספר פסים המתאימים למצבי האוליגומריזציה (איור 5A). הפס הנמוך ביותר היה ממוקם בין סמן מקומי 480 kDa ו 720 kDa, בדומה לתוצאות קודמות שדווחו עבור FL HTT מטוהרים מתאי חרקים22. עם זאת, מונומר HTT לא היה הפס הנפוץ ביותר בעת שימוש ב- PAGE מקורי מסורתי, והתוצאות אינן מתואמות עם פרופיל הצבירה שנקבע על ידי SEC-MALS אנליטי. מספר טלאים הידרופוביים הקיימים ב-FL HTT36,37,38, במיוחד הממשק ההידרופובי בין HAP40 ל-FL HTT25, עשויים לתרום להיווצרותם של אוליגומרים בעלי סדר גבוה יותר במהלך הנדידה בתוך הג'ל. הסיבה לכך היא שאזורים הידרופוביים ידועים כמתקשרים זה עם זה בהיעדר אינטראקציות של חומרי ניקוי או ייצוב חלבון-חלבון. בהתאם לתכונות ההידרופוביות של HTT, FL HTT יוצר כמויות הולכות וגדלות של שברים אוליגומריים מסודרים יותר בהיעדר CHAPS במהלך שלב הטיהור של ה- SEC.
Blue Native PAGE, הנמצא בשימוש נרחב לחקר חלבוני ממברנה וקומפלקסים חלבוניים גדולים המכילים טלאים הידרופוביים39, הושווה ל-PAGE המקורי המסורתי. HTT מטוהר הראה שלושה פסים עיקריים ב-Blue Native PAGE עם MW מוערך של 643, 927 ו-1070 kDa (איור 5B) שככל הנראה מייצגים את המינים המונומריים, הדימריים והטרימריים של HTT, בהתאמה. להקת המונומרים נותרה הלהקה הנפוצה ביותר ב-Blue Native PAGE, והתאימה היטב לפרופיל האנליטי של אותן דגימות. הערכת היתר של MW של מונומר HTT על ידי Blue Native PAGE עשויה לנבוע מהמבנה הכדורי החלול הייחודי או מהאזורים ההידרופוביים של HTT הגורמים להגירה איטית יותר ביחס לסמני המשקל המולקולריים המתאימים 11,23,25. באופן כללי, ל-FL Q23-HTT, FL Q48-HTT, FL Q73-HTT ו-ΔExon1-HTT יש פרופילים דומים של Blue Native PAGE עם הבדלים קלים בלבד בנדידת פס החלבון בשל הבדלי המשקל המולקולרי שלהם.
כבדיקה נוספת של איכות החלבונים המטוהרים, ניתן להסיר את תג הדגל של מסוף C מ- FL HTT על ידי טיפול בפרוטאז TEV. לאחר ביקוע פרוטאוליטי, דגימות נותחו על ידי כתם מערבי באמצעות ארבעה נוגדנים כדי לאשר הסרת תג FLAG ולזהות השפלה של HTT. תגובתיות חיסונית לאנטי-FLAG M2 ושלושה נוגדנים ספציפיים להאנטינגטון עם אפיטופים ל-N-terminus, לתחומי הביניים ול-C-terminus של HTT הראו הסרה מוצלחת של תגי FLAG וללא מוצרי השפלה ספציפיים ל-HTT (איור משלים S1).
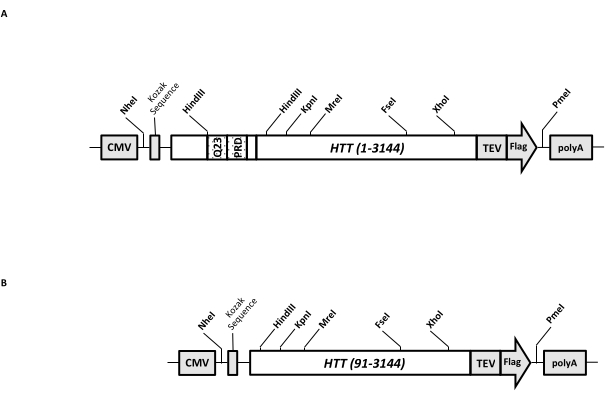
איור 1: בנייה לביטוי HTT באורך מלא. (A) Q23 HTT באורך מלא עבר אופטימיזציה לקודון ושוכפל לפלסמיד pcDNA3.1 (+). הקצה 3' של HTT תויג עם אפיטופ דגל ואתר ביקוע פרוטאז TEV כדי לייצר חלבון HTT ללא תגים. מתיחת הפוליגלוטמין והתחום העשיר בפרולין תוכננו עם אתרי אנדונוקלאז הגבלה של HindIII כדי להכניס חזרות CAG נוספות באמצעות שיבוט קלטות, כלומר, Q48 ו-Q73 , כדי לייצר גרסאות HTT עם אורכי polyQ שונים. (B) מבנה ΔExon1 נעשה מוטגנזה של PCR באמצעות pcDNA3.1-Q23-HTT כתבנית. שאריות 91-3,144 של HTT נשארו במבנה ΔExon1 לביטוי. קיצורים: HTT = הנטינגטון; CMV = ציטומגלווירוס; Q23 = מתיחת פוליגלוטמין; PRD = תחום עשיר בפרולין; TEV = אתר ביקוע וירוס טבק. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
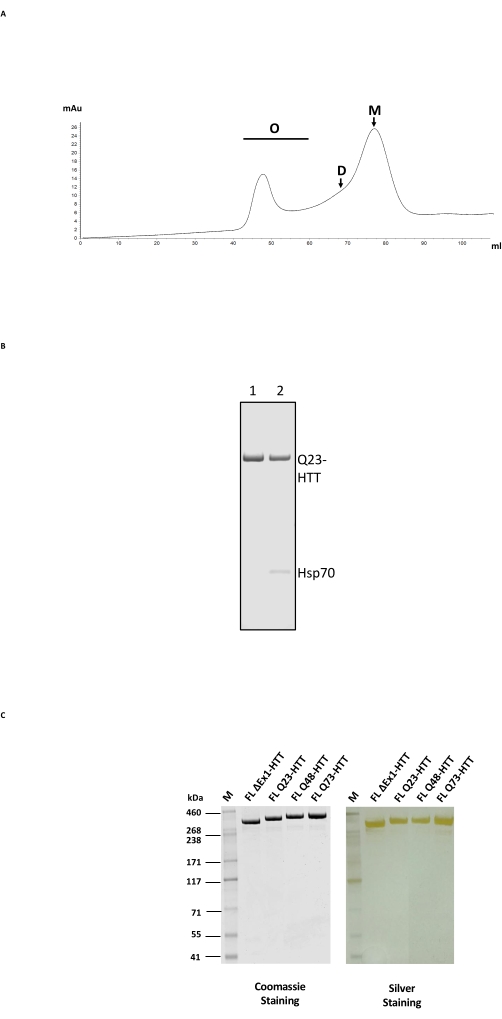
איור 2: טיהור בקנה מידה גדול של HTT . (A) פרופיל SEC של Q23-HTT באורך מלא נגד דגלים בעמודת FPLC. פסגות אוליגומרים, דימרים ומונומרים בעלי סדר גבוה של Q23-HTT מסומנים. שברים המכילים מונומר נאספו כדגימת HTT הסופית. (B) SDS-PAGE של Q23-HTT מטוהר עם שלב שטיפת ATP/מגנזיום (נתיב 1) או ללא שטיפת ATP/מגנזיום גורמת ל-Hsp70 co-elution (נתיב 2). (C) גרסאות HTT מטוהרות סופיות באורך מלא ב-SDS-PAGE מוכתמות ב-G-250 כחול של Coomassie או בכתם כסף. קיצורים: FL = אורך מלא; HTT = צידטין; SEC = כרומטוגרפיה של אי הכללת גודל; FPLC = כרומטוגרפיה נוזלית מהירה של חלבון; O = אוליגומר; D = דימר; M = מונומר; SDS-PAGE = נתרן דודצילסולפט פוליאקרילאמיד ג'ל אלקטרופורזה; Hsp70 = חלבון הלם חום 70. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
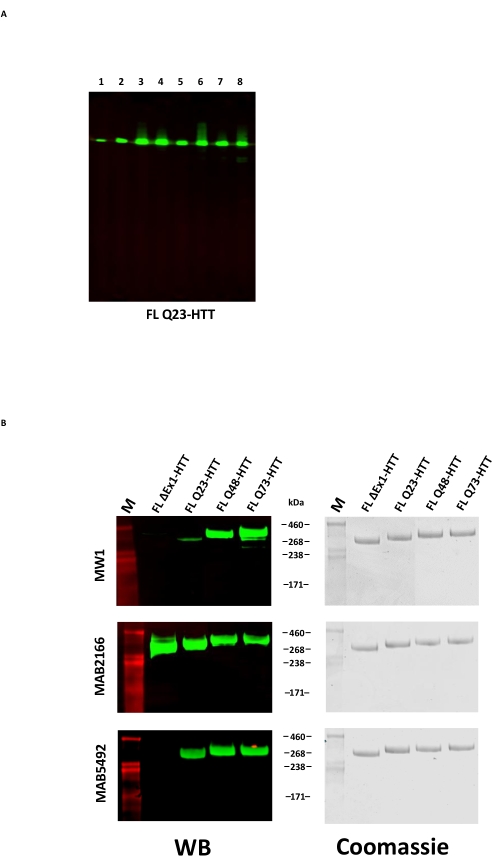
איור 3: ניתוח כתמים מערביים של גרסאות HTT מטוהרות . (A) FL Q23-HTT מטוהר הופעל על SDS-PAGE והועבר לממברנת PVDF. הנוגדנים העיקריים והאפיטופים המקיימים אינטראקציה הם נתיב 1, α-FLAG M2, תג FLAG; נתיב 2, MAB5492, HTT aa. 1-82; נתיב 3, MAB5490, HTT aa 115-129; נתיב 4, MAB2166, HTT aa 181-810; נתיב 5, MAB3E10, HTT aa 1,171-1,177; נתיב 6, MAB4E10, HTT aa 1,844-2,131; נתיב 7, MAB2168, HTT aa 2,146-2,541; נתיב 8, MAB8A4, HTT aa 2,703-2,911. (B) 1 מיקרוגרם של גרסאות FL HTT מטוהרות הופעלו על SDS-PAGE והועברו ל-PVDF (משמאל), וג'ל SDS כפול הופעל והוכתם בכחול קומאסי (מימין). הנוגדנים העיקריים והאפיטופים המקיימים אינטראקציה הם שורה 1, MW1, חזרות PolyQ מורחבות; שורה 2, MAB2166, HTT aa 181-810; שורה 3, MAB5492, HTT aa 1-82. קיצורים: FLL Q23-HTT = חלבון ציד באורך מלא המכיל 23 שאריות גלוטמין; SDS-PAGE = נתרן דודצילסולפט פוליאקרילאמיד ג'ל אלקטרופורזה; WB = כתם מערבי; M = סמן; PVDF = פוליווינילידן פלואוריד. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
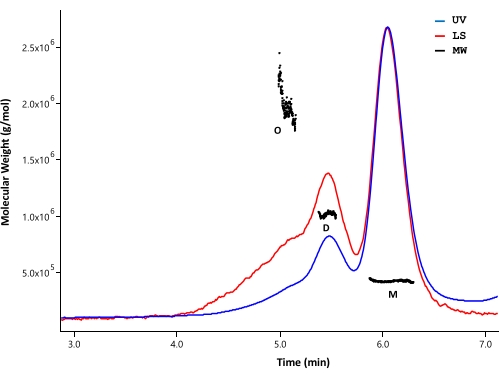
איור 4: ניתוח SEC-MALS של HTT באורך מלא. Q23-HTT מטוהר באורך מלא הוטבע על עמודת UPLC. מיקומי שיא של מונומר, דימר ואוליגומר חזויים מסומנים. המשקלים המולקולריים חושבו עבור פסגות מונומר, דימר וטרימר ופורטו בטבלה 5. פרופילי אלוציה דומים נצפים עבור Q48, Q73 ו- ΔExon1 HTT, עם תוכן משתנה של מונומר, דימר ואוליגומר בכל טיהור. קיצורים: SEC-MALS = כרומטוגרפיה של אי הכללת גודל עם פיזור אור מרובה זווית; UV = אולטרה סגול; LS = פיזור אור; MW = משקל מולקולרי; Q23-HTT = חלבון הנטנטין המכיל 23 שאריות גלוטמין; M = מונומר; D = דימר; O = אוליגומר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
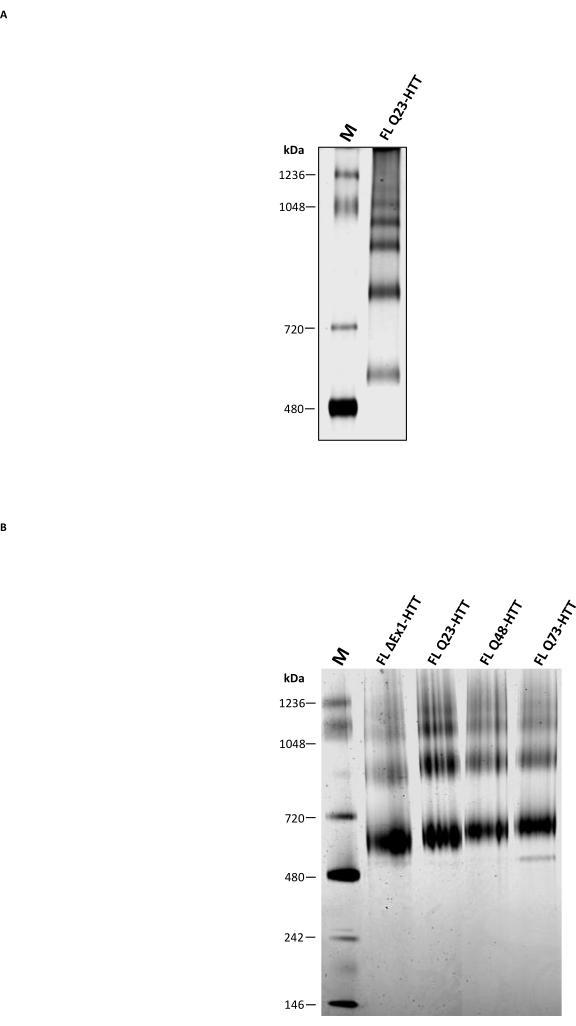
איור 5: אפיון של HTT מטוהר באמצעות ג'ל NATIVE PAGE שקוף או ג'ל PAGE מקורי כחול. סמן מקורי ו-Q23-HTT מונומרי לכאורה מ-SEC נפתרו ב-3-8% ג'לים מסוג Tris-acetate במערכת PAGE ללא דנטורציה (A) ובמערכת Blue Native PAGE (B). קיצורים: FL = אורך מלא; Q23-HTT = חלבון הנטנטין המכיל 23 שאריות גלוטמין; PAGE = אלקטרופורזה בג'ל פוליאקרילאמיד; M = סמן. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
| צעד | שם | הרכב | ||
| 6.1.1 | מאגר א' | 50 mM Tris, 500 mM NaCl, 5% v/v גליצרול, 5 mM EDTA, 0.01% v/v Tween-20, pH 8.0. | ||
| 6.1.2 | חיץ ליסיס | 50 mM Tris, 500 mM NaCl, 5% v/v גליצרול, 5 mM EDTA וקוקטייל מעכב פרוטאז אחד | ||
| 6.1.4.2 | מאגר א' | 50 mM Tris, 500 mM NaCl, 5% v/v גליצרול, 5 mM EDTA, 0.01% v/v Tween-20, pH 8.0. | ||
| 6.1.4.3 | מאגר ב' | 50 מ"מ טריס; 500 mM KCl; 5 מ"מ MgCl2; 5% v/v גליצרול; 0.01% v/v Tween-20, pH 8.0 | ||
| 6.1.4.4 | מאגר C | 20 מ"מ טריס; 200 mM KCl; 5 מ"מ MgCl2; 5 mM ATP; 0.01% v/v Tween-20; 5% v/v גליצרול, pH 8.0 | ||
| 6.1.4.5 | מאגר D | 50 מ"מ טריס; 500 mM NaCl; 5% v/v גליצרול; 5 mM EDTA; 0.5% עם מסך שטוח, pH 8.0 | ||
| 6.1.4.6 | מאגר אלוציון | 50 מ"מ טריס; 500 mM NaCl; 5% v/v גליצרול; 0.5% עם צ'אפס; 0.2 מ"ג/מ"ל פפטיד DYKDDDDK, pH 8.0 | ||
| 6.1.6 | מאגר התחדשות | 0.1 M גליצין הידרוכלוריד, pH 3.5; 0.01% v/v טווין-20 | ||
| 6.2.1 | מאגר SEC | 50 mM Tris, 500 mM NaCl, 5% v/v גליצרול, 0.5% עם CHAPS של v/v, 1 mM TCEP | ||
| 7.3 | מאגר SEC-MALS | 50 mM HEPES, pH 7.2, 500 mM NaCl, 5% v/v גליצרול, 0.5% עם CHAPS | ||
| 8.7 | פתרון מעכב | 40% v/v מתנול ו-7% v/v חומצה אצטית | ||
| 9.4.2 | פתרון צביעה של קומאסי | 0.01% עם קומאסי G250, 50% נגד נגד ונגד מתנול, 10% נגד v חומצה אצטית | ||
| 9.5.1 | פתרון תיקון | 50% מתנול v/v, 10% v/v חומצה אצטית, 50 μL של פורמלדהיד / 100 מ"ל של תמיסה | ||
טבלה 1: הרכב המאגרים והפתרונות
| שלבים | ריכוז HTT (מ"ג/מ"ל) | נפח כולל (mL) | תוכן HTT (מ"ג) | תפוקת HTT לתא (pg/תא) | % תשואה |
| סופרנטנט | 0.1792 | 220 | 39.4 | 4.4 | 100 |
| אנטי-דגל | 1.524 | 8.6 | 13.1 | 1.47 | 33.4 |
| שניה | 0.91 | 3.9 | 3.54 | 0.4 | 9.1 |
טבלה 2: תפוקת HTT מכדור 2 L HEK293 המומר עם pcDNA3.1-Q23-HTT-TEV-Flag. קיצורים: FL Q23-HTT = חלבון הנטינגטון באורך מלא המכיל 23 שאריות גלוטמין; TEV = אתר ביקוע וירוס טבק; SEC = כרומטוגרפיה של אי הכללת גודל.
| דוגמת HTT | תפוקת HTT (מ"ג/ל') | טוהר ממוצע (%) | ||
| חומצות אמינו מסועפות שרשרת | א280 | |||
| 1 | FL DEx1-HTT (N=3) | 0.67-1.30 | 0.69-1.18 | 99.3 |
| 2 | FL Q23-HTT (N=3) | 0.25-0.92 | 0.28-0.98 | 96.9 |
| 3 | FL Q48-HTT (N=3) | 0.28-1.15 | 0.38-1.16 | 97.4 |
| 4 | FL Q73-HTT (N=3) | 0.58-1.05 | 0.57-0.97 | 98.8 |
טבלה 3: סיכום תפוקת החלבון של ארבעה טיהורים בגרסאות FL HTT והטוהר הסופי שלהם. קיצור: FLL HTT = חלבון ציד באורך מלא.
| דוגמת HTT | A | D | M |
| FL Q23-HTT | 4.2-6.9% | 18.7-29.3% | 66.5-76.0% |
| FL Q48-HTT | 4.0-9.4% | 10.6-17.8% | 73.6-85.4% |
| FL Q73-HTT | 2.0-14.0% | 16.9-24.6% | 65.1-81.1% |
טבלה 4: סיכום תכולת הצבירה, הדימר והמונומר המייצגים של גרסאות FL HTT מהטיהור. קיצורים: FL HTT = חלבון ציד באורך מלא; A = צבירה; D = דימר; M = מונומר; SEC = כרומטוגרפיה של אי הכללת גודל.
איור משלים S1: ניתוח כתמים מערביים בעקבות עיכול פרוטאזות TEV. FL Q23-HTT ו-FL Q48-HTT מטוהרים הופעלו על גבי SDS-PAGE, הועברו לממברנות PVDF ונותחו על ידי כתמים מערביים בעקבות תקציר TEV. נוגדנים עיקריים ששימשו היו אנטי-דגל M2 (תג דגל), MAB5492 (HTT aa 1-82), MAB3E10 (HTT aa 997-1,276) ו-MAB2168 (HTT aa 2,146-2,541). נתיב 1, תקן חלבון; נתיב 2, Q23-HTT-TEV-דגל; נתיב 3, Q48-HTT-TEV-דגל; נתיב 4, Q23-HTT-TEV-Flag מטופל בפרוטאז TEV בשעה 1:5, לילה בטמפרטורה של 4 מעלות צלזיוס; נתיב 5, Q48-HTT-TEV-Flag מטופל בפרוטאז TEV בשעה 1:5, לילה בטמפרטורה של 4 מעלות צלזיוס. קיצורים: FL HTT = חלבון ציד באורך מלא; SDS-PAGE = נתרן דודצילסולפט פוליאקרילאמיד ג'ל אלקטרופורזה; TEV = וירוס חריטת טבק; PVDF = פוליווינילידן פלואוריד. אנא לחץ כאן כדי להוריד קובץ זה.
איור משלים S2: ניתוח SEC-MALS של גרסאות FL HTT הנתונות למחזורי הפשרה בהקפאה. Q23-HTT (A) ו-Q48-HTT (B) מטוהרים הוקפאו בטמפרטורה של -80 מעלות צלזיוס והופשרו בטמפרטורת החדר עד פי 6. Q23-HTT ו-Q48-HTT לאחר ההפשרה הראשונה ומחזורי ההפשרה השישית נותחו לאחר מכן על ידי SEC-MALS. ירידה קלה בשבר מונומר ועלייה בשברים דימרים ואוליגומרים מסדר גבוה נצפו על ידי פיזור אור לאחר מחזורי הפשרה חוזרים ונשנים. מיקומי שיא של מונומר חזוי, דימר ואוליגומר מסדר גבוה מסומנים. קיצורים: FL HTT = חלבון ציד באורך מלא; O = אוליגומר; D = דימר; M = מונומר; SEC-MALS = כרומטוגרפיה של הרחקת גודל עם פיזור אור מרובה זווית. אנא לחץ כאן כדי להוריד קובץ זה.
איור משלים S3: דף SDS של גרסאות FL HTT הנתונות למחזורי הפשרה בהקפאה. Q23-HTT מטוהרים (נתיבים 2-7) ו-Q48-HTT (נתיבים 9-14) הוקפאו בטמפרטורה של -80 מעלות צלזיוס והופשרו בטמפרטורת החדר עד פי 6. Aliquots של Q23-HTT ו- Q48-HTT אוחסנו לאחר כל מחזור הפשרה בהקפאה ולאחר מכן נותחו על ידי דף SDS. לא נצפתה עלייה במוצרים המצרפיים או במוצרי ההשפלה; הדגימות נחשבו יציבות וטהורות ב->95% לפי צפיפות הפסים. קיצורים: FL HTT = חלבון ציד באורך מלא; SDS-PAGE = נתרן דודצילסולפט פוליאקרילאמיד ג'ל אלקטרופורזה. אנא לחץ כאן כדי להוריד קובץ זה.
קובץ משלים 1: FPLC 15 mL נגד דגל HTT סקריפט. קיצורים = FPLC = כרומטוגרפיה נוזלית מהירה של חלבונים; HTT = חלבון הנטינגטון. אנא לחץ כאן כדי להוריד קובץ זה.
קובץ משלים 2: FPLC SEC_MALS סקריפט HTT. קיצורים: SEC-MALS = כרומטוגרפיה של אי הכללת גודל עם פיזור אור מרובה זווית; FPLC = כרומטוגרפיה נוזלית מהירה של חלבון; HTT = חלבון הנטינגטון. אנא לחץ כאן כדי להוריד קובץ זה.
Discussion
אנו מתארים כאן שיטת טרנספקציה, ביטוי וטיהור חולפת ליצירת מבנים מרובים של חלבוני FL HTT עם טוהר והומוגניות מתאימים לשימוש כסטנדרטים לפיתוח בדיקת אימונואסאי וטרשת נפוצה, בקרות לניתוח כתמים מערביים ולמחקרי מבנה-תפקוד. שיטת ביטוי חולפת זו ניתנת להרחבה ורב-תכליתית ומאפשרת למשתמש ליצור כמויות נמוכות של מיליגרם של גרסאות FL HTT ביעילות רבה יותר מאשר שימוש בקווי תאים יציבים או בשיטות מבוססות וירוסים שתוארו קודם לכן21,22,23,24. באופן שגרתי, ניתן להפיק 2-5 מ"ג של FL HTT מטוהר מאוד מייצור חלבון בקנה מידה של 2 ליטר תוך פחות משבוע באמצעות שיטת הביטוי החולפת לאחר בניית הפלסמיד, עם תפוקה אופיינית של 1-2.5 מ"ג של FL HTT לליטר של תרבית תאים.
שיטת הביטוי החולפת המתוארת כאן מתגברת על מכשולים רבים בביטוי קווי תאים יציבים, כגון הזמן הארוך הדרוש ליצירת קווי תאים וקשיים באחסון ושמירה על קווי תאים יציבים. PEI הוא גם זול יחסית בהשוואה לריאגנטים אחרים בשוק, מה שהופך את הטרנספקציה בקנה מידה גדול לכדאית מבחינה כלכלית. יש גם מגבלות בפרוטוקול: יעילות ההעברה תלויה במידה רבה באיכות הפלסמידים, בצמיחת התאים האופטימלית ובמידת האחסון וההכנה של PEI. המפעילים צריכים לנקוט זהירות מיוחדת ולבצע בקרות איכות באותם צעדים קריטיים כדי למנוע ירידה דרסטית בתפוקת החלבון. שרף Anti-FLAG המשמש בפרוטוקול הוא גם יקר יחסית ומראה לכידה מופחתת של FL HTT לאחר מספר טיהורים והתחדשות. חוקרים מסוימים עשויים למצוא את זה מעשי יותר לעבור לתג אחר כדי לאפשר התחדשות חזקה יותר של שרף הזיקה.
קווי תאים שונים ותנאי ביטוי שונים נבדקו כדי למטב את רמות הביטוי של FL HTT. תאי HEK293 נבחרו לביטוי של FL HTT בגלל הביטוי הגבוה של חלבון וקלות הטיפול בפורמט תרבית מתלים, מה שהופך את השיטה למתאימה לביטוי בקנה מידה גדול בשייקרים או בביוריאקטורים. ניתן להשיג רמת ביטוי גבוהה יותר של חלבון FL HTT בטמפרטורות תרבותיות נמוכות יותר כגון 32 מעלות צלזיוס במקום להשתמש בטמפרטורה המקובלת של 37 מעלות צלזיוס. ייתכן שהטמפרטורה הנמוכה יותר עשויה להאט את סינתזת החלבון ולקדם קיפול נכון של FL HTT40. עם זאת, תופעה זו אינה ספציפית ל- FL HTT או לקווי התאים שנבדקו. הטמפרטורה המופחתת לאחר הטרנספקציה נמצאת בשימוש נרחב בביטוי חלבונים פרמצבטיים בתאי CHO. למרות שהמנגנון אינו מובן במלואו, ההערכה היא שטמפרטורות נמוכות עוצרות את מחזור התאים בשלב G1 ומסיטים את האנרגיה התאית לייצור חלבונים41.
HTT באורך מלא מטוהר מתאי יונקים יחד עם המלווה Hsp7024, ושלבי שטיפה של Mg-ATP יכולים להסיר את חלבון Hsp70. באופן מעניין, Hsp70 משותף לא נצפה ב-FL HTT מטוהר ממערכת ביטוי תאי חרקים21,22,23. זה עשוי לשקף הבדל ב-PTMs של FL HTT או בתגובות חלבון הלם חום לביטוי יתר של FL HTT בתאי יונקים וחרקים. לאחר הסרת החלבון הרקומביננטי מ-Hsp70, נדרשים דטרגנטים לא יוניים כגון CHAPS או DDM כדי לייצב את הצורה המונומרית של FL HTT.
מצבי האוליגומריזציה של גרסאות FL HTT נותחו באמצעות Blue Native PAGE ו- SEC-MALS. חלק קטן של HTT דימרי ואוליגומרי מסדר גבוה יותר היה נוכח כאשר נותח על ידי Blue Native PAGE או SEC-MALS. יש לציין כי נראה כי אוליגומרים בעלי סדר גבוה יותר שנוצרו על ידי FL HTT אינם מתואמים עם אורך polyQ, ואפילו מוטציית המחיקה של Exon1 מציגה יחס דומה של אוליגומר-דימר-מונומר. ההבדלים בפועל בתכולת האוליגומרים בין מבנים אלה נובעים ככל הנראה מהבדלים קלים בייצור ובטיפול בכל אצווה. בניגוד לאגרגטים וסיברילים שנוצרו על ידי HTT Exon140,41, האוליגומרים בעלי הסדר הגבוה יותר של FL HTT נותרו מסיסים וניתן היה לנתח אותם על ידי SEC ו- Native PAGE.
FL HTT מונומרי מטוהר הוא יציב יחסית בלבד. אחסון ממושך בטמפרטורה של 4 מעלות צלזיוס, דגירה קצרה בטמפרטורת החדר או ריכוזים > 1 מ"ג/מ"ל ימירו כולם FL HTT מונומרי לצורות דימריות ואוליגומריות בעלות סדר גבוה יותר למרות שלא נצפו משקעים נראים לעין בתנאים אלה. FL HTT מונומרי מטוהר שנשמר ב-≤1 מ"ג/מ"ל נשאר יציב יחסית ב-80°C- במאגר האחסון (50 mM Tris, pH 8.0, 500 mM NaCl, 5% v/v גליצרול, 0.5% w/v CHAPS ו-5 mM DTT) כפי שתואר קודםלכן 24. עד 6 מחזורי הפשרה בהקפאה של FL HTT שהוכנו ואוחסנו באופן זה לא גרמו למשקעים נראים לעין של החלבון, אם כי מעבר קל למצב אוליגומרי גבוה יותר נצפה על ידי SEC-MALS (איור משלים S2). דגימות נותחו גם על ידי SDS PAGE לאחר מחזורי הפשרה חוזרים ונשנים. לא נצפו משקעים נראים לעין; לא נצפו אגרגטים או מוצרי השפלה נוספים על ידי SDS-PAGE (איור משלים S3). היציבות ארוכת הטווח של FL HTT מטוהר עדיין תחת חקירה. בהיעדר נתונים חד משמעיים לטווח ארוך, אנו ממליצים לאחסן FL HTT מטוהר ב -80 °C למשך לא יותר מ 6 חודשים.
גרסאות חלבון FL HTT רקומביננטיות באיכות גבוהה והשיטות לייצורן מבוקשות מאוד על ידי קהילת המחקר HD. חלבונים אלה נמצאים בשימוש כתקנים אנליטיים של אימונואסאי וטרשת נפוצה, במחקרים מבניים ובפיתוח מבחנים חדשניים ספציפיים ל-FL HTT. שיטות הביטוי הארעיות בקנה מידה גדול המתוארות כאן ייצרו באופן עקבי כמויות מיליגרם של גרסאות FL HTT עם טוהר של >95%, וסיפקו כלים חיוניים למחקרי HTT. ייצור של עשרות מיליגרם של גרסאות FL HTT polyQ מטוהרות מאוד ומוטנטים אחרים לתמיכה במחקר HD הפך לשגרה.
Disclosures
המחברים מצהירים כי אין להם ניגוד עניינים עם התוכן של מאמר זה.
Acknowledgements
אנו מודים למחלקה למדעי הרוקחות, אוניברסיטת מדינת ניו יורק בבאפלו, על ביצוע ניתוח טרשת נפוצה של HTT. עבודה זו הייתה מאמץ משותף עם קרן CHDI. אנו מודים באופן ספציפי לאליזבת מ. דוהרטי; איגנסיו מוניוז-סנג'ואן; דאגלס מקדונלד, קרן CHDI; ורורי קרטיס, קוריה, על הקלט שלא יסולא בפז שלהם במהלך הכנת כתב היד הזה. אנו מודים גם למישל לוצ'ה, מית'רה מחמודי וסטפני פוקס על תמיכתן במאמץ מחקרי זה.
Materials
| Name | Company | Catalog Number | Comments |
| 100 kDa concentrator-Amicon | Millipore | UFC910096 | Protocol Section Number-6.2.4 |
| 20x blue native PAGE running buffer | Invitrogen | BN2001 | Protocol Section Number-8.1 |
| 20x TBS | Thermo Fisher | PI28358 | Protocol Section Number-5.1 |
| 4x blue native PAGE sample buffer | Invitrogen | BN2003 | Protocol Section Number-8.3 |
| 4x LDS loading buffer | Invitrogen | NP0007 | Protocol Section Number-5.3 |
| 5 L Erlenmeyer flasks | Corning | 431685 | Protocol Section Number-4.2 |
| Agarose gel extraction kit | Qiagen | 28704 | Protocol Section Number-2.2 |
| Anti-clumping agent | Thermo Fisher | 0010057AE | Protocol Section Number-4.8 |
| anti-FLAG M2 affinity gel | Sigma | A2220 | Protocol Section Number-6.1.1 |
| anti-FLAG M2 | Sigma | F3165 | Protocol Section Number-5.7 |
| Anti foam-Excell anti foam | Sigma | 59920C-1B | Protocol Section Number-4.8 |
| ATP | Sigma | A6419 | Protocol Section Number-6.1.4.4 |
| BEH 450 SEC | Waters | 186006851 | 2.5 µm x 4.6 mm x 150 mm Protocol Section Number-7.3 |
| blue native PAGE 5% G-250 sample additive | Invitrogen | BN2004 | Protocol Section Number-8.3 |
| carbenicillin | Thermo Fisher | 10177012 | Protocol Section Number-2.5 |
| centrifuge - Sorvall Lynx 6000 | Thermo Fisher | 75006590 | Protocol Section Number-6.1.3 |
| Cell Counter - ViCELL | BECKMAN COULTER | Protocol Section Number-4.3 | |
| CHAPS | Anatrace | C316S | Protocol Section Number-6.1.4.6 |
| Competent E. coli cells-TOP10 | Invitrogen | C404010 | Protocol Section Number-2.4 |
| digitonin | Sigma | D141 | Protocol Section Number-5.1 |
| differential refractive index detector | Wyatt | Protocol Section Number-7.1 | |
| DYKDDDDK peptide | Genscript | Peptide synthesis service Protocol Section Number-6.1.4.6 | |
| EDTA | Sigma | EDS | Protocol Section Number-5.1 |
| EndoFree Plasmid Giga Kit | Qiagen | 12391 | Protocol Section Number-3.3 |
| Endotoxin free water | Cytiva | SH30529.03 | Protocol Section Number-4.1 |
| endotoxin quantification kit-CRL Endosafe Nexgen-PTS detection system | Charles River | PTS150K | Protocol Section Number-3.4 |
| fixed angle rotor A23-6x100 rotor | Thermo Fisher | 75003006 | Protocol Section Number-6.1.3 |
| FPLC software- Unicorn 6.2 | Cytiva | Protocol Section Number-6.1.4 | |
| Gene synthesis | Genscript | Gene synthesis service Protocol Section Number-1.2 | |
| Glycerol | Fisher Scientific Glycerol (Certified ACS) | G33-4 | Protocol Section Number-5.6 |
| Growth Medium-Expi293 expression medium | Thermo Fisher | A1435102 | Protocol Section Number-4.2 |
| HEK293 cells | Thermo Fisher | R79007 | Protocol Section Number-4 |
| high shear homogenizer-Microfluidizer | MicroFluidics | LM10 | Protocol Section Number-6.1.3 |
| HPLC - 1260 infinity II Bio-Insert HPLC | Agilent | Protocol Section Number-7.1 | |
| Image Studio | LiCor | Image analysis software Protocol Section Number-5.1 | |
| MAB2166 | Sigma | MAB2166 | Protocol Section Number-5.7 |
| MAB2168 | EMD | MAB2168 | Protocol Section Number-5.7 |
| MAB3E10 | Santa Cruz | SC-47757 | Protocol Section Number-5.7 |
| MAB4E10 | Santa Cruz | SC-7757 | Protocol Section Number-5.7 |
| MAB5490 | Sigma | MAB5490 | Protocol Section Number-5.7 |
| MAB5492 | Sigma | MAB5492 | Protocol Section Number-5.7 |
| MAB8A4 | Santa Cruz | SC-47759 | Protocol Section Number-5.7 |
| multi-angle light scattering detector | Wyatt | Protocol Section Number-7.1 | |
| NativeMark Unstained Protein Standard | Invitrogen | LC0725 | Protocol Section Number-8.4 |
| NaCl | Sigma | S9888 | Protocol Section Number-5.6 |
| NheI | New England Biolab | R0131S | Hi-Fi version available Protocol Section Number-2.2 |
| NuPAGE 3–8% Tris acetate gels | Invitrogen | EA0375PK2 | Protocol Section Number-5.4 |
| NuPAGE Tris-Acetate SDS Running buffer | Invitrogen | LA0041 | Protocol Section Number-5.4 |
| PEI 25K | Polysciences | 23966-1 | Protocol Section Number-4.1 |
| Penicillin-Streptomycin | Thermo Fisher | 15070063 | Protocol Section Number-4.2 |
| Phosphate Buffered Saline (PBS) | Cytiva | SH30256.02 | Protocol Section Number-4.5 |
| plasmid miniprep kit | Qiagen | 27104 | Protocol Section Number-2.6 |
| PmeI | New England Biolab | R0560S | Protocol Section Number-2.2 |
| precast Bis-tris gel- 3-12% NativePAGE Novex Bis-Tris Gel | Invitrogen | BN1003BOX | Protocol Section Number-8.4 |
| protease inhibitor cocktail | GoldBio | GB-331-1 | Protocol Section Number-5.1 |
| SEC-MALS analysis software - Astra 7 | Wyatt Technology | Protocol Section Number-7.6 | |
| secondary antibody -IRdye 800 CW goat anti-mouse IgG | LiCor | 926-32210 | Protocol Section Number-5.9 |
| Superose 6 pg XK 16/70 | Cytiva | 90100042 | Protocol Section Number-6.2 |
| Tris base | Fisher | BP152 | Protocol Section Number-5.6 |
| Tween-20 | Thermo Fisher | AAJ20605AP | Protocol Section Number-6.1.1 |
| UV spectrometer - Nanodrop 8000 | Thermo Fisher | ND-8000-GL | Protocol Section Number-2.2 |
| XK26/100 | Cytiva | 28988951 | Protocol Section Number-6.1.1 |
References
- Walker, F. O. Huntington's disease. Lancet. 369 (9557), 218-228 (2007).
- McColgan, P., Tabrizi, S. J. Huntington's disease: a clinical review. European Journal of Neurology. 25 (1), 24-34 (2018).
- Duyao, M., et al. Trinucleotide repeat length instability and age of onset in Huntington's disease. Nature Genetics. 4 (4), 387-392 (1993).
- MacDonald, M. E., et al. A novel gene containing a trinucleotide repeat that is expanded and unstable on Huntington's disease chromosomes. Cell. 72 (6), 971-983 (1993).
- Nasir, J., et al. Targeted disruption of the Huntington's disease gene results in embryonic lethality and behavioral and morphological changes in heterozygotes. Cell. 81 (5), 811-823 (1995).
- Dragatsis, I., Levine, M. S., Zeitlin, S. Inactivation of Hdh in the brain and testis results in progressive neurodegeneration and sterility in mice. Nature Genetics. 26 (3), 300-306 (2000).
- Anne, S. L., Saudou, F., Humbert, S. Phosphorylation of huntingtin by cyclin-dependent kinase 5 is induced by DNA damage and regulates wild-type and mutant huntingtin toxicity in neurons. Journal of Neuroscience. 27 (27), 7318-7328 (2007).
- Dietrich, P., Johnson, I. M., Alli, S., Dragatsis, I. Elimination of huntingtin in the adult mouse leads to progressive behavioral deficits, bilateral thalamic calcification, and altered brain iron homeostasis. PLoS Genetics. 13 (7), 1006846(2017).
- Dragatsis, I., et al. Effect of early embryonic deletion of huntingtin from pyramidal neurons on the development and long-term survival of neurons in cerebral cortex and striatum. Neurobiology of Disease. 111, 102-117 (2018).
- Benn, C. L., et al. Huntingtin modulates transcription, occupies gene promoters in vivo, and binds directly to DNA in a polyglutamine-dependent manner. Journal of Neuroscience. 28 (42), 10720-10733 (2008).
- Saudou, F., Humbert, S. The biology of huntingtin. Neuron. 89 (5), 910-926 (2016).
- Davies, S. W., et al. Formation of neuronal intranuclear inclusions underlies the neurological dysfunction in mice transgenic for the HD mutation. Cell. 90 (3), 537-548 (1997).
- DiFiglia, M., et al. Aggregation of huntingtin in neuronal intranuclear inclusions and dystrophic neurites in brain. Science. 277 (5334), 1990-1993 (1997).
- Gutekunst, C. A., et al. Nuclear and neuropil aggregates in Huntington's disease: Relationship to neuropathology. Journal of Neuroscience. 19 (7), 2522-2534 (1999).
- Hodgson, J. G., et al. A YAC mouse model for Huntington's disease with full-length mutant huntingtin, cytoplasmic toxicity, and selective striatal neurodegeneration. Neuron. 23 (1), 181-192 (1999).
- Hoffner, G., Djian, P. Polyglutamine aggregation in Huntington disease: does structure determine toxicity. Molecular Neurobiology. 52 (3), 1297-1314 (2015).
- Waldvogel, H. J., Kim, E. H., Tippett, L. J., Vonsattel, J. P. G., Faull, R. L. M. The neuropathology of Huntington's disease. Current Topics in Behavioral Neurosciences. 22, 33-80 (2014).
- Kim, M. Beta conformation of polyglutamine track revealed by a crystal structure of huntingtin N-terminal region with insertion of three histidine residues. Prion. 7 (3), 221-228 (2013).
- Hoop, C. L., et al. Huntingtin exon 1 fibrils feature an interdigitated β-hairpin-based polyglutamine core. Proceedings of the National Academy of Sciences of the United States of America. 113 (6), 1546-1551 (2016).
- Vieweg, S., Ansaloni, A., Wang, Z. M., Warner, J. B., Lashuel, H. A. An intein-based strategy for the production of tag-free huntingtin exon 1 proteins enables new insights into the polyglutamine dependence of Httex1 aggregation and fibril formation. Journal of Biological Chemistry. 291 (23), 12074-12086 (2016).
- Seong, I. S., et al. Huntingtin facilitates polycomb repressive complex 2. Human Molecular Genetics. 19 (4), 573-583 (2009).
- Li, W., Serpell, L. C., Carter, W. J., Rubinsztein, D. C., Huntington, J. A. Expression and characterization of full-length human huntingtin, an elongated HEAT repeat protein. Journal of Biological Chemistry. 281 (23), 15916-15922 (2006).
- Vijayvargia, R., et al. Huntingtin's spherical solenoid structure enables polyglutamine tract-dependent modulation of its structure and function. eLife. 5, 11184(2016).
- Huang, B., et al. Scalable production in human cells and biochemical characterization of full-length normal and mutant huntingtin. PLoS ONE. 10 (3), 0121055(2015).
- Guo, Q., et al. The cryo-electron microscopy structure of huntingtin. Nature. 555 (7694), 117-120 (2018).
- Harding, R. J., et al. Design and characterization of mutant and wildtype huntingtin proteins produced from a toolkit of scalable eukaryotic expression systems. Journal of Biological Chemistry. 294 (17), 6986-7001 (2019).
- Harding, R. J., et al. HAP40 orchestrates huntingtin structure for 1 differential interaction with polyglutamine 2 expanded exon 1. bioRxiv. , (2021).
- Huang, B., et al. Pathological polyQ expansion does not alter the conformation of the Huntingtin-HAP40 complex. Structure. 29 (8), 804-809 (2021).
- Colin, E., et al. Huntingtin phosphorylation acts as a molecular switch for anterograde/retrograde transport in neurons. EMBO Journal. 27 (15), 2124-2134 (2008).
- Thompson, L. M., et al. IKK phosphorylates Huntingtin and targets it for degradation by the proteasome and lysosome. Journal of Cell Biology. 187 (7), 1083-1099 (2009).
- Ratovitski, T., et al. Post-translational modifications (PTMs), identified on endogenous Huntingtin, cluster within proteolytic domains between HEAT repeats. Journal of Proteome Research. 16 (8), 2692-2708 (2017).
- Taylor, S. C., Berkelman, T., Yadav, G., Hammond, M. A defined methodology for reliable quantification of western blot data. Molecular Biotechnology. 55 (3), 217-226 (2013).
- Tarazona, M. P., Saiz, E. Combination of SEC/MALS experimental procedures and theoretical analysis for studying the solution properties of macromolecules. Journal of Biochemical and Biophysical Methods. 56 (1-3), 95-116 (2003).
- Folta-Stogniew, E. Oligomeric states of proteins determined by size-exclusion chromatography coupled with light scattering, absorbance, and refractive index detectors. Methods in Molecular Biology. 328, Clifton, N.J. 97-112 (2006).
- McMeekin, T. L., Wilensky, M., Groves, M. L. Refractive indices of proteins in relation to amino acid composition and specific volume. Biochemical and Biophysical Research Communications. 7 (2), 151-156 (1962).
- Atwal, R. S., et al. Huntingtin has a membrane association signal that can modulate huntingtin aggregation, nuclear entry and toxicity. Human Molecular Genetics. 16 (21), 2600-2615 (2007).
- Kegel-Gleason, K. B. Huntingtin interactions with membrane phospholipids: Strategic targets for therapeutic intervention. Journal of Huntington's Disease. 2 (3), 239-250 (2013).
- Michalek, M., Salnikov, E. S., Werten, S., Bechinger, B. Membrane interactions of the amphipathic amino terminus of huntingtin. Biochemistry. 52 (5), 847-858 (2013).
- Wittig, I., Braun, H. P., Schägger, H. Blue native PAGE. Nature Protocols. 1 (1), 418-428 (2006).
- Nissley, D. A., O'Brien, E. P. Altered co-translational processing plays a role in huntington's pathogenesis-A hypothesis. Frontiers in Molecular Neuroscience. 9, 54(2016).
- Kumar, N., Gammell, P., Clynes, M. Proliferation control strategies to improve productivity and survival during CHO based production culture: A summary of recent methods employed and the effects of proliferation control in product secreting CHO cell lines. Cytotechnology. 53 (1-3), 33-46 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved