A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מיצוי וטיהור של חלבון FAHD1 מכבד כליות ועכבר חזירים
In This Article
Summary
פרוטוקול זה מתאר כיצד לחלץ את החלבון 1 המכיל הידרולאז 1 (FAHD1) מכליות החזירים ומכבד העכברים. השיטות המפורטות עשויות להיות מותאמות לחלבונים אחרים בעלי עניין ולשנות אותן עבור רקמות אחרות.
Abstract
פומארילאצטואצטט הידרולאז המכיל חלבון 1 (FAHD1) הוא החבר המזוהה הראשון במשפחת העל FAH באאוקריוטים, הפועל כאוקסלואצטט דקרבוקסילאז במיטוכונדריה. מאמר זה מציג סדרה של שיטות למיצוי וטיהור של FAHD1 מכליות חזירים וכבד עכברים. השיטות המכוסות הן כרומטוגרפיית חילופי יונית עם כרומטוגרפיה נוזלית של חלבונים מהירים (FPLC), סינון ג'ל הכנה ואנליטי עם FPLC, וגישות פרוטאומיות. לאחר מיצוי החלבון הכולל, נחקרו משקעי אמוניום סולפט וכרומטוגרפיית חילופים יונית, ו-FAHD1 הופק באמצעות אסטרטגיה רציפה באמצעות חילופי יונים וכרומטוגרפיית אי הכללת גודל. גישה מייצגת זו עשויה להיות מותאמת לחלבונים אחרים בעלי עניין (המתבטאים ברמות משמעותיות) ומשתנה עבור רקמות אחרות. חלבון מטוהר מרקמה עשוי לתמוך בפיתוח נוגדנים איכותיים, ו/או מעכבים פרמקולוגיים חזקים וספציפיים.
Introduction
החלבון האאוקריוטי המכיל את תחום FAH 1 (FAHD1) פועל כאוקסלואצטט דו-תפקודי (OAA) דקרבוקסילאז (ODx)1 ואצילפירובט הידרולאז (ApH)2. הוא מקומי במיטוכונדריה2 ושייך למשפחת העל הרחבה FAH של אנזימים 1,2,3,4,5,6. בעוד שפעילות ה-ApH שלה רלוונטית רק באופן מינורי, פעילות ה-ODx של FAHD1 מעורבת בוויסות של שטף מחזור TCA 1,7,8,9. OAA נדרש לא רק לתגובת הסינתאז המרכזית של ציטראט ציטראט במחזור החומצה הטריקרבוקסילית, אלא גם פועל כמעכב תחרותי של סוקסינט דהידרוגנאז כחלק ממערכת הובלת האלקטרונים וכמטבוליט קטפלרוטי. הפחתה של ביטוי הגנים FAHD1 בתאי אנדותל של ורידים טבוריים אנושיים (HUVEC) הביאה לירידה משמעותית בקצב התפשטות התא10, ולעיכוב משמעותי של פוטנציאל הממברנה המיטוכונדרית, הקשורה למעבר מקביל לגליקוליזה. מודל העבודה מתייחס לתפקוד לקוי של מיטוכונדריאלי הקשורלפנוטיפ דמוי 11 (MiDAS)11, שבו רמות OAA מיטוכונדריאליות מווסתות באופן הדוק על ידי פעילות FAHD1 1,8,9.
קל יותר להשיג חלבון רקומביננטי באמצעות ביטוי וטיהור מחיידקים12 ולא מרקמה. עם זאת, חלבון המתבטא בחיידקים עשוי להיות מוטה על ידי היעדר אפשרי של שינויים לאחר התרגום, או פשוט עשוי להיות בעייתי (כלומר, עקב אובדן פלסמיד, תגובות עקה חיידקיות, קשרים דיסולפידיים מעוותים/לא מעוצבים, הפרשה ללא או הפרשה לקויה, צבירת חלבונים, ביקוע פרוטאוליטי וכו '). עבור יישומים מסוימים, יש לקבל חלבון מליסאט תאי או מרקמה, על מנת לכלול שינויים כאלה ו/או להחריג ממצאים אפשריים. חלבון מטוהר מרקמה תומך בפיתוח נוגדנים באיכות גבוהה, ו/או מעכבים פרמקולוגיים חזקים וספציפיים עבור אנזימים נבחרים, כגון עבור FAHD113.
כתב יד זה מציג סדרה של שיטות למיצוי וטיהור של FAHD1 מכליות חזירים וכבד עכברים. השיטות המתוארות דורשות כרומטוגרפיה נוזלית מהירה של חלבון (FPLC) אך משתמשות בציוד מעבדה נפוץ. שיטות חלופיות ניתן למצוא במקומות אחרים 14,15,16,17. לאחר מיצוי חלבונים כולל, הפרוטוקול המוצע כולל שלב בדיקה, שבו נדונים תת-פרוטוקולים עבור משקעי אמוניום גופרתיים וכרומטוגרפיית חילופי יונית (איור 1). לאחר הגדרת תת-פרוטוקולים אלה, החלבון המעניין מופק באמצעות אסטרטגיה רציפה באמצעות חילופי יונית וכרומטוגרפיית אי הכללת גודל עם FPLC. בהתבסס על הנחיות אלה, הפרוטוקול הסופי עשוי להיות מותאם בנפרד לחלבונים אחרים בעלי עניין.
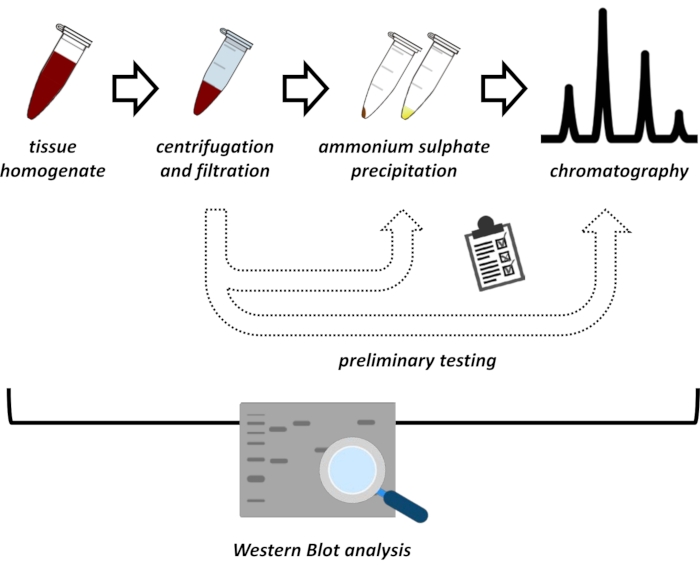
איור 1: האסטרטגיה הכוללת של פרוטוקול זה. מלמעלה למטה: חלבון מופק מרקמות. רקמות הומוגנטיות מוכנות, צנטריפוגות ותנוססות. עבור כל זוג של דגימות סופרנטנט ודגימות שמקורן בכדור, יש לבצע בדיקות לאיתור משקעי אמוניום סולפט וכרומטוגרפיית חילופי יונית (FPLC) כדי לחקור תנאים אופטימליים. לאחר קביעת תת-פרוטוקולים אלה, ניתן לחלץ את החלבון באמצעות הליך רציף של משקעי אמוניום סולפט, כרומטוגרפיית חילופי יונית וכרומטוגרפיה חוזרת ונשנית של הרחקת גודל (FPLC) בריכוזי pH ומלח משתנים. כל הצעדים צריכים להיות נשלטים על ידי כתם מערבי. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
Protocol
כל הניסויים בוצעו בהתאם להנחיות המוסדיות. כליה חזירית הושגה טרייה מהסופרמרקט המקומי. רקמות כבד נקטפו מעכברים מסוג בר C57BL6 שנשמרו במכון לחקר ההזדקנות הביו-רפואית באוניברסיטת אינסברוק, Rennweg 10, 6020 אינסברוק, אוסטריה תחת פיקוחה של אוניברסיטת דוז. ד"ר פידר יאנסן-דור, מכוסה על ידי אישור אתי כמוביל הפרויקט שהונפק בשנת 2013 (BMWF-66.008/0007-II/3b/2013). תחזוקה ושימוש בעכברים לפרויקט מכוסים תחת אישור אתי מס '2020-0.242.978 מיום 5 במאי 2020, שהונפק על ידי משרד החינוך, המדע והמחקר האוסטרי (BMBWF).
1. הכנות
הערה: לפני שהפרוטוקול מתחיל, יש להכין מספר דברים, כלומר את מאגר החלבון ליזה, דגימת הרקמה הגולמית ונוגדן ספציפי, מלבד כימיקלים וחומרים כלליים.
- הכינו 250 מ"ל של מאגר ליזה של חלבון לכל 100 גרם של משקל נטו של רקמה: 250 מ"ל של 1x PBS עם 50 mM NaF, 1 mM PMSF, 2 מיקרוגרם/מ"ל אפרוטינין, ואורתובנדט מופעל 1 mM (ראה טבלה 1). סנן את הפתרון באמצעות יחידת מסנן מזרק של 0.22 מיקרומטר.
הערה: הפעלה של אורתובנדט נדרשת לפני השימוש כדי להמיר אותו למעכב חזק יותר של חלבון טירוזין פוספטזות18. אורתובנדט מופעל ניתן לקבל מספקים מסחריים, אך גם מוכן כדלקמן.- הכן תמיסת מלאי של 200 mM של (נתרן) אורתובנדט ב- ddH2O. להכנת 10 מ"ל של תמיסה, להוסיף 368 מ"ג של Na3VO4 עד 9 מ"ל של מים ולהמיס על ידי ערבוב. לאחר ההמסה, הוסיפו את הווליום ל-10 מ"ל עם ddH2O.
הערה: ה- pH ההתחלתי של תמיסת הנתרן אורתובנדט עשוי להשתנות עם מקור החומר, ויש להתאים את ה- pH ל- 10 בגישה חוזרת באופן הבא. - בהתאם ל- pH הראשוני של הפתרון, התאם את ה- pH ל- 10 עם NaOH או HCl. ב- pH > 10, לתמיסה יהיה צבע צהוב. מרתיחים את התמיסה עד שהיא הופכת חסרת צבע, מקררים אותה לטמפרטורת החדר ובודקים את ה-pH. אם ה- pH הוא >10, הוסף נפח קטן של HCl כדי להתאים את ה- pH ל- 10. בשלב זה, הפתרון עשוי להפוך שוב לצהוב.
- חוזרים על הרתיחה והקירור עד שהתמיסה נשארת חסרת צבע וה-pH מתייצב על 10 (בערך 5-7 פעמים). בשלב זה, הוספת HCl גורמת למראה קלוש של צבע צהוב בתמיסה. אחסן אורתובנדט מופעל ב 1 מ"ל aliquots ב -20 °C (76 °F).
- הכן תמיסת מלאי של 200 mM של (נתרן) אורתובנדט ב- ddH2O. להכנת 10 מ"ל של תמיסה, להוסיף 368 מ"ג של Na3VO4 עד 9 מ"ל של מים ולהמיס על ידי ערבוב. לאחר ההמסה, הוסיפו את הווליום ל-10 מ"ל עם ddH2O.
- מכינים צינורות עם 2 מ"ל של חיץ ליזיס לגרם רקמה ומניחים אותם על קרח.
הערה: פרוטוקול זה השתמש בשמונה צינורות של 50 מ"ל, שכל אחד מהם מלא ב-30 מ"ל של מאגר ליזיס בסך הכל עבור כליה אחת של חזירים (כ-100-150 גרם), ושני צינורות שכל אחד מהם מלא ב-40 מ"ל של מאגר ליזיס עבור 20 כבדי עכברים (כל אחד 1-2 גרם) בסך הכל. - להכין את הרקמה: לנתח את הרקמה על צלחת זכוכית מנוקה מראש המונחת על קרח בקופסת קצף פוליסטירן. חותכים חתיכות טישו של כ-100 מ"ג כל אחת כדי לעבור בקלות לצינורות המתאימים לצורך תזה לאחר מכן. מעבירים את חלקי הרקמה לצינורות המוכנים (שלב 1.2).
- מכינים תמיסת אמוניום גופרתית רוויה: מחממים 500 מ"ל של ddH2O עד 70 מעלות צלזיוס ותוך כדי ערבוב, מוסיפים בהדרגה אבקת אמוניום גופרתי (ראו טבלת חומרים) עד שלא מומס יותר אמוניום סולפט. קררו את התמיסה הרוויה (יתר על המידה) הזו לטמפרטורת החדר ואחסנו אותה בטמפרטורה של 4 מעלות צלזיוס למשך הלילה.
2. מיצוי חלבון כולל
הערה לאחר הכנת הדגימה במאגר ליזה של חלבון קר (ראה שלב 1.3), הומוגניזציה של הרקמה בצורה הטובה ביותר האפשרית באמצעות סוניזציה על ידי בדיקה קולית, או באמצעות הומוגנייזר חשמלי כדלקמן.
- הומוגניזציה של רקמות
- במקרה של כליה חזירית, נקו את ההשעיה עדיף על ידי בדיקה קולית תוך שמירה על הדגימה על קרח (10 מחזורים של 15 שניות דופק, עם מרווחים של 30 שניות בין הפולסים כדי לקרר את הדגימה על קרח, באמפליטודה בינונית עם מחזור עבודה של 50%).
- במקרה של איברי עכבר, הומוגניזציה של ההשעיה באמצעות הומוגנייזר חשמלי (החל מכוח נמוך, ולאט לאט מאיץ לכוח בינוני) תוך שמירה על הדגימה על קרח. שטפו באופן קבוע את ההומוגנייזר החשמלי ב-PBS כדי להסיר כל חומר אורגני שסותם את המכשיר.
- קח 20 μL מתוך הדגימות ובדוק תחת המיקרוסקופ אם התאים של הרקמה ההומוגנית נהרסים כראוי; אחרת, חזור על ההומוגניות.
- צנטריפוגה את הצינורות בצנטריפוגה שולחנית ב 10,000 x g במשך 30 דקות ב 4 °C (64 °F).
הערה: לחלופין, צנטריפוגה על ה-supernatant בפעם השנייה ב-20,000 x g למשך 30 דקות ב-4 °C כדי למנוע שברים קטנים של הכדור הראשוני שאולי הועבר. פעולה זו תפשט את הסינון הבא בשלב 2.3. - אספו את חומר העל בצינור טרי והניחו אותו על קרח. מסננים ברצף את ה-supernatant באמצעות יחידות מסנן מזרקים של 0.45 μm ו-0.22 μm. Aliquot את supernatant לתוך 10 מ"ל אצוות ולהקפיא אותם ב -20 °C (76 °F) לאחסון לטווח קצר או ב -80 °C (80 °F) לאחסון ארוך יותר.
הערה: סינון מקדים עם 0.45 מיקרומטר מסיר את רוב החלקיקים לפני ששלב סינון שני עם 0.22 מיקרומטר מסיר את החלקיקים העדינים יותר. שימוש ישיר במסנן 0.22 מיקרומטר עלול לגרום לסיכון של סתימת המסננים. - הכן דגימת 50 μL לניתוח SDS-PAGE/כתם מערבי על-ידי הוספת 10 μL של מאגר דגימות SDS 5x (ראה טבלה 1) ל- 40 μL של הסופרנאטנט, ולאחר מכן הרתחה ב- 95 °C למשך 10 דקות.
- לחלופין, יש לבצע החייאה בכ-100 μL של גלולה המתקבלת בשלב 2.2 ב-900 μL של ddH2O, ולהכין דגימה לניתוח SDS-PAGE/כתם מערבי כמתואר לעיל.
הערה: הכללת דגימות שמקורן בכדור בניתוח הכתמים המערבי, בנוסף לבקרה החיובית, תציין אם הביטוי של החלבון נמוך, או שהנוגדן בעייתי.
- לחלופין, יש לבצע החייאה בכ-100 μL של גלולה המתקבלת בשלב 2.2 ב-900 μL של ddH2O, ולהכין דגימה לניתוח SDS-PAGE/כתם מערבי כמתואר לעיל.
3. SDS-PAGE וניתוח כתמים מערביים
הערה: נדרש ניתוח כתם מערבי כדי לבדוק אם יש מסיסות חלבונים. להלן תיאור פרוטוקול להדבקת חשמל, תוך שימוש במערכת כתם רטובה/מיכלית (ראו טבלת חומרים). פרוטוקול חלופי עבור SDS-PAGE ניתן למצוא במקום אחר19.
- הכינו ג'ל פוליאקרילאמיד SDS-PAGE רציף של 12.5% על פי הוראות היצרן (כלומר, ג'ל ערימה על גבי ג'ל רזולוציה; ראו טבלה 1). הפעל את הדגימות שהוכנו בעבר במהלך שלב 2 (בדומה לשלבים 4, 5 ו- 6; ראה להלן).
- טענו סולם סמן חלבון לבאר הראשונה (ראו טבלת חומרים). טען 5 ננוגרם של חלבון רקומביננטי hFAHD1 (המתקבל מחיידקים12; ראה טבלה 1) כבקרה חיובית לבאר השנייה.
- לאחר מכן, טען 20 μL של הדגימה לניתוח, ומלא את כל הבארות הנותרות ב- 20 μL של מאגר דגימות SDS-PAGE 1x מוכן (כלומר, 5x מאגר דגימה מדולל עם ddH2O). הפעל את הג'לים של SDS-PAGE ב- 125 V באמצעות מאגר הריצה של SDS (ראה טבלה 1).
- לאחר השלמת SDS-PAGE, בצע ניתוח כתם מערבי ובדוק את הממברנות באמצעות הנוגדן הזמין שהועלה כנגד FAHD1 (ראה טבלה 1).
הערה: מכיוון שהדגימות נלקחות מרקמה גולמית הומוגנטית, בדרך כלל איכות ה- SDS-PAGE וניתוח הכתמים המערבי בשלב זה נפגעת; עם זאת, חשוב לבדוק אם החלבון למיצוי מסיס בסופרנטנט. הפרוטוקול הבא נבדק לאיתור כליות חזירים, ואיברי עכבר שונים, כולל כבד, לב, מוח וכליות.- הכינו את מאגר העברת הכתמים המערבי פי 10 (ראו טבלה 1). הכינו את מאגר העברת הכתמים המערבי 1x (ראו טבלה 1) וקררו אותו ל-4 מעלות צלזיוס.
- הפעל קרום PVDF במשך 2 דקות במתנול. לשטוף את הממברנה ב ddH2O במשך 2 דקות. שיווי משקל הממברנה במשך 15 דקות במאגר העברת כתמים מערבי אחד.
- שטפו את ה-SDS-gel עם 1x PBS למשך 10 דקות תוך כדי רעד כדי להסיר את המאגר הפועל על ידי SDS, ולאחר מכן דגירו את הג'ל ב-1x חיץ העברת כתמים מערבי למשך 10 דקות לשיווי משקל. הרכיבו את קלטת האלקטרובלוט (כלומר, שילוב של ממברנת PVDF מופעלת וג'לים) על פי הוראות היצרן.
- הפעל את הכתם באמצעות כתם חשמלי ב 300 mA במשך שעה אחת בקופסת קצף פוליסטירן מלאה בקרח או בחדר הקר (4 מעלות צלזיוס). העבר את קרום ה- PVDF לצינור של 50 מ"ל כאשר צדו החשוף פונה לצד הפנימי של הצינור. דגירה של הממברנה ב-20 מ"ל של חיץ חוסם כתם מערבי (ראו טבלה 1) למשך הלילה בטמפרטורה של 4 מעלות צלזיוס תוך כדי גלגול על גליל צינור (ראו טבלת חומרים).
- למחרת, לשטוף את הממברנה במשך 5 דקות עם 20 מ"ל של חיץ שטיפת כתמים מערבי (PBS עם 0.1% (v/v) Tween 20) באותו צינור תוך כדי גלגול. דגירה של הממברנה באותו צינור עם הנוגדן העיקרי2 (המכוון ל-FAHD1; ראו טבלה 1) מדולל ב-1:500 ב-1:500 ב-10:500 בחיץ החוסם של הכתם המערבי למשך שעה אחת בטמפרטורת החדר בזמן הגלגול.
- שטפו את הממברנה באותו צינור שלוש פעמים במשך 10 דקות כל אחת עם 20 מ"ל של חיץ שטיפת כתם מערבי בזמן גלגול. דגירה של הממברנה במשך 30 דקות בטמפרטורת החדר עם נוגדן משני מצומד HRP (ראה טבלת חומרים) מדולל 1:3000 ב-5 מ"ל של חיץ חסימת כתמים מערבי.
- שטפו את הממברנה באותו צינור שלוש פעמים במשך 10 דקות כל אחת עם 20 מ"ל של חיץ שטיפת כתמים מערבי ופעמיים במשך 5 דקות כל אחת עם 1x PBS. מייבשים את הממברנה על ידי החזקתה בזהירות עם פינצטה בקצה אחד, ועל ידי נגיעה בפיסת תאית או בפיסת נייר ווטמן עם הקצה הנגדי (התחתון) של הממברנה. שים את הממברנה (צד חשוף למעלה) על צלחת זכוכית מנוקה.
- בזהירות לכסות את כל הממברנה עם 1 מ"ל של מצע כתם מערבי ECL מוכן באמצעות פיפטה, תוך הקפדה לא ליצור שום בועות אוויר. תנו לתמיסת ה-ECL לחדור למשך 3 דקות, ומיד לפתח את הממברנה באמצעות סרט רנטגן או באמצעות מערכת הדמיה.
הערה: אם החלבון זוהה באף אחת מהדגימות אלא רק בבקרה החיובית, הדבר עשוי להצביע על כך שהחלבון אינו מסיס, או שאינו קיים בכמויות מספיקות כדי שיזוהו על ידי הנוגדן. אם רק ננוגרמות של הבקרה החיובית היו נטענות, התרחיש הראשון סביר יותר. אם לא זוהה חלבון כלל, בדקו את איכות הנוגדן, ואולי עברו לנוגדן פוליקלונלי ולא לנוגדן חד שבטי. במקרים נדירים, כלומר, עבור חלבונים הידרופוביים מסוימים, החלבון עשוי להיות ניתן לזיהוי לאחר צנטריפוגה, אך לא לאחר סינון. במקרה כזה, מומלץ להשתמש ביחידות סינון מיוחדות לחלבונים הידרופוביים.
- לחלופין, הכתימו את ממברנות ה-PVDF לאחר הכתם המערבי כדי לשלוט בהעברה המוצלחת של החלבון מהג'ל SDS-PAGE לממברנת ה-PVDF.
הערה: צביעת Coomassie מומלצת לפתרון בעיות, פיתוח שיטה ותיעוד, אך יש לזכור כי לאחר החלת פרוטוקול זה, הממברנות הולכות לאיבוד לניתוח נוסף של כתמים מערביים. צביעת Ponceau S מעניקה צביעה חלשה יותר, אך ניתן להשתמש בה אם יש לחקור מחדש את הממברנות.- הכינו מגשים קטנים המכילים את הכתם (Coomassie או Ponceau S) ואת תמיסות ההכתמה.
- באמצעות פינצטה, מכניסים את הממברנה לתמיסת הכתם ומנערים בעדינות עד שהממברנה מוכתמת היטב (5-10 דקות).
- מעבירים את הממברנה לתוך התמיסה המפרקת ומטלטלים עד שהתמיסה רוויה (5-10 דקות). חזור על שלב ההסרה עד שניתן יהיה לראות את רצועות החלבון על הממברנה; אם לא נצפו רצועות כלל, חזור על הכתם עם זמן דגירה ארוך יותר. מייבשים את הממברנה על ידי הנחתה על צלחת זכוכית באמצעות פינצטה.
4. בדיקה: משקעי אמוניום סולפט
הערה: משקעי אמוניום סולפט הם שיטה לטיהור חלבונים על ידי שינוי המסיסות של החלבון. בניסוי ראשוני, ריכוז האמוניום גופרתי גדל ברצף לערך המזרז כמות מקסימלית של מזהמי חלבון, תוך השארת FAHD1 בתמיסה. המסיסות של החלבון נבדקת שוב באמצעות ניתוח כתמים מערבי.
- המשך משלב 2.3: או להפשיר את הדגימה או להמשיך ישירות לאחר מיצוי החלבון (כלומר, מבלי להקפיא את הדגימה). סנן את הדגימה באמצעות יחידת מסנן של 0.22 מיקרומטר כדי לא לכלול משקעים אפשריים לאחר ההפשרה. מכינים שישה צינורות של 1.5 מ"ל על קרח, ומעבירים 250 μL של דגימה לכל צינור.
- מכינים סדרת דילול של 5%, 10%, 15%, 20%, 25% ו-30% אמוניום סולפט בצינורות שהוכנו למעלה, ומרכיבים את הנפח הסופי ל-1000 מיקרול' עם מאגר ליזה של חלבון. דגירה של הדגימות בטמפרטורה של 4 מעלות צלזיוס למשך הלילה על מסובב צינור (ראו טבלת חומרים).
- באמצעות צנטריפוגה שולחנית, צנטריפוגה ב 10,000 x g במשך 30 דקות ב 4 °C (64 °F) ולהעביר בזהירות את כל supernatants לתוך צינורות נפרדים. מייבשים את הכדורים המתקבלים באוויר ומחזרים כל אחד מהם ב-1000 מיקרול' של ddH2O.
- עבור כל זוג של כדוריות וסופרנטנטים שעברו שימוש חוזר מהשלב הקודם, יש לערבב 40 μL עם 10 μL של 5x μL של מאגר דגימת SDS 5x ולרתוח ב-95 °C עם מכסים פתוחים עד שרוב הנוזל התאדה. לאחר מכן, יש לבצע החייאה של הכדור בתערובת של 50% DMSO ב-ddH2O.
- בצע SDS-PAGE (שלב 3) אך הפעל את הג'לים ב- 80 וולט במשך 3 שעות. עבור כל ריכוז של אמוניום גופרתי, טענו את הדגימות שמקורן בכדורית ההחייאה ובסופרנטנט (שלב 4.3) בזוגות. בצע ניתוח כתם מערבי (שלב 3).
- בדוק את הריכוז הגבוה ביותר של אמוניום סולפט, שבו החלבון שיש לטהר (כלומר, FAHD1) נשאר בדגימה שמקורה בסופרנטנט. בהתבסס על התוצאות, הגדר פרוטוקול משקעים אמוניום סולפט עבור החלבון המעניין, שישמש בניסויים עתידיים.
הערה: אמוניום סולפט ידוע כמעוות את SDS-PAGE ואת הכתם המערבי. ככל שריכוז האמוניום סולפט עולה, איכות ניתוח הכתמים המערבי תיפגע. עם זאת, כמו בשלב 3 בעבר, ניתוח זה משמש לבדיקת המסיסות של החלבון המעניין בריכוזים נתונים של אמוניום סולפט. פרוטוקול זה נועד לזרז חלבונים אחרים, בעוד שהחלבון שיש לטהר חייב להישאר מסיס.
5. בדיקה: כרומטוגרפיית החלפה יונית עם FPLC
הערה: מולקולות עם קבוצות פונקציונליות טעונות קשורות לעמודת חלקיקי סיליקה עבור FPLC, מה שמאפשר התמיינות של חלבונים בהתאם למטען פני השטח שלהם. בצע שלב זה פעמיים, באמצעות עמודת ההחלפה הקטיונית ועמודת ההחלפה האניונית (ראה טבלת חומרים). שלבי הפרוטוקול זהים עבור כרומטוגרפיית החלפה קטיונית או אניונית, אך המאגרים שיש להשתמש בהם שונים (ראו טבלה 1); שניהם עם "מלח נמוך" 15 mM NaCl ו "מלח גבוה" 1 M NaCl תנאים. עבור העמודות שבהן נעשה שימוש, מומלץ קצב זרימה של 1 מ"ל/דקה.
- הגדר את מערכת FPLC עם עמודת החליפין האניונית או הקטיונית. שטפו את העמודה עם 5 נפחי עמודים (CVs) של 20% EtOH (ב-H2O), ואחריהם 5 קורות חיים של ddH2O. לחלופין, שטפו את העמודה עם 1 CV של מאגר מלח נמוך, מאגר מלח גבוה, ושוב מאגר מלח נמוך בסדר עד שלא נצפו יותר פסגות בכרומטוגרמה, אלא שטפו לפחות פעם אחת.
- לאחר קביעת הפרוטוקול האופטימלי למשקעי אמוניום סולפט בקנה מידה קטן (שלב 4), החל את פרוטוקול המשקעים על 10 מ"ל של רקמה מקורית הומוגנטית (שלב 2). לחלופין, יש להזין את הדגימה כנגד מאגר המלח הנמוך.
- החל את הדגימה על העמודה (למשל, בזריקה או באמצעות משאבת דגימה) ואסוף את הזרימה החוצה. שטפו את העמודה עם 1 קורות חיים של מאגר המלח הנמוך.
- הגדר אלוטציה הדרגתית ליניארית מ-100% מאגר מלח נמוך/ 0% מאגר מלח גבוה ל-0% מאגר מלח נמוך/100% מאגר מלח גבוה בתוך 3 קורות חיים. לאחר סיום השיפוע, המשיכו לפעול עם מאגר המלח הגבוה עד שלא יזוהו עוד פסגות הקשורות לחלבון (ספיגת UV ב-280/255 ננומטר) בכרומטוגרמה בטווח של 1 CV.
- יש למרוח 1 מ"ל של 25% SDS מומס ב-0.5 M NaOH (ב-ddH2O) כדי לנקות את העמודה. ברצף, שטפו את העמודה עם 3 קורות חיים של ddH2O ו-3 קורות חיים של 20% EtOH (ב-ddH2O).
- אסוף דגימות SDS-PAGE של כל שברי השיא והזרימה-דרך, ובדוק אותן באמצעות כתם מערבי לנוכחות החלבון המעניין (שלב 3). הקפיאו את השברים שנאספו בחנקן נוזלי ואחסנו אותם בטמפרטורה של -80 מעלות צלזיוס.
- לאחר השלמת ניתוח הכתמים המערביים, הפשירו ואגדו את השברים המכילים את החלבון בעל העניין והשליכו את האחרים. חזור על שלבים 5.1-5.5 עם העמודה החלופית (כלומר, עמודת החליפין הקטיונית או האניונית).
- לאחר ששתי העמודות נבדקו, הגדר פרוטוקול FPLC לחלבון המעניין, שישמש בניסויים עתידיים. הפחיתו את נפח תמיסת החלבון באמצעות יחידות מסנן אולטרה-צנטריפוגה (10 kDa, ראו טבלת חומרים) עד ל-2 מ"ל.
הערה: ישנן שתי תוצאות צפויות של סדרת ניסויים זו. או שהחלבון המעניין נקשר לאחד העמודים, ותמיסת החלבון כבר טהורה למדי לאחר האלוטציה, או שהחלבון נשאר בזרימה בשני המקרים. בתרחיש האחרון, למרות שהחלבון נמצא בזרימה- דרך, אפקט הניקוי של שלב זה עדיין עשוי להיות משמעותי. במקרה כזה, כמו עבור FAHD1 בכליות חזירים וכבד עכבר, שלב זה של חילופי יונית עדיין יבוצע. אם עמודת ההחלפה הקטיונית או האניונית אינה יכולה לספק אפקט ניקוי תקין, ניתן לנסות לשנות את ה- pH של ה- lysate וה- buffer, וכדי לבצע דיאליזציה של הדגימה כנגד מאגר הריצה לפני היישום ל- FPLC.
6. מיצוי חלבונים באמצעות תת-פרוטוקולים מוגדרים עבור אמוניום סולפט-משקעים ו-FPLC
הערה: חלקיקים נקבוביים בעמודת ג'ל סיליקה עבור FPLC (ראה טבלת חומרים) מאפשרים הבחנה של חלבונים בהתאם לרדיוס ההידרודינמי שלהם. השלבים המתוארים יבוצעו באמצעות מערכת FPLC, באמצעות כרומטוגרפיית אי הכללת גודל (SEC). עבור העמודה SEC שבה נעשה שימוש (ראה טבלת חומרים), מומלץ קצב זרימה של 0.3 מ"ל/דקה.
- הכינו את כל החומרים הנדרשים (ראו שלב 1) והוציאו את סך החלבון מהרקמה (ראו שלב 2). בצע משקעי אמוניום סולפט עם כל הרקמה הומוגנטית שלא שימשה לבדיקה (ראה שלב 4). עבור נפחים גדולים יותר, רכזו את הליזאט באמצעות יחידות מסנן אולטרה-צנטריפוגה (10 kDa; ראו טבלת חומרים) עד לנפח קטן יותר של 50 מ"ל או פחות.
- בצע שלב טיהור ראשון באמצעות כרומטוגרפיית החלפה יונית (ראה שלב 5).
- הכינו דוגמאות לכתם מערבי, כפי שתואר בשלבים הקודמים. בצע ניתוח כתמים מערביים ואגד את כל FAHD1 המכיל שברים מכרומטוגרפיית חילופי יונית.
- הפחיתו את נפח תמיסת החלבון עד ל-2 מ"ל באמצעות יחידות מסנן אולטרה-צנטריפוגה (10 kDa). סנן ברצף את התמיסה עם יחידות מסנן מזרקים של 0.45 מיקרומטר ו-0.22 מיקרומטר כדי להסיר כל מיקרו-משקעים.
- אזן את עמודת ה- SEC עם 1 CV של מאגר הריצה של SEC (ראה טבלה 1), המכיל 1 mM DTT. טען את הדגימה על העמודה והפעל את הכרומטוגרפיה עד שכל החלבונים יתרוקנו (1-2 CV).
- אסוף שברים של 1 מ"ל של הזרימה-דרך המתאימה לשיאים משמעותיים בכרומטוגרמה (ספיגת UV ב-280/255 ננומטר) והכן דגימות של 50 μL של כל שבר שנאסף עבור SDS-PAGE וניתוח כתמים מערביים, כפי שתואר בשלבים הקודמים. הקפיאו את כל השברים באמצעות חנקן נוזלי, ואחסנו אותם בטמפרטורה של -80 מעלות צלזיוס.
- שטפו ברציפות את עמודת ה-SEC עם 1 קורות חיים של ddH2O ו-1 CV של 20% EtOH (ב-ddH2O). בצע ניתוח של כתם מערבי, ואגד את כל השברים המכילים FAHD1 המכילים. הפחיתו את נפח תמיסת החלבון ל-2 מ"ל באמצעות יחידות מסנן אולטרה-צנטריפוגה (10 kDa, ראו טבלת חומרים).
- הערך את ריכוז החלבון באמצעות ערכת בדיקת BCA מסחרית (ראה טבלת חומרים).
הערה: תכולת ה-pH והמלח של הפאזה הניידת עשויים להשפיע על פרופיל ההתרוממות של חלבונים כדוריים20. תנאים חומציים או בסיסיים עשויים לגרום לשיאים להיות פחות מוגדרים ולהגביר את האינטראקציות בין חלבונים למטריצות שיובילו לשמירה חלקית של חלבון בעמודה20. השפעה זו עשויה להיות מנוצלת להמשך טיהור חלבונים. חזרה על שלב 6 עם קצבי זרימה, pH וריכוזי מלח שונים עשויה לשפר את טוהר החלבון20.
7. צביעת כסף
הערה: ניתוח צביעת כסף של ג'לים SDS-PAGE נדרש כדי לבדוק אם יש זיהומים חלבוניים שייתכן שלא ניתן לראות עם צביעת Coomassie. הפרוטוקול הבא הוא אחד מבין גרסאות רבות שניתן למצוא בספרות21. בצע את כל שלבי הדגירה על ידי רעד במגש זכוכית נקי. אספו את כל הנוזלים המכילים כסף ופורמלדהיד במיכל פסולת מיוחד והשליכו אותם כראוי.
- דגירו את הג'לים של SDS-PAGE בתמיסת תיקון כתמי כסף (ראו טבלה 1) למשך הלילה בחדר הקר. דגירו את הג'לים בתמיסת דגירה מכתים כסופה (ראו טבלה 1) למשך 3 שעות בטמפרטורת החדר. לחלופין, הוסף גלוטארלדהיד (ראה טבלה 1) כדי לשפר את הזיהוי של רצועות קלושות. יש לשטוף את הג'לים ארבע פעמים ב-ddH2O למשך 10 דקות כל אחד.
- דגירו את הג'לים בתמיסת כסף מכתים כסופה (ראו טבלה 1) למשך שעה אחת.
הערה: שימו לב שמעכשיו כל הנוזלים והג'ל עצמו מכילים כסף ופורמלדהיד שהם רעילים. - דגירו את הג'לים בתמיסת מפתחי כתמי כסף (ראו טבלה 1) תוך רעד נמרץ עד שהפסים נראים בבירור. כדי לעצור את התגובה, יש להשליך את תמיסת המפתחים ולדגום מיד את הג'לים בתמיסת עצירת צביעת כסף (ראו טבלה 1) למשך 10 דקות לפחות.
הערה: רצועות מוכתמות בשלבים 7.2 ו- 7.3 יהפכו כל הזמן מפותחות יותר. הוספת יותר פורמלדהיד לפתרון ממה שצוין עשויה להיות נחוצה אם הכתם חלש.
תוצאות
חלבון FAHD1 הופק מתוך כבד הכליה והעכבר של חזירים באמצעות הפרוטוקול שהוצג. עבור רקמת עכבר, נדרשים מספר איברים כדי להשיג מספר מיקרוגרם לאחר שלב הטיהור הסופי. מסיבה זו, מאמר זה מתמקד במיצוי של FAHD1 מכליות חזירים, שהוא ניסוי הרבה יותר למופת. הפקת FAHD1 מכבד העכבר מבוצעת כדי להציג את הקשיים ואת המלכודו...
Discussion
שלבים קריטיים בפרוטוקול
הקפדה על הנחיות נפוצות לטיפול בחלבונים היא חיונית, כגון עבודה על קרח ובתנאים מתונים של pH ומלח. השימוש במעכבי פרוטאזות מועיל לשיטה, בעוד שהשימוש במעכבי פרוטאזום מומלץ מאוד. הקפאה והפשרה של הדגימה עלולות תמיד לגרום למשקעי חלבון (לפחות באופן חלקי), ולכן כל א...
Disclosures
למחברים אין אינטרסים כלכליים מתחרים.
Acknowledgements
המחברים מודים מאוד על הסיוע הטכני של אייסה אוזטורק ואווה אלברטיני. עכברים ששימשו ליצירת רקמת כבד נשמרו תחת פיקוחה של אוניברסיטת דוז. ד"ר פידר יאנסן-דור (המכון לחקר ההזדקנות הביו-רפואית באוניברסיטת אינסברוק, Rennweg 10, 6020 אינסברוק, אוסטריה).
Materials
| Name | Company | Catalog Number | Comments |
| 0.22 µm filter units | MERCK | SLGP033RS | Millex-HP, 0.22 µm, PES 33 mm, not steril |
| 0.45 µm filter units | MERCK | SLHP033NS | Millex-HP, 0.45 µm, PES 33 mm, not steril |
| 15 mL Falcon tubes | VWR | 734-0451 | centrifugal tubes |
| 50 mL Falcon tubes | VWR | 734-0448 | centrifugal tubes |
| 96-Well UV Microplate | Thermo-Fischer | 8404 | UV/VIS transparent flat-bottom 96 well plates |
| Acrylamide/Bis Solution (40%, 29:1 ratio) | BIO-RAD | #1610147 | 40% acrylamide/bis-acrylamide, 29:1 (3.3% crosslinker) solution for casting polyacrylamide gels |
| ÄKTA FPLC system | GE Healthcare Life Sciences / Cytiva | - | using the FPLC system by GE Healthcare; different custom versions exist; this work used the "ÄKTA pure" system |
| Amicon Ultra-15, PLGC Ultracel-PL Membran, 10 kDa | MERCK | UFC901024 | centrifigal filters for protein enrichment; 10 kDa molecular mass filter; 15 mL |
| Amicon Ultra-4, PLGC Ultracel-PL Membran, 10 kDa | MERCK | UFC801024 | centrifigal filters for protein enrichment; 10 kDa molecular mass filter; 4 mL |
| Ammonium sulfate powder | MERCK | A4418 | ammonium sulphate for molecular biology, ≥99.0% |
| Ammoniumpersulfat reagent grade, 98% | MERCK | 215589 | Catalyst for acrylamide gel polymerization. |
| Coomassie Brilliant blue R 250 | MERCK | 1125530025 | Coomassie Brilliant blue R 250 (C.I. 42660) for electrophoresis Trademark of Imperial Chemical Industries PLC. CAS 6104-59-2, pH 6.2 (10 g/l, H2O, 25 °C) |
| Dialysis tubing cellulose membrane | MERCK | D9277 | Cellulose membranes for the exchange of buffers via dialysis. |
| Eppendof tubes 1.5 mL | VWR | 525-1042 | microcentrifugal tubes; autoclaved |
| HiLoad 26/600 Superdex 75 pg | GE Healthcare Life Sciences / Cytiva | 28989334 | HiLoad Superdex 75 pg prepacked columns are for high-resolution size exclusion chromatography of recombinant proteins |
| Immun-Blot PVDF Membrane | BIO-RAD | #1620177 | PVDF membranes are protein blotting membranes optimized for fluorescent and multiplex fluorescent applications. |
| Mini Trans-Blot Electrophoretic Transfer Cell | BIO-RAD | #1703930 | Use the Mini Trans-Blot Cell for rapid blotting of Mini-PROTEAN precast and handcast gels. |
| Mini-PROTEAN Tetra Vertical Electrophoresis Cell for Mini Precast Gels | BIO-RAD | #1658004 | 4-gel vertical electrophoresis system, includes electrode assembly, companion running module, tank, lid with power cables, mini cell buffer dam. |
| Mono Q 10/100 GL | GE Healthcare Life Sciences / Cytiva | 17516701 | Mono Q columns are strong anion exchange chromatography columns for protein analysis or small scale, high resolution polishing of proteins. |
| Mono S 10/100 GL | GE Healthcare Life Sciences / Cytiva | 17516901 | Mono S columns are strong cation exchange chromatography columns for protein analysis or small scale high resolution polishing of proteins. |
| PageRuler Prestained Protein Ladder, 10 to 180 kDa | Thermo-Fischer | 26616 | A mixture of 10 blue-, orange-, and green-stained proteins (10 to 180 kDa) for use as size standards in protein electrophoresis (SDS-PAGE) and western blotting. |
| Pierce BCA Protein Assay Kit | Thermo-Fischer | 23225 | A two-component, high-precision, detergent-compatible protein assay for determination of protein concentration. |
| Sonifier 250; Ultrasonic Cell Disruptor w/ Converter | Branson | - | New models at https://www.emerson.com/documents/automation/brochure-sonifier-sfx250-sfx550-cell-disruptors-homogenizers-branson-en-us-168180.pdf |
| Swine Anti-Rabbit Immunoglobulins/HRP (affinity isolated) | Agilent Dako | P0399 | The antibody used for horseradish peroxidase conjugation reacts with rabbit immunoglobulins of all classes. |
| TEMED, 1,2-Bis(dimethylamino)ethane, TMEDA | MERCK | T9281 | TEMED (N,N,N′,N′-Tetramethylethylenediamine) is molecule which allows rapid polymerization of polyacrylamide gels. |
| Tube Roller | - | - | A general tube rotator roller; e.g. a new model at https://labstac.com/de/Mixer/Roller/c/71 |
| Tube Rotator | - | - | A general tube rotator wheel; e.g. a new model at https://labstac.com/de/Tube-Roller/p/MT123 |
| ULTRA-TURRAX; T 25 digital | IKA | 0003725000 | New models at https://www.ika.com/de/Produkte-Lab-Eq/Dispergierer-Dipergiergeraet-Homogenisierer-Homogenisator-csp-177/T-25-digital-ULTRA-TURRAX-cpdt-3725000/ |
References
- Pircher, H., et al. Identification of FAH domain-containing protein 1 (FAHD1) as oxaloacetate decarboxylase. Journal of Biological Chemistry. 290 (11), 6755-6762 (2015).
- Pircher, H., et al. Identification of human Fumarylacetoacetate Hydrolase Domain-containing Protein 1 (FAHD1) as a novel mitochondrial acylpyruvase. Journal of Biological Chemistry. 286 (42), 36500-36508 (2011).
- Kang, T. -. W., et al. Senescence surveillance of pre-malignant hepatocytes limits liver cancer development. Nature. 479 (7374), 547-551 (2011).
- Hong, H., Seo, H., Park, W., Kim, K. K. -. J. Sequence, structure and function-based classification of the broadly conserved FAH superfamily reveals two distinct fumarylpyruvate hydrolase subfamilies. Environmental Microbiology. 22 (1), 270-285 (2020).
- Timm, D. E., Mueller, H. A., Bhanumoorthy, P., Harp, J. M., Bunick, G. J. Crystal structure and mechanism of a carbon-carbon bond hydrolase. Structure. 7 (9), 1023-1033 (1999).
- Bateman, R. L., et al. Mechanistic inferences from the crystal structure of Fumarylacetoacetate Hydrolase with a bound phosphorus-based inhibitor. Journal of Biological Chemistry. 276 (18), 15284-15291 (2001).
- Weiss, A. K. H., et al. Structural basis for the bi-functionality of human oxaloacetate decarboxylase FAHD1. Biochemical Journal. 475 (22), 3561-3576 (2018).
- Etemad, S., et al. Oxaloacetate decarboxylase FAHD1 - a new regulator of mitochondrial function and senescence. Mechanisms of Ageing and Development. 177, 22-29 (2019).
- Weiss, A. K. H., et al. Regulation of cellular senescence by eukaryotic members of the FAH superfamily - A role in calcium homeostasis. Mechanisms of Ageing and Development. 190, 111284 (2020).
- Petit, M., Koziel, R., Etemad, S., Pircher, H., Jansen-Dürr, P. Depletion of oxaloacetate decarboxylase FAHD1 inhibits mitochondrial electron transport and induces cellular senescence in human endothelial cells. Experimental Gerontology. 92, 7-12 (2017).
- Wiley, C. D., et al. Mitochondrial dysfunction induces senescence with a distinct secretory phenotype. Cell Metabolism. 23 (2), 303-314 (2016).
- Weiss, A. K. H., et al. Expression, purification, crystallization, and enzyme assays of Fumarylacetoacetate Hydrolase Domain-containing proteins. Journal of Visualized Experiments: JoVE. (148), e59729 (2019).
- Weiss, A. K. H., et al. Inhibitors of Fumarylacetoacetate Hydrolase Domain Containing Protein 1 (FAHD1). Molcules. 26 (16), 5009 (2021).
- Mizutani, H., Kunishima, N. Purification, crystallization and preliminary X-ray analysis of the fumarylacetoacetase family member TTHA0809 from Thermus thermophilus HB8. Acta Crystallographica Section F Structural Biology and Crystallization Communications. 63 (9), 792-794 (2007).
- Lee, C. H. A simple outline of methods for protein isolation and purification. Endocrinology and Metabolism. 32 (1), 18-22 (2017).
- Amer, H. E. A. Purification of proteins: Between meaning and different methods). Proteomics Technologies and Applications. , (2019).
- Niu, L., Yuan, H., Gong, F., Wu, X., Wang, W. Protein extraction methods shape much of the extracted proteomes. Frontiers in Plant Science. 9, 802 (2018).
- Gordon, J. A. Use of vanadate as protein-phosphotyrosine phosphatase inhibitor. Methods in Enzymology. 201, 477-482 (1991).
- Gallagher, S. R. SDS-polyacrylamide gel electrophoresis (SDS-PAGE). Current Protocols in Essential Laboratory Techniques. , (2012).
- . Effect of pH on Protein Size Exclusion Chromatography Available from: https://www.agilent.com/cs/library/applications/5990-8138EN.pdf (2011)
- Sørensen, B. K., et al. Silver staining of proteins on electroblotting membranes and intensification of silver staining of proteins separated by polyacrylamide gel electrophoresis. Analytical Biochemistry. 304 (1), 33-41 (2002).
- Fagerberg, L., et al. Analysis of the human tissue-specific expression by genome-wide integration of transcriptomics and antibody-based proteomics. Molecular & Cellular Proteomics. 13 (2), 397-406 (2014).
- . Cytiva Life Fundamentals of size exclusion chromatography Available from: https://www.cytivalifesciences.com/en/us/solutions/protein-research/knowledge-center/protein-purification-methods/size-exclusion-chromatography (2022)
- Rosano, G. L., Ceccarelli, E. A. Recombinant protein expression in Escherichia coli: advances and challenges. Frontiers in Microbiology. 5, 172 (2014).
- Rosano, G. L., Morales, E. S., Ceccarelli, E. A. New tools for recombinant protein production in Escherichia coli: A 5-year update. Protein Science: A Publication of the Protein Society. 28 (8), 1412-1422 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved