A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
שימוש בספקטרומטר ניידות יונים מחזורי לניסויי ניידות יון דו-מושבית
In This Article
Summary
ספקטרומטריית ניידות יונים (IMS) היא השלמה מעניינת לספקטרומטריית מסה לאפיון ביומולקולות, בעיקר משום שהיא רגישה לאיזומריזם. פרוטוקול זה מתאר ניסוי IMS (IMS/IMS) דו-מושבי, המאפשר בידוד של מולקולה ויצירת פרופילי הניידות של שבריה.
Abstract
אפיון מדויק של מבנים כימיים חשוב להבין את המנגנונים הביולוגיים הבסיסיים שלהם ואת המאפיינים התפקודיים שלהם. ספקטרומטריית מסה (MS) היא כלי פופולרי אך לא תמיד מספיקה כדי לחשוף לחלוטין את כל התכונות המבניות. לדוגמה, למרות פחמימות רלוונטיות מבחינה ביולוגית, האפיון שלהם מסובך על ידי רמות רבות של איזומריזם. ספקטרומטריית ניידות יונים (IMS) היא השלמה מעניינת מכיוון שהיא רגישה לקונפורציות יונים, ולכן לאיזומריזם.
יתר על כן, ההתקדמות האחרונה שיפרה באופן משמעותי את הטכניקה: הדור האחרון של מכשירי IMS מחזוריים מציע יכולות נוספות בהשוואה למכשירי IMS ליניאריים, כגון כוח פתרון מוגבר או האפשרות לבצע ניסויים בניידות יונים דו-מושבית (IMS/IMS). במהלך IMS/IMS, יון נבחר בהתבסס על ניידות היונים שלו, מקוטע וניתוח מחדש כדי לקבל מידע על ניידות יונים על שבריו. עבודה שנערכה לאחרונה הראתה כי פרופילי הניידות של הקטעים הכלולים בנתוני IMS/IMS כאלה יכולים לשמש כטביעת אצבע של גליקן מסוים וניתן להשתמש בהם באסטרטגיית רשת מולקולרית כדי לארגן ערכות נתונים של גליקומוניקה באופן רלוונטי מבחינה מבנית.
מטרת פרוטוקול זה היא אפוא לתאר כיצד ליצור נתוני IMS/IMS, מהכנה מדגמית לכיול חתך הרוחב הסופי של התנגשות (CCS) של ממד ניידות היונים המניב ספקטרום ניתן לשחזור. אם ניקח את הדוגמה של גליקאן נציג אחד, פרוטוקול זה יראה כיצד לבנות רצף בקרה של IMS /IMS במכשיר IMS מחזורי, כיצד להסביר את רצף הבקרה הזה כדי לתרגם את זמן ההגעה של IMS לזמן הסחף (כלומר, זמן ההפרדה האפקטיבי החל על היונים), וכיצד לחלץ את פרטי הניידות הרלוונטיים מהנתונים הגולמיים. פרוטוקול זה נועד להסביר בבירור את הנקודות הקריטיות של ניסוי IMS/IMS ובכך לסייע למשתמשי IMS מחזוריים חדשים לבצע רכישות פשוטות וניתנות לשחזור.
Introduction
האפיון הכימי המלא של ביומולקולות הוא המפתח להבנת התכונות הביולוגיות והתפקודיות הבסיסיות שלהם. לשם כך, מדעים "omics" התפתחו בשנים האחרונות, במטרה לאפיין בקנה מידה גדול של מבנים כימיים בריכוזים ביולוגיים. בפרוטאומיקה ובמטבולומיקה, טרשת נפוצה הפכה לכלי ליבה כדי לפענח את ההטרוגניות המבנית שנמצאת במדיה הביולוגית - במיוחד הודות לרגישותה וליכולתה לספק מידע מבני באמצעות MS דו-מושבי (MS/MS). באסטרטגיות MS/MS, יון נבחר על פי המסה שלו, לאחר מכן מקוטע, ולבסוף, המסות של שבריו נרכשים כדי ליצור טביעת אצבע של המולקולה. ספקטרום MS/MS יכול לשמש, בפרט, כדי להתאים מסדי נתונים ספקטרליים 1,2, או לשחזר באופן זמני את מבני האב3,4. תחת ההנחה כי ספקטרום דומה שייך לתרכובות דומות, נתוני MS / MS יכולים לשמש גם לבניית רשתות מולקולריות (MNs) המחברות מינים קשורים באמצעות ציון דמיון 5,6.
עם זאת, בגלל המאפיין הטבוע של טרשת נפוצה כדי לזהות את יחס המסה למטען (m/z) של יונים, הטכניקה עיוורת למספר תכונות מבניות הנופלות בטווח של איזומריזם (סטריאו).. לדוגמה, פחמימות עשויות מכמה תתי-יחידות חד-יחידות חד-צדדיות, שרבות מהן סטריאואיזומרים או אפילו אפימרים (למשל, Glc לעומת Gal או Glc vs. Man). יחידות משנה אלה מקושרות על ידי קשרים גליקוסידיים, אשר יכולים להיות שונים על ידי המיקום של ההצמדה (regioisomerism) ואת התצורה הסטרית של הפחמן האנומרי (אנומריזם). מאפיינים אלה מקשים על טרשת נפוצה עצמאית להבחין בין איזומרים פחמימות7, ורק regioisomerism ניתן לטפל באמצעות שיטות הפעלה אנרגיה גבוהה8,9,10. למרות נגזרות היא אפשרות לשבש את השתוות של קבוצות סטריאוטיאוסומריות11, זה דורש הכנה מדגם נרחבת. אפשרות נוספת, פשוטה יותר, היא לשייך טרשת נפוצה עם ממד אנליטי הרגיש לאיזומריזם, כגון IMS.
מכיוון שפרוטוקול זה מיועד למשתמשים שכבר מכירים את המושגים הבסיסיים של IMS, ומכיוון שביקורות מפורטות זמינות במקומות אחרים12,13, רק סקירה קצרה של עקרונות IMS ניתנת כאן. IMS היא שיטת הפרדה של שלב הגז המסתמכת על אינטראקציה של יונים עם גז חוצץ ושדה חשמלי, ובסופו של דבר מפרידה יונים על פי הקונפורמציות של שלב הגז שלהם. עקרונות שונים של IMS בשילוב טרשת נפוצה ניתן למצוא על מכשירים מסחריים: חלקם פועלים בשדות חשמליים גבוהים ונמוכים לסירוגין (IMS אסימטריים שדה, FAIMS), בעוד שרובם פועלים בתוך מגבלת השדה הנמוך - בעיקר IMS צינור להיסחף (DTIMS, שדה חשמלי יורד באופן ליניארי), IMS גל נסיעה (TWIMS, גלים פוטנציאליים סימטריים) ו- IMS לכודים (TIMS, זרימה גבוהה של יונים לוכדים גז חוצץ נגד שדות חשמליים)13 . שיטות השדה הנמוך מאפשרות גישה למה שמכונה CCS, מאפיין של זוג היונים-גז המייצג את פני השטח (ב- Å2 או nm2) של היון המקיים אינטראקציה עם גז המאגר במהלך ההפרדה. CCS הוא תיאורטית בלתי תלוי במכשיר ולכן הוא שימושי כדי ליצור נתונים שניתן לשחזר בין מעבדות שונות14. הפרדות ניידות יונים יכולות להיות מושפעות מפרמטרים שונים, ובמיוחד מתנודות של לחץ הגז וטמפרטורת הגז בתא הניידות. כיול CCS הוא דרך לתקן זאת, שכן הן הכיול והן מינים של עניין יושפעו באופן דומה13. עם זאת, חובה להתקין את המכשיר בחדר מבוקר טמפרטורה ויש לו מערכת בקרת לחץ גז אמינה.
התפתחות מעניינת של IMS היא IMS / IMS, שהוצגה לראשונה בשנת 2006 על ידי הקבוצה של קלמר כאנלוגית של MS / MS15,16. ב- IMS / IMS, יון של עניין מבודד באופן סלקטיבי בהתבסס על ניידות היונים שלו; לאחר מכן הוא מופעל (עד לפיצול אפשרי), ומבוצע ניתוח IMS חדש של היון או הקטעים המופעלים. בעיצוב האינסטרומנטלי הראשון, שני תאי IMS הוכנסו לסדרה, מופרדים על ידי משפך יונים שבו עמדה ההפעלה. מאז, למרות שהוצעו מספר הגדרות IMS/IMS (לסקירה, ראו אלדריד ותלסינו17), ספקטרומטר המסה המסחרי הראשון עם יכולת IMS/IMS הפך לזמין רק בשנת 201918. מכשיר זה שיפר באופן משמעותי את הרעיון הראשוני על ידי שילובו עם פריצת דרך טכנולוגית נוספת: עיצוב מחזורי של תא IMS.
תא ה- IMS המחזורי מאפשר תיאורטית להגדיל כמעט לאין שיעור את אורך נתיב הסחף, ובכך את כוח הפענוח של המכשיר19. זה הושג באמצעות גיאומטריה מכשיר מסוים, שבו תא TWIMS מחזורי ממוקם אורתוגנלית לציר האופטי היונים הראשי. אזור מערך רב-תכליתי בכניסה לתא IMS מאפשר שליטה בכיוון נתיב היון: (i) שליחת יונים לצדדים להפרדת IMS, (ii) קדימה לזיהוי MS, או (iii) אחורה מתא ה- IMS לאחסון בתא סידור מראש. מתא אחסון זה מראש, ניתן להפעיל את היונים ואת הקטעים שהוכנסו מחדש בתא IMS למדידת ניידות יונים, גישה ששימשה בהצלחה לאפיון stereoisomers20. בסופו של דבר, הנתונים שנאספו מכילים ניידות יונים ומידע m/z עבור המבשר ורסיסיו.
בפרסום שפורסם לאחרונה שהשתמש בעיצוב מחזורי זה לניתוחי גליקנים (Ollivier et al.21), הראינו כי פרופיל הניידות של השברים הכלולים בנתוני IMS / IMS כאלה פועל כטביעת אצבע של ביומולקולה שניתן להשתמש בה באסטרטגיית רשת מולקולרית. הרשת שנוצרה, הנקראת IM-MN, הובילה לארגון ערכות נתונים של גליקומוניקה באופן רלוונטי מבחינה מבנית, ואילו הרשת שנבנתה אך ורק מנתוני MS/MS (MS-MN) חשפה מידע מועט. כדי להשלים פרסום זה ולסייע למשתמשי IMS מחזוריים ליישם זרימת עבודה זו, פרוטוקול זה מספק תיאור מלא של הפרוטוקול המשמש לאיסוף הנתונים. פרוטוקול זה מתמקד רק ביצירת נתוני IMS/IMS שבהם משתמשים יכולים להשתמש כדי לבנות רשתות IM-MN (ראה21) - או עבור כל יישום אחר לפי בחירתם. בניית IM-MN לא תיחשב כאן, שכן פרוטוקולים עבור רשת מולקולרית כבר זמינים22. הנקודות המכריעות שיש לעקוב אחריהן כדי ליצור רכישות IMS/IMS יקרות ערך הניתנות לשחזור מודגשות. לוקח את הדוגמה של אחד oligosaccharides נחקר על ידי אוליבייה ואח '. 21, השלבים הבאים מפורטים: (i) הכנת מדגם, (ii) כוונון של מכשיר IMS מחזורי, (iii) איסוף שיא אוטומטי של הנתונים, ו - (iv) כיול CCS.
Access restricted. Please log in or start a trial to view this content.
Protocol
הערה: מבט כולל על הפרוטוקול מסופק באיור 1. הפרמטרים המשמשים לניסויים המתוארים בפרוטוקול הנוכחי ניתן למצוא בטבלה משלימה S1 ובטבלה משלימה S2.
1. הכנת הפתרון לדוגמה
הערה: הפרוטוקול מתואר באמצעות פנטסכריד arabinoxylan (23-α-L-arabinofuranosyl-xylotetraose או XA2XXX; ראה את טבלת החומרים) כדוגמה.
- הכנת הממס: 500 μM LiCl ב 50:50 H2O:MeOH (vol./vol.).
- הכן פתרון מלאי של 100 מ"מ של ליתיום כלוריד (LiCl) ב- H2O על ידי שקילה של 212 מ"ג LiCl והוסף 50 מ"ל של מים דה-יוניים בטוהר גבוה (H2O) בצינור חרוטי פוליפרופילן 50 מ"ל. יש לנער עד להמסה מלאה.
הערה: הממס מסומם עם מלח ליתיום כדי לקדם את היווצרות [M +Li]+ תוספות במקור היון של הספקטרומטר, כפי שהוא בדרך כלל מניב ספקטרום פיצול באיכות טובה יותר לעומת תוספים אלקליים אחרים. השימוש LiCl מומלץ כי חומצות אורגניות (ולכן המלחים שלהם) נמצאו בעבר להשפיע על פרופילי IMS23. - בבקבוק זכוכית, לדלל את פתרון מלאי LiCl 200x: ל 250 μL של פתרון המניה, להוסיף 24.75 מ"ל של H2O. להוסיף 25 מ"ל של מתנול (MeOH) כדי להגיע לריכוז סופי של LiCl של 500 מיקרומטר ב 50:50 H2O:MeOH (v /v). Sonicate במשך 2 דקות כדי degas הממס.
הערה: MeOH מהווה סכנה בריאותית (H225, H301, H311, H331, H370); לתפעל מתחת למכסה המנוע המחלץ לובש חלוק מעבדה, כפפות, והגנה על העיניים. שיעור של 50:50 MeOH / H2O (v / v) נראה הממס הטוב ביותר עבור יינון של oligosaccharides; עם זאת, MeOH יכול להיות מוחלף על ידי אצטוניטריל (ACN) במידת הצורך.
- הכן פתרון מלאי של 100 מ"מ של ליתיום כלוריד (LiCl) ב- H2O על ידי שקילה של 212 מ"ג LiCl והוסף 50 מ"ל של מים דה-יוניים בטוהר גבוה (H2O) בצינור חרוטי פוליפרופילן 50 מ"ל. יש לנער עד להמסה מלאה.
- בצינור פוליפרופילן 1.5 מ"ל, לשקול 1 מ"ג של פחמימות. יש להתמוסס בנפח מתאים של 500 מיקרומטר LiCl כדי להגיע לריכוז של 1 מ"ג/מ"ל. לדלל לריכוז סופי של 10 מיקרוגרם / מ"ל ב 50:50 MeOH / H2O + 500 μM LiCl. יש לאחסן בטמפרטורה של 4 °C (65 °F).
הערה: הריכוז של 10 מיקרוגרם / מ"ל נבחר כדי לייעל את האות על כל יוני שבר במהלך IMS / IMS-MS (זה עבור תרכובת טהורה; להגדיל את הריכוז בעת עבודה על תערובות). לרכישת ספקטרום IMS/IMS הפניה, אין לדלל עוד יותר את המדגם: רוויה של גלאי MS לפני הפיצול צפויה, אם כי המכשיר מציע אפשרויות לתקן אותו (ראה שלב 3.2.).
2. כוונון של ספקטרומטר המסה של IMS המחזורי
הערה: הוראות הקשורות לתוכנה (חלונות, תפריטים ופקודות) מסומנות באותיות מודגשות.
- פתח את מסוף המכשירים מתוכנת בקרת המכשירים (דף כוונון MS , עיין בפרטי התוכנה בטבלת החומרים) והצב את המכשיר במצב הפעלה . המתן לפחות 3 שעות עד שהמתחים הגבוהים יתייצבו בתא ה- IMS.
הערה: לקבלת השחזור הטוב ביותר, המתחים בתא IMS צריכים להיות מיוצבים לחלוטין. הפעל את המתחים הגבוהים ותן למכשיר להתייצב בן לילה לפני כל ניתוח IMS מחזורי. יתר על כן, הלחץ והטמפרטורה בתא ניידות היונים חייבים להישמר קבועים ככל האפשר. למרות קריאה חוזרת ללחץ זמין בכרטיסייה ואקום , אין readback זמין עבור הטמפרטורה. שמור את המכשיר במעבדה תרמוסטט. המכשיר המשמש בעבודה זו פועל ב 1.75 mbar במעבדה תרמוסטט ב 20 °C (60 °F). - הגדרת מכשיר IMS מחזורי
הערה: יש להחדיר פתרונות סטנדרטיים באמצעות מערכת הנוזלים המובנית עבור התקנת המכשיר.- מניחים את מיכלי הנוזלים המלאים בתקנים המתאימים המסופקים על ידי היצרן במערכת הנוזלים: מאגר B ('Lockmass'): 10 pg/μL לאוצין אנקפלין (LEU ENK) ב 50:50 ACN / H2O + 0.1% חומצה פורמית; מאגר C ('קליברנט'): MajorMix.
הערה: בפרוטוקול זה, פתרון הכיול של MajorMix ישמש לכיול ממדי m/z ו- CCS. מסיבות מעשיות, יבוצע כיול CCS חיצוני (ראה שלב 5 של הפרוטוקול); לפיכך, ניתן גם להשתמש בתערובת קליברנט בתוך הבית עבור CCS ועוד calibrant עבור m / z (למשל, נתרן formate או נתרן יודיד). - בדף הכוונון של מסוף הקוורץ, עבור לכרטיסיה Fluidics . הגדר את נוזלים מדגם למאגר C ואת נוזל הייחוס למאגר B. החדיר את שני הפתרונות ברציפות במקור היון כדי לבדוק את אות MS.
- בצע את הגדרת ADC, הגדרת גלאי (באמצעות LEU ENK) וכיול המוני (עיין בטבלת החומרים עבור פתרון הכיול) מהדף הגדרת מכשירים בהתאם להוראות היצרן.
- מניחים את מיכלי הנוזלים המלאים בתקנים המתאימים המסופקים על ידי היצרן במערכת הנוזלים: מאגר B ('Lockmass'): 10 pg/μL לאוצין אנקפלין (LEU ENK) ב 50:50 ACN / H2O + 0.1% חומצה פורמית; מאגר C ('קליברנט'): MajorMix.
- הקלט רכישת IMS של פתרון הכיול באמצעות הפרדת מעבר יחידה (השתמש בה עבור כיול IMS חיצוני).
הערה: מקור היונים ופרמטרי הגל הנודד (TW) (גובה הגל הסטטי ומהירות הגל) חייבים להישמר קבועים במהלך כל הרכישות (כיול ורכישות). אם למשתמש אין ידע מוקדם על הפרמטרים האופטימליים עבור המדגם שלו, שלב זה יכול להתבצע לאחר שלב 3 של הפרוטוקול (עבור [M+Li]+ תוספות של אוליגוסכרידים ניטרליים, התוצאות הייצוגיות משתמשות בגובה TW של 16 V ומהירות TW של 350 מ'/ש', המעניקות את התוצאות הטובות ביותר).- מהכרטיסיה Fluidics , בחר מדגם מיקום מבולבל והטמיע את הקליברנט (ראה טבלת החומרים) במקור היונים (באמצעות מערכת הנוזלים המובנית) באמצעות הבדיקה 'מדגם' בקצב זרימה של 10 μL / min.
- הגדר רצף IMS של מעבר יחיד. מהדף 'כוונון' , מקם את הכלי במצב ניידות ופתח את החלון בקרת רצף מחזורי . בחר מצב מתקדם . בכרטיסיה פונקציות מחזוריות של חלון חדש זה, בחר הוסף חבילה ולאחר מכן מעבר יחיד/מרובה. המתן עד שרצף של אירועי ניידות יופיע בכרטיסיה רצף של אותו חלון.
הערה: כדי להפעיל את התצוגה בזמן אמת, על המשתמש להחיל את פרמטרי המכשיר: לחץ על הכוונון במצב TOF או על הפעל במצב ניידות. לפני העברת המכשיר בין מצבי TOF למצבי ניידות, יש צורך לבטל כל רכישה פועלת (כולל תצוגת הדף Tune). השפע היחסי של יונים עשוי להשתנות בין מצב TOF למצב ניידות עקב שינויים בפרמטרי העברת היונים. - התאם את הרצף כך שכל היונים הקליברנטיים יבצעו מעבר יחיד סביב מסלול המרוצים המחזורי של IMS. אין לשנות את זמן ההזרקה או את ההוצאה ולרכוש זמן; עם זאת, צמצם את הזמן הנפרד ל- 1 אלפיות השנייה (בכרטיסיה רצף ). אם יונים מסוימים של תערובת הכיול אינם מתאימים בחלון זמן ההגעה המוצג, שנה את הסינכרון של ה- IMS עם הדוחף של מנתח TOF התאוצה האורתוגונלית על-ידי הגדלת מספר הדחפים לסל בכרטיסיה הגדרות ADC .
הערה: הזמנים ברצף הבקרה שולטים רק במערך הרב-תכליתי עבור גוון gating. כל עוד היונים עוסקים במעבר הראשון שלהם (או nth) סביב מסלול המרוצים, הם יסיימו את המעבר האמור גם אם הכיוון של TW השתנה במערך בינתיים. הפחתת זמן ההפרדה ל- 1 אלפיות השנייה פירושה שהמערך יעבור למצב פליטה לאחר 1 אלפיות השנייה. זה מבטיח כי היונים מהר יותר לא יהיה מספיק זמן לעבור את המערך ולעסוק במעבר שני לפני היונים איטיים יותר לסיים את המעבר הראשון שלהם. לכן, כל היונים יהיו כפופים לאותו מספר של מעברים (כלומר, מעבר אחד), אשר יש צורך לבצע כיול IMS. - תרשום רכישה של 2 דקות. בחלון בקרת רצף מחזורי , לחץ על רכישה כדי לפתוח את החלון המוקפץ הגדרות רכישה . הזן את שם הקובץ, התיאור ואורך הרכישה (דקות) ולחץ על שמור.
- רשום רכישה נוספת של 2 דקות של פתרון הכיול באותם תנאים כמו שלב 2.3 (השתמש בזה כדי לבדוק את איכות הכיול של CCS). בחלון בקרת רצף מחזורי , לחץ על רכישה כדי לפתוח את החלון המוקפץ הגדרות רכישה . הזן את שם הקובץ, התיאור ואורך הרכישה (דקות) ולחץ על שמור.
- לשטוף ביסודיות את מערכת fluidics עם 50:50 H2O / ACN כדי למנוע התגבשות של calibrant בצנרת הצצה.
3. רכישת IMS/IMS-MS
- באמצעות משאבת מזרק, להחדיר את המדגם (מסומם ליתיום) ב 10 מיקרוגרם / מ"ל דרך הבדיקה מדגם בקצב זרימה של 10 μL / min.
- העבר את הכלי למצב TOF (מדף כוונון MS ) כדי לבדוק את יציבות האות. רשום רכישת טרשת נפוצה מלאה (1 דקות) של המדגם, אשר יהיה שימושי כדי לבדוק את התבנית האיזוטופית ואת נוכחותם של מזהמים פוטנציאליים.
הערה: מכיוון שריכוז המדגם נבחר כדי לקבל אות יון טוב עבור השברים, ניתן לצפות ברוויה של TOF בשלב זה. ניתן לזהות רוויית TOF באמצעות הממצאים הבאים: (i) רזולוציית טרשת נפוצה מוגברת באופן מלאכותי, (ii) שינוי ביחסים איזוטופיים, ו- (iii) שפע של פסגות בשפע נמוך בין איזוטופים. השתמש בעדשת DRE (שיפור טווח דינמי, הכרטיסיה פרופיל Quad/MS/DRE של דף הכוונון הראשי) כדי להחליש את העברת היונים ולמחוק את הרוויה במצב TOF (איור 2A,B). - שים את המכשיר במצב MSMS (הכרטיסיה פרופיל Quad/MS של דף המנגינה הראשי) ובחר את המסה של היון הממוקד בשדה מסה MSMS לבידוד ברביעייה (בדוגמה: m/z של 685.2, המתאים למין היוני [M+Li]+ של הפנטסכריד הארבינוקסילן). רשום רכישה של דקה אחת כדי לבדוק את בידוד המבשר בעת עיבוד הנתונים.
הערה: תוספות ליתיום יש איזוטופ ב--1 Da של הפסגה המונואיזוטופית, אשר יש להסיר מחלון הבחירה של MS / MS, כך שזה לא יפריע לשלבי העיבוד. ניתן להסיר אותו על-ידי צמצום טווח הבחירה באמצעות הפרמטרים רזולוציית LM ורזולוציית HM בכרטיסיה פרופיל Quad/MS (איור 2C). - הגדר רצף IMS "חיתוך" כדי לבצע בחירה מבוססת ניידות של איזומר העניין.
- העבר את המכשיר למצב ניידות (ראה שלב 2.3.2). בחלון בקרת רצף מחזורי , מהכרטיסיה פונקציות מחזוריות , בחר הוסף חבילה ולאחר מכן חתך. המתן להופעת רצף מורכב של אירועי ניידות בכרטיסיה רצף (איור 3).
הערה: ניתן לדמיין כל שלב בתהליך IMS/IMS: לחץ על האירוע 'הוצא ורכוש' בכרטיסיה 'רצף'. לאחר סימון באדום, העבר אותו למיקום המתאים בתוך הרצף באמצעות הלחצנים למעלה ולמטה. - מקם את האירוע 'הוצא ורכוש ' מיד לאחר האירוע הנפרד הראשון (כלומר, הזז אותו בשורה 3 במקום בשורה 8 ברצף כפי שמוצג באיור 3) ולאחר מכן לחץ על הפעל. חפש את תוצאות ההפרדה הראשונית שיוצגו בזמן אמת. הגדל את משך הזמן של האירוע הנפרד הראשון עבור הפרדה מרובת מעברים על-ידי שינוי ערך הזמן עבור אירוע זה ברצף עד שהרזולוציה של פסגות IMS תהיה משביעת רצון. הקלט רכישה של דקה אחת לעיון.
הערה: שים לב לערך השהיית ההתחלה של ADC בכרטיסיה הגדרת ADC : יהיה שימושי לבדוק את איכות הבידוד. - לחץ על השהה. שים לב שתוצאות ההפרדה הראשונית מוצגות, אם כי שינויים ברצף הפקדים לא יוחלו עד שהמשתמש ילחץ שוב על הפעל . מקם את האירוע 'הוצא ורכוש' מתחת לאירועי 'הוצא', 'הוצא' ל'חנות מקדימה' ו'חסימה והוצאה' . התאם את משך האירועים כך שהשיא הממוקד יהיה באזור 'הוצא אל טרום-חנות' , וכל יון אחר נמצא באזור 'הוצא ' או 'החזק' ו'הוצא' .
הערה: ניתן לדמיין את משך הזמן של שלושת האירועים הללו בהשוואה להפצות זמן ההגעה (ATDs) באמצעות סרגל מקודד בצבע מתחת לספקטרום הניידות בכרטיסיה Mobilogram (איור 3). - מקם את האירוע 'הוצאה ורכישה' בסוף הרצף, מתחת להוצאה מחדש מקדם-חנות והאירועים הנפרדים השניים. לחץ על הפעל כדי להציג את האוכלוסיה שנבחרה.
הערה: מאחר שהאוכלוסייה שנבחרה עזבה את תא ה- IMS, כל ההפרדות הקודמות אבדו והיא חוזרת להפרדה של מעבר יחיד (הרצויה). - בדוק את איכות הבידוד. כדי לוודא שרק שיא העניין נבחר, בצע את אותה הפרדה לאחר החזרה למצב הקודם (כלומר, אותו זמן נפרד ) כפי שמוצג באיור 4. הקלט רכישה של דקה אחת לעיון.
הערה: המשתמשים מוזמנים לבדוק את האוכלוסייה שנפלטה; חלון הזמן 'הוצא לקדם-חנות' צריך להיות ברמה בסיסית (איור 4B). כדי לבדוק זאת, מקם את השהיית ההתחלה של ADC במצב ידני בכרטיסיה הגדרות ADC והזן את זמן ההשהיה שצוין בשלב 3.4.2. הקלט רכישה של דקה אחת לעיון. - בכרטיסיה רצף , בעמודה לצד זמני האירוע המוגדרים על-ידי המשתמש (העמודה Time Abs , המסומנת באדום), חפש את הזמנים המסוכמים של כל האירועים. שימו לב לשרירי הבטן של הזמן שנמצאו על קו האירוע Reinject מקדם-חנות לביצוע כיול CCS.
- העבר את המכשיר למצב ניידות (ראה שלב 2.3.2). בחלון בקרת רצף מחזורי , מהכרטיסיה פונקציות מחזוריות , בחר הוסף חבילה ולאחר מכן חתך. המתן להופעת רצף מורכב של אירועי ניידות בכרטיסיה רצף (איור 3).
- לפצל את הפסגה הממוקדת בין שני הסיבובים של IMS. שנה את המתחים של שלב החזרה כדי להגדיל את האנרגיה הקינטית של היונים, ושבר אותם עם התנגשות עם גז ניידות היונים.
- הגדר את משך האירוע Separate ישירות לפני ההוצאה והרכישה ל- 1 אלפיות השנייה (ראה הסבר בשלב 2.3.3).
- בשורה הוצא מחדש מקדם-חנות , סמן את התיבה אפשר הפעלה ומטב את הפיצול עם הפקד המוכלל. אם הספקטרום משביע רצון (לדוגמה, שיא הבסיס הוא שבר), המשך ישירות לשלב 3.5.4.
הערה: בעת הפעלת הפעלה, שלושה מתחים על הקו יהפכו לאפורים: אלה המתחים שהמשתמש צריך לשנות אם נדרש אופטימיזציה ידנית של המתחים (ראה את השלב הבא). שלושת המתחים הללו (מעבר צבע קדם-מערך, הטיית קדם-מערך והיסט מערך) יוצרים את מעבר הצבע המשמש להפעלת היונים. האנרגיה הקינטית של היונים תגדל עם השיפוע בין ההטיה טרום-מערך להיסט המערך (ראו איור 5). ערכי ברירת המחדל של ערכי היסט → הטיית מעבר צבע → הם: ללא הפעלה 85 → 70 → 45 V; הפעלה מרבית של הפונקציה המובנית 185 → 170 → -5 V (+150 V). לאחר הפיצול, אל תשכח להתאים מחדש את שידור היונים באמצעות עדשת DRE (להקטין את ההנחתה של האות) (ראה שלב 3.2.). - אם הפיצול אינו משביע רצון עם הפקד המובנה, בטל את הסימון בתיבה אפשר הפעלה והמשך לייעל באופן ידני את מתחי ההחזרה. הגדל את מתח מעבר הצבע לפני המערך (מתח ההטיה טרום-מערך חייב תמיד להישמר 15 V מתחת למעבר הצבע טרום-מערך), והורד את מתח היסט המערך (שניתן להגדירו כשלילי) עד שהתוצאות יהיו משביעות רצון.
הערה: בעת כוונון ידני של המתחים של המערך הרב-תכליתי, המשתמש יכול לעבור מהתצוגה 'Mobilogram' לשרטוטים אינטראקטיביים של המתחים המוחלים במערך הרב-תכליתי (תרשים PE) כדי להמחיש טוב יותר את הגדרות המתח (איור 5A). - רשום רכישה של 2 דקות. בחלון המוקפץ של הרכישה, סמן את האפשרות שמור על זמן דריפט כדי ליצור קובץ המכיל רק את זמני ההגעה לעומת m/z (זמן הרכישה המשמש לניתוחים כרומטוגרפיים - זמן השמירה -מוסר מהקובץ). שים לב שקובץ זה מסומן בשם *_dt. RAW.
הערה: אם המשתמש שוכח לבדוק את האפשרות שמור על זמן דריפט , עדיין ניתן לחלץ את ממד IMS באמצעות תוכנת Driftscope 2.9 (קובץ | ייצוא ל- MassLynx | שמור על זמן דריפט).
- סובבו את המכשיר בחזרה למצב TOF בעמוד הכוונון הראשי, ושטפו את המערכת ביסודיות עם 50:50 MeOH/H2O לפני שתמשיכו במדגם הבא.
4. עיבוד IMS/IMS-MS עם MZmine 224
הערה: MZmine 2 זמין מכתובת ה- URL שניתנה בטבלת החומרים. מומלץ להשתמש ב- MZmine 2.51. בעת הכנת כתב יד זה, הגירסאות המאוחרות יותר אינן יכולות לפתוח קבצי RAW ממכשירי IMS מחזוריים עקב שינוי בפונקציית הייבוא.
- יבא את הקבצים הגולמיים המכילים רק את ממדי IMS ו- m/z (*_dt. RAW) באמצעות שיטות נתונים גולמיות | ייבוא נתונים גולמי.
הערה: קבצים גולמיים יופיעו בצד שמאל של החלון הראשי של MZmine. אל תייבא את *המקורי . קבצי RAW שעדיין מכילים את ממד זמן השמירה. MZmine אינו מבחין בין זמן שמירה לזמן ההגעה של IMS, ונקודות הנתונים של שני הממדים יחפפו. - מטב את פרמטרי זרימת העבודה בקובץ מייצג על-ידי בחירתו במקטע קבצי נתונים גולמיים רשימה.
- הערך את רמת הרעש בנתונים. לחץ באמצעות לחצן העכבר הימני על הקובץ ברשימה קבצי נתונים גולמיים , בחר הצג TIC והצג את שיא הבסיס "כרומטוגרמה" (BPC). לחץ פעמיים על הפסגה הקטנה ביותר הנצפית בעין כדי להציג את ספקטרום המסה שלה. שקול את רמת הרעש בנתונים להיות סביב זה של האיזוטופ השני של שיא הבסיס בספקטרום זה, ולהשתמש באותו ערך עבור כל סף העוצמה בשלבי העיבוד הבאים.
הערה: הנתונים נרכשו באמצעות בידוד מרובע ולכן נחשבים על ידי MZmine כמו MS / MS. לאורך כל עיבוד MZmine, הקפד לעבוד ברמת MS = 2. - בצע את זיהוי ההמונים באמצעות שיטות נתונים גולמיות | | לזיהוי תכונות גילוי המוני. לקבלת נתונים שנרכשו במצב פרופיל, השתמש באלגוריתם התמרת Wavelet . כדי להגדיר את הפרמטרים של האלגוריתמים ב- MZmine, לחץ על לחצן [...] לצד האלגוריתם והשתמש באפשרות הצג תצוגה מקדימה כדי לדמיין את הנתונים תוך מיטוב הפרמטרים.
הערה: בשלב זה, הפסגות שנבחרו על ידי האלגוריתם יופיעו באדום בחלון התצוגה המקדימה. בעת שימוש באלגוריתם המרת גל על קבצי RAW קנייניים, MZmine לפעמים יטעה בנקודות נתוני הפרופיל עבור פסגות ממוקדות. התוכנה תציג הודעה המציינת כי המשתמש מפעיל אלגוריתם פרופיל על ספקטרום centroided: התעלם מהודעה זו ולחץ על אישור. - לשחזר את ספקטרום ניידות היונים שחולץ (EIM) עבור כל מסה שבר באמצעות שיטות נתונים Raw | | לזיהוי תכונות בונה הכרומטוגרמה של ADAP ברשימת ההמונים 'ההמונים' שנוצרה על ידי השלב הקודם. מכיוון שקלט העמידות ל- m/z בשלב זה הוא עמידות לסריקה לסריקה, הקפד להשאיר אותו גבוה לפחות פי 3-4 מהדיוק הכולל הצפוי.
- מכיוון שהשלב הקודם אינו כולל אפשרות תצוגה מקדימה, בדוק את איכות בחירת השיא ישירות באמצעות רשימת התכונות שהופיעה בחלונית הימנית של חלון MZmine הראשי. פתח את הרשימה תכונות, בחר את כל השורות, לחץ באמצעות לחצן העכבר הימני ובחר הצג/XIC (דו-שיח). לחץ על הכל כדי להציג את כל היונים בספקטרום הניידות. בדוק את הפסגות שנבחרו המופיעות בצבע כדי לוודא שאין פסגות שהוחמצו בבירור.
- נתק את ה- EIMs כדי לפצל את ה - m/z המכילים פסגות שונות בתכונות מרובות. השתמש בשיטות של רשימת תכונות | | לזיהוי תכונות פירוק כרומטוגרמה, ובחר את אלגוריתם Wavelets (ADAP). מטב את האלגוריתם עבור הנתונים באמצעות האפשרות הצג תצוגה מקדימה ופרמטרי המפתח הבאים: סף S/N, סף מקדם/אזור וטווח גל RT.
הערה: מומלץ לבדוק את ההיבט של הספקטרום המבולבל. השתמש בכלי הפריט החזותי כרומטוגרמה, כמתואר בשלב 4.2.4. הפסגות המפותקות יופיעו בצבע, ויש לפצל פסגות של אותה מסה, כפי שמוצג באיור 6A. - Deisotope EIMs מנותק באמצעות שיטות רשימת תכונות | איזוטופים | לוקוס פסגות איזוטופיות. השתמש בדיוק הצפוי של המכשיר עבור ערך העמידות m/z , והגדר את עמידות זמן ההגעה ל- 0.1 אלפיות השנייה (מוצגת ב- MZmine כסובלנות זמן שמירה 0.1 דקות), מכיוון שאיזוטופים אינם נפתרים במהלך הפרדת IMS. בדוק את רשימת התכונות: אם נותרו איזוטופים כלשהם, הגדל את ערכי הסבילות.
הערה: למרות deisotoping יכול להתבצע באופן תיאורטי בכל רגע של עיבוד רשימת התכונות, חשוב לעשות את זה אחרון, כך ערכי החיוב ניתן לייצא (האלגוריתמים המשמשים עבור השלבים האחרים לפעמים להסיר את פרטי מצב החיוב).
- הערך את רמת הרעש בנתונים. לחץ באמצעות לחצן העכבר הימני על הקובץ ברשימה קבצי נתונים גולמיים , בחר הצג TIC והצג את שיא הבסיס "כרומטוגרמה" (BPC). לחץ פעמיים על הפסגה הקטנה ביותר הנצפית בעין כדי להציג את ספקטרום המסה שלה. שקול את רמת הרעש בנתונים להיות סביב זה של האיזוטופ השני של שיא הבסיס בספקטרום זה, ולהשתמש באותו ערך עבור כל סף העוצמה בשלבי העיבוד הבאים.
- אם מעבדים ספקטרום IMS/IMS-MS מרובים, חזור על העיבוד עם פרמטרים ממוטבים אלה. שמור את אותם פרמטרים לכל הספקטרום.
- במקרה של ספקטרום מרובה, קבץ אותם בטבלה אחת כדי לייצא אותם; אם לא, דלג ישירות לשלב 4.5. כדי לקבץ את הספקטרום, השתמש בשיטות של רשימת תכונות | יישור | הצטרף ליישור. מכיוון שהמטרה היא לא ליישר את הפסגות, השתמש בערכי עמידות מגבילים הן עבור m /z והן עבור זמן ההגעה. תן את אותו משקל לשני הממדים.
- יצא את רשימת התכונות הסופית לקובץ *.csv . שימוש בשיטות של רשימת תכונות | | ייצוא/ייבוא יצא לקובץ CSV וייצא את הערכים הבאים: יצא שורה m/z, יצא זמן שמירה של שורה (זמן ההגעה בפועל של IMS), שיא m/z וגובה שיא. השתמש בפסיק כמפריד שדות.
5. TWCCSN2 של ספקטרום IMS/IMS ממוקד
הערה: בפרוטוקול זה, ייעשה שימוש בכיול התאמה לוגריתמית25,26, אשר נוטה לתת תוצאות טובות יותר מאשר כיול ליניארי וקל ליישום בגיליון אלקטרוני או סקריפט עיבוד בתוך הבית. סקריפט פנימי (שנכתב ב- R) זמין בכתובת ה- URL שניתנה בטבלת החומרים.
- בחר את ערכי זמן ההגעה של ההפניה מהרכישה הקליברית (ראה שלב 2.3). בצע זאת באופן ידני באמצעות תוכנת הבנאי (עיין בטבלת החומרים) כדי לבדוק את ההיבט של כל פסגות הכיול של IMS.
- בחלון כרומטוגרמה , פתח את *_dt. קובץ RAW המתאים לכיול.
- עבור כל נקודת כיול, צור את ה- EIM באמצעות | תצוגה אפשרות המונית .
- בדוק את הפרופיל של EIMs. אם חלקם מוגדרים בצורה גרועה, החליקו אותם באמצעות התהליך | אפשרות חלקה (מכיוון שהתוצאות הטובות ביותר מתקבלות בדרך כלל עם האלגוריתם Savitzky-Golay, חלק פי 2 על פני 3 סלים). דווח על ערכי השיא בגיליון אלקטרוני.
הערה: מכיוון שנקודות ההתייחסות נרכשות בדרך כלל באמצעות התקני DTIMS ברזולוציה נמוכה, חלק מההפצות הרב-מודאליות עשויות להופיע ב- IMS מחזורי בהתאם לכיולים. הסר כל שיא המציג התפלגות כזו מרשימת הכיול.
- חשב את פרמטרי ההתאמה הלוגריתמית מהכיולים.
- עבור כל נקודות הכיול, חשב את הנקודות הבאות.
- חשב את זמן הסחף באמצעות Eq (1):
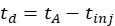 (1)
(1)
עם td זמן הסחף, tA זמן ההגעה הנמדד, ו tinj זמן ההזרקה בתא IMS (הכל בטרשת נפוצה).
הערה: עבור מולקולות קטנות, כגון שברי אוליגוסכריד, זמן הטיסה (זמן הטיסה בין היציאה מתא IMS לבין הגלאי) וריאציה בין מסות שונות נמצא בטווח השגיאות של כיול CCS וניתן להתעלם ממנו. - חישוב המסה הניטרלית של היונים באמצעות Eq (2):
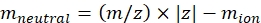 (2)
(2)
עם z מצב הטעינה של היון, ו יון המסה של יון הנגד (ב Da). השתמש במסות מדויקות כדי למנוע החדרת אי ודאות. אם קיים אובדן אטום במקום יון נגדי, השתמש בערכי יון שליליים (לדוגמה, עבור [M-H]-mneutral = (m/z) * |z| - (- 1.007276) = (m/z) * |z| + 1.007276). - חשב את הפרמטר של CCS באמצעות Eq (3):
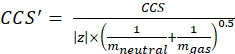 (3)
(3)
עם CCS ערך צינור נדידת הייחוס DTCCSN2 (ב- nm2), ו- mgas המסה של גז הסחף (ב- Da; ex. עבור חנקן: mgas = 28.01 Da). - חשב את הפרמטר td' באמצעות Eq (4):
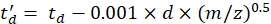 (4)
(4)
עם d עיכוב התחלת הגלאי המשמש באופן ניסיוני לתיקון לזמן מת (בדרך כלל ~ 1.5 אלפיות השנייה). - חשב לוגריתם של הפרמטרים לעיל:
ln (CCS') ו- ln (t'd)
- חשב את זמן הסחף באמצעות Eq (1):
- בצע רגרסיה ליניארית כדי לקבוע את מקדם R2 ואת הפרמטרים x ו - y של ההתאמה הלוגריתמית (עם x השיפוע ו - ln(y) היירוט) באמצעות Eq (5):
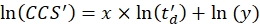 (5)
(5)
הערה: המשתמש יכול להתוות את ערכי ln(CCS') לעומת ln(td') כדי לבדוק באופן חזותי את תוצאות הכיול, אם כי זה אופציונלי.
- עבור כל נקודות הכיול, חשב את הנקודות הבאות.
- החל את הכיול על הנתונים הניסיוניים כדי לכייל את הפסגות שנבחרו על-ידי MZmine עבור כל ספקטרום IMS/IMS המיוצא לקובץ *.csv. עבור כל נקודה, חשב את הנקודות הבאות.
- חשב את זמן הסחף באמצעות Eq (6):
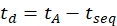 (6)
(6)
עם tseq הזמן שקדם להפרדת IMS הסופית (הערך 'Time Abs' שצוין בשלב 3.4.6).
הערה: אם כיול ספקטרום IMS/IMS מרובים שנרכשו עם רצפים שונים, בדוק בקפידה את ערכי tseq. - חשב את המסה הניטרלית של היונים באמצעות Eq (7):
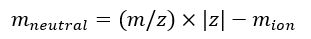 (7)
(7) - חשב את הפרמטרים td' ו- td'' באמצעות Eq (8) ו- Eq (9):
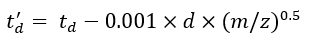 (8)
(8)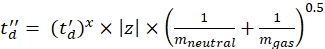 (9)
(9) - חשב את ערכי ה- CCS המכוילים הסופיים (TWCCSN2 ב- nm2) באמצעות Eq (10):
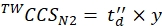 (10)
(10)
הערה: למרות שלב 5.2.2. נותן ln(y) כמו היירוט, y חייב לשמש כדי להשיג את הערך הסופי CCS. אל תשכח ליישם פונקציה מעריכית.
- חשב את זמן הסחף באמצעות Eq (6):
- בדוק את דיוק הכיול על-ידי החלת הכיול לרכישה השנייה של פתרון הכיול שנרכש בשלב 2.4.
הערה: הכיול אמור להניב תוצאות עם שגיאה של ~1-2%.
Access restricted. Please log in or start a trial to view this content.
תוצאות
פנטסכריד arabinoxylan, XA2XX, נבחר כדוגמה כדי להמחיש פרוטוקול זה. תרכובת זו זמינה מסחרית, אך רק כתערובת עם פנטסכריד ערבינוקסילן אחר, XA3XX (XA3XXX טהור זמין גם מסחרית). המבנים של XA2XX ו- XA3XX ניתנים באיור S1 משלים. כמו היחס של XA2XXX ו XA3XXX בתערובת המסחרית הוא ~ 50:50,...
Access restricted. Please log in or start a trial to view this content.
Discussion
ה- SELECT SERIES Cyclic IMS הוא כלי רב עוצמה המאפשר בחירת אוכלוסיית יונים מוגדרת - של ניידות m/z ויונים נתונה - ללא צורך בהפרדה כרומטוגרפית במעלה הזרם. המכשיר מאפשר ליצור מפת פיצול דו-שנתית של אוכלוסיית יונים זו, שממנה ניתן לחלץ הן MS / MS והן ספקטרום IMS / IMS / IMS. עם זאת, המשתמש חייב לציין מספר נקודות קריט?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
למחברים אין ניגוד אינטרסים לחשוף.
Acknowledgements
S.O. מודה לסוכנות המחקר הלאומית הצרפתית על מימון הדוקטורט שלו (הענק ANR-18-CE29-0006).
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 33-α-L- plus 23-α-L-Arabinofuranosyl-xylotetraose (XA3XX/XA2XX) mixture | Megazyme Ltd., Wicklow, Ireland | O-XAXXMIX | XA2XX + XA3XX mixture |
| 33-α-L-Arabinofuranosyl-xylotetraose (XA3XX) | Megazyme Ltd., Wicklow, Ireland | O-XA3XX | Pure XA3XX standard |
| Eppendorf Safe-Lock Tubes, 1.5 mL, Eppendorf Quality, colorless, 1,000 tubes | Eppendorf, Hamburg, Germany | 0030120086 | Used to prepare the carbohydrate stock solution and dilution |
| FALCON 50 mL Polypropylene Conical Tube 30 x 115 mm | Corning Science México S.A. de C.V., Reynosa, Tamaulipas, Mexico | 352070 | Used to prepare the aqueous stock solution of 100 mM LiCl |
| Lithium Chloride (ACS reagent, ≥99 %) | Sigma-Aldrich Inc., Saint Quentin Fallavier, France | 310468 | Used to dope the sample with lithium |
| Major Mix IMS/Tof Calibration Kit | Waters Corp., Wilmslow, UK | 186008113 | Calibration solution for MS and IMS |
| MassLynx 4.2 SCN1016 Release 6 (Waters Embedded Analyser Platform for Cyclic IMS 2.9.1 Release 9) | Waters Corp., Wilmslow, UK | 721022377 | Cyclic IMS vendor software for instrument control and data processing |
| Methanol for HPLC PLUS Gradient grade | Carlo-Erba Reagents, Val de Reuil, France | 412383 | High-purity solvent |
| MS Leucine Enkephaline Kit | Waters Corp., Wilmslow, UK | 700002456 | Reference compound used for tuning of the mass spectrometer |
| SCHOTT DURAN 100 mL borosilicate glass bottle | VWR INTERNATIONAL, Radnor, Pennsylvania, US | 218012458 | Used to prepare the solution of 500 µM LiCl in 50:50 MeOH/Water |
| SELECT SERIES Cyclic IMS | Waters Corp., Wilmslow, UK | 186009432 | Ion mobility-mass spectrometer equipped with a cylic IMS cell |
| Website: http://mzmine.github.io/ | MZmine Development Team | - | Link to download the MZmine software |
| Website: https://github.com/siollivier/IM-MN | INRAE, UR BIA, BIBS Facility, Nantes, France | - | Link to an in-house R script containing a CCS calibration function |
References
- Allard, P. -M., et al. Integration of molecular networking and in-silico MS/MS fragmentation for natural products dereplication. Analytical Chemistry. 88 (6), 3317-3323 (2016).
- Wang, M., et al. Mass spectrometry searches using MASST. Nature Biotechnology. 38 (1), 23-26 (2020).
- David, M., Fertin, G., Rogniaux, H., Tessier, D. SpecOMS: a full open modification search method performing all-to-all spectra comparisons within minutes. Journal of Proteome Research. 16 (8), 3030-3038 (2017).
- Dührkop, K., et al. SIRIUS 4: a rapid tool for turning tandem mass spectra into metabolite structure information. Nature Methods. 16 (4), 299-302 (2019).
- Wang, M., et al. Sharing and community curation of mass spectrometry data with Global Natural Products Social Molecular Networking. Nature Biotechnology. 34 (8), 828-837 (2016).
- Nothias, L. -F., et al. Feature-based molecular networking in the GNPS analysis environment. Nature Methods. 17 (9), 905-908 (2020).
- Gray, C. J., et al. Advancing solutions to the Carbohydrate Sequencing Challenge. Journal of the American Chemical Society. 141 (37), 14463-14479 (2019).
- Ropartz, D., et al. Online coupling of high-resolution chromatography with extreme UV photon activation tandem mass spectrometry: Application to the structural investigation of complex glycans by dissociative photoionization. Analytica Chimica Acta. 933, 1-9 (2016).
- Wolff, J. J., et al. Negative electron transfer dissociation of glycosaminoglycans. Analytical Chemistry. 82 (9), 3460-3466 (2010).
- Ropartz, D., et al. Charge transfer dissociation of complex oligosaccharides: comparison with collision-induced dissociation and extreme ultraviolet dissociative photoionization. Journal of the American Society for Mass Spectrometry. 27 (10), 1614-1619 (2016).
- Morelle, W., et al. Fragmentation characteristics of permethylated oligosaccharides using a matrix-assisted laser desorption/ionization two-stage time-of-flight (TOF/TOF) tandem mass spectrometer. Rapid Communications in Mass Spectrometry. 18 (22), 2637-2649 (2004).
- Gabelica, V., Marklund, E. Fundamentals of ion mobility spectrometry. Current Opinion in Chemical Biology. 42, 51-59 (2018).
- Gabelica, V., et al. Recommendations for reporting ion mobility mass spectrometry measurements. Mass Spectrometry Reviews. 38 (3), 291-320 (2019).
- Hernandez-Mesa, M., et al. Interlaboratory and interplatform study of steroids collision cross section by traveling wave ion mobility spectrometry. Analytical Chemistry. 92 (7), 5013-5022 (2020).
- Koeniger, S. L., et al. An IMS-IMS analogue of MS-MS. Analytical Chemistry. 78 (12), 4161-4174 (2006).
- Merenbloom, S. I., Koeniger, S. L., Valentine, S. J., Plasencia, M. D., Clemmer, D. E. IMS−IMS and IMS−IMS−IMS/MS for separating peptide and protein fragment ions. Analytical Chemistry. 78 (8), 2802-2809 (2006).
- Eldrid, C., Thalassinos, K. Developments in tandem ion mobility mass spectrometry. Biochemical Society Transactions. 48 (6), 2457-2466 (2020).
- Giles, K., et al. A cyclic ion mobility-mass spectrometry system. Analytical Chemistry. 91 (13), 8564-8573 (2019).
- Merenbloom, S. I., Glaskin, R. S., Henson, Z. B., Clemmer, D. E. High-resolution ion cyclotron mobility spectrometry. Analytical Chemistry. 81 (4), 1482-1487 (2009).
- Ollivier, S., et al. Anomeric retention of carbohydrates in multistage cyclic ion mobility (IMSn): de novo structural elucidation of enzymatically produced mannosides. Analytical Chemistry. 93 (15), 6254-6261 (2021).
- Ollivier, S., Fanuel, M., Rogniaux, H., Ropartz, D. Molecular networking of high-resolution tandem ion mobility spectra: a structurally relevant way of organizing data in glycomics. Analytical Chemistry. 93 (31), 10871-10878 (2021).
- Aron, A. T., et al. Reproducible molecular networking of untargeted mass spectrometry data using GNPS. Nature Protocols. 15 (6), 1954-1991 (2020).
- McKenna, K. R., Li, L., Krishnamurthy, R., Liotta, C. L., Fernández, F. M. Organic acid shift reagents for the discrimination of carbohydrate isobars by ion mobility-mass spectrometry. The Analyst. 145 (24), 8008-8015 (2021).
- Pluskal, T., Castillo, S., Villar-Briones, A., Orešič, M. MZmine 2: Modular framework for processing, visualizing, and analyzing mass spectrometry-based molecular profile data. BMC Bioinformatics. 11, 395(2010).
- Ruotolo, B. T., Benesch, J. L. P., Sandercock, A. M., Hyung, S. -J., Robinson, C. V. Ion mobility-mass spectrometry analysis of large protein complexes. Nature Protocols. 3 (7), 1139-1152 (2008).
- Bush, M. F., Hall, Z., Giles, K., Hoyes, J., Robinson, C. V., Ruotolo, B. T. Collision cross sections of proteins and their complexes: a calibration framework and database for gas-phase structural biology. Analytical Chemistry. 82 (22), 9557-9565 (2010).
- Ropartz, D., et al. Structure determination of large isomeric oligosaccharides of natural origin through multipass and multistage cyclic traveling-wave ion mobility mass spectrometry. Analytical Chemistry. 91 (18), 12030-12037 (2019).
- Tolmachev, A. V., et al. Characterization of ion dynamics in structures for lossless ion manipulations. Analytical Chemistry. 86 (18), 9162-9168 (2014).
- Arndt, J. R., et al. High-resolution ion-mobility-enabled peptide mapping for high-throughput critical quality attribute monitoring. Journal of the American Society for Mass Spectrometry. 32 (8), 2019-2032 (2021).
- Le Fèvre, A., Dugourd, P., Chirot, F. Exploring conformational landscapes using trap and release tandem ion mobility spectrometry. Analytical Chemistry. 93 (9), 4183-4190 (2021).
- Ohshimo, K., He, X., Ito, R., Misaizu, F. Conformer separation of dibenzo-crown-ether complexes with Na+ and K+ ions studied by cryogenic ion mobility-mass spectrometry. The Journal of Physical Chemistry A. 125 (17), 3718-3725 (2021).
- Purves, R. W., Barnett, D. A., Ells, B., Guevremont, R. Gas-phase conformers of the [M + 2H]2+ ion of bradykinin investigated by combining high-field asymmetric waveform ion mobility spectrometry, hydrogen/deuterium exchange, and energy-loss measurements. Rapid Communications in Mass Spectrometry. 15 (16), 1453-1456 (2001).
- Ujma, J., et al. Cyclic ion mobility mass spectrometry distinguishes anomers and open-ring forms of pentasaccharides. Journal of the American Society for Mass Spectrometry. 30 (6), 1028-1037 (2019).
- Warnke, S., Faleh, A. B., Scutelnic, V., Rizzo, T. R. Separation and identification of glycan anomers using ultrahigh-resolution ion-mobility spectrometry and cryogenic ion spectroscopy. Journal of The American Society for Mass Spectrometry. 30 (11), 2204-2211 (2019).
- Williamson, D. L., Bergman, A. E., Nagy, G. Investigating the structure of α/β carbohydrate linkage isomers as a function of group I metal adduction and degree of polymerization as revealed by cyclic ion mobility separations. Journal of the American Society for Mass Spectrometry. 32 (10), 2573-2582 (2021).
- Myers, O. D., Sumner, S. J., Li, S., Barnes, S., Du, X. One step forward for reducing false positive and false negative compound identifications from mass spectrometry metabolomics data: new algorithms for constructing extracted ion chromatograms and detecting chromatographic peaks. Analytical Chemistry. 89 (17), 8696-8703 (2017).
- Marchand, A., Livet, S., Rosu, F., Gabelica, V. Drift tube ion mobility: how to reconstruct collision cross section distributions from arrival time distributions. Analytical Chemistry. 89 (23), 12674-12681 (2017).
- Davis, D. M., et al. Analysis of ion mobility spectra for mixed vapors using Gaussian deconvolution. Analytica Chimica Acta. 289 (3), 263-272 (1994).
- Polasky, D. A., Dixit, S. M., Fantin, S. M., Ruotolo, B. T. CIUSuite 2: next-generation software for the analysis of gas-phase protein unfolding data. Analytical Chemistry. 91 (4), 3147-3155 (2019).
- Salbo, R., et al. Traveling-wave ion mobility mass spectrometry of protein complexes: accurate calibrated collision cross-sections of human insulin oligomers. Rapid Communications in Mass Spectrometry. 26 (10), 1181-1193 (2012).
- Gelb, A. S., Jarratt, R. E., Huang, Y., Dodds, E. D. A study of calibrant selection in measurement of carbohydrate and peptide ion-neutral collision cross sections by traveling wave ion mobility spectrometry. Analytical Chemistry. 86 (22), 11396-11402 (2014).
- Richardson, K., Langridge, D., Dixit, S. M., Ruotolo, B. T. An improved calibration approach for traveling wave ion mobility spectrometry: robust, high-precision collision cross sections. Analytical Chemistry. 93 (7), 3542-3550 (2021).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved