A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
אפיון תלת מימדי של אתרי מגע בין-אורגניים בהפטוציטים באמצעות מיקרוסקופיית אלקטרונים חתך טורי
In This Article
Summary
פרוטוקול פשוט ומקיף לרכישת פרטים תלת מימדיים של אתרי מגע ממברנה בין אברונים בהפטוציטים מהכבד או תאים ברקמות אחרות.
Abstract
מיקרוסקופיית אלקטרונים של תמסורת נחשבת זה מכבר לתקן הזהב להדמיה של מבנה-על תאי. עם זאת, האנליזה מוגבלת לעתים קרובות לשני ממדים, מה שמקשה על היכולת לתאר באופן מלא את המבנה התלת-ממדי (התלת-ממדי) ואת הקשר התפקודי בין האברונים. מיקרוסקופיית אלקטרונים בנפח (vEM) מתארת אוסף של טכניקות המאפשרות חקירה של מבנה-על תאי בתלת-ממד ברזולוציות מזוקליות, מיקרו-קנה מידה וננומטריות.
פרוטוקול זה מספק שיטה נגישה וחזקה להשגת נתוני vEM באמצעות EM (TEM) של העברת מקטעים טוריים ומכסה את ההיבטים הטכניים של עיבוד דגימות עד לשחזור תלת-ממדי דיגיטלי בתהליך עבודה יחיד ופשוט. כדי להדגים את התועלת של טכניקה זו, מוצג הקשר האולטרה-סטרוקטורלי התלת-ממדי בין הרשתית האנדופלסמית והמיטוכונדריה לבין אתרי המגע שלהם בהפטוציטים בכבד. מגעים בין-אורגניים ממלאים תפקידים חיוניים בהעברת יונים, שומנים, חומרים מזינים ומולקולות קטנות אחרות בין אברונים. עם זאת, למרות הגילוי הראשוני שלהם בהפטוציטים, עדיין יש הרבה מה ללמוד על התכונות הפיזיות שלהם, הדינמיקה והתפקודים שלהם.
אנשי קשר בין-אורגניים יכולים להציג מגוון של מורפולוגיות, המשתנות בסמיכות של שני האברונים זה לזה (בדרך כלל ~ 10-30 ננומטר) ובהיקף אתר המגע (החל מאנשי קשר נוקבים וכלה באנשי קשר תלת-ממדיים גדולים יותר דמויי ציסטרנל). בדיקת מגעים קרובים דורשת הדמיה ברזולוציה גבוהה, ו- TEM מקטע סדרתי מתאים היטב כדי לדמיין את האולטרה-סטרוקטורל התלת-ממדי של מגעים בין-אורגניים במהלך התמיינות הפטוציטים, כמו גם שינויים בארכיטקטורת הפטוציטים הקשורים למחלות מטבוליות.
Introduction
מאז המצאתם בשנות ה-30 של המאה ה-20, מיקרוסקופי אלקטרונים אפשרו לחוקרים לדמיין את המרכיבים המבניים של תאים ורקמות 1,2. רוב החקירות סיפקו מידע דו-ממדי, שכן בניית מודלים תלת-ממדיים דורשת איסוף מקטעים סדרתיים קפדניים, צילום ידני, עיבוד שלילי, מעקב ידני, יצירה והרכבה של מודלים תלת-ממדיים מיריעות זכוכית, פלסטיק או קלקר 3,4. כמעט 70 שנה לאחר מכן, חלה התקדמות ניכרת בהיבטים רבים של התהליך, החל מביצועי מיקרוסקופ, איסוף מקטעים סדרתיים, הדמיה דיגיטלית אוטומטית, תוכנה וחומרה מתוחכמות לשחזור תלת-ממדי, הדמיה וניתוח וכלה בגישות חלופיות למה שמכונה כיום ביחד VOLUME EM (vEM). טכניקות vEM אלה נחשבות בדרך כלל כמספקות מידע אולטרה-סטרוקטורלי תלת-ממדי ברזולוציות ננומטר על פני קני מידה של מיקרון וכוללות מיקרוסקופיית אלקטרונים (TEM) וטכניקות חדשות יותר של מיקרוסקופ אלקטרונים סורקים (SEM); ראה חוות דעת 5,6,7,8.
לדוגמה, קרן יונים ממוקדת SEM (FIB-SEM) משתמשת בקרן יונים ממוקדת בתוך SEM כדי לכרסם את פני השטח של הבלוק בין סריקות הדמיה SEM עוקבות של פני השטח של הבלוק, מה שמאפשר כרסום/הדמיה אוטומטיים חוזרים ונשנים של דגימה ובניית מערך נתונים תלת-ממדי לשחזור 9,10. לעומת זאת, SEM של פני בלוקים טוריים (SBF-SEM) משתמש ב- ultramicrotome בתוך ה- SEM כדי להסיר חומר מפני הבלוק לפני ההדמיה 11,12, בעוד שטומוגרפיה של מערך היא תהליך לא פולשני הדורש איסוף של מקטעים טוריים, על כיסויים, ופלים או קלטת, לפני הגדרת זרימת עבודה אוטומטית של הדמיית אזור העניין בקטעים רציפים ב- SEM כדי ליצור את ערכת הנתונים התלת-ממדית13 . בדומה לטומוגרפיה של מערך, מקטע טורי TEM (ssTEM) דורש איסוף מקטעים פיזיים לפני ההדמיה; עם זאת, מקטעים אלה נאספים ברשתות TEM ומצטלמים ב- TEM 14,15,16. ניתן להרחיב את ssTEM על ידי ביצוע טומוגרפיה הטיה 17,18,19. טומוגרפיה של הטיה טורית מספקת את הרזולוציה הטובה ביותר ב-x, y ו-z, ובעוד שהיא שימשה לשחזור תאים שלמים20, היא מאתגרת למדי. פרוטוקול זה מתמקד בהיבטים המעשיים של ssTEM כטכניקת ה- vEM הנגישה ביותר הזמינה למעבדות EM רבות שאולי אין להן כרגע גישה למקטעים מיוחדים או למכשירי vEM, אך ייהנו מיצירת נתוני vEM תלת-ממדיים.
אולטרה-מיקרוטומיה סדרתית לשחזור תלת-ממדי נחשבה בעבר למאתגרת. היה קשה לגזור סרטים ישרים בעובי חתך אחיד, להיות מסוגלים לסדר ולאסוף סרטים בגודל הנכון, בסדר הנכון, לרשתות עם תמיכה מספקת, אך ללא פסי רשת המסתירים אזורי עניין, והכי חשוב, מבלי לאבד קטעים, שכן סדרה לא שלמה עשויה למנוע שחזור תלת-ממדי מלא21. עם זאת, שיפורים באולטרה-מיקרוטומים מסחריים, סכיני חיתוך וגיזום יהלומים22,23, יריעות תמיכה בבלוטת אלקטרונים ברשתות21,24, ודבקים לסיוע בהדבקת מקטעים ושימור סרטים13,21 הם רק חלק מההתקדמות המצטברת לאורך השנים שהפכה את הטכניקה לשגרתית יותר במעבדות רבות. לאחר איסוף מקטעים סדרתיים, הדמיה סדרתית ב- TEM היא פשוטה ויכולה לספק תמונות EM עם גדלי px תת-ננומטריים ב- x ו- y, מה שמאפשר חקירה ברזולוציה גבוהה של המבנים התת-תאיים - דרישה פוטנציאלית לשאלות מחקר רבות. מחקר המקרה שהוצג כאן מדגים את השימוש ב- ssTEM ו- 3D שחזור במחקר של מגעים אנדופלסמיים מסוג רטיקולום (ER) - אברונים בהפטוציטים בכבד, שם נצפו לראשונה מגעי ER-אברונים25,26.
בעודו רציף עם המעטפת הגרעינית, ה-ER גם יוצר קשרים הדוקים עם אברוני תאים רבים אחרים, כולל ליזוזומים, מיטוכונדריה, טיפות שומנים וקרום פלזמה27. מגעי ER-אברונים היו מעורבים בחילוף החומרים של השומנים28, פוספוינוסיטיד ואיתות סידן29, ויסות אוטופגיה ותגובת עקה30,31. המגעים בין ER-אברונים ומגעים בין-אורגנטיים אחרים הם מבנים דינמיים מאוד המגיבים לצרכים מטבוליים תאיים ולרמזים חוץ-תאיים. הודגם כי הם משתנים מבחינה מורפולוגית בגודלם ובצורתם ובמרחקים שבין ממברנות אברונים32,33. ההערכה היא שהבדלים אולטרה-סטרוקטורליים אלה עשויים לשקף את הרכבי החלבון/שומנים השונים שלהם ולתפקד34,35. עם זאת, זו עדיין משימה מאתגרת להגדיר אנשי קשר בין-אורגניים ולנתח אותם36. לפיכך, נדרש פרוטוקול אמין אך פשוט לבחינה ואפיון של מגעים בין-אורגניים לצורך חקירות נוספות.
מכיוון שמגעי ER-אברונים יכולים לנוע בין 10 ל-30 ננומטר בהפרדת ממברנה לממברנה, תקן הזהב לזיהוי היה באופן היסטורי TEM. TEM בעל חתך דק חשף לוקליזציה ספציפית של תת-דומיינים עבור חלבוני ER תושבים במגעי ממברנה שונים37. באופן מסורתי, זה חשף מגעים ER-אברוניים עם רזולוציית nm, אך לעתים קרובות הציג רק תצוגה דו-ממדית של אינטראקציות אלה. עם זאת, גישות vEM חושפות את ההצגה וההקשר האולטרה-סטרוקטורליים של אתרי קשר אלה בתלת-ממד, ומאפשרות שחזור מלא של אנשי קשר וסיווג מדויק יותר של אנשי קשר (נקודה לעומת צינורית לעומת דמוית ציסטרנל) וכימות38,39. בנוסף להיותו סוג התא הראשון שבו נצפו מגעי ER-אברונים25,26, להפטוציטים יש מערכת נרחבת של מגעים בין-אורגניים אחרים המשרתים תפקידים חיוניים בארכיטקטורה ובפיזיולוגיה שלהם28,40. עם זאת, אפיון מורפולוגי יסודי של ER-אברון ומגעים בין-אורגניים אחרים בהפטוציטים עדיין חסר. לפיכך, האופן שבו נוצרים קשרים בין-אורגניים ומשתפצים במהלך התחדשות ותיקון רלוונטי במיוחד לביולוגיה של הפטוציטים ולתפקוד הכבד.
Access restricted. Please log in or start a trial to view this content.
Protocol
כל בעלי החיים שוכנו בהתאם להנחיות משרד הפנים הבריטי, וקצירת הרקמות בוצעה בהתאם לחוק החיות הבריטי (נהלים מדעיים) משנת 1986.
1. קיבוע והכנה של דגימות
- נתחו את רקמת הכבד לחתיכות בגודל המתאים, כ-8 מ"מ x 8 מ"מ x 3 מ"מ, והניחו את החלקים בתמיסת מלח חמה עם מאגר פוספט (PBS, 37 מעלות צלזיוס).
- הזריקו טמפרטורת החדר (20-25 מעלות צלזיוס) מקבעת (1.5% גלוטארלדהיד ב-1% סוכרוז, 0.1 מ' נתרן קקודילאט) לחתיכות הכבד והעברו אותן מ-PBS לקיבוע למשך עד 20 דקות בטמפרטורת החדר. יש לשמור תמיד על הרקמה שקועה בתמיסות כדי למנוע ייבוש.
הערה: אלדהידים הם חומרים מגרים שהם קורוזיביים ועלולים להיות מסרטנים. נתרן קקודילאט רעיל אם נבלעים או שואפים אותו. יש לטפל בכל הקיבועים תוך לבישת ציוד מגן אישי מתאים, והניסוי צריך להתבצע במכסה אדים. קיבוע טוב יביא לרקמה מוצקה יותר. - הגדר את המיקרוטום הרוטט עם להב, אמבט קרח ומגש חיץ קר במילוי PBS. הרכיבו את החתיכה הראשונה של רקמת כבד קבועה על מחזיק דגימה עם דבק ציאנואקרילט והעבירו את הבלוק למיקרוטום הרוטט.
- בעקבות המלצות היצרן, ניגשו לרקמה וחתכו את הכבד הקבוע לפרוסות בעובי 100 מיקרומטר.
- אספו את הפרוסות באמצעות מרית או מברשת שיער טבעית והעבירו אותן למנה של 12 או 24 בארות המכילה תיקון קר כקרח (1.5% גלוטארלדהיד, 0.1 מ' נתרן קקודילאט) על קרח. השאירו את הפרוסות על הקרח עד שכל הדגימות נפרסו ויהיו מוכנות לעיבוד נוסף.
- בחר את הפרוסות המכילות את אזורי העניין לעיבוד נוסף ושטיפה בתסיסה עדינה. בצעו שלוש שטיפות של 5 דקות עם טמפרטורת החדר 0.1 מ' נתרן קקודילאט במנה של 12 או 24 בארות, וודאו שלפרוסות יש מספיק חיץ כדי לנוע בחופשיות.
הערה: באופן כללי, אזורי עניין נבחרים על סמך תכונות אנטומיות הקשורות לשאלה הביולוגית של המחקר ומונחים על ידי אזורים ברקמה שסביר להניח שיהיו נוכחים בסדרה כולה, למשל, לא בקצה הקטע, ושמורים היטב. - במכסה אדים, החליפו 0.1 מיליון נתרן קקודילאט באוסמיום טטרוקסיד 1% טרי/1.5% אשלגן פריציאניד. מניחים את המנה של 12 או 24 בארות במיכל אטום ומעבירים את המיכל למקרר עם כימיקלים מסוכנים למשך שעה אחת.
הערה: אוסמיום מסוכן ביותר במקרה של בליעה, שאיפה ומגע בעור. אשלגן פריציאניד הוא מגרה ומזיק על ידי שאיפה ומגע בעור. טפלו תמיד בציוד מגן אישי מתאים, ובצעו את הניסוי במכסה אדים. - במכסה אדים, הסירו את האוסמיום טטרוקסיד/אשלגן פריציאניד לבקבוק פסולת אוסמיום ייעודי, ושטפו את הדגימות במשך 5 דקות עם 0.1 מ' נתרן קקודילאט שלוש פעמים. השאירו את הדגימות במיכל אטום למשך הלילה בטמפרטורה של 4 מעלות צלזיוס.
הערה: נקודת השהיה פוטנציאלית. ניתן לאחסן דגימות ב-0.1 מ' נתרן קקודילאט במיכל אטום בטמפרטורה של 4 מעלות צלזיוס במשך שבועות עם פגיעה מועטה בשימור. ודאו שיש מספיק חיץ כדי למנוע ייבוש. - דגירה את הדגימות עם חומצה טאנית 1% שהוכנה זה עתה ב-0.05 מ' נתרן קקודילאט למשך 45 דקות בחושך בטמפרטורת החדר.
הערה: חומצה טאנית היא מגרה ועלולה לגרום לנזק לעיניים. לבשו ציוד מגן אישי מתאים ובצעו את הניסוי במכסה אדים. - בצעו שלוש שטיפות של 5 דקות עם ddH2O לפני התייבשות והטבעה.
2. התייבשות דגימה, הטבעת שרף Epon והרכבה
- הכן שרף Epon בהתאם ליחס הבא לפי משקל (ראה שלב 2.2). Tare איזון עם פלסטיק חד פעמית 100 מל המכילה מוט ערבוב. חותכים את הקצוות מ-5 פיפטות פסטר חד פעמיות מפלסטיק ומשתמשים בהן כדי להעביר רכיבי שרף צמיגים לתוך הכוס.
- הוסף ברצף 19.2 גרם של שרף-812, 7.6 גרם של DDSA, 13.2 גרם של MNA ו-0.8 גרם של מאיץ DMP-30 לכוס. באמצעות הפיפטה החמישית מפלסטיק נקי, מערבבים היטב את רכיבי השרף ביד.
הערה: הימנעו מהכנסת בועות אך הקפידו על ערבוב מספיק של השרף התחתון עם החלק העליון כדי להשיג שינוי צבע וערבוב גס של שכבות הרכיבים. כל מרכיבי השרף הם מגרים ומזיקים על ידי שאיפה ומגע בעור. DMP-30 הוא קורוזיבי ועלול לגרום לקורוזיה בעור. ללבוש ציוד מגן אישי מתאים. - מניחים את הכוס על מערבל מגנטי ומשאירים לערבב בעדינות, ומדי פעם מערבבים את השרף באופן ידני.
- לשטוף את הדגימות עם תסיסה עדינה במשך 5 דקות עם 70% אתנול; חזור על הפעולה פעם אחת.
- לשטוף את הדגימות עם תסיסה עדינה במשך 5 דקות עם 90% אתנול; חזור על הפעולה פעם אחת.
- לשטוף את הדגימות עם תסיסה עדינה במשך 5 דקות עם 100% אתנול; חזור על הפעולה פעם אחת.
- בזמן שהדגימות נמצאות ב-100% שטיפות אתנול במכסה אדים, הכינו תערובת של 50:50 (v/v) פרופילן אוקסיד (PO):Epon בבקבוקון זכוכית עם מכסה פלסטיק עמיד בפני תחמוצת פרופילן (PO). מצמידים בזהירות אך בבטחה את מכסה בקבוקון הזכוכית, ותוך כדי שמירה על אחיזה במכסה ובבקבוקון, מנענעים או מערבולת לערבוב.
הערה: תחמוצת פרופילן היא חומר מגרה רעיל ודליק מאוד שממיס חלק מהפלסטיק. לבשו ציוד מגן אישי מתאים ובצעו את הניסוי במכסה אדים. - לאחר שלב 2.6, דגירו את הדגימות עם PO:Epon למשך שעה אחת במיכל עמיד בפני PO (למשל, מגשי אלומיניום או בקבוקוני זכוכית), עם נדנדה/תסיסה עדינה במכסה האדים.
- במכסה האדים, העבירו את הדגימות ל-100% Epon. דגירה למשך 2 שעות בטמפרטורת החדר במכסה האדים עם נדנדה / סיבוב / תסיסה. העבירו את תערובת PO:Epon לבקבוק פסולת ייעודי של Epon מזכוכית.
- חזור על שלב 2.9 פעם אחת.
- הר את הדגימות להטבעה. בהתאם לגודל הפרוסות ולאזור העניין, הרכיבו ישירות את הפרוסות על גבי זיזי שרף מעוותים מראש או הטמיעו אותן שטוחות לצורך כריתה והטמיעו אותן מחדש במועד מאוחר יותר.
הערה: להטבעה שטוחה, ניתן להשתמש ב"שקופית יצוקה" כדי להטמיע פרוסות רבות בו-זמנית. ניתן להשתמש בשאריות שרף למילוי כמוסות קרן ולאפות אותו להכנת סטוצים מפוקפקים מראש או להקפאה לשימוש מאוחר יותר. - לאחר ההרכבה והכיסוי בשרף מספיק כדי למלא את חלל "יציקת המגלשה", אופים את הדגימות למשך הלילה בתנור של 60 מעלות צלזיוס.
הערה: נקודת השהיה פוטנציאלית. ניתן לאחסן דגימות בטמפרטורת החדר במשך שנים. - להטבעה מחדש, זהה את אזור העניין בפרוסות הרקמה המוטבעות השטוחות. באמצעות מסור של תכשיטן, חותכים את פיסת הרקמה בגודל המתאים (1 מ"מ2 עד 4 מ"מ2) ומטמיעים מחדש באמצעות שרף שהוכן, כמו בשלב 2.2, על החלק העליון של בלוק מוכן מראש ואופים לילה בתנור של 60 מעלות צלזיוס.
הערה: לחלופין, ניתן להדביק את חתיכת הרקמה לסטאב או סיכה עם שרף אפוקסי בשני חלקים. עזבו כדי לצאת לדרך למשך הלילה. נקודת השהיה פוטנציאלית.
3. קיצוץ וחיתוך טורי של דוגמאות מוטבעות
הערה: חתך הוא מיומנות נלמדת; משתמשים צריכים להיות מיומנים בחתך ultrathin לפני ניסיון חתך סדרתי. מכיוון שפקדי המיקרוטום המדויקים משתנים בין היצרנים, עקוב אחר ההוראות וההנחיות של היצרן.
- כאשר הדגימה נעולה במתאם הזמירה, השתמש בסכין גילוח כדי לחתוך בזהירות את הרקמה המוטבעת בשרף כדי לעמוד בקריטריונים הבאים (ראו איור 1A,B):
- ודא שיש משטח שטוח ועליון החושף את הרקמה סביב אזור העניין.
- יש לוודא צורת טרפז כאשר הקצוות העליונים והתחתונים נקיים ומקבילים.
- ודא מידות כוללות של 200-500 מיקרומטר ב - x, 100-500 מיקרומטר ב - y.
- הקפידו על פני בלוק אסימטריים, למשל, פינות צד ימין של כ-90 מעלות, פינות בטן שמאליות למעלה ופינה תחתונה שמאלית חריפה.
הערה: קריוקנייף זמירה יכול להיות כלי חלופי לסכין גילוח. ההמלצות האחרות הן לנוחות המשתמש להזמנת קטעים בעת ההדמיה. אופציונלי: אם מקטעים אינם מצליחים ליצור סרטים יציבים, ניתן להחיל מלט מגע על הקצה המוביל של פני הבלוק כדי לסייע ביצירת רצועת הכלים. סכיני הגילוח חדים; הקפידו להחזיק את סכין הגילוח כך שהחלקות מקריות לא צפויות לגרום לפגיעה אישית.
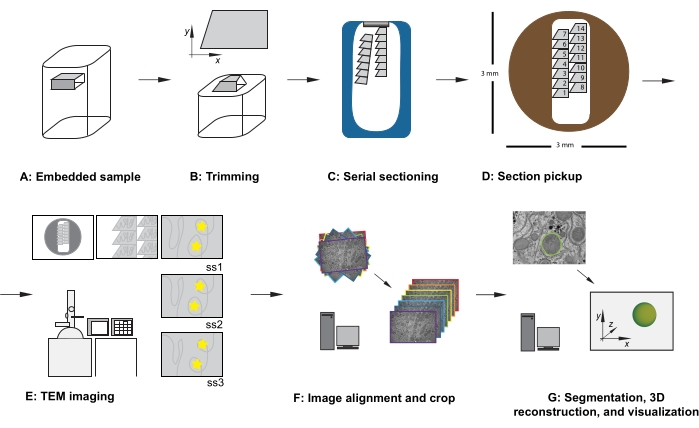
איור 1: זרימת עבודה של TEM של מקטע טורי. (A) דיאגרמה של הדגימה בבלוק השרף. (B) חתוך בלוק כדי ליצור צורת טרפז עם קצוות המתאימים לחתך טורי ופני בלוק אסימטריים כדי להבטיח כיוון ידוע. (C) דיאגרמה המציגה סרטים של מקטעים סדרתיים, צפים על פני המים בסירת סכין היהלומים. (D) דיאגרמה המציגה את המקטע ואת ארגון רצועת הכלים, ומכתיבה את סדר המקטעים, ברשת חריצים של TEM בקוטר 3 מ"מ. (E) הדמיה וניווט של TEM. הצגת סרט וסדר מקטעים ושימוש ב"מדבקות כוכב צהוב" על הצג לצורך הפניית מסך כדי להבטיח הדמיה מחדש של אותו אזור עניין בסעיפים הבאים. (F) יישור תמונה וחיתוך. (G) סגמנטציה, שחזור תלת-ממדי והדמיה. קיצור: TEM = מיקרוסקופ אלקטרונים תמסורת. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
- לאחר החיתוך, העבר את קשת הדגימה, יחד עם הצ'אק והמדגם, לזרוע הדגימה של המיקרוטום, תוך מיקום קשת הדגימה כך שטווח הנסיעה של הקשת יעבור מלמעלה למטה; לאבטח את קשת הדגימה במקום.
- מניחים ונועלים את סכין היהלום במחזיק הסכין, ומבטיחים שזווית החיתוך מוגדרת כראוי לסכין. נעל את מחזיק הסכינים לתוך הבמה בצורה מאובטחת.
- כאשר הבמה דולקת, השתמשו בהתקדמות הסכין תוך כדי בדיקה מתמדת של הקשר בין פני הבלוק לקצה הסכין. מקדמים בזהירות את הסכין לעבר הדגימה, ומתאימים ללא הרף את הזווית הצדדית של הסכין, את הטיית הדגימה ואת סיבוב הדגימה על ידי התאמת הידיות הרלוונטיות עד שהגוש מיושר לקצה הסכין.
- כבו את תאורת הבמה; להדליק את הבמה במורד התאורה; להגדיר את החלק העליון והתחתון של חלון החיתוך של זרוע הדגימה; ולהשאיר את הדגימה ממש מתחת לקצה הסכין.
- מלאו את סירת הסכינים ב-ddH2O נקי וודאו שמשטח המים יישר עם קצה הסכין ורק מעט קעור.
- אופציונלי: טבלו ריסים ב-Triton X-100 0.1% ולאחר מכן במי סירת הסכינים כדי להפחית את מתח הפנים של המים כדי לסייע בכלורופורמינג ובאיסוף סרטים.
- הכן את תחנת העבודה עם ריסים (ריסים מודבקים למקל קוקטייל), רשתות חריץ מצופות טופסבר, מלקחיים מוצלבים מסומנים, כלורופורם, תמיסת Triton X-100 0.1%, מים מזוקקים, נייר סינון וקופסת רשת עם הערות קופסת רשת.
- הגדר את מהירות החיתוך ב-1 מ"מ לשנייה ואת עובי החיתוך הראשוני ל-100 ננומטר והתחל את מחזור החיתוך.
- לאחר חיתוך החלק הראשון, שנו את פרמטרי החיתוך למהירות חיתוך של 0.8 מ"מ לשנייה ואת עובי החיתוך ל-70 ננומטר, והמשיכו בחיתוך, מה שמאפשר למקטעים ליצור סרט שנע על פני השטח של סירת הסכינים המלאה במים (איור 1C).
הערה: חשוב להיות מודעים לצבע של החלקים המיוצרים מכיוון שלעתים קרובות זהו מדריך מדויק יותר לעובי מקטעי השרף. מקטעי כסף הם בדרך כלל בעובי של כ-70 ננומטר, בעוד שהחלקים האפורים דקים יותר ומקטעי הזהב עבים יותר. - אפשרו למיקרוטום להמשיך לגזור קטעים ואת הסרט כדי להתארך.
הערה: חשוב להימנע מתנודות גדולות והפרעות פיזיות בחדר. טיוטות יכולות לגרום למקטעים לנוע על פני המים בסירת הסכינים, ותנודות פיזיות עלולות לגרום למיקרוטום להיחתך בצורה לא אחידה. - לאחר איסוף מספיק קטעים ולפני שהסרט מגיע לקצה הסירה, יש להפסיק את החיתוך (רגע לאחר שהדגימה עברה את קצה הסכין).
הערה: מספר המקטעים הדרושים תלוי בגודל פני הבלוק ובגודל מערך הנתונים שיש לאסוף. לכן, כדאי להיות מודעים לקשר בין גודל הבלוק לרשת החריץ כאשר קטעי החתך יורדים. - באמצעות ריסים בכל יד, חלקו בעדינות את הסרט לסרטים קטנים יותר שיכולים להתאים לאורך רשת החריצים, תוך הקפדה לרשום את מיקומם היחסי מתוך המדגם.
הערה: אם הרוחב המשולב שלהם מתאים, ניתן למקם בעדינות סרטים מרובים זה ליד זה ולהרים אותם יחד ברשת חריצים אחת. אם אתם מרימים סרטים מרובים ברשת חריצים אחת, שימו לב לסדר ולמיקום היחסי של הסרטים. לדוגמה, מקם תמיד את רצועות הכלים רחוק יותר לתוך הדגימה מימין לרצועת הכלים שכבר נמצאת במדגם (איור 1D). - אופציונלי: באמצעות מוט אפליקטור זכוכית, רחף טיפה של כלורופורם מעל החלקים כדי לשטח אותם החוצה.
הערה: כלורופורם הוא רעיל ומגרה. אין לתת לכלורופורם לגעת במשטח המים או בקטעים. אם זה קורה בטעות, יש להסיר את המים ולשטוף את הסכין לפני שחוזרים לחתך. הכלורופורם יכול לפגוע בחלקים ולהשחית את הדבק שמצמיד את היהלום לתוך סירת הסכינים. - באמצעות המלקחיים הממוספרים הראשונים, הרימו את רשת החריצים הריקה הראשונה (בצד ימין של החריץ, בצד הפורמר כלפי מטה), טבלו בעדינות בטריטון X-100, ולאחר מכן פעמיים במים המזוקקים לפני הסרת עודפי מים מקצה המלקחיים באמצעות פיסת נייר סינון.
- עם ריס ביד אחת והמלקחיים ביד השנייה, הורידו בעדינות כ-2/3מרשת החריצים המצופה בפורמבר לתוך מי סירת הסכינים (הרחק מהקטעים), כך שצד הפורמבאר פונה כלפי מטה, והקצה הימני הארוך של החריץ נמצא על פני המים ומקביל לקצה המים.
- סובבו בעדינות את הרשת במים לכיוון הסרטים, כך שעם השבץ החוזר, המקטעים נסחפים לכיוון הרשת. המשך לעשות זאת בתנועות קטנות יותר ויותר עד שהקצה הימני של הסרט יתיישר עם הקצה הימני של החריץ. לאחר מכן, עם ה-waft האחרון, העלו בעדינות את הרשת למעלה כדי לאסוף את החלקים לרשת החריץ.
- השאירו את הרשת במלקחיים לייבוש לפני שאתם מאחסנים אותה בתיבת הרשת, עם ביאורים מתאימים בגיליון הייחוס של תיבת הרשת.
- חזור על שלב 3.16 עד לאיסוף כל הסרטים, כדי להבטיח שסדר הסרטים נשמר.
- אם נדרשים קטעים נוספים, יש להחזיר את הסכין ל-150 ננומטר בערך, לבדוק את מפלס המים בסירה ולהוסיף עוד במידת הצורך. התחל שוב את תהליך החיתוך, בהתאם לשלבים 3.11-3.18.
- לאחר איסוף כל החלקים, יש לוודא שקצה הסכין נקי מפסולת מקטעים, להרחיק את הסכין מפני הבלוק, ולהסיר ולנקות את הסכין.
4. צביעת רשת
- לאחר הייבוש, הכתימו את החלקים בציטראט עופרת של ריינולדס על פרפילם על הספסל או בצלחת פטרי. הניחו מספר כדורים של נתרן הידרוקסיד מתחת למכסה צלחת פטרי כדי לספק סביבה נטולת פחמן דו-חמצני. לאחר מכן, בזהירות, הרחק מהכדורים, פיפטה 40 μL טיפות של ציטראט עופרת של ריינולדס על הפרפילם, אחת לכל רשת.
הערה: אין להכתים יותר מדי רשתות בבת אחת; לדוגמה, המקסימום צריך להיות 6. נסו לא לנשום ישירות על צלחת ההכתמה. פחמן דו-חמצני יכול להגיב עם ציטראט העופרת ולגרום לזרז לא רצוי ברשתות. - הופכים כל רשת (חתך בצד כלפי מטה) על טיפת הציטראט עופרת ומשאירים מוגנים על ידי מכסה צלחת פטרי למשך 7 עד 10 דקות. בזמן שהרשתות מכתימות, הכינו פיסת פרפילם שנייה גדולה יותר על הספסל עם חמש טיפות מים מזוקקים של 300 μL לכל רשת.
- בסוף הדגירה של עופרת ציטראט, מעבירים כל רשת לטיפת מים מזוקקים כדי לשטוף במשך דקה אחת מבלי לנשום ישירות על הרשתות.
- חזור על שלב 4.3 בסך הכל חמש פעמים.
- באמצעות מלקחיים מוצלבים ממוספרים, מרימים את הרשת הראשונה, נוגעים בקצה הרשת כדי לסנן את הנייר כדי לסלק את רוב המים, ומאפשרים לייבש את המלקחיים (למשך 20 דקות לפחות). חזור על הפעולה עבור כל רשת.
5. רכישת הדמיה על ידי TEM
הערה: מכיוון שפקדי ה-TEM המדויקים משתנים בין היצרנים, בצע את ההוראות וההנחיות של היצרן. השלבים הבאים צריכים להתבצע על ידי משתמשים שכבר בקיאים בשימוש ב- TEM.
- לפני ההדמיה, בצע את הבדיקות הרגילות, למשל, יישור קרן, הפניות רווח ואוצנטריות דגימה.
- טען בזהירות את הרשת הראשונה של מקטעים סדרתיים לתוך מחזיק הדגימה, תוך הקפדה על יישור החריץ (ולכן מקטעים) לציר האנכי של שלב המיקרוסקופ.
הערה: דיוק זה אינו חיוני אך חוסך זמן במהלך שלבי הרכישה והטיפול העתידי בנתונים. בעת הוספת הרשת (מקטע בצד למטה או בצד המקטע כלפי מעלה), הקפד לצלם את כל הרשתות באותו כיוון. - בהגדלה נמוכה, שימו לב לסדר, למיקום ולמיקום של המקטעים הטוריים (איור 1E). נווט אל החלק האמצעי של הסדרה ברשת.
הערה: בהתאם למטרת המחקר המדויקת, הגישות להדמיה עשויות להשתנות; עם זאת, להלן נקודת התחלה שימושית. צורת המקטעים והיחסים בין הסרטים (כפי שנאספו בשלב 3.14) מכתיבים איזה מקטע היה ראשון ואיזה מקטע היה אחרון ברשת. - עיין במדגם וזהה אזור עניין. שימו לב לדגימה בהגדלה הרצויה, ושקלו לאסוף את הסדרה בהגדלה מעט נמוכה יותר, מכיוון שלעתים קרובות המקטעים אינם מיושרים בצורה מושלמת, וייתכן שיהיה צורך לחתוך תמונות מאוחר יותר.
- צלם תמונות ייחוס בהגדלה נמוכה יותר כדי להעריך את ההקשר של אזור העניין, את מיקומו המחוספס בהגדלה שונה ביחס לגבולות המקטעים, ותכונות ציון דרך בתוך המדגם. השתמש בהם כדי לחתום על אזור העניין במקטעים אחרים.
- אופציונלי: עבור הפניה למסך, השתמש במרק דבק רב-פעמי, במדבקות או בפיסת נייר מקרן תקורה (OHP), המודבקת למסך, כדי להציב סמנים זמניים על המסך כדי לאפשר הדמיה חוזרת שגרתית של אותן תכונות של אזור העניין במרכז התמונה, לאורך כל מערך הנתונים (ראו כוכבים צהובים באיור 1E).
- באמצעות תמונות ההפניה, נווט לאזור העניין בחלק הראשון של הרשת, וקבל תמונה בהגדלה הרצויה.
הערה: בעת שמירת תמונות, שים לב למטה בשם הקובץ הראשון של התמונה הראשונה של הסדרה והשתמש במינוח שמות רציף כך שכל שמות התמונות יפעלו לפי הסדר הרציף של המקטעים הטוריים. - נווט אל המקטע הבא וחזור על שלב 5.7 עד שכל המקטעים צולמו עבור אזור עניין זה.
6. ייצוא תמונה ורישום יישור מקטעים טוריים
- ייצא את קבצי התמונה השייכים לאותה מחסנית לתיקיה אחת. ודא שהתיקיה ממוינת לפי שם הקובץ.
הערה: התמונות צריכות באופן אידיאלי לכלול את אותו שם שורש ולעקוב אחר הסדר שבו הן נרכשו. - פתח את פיג'י ולחץ על קובץ | ייבוא | רצף תמונות.
- לחץ על התמונה הראשונה של התיקיה ולחץ על פתח. המתן עד שיופיע חלון קופץ של אפשרויות רצף (איור 2A).
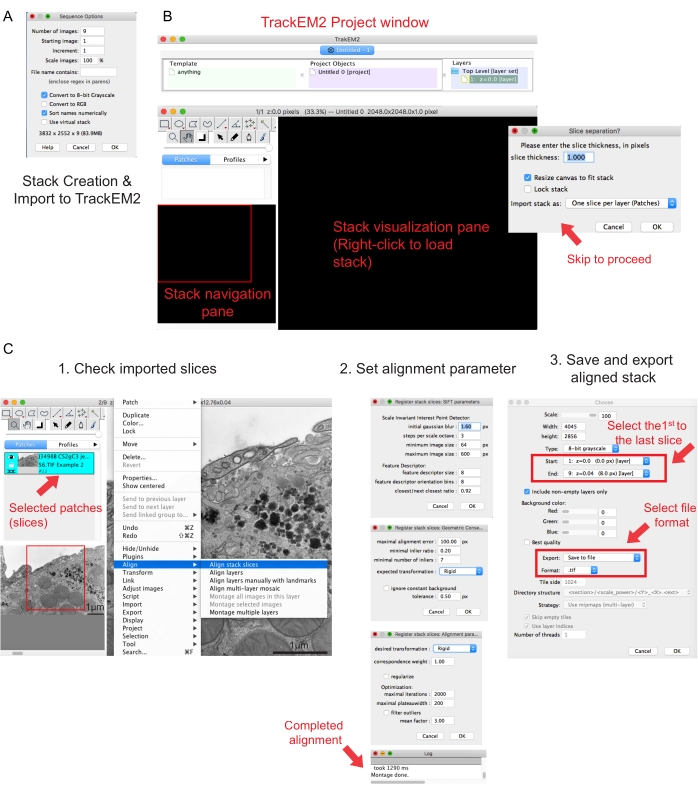
איור 2: יצירת מחסנית טורית ויישור מקטעים טוריים באמצעות Fiji. (A) צילום מסך המציג את אפשרויות הרצף בעת טעינת התמונות ליצירת מחסנית טורית. (B) צילום מסך של תוסף TrackEM2 וחלונות המפתח של התוסף. הקש אישור בהפרדת פרוסות כדי להמשיך ביישור. (C) צילום מסך לאחר טעינה מוצלחת של הערימה הטורית לחלונית התצוגה החזותית. שלושה חלונות רציפים של פרמטרי יישור יופיעו לאחר שייערכו פרוסות מחסנית יישור . ייצא את המחסנית המיושרת לאחר השלמת היישור. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
- לחץ על מיון שמות באופן מספרי | המר לאפשרות של 8 סיביות . לחץ על אישור.
הערה: המרה ל- 8 סיביות מסייעת לייבוא הנתונים לאמירה ומפחיתה את גודל הקובץ, ומאפשרת מהירויות עיבוד מהירות יותר בשלבים מאוחרים יותר. - בדוק את השלמות, הרצף וההגדלה של הערימה שנוצרה. שמור את המחסנית שנוצרה כקובץ .tif.
הערה: תמונות היו צריכות להירכש באותה הגדלה. - הפעל את התוסף TrakEM241. עבור אל קובץ | ניו | TrackEM2 (ריק).
הערה: התוסף יבקש מהמשתמש לשמור את קבצי TrackEM2. במידת הצורך, שמור את קבצי TrackEM2 בתיקיית התמונה. שלושה חלונות אמורים להופיע: חלון פרוייקט, חלון ניווט בערימה (משמאל) וחלון תצוגה חזותית של מחסנית (איור 2B). - לחץ באמצעות לחצן העכבר הימני על חלונית התצוגה החזותית השחורה. לחץ על ייבוא | ייבא מחסנית ובחר את המחסנית שנוצרה בעבר.
- לחץ על אישור כדי לטעון את המחסנית לחלון הניווט בערימה.
הערה: חלון הפרדת פרוסות יופיע כדי לבקש קשר גומלין בין פיקסלים לממדים. ליישור מחסנית בלבד, לחץ על אישור כדי לדלג על שלב זה. - השתמש במחוון כדי לבדוק את כל פרוסות הערימה. חפש את הפרוסה הטעונה, שתופיע כתיקון בתוכנית הניווט. בחר את התיקונים שייכללו ביישור הבא.
הערה: טלאים נבחרים יהפכו לכחולים. - רחף עם העכבר מעל חלונית הצפייה. לחץ באמצעות לחצן העכבר הימני על התמונה, בחר ישר | יישור פרוסות מחסנית (איור 2C-1).
- ציין את פרמטרי היישור באמצעות קבוצה של שלושה חלונות רציפים.
הערה: עבור רוב הנתונים, התחל עם יישור קשיח (מאפשר סיבוב ותרגום אך לא טרנספורמציה) ושמור על פרמטרים אחרים כברירת מחדל (איור 2C-2). - אפשר ליישור לפעול עד שיומן הקריאה יגיד שמונטאז' בוצע.
הערה: זמן הריצה תלוי במספר הווקסלים ובמהירות המחשב. - בדוק את הערימה המיושרת בחלונית הצפייה. הקש Alt ו - - מקשים (ב- PC) או על מקשי Ctrl ו - - (ב- Mac) לקבלת תצוגה של תצוגה מוגדלת של הערימה המיושרת.
- אם אתה מרוצה מהמחסנית המיושרת, לחץ באמצעות לחצן העכבר הימני על ייצוא | צור תמונה שטוחה כדי לשמור את הערימה המיושרת.
- בחר את התמונה הראשונה כתחילת הערימה ואת התמונה האחרונה כסוף הערימה, לחץ על אישור (איור 2C-3). שמור את הערימה המיושרת כ.tif.
הערה: כדי להקטין את גודל הקובץ, חתוך את הנתונים כך שיכילו רק את אזור העניין הדרוש. - במידת הצורך, בצע יישור אפין בערימה המיושרת. פתח את המחסנית המיושרת בפיג'י, בחר תוסף | | הרשמה סטאק-רג.
- בחר באפשרות אפין והקש אישור. המתן עד להשלמת התוכנית.
- שמור את הערימה המיושרת עם אפין עם שם קובץ אחר.
7. סגמנטציה ושחזור תלת-ממדי
- פתח את אמירה42. לחץ על קובץ | פתח את Data כדי לטעון את המחסנית המיושרת.
- ציין את מדידות הווקסל בחלון הקופץ החדש (איור 3A).
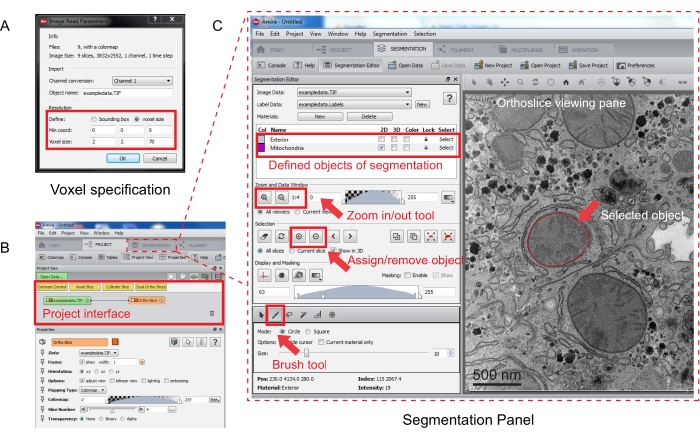
איור 3: סגמנטציה של מחסנית טורית באמצעות Amira. (A) חלון הקופץ של הגדרת Voxel לפני טעינת מחסנית מיושרת. (B) צילום מסך של ממשק הפרויקט לאחר ייבוא מחסנית. בחר בכרטיסיה סגמנטציה כדי להתחיל במעקב אחר אובייקטים בחלונית 'עורך סגמנטציה'. (C) תכונות עיקריות של לשונית הפילוח. הגדר את האובייקטים לצורך סגמנטציה במקטע 'עורך סגמנטציה' בכרטיסיה 'סגמנטציה'. השתמש בפונקציית התצוגה כדי לסייע בזיהוי אובייקטים. בחר בכלי Brush ועקוב אחר הגבול של האובייקט. לחץ על הסימן + תחת בחירה כדי להקצות את המעקב. נראה כי לאובייקט שהוקצה יש גבול אדום בחלונית הצפייה האורתוסליצית. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
הערה: צומת מחסנית תמונות יופיע בממשק הפרויקט, ואורתוסליקה תופיע בחלונית התצוגה מימין (איור 3B).
- כדי להתחיל בסגמנטציה, בחרו בכרטיסיה 'סגמנטציה' (איור 3B).
הערה: מומלץ לשמור את התקדמות הפילוח לפני ובמהלך הסגמנטציה. עבור אל מודל | שמור את Model כמו כל קובץ .am שמתאים. - לחץ על חדש בחלונית עורך הפילוח כדי להגדיר אובייקטים חדשים ברשימת החומרים. לחץ באמצעות לחצן העכבר הימני כדי לשנות את צבע האובייקט ולחץ פעמיים כדי לשנות את שם האובייקט.
- לסגמנטציה ידנית, בחר בכלי הפילוח מתחת לרשימת החומרים. בחרו בכלי ברירת המחדל ' מברשת' כדי להדגיש את הפיקסלים (איור 3C).
הערה: לחלופין, השתמש בכלי המברשת כדי לעקוב אחר קווי המתאר של האובייקט והקש Shift + F כדי למלא את האובייקט. - כדי להמיר את כלי המברשת למחק, הקש Ctrl באופן רציף תוך בחירת פיקסלים לתיקון. ציין כל פרוסה בערימה.
- לאחר האישור, הקצה את הבחירה לתווית על-ידי לחיצה על הסימן + . לחץ על הסימן - כדי להסיר את הבחירה.
- חזור לממשק הפרויקט לאחר השלמת הפילוח. חפש צומת עם סיומת ".label" המחוברת לערימת התמונות.
- לחץ באמצעות לחצן העכבר הימני על ההרחבה ".label" ובחר צור משטח | הגש בקשה ליצירת קובץ .surf.
- כדי לעבד את המודל התלת-ממדי של אובייקט מפולח, לחץ באמצעות לחצן העכבר הימני על קובץ ה- .surf ובחר תצוגת Surface כדי ליצור מודל תלת-ממדי בחלונית הצפייה.
- שמור את המודל התלת-ממדי להדמיה חזותית או לניתוחים כמותיים נוספים.
Access restricted. Please log in or start a trial to view this content.
תוצאות
עבור טכניקה זו, אזורי עניין נבחרים על סמך מטרת המחקר הביולוגי וזוהו לפני חיתוך וחיתוך של רקמות משובצות. באופן דומה, גודל פני הבלוק עשוי להיות מוכתב על ידי שאלת המחקר; במקרה זה, הדגימה נחתכה כדי להשאיר פני בלוק של כ-0.3 מ"מ x 0.15 מ"מ (איור 4A). זה איפשר שתי רשתות של 9 מקטעים טוריים לכל...
Access restricted. Please log in or start a trial to view this content.
Discussion
טכניקת vEM נגישה להדמיה של מבנה אברונים ואינטראקציות בתלת-ממד מתוארת בפרוטוקול זה. המורפולוגיה של מגעים בין-אורגניים בהפטוציטים מוצגת כמקרה בוחן כאן. עם זאת, גישה זו יושמה גם כדי לחקור מגוון דגימות ותחומי מחקר אחרים, כולל אינטראקציות של תאי שוואן-אנדותל בעצבים היקפיים45, ביוגנז...
Access restricted. Please log in or start a trial to view this content.
Disclosures
למחברים אין ניגודי עניינים לחשוף.
Acknowledgements
אנו מודים לג'ואנה הנלי, רבקה פיאדיירו ואניה סטראטמן-איוונובסקה על סיוע טכני מומחה. אנו מודים גם לחברי המעבדה של סטפן ולאיאן ג'יי ווייט על דיונים מועילים. J.J.B. נתמך על ידי מימון MRC למעבדת MRC לביולוגיה מולקולרית של התא ב- UCL, קוד הפרס MC_U12266B. C.J.S. נתמך על ידי מימון MRC ליחידה האוניברסיטאית של מעבדת MRC לביולוגיה מולקולרית של התא ב- UCL, קוד פרס MC_UU_00012/6. P.G. ממומן על ידי המועצה האירופית למחקר, קוד מענק ERC-2013-StG-337057.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 0.22 µm syringe filter | Sarstedt | 83.1826.001 | |
| Aluminum trays | Agar Scientific | AGG3912 | |
| Amira v6 | ThermoFisher | https://www.thermofisher.com | |
| Chloroform | Fisher | C/4960/PB08 | |
| DDSA/Dodecenyl Succinic Anhydride | TAAB | T027 | Epon ingredient |
| Diamond knife | DiaTOME | ultra 45° | |
| DMP-30/2,4,6-tri (Dimethylaminomethyl) phenol | TAAB | D032 | Epon ingredient |
| Dumont Tweezers N5 | Agar Scientific | AGT5293 | |
| Fiji | https://imagej.net/ | ||
| Fiji TrakEM2 plugin | https://imagej.net/ | ||
| Formaldehyde 36% solution | TAAB | F003 | |
| Formvar coated slot grid | Homemade | Alternative: EMS diasum (FF2010-Cu) | |
| Glass bottle with applicator rod | Medisca | 6258 | |
| Glass vials | Fisher Scientific | 15364769 | |
| Gluteraldehyde 25% solution | TAAB | G011 | |
| MNA/Methyl Nadic Anhydride | TAAB | M011 | Epon ingredient |
| Osmium Tetroxide 2% solution | TAAB | O005 | |
| Potassium Ferricyanide | Sigma-Aldrich | P-8131 | |
| Propylene oxide | Fisher Scientific | E/0050/PB08 | |
| Reuseable adhesive | Blue Tack | ||
| Reynolds Lead Citrate | TAAB | L037 | Section stain |
| Sodium Cacodylate | Sigma-Aldrich | C-0250 | to make 0.1 M Caco buffer |
| Super Glue | RS Components | 918-6872 | Cyanoacrylate glue, Step 1.3 |
| TAAB 812 Resin | TAAB | T023 | Epon ingredient |
| Tannic acid | TAAB | T046 | |
| Triton X-100 | Sigma-Aldrich | T9284 | |
| Two part Epoxy Resin | RS Components | 132-605 | Alternative: Step 2.13 |
| Ultramicrotome | Leica | UC7 | |
| Vibrating microtome | Leica | 100 µm thick slices, 0.16 mm/s cutting at 1 mm amplitude . | |
| Weldwood Original Contact cement | DAP | 107 | Contact adhesive: Step 3.1.4 |
References
- Knoll, M., Ruska, E. Das elektronenmikroskop. Zeitschrift für Physik. 78 (5), 318-339 (1932).
- von Ardenne, M. Daselektronen-rastermikroskop. Zeitschrift für Physik. 109 (9), 553-572 (1938).
- Bang, B. H., Bang, F. B. Graphic reconstruction of the third dimension from serial electron microphotographs. Journal of Ultrastructure Research. 1 (2), 138-139 (1957).
- Birch-Andersen, A. Reconstruction of the nuclear sites of Salmonella typhimurium from electron micrographs of serial sections. Journal of General Microbiology. 13 (2), 327-329 (1955).
- Denk, W., Horstmann, H. Serial block-face scanning electron microscopy to reconstruct three-dimensional tissue nanostructure. PLoS Biology. 2 (11), 329(2004).
- Peddie, C. J., Collinson, L. M. Exploring the third dimension: volume electron microscopy comes of age. Micron. 61, 9-19 (2014).
- Titze, B., Genoud, C. Volume scanning electron microscopy for imaging biological ultrastructure. Biology of the Cell. 108 (11), 307-323 (2016).
- Kornfeld, J., Denk, W. Progress and remaining challenges in high-throughput volume electron microscopy. Current Opinion in Neurobiology. 50, 261-267 (2018).
- Heymann, J. A., et al. Site-specific 3D imaging of cells and tissues with a dual beam microscope. Journal of Structural Biology. 155 (1), 63-73 (2006).
- Knott, G., Marchman, H., Wall, D., Lich, B. Serial section scanning electron microscopy of adult brain tissue using focused ion beam milling. Journal of Neuroscience. 28 (12), 2959-2964 (2008).
- Leighton, S. B. SEM images of block faces, cut by a miniature microtome within the SEM - a technical note. Scanning Electron Microscopy. , 73-76 (1981).
- Martone, M. E., Deerinck, T. J., Yamada, N., Bushong, E., Ellisman, M. H. Correlated 3D light and electron microscopy: use of high voltage electron microscopy and electron tomography for imaging large biological structures. Journal of Histotechnology. 23 (3), 261-270 (2000).
- Micheva, K. D., Smith, S. J. Array tomography: a new tool for imaging the molecular architecture and ultrastructure of neural circuits. Neuron. 55 (1), 25-36 (2007).
- Sjostrand, F. S. Ultrastructure of retinal rod synapses of the guinea pig eye as revealed by three-dimensional reconstructions from serial sections. Journal of Ultrastructure Research. 2 (1), 122-170 (1958).
- Ware, R. W. Three-dimensional reconstruction from serial sections. International Review of Cytology. 40, 325(1975).
- Stevens, J. K., Davis, T. L., Friedman, N., Sterling, P. A systematic approach to reconstructing microcircuitry by electron microscopy of serial sections. Cognitive Brain Research. 2 (3), 265-293 (1980).
- Hoppe, W. Three-dimensional electron microscopy. Annual Review of Biophysics. 10, 563-592 (1981).
- Frank, J. Electron tomography: methods for three-dimensional visualization of structures in the cell. , Springer. New York, NY. (2008).
- Baumeister, W. Electron tomography: towards visualizing the molecular organization of the cytoplasm. Current Opinion in Structural Biology. 12 (5), 679-684 (2002).
- Hoog, J. L., Schwartz, C., Noon, A. T., O'Toole, E. T. Organization of interphase microtubules in fission yeast analyzed by electron tomography. Developmental Cell. 12 (3), 349-361 (2007).
- Harris, K. M., Perry, E., Bourne, J., Feinberg, M., Ostroff, L., Hurlburt, J. Uniform serial sectioning for transmission electron microscopy. Journal of Neuroscience. 26 (47), 12101-12103 (2006).
- Jesior, J. C. Use of low-angle diamond knives leads to improved ultrastructural preservation of ultrathin sections. Scanning Microscopy Supplement. 3, 147-152 (1989).
- Studer, D., Gnaegi, H. Minimal compression of ultrathin sections with use of an oscillating diamond knife. Journal of Microscopy. 197, 94-100 (2000).
- Gay, H., Anderson, T. F. Serial sections for electron microscopy. Science. 120 (3130), 1071-1073 (1954).
- Bernhard, W., Rouiller, C. Close topographical relationship between mitochondria and ergastoplasm of liver cells in a definite phase of cellular activity. The Journal of Biophysical and Biochemical Cytology. 2, 73-78 (1956).
- Palade, G. E. An electron microscope study of the mitochondrial structure. The Journal of Histochemistry & Cytochemistry. 1 (4), 188-211 (1953).
- Wu, H., Carvalho, P., Voeltz, G. K. Here, there, and everywhere: The importance of ER membrane contact sites. Science. 361 (6401), (2018).
- Vance, J. E. Inter-organelle membrane contact sites: implications for lipid metabolism. Biology Direct. 15 (1), 24(2020).
- Stefan, C. J. Endoplasmic reticulum-plasma membrane contacts: Principals of phosphoinositide and calcium signaling. Current Opinion in Cell Biology. 63, 125-134 (2020).
- Zaman, M. F., Nenadic, A., Radojicic, A., Rosado, A., Beh, C. T. Sticking with it: ER-PM membrane contact sites as a coordinating nexus for regulating lipids and proteins at the cell cortex. Frontiers in Cell and Developmental Biology. 8, 675(2020).
- van Vliet, A. R., Sassano, M. L., Agostinis, P. The unfolded protein response and membrane contact sites: tethering as a matter of life and death. Contact. 1, 1-15 (2018).
- Cohen, S., Valm, A. M., Lippincott-Schwartz, J. Interacting organelles. Current Opinion in Cell Biology. 53, 84-91 (2018).
- Hariri, H., et al. Lipid droplet biogenesis is spatially coordinated at ER-vacuole contacts under nutritional stress. EMBO Reports. 19 (1), 57-72 (2018).
- Stefan, C. J., Trimble, W. S., Grinstein, S., Drin, G. Membrane dynamics and organelle biogenesis-lipid pipelines and vesicular carriers. BMC Biology. 15 (1), 102(2017).
- Eisenberg-Bord, M., Shai, N., Schuldiner, M., Bohnert, M. A tether is a tether is a tether: tethering at membrane contact sites. Developmental Cell. 39 (4), 395-409 (2016).
- Scorrano, L., De Matteis, M. A., Emr, S., Giordano, F. Coming together to define membrane contact sites. Nature Communications. 10 (1), 1287(2019).
- Lak, B., Li, S., Belevich, I., Sree, S. Specific subdomain localization of ER resident proteins and membrane contact sites resolved by electron microscopy. European Journal of Cell Biology. 100 (7), 151180(2021).
- Collado, J., Kalemanov, M., Campelo, F., Bourgoint, C. Tricalbin-mediated contact sites control ER curvature to maintain plasma membrane integrity. Developmental Cell. 51 (4), 476-487 (2019).
- West, M., Zurek, N., Hoenger, A., Voeltz, G. K. A 3D analysis of yeast ER structure reveals how ER domains are organized by membrane curvature. Journal of Cell Biology. 193 (2), 333-346 (2011).
- Ilacqua, N., Anastasia, I., Raimondi, A., Lemieux, P. A three-organelle complex made by wrappER contacts with peroxisomes and mitochondria responds to liver lipid flux changes. Journal of Cell Science. 135 (5), 259091(2022).
- Cardona, A., Saalfeld, S., Schindelin, J., Arganda-Carreras, I. TrakEM2 software for neural circuit reconstruction. PLoS One. 7 (6), 38011(2012).
- Stalling, D., Westerhoff, M., Hege, H. -C. Amira: A highly interactive system for visual data analysis. The Visualization Handbook. 38, 749-767 (2005).
- Hsieh, T. S., Chen, Y. J., Chang, C. L., Lee, W. R., Liou, J. Cortical actin contributes to spatial organization of ER-PM junctions. Molecular Biology of the Cell. 28 (23), 3171-3180 (2017).
- Anastasia, I., Ilacqua, N., Raimondi, A., Lemieux, P. Mitochondria-rough-ER contacts in the liver regulate systemic lipid homeostasis. Cell Reports. 34 (11), 108873(2021).
- Cattin, A. L., Burden, J. J., Van Emmenis, L., Mackenzie, F. E. Macrophage-Induced Blood Vessels Guide Schwann Cell-Mediated Regeneration of Peripheral Nerves. Cell. 162 (5), 1127-1139 (2015).
- Lopes-da-Silva, M., et al. A GBF1-dependent mechanism for environmentally responsive regulation of ER-Golgi transport. Developmental Cell. 49 (5), 786-801 (2019).
- Banushi, B., Forneris, F., Straatman-Iwanowska, A., Strange, A. Regulation of post-Golgi LH3 trafficking is essential for collagen homeostasis. Nature Communications. 7, 12111(2016).
- Rey, S. A., et al. Ultrastructural and functional fate of recycled vesicles in hippocampal synapses. Nature Communications. 6, 8043(2015).
- Belicova, L., Repnik, U., Delpierre, J., Gralinska, E. Anisotropic expansion of hepatocyte lumina enforced by apical bulkheads. Journal of Cell Biology. 220 (10), 202303003(2021).
- Kizilyaprak, C., Daraspe, J., Humbel, B. M. Focused ion beam scanning electron microscopy in biology. Journal of Microscopy. 254 (3), 109-114 (2014).
- Xu, C. S., Hayworth, K. J., Lu, Z., Grob, P. Enhanced FIB-SEM systems for large-volume 3D imaging. Elife. 6, 1-36 (2017).
- Parlakgül, G., Arruda, A. P., Cagampan, E., Pang, S. High resolution 3D imaging of liver reveals a central role for subcellular architectural organization in metabolism. bioRxiv. , (2020).
- Guerin, C. J., Kremer, A., Borghgraef, P., Lippens, S. Targeted studies using serial block face and focused ion beam scan electron microscopy. The Journal of Visualized Experiments: JoVE. (150), e59480(2019).
- Kremer, A., et al. A workflow for 3D-CLEM investigating liver tissue. Journal of Microscopy. 281 (3), 231-242 (2021).
- Hayat, M. Principles and techniques of electron microscopy: biological applications. , Cambridge University Press. (2000).
- Wisse, E., Braet, F., Duimel, H., Vreuls, C. Fixation methods for electron microscopy of human and other liver. World Journal of Gastroenterology. 16 (23), 2851-2866 (2010).
- Hanley, J., Dhar, D. K., Mazzacuva, F., Fiadeiro, R. Vps33b is crucial for structural and functional hepatocyte polarity. Journal of Hepatology. 66 (5), 1001-1011 (2017).
- Deerinck, T. J., Bushong, E. A., Thor, A., Ellisman, M. H. NCMIR methods for 3D EM: a new protocol for preparation of biological specimens for serial block face scanning electron microscopy. Microscopy. 1, 6-8 (2010).
- Miranda, K., Girard-Dias, W., Attias, M., de Souza, W., Ramos, I. Three dimensional reconstruction by electron microscopy in the life sciences: An introduction for cell and tissue biologists. Molecular Reproduction and Development. 82 (7-8), 530-547 (2015).
- Yamaguchi, M., Chibana, H. A method for obtaining serial ultrathin sections of microorganisms in transmission electron microscopy. The Journal of Visualized Experiments: JoVE. (131), e56235(2018).
- Hall, D. H., Hartwieg, E., Nguyen, K. C. Modern electron microscopy methods for C. elegans. Methods in Cell Biology. 107, 93-149 (2012).
- Hagler, H. K. Ultramicrotomy for biological electron microscopy. Methods in Molecular Biology. 369, 67-96 (2007).
- Arganda-Carreras, I., et al. Consistent and elastic registration of histological sections using vector-spline regularization. Computer vision approaches to medical image analysis, CVAMIA 2006, Lecture Notes in Computer Science. Beichel, R. R., Sonka, M., et al. 4241, Springer Berlin Heidelberg. Berlin, Heidelberg. 85-95 (2006).
- Belevich, I., Joensuu, M., Kumar, D., Vihinen, H., Jokitalo, E. Microscopy image browser: a platform for segmentation and analysis of multidimensional datasets. PLoS Biology. 14 (1), 1002340(2016).
- Fiala, J. C. Reconstruct: a free editor for serial section microscopy. Journal of Microscopy. 218, 52-61 (2005).
- Kremer, J. R., Mastronarde, D. N., McIntosh, J. R. Computer visualization of three-dimensional image data using IMOD). Journal of Structural Biology. 116 (1), 71-76 (1996).
- Iudin, A., Korir, P. K., Salavert-Torres, J., Kleywegt, G. J., Patwardhan, A. EMPIAR: a public archive for raw electron microscopy image data. Nature Methods. 13 (5), 387-388 (2016).
- Xu, C. S., Pang, S., Shtengel, G., Muller, A. An open-access volume electron microscopy atlas of whole cells and tissues. Nature. 599 (7883), 147-151 (2021).
- Karabag, C., et al. Semantic segmentation of HeLa cells: An objective comparison between one traditional algorithm and four deep-learning architectures. PLoS One. 15 (10), 0230605(2020).
- Heinrich, L., Bennett, D., Ackerman, D., Park, W. Whole-cell organelle segmentation in volume electron microscopy. Nature. 599 (7883), 141-146 (2021).
- Kim, J. S., Greene, M. J., Zlateski, A., Lee, K. Space-time wiring specificity supports direction selectivity in the retina. Nature. 509 (7500), 331-336 (2014).
- Spiers, H., Songhurst, H., Nightingale, L., de Folter, J. Deep learning for automatic segmentation of the nuclear envelope in electron microscopy data, trained with volunteer segmentations. Traffic. 22 (7), 240-253 (2021).
- Hasan, N. M., Gupta, A., Polishchuk, E., Yu, C. H. Molecular events initiating exit of a copper-transporting ATPase ATP7B from the trans-Golgi network. The Journal of Biological Chemistry. 287 (43), 36041-36050 (2012).
- Stoeck, I. K., Lee, J. Y., Tabata, K., Romero-Brey, I. Hepatitis C virus replication depends on endosomal cholesterol homeostasis. The Journal of Virology. 92 (1), 01196(2018).
- Ma, X., Qian, H., Chen, A., Ni, H. M., Ding, W. X. Perspectives on mitochondria-ER and mitochondria-lipid droplet contact in hepatocytes and hepatic lipid metabolism. Cells. 10 (9), 2273(2021).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved