Method Article
מד מתח קשירה בדיקות לכימות גורם גדילה מתווך מכניקת אינטגרין והדבקה
In This Article
Summary
משטח TGT הוא פלטפורמה חדשנית לחקר גורם גדילה-אינטגרין crosstalk. תכנון הבדיקה הגמיש, הספציפיות של ליגנד ההדבקה והמודולציה המדויקת של תנאי הגירוי מאפשרים הערכות כמותיות חזקות של יחסי הגומלין בין EGFR-integrin. התוצאות מדגישות את EGFR כ'מכנו-מארגן' המכוון את מכניקת האינטגרין, ומשפיע על מכלול הידבקות המוקד ועל התפשטות התאים.
Abstract
אורגניזמים רב-תאיים מסתמכים על אינטראקציות בין קולטני ממברנה לבין ליגנדות קוגנטיות במטריצה החוץ-תאית הסובבת (ECM) כדי לתאם פונקציות מרובות, כולל הידבקות, התפשטות, נדידה והתמיינות. כוחות מכניים יכולים להיות מועברים מהתא דרך קולטן ההדבקה integrin לליגנדות ב- ECM. הכמות והארגון המרחבי של כוחות אלה הנוצרים על ידי תאים יכולים להיות מווסתים על ידי קולטני גורם גדילה, כולל קולטן גורם גדילה אפידרמלי (EGFR). הכלים הקיימים כיום לכימות שינויים בתיווך crosstalk במכניקת התאים ולקשר אותם להידבקויות מוקדיות, מורפולוגיה תאית ואיתות מוגבלים. חיישני כוח מולקולרי מבוססי דנ"א המכונים קשירת מד מתח (TGTs) שימשו לכימות השינויים הללו. גשושיות TGT הן ייחודיות ביכולתן גם לווסת את סף הכוח הבסיסי וגם לדווח על כוחות קולטן בקנה מידה של פיקונוואטון על פני כל פני התא הדביק ברזולוציה מרחבית מוגבלת עקיפה. בדיקות ה-TGT המשמשות כאן מסתמכות על דיסוציאציה בלתי הפיכה של דופלקס דנ"א על ידי כוחות קולטן-ליגנד המייצרים אות פלואורסצנטי. זה מאפשר כימות של מתח האינטגרין המצטבר (היסטוריית הכוח) של התא. מאמר זה מתאר פרוטוקול המשתמש ב- TGTs כדי לחקור את ההשפעה של EGFR על מכניקת האינטגרין ויצירת הידבקות. ההרכבה של פלטפורמת החישה המכנית TGT מפורטת באופן שיטתי ומתווה את הנוהל לכוחות תמונה, הידבקויות מוקד והתפשטות תאים. באופן כללי, היכולת לווסת את סף הכוח הבסיסי של הגשושית, את ליגנד ההדבקה ואת הסוג והריכוז של גורם הגדילה המשמש לגירוי הופכים את זה לפלטפורמה חזקה לחקר יחסי הגומלין בין קולטני ממברנה מגוונים בוויסות כוחות בתיווך אינטגרין.
Introduction
לתאים יש את היכולת הפנימית לחוש, ליצור ולהגיב לכוחות מכניים, מה שמוביל לשינויים בפנוטיפ התאי ולשיפוץ של המיקרו-סביבה המקומית 1,2. לכוחות יש תפקיד מכריע בוויסות היבטים רבים של התנהגות התאים, כולל הידבקות, נדידה, התפשטות, התמיינות וריפוי פצעים 3,4. סטיות בחילופין מכני דו-כיווני בין תא למיקרו-סביבה עלולות להוביל למצבים חולים, כולל סרטן5. קולטני ממברנה רבים מעורבים בשמירה על הומאוסטזיס של מטריצת תאים; מתוכם, לאינטגרינים ולקולטן גורם הגדילה האפידרמלי (EGFR) יש סינרגיה חזקה 6,7. באופן קלאסי, אינטגרין מבסס את הקשר המכני בין המיקרו-סביבה לבין השלד התוך-תאי בעוד ש-EGFR מווסת את גדילת התאים, התפשטותםוהישרדותם 8,9. EGFR היא מטרה טיפולית שנחקרה מאוד, המתמקדת בוויסות חיצוני-פנימי המאפשר איתות תוך-תאי. EGFR-integrin crosstalk הוקם גנטית וביוכימית כדי לווסת את ההתקדמות של מחלות מרובות, כולל סרטן10,11. בעוד שמחקרים מצביעים על קיומם של יחסי גומלין בין EGFR-integrin, התוצאות מיוחסות למסלולי איתות הרחק מממברנת הפלזמה 7,12,13,14. ההשפעה של EGFR, או גורמי גדילה אחרים, על מכניקת התאים נותרה במידה רבה בלתי נחקרת, בין השאר בשל היעדר כלים למדידת כוחות תאיים ותוצאות איתות. האתגר טמון בזיהוי כלים מתאימים לחקר התקשורת בין פרדיגמות האיתות המקביליות הללו ולכימות תרומתן הספציפית למכניקת התא.
מספר גישות פותחו למדידת כוחות הנוצרים על ידי קולטני הידבקות תאים, והקורא מופנה לסקירות מעמיקות של טכניקות אלה15,16. בקצרה, מיקרוסקופיית כוח המתיחה וזיהוי מערך מיקרו-עמודים מסתמכים על דפורמציה של מצע בסיסי כדי להסיק כוחות ננו-ניוטון (nN), סדר גודל גדול יותר מכוחות קולטן בודדים17,18. טכניקות של מולקולה בודדת, כולל AFM ופינצטה אופטית, רגישות לכוחות פיקונוואטון (pN) של חלבון יחיד, אך מודדות רק קולטן אחד בכל פעם ואינן מציעות רזולוציה מרחבית טובה (או בכלל). בדיקות מתח מולקולרי מבוססות דנ"א וגשושיות קשירה של מד מתח (TGT) מציעות רזולוציית כוח pN עם רזולוציה מרחבית מוגבלת עקיפה (או טובה יותר), מה שמעניק להן תפקיד ייחודי בחקר כוחות חד-תאיים19,20 מסוגי תאים מגוונים, כולל פיברובלסטים, תאים סרטניים, טסיות דם ותאי מערכת החיסון 21,22,23,24 . בעוד שלגשושיות המתח המולקולרי יש אלמנט "קפיץ" הניתן להרחבה, אידיאלי להדמיה בזמן אמת, בדיקות TGT נקרעות באופן בלתי הפיך, ומותירות אחריהן "היסטוריית כוח" פלואורסצנטית. TGTs מווסתים בנוסף את סף המתח של המצע הבסיסי; ניתן להשתמש בסדרה של בדיקות בעלות הרכבים כימיים דומים אך כוחות קרע שונים, או סובלנות למתח (Ttol), כדי לכמת את המתח המינימלי הנדרש להיווצרות הידבקות מוקדית והתפשטות תאים. בדיקות TGT מורכבות משני גדילי דנ"א משלימים, האחד מעוגן לפני השטח והשני מציג ליגנד לתא. אם קולטן קושר את הליגנד ומפעיל כוח גדול יותר מטולה-T של הגשושית, הגדילים יופרדו. Ttol מוגדר ככוח הקבוע הדרוש כדי לקרוע 50% מהגשושיות במרווח של 2 שניות בתנאים אידיאליים. בבדיקות TGT "מופעלות", ניתן להפריד קוונצ'ר על הגדיל העליון מפלואורופור על הגדיל התחתון. רק כאשר גשושית ה-TGT נקרעה, ככל הנראה על ידי כוחות גדולים או שווים ל-Ttol, ייווצר אות פלואורסצנטי. ניתן גם לתקן בדיקות TGT, מה שמאפשר מניפולציה קלה של מערכות ביולוגיות ובדיקות של מצבים מרובים. מסיבות אלה, בדיקות TGT שימשו בעבודה זו.
בדיקות TGT שימשו כדי לחקור כיצד הידבקות תאים תלויי אינטגרין וכוחות מכניים מווסתים על ידי EGFR21 מופעל. עבודה זו ביססה את EGFR כ'מארגן מכאנו', כוונון ארגון הידבקות מוקדית ויצירת מתח. בנוסף, נמצא כי גירוי EGF השפיע על התפלגותם ובשלותם של הידבקויות מוקדיות והגביר את התפשטות התאים. גישה זו יכולה לשמש במחקרים עתידיים כדי לחקור כיצד גורמי גדילה משפיעים על כוחות מכניים בהתקדמות הגידול ובדינמיקה שלו. בעוד שהתפקיד של הצלבת EGFR-integrin בוויסות המעבר האפיתליאלי למזנכימלי נקבע, תפקידם של כוחות מכניים בתהליך זה נותר תחת חקירה10.
כאן, מוצג פרוטוקול מפורט לניסויים אלה המכסה סינתזה והרכבה של 56 בדיקות PN TGT, יצירת משטחי TGT על כיסויי זכוכית, יישום של תאי Cos-7 על משטח TGT וגירוי עם EGF, קיבוע והכתמה של תאים עם פאלואידין, ונוגדן אנטי-פקסילין, פלואורסצנציית השתקפות פנימית כוללת ברזולוציה גבוהה (TIRF) והדמיית מיקרוסקופיה של הפרעות השתקפות (RICM), וכימות תמונות. פרוטוקול זה, למרות שנכתב כדי לחקור גירוי EGF של תאי Cos-7, ניתן להתאמה בקלות עבור ניסויים רבים מבוססי TGT. ניתן להחליף בקלות ליגנדות שונות, Ttol, סוגי תאים, פרמטרים של גירוי, חלבונים המסומנים לאחר קיבוע וניתוח כמותי, מה שהופך את הפרוטוקול הזה לחזק ושימושי באופן נרחב.
Protocol
1. הכנת אוליגונוקלאוטיד TGT
הערה: הפרטים של סינתזת בדיקה אוליגונוקלאוטיד מתוארים כאן. שים לב שניתן לבצע כמה שינויים ושלבי טיהור למיקור חוץ לצורך סינתזה מותאמת אישית.
- הפעילו את האמין העיקרי של הפפטיד ציקלו[Arg-Gly-Asp-D-Phe-Lys(PEG-PEG)] עם הפפטיד azide-NHS כפי שתואר על ידי Zhang et al22 על ידי ערבוב ביחס של 1:1.5 (100:150 ננומולים) בנפח סופי של 10 μL דימתילפורמיד. מוסיפים 0.1 μL של טריאתילמין הבסיס האורגני ודגירה למשך 12 שעות בטמפרטורה של 4 מעלות צלזיוס.
- טהרו את המוצר על ידי HPLC בפאזה הפוכה באמצעות 0.1 M TEAA (ממס A) ו-100% אצטוניטריל (ממס B) עם קצב זרימה של 1 מ"ל לדקה והתנאי ההתחלתי של 10% ממס B מוגדר בשיפוע של 0.5% לדקה. שלבו את הפסגות האלוהיות (ספיגה ב-203 ננומטר) ואמתו על ידי ספקטרומטריית מסות MALDI-TOF. המוצר הוא cRGDfK-azide.
- כדי ליצור את הגדיל העליון של TGT, שלבו את cRGDfK-azide ו-alkyne-21-BHQ2 oligonucleotide (גדיל עליון TGT: 5Hexynyl/GTGAAATACCGCACAGATGCG/3BHQ_2) ביחס של 2:1 (͂200 μM: 100 μM) ב-100 μL של מלח 1x 1x Phosphate Buffered Saline (PBS) עם 5 mM נתרן אסקורבט ו-Cu-THPTA בעל 0.1 μM. אפשרו לתגובה להמשיך לפחות 4 שעות בטמפרטורת החדר (RT) או למשך הלילה בטמפרטורה של 4 מעלות צלזיוס.
- מעבדים את התערובת באמצעות ג'ל ההתפלה P2 כדי להסיר עודפי צבע, תוצרי לוואי, ממס אורגני וריאגנטים שלא טופלו. הכינו את עמוד הצנטריפוגה עם 650 μL של ג'ל P2 שעבר הידרציה מראש על ידי סיבובו כלפי מטה ב-18,000 x גרם למשך דקה אחת. השליכו את הנוזל הזורם והוסיפו את תערובת התגובה. סובבו שוב ב-18,000 x g למשך דקה אחת ואספו את הזרימה.דרך. הביאו את תערובת התגובה לנפח סופי של 300 μL עם מים אולטרה-פוריים.
הערה: הקפידו מראש על ג'ל P2 עם מים למשך 6 שעות. - טהרו את תערובת התגובה המותפלת על ידי HPLC בפאזה הפוכה. הממסים האורגניים המשמשים לטיהור זה כוללים 0.1 M TEAA ב- H2O (ממס A) ו- 100% MeCN (ממס B, או הפאזה הניידת).
- לפני הזרקת התערובת, יש לאזן את העמודה במצב התחלתי של 10% ממס B עם גרדיאנט של 1%/דקה. התאם את קצב הזרימה ל- 1 מ"ל לדקה. הזריקו את תערובת התגובה ללולאת HPLC עם מחט הזרקה של 500 μL.
- אסוף את המוצר על ידי הדמיה של ספיגת שיא ב-260 ננומטר עבור הדנ"א ו-560 ננומטר עבור ה-BHQ2 quencher. מייבשים את המוצר המרופט למשך הלילה ברכז צנטריפוגלי ואקום.
- השתמש בהחלפה נוקלאופילית כדי להצמיד גדיל תחתון TGT לאסטר Cy3B-NHS כמתואר ב- Ma et. אל25. יש לערבב 100 μM של גדיל תחתון TGT של 56 pN (5Biosg/TTTTTT/iUniAmM/iUniAmM/CGCATCTGTGCGGTATTTCACTTT) עם 50 מיקרוגרם של אסטר Cy3B-NHS המומס מראש ב-10 מיקרול של DMSO. התאימו את ה-pH של תערובת זו ל-9 עם 0.1 מ' נתרן ביקרבונט והביאו את הנפח הסופי ל-100 μL עם 1x PBS. דגירה של תערובת התגובה למשך הלילה ב-RT.
- טהרו את התערובת ברצף באמצעות סינון ג'ל P2 ו-HPLC בפאזה הפוכה כדי להפריד בין ריאגנטים, מלחים וממיסים אורגניים שלא טופלו (המתוארים בשלבים 1.4 ו-1.5).
- הערך את הריכוז של צמדי הצבעים האוליגונוקלאוטידים המטוהרים על ידי רישום הספיגה שלהם ב-260 ננומטר באמצעות ספקטרופוטומטר.
- אפיינו את המוצרים המטוהרים על ידי ספקטרומטריית מסות MALDI-TOF. ממיסים עודפי חומצה 3-הידרוקסיפיקולינית לממס TA50 (50:50 v/v אצטוניטריל ו-0.1% TFA ב-ddH2O) כדי להכין את מטריצת ה-MALDI הטרייה. משקלים מולקולריים משוערים ונמדדים עבור המוצרים המסומנים הם: cRGDfK-1-BHQ2 - 8157.9 (מחושב), 8160.1 (נמצא); Cy3B מסומן 56 pN TGT - 10272.7 (מחושב), 10295.8 (נמצא).
- ממיסים את הגדילים העליונים והתחתונים בנפרד במים נטולי נוקלאז בריכוז שבין 30-50 μM. השתמשו בקצות פיפטה ללא DNase כדי למנוע זיהום במלאי. אחסן ב- 4 °C עבור יישומים לטווח קצר או -20 °C עבור יישומים לטווח ארוך. היציבות של אוליגונוקלאוטידים אינה מושפעת ממחזורי הפשרה חוזרים ונשנים של הקפאה.
2. הכנת פני השטח
יום 1:
- יש למקם כיסויי זכוכית בקוטר 25 מ"מ (עד 8) לתוך מתלה פוליאתילן פלואורואורואתילן. מניחים את המדף בכוס בורוסיליקט 50 מ"ל המכילה 40 מ"ל של 200 אתנול הוכחה. כסו את הכוס בסרט פרפין כדי למנוע כניסת מים וצליל בתדר הפעלה של 35 קילוהרץ למשך 10-15 דקות ב-RT (איור 1A).
- מלאו של 50 מ"ל ב-40 מ"ל של תמיסת פיראנה שהוכנה זה עתה על ידי ערבוב חומצה גופרתית ומי חמצן ביחס של 3:1 בכוס פירקס. מערבבים עם פיפטה מזכוכית. העבירו את מתלה הכיסויים לתוך הכוס ודגרו במשך 30 דקות ב-RT במכסה האדים כדי לחרוט את משטח הכיסוי (איור 1B).
הערה: לבשו ציוד הגנה אישי מלא, כולל מעיל מעבדה, כפפות ומשקפי מגן, ועבדו במכסה המנוע של האדים הכימיים. מוסיפים מי חמצן לחומצה לאט כדי למנוע התחממות יתר של התמיסה. - לאחר החריטה, השתמשו בפינצטה כדי להעביר את מתלה הכיסוי לכוס עם מים אולטרה-פוריים. חזור על שלב זה שש פעמים במרווחים של 15 שניות כדי לנטרל לחלוטין את החומצה (איור 1C).
הערה: השאירו את תמיסת הפיראנה במכסה האדים הכימי למשך הלילה לפני השלכתה למיכל הפסולת החומצה. - בדקו באופן חזותי את הכיסויים כדי לוודא שהמשטחים נראים נקיים ללא תבניות או חלקיקי אבק על פני הזכוכית. חזור על שלבים 2.1-2.4 אם זוהו דפוסים או אבק.
הערה: בדוק את ההידרופיליות של פני השטח על ידי טבילת כיסויים מטופלים במים והסרתם אנכית. מים על כיסויים מטופלים נסוגים כסדין אחיד ליצירת הטבעות של יאנג בהשוואה לכיסויים לא מטופלים היוצרים טלאים. - מעבירים את מדף הכיסויים לכוס עם 200 אתנול חסין ושוטפים פעמיים במשך 15 שניות כדי ליישר את המשטחים לממס אורגני. העבר את ארון המדפים לתמיסת אתנול הוכחה של 200 עם 3% APTES למשך שעה אחת ב-RT כדי להסלף את הכיסויים (איור 1D). מכסים את הכוס בסרט פרפין.
הערה: פרמטרי התצהיר של APTES משתנים בהתאם לשיטת ניקוי פני השטח, תכולת המים הממסים, ריכוז APTES, זמני הדגירה והטמפרטורה לחישול. - טבלו את המדף בכוס נקייה עם תמיסת אתנול 200 הוכחה. חזרו על שטיפה זו שלוש פעמים במשך 15 שניות כל אחת (איור 1E).
- מייבשים את הכיסויים באמצעות גז חנקן (N2) עם לחץ יציאה נמוך. מניחים את הכיסויים לתוך צלחת פוליסטירן בקוטר 10 ס"מ עם חתיכת סרט פרפין מונחת שטוח בתוכה. ודאו שהכיסויים יבשים ומופרדים (איור 1F).
- הוסיפו 100 μL של תמיסת NHS-ביוטין של 2 מ"ג/מ"ל ב-DMSO לארבעה קליפים המונחים על סרט פרפין. קבעו "כריך" עם ארבעת הכיסויים האחרים למעלה (שני כיסויים הפונים זה לזה עם תמיסת הפונקציונליזציה ביניהם) ודגרו את המנה למשך הלילה בטמפרטורה של 4 מעלות צלזיוס (איור 1G).
הערה: ב 4 ° C, מגיב NHS יציב יותר, מה שמאפשר פונקציונליזציה אחידה של פני השטח. בנוסף, הכריך משמר ריאגנטים. הימנעו מהוספת תמיסה עודפת בכריך מכיוון שהיא עלולה לדלוף החוצה ולגרום לכיסויים להחליק.
יום 2:
- מוציאים את התבשיל מ-4 מעלות צלזיוס ומפרידים את הכיסויים הסנדוכים. כוון את החלקות במדף כאשר המשטח המצופה פונה זה אל זה כפי שמוצג באיור 2A. שטפו אותם בתמיסת אתנול הוכחה של 200 שלוש פעמים במשך 15 שניות כל אחת. יבשו עם גז N2 והניחו אותם במנה חדשה עם סרט פרפין בתוכו.
הערה: הכוונת הכיסויים כפי שצוין מסייעת בזיהוי המשטח המתפקד. - שטפו את הכיסויים עם 1 מ"ל של 1x PBS שלוש פעמים כדי לאזן אותם בחזרה לשלב מימי. הוסיפו 800 μL של 0.1% אלבומין בסרום בקר (BSA) ב-1x PBS (w/v) לכל אחד מהכיסויים ודגרו ב-RT למשך 30 דקות כדי להעביר את פני השטח ולחסום קשירה לא ספציפית של ריאגנטים פונקציונליים מאוחרים יותר (איור 2B).
- לאחר הדגירה, לשטוף את כיסויים שלוש פעמים עם 1 מ"ל של 1x PBS. הוסיפו 800 μL של 1 מיקרוגרם/מ"ל של סטרפטווידין ב-1x PBS ב-RT למשך 45-60 דקות כדי לתפקד את הכיסויים (איור 2C).
הערה: שמור כיסוי אחד ללא סטרפטווידין כדי לאמת את יעילות הפסייבציה (אופציונלי). הוסף 10 ננומטר מולקולות ביוטינילציה ותמונה באמצעות תנאי ניסוי. עוצמת משטח זו צריכה להיות קרובה לרעש הכהה של המצלמה. - במקביל לשלב 2.11, הרכיבו את הגשושיות TGT (למעלה: גדיל תחתון ביחס טוחן של 1:1) בריכוז סופי של 50 ננומטר ב-100 מיקרול של 1 M NaCl בצינור PCR באמצעות תרמוציקלר. נתקו גדילים בטמפרטורה של 95 מעלות צלזיוס למשך 5 דקות, וחישול הדרגתי על ידי הפחתת הטמפרטורה ל-25 מעלות צלזיוס ושמירה עליה למשך 25 דקות (איור 2D). הימנעו מחשיפה ממושכת של בדיקות TGT לאור.
- לאחר הדגירה של סטרפטווידין, השתמש ב-1x PBS כדי לשטוף את הכיסויים שלוש פעמים. הוסיפו 100 μL של בדיקות ה-TGT שהורכבו מראש לארבעה מהכיסויים והכינו סנדוויצ'ים באמצעות 4 הכיסויים הנותרים עם הצד הפונקציונלי הפונה אל הגשושיות (שמונה משטחים דורשים ארבעה צינורות של בדיקות TGT היברידיות). מכסים בנייר אלומיניום ודגירה למשך שעה אחת ב-RT כדי לאפשר קשירה של הגשושית לפני השטח (איור 2E).
- לאחר הדגירה, מפרידים את הכריכים ושוטפים את הכיסויים עם 1x PBS שלוש פעמים. משטחי ה-TGT מוכנים כעת להדמיה. הרכיבו בזהירות את הכיסויים לתאי הדמיה מנוקים מראש והוסיפו 1x PBS כדי לשמור על הידרציה של המשטחים (איור 2F).
הערה: שמירה על התאים תפצח את פני השטח. למנוע ייבוש של המשטחים.
3. הכנת תאים וכתמים
- כדי לחקור את ההשפעה של גירוי גורם הגדילה האפידרמלי (EGF) על מכניקת Cos-7, הידבקות והתפשטות תאים, נסה לבצע טריפסיניזציה של תאי Cos-7 עם 0.05% טריפסין-EDTA למשך 2 דקות. נטרל את הטריפסין על ידי שטיפה עם HBSS וצנטריפוגה ב-800 x גרם למשך 5 דקות. חזור על שלב הנטרול פעם נוספת.
- תאי צלחת בצפיפות של 4 x 104 תאים על משטחי ה-TGT המורכבים במדיום הנשר המתוקן (DMEM) של Dulbecco בתוספת 50 ננוגרם/מ"ל EGF או DMEM ללא EGF. אפשרו לתאים להתפשט במשך 60 דקות בטמפרטורה של 37 מעלות צלזיוס עם 5% CO2 בחממת תרביות תאים (איור 3A).
הערה: תאים מודגרים ב- DMEM ללא סרום כדי למנוע גירוי מגורמי גדילה. EGF מדולל בחומצה אצטית של 10 mM כדי ליצור מלאי של 1 מ"ג/מ"ל. הוא משמש ב-50 ננוגרם/מ"ל ב-DMEM לניסויי הדמיה. - לאחר הדגירה, שטפו את התאים שלוש פעמים עם PBS 1x ותיקנו עם 2 מ"ל של 4% פרפורמלדהיד למשך 12 דקות ב-RT (איור 3B).
הערה: כל שלבי הדגירה מבוצעים על שייקר סיבובי במהירות של כ-35 סל"ד לצורך התפשטות אחידה של התמיסות. הגן על משטחי ה-TGT מפני אור על-ידי כיסוים עד שהם מוכנים להדמיה. - שאפו את הקיבוע ושטפו את הכיסויים חמש פעמים עם 1x PBS במרווחים של 5 דקות ב-RT. לחלופין, דגרו את הכיסויים עם 50 mM NH4Cl ב-1x PBS למשך 30 דקות ב-37 מעלות צלזיוס כדי להרוות את האוטופלואורסצנציה האוטומטית הקשורה לפרפורמלדהיד ושטפו שלוש פעמים עם 1x PBS במרווחים של 5 דקות (איור 3B).
- הוסף Buffer A (1x PBS, 5% סרום סוסים רגיל, 5% סרום עיזים רגיל, 1% BSA, 0.025% Triton X-100) ודגירה במשך 30 דקות ב 37 °C כדי לחסום ולחלחל את התאים. יש לשטוף שלוש פעמים עם PBS אחד במרווחים של 5 דקות (איור 3B).
- הניחו את תאי ההדמיה עם כיסויים במיכל לחות. דיללו את הנוגדן העיקרי נגד פקסילין (סמן הידבקות מוקדי) בשעה 1:250 במאגר חוסם (1x PBS, 5% סרום סוסים תקין, 5% סרום עיזים רגיל, 1% BSA, 0.005% טריטון x-100). דגירה עם 200 μL של תמיסת נוגדנים ראשונית לכל כיסוי למשך 2 שעות בטמפרטורה של 37 מעלות צלזיוס (איור 3B).
הערה: אל תתנו למשטחים להתייבש. - שטפו את הכיסויים חמש פעמים עם 1x PBS במרווחים של 5 דקות והחזירו אותם למיכל הלחות. סמן תאים בו זמנית עם תערובת של נוגדן משני נגד ארנב עיזים מצומדות צבע בשעה 1:800 דילול וצבע מצומד פאלואידין (אקטין) בשעה 1:400 דילול ב-200 μL של חיץ חוסם לכל כיסוי. דגירה בטמפרטורה של 37 מעלות צלזיוס למשך 60 דקות (איור 3B).
- שטפו את המשטחים חמש פעמים עם PBS אחד במרווחים של 5 דקות ואחסנו בטמפרטורה של 4 מעלות צלזיוס עד שהם מוכנים להדמיה (איור 3B).
הערה: דגימות תמונה תוך 3 ימים מהכנת פני השטח כדי למנוע השפלת אותות.
4. רכישת תמונה
- השתמש במטרת טבילת שמן 60x עם מפתח צמצם מספרי גבוה (1.49) במיקרוסקופ הפוך עם עירור TIRF 488, 561 ו- 647, עירור RICM, מערכת מיקוד מושלמת ומצלמה דיגיטלית.
- מוסיפים שמן למטרה, מנקים את תחתית הכיסוי של תא הדגימה ומניחים את הדגימה על הבמה. התמקדו בתא והתמקדו באופן מושלם.
- הכניסו את המיקרוסקופ למצב הדמיית RICM עם עירור אפיפלואורסצנטי וקוביית מסנן GFP עם הסרת מסנן הפליטה. יישרו את ה-RICM על ידי סגירה ומרכוז של הסרעפת עם מפתח הצמצם epi-illumination.
- שים את המיקרוסקופ במצב TIRF עם עירור לייזר וקוביית מסנן TIRF עם ארבעה מעברים. מקד את הלייזר של 488 ננומטר לנקודה קטנה על תקרת החדר והגדיל את זווית ההיארעות עד מעבר לזווית הקריטית תוך ניטור פלואורסצנטיות במצלמה במצב חי. שימו לב לירידה חדה בפלואורסצנציה ברקע ובמישור מיקוד יחיד כאשר הזווית הקריטית עולה עליה.
הערה: TIRF מעורר אזור דק (~100 ננומטר) הקרוב ביותר לממשק כיסוי הדגימה המדגיש בדיקות TGT פתוחות והדבקות מוקדיות תוך ביטול פלואורסצנציה מחוץ למיקוד מתוך התא. אם TIRF אינו זמין, ניתן להשתמש באפי-פלואורסצנציה; עם זאת, יחסי האות לרעש יהיו נמוכים יותר. - זהה תאים להדמיה באמצעות מצב "חי" של המצלמה באמצעות RICM.
- רכוש את תמונת ה- RICM ותמונות TIRF של אקטין (640 ננומטר לשעבר), מתח אינטגרין (561 ננומטר לשעבר) ופקסילין (488 ננומטר לשעבר). השג תמונות ברצף באמצעות זמן חשיפה של 200 אלפיות השנייה.
הערה: זמן החשיפה תלוי בגורמים רבים, כולל המטרה, הספק לייזר, מסנני פליטה ורגישות למצלמה. האות צריך להיות גדול לפחות פי 2 מהרקע. הרקע הוא סביב 1000 AU ולכן האות צריך להיות לפחות 2000-3000 AU. - חזור על 4.4-4.5 עבור 30 תאים לפחות. החליפו כיסויים, התמקדו וחזרו על הפעולה 4.4-4.5.
5. ניתוח נתונים
הערה: בצע ניתוח תמונה כמותי באמצעות תוכנת פיג'י והניתוח באמצעות תוכנת סטטיסטיקה.
- פתחו את ערכת התמונות עבור תא אחד.
- צור מסיכה של אזור התא (מסיכת RICM) על-ידי התחקות אחר גבול התא בתמונת RICM באמצעות כלי הבחירה של ImageJ Freehand. שמור את אזור העניין (ROI) למנהל ההחזר על ההשקעה (נתח > כלים > מנהל החזר ההשקעה) (איור 4A1,2).
- בחר אזור מייצג מחוץ לתא בתמונת המתח האינטגרין וצייר החזר השקעה של לפחות 200 x 200 פיקסלים. אל תכלול תאים אחרים או פסולת פלואורסצנטית מהחזר ההשקעה. מדוד את פלואורסצנציית הרקע בהחזר ההשקעה באמצעות כלי המדידה (נתח > מדידה) (איור 4A3).
- הפחת את הפלואורסצנציה הממוצעת ברקע המתקבלת בשלב 5.2 מתמונת המתח (תהליך > מתמטיקה > חיסור) (איור 4A4).
- השתמש במסיכת RICM שנקבעה בשלב 5.2 כדי להגדיר את אות המתח בתוך טביעת הרגל של התא (מנהל ההחזר על ההשקעה > בחר > החל מסיכה > ערוך > נקה בחוץ) (איור 4A5).
- צור מסיכת סף לתמונת המתח באמצעות השיטה של הואנג לסף אוטומטי (> תמונה התאם > סף) (איור 4A6). ודא שמסכת הסף מייצגת בצורה הטובה ביותר את האזור עבור מתח האינטגרין שנוצר. ככלל אצבע, הגדר את הסף ל- 2x מהפלואורסצנציה הממוצעת ברקע.
- צור בחירה של מסיכת המתח המסודרת (ערוך > בחירה > יצירה) (איור 4A7).
- העבר את המסכה שנבחרה לתמונת המתח שנוצרה בשלב 5.4 ומדוד את העוצמה המשולבת של בדיקות פתוחות (מנהל ROI > Select (מסכת מתח) > ניתוח > מדידת > RawIntDen) (איור 4C).
- מדוד את האזור, המעגליות ויחס הגובה-רוחב של המאפיינים המורפומטריים של התא מתוך מסיכת RICM (מנהל ROI > Select (מסיכת RICM) > החל מסכה > נתח > מדידה) (איור 4B).
- מדוד את צפיפות הקרע המכני, המוגדרת כאחוז טביעת הרגל של התא באמצעות בדיקות קרועות על-ידי בחירת תמונת מסכת המתח והחלת מסכת ה-RICM (מנהל ההחזר על ההשקעה > Select (מסיכת RICM) > נתח > מדד > %שטח) (איור 4C).
- ייצא את המדידות להמשך ניתוח והדמיה לתוכנת סטטיסטיקה.
- חזור על 5.1-5.11 עבור כל תא.
תוצאות
בדיקות TGT מופעלות שימשו כדי לחקור את ההשפעה של קולטן גורם גדילה אפידרמלי המופעל על ידי ליגנד (EGFR) על מכניקת תאים בתיווך אינטגרין ויצירת הידבקות בתאי Cos-721. הגשושיות מציגות את הליגנד מחזורי Arg-Gly-Asp-Phe-Lys (cRGDfK)21,23,25,26, שהוא סלקטיבי עבור ההטרודימר האנטגרין αVβ3 עם זיקה קטנה בלבד ל-α5β1 אינטגרין 27,28,29,30. בדיקת ה-TGT מורכבת מדנ"א דו-צדדי המתפקד על משטח כיסוי זכוכית דרך הגדיל התחתון באמצעות קשירת ביוטין-סטרפטווידין. הגדיל העליון מציג את ליגנד האינטגרין וזמין להיקשר לקולטן האינטגרין הקוגנטי בקרום התא (איור 5A). הגדיל התחתון מסומן בפלואורופור ובחוט העליון עם קוונצ'ר, מה שמוביל לפלואורסצנציה מינימלית ברקע כאשר ה-TGT הדו-צדדי שלם. אם אינטגרין קושר את הליגנד ומפעיל כוח בעל גודל גדול יותר מטול ה-T של הגשושית, דופלקס הדנ"א ייפרד ויוביל לפלואורסצנציה (איור 5A). כל גשושית TGT שלא נקרעה על ידי כוח מכני תישאר לא פלואורסצנטית. פלואורסצנציה סלקטיבית זו מאפשרת מיפוי שיטתי וכמותי של כוחות שנוצרו על ידי אינטגרין בקנה מידה pN ברזולוציה מוגבלת עקיפה. בדיקות TGT גם מווסתות את סף המתח של המצע.
מוצגת כאן דוגמה מייצגת של משטח TGT עםטול T של 56 pN. תאי Cos-7 צופו על משטח TGT זה עם או בלי גירוי EGF כדי לחקור את ההשפעה של הפעלת EGFR באמצעות גירוי ליגנד על הידבקות תאים ומכניקה של אינטגרין (איור 5A,B). התאים דוגרו עם או בלי EGF על משטחי ה-TGT במשך 60 דקות, קבועים ומוכתמים באופן חיסוני כדי להציג את התפלגות ההדבקה המוקדית (פקסילין) ואת הארגון של השלד הציטוסקלטון (F-actin) (איור 5B). לאחר מכן צולמו התאים באמצעות מיקרוסקופיית RICM ו-TIRF. כפי שניתן לראות בבירור בתמונת RICM, התפשטות תאי Cos-7 על פני השטח של 56 pN TGT שופרה באופן משמעותי עם גירוי EGF בהשוואה ללא גירוי. זה כומת עבור 50 תאים בכל מצב על ידי מדידת גודל אזור המגע בין התא למצע מתמונת RICM (איור 5C). גירוי עם EGF הביא למורפולוגיה מעגלית יותר, המייצגת את תאי Cos-7 מתפשטים וגדלים בסביבתם הפיזיולוגית הטבעית (איור 5D). הפלואורסצנציה מגשושיות פתוחות גבוהה יותר גם עם גירוי EGF כפי שנצפה בתמונת הפלואורסצנציה של המתח. העוצמה המשולבת של הגשושיות הפתוחות, שהיא פרופורציונלית למספר הגשושיות הפתוחות, הייתה גבוהה בהרבה עם גירוי EGF בהשוואה ללא (איור 5B,E). זהו ייצוג של כל ההתקשרויות של קולטן-ליגנד שבהן האינטגרינים הפעילו כוח גדול יותר מ-Ttol (56 pN).
צביעה בפקסילין הראתה כי ההתפלגות, המספר, ההבשלה (גודל) והארגון של הידבקויות מוקדיות הושפעו גם הם מגירוי EGF. הידבקויות מוקדיות בתאים מגורה EGF נראו בוגרות יותר ומכוונות רדיאליות בהשוואה ללא פקדי EGF. ארגון השלד של F-אקטין שופר גם הוא עם גירוי EGF, כפי שהוערך על ידי צביעת הפאלואידין (איור 5B). הערכות איכותניות אלה נעשו על ידי השוואה חזותית של תמונות משתי קבוצות הטיפול. ניתוח כמותי של הידבקות מוקדית יכול להיעשות אך הוא מעבר להיקף של פרוטוקול זה. בניסוי זה, משטח ה-TGT סיפק פלטפורמה לפרט באופן שיטתי את ההשפעה של הפעלת EGFR על התפשטות תאים, מכניקת אינטגרין ויצירת הידבקות מוקדית.
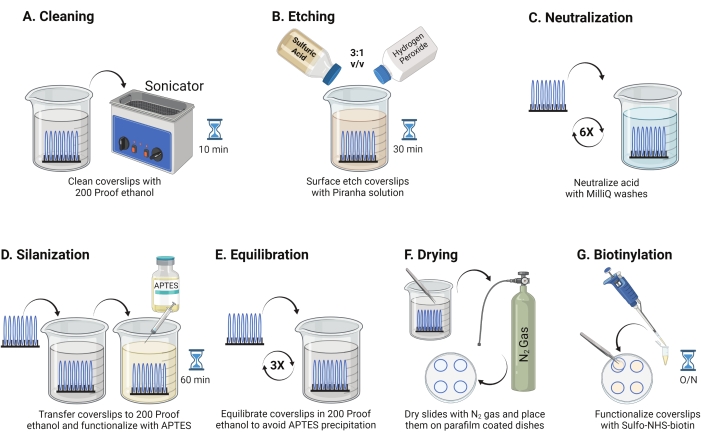
איור 1: סכמטי ליום 1 של הכנת פני השטח של TGT. (A) נקה את הכיסויים. (ב) לחרוט את משטח הכיסוי. (ג) לנטרל את פתרון הפיראנה. (D) סילאניזציה של פני השטח כדי ליצור קבוצות אמינים תגובתיות. (E) לאזן את הכיסויים לפאזה האורגנית. (F) לייבש את הכיסויים בגז אינרטי. (G) ביוטינילט את קבוצות האמין שעל פני השטח. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
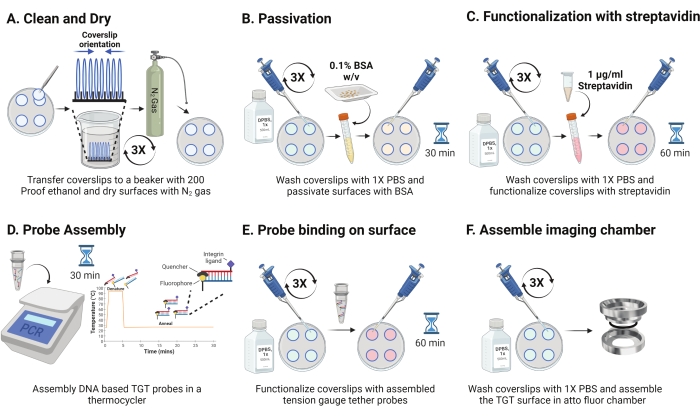
איור 2: סכמטי ליום 2 של הכנת משטח ה-TGT. (A) נקו ויבשו את הכיסויים כדי להסיר כל שאריות ביוטין מהיום הקודם. (ב) לעבור עם BSA כדי למנוע קשירה לא ספציפית של מגיב בשלבים הבאים. (C) לתפקד את הכיסויים עם סטרפטווידין. (D) הכלאה של הגשושיות ברכיבה תרמית. (E) להחיל את הגשושיות המסונתזות על הכיסויים (F) להרכיב את הכיסוי בתא ההדמיה של התא. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
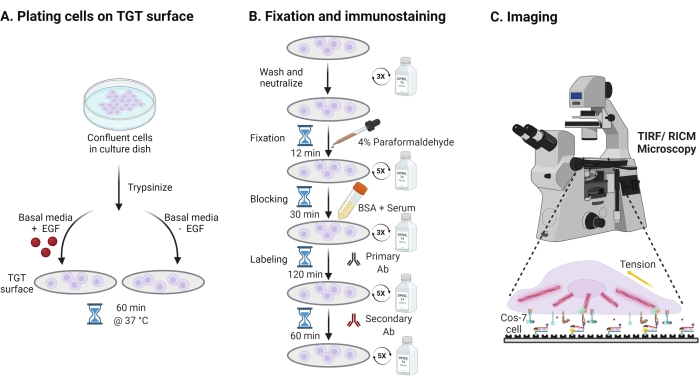
איור 3: זרימת עבודה כללית המדגישה את השלבים הרחבים לאורך כל מערך הניסוי. (B) תרשים זרימה של השלבים המעורבים בקיבוע ובכתם חיסוני לאחר ההצמדה וההתפשטות על משטח ה-TGT. (C) לאחר ההכתמה, התאים מצטלמים על מיקרוסקופ פלואורסצנטי הפוך עם מיקרוסקופ RICM ו-TIRF. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
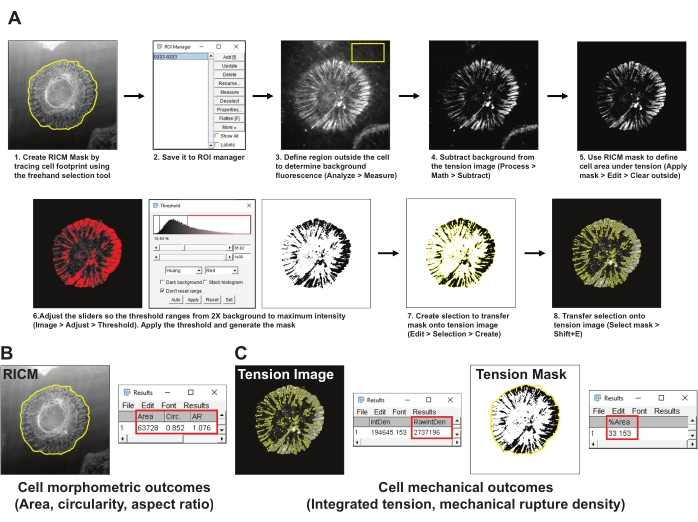
איור 4: דוגמה לעיבוד נתונים וניתוח כמותי. (A) פירוט שלב אחר שלב של צינור הניתוח המשמש בפיג'י (ImageJ) לכימות תמונת RICM ומתח. (B) דוגמה מייצגת לתוצאות מורפומריות של תאים שנותחו באמצעות הצינור הנ"ל. (C) דוגמאות מייצגות לתוצאות מכניות של תאים שנותחו באמצעות הצינור הנ"ל. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
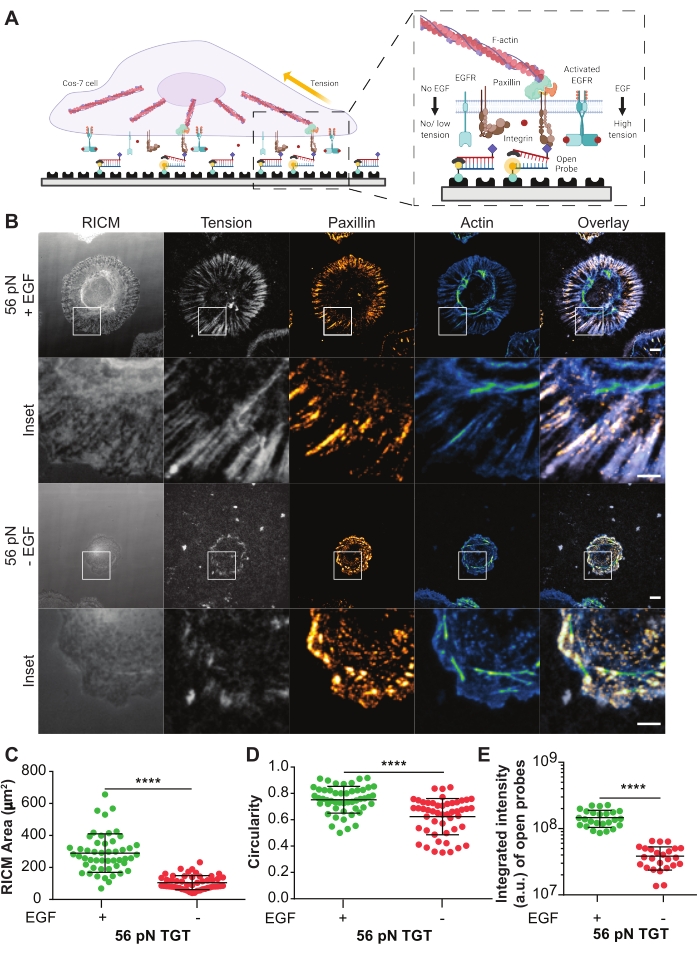
איור 5: נתונים לדוגמה מניסוי TGT. (A) דיאגרמה המדגישה את אזור המגע בממשק פני השטח של קרום התא-TGT. Inset מקרינה אינטגרין באינטראקציה עם הליגנד הקוגנטי שלה cRGDfK עם (מימין) או בלי גירוי EGF (שמאלי). (B) תמונות RICM ו-TIRF של תאי Cos-7 מתפשטות על פני השטח של 56 pN TGT. התמונות מתקבלות 60 דקות לאחר הציפוי עם או בלי גירוי EGF. תמונות RICM בודדות (כפי שנרכשו), מתח אינטגרין (גווני אפור), פקסילין (כתום חם) ו-F-אקטין (כחול-ירוק) מוצגות עם שכבות-על לשני תנאי הגירוי. סרגל קנה מידה: 10 מיקרומטר. הכניסה מדגישה ROI מוגדל (אזור עניין) המפרט את הקולוקליזציה של מתח האינטגרין שנוצר באתרים של היווצרות הידבקות המסומנים על ידי פקסילין, ואת הארגון הציטוסקטלי התת-תאי הבסיסי המסומן על ידי אקטין. סרגל קנה מידה: 5 מיקרומטר. (ג-ה) חלקות פיזור עבור אזור ההתפשטות (טביעת הרגל של תאי RICM) (C), מעגליות (D) ומתח משולב (E) עבור תאי Cos-7 עם או בלי גירוי EGF. פסים מציינים ממוצע ± s.d. ההבדלים בין הקבוצות הוערכו סטטיסטית עם מבחן ה-t של הסטודנט; עמ' < 0.0001. n = 50 תאים בשלושה ניסויים עצמאיים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
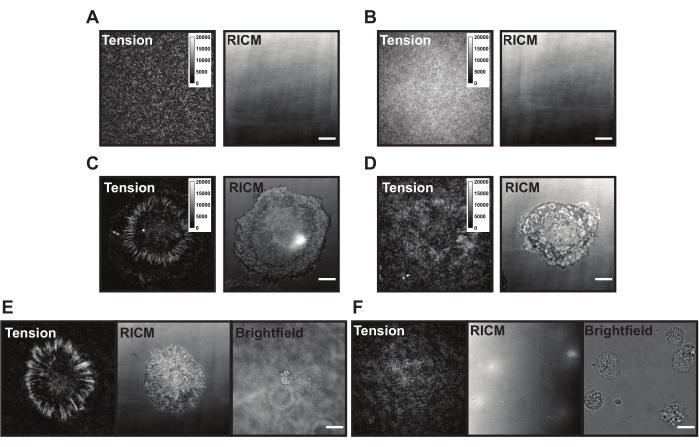
איור 6: משטחי TGT לדוגמה עם בעיות אפשריות שונות. (A) תמונות מתח ו-RICM של משטח TGT אידיאלי עם גשושית מורכבת ומרווה לפני הידבקות התא. (B) מתח ותמונות RICM של משטח TGT שבו הגשושית TGT חסרה את הגדיל העליון (quencher). תמונת מתח מראה פלואורסצנציה אחידה מפלואורופור פתוח בגדיל התחתון. (C) תמונות מתח ו-RICM לתאים המתפשטות על משטח TGT אידיאלי. (D) מתח ותמונות RICM לתאים מתפשטות על משטח TGT עשוי בצורה גרועה עם פסיבציה מוגבלת או גשושית מושפלת. (E) תמונות מתח, RICM ושדה בהיר עבור תאים המצופים על משטח אידיאלי עם ליגנד cRGDfK המציין כי אינטראקציות cRGDfK-integrin חיוניות לחיבור תאים וליצירת מתח. (F) תמונות מתח, RICM ו-brightfield עבור תאים המצופים על משטח ללא ליגנד cRGDfK ב-TGT. בעוד שהתאים נראים בתמונת השדה הבהיר, לא נצפה חיבור תאי או מתח אינטגרין שנוצר. סרגל קנה מידה: 10 מיקרומטר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
Discussion
בעזרת הפרוצדורה המפורטת שלב אחר שלב שתוארה לעיל, ניתן להכין משטחי TGT לכימות המורפולוגיה של התאים ומתח האינטגרין הנוצרים על ידי תאים דביקים במהלך חיבור התא והתפשטותם לאחר הטיפול ב-EGF. תכנון הגשושית הפשוט והסינתזה והכנת פני השטח יחד עם מערך הניסוי הפשוט סיפקו פלטפורמה יציבה לחקר האינטראקציה של EGFR ואינטגרין. באופן כללי, התוצאות מאמתות כי הפעלה תלוית ליגנד של EGFR משפרת את התפשטות התאים, מכווננת את תכונות נושאות הכוח של קולטני אינטגרין, ומקדמת את ארגון ההדבקה וההבשלה של המוקד. התוצאות המתקבלות באמצעות בדיקות TGT תומכות בהשערה הכוללת כי גורמי גדילה, כגון EGFR, פועלים כ'מארגני מכאנו', מה שמגדיל את הכמות והארגון המרחבי של מתח האינטגרין ומווסת את האוריינטציה והמכניקה של הידבקויות מוקדיות.
עם היישום על פני השטח של TGT, התאים נוחתים, מתחברים ומתפשטים כאשר קולטני האינטגרין (αVβ3) חשים ונקשרים לליגנד cRGDfK. בכך ניתן לקרוע את בדיקות ה-TGT באופן מכני, וליצור פלואורסצנציה באתר של מעורבות ליגנד. הקריאה היא "היסטוריית הכוח" המצטברת של התא המקיים אינטראקציה עם פני השטח. ישנן כמה בעיות נפוצות עם משטחי TGT שיכולים להיות נוכחים במהלך ניסויים אלה. פלואורסצנציה של רקע גבוה על פני השטח (איור 6A,B), מראה פני שטח מטושטש, כישלון של התאים ביצירת אות מתח (איור 6C,D) וכישלון של תאים להתפשט (איור 6E,F) עשויים לנבוע מחסרונות טכניים בבדיקת TGT או בסינתזת פני השטח. פתרונות לבעיות נפוצות אלה מוצגים בטבלה 1.
התכנון הפשוט של בדיקות TGT מספק לביולוגים של התא כלי רב עוצמה לחקר תוצאות איתות ספציפיות של גורמי גדילה-אינטגרין בבידוד ללא הפרעה מקולטנים אחרים על פני התא על ידי מתן ליגנדות וגירויים ספציפיים בלבד. בנוסף, בדיקות TGT מאפשרות לחקור את סף המתח המדגיש את קולטני האינטגרין הבודדים במהלך הידבקות התא ברגישות ל-pN. גישות חלופיות אינן מדווחות על כוחות המופעלים על ידי קולטנים בודדים בעלי רזולוציה מרחבית גבוהה בדגימות קבועות31. מיקרוסקופיית כוח המתיחה רגישה רק לכוחות nN, סדר גודל גבוה יותר מהכוחות המופעלים על ידי קולטני אינטגרין בודדים15, ובדיקות מתח מולקולריות מודדות כוחות pN, אך מכיוון שהן הפיכות, הן אינן עומדות בקיבוע בחוזקה. מסיבות אלה, בדיקות TGT הן כלי אטרקטיבי לחקר המכניקה של אינטראקציות גורם גדילה-אינטגרין.
ישנם מספר ניואנסים טכניים הקשורים בדיקות TGT שיש לקחת בחשבון לפני תכנון ניסוי. תמונת המתח היא תמונת מצב בזמן, המייצגת את היסטוריית הכוחות ואינה אינדיקציה למפגשי הקולטן-ליגנד בכל נקודת זמן נתונה. מאחר ויצירת האותות תלויה בהפרדת גשושיות, הפלואורסצנציה של TGT נובעת מבדיקות פתוחות שאינן נמצאות תחת מתח פעיל כתוצאה ממעורבות קולטן-ליגנד. משמעות הדבר היא שהקריאה למתח האינטגרין המתקבלת על פני השטח של TGT היא היסטורית ומצטברת באופיה ומייצגת היכן היו כוחות גדולים יותר מ-Ttol; המיקומים של כוחות הקולטן-ליגנד הנוכחיים הקטנים מ-Ttol אינם מדווחים על19,32. מאחר שקרע TGT גורם לסיום המעורבות של הקולטן-ליגנד, התפשטות התאים נובעת מאינטראקציות אינטגרין-ליגנד שחוות כוחות נמוכים יותר מ-Ttol. לפיכך, על המשתמש להיזהר בעת הגדרת הזמן שלאחר הציפוי כדי להעריך את התוצאות המכניות הקשורות להידבקויות מבוססות אינטגרין. לבסוף, יש לקחת בחשבון את המשמעות של Ttol. לגשושיות ה-TGT המועסקות כאן ישT tol של 56 pN, כאשר Ttol הוא הכוח הקבוע הדרוש כדי לקרוע 50% מהגשושיות כאשר הן מיושמות במשך 2 שניות. כאשר בוחנים מערכות ביולוגיות מסובכות, TGTs ככל הנראה חווים הדרגתיות כוח הטרוגנית ומגוונת עם תלות משתנה בזמן. אם TGTs ייקרעו על ידי כוחות גדולים יותר מ-Ttol, הפלואורסצנציה תהיה הערכת חסר של המתח הכולל. לחלופין, כוחות מתחתל-T tol המופעלים לפרקי זמן ארוכים יותר יכולים לקרוע מספר דומה של בדיקות ככוחות סף גבוהים המופעלים לתקופות קצרות יותר. שני תרחישים אלה עשויים לגרום לאותה קריאת עוצמת פלואורסצנציה, מה שמקשה על פתרון עוצמת המתח או הדינמיקה המדויקת באמצעות בדיקות TGT33,34.
באופן כללי, הערכות של מתח אינטגרין עם גירוי גורם גדילה צריכות להיעשות בזהירות על ידי תכנון ניסויים עם בקרות פנימיות, השוואת פרופילי התפשטות על משטחים אחרים המצופים מטריצה, ביצוע הערכות מקבילות של פלואורסצנציה TGT בתאים בנוכחות או בהיעדר גירוי גורם גדילה, ושימוש ב- TGTs עם Ttol שונה . TGTs מאפשרים כימות של תפקיד האיתות של גורם גדילה בוויסות המכניקה של קולטני אינטגרין, דינמיקת הידבקות מוקדית והתפשטות תאים. פרוטוקול זה יכול לשמש כתבנית לניסויים רבים מבוססי TGT באמצעות בדיקות עם Ttol שונים, ליגנדות שונות, סוגי תאים שונים או תנאי גירוי שונים. ניתן לסמן כל חלבונים בעלי עניין לאחר קיבוע, וניתן ליישם כל סוג של ניתוח תמונה כמותי. ככזה, אנו מציגים תבנית לניסויים רבים של TGT.
השימוש בבדיקות TGT אינו מוגבל לחקר האינטגרינים, אלא ניתן להרחיב אותו למגוון רחב של קולטני קרום תאים על פני סוגי תאים שונים על ידי שינוי הליגנד. בדיקות TGT שימשו לחקר תפקידם של כוחות בוויסות מפלים שונים של איתות קולטנים, כולל זיהוי התפקיד המכני של מכניקת קולטני Notch בהתפתחות עוברית ונוירוגנזה35, הכוחות המתווכים זיהוי והפנמה של אנטיגנים על ידי קולטני תאי B36, ויכולת קריאת ההוכחה המכנית של קולטני פני השטח של תאי T כדי לזהות שינויים בכוחות להגברת העוצמה והספציפיות של העברת האות37 . יחד, ממצאים אלה מדגישים את הפוטנציאל העצום של בדיקות TGT במגוון מסגרות ניסוי.
Disclosures
המחברים מצהירים על היעדר ניגודי עניינים.
Acknowledgements
המחברים מבקשים להכיר את חברי המעבדה של מתייס לדיונים ולביקורות פוריים. אנו מכירים במימון ל- A.L.M. מ- NSF CAREER 1832100 ו- NIH R01GM131099.
Materials
| Name | Company | Catalog Number | Comments |
| (3-Aminopropyl)triethoxysilane | Millipore Sigma | 440140 | Surface Preparation |
| 3-hydroxypicolinic acid (3-HPA) | Millipore Sigma | 56197 | Maldi-TOF-MS matrix |
| Acetic Acid, Glacial | Fisher Scientific | A38S | Diluting EGF |
| Acetonitrile (HPLC) | Fisher Scientific | A998SK | Oligonucleotide Preparation |
| Alexa Fluor 488 Phalloidin | Cell Signaling Technology | 8878S | Immunocytochemistry |
| Ammonium Chloride | Fisher Scientific | A687 | Immunocytochemistry |
| Anti-Paxillin antibody [Y113] | Abcam | ab32084 | Immunocytochemistry |
| BD Syringes only with Luer-Lok | BD bioscience | 309657 | Surface Preparation |
| Bio-Gel P-2 | Bio-Rad | 1504118 | Oligonucleotide Preparation |
| Bovine Serum Albumin (BSA) Protease-free Powder | Fisher Scientific | BP9703100 | Surface Preparation |
| Cos-7 cells | ATCC | CRL-1651 | Cell Culture, Passage numbers 11-20 |
| Coverslip Mini-Rack, for 8 coverslips | Fisher Scientific | C14784 | Surface Preparation |
| c(RGDfK(PEG-PEG)), PEG=8-amino-3,6-dioxaoctanoic acid | Vivitide | PCI-3696-PI | Oligonucleotide Preparation |
| Cy3B NHS ester | GE Healthcare | PA63101 | Oligonucleotide Preparation |
| Dimethylformamide | Millipore Sigma | PHR1553 | Oligonucleotide Preparation |
| DMEM with L-Glutamine, 4.5g/L Glucose and Sodium Pyruvate | Fisher Scientific | MT10013C | Cell Culture |
| Epidermal Growth Factor human EGF | Millipore Sigma | E9644 | Cell Culture |
| Ethanol, 200 proof (100%) | Fisher Scientific | 22032601 | Surface Preparation |
| Falcon Standard Tissue Culture Dishes | Fisher Scientific | 08-772E | Surface Preparation |
| Fetal Bovine Serum | Fisher Scientific | 10-438-026 | Cell Culture |
| Flurobrite DMEM | Fisher Scientific | A1896701 | Cell Culture |
| Goat anti-Rabbit IgG (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor 647 | Invitrogen | A-21244 | Immunocytochemistry |
| Goat Serum | Fisher Scientific | 16-210-064 | Immunocytochemistry |
| Hank’s balanced salts (HBSS) | Fisher Scientific | 14-170-161 | Cell Culture |
| Horse Serum | Fisher Scientific | 16050130 | Immunocytochemistry |
| Hydrogen Peroxide | Fisher Scientific | H325-500 | Surface Preparation |
| Nanosep MF centrifugal devices | Pall laboratory | ODM02C35 | Oligonucleotide Preparation |
| NHS-azide | Fisher Scientific | 88902 | Oligonucleotide Preparation |
| Nitrogen Gas Cylinder | Airgas | Surface Preparation | |
| No. 2 round glass coverslips - 25 mm | VWR | 48382-085 | Surface Preparation |
| Parafilm M Laboratory Film | Fisher Scientific | 13-374-10 | Surface Preparation |
| Paraformaldehyde 16% | Fisher Scientific | 50-980-487 | Immunocytochemistry |
| PBS, 1X | Fisher Scientific | 21-030-CV | Surface Preparation/Immunocytochemistry |
| Penicillin-Streptomycin (5,000 U/mL) | Fisher Scientific | 15-070-063 | Cell Culture |
| PYREX Low Form Griffin Beakers | Fisher Scientific | 02-540G | Surface Preparation |
| Sodium Ascorbate | Fisher Scientific | 18-606-310 | Oligonucleotide Preparation |
| Sodium Bicarbonate | Fisher Scientific | S233 | Oligonucleotide Preparation |
| Sodium Chloride | Fisher Scientific | BP358 | Surface Preparation |
| Streptavidin | Fisher Scientific | 434301 | Surface Preparation |
| Sulfo-NHS-LC-Biotin | Fisher Scientific | 21335 | Surface Preparation |
| Sulfuric Acid | Fisher Scientific | A300-500 | Surface Preparation |
| TEAA | Fisher Scientific | NC0322726 | Oligonucleotide Preparation |
| Triethylamine | Millipore Sigma | 471283 | Oligonucleotide Preparation |
| Trifluoroacetic Acid (TFA) | Fisher Scientific | PI28901 | Oligonucleotide Preparation |
| THPTA | Fisher Scientific | NC1296293 | Oligonucleotide Preparation |
| Triton X 100 Detergent Surfact Ams Solution | Fisher Scientific | 85111 | Immunocytochemistry |
| Water, DNA Grade, DNASE, Protease free | Fisher Scientific | BP24701 | Oligonucleotide Preparation |
| Equipment | |||
| Agilent AdvanceBio Oligonucleotide C18 column, 4.6 x 150 mm, 2.7 μm | Agilent | 653950-702 | Oligonucleotide Preparation |
| High-performance liquid chromatography | Agilent | 1100 | Oligonucleotide Preparation |
| Low Speed Orbital Shaker | Fisher Scientific | 10-320-813 | Immunocytochemistry |
| Matrix-assisted laser desorption/ ionization time-of-flight mass spectrometer (MALDI-TOF-MS) | Voyager STR | Oligonucleotide Preparation | |
| Molecular Probes Attofluor Cell Chamber | Fisher Scientific | A7816 | Surface Preparation |
| Nanodrop 2000 UV-Vis Spectrophotometer | Thermo Fisher | Oligonucleotide Preparation | |
| Nikon Eclipse Ti inverted microscope | pe Nikon | Microscopy | |
| Nikon Perfect Focus System | Nikon | Microscopy | |
| NIS Elements software | Nikon | Microscopy | |
| ORCA-Flash4.0 V3 Digital CMOS camera | Hamamatsu | Microscopy | |
| Quad band TIRF 405/488/561/647 cube | CHROMA | Microscopy | |
| RICM Cube | CHROMA | Microscopy | |
| SOLA v-nIR Light Engine | Lumencor | Microscopy | |
| Thermo Forma Steri Cycle 370 CO2 Incubator | Fisher Scientific | Cell Culture | |
| VWR 75D Ultrasonic Cleaner | VWR | 13710 | Surface Preparation |
| Data Analysis | Use | ||
| Fiji (Image J) | https://imagej.net/software/fiji/downloads | Quantitative Analysis | |
| Graph Pad Prism | Graph Pad | Statistical Analysis | |
| Oligo name | 5'modification/ 3' modification | Sequence (5' to 3') | Use |
| Alkyne-21-BHQ2 | 5' Hexynyl/ 3' BHQ_2 | GTGAAATACCGCACAGATGCG | Top strand TGT probe |
| 56 pN TGT | 5' Biosg/TTTTTT/iUniAmM | CGCATCTGTGCGGTATTTCACTTT | Bottom strand TGT probe |
| 12 pN TGT | 5' AmMC6/ 3' BioTEG | CGCATCTGTGCGGTATTTCACTTT | Bottom strand TGT probe |
References
- Lim, C. -. G., Jang, J., Kim, C. Cellular machinery for sensing mechanical force. BMB Reports. 51 (12), 623-629 (2018).
- Moraes, C., Sun, Y., Simmons, C. A. (Micro)managing the mechanical microenvironment. Integrative Biology. 3 (10), 959-971 (2011).
- Vogel, V., Sheetz, M. P. Mechanical forces matter in health and disease. From Cancer to Tissue Engineering. Nanotechnology. , 233-303 (2010).
- Wang, J. H. C., Li, B. Mechanics rules cell biology. BMC Sports Science, Medicine and Rehabilitation. 2 (1), 16 (2010).
- Moeendarbary, E., Harris, A. R. Cell mechanics: principles, practices, and prospects. Wiley Interdisciplinary Reviews: Systems Biology and Medicine. 6 (5), 371-388 (2014).
- Streuli, C. H., Akhtar, N. Signal co-operation between integrins and other receptor systems. Biochemical Journal. 418 (3), 491-506 (2009).
- Chiasson-MacKenzie, C., McClatchey, A. I. EGFR-induced cytoskeletal changes drive complex cell behaviors: The tip of the iceberg. Science Signaling. 11 (515), (2018).
- Kechagia, J. Z., Ivaska, J., Roca-Cusachs, P. Integrins as biomechanical sensors of the microenvironment. Nature Reviews Molecular Cell Biology. 20 (8), 457-473 (2019).
- De Luca, A., et al. The role of the EGFR signaling in tumor microenvironment. Journal of Cellular Physiology. 214 (3), 559-567 (2008).
- Javadi, S., Zhiani, M., Mousavi, M. A., Fathi, M. Crosstalk between Epidermal Growth Factor Receptors (EGFR) and integrins in resistance to EGFR tyrosine kinase inhibitors (TKIs) in solid tumors. European Journal of Cell Biology. 99 (4), 151083 (2020).
- Eliceiri, B. P. Integrin and growth factor receptor crosstalk. Circulation Research. 89 (12), 1104-1110 (2001).
- Dan, L., Jian, D., Na, L., Xiaozhong, W. Crosstalk between EGFR and integrin affects invasion and proliferation of gastric cancer cell line, SGC7901. OncoTargets and Therapy. 5, 271-277 (2012).
- Giancotti, F. G., Tarone, G. Positional control of cell fate through joint integrin/receptor protein kinase signaling. Annual Reviews: Cell and Developmental Biology. 19, 173-206 (2003).
- Ricono, J. M., et al. Specific cross-talk between epidermal growth factor receptor and integrin alphavbeta5 promotes carcinoma cell invasion and metastasis. Cancer Research. 69 (4), 1383-1391 (2009).
- Polacheck, W. J., Chen, C. S. Measuring cell-generated forces: a guide to the available tools. Nature Methods. 13 (5), 415-423 (2016).
- Hang, X., et al. Nanosensors for single cell mechanical interrogation. Biosensors and Bioelectronics. 179, 113086 (2021).
- Style, R. W., et al. Traction force microscopy in physics and biology. Soft Matter. 10 (23), 4047-4055 (2014).
- Schoen, I., Hu, W., Klotzsch, E., Vogel, V. Probing cellular traction forces by micropillar arrays: contribution of substrate warping to pillar deflection. Nano Letters. 10 (5), 1823-1830 (2010).
- Ma, V. P. -. Y., Salaita, K. DNA Nanotechnology as an Emerging Tool to Study Mechanotransduction in Living Systems. Small. 15 (26), 1900961 (2019).
- Kim, Y., Kim, K. A., Kim, B. C. Double-stranded DNA force sensors to study the molecular level forces required to activate signaling pathways. Journal of the Korean Physical Society. 78 (5), 386-392 (2021).
- Rao, T. C., et al. EGFR activation attenuates the mechanical threshold for integrin tension and focal adhesion formation. Journal of Cell Sciences. 133 (13), (2020).
- Zhang, Y., Ge, C., Zhu, C., Salaita, K. DNA-based digital tension probes reveal integrin forces during early cell adhesion. Nature Communications. 5, 5167 (2014).
- Liu, Y., et al. DNA-based nanoparticle tension sensors reveal that T-cell receptors transmit defined pN forces to their antigens for enhanced fidelity. Proceedings of the National Academy of Sciences of the United States of America. 113 (20), 5610-5615 (2016).
- Zhang, Y., et al. Platelet integrins exhibit anisotropic mechanosensing and harness piconewton forces to mediate platelet aggregation. Proceedings of the National Academy of Sciences of the United States of America. 115 (2), 325-330 (2018).
- Ma, V. P. -. Y., et al. Mechanically induced catalytic amplification reaction for readout of receptor-mediated cellular forces. Angewandte Chemie International Edition. 55 (18), 5488-5492 (2016).
- Wang, X., Ha, T. Defining single molecular forces required to activate integrin and notch signaling. Science. 340 (6135), 991-994 (2013).
- Chen, Y., Lee, H., Tong, H., Schwartz, M., Zhu, C. Force regulated conformational change of integrin αVβ3. Matrix Biology. 60-61, 70-85 (2017).
- Kantlehner, M., et al. Surface coating with cyclic RGD peptides stimulates osteoblast adhesion and proliferation as well as bone formation. ChemBioChem. 1 (2), 107-114 (2000).
- Kapp, T. G., et al. A comprehensive evaluation of the activity and selectivity profile of ligands for RGD-binding integrins. Scientific Reports. 7, 39805 (2017).
- Kok, R. J., et al. Preparation and functional evaluation of RGD-modified proteins as alpha(v)beta(3) integrin directed therapeutics. Bioconjugate Chemistry. 13 (3), 128-135 (2002).
- Li, I. T. S., Ha, T., Chemla, Y. R. Mapping cell surface adhesion by rotation tracking and adhesion footprinting. Scientific Reports. 7 (1), 44502 (2017).
- Wang, Y., et al. Force-activatable biosensor enables single platelet force mapping directly by fluorescence imaging. Biosensors and Bioelectronics. 100, 192-200 (2018).
- Murad, Y., Li, I. T. S. Quantifying molecular forces with serially connected force sensors. Biophysical Journal. 116 (7), 1282-1291 (2019).
- Yasunaga, A., Murad, Y., Li, I. T. S. Quantifying molecular tension-classifications, interpretations and limitations of force sensors. Physical Biology. 17 (1), 011001 (2019).
- Luca, V. C., et al. Notch-Jagged complex structure implicates a catch bond in tuning ligand sensitivity. Science. 355 (6331), 1320-1324 (2017).
- Spillane, K. M., Tolar, P. B cell antigen extraction is regulated by physical properties of antigen-presenting cells. The Journal of Cell Biology. 216 (1), 217-230 (2017).
- Brockman, J. M., Salaita, K. Mechanical proofreading: a general mechanism to enhance the fidelity of information transfer between cells. Frontiers in Physics. 7, 14 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved