A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מודל אמין של דש פאסיו-עורי חזירי למחקרי ביו-הנדסה של אלוגרפטים מרוכבים מרוכבים בכלי דם
In This Article
Summary
הפרוטוקול הנוכחי מתאר את מודל הדש החיתו-עורי החזירי ואת השימוש הפוטנציאלי בו במחקר רקמות מרוכבות וסקולריות.
Abstract
Allografts מרוכבים וסקולריים (VCA) כגון השתלת יד, פנים או פין מייצגים את הטיפול החדשני לפגמים הרסניים בעור, שנכשל בצעדים הראשונים של הסולם המשחזר. למרות התוצאות האסתטיות והתפקודיות המבטיחות, הגורם המגביל העיקרי נותר הצורך בדיכוי חיסוני המיושם באופן דרסטי לכל החיים והסיכונים הרפואיים הידועים שלו, המונעים אינדיקציות רחבות יותר. לכן, הרמת המחסום החיסוני ב-VCA חיונית כדי להטות את הכף האתית ולשפר את איכות החיים של המטופלים באמצעות הטכניקות הכירורגיות המתקדמות ביותר. יצירת דה נובו של שתל ספציפי למטופל היא פריצת הדרך הקרובה בהשתלה משחזרת. באמצעות טכניקות של הנדסת רקמות, ניתן לשחרר VCAs מתאים תורמים ולהתאים אותם אישית עבור המקבל באמצעות פרפוזיה-דה-סלולריזציה-רצלולריזציה. כדי לפתח את הטכנולוגיות החדשות הללו, יש צורך במודל VCA של בעלי חיים בקנה מידה גדול. לפיכך, דשים עוריים-חזיריים, המורכבים מעור, שומן, חיתולית וכלי דם, מייצגים מודל אידיאלי למחקרים ראשוניים ב- VCA. עם זאת, רוב דגמי VCA המתוארים בספרות כוללים שריר ועצמות. עבודה זו מדווחת על טכניקה אמינה וניתנת לשחזור עבור בציר דשים עוריים-עוריים בחזירים, כלי מעשי לתחומי מחקר שונים, במיוחד הנדסת רקמות מרוכבות וסקולריות.
Introduction
אלוגרפטים מרוכבים של כלי דם (VCA) חוללו מהפכה בטיפול באובדן חלקי גוף קשים לתיקון, כגון ידיים, פנים ופין 1,2,3. למרבה הצער, התוצאות ארוכות הטווח הראשונות4 הראו כי מתן לכל החיים של חומרים מדכאי חיסון במינון גבוה יכול להוביל למצבים רפואיים נלווים חמורים, כולל סוכרת, זיהומים, ניאופלזיהותפקוד לקוי של כלי הדם 5. לאחרונה, צוותי VCA מומחים נאלצו לנהל את הסיכון לדחייה כרונית המובילה לאובדן שתלים ולבצע את המקרים הראשונים של השתלת פנים 6,7. אסטרטגיות שונות תוארו כדי להתגבר על המגבלות של דיכוי חיסוני ב- VCA. הראשון מסתמך על ביסוס סבילות השתל לטווח ארוך על ידי גרימת מצב כימריזם מעורב חיסוני במקבל אלוגרפט 8,9. השנייה כוללת יצירת דה נובו של שתל ספציפי למטופל באמצעות הנדסת רקמות.
לאחרונה, דה-סלוליזציה של פרפוזיה של רקמות ביולוגיות יצרה פיגומי מטריצה חוץ-תאית מקומית (ECM), מה שמאפשר שימור של רשת כלי הדם וארכיטקטורת הרקמות של איברים שלמים10. לפיכך, ה-recellularization של ECM אלה עם תאים ספציפיים למקבל תיצור שתל מותאם אישית ללא אילוצים חיסוניים. במחקר על ביו-הנדסה של VCA, צוותים מרובים ביצעו דה-סלולריות והשיגו ECM כזה תוך שמירה על הארכיטקטורה כולה11,12,13. עם זאת, תהליך ה-recellularization נותר מאתגר ולא הצליח במודלים של בעלי חיים גדולים14,15. פיתוח טכנולוגיות פורצות דרך אלה יוצר צורך במודלים אמינים וניתנים לשחזור של רקמות מרוכבות גדולות של בעלי חיים. מודלים של חזירים מייצגים את הבחירה המרבית בצנרת ההתפתחותית הביו-הנדסית, שכן עור חזירי מציג את המאפיינים האנטומיים והפיזיולוגיים הקרובים ביותר לעור האדם16. השימוש בדשים עוריים-עוריים (FCF) הוא אידיאלי בצעדים הראשונים לקראת יצירת שתלי רקמה מרוכבים 'מותאמים'. ואכן, FCF הוא מודל VCA יסודי המכיל תאי עור, שומן, פאשיה ואנדותל. תיאור של דשים מעוריים חזירים17 ודשים אוסטאומיו-עוריים18 ניתן למצוא בספרות. עם זאת, קיים חוסר התמקדות בטכניקות קצירת דשים עוריים-עוריים.
לפיכך, מחקר זה נועד לספק לחוקרים תיאור מפורט של טכניקת רכש FCF של חזירים ולתאר את כל מאפייני הדש לשימוש בו בתחומי מחקר רבים, במיוחד בהנדסת רקמות מרוכבות וסקולריות.
Protocol
כל בעלי החיים קיבלו טיפול אנושי בעקבות מדריך המכון הלאומי לבריאות לטיפול ושימוש בחיות מעבדה. הוועדה המוסדית לטיפול ושימוש בבעלי חיים אישרה את פרוטוקול הניסוי (IACUC- פרוטוקול #2020N000015). שבע נקבות חזירי יורקשייר (20-25 ק"ג) שימשו לכל הניסויים.
1. טיפול טרום ניתוחי
- מהר את החיה למזון מוצק 12 שעות לפני הניתוח.
- הרגיעו את החיה עם 4.4 מ"ג/ק"ג של טלזול, 2.2 מ"ג/ק"ג של קסילזין ו-0.04 מ"ג/ק"ג (IM) של אטרופין סולפט (ראו טבלת חומרים).
- יש להניח קטטר תוך ורידי היקפי של 18 גרם בווריד האוזן.
- אינטובציה החזירים עם צינור endotracheal מתאים (6-15 מ"מ ניתן להשתמש עבור 10-200 ק"ג חזירים) ולחבר את הצינור למכונת הנשמה. מתן משככי כאבים טרום ניתוחיים עם בופרנורפין (0.05 מ"ג/ק"ג, IM) (ראה טבלת חומרים).
2. ניטור תוך ניתוחי
- שמרו על הרדמה עם תערובת אינהלציה של 1.5%-3% איזופלורן עם זרימת חמצן של 1.5 ליטר לדקה.
- נטר באופן רציף את קצב הלב, את אוקסימטריית הדופק ואת ה-CO2 של סוף הגאות והשפל. הערך את לחץ הדם ואת טמפרטורת הגוף כל 5 דקות.
הערה: טווח היעד לדופק הוא בין 90-100 פעימות לדקה, ריווי החמצן חייב להיות גבוה מ-93%, וטווח ה-CO 2 הסופי הוא בין 5%-6% מ-CO2. - מתן 5-10 מ"ל / ק"ג לשעה 0.9% מלוחים לאורך כל ההליך כדי לווסת את הלחץ העורקי הממוצע בין 60 מ"מ כספית ל 90 מ"מ כספית.
3. רכש FCF ספנוסי דו-צדדי
- מניחים את החיה בתנוחת שכיבה. מגלחים ומשפשפים גם את המפשעות וגם את הגפיים האחוריות, כוללים את כל האחוריים באתר הניתוחי, ומרופטים בצורה סטרילית.
- למשש את הדופק של העורק הספנוס ~ 3 רוחב אצבעות מדיאלי מן הפטלה ולתייג אותו.
- לזהות ולשרטט את גבולות הדש.
הערה: הגבול העליון הוא ציר מקביל לקמט המפשעה 3 ס"מ מתחתיו. הגבול הצדדי הוא ציר מעמוד השדרה האיליאק העליון הקדמי לחלק המדיאלי של הפטלה. - ציירו דש דמוי אליפסה בקוטר 10 ס"מ שבמרכזו הפדיקל הספנוס וכלול בגבולות הדש שתוארו קודם לכן (שלב 3.3).
- בצע חתך בעור באורך 1.5 ס"מ לגבי החלק הדיסטלי של הפדיקל על דופן הדש.
- פתח את החיתולית ואת החתך הבוטה כדי לחשוף את העורק הספנוס ואת שני הוורידים שלו. ביצוע ליגטורה כפולה והפרדה בחבילה אחת.
- חותכים את העור הנותר של הדש עם להב.
- השתמש cautery כדי לפתוח את הרקמה התת עורית ואת החיתולית שמסביב. בצע המוסטזיס יסודי באמצעות מלקחיים דו קוטביים (ראה טבלת חומרים).
- חברו את מרכיב העור של הדש לחזית הבסיסית עם 3-0 תפרים שאינם נספגים כדי למנוע מתיחה לא מכוונת והפרעה של כלי ניקוב.
- שחררו את הדש מהגרסיליס על ידי ניתוח החיתולית הרחק מהשריר.
הערה: החלק הדיסטלי של הפדיקל הספנוס עובר במישור שבין שריר הגראסיליס לבין החיתולית. מתח מתאים והמוסטזיס דו קוטבי זהיר של ענפי צד הם מרכיבים חיוניים כדי להקל על דיסקציה pedicle. - השתמש באזמל כדי לבצע חתך של 12 ס"מ בקמט המפשעתי. בצע חתך ניצב המחבר את הקמט המפשעה לחלק הפרוקסימלי של הדש. הרימו את העור המחבר ופתחו את השכבה התת עורית באמצעות צריבה.
- המשך את נתיחת הפדיקל על ידי מעקב אחר כלי הדם הספנוסים כלפי מטה לכיוון כלי הירך.
הערה: החלק הפרוקסימלי של הפדיקל הספנוס יכול לעבור דרך המחיצה הבין-שרירית או לצלול לתוך שריר הגראסיליס. - שלד את כלי הירך ומעביר אותם באופן דיסטלי לענף הספנוס בשתי צרורות נפרדים. המשך את כריתת כלי הירך מדיסטלי לפרוקסימלי עד להגעה לרמה של הרצועה המפשעתית. השתמש מלקחיים דו קוטביים כדי לצרוב או קליפסים וסקולריים ו 2-0 קשרי משי כדי ligate את כלי הירך העמוקים, ולאחר מכן לחתוך.
הערה: ניתן להשתמש גם בקליפסים של כלי הדם לפני חיתוך כלי הדם. - חזור על שלבים 3.2-3.13 על האחורית הנגדית כדי לקצור את הדש הספנוס השני.
- הפריניזציה של בעל החיים עם הזרקת הפרין תוך ורידית (100 IU/kg) 5 דקות לפני שלב 3.16.
- ליגייט פדיקל הירך (עורק ווריד) פרוקסימלי ככל האפשר לרצועה המפשעתית ולהפריד את הדש מהחזיר התורם.
- להרחיב את קצוות כלי הירך ולהכניס 20 גרם אנגיוקטטר הן בעורק והן בווריד. השתמש 3-0 עניבות משי כדי להדק את הקטטר לכלי.
- שטפו באיטיות את עורק הדש החיתו-עורי עם 10 מ"ל של תמיסת הפרין (100 IU/mL) עד לצפייה בזרימה ורידית ברורה (איור 1).
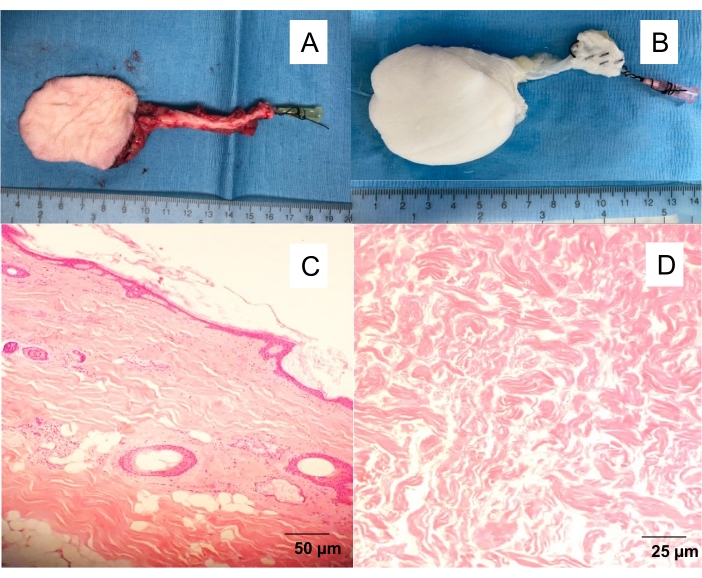
איור 1: דש פאסיו-עורי צפניואי מקומי ודה-תאי . (A) דש עור מבודד עם אנגיוקטטר של 20 גרם המוחדר לעורק הירך, ומאפשר לשטוף את הדש מהדם ולהמשיך בניסויים שונים (אנגיוגרפיה, דה-סלוליזציה של פרפוזיה). (B) דש עור נטול תאים. דה-סלוליזציה של פרפוזיה מניבה פיגומים לבנים וא-תאיים לאחר 10 ימים של זליגת חומרי ניקוי. חתכים מוכתמים בעובי מלא של (C) דש עור מקומי ו-(D) דש עור נטול תאים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
- להרדים את החיה עם הזרקת IV של נתרן phenobarbital (100 מ"ג / ק"ג). אשר מוות על ידי היעדר פעימות לב ותנועות נשימה.
תוצאות
לעבודה הזו על בעלי חיים קדמה קביעת ה-saphenous perforasome על שלוש דגימות קדבוריות (איור 2). תמיסת מילוי צבעונית הוזרקה לעורק הספנוס כדי להרגיע את רשת כלי הדם הספציפית המגיעה מהעורק. התמיסה מורכבת מ-10 מ"ל סוכן גליצרין בצבע כחול מעורבב עם 10 מ"ל של החומר המדולל (ראו טבלת חומרים). ?...
Discussion
מאמר זה מתאר דש חית-עורי אמין וניתן לשחזור שנקצר על אחורי חזירים. ביצוע פרוטוקול כירורגי שלב אחר שלב זה יאפשר רכישה של שני דשים על בעל חיים אחד בלבד בפחות משעתיים. השלב הקריטי ביותר של הניתוח הוא השלד של פדיקל כלי הדם בתוך סיבי השריר gracilis, אשר דורש דיסקציה יסודית על ידי מנתח מיומן. הצמדת העור...
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
עבודה זו מומנה על ידי מענקי בתי חולים לילדים #85127 (BEU ו- CLC) ו- #84702 (AA). המחברים מבקשים להודות לקרן "Gueules Cassées" על התמיכה בשכר לעמיתים המעורבים בפרויקט.
Materials
| Name | Company | Catalog Number | Comments |
| 18 G angiocatheter | BD Insyte Autoguard | 381409 | |
| 20 G angiocatheter | BD Insyte Autoguard | 381411 | |
| Adson Tissue Forceps, 11 cm, 1 x 2 Teeth with Tying Platform | ASSI | ASSI.ATK26426 | |
| Atropine Sulfate | AdvaCare | 212-868 | |
| Bipolar cords | ASSI | 228000C | |
| Buprenorphine HCl | Pharmaceutical, Inc | 42023-179-01 | |
| Dilating Forceps | Fine science tools (FST) | 18131-12 | |
| Endotrachel tube | Jorgensen Labs | JO615X | size from 6 to 15mm depending on the pig weight |
| Ethilon 3-0 16 mm 3/8 | Ethicon | MPVCP683H | |
| Euthasol | Virbac AH | 200-071 | |
| Heparin Lock Flush Solution, USP, 100 units/mL | BD PosiFlush | 306424 | |
| Isoflurane | Patterson Veterinary | 14043-704-06 | |
| Jewelers Bipolar Forceps Non Stick 11 cm, straight pointed tip, 0.25 mm tip diameter | ASSI | ASSI.BPNS11223 | |
| Metzenbaum scissors 180 mm | B Braun | BC606R | |
| Microfil blue | Flow tech | LMV-120 | |
| Microfil dilution | Flow tech | LMV-112 | colored filing solution |
| Monopolar knife | ASSI | 221230C | |
| N°15 scalpel blade | Swann Morton | NS11 | |
| Omnipaque | General Electric | 4080358 | contrast product |
| Perma-Hand Silk 3-0 | Ethicon | A184H | |
| Small Ligaclip | Ethicon | MCM20 | |
| Stevens scissors 115 mm | B Braun | BC008R | |
| Telazol | Zoetis | 106-111 | |
| Xylamed (xylazine) | Bimeda | 200-529 |
References
- Dubernard, J. M., et al. Human hand allograft: Report on first 6 months. The Lancet. 353 (9161), 1315-1320 (1999).
- Meningaud, J. P., et al. Procurement of total human face graft for allotransplantation: A preclinical study and the first clinical case. Plastic and Reconstructive Surgery. 126 (4), 1181-1190 (2010).
- Cetrulo, C. L., et al. Penis transplantation: First US experience. Annals of Surgery. 267 (5), 983-988 (2018).
- Lantieri, L., et al. Face transplant: Long-term follow-up and results of a prospective open study. Lancet. 388 (10052), 1398-1407 (2016).
- Derek, E., Dhanireddy, K. Immunosuppression. Current Opinion in Organ Transplantation. 17 (6), 616-618 (2012).
- Lantieri, L., et al. First human facial retransplantation: 30-month follow-up. Lancet. 396 (10264), 1758-1765 (2020).
- Kauke, M., et al. Full facial retransplantation in a female patient-Technical, immunologic, and clinical considerations. American Journal of Transplantation. 21 (10), 3472-3480 (2021).
- Leonard, D. A., et al. Vascularized composite allograft tolerance across MHC barriers in a large animal model. American Journal of Transplantation. 14 (2), 343-355 (2014).
- Kawai, T., et al. HLA-mismatched renal transplantation without maintenance immunosuppression. The New England Journal of Medicine. 368 (19), 1850-1852 (2013).
- Badylak, S. F., Taylor, D., Uygun, K. Whole-organ tissue engineering: Decellularization and recellularization of three-dimensional matrix scaffolds. Annual Review of Biomedical Engineering. 13, 27-53 (2011).
- Jank, B. J., et al. Creation of a bioengineered skin flap scaffold with a perfusable vascular pedicle. Tissue Engineering Part A. 23 (13-14), 696-707 (2017).
- Jank, B. J., et al. Engineered composite tissue as a bioartificial limb graft. Biomaterials. 61, 246-256 (2015).
- Duisit, J., et al. Decellularization of the porcine ear generates a biocompatible, nonimmunogenic extracellular matrix platform for face subunit bioengineering. Annals of Surgery. 267 (6), 1191-1201 (2018).
- Lupon, E., et al. Engineering Vascularized composite allografts using natural scaffolds: A systematic review. Tissue Engineering Part B: Reviews. , (2021).
- Duisit, J., Maistriaux, L., Bertheuil, N., Lellouch, A. G. Engineering vascularized composite tissues by perfusion decellularization/recellularization: Review. Current Transplantation Reports. 8, 44-56 (2021).
- Sullivan, T. P., Eaglstein, W. H., Davis, S. C., Mertz, P. The pig as a model for human wound healing. Wound Repair and Regeneration: Official Publication of the Wound Healing Society [and] the European Tissue Repair Society. 9 (2), 66-76 (2001).
- Haughey, B. H., Panje, W. R. A porcine model for multiple musculocutaneous flaps. The Laryngoscope. 99 (2), 204-212 (1989).
- Ibrahim, Z., et al. A modified heterotopic swine hind limb transplant model for translational vascularized composite allotransplantation (VCA) research. Journal of Visualized Experiments. (80), e50475 (2013).
- Rosh, E. H., Vistnes, L. M., Ksander, G. A. The panniculus carnosus in the domestic pic. Plastic and Reconstructive Surgery. 59 (1), 94-97 (1977).
- Alessa, M. A., et al. Porcine as a training module for head and neck microvascular reconstruction. Journal of Visualized Experiments. (139), e58104 (2018).
- Minqiang, X., Jie, L., Dali, M., Lanhua, M. Transmidline abdominal skin flap model in pig: Refinements and advancements. Journal of Reconstructive Microsurgery. 28 (02), 111-118 (2012).
- Bodin, F., et al. Porcine model for free-flap breast reconstruction training. Journal of Plastic, Reconstructive & Aesthetic Surgery. 68 (10), 1402-1409 (2015).
- Kadono, K., Gruszynski, M., Azari, K., Kupiec-Weglinski, J. W. Vascularized composite allotransplantation versus solid organ transplantation: Innate-adaptive immune interphase. Current Opinion in Organ Transplantation. 24 (6), 714-720 (2019).
- Kruit, A. S., et al. Rectus Abdominis flap replantation after 18 h hypothermic extracorporeal perfusion-A Porcine Model. Journal of Clinical Medicine. 10 (17), 3858 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved