A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
כלים מיקרופלואידיים לחקר אינטראקציות פטרייתיות-מיקרוביאליות ברמה התאית
In This Article
Summary
בשל האטימות של האדמה, לא ניתן לדמיין בקלות אינטראקציות בין המיקרובים המרכיבים אותה עם רזולוציה תאית. כאן מוצגים שני כלים מיקרופלואידיים, המציעים הזדמנויות חדשות לחקר אינטראקציות פטרייתיות-מיקרוביאליות. המכשירים הם רב-תכליתיים ופשוטים לשימוש, ומאפשרים שליטה מרחבית-טמפורלית גבוהה והדמיה ברזולוציה גבוהה ברמה התאית.
Abstract
פטריות נימה הן תושבות מוצלחות של הקרקע וממלאות תפקיד מרכזי במערכות אקולוגיות בקרקע, כגון בפירוק חומר אורגני ואנאורגני, כמו גם בוויסות רמות חומרי ההזנה. שם הם גם מוצאים הזדמנויות רבות לקיים אינטראקציה עם מגוון של מיקרובים אחרים כגון חיידקים או פטריות אחרות. עם זאת, חקר אינטראקציות פטרייתיות ברמה התאית יכול להיות מאתגר בשל האופי דמוי הקופסה השחורה של האדמה. כלים מיקרופלואידיים חדשים מפותחים לחקר אינטראקציות פטרייתיות; מודגשות שתי פלטפורמות שנועדו לחקור אינטראקציות חיידקיות-פטרייתיות ופטרייתיות-פטרייתיות. בתוך מיקרו-ערוצים אלה, ניתן לנטר אינטראקציות פטרייתיות-מיקרוביאליות בסביבות פיסיקליות-כימיות מבוקרות ברזולוציה טמפורלית ומרחבית גבוהה יותר ממה שהיה אפשרי בעבר. היישום של כלים אלה הניב תובנות ביולוגיות חדשניות רבות, כגון תצפית על התקשרות קוטבית חיידקית להיפאים או חשיפת אנטגוניזמים פטרייתיים-פטרייתיים לא אופייניים. מאפיין מרכזי של מתודולוגיות אלה מתייחס לקלות השימוש בכלי זה על ידי אנשים שאינם מומחים, מה שמניב טכנולוגיות הניתנות לתרגום גבוה לשימוש במעבדות מיקרוביולוגיה.
Introduction
אדמה היא סביבה מגוונת במיוחד המכילה שפע של מיקרואורגניזמים המסייעים למחזורי פחמן וזרחן 1,2. פטריות נימה הן מרכיב מרכזי במערכות אקולוגיות רבות כמפרקים של חומר אורגני ואנאורגני ויכולות לשפר את התזונה של צמחים באמצעות יצירת יחסים סימביוטיים 3,4. בתוך האדמה, פטריות מתקשרות באופן דינמי עם מספר רב של מיקרובים כגון פטריות אחרות5, חיידקים6, וירוסים7 ונמטודות8. לאינטראקציות אלה יש השלכות משמעותיות על בריאות הקרקע והצמחים. עם זאת, בשל היעדר מערכות ניסיוניות מתאימות המסוגלות להדמיית מיקרואורגניזמים מתקשרים עם מיקרואורגניזמים ברזולוציה גבוהה, רבים נותרו בלתי מוגדרים.
לחקירות הנוגעות לאינטראקציות בין חיידקים לפטריות (BFIs) ולאינטראקציות פטרייתיות-פטרייתיות (FFIs) יש יישומים בעלי ערך במגוון תחומים, כולל חומרים אנטי-מיקרוביאליים ברפואה וחומרי הדברה ביולוגית בחקלאות. לדוגמה, הפטרייה Coprinopsis cinerea מייצרת את הפפטיד קופסין, אשר הוכח כי הוא מפגין פעילות אנטיבקטריאלית נגד הפתוגן האנושי ליסטריה מונוציטוגנים9. באופן דומה, התרכובת שמקורה בפטריות, griseofulvin, נמצאת בשימוש נרחב כטיפול בזיהומים פטרייתיים אנושיים והיא גם מסוגלת לעכב את הצמיחה של הפטרייה הפתוגנית הצמחית Alternaria solani10,11. מספר זנים של החיידק השוכן בקרקע, Bacillus subtilis, הוכחו גם כחומרים ביו-מבוקרים יעילים של הפתוגן הצמחי הפטרייתי Rhizoctonia solani 12,13. עם זאת, בשל מגבלות הקשורות למתודולוגיות מסורתיות, BFIs ו- FFIs אינם מובנים היטב ברמה של תאים בודדים.
מחקרים קונבנציונליים חוקרים בדרך כלל BFIs ו-FFIs על המאקרו-קנה מידה באמצעות לוחות אגר עם שני מינים או יותר שנמצאים בעימות. האינטראקציה ביניהם נבחנת על ידי מדידת קצבי גדילה וייצור מטבוליטים של המינים המתעמתים 14,15,16; עם זאת, מתודולוגיה זו נפתרת רק לרמת המושבה. כדי לחקור אינטראקציות ברמה התאית, ניתן לטפח אינוקולנטים חיידקיים ופטרייתיים על גבי שקופיות מיקרוסקופ זכוכית מצופות באגר שמצולמות לאחר מכן תחת מיקרוסקופ17. עם זאת, זה יכול להיות קשה לעקוב אחר hypha יחיד באמצעות שקופיות מיקרוסקופ בשל חוסר כליאה, כלומר תמונות קיטועי זמן קשה יותר להשיג. יתר על כן, ההזדמנות להגביל מרחבית מיקרואורגניזמים אחרים בתוך אזורים מוגדרים של התפטיר הפטרייתי או ליצור סביבות כימיות מוגדרות שניתן להפריע להן, למשל, אינה אפשרית במערכים כאלה. אופי "הקופסה השחורה" של האדמה מוסיף גם למורכבות של חקר אינטראקציות פטרייתיות-מיקרוביאליות ברמה של תאים בודדים18. על ידי התבוננות במינים מתקשרים הרחק מהמגוון המדהים של המיקרוביום הקרקעי, ניתן להעריך את האופן המדויק שבו חברים בודדים מתקשרים. לפיכך, קיים צורך מתמשך בפלטפורמות רב-תכליתיות המאפשרות הדמיה חד-תאית ברזולוציה גבוהה של BFIs ו-FFIs.
טכנולוגיות מיקרופלואידיות, מה שמכונה מערכות מעבדה על שבב, מספקות פלטפורמה אידיאלית לחקר BFIs ו- FFIs ברמה של תאים בודדים. תחום המיקרופלואידיקה, שמקורו בטכנולוגיות שפותחו לצורך אנליזה כימית ומיקרו-אלקטרוניקה, אומץ על ידי מדעי הביולוגיה19. טכנולוגיות מיקרופלואידיות מווסתות כמויות קטנות של נוזלים בתוך רשת מותאמת אישית של תעלות ממוזערות, בעלות ממד אחד לפחות בסולם המיקרומטר, והשימוש בהן במחקר ביולוגי מתרחבל-20. בפרט, התקנים מיקרופלואידיים פותחו כדי לבחון את הצמיחה של פטריות נימה 21,22,23,23,24,25,26,27,28,29,30. אחד היתרונות של שימוש בטכנולוגיה זו הוא שכליאה של hyphae והתפלגות חומרי המזון בתוך מיקרו-ערוצים דומה יותר למבנה סביבת הקרקע מאשר שיטות אגר קונבנציונליות31. לאחרונה, פלטפורמות מיקרופלואידיות שימשו כדי לחקור אינטראקציות בין נויטרופילים אנושיים לבין פתוגנים פטרייתיים32, חיידקים ושורשי צמחים33, כמו גם פטריות ונמטודות34,35.
אחד היתרונות הרבים של שימוש במיקרופלואידיקה לחקר אינטראקציות מיקרוביאליות כולל את הבקרה הספציפית של סביבת המיקרו-ערוצים. לדוגמה, ניתן לנצל משטרי זרימה למינריים כדי ליצור גרדיאנטים מוגדרים של ריכוז, וזה שימושי במיוחד כאשר בוחנים את הכימוטקסיס החיידקי36. יתרון נוסף הוא שהאופי השקוף של פולי(דימתילסילוקסן) (PDMS), פולימר אלסטומרי זול וניתן להתאמה ביולוגית הנפוץ בייצור התקנים מיקרופלואידיים, מאפשר הדמיה ברזולוציה גבוהה של תאים בודדים באמצעות מיקרוסקופיה פלואורסצנטית של שדה בהיר ופלואורסצנטי37. באופן דומה, כליאה של מיקרובים בתוך מיקרו-ערוצים פירושה שניתן לבצע ניסויים בהילוך מהיר העוקב אחר תאים בודדים, מה שמאפשר לרשום ולכמת תגובות תאיות בודדות37. לבסוף, מכיוון שניתן לתכנן התקנים מיקרופלואידיים כך שיהיו ידידותיים למשתמש, הם יכולים להיות מועסקים בקלות על ידי אנשים שאינם מומחים38.
קידום הידע על יחסי הגומלין בין מיקרואורגניזמים שוכני קרקע חשוב לשיפור שיטות ניהול אקולוגיות בנות קיימא השומרות על המגוון הביולוגי ולמיתון ההשפעה של שינויי האקלים על סביבות יבשתיות39. לפיכך, פיתוח כלים מיקרופלואידיים חדשניים הוא בסיסי להרחבת ההבנה של פטריות והאינטראקציות שלהן ברמה התאית. הפרוטוקול כאן יתמקד בשני התקנים מיקרופלואידיים שיוצרו עבור המחקר של BFIs40 ו-FFIs41 כפי שהם מיוצגים באיור 1.

איור 1: ייצוג חזותי וסכמטי של התקני האינטראקציה החיידקית-פטרייתית (BFI) והתקני האינטראקציה הפטרייתית-פטרייתית (FFI). תקע תפטיר ממוקם בכניסה לקצה אחד של המיקרו-ערוצים כדי לאפשר צמיחת היפל לתוך המכשיר. המפרצון החיידקי נמצא בקצה הנגדי. סרגל קנה מידה = 5 מ"מ. (B) סקירה סכמטית של התקן ה- BFI, המתארת את המיקום של מפרצוני החיידקים ואת כיוון הצמיחה ההיפלית באמצעות מיקרו-ערוצי האינטראקציה. הערוצים הם בעומק של 10 מיקרומטר, ברוחב של 100 מיקרומטר ובאורך של 7 מ"מ, עם 28 ערוצי תצפית בסך הכל. (C) מבחן עימות על לוח אגר בין Coprinopsis cinerea ו Bacillus subtilis NCIB 3610, סרגל קנה מידה = 20 מ"מ (משמאל). תמונות מיקרוסקופיה מראות את האינטראקציה בין C. cinerea ו- B. subtilis NCIB 3610 בתוך המיקרו-ערוץ (האמצעי והימין), כלומר חיבור קוטבי של חיידקים להיפאה פטרייתית. סרגל קנה מידה = 25 מיקרומטר (באמצע) ו- 10 מיקרומטר (מימין). (D) תמונה של מכשיר ה-FFI המחובר לצלחת פטרי בעלת תחתית זכוכית, מחוסנת פעמיים בתקעים תפטיריים. סרגל קנה מידה = 1 ס"מ. (E) סקירה סכמטית של התקן ה- FFI. שני תקעי אינוקולנט פטרייתיים מוכנסים לתוך המפרצים בשני קצות המכשיר, ומאפשרים חקירה היפלית של המיקרו-ערוצים. ערוצי הבקרה מחוברים לכניסה פטרייתית אחת בלבד ויש להם ערוץ ללא מוצא, מה שמונע אינטראקציות בין פטריות הבדיקה. ערוצי אינטראקציה מחברים בין שני המפרצים הפטרייתיים ומאפשרים אינטראקציות היפאליות בין הנבדקים בתוך המיקרו-ערוץ. כל תעלת אינטראקציה מורכבת מ-18 מקטעים בצורת יהלום, באורך כולל של 8.8 מ"מ (490 x 430 מיקרומטר ליהלום), בעומק של 10 מיקרומטר ובבעל אזור חיבור בין כל יהלום של 20 מיקרומטר. סוגי הערוצים משוכפלים, סרגלי קנה מידה = 1 מ"מ. (F) אזור אינטראקציה בין שתי חזיתות היפל מתקרבות, הגדלות מקצוות מנוגדים של ערוץ האינטראקציה המחובר. תמונת מיקרוסקופיה של ניגודיות פאזה, סרגל קנה מידה = 250 מיקרומטר. הלוחות באיור זה שונו מ-Stanley et al., 2014 (A-C)40 ו-Gimeno et al., 2021 (D-F)41. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
Protocol
הערה: סיכום של ההליכים המתוארים בפרוטוקול זה מתואר באופן חזותי באיור 2.
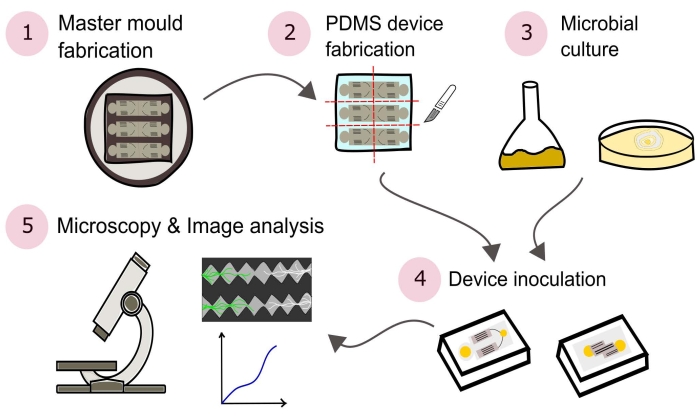
איור 2: ייצוג סכמטי של המתודולוגיה המוצגת המורכב מחמישה חלקים עיקריים המפורטים בפרוטוקול זה. עיצובי המכשירים נוצרים באמצעות תוכנת תכנון בעזרת מחשב (CAD) ותבנית ראשית המיוצרת באמצעות פוטוליטוגרפיה (1). זה משמש ליציקת פולי(דימתילסילוקסן) (PDMS), אשר לאחר מכן נקטע לתוך לוחות ומלוכד לצלחות פטרי בעלות קרקעית זכוכית כדי ליצור את המכשירים המיקרופלואידיים (2). מיקרובים שייכללו במחקר עוברים תרבית (3) ומשמשים לחיסון המכשירים (4). אינטראקציות נחקרות באמצעות מיקרוסקופיה ומכומתות באמצעות טכניקות ניתוח תמונה (5). אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
1. ייצור עובש מאסטר
- הפקת מסכות צילום
- צור תכנוני התקנים מיקרופלואידיים באמצעות תוכנת תכנון בעזרת מחשב (CAD). הממדים של המכשירים המוצגים ניתנים באיור 1 ופרטים נוספים על תכונות העיצוב הספציפיות מפורטים באופן מקיף בפרסומים המתאימים 40,41.
- ייצא את קובץ העיצוב CAD באמצעות תבנית מתאימה (לדוגמה, .dwg, .dxf). הדפס מסכת פוטוליתוגרפיה של סרט על-ידי שליחת קובץ העיצוב CAD המיוצא לספק מסחרי להדפסה.
- פוטוליתוגרפיה
הערה: הצעדים הבאים צריכים להתבצע בסביבה נטולת אבק ומבוקרת אור, כגון מכסה מנוע זרימה למינרי או מתקן חדר נקי. תנאי הניסוי המסופקים כאן ניתנים כמדריך ויש לייעל אותם בתוך החברה. המחברים ממליצים לחפש הדרכה ספציפית וייעוץ פרוטוקולים מבוססים42.- מכינים פרוסת סיליקון 100 מ"מ על ידי אפייה בתנור בטמפרטורה של 200 מעלות צלזיוס למשך שעתיים. מצפה את פרוסת הסיליקון בפוטורסיסט SU-8 2010, מכוון לעובי מטרה של 10 מיקרומטר, תוך שימוש בתנאים הבאים: 500 סל"ד ל-10 שניות (תאוצה 100 סל"ד לשנייה) ו-3,000 סל"ד ל-45 שניות (תאוצה 300 סל"ד לשנייה).
אזהרה: SU-8 פוטורסיסט הוא מסוכן, היזהר בעת טיפול ומניעת שאיפה ומגע עם העור. הוא דליק, עלול להיות מסרטן ורעיל לסביבה. - אופים את פרוסת הסיליקון המצופה בטמפרטורה של 95 מעלות צלזיוס למשך 2.5 דקות (אפייה רכה). חשוף את הפוטורסיסט לאור אולטרה סגול (UV), באמצעות מסכת הפוטוליתוגרפיה של הפילם ומינון אנרגיה של 140 mJ/cm2 באורך גל של 365 ננומטר באמצעות יישור מסיכה.
- יש לאפות את פרוסת הסיליקון המצופה בטמפרטורה של 95 מעלות צלזיוס למשך 3.5 דקות (אפייה לאחר החשיפה). לטבול ולתסיס את פרוסת הסיליקון בתמיסת המפתחים במשך 3 דקות כדי לחשוף את המבנים המיקרו-פבריקטיים על ידי הסרת הפוטורסיסט שלא נחשף.
אזהרה: פתרון המפתחים יכול להיות דליק, לנקוט באמצעי זהירות מתאימים בעת הטיפול והאחסון. - יש לשטוף בתמיסת מפתח טרייה למשך 10 שניות. יש לשטוף עם אלכוהול איזופרופיל במשך 10 שניות ולייבש את האוויר. השתמש באוויר מסונן ודחוס כדי להבטיח שהמבנים יבשים לחלוטין. למדוד את הגובה של מבני SU-8, למשל, באמצעות פרופילומטר.
- סילאניזציה של כל תבנית ראשית עם 50 μL של כלורוטרימתילסילן על ידי הפעלת לחץ ואקום של 50 mbar במשך 2 שעות. המחברים מציינים כי סילאניזציה מחדש של תבנית המאסטר לא נמצאה נחוצה.
אזהרה: כלורוטרימתילסילן הוא חומר מסוכן. יש ללבוש ציוד מגן אישי מתאים (PPE) ולטפל בזהירות. יש להימנע ממגע עם העור והעיניים ולמנוע שאיפה. התרחקו ממקורות הצתה ושימוש באזור מאוורר היטב.
- מכינים פרוסת סיליקון 100 מ"מ על ידי אפייה בתנור בטמפרטורה של 200 מעלות צלזיוס למשך שעתיים. מצפה את פרוסת הסיליקון בפוטורסיסט SU-8 2010, מכוון לעובי מטרה של 10 מיקרומטר, תוך שימוש בתנאים הבאים: 500 סל"ד ל-10 שניות (תאוצה 100 סל"ד לשנייה) ו-3,000 סל"ד ל-45 שניות (תאוצה 300 סל"ד לשנייה).
2. ייצור מכשירים
הערה: הצעדים הבאים צריכים להתבצע בסביבה נטולת אבק, כגון מכסה מנוע זרימה למינרי.
- הכנת לוחות פולי(דימתילסילוקסן) (PDMS)
- הכינו כ-40 גרם של PDMS על ידי ערבוב יסודי של הבסיס וחומר הריפוי ביחס של 10:1 באמצעות מרית בכוס פלסטיק נקייה. דגה את התערובת כדי להסיר את כל בועות האוויר על ידי הנחת הפלסטיק המכילה את ה- PDMS לתוך תא ואקום (לחץ ואקום = 50 mbar) במשך שעה אחת.
- אבטחו את התבנית הראשית לתוך תושבת פלסטיק באמצעות סרט הדבקה שקוף. נקו באמצעות אוויר מסונן דחוס כדי להסיר את חלקיקי האבק.
הערה: לחלופין, ניתן לעצב רדיד אלומיניום סביב צלחת פטרי זכוכית, ולאחר מכן להשתמש בו כדי לאכלס את התבנית הראשית ולהכיל את PDMS43. - יוצקים את תערובת ה-PDMS למרכז התבנית הראשית, ומבטיחים שהיא נמצאת על משטח מישורי, ומאפשרים להתיישב.
הערה: יש לשפוך את תערובת ה- PDMS קרוב ככל האפשר אל פני השטח של התבנית הראשית ולשמור על זרימה רציפה כדי למזער את הכנסת בועות האוויר. ניתן להסיר בועות אוויר על ידי הפניית אוויר דחוס מעל הבועה או על ידי הוצאתן החוצה באמצעות מחט עדינה. - מכסים את התבנית הראשית באופן רופף במכסה פלסטיק כדי למנוע מחלקיקי אבק לשקוע על פני השטח של ה-PDMS. מעבירים את התבנית הראשית לתנור ומרפאים למשך הלילה ב-70 מעלות צלזיוס.
- מוציאים את התבנית הראשית מהתנור ומניחים להתקרר. מקלפים את ה-PDMS שנרפא הרחק מהתבנית הראשית וממסגרת הפלסטיק, תוך הקפדה על הימנעות מפגיעה בתבנית הראשית/PDMS.
- הניחו סרט דבק שקוף על המיקרו-ערוצים המובלטים ב-PDMS כדי לשמור על משטח נטול אבק. ודא שהקלטת מוסרת לפני ההדבקה.
- חותכים את ה-PDMS ללוחות (כלומר, אם מספר מכשירים כלולים בעיצוב על תבנית האב, ניתן לייצר רבים מהם מיציקה אחת) כפי שצוין על ידי העיצוב באמצעות גיליוטינה רכובה או סכין גילוח. בעת חיתוך הפתח הצדדי של לוח ה-PDMS של BFI, ודאו שהמיקרו-ערוצים פתוחים לחלוטין (איור 1A). עבור לוח ה-PDMS של FFI, ודאו שכל פינה נחתכת כדי לאפשר לה להשתלב בצלחת ה-Petri בעלת תחתית הזכוכית המוצגת באיור 1D.
- ניקוב חורי כניסה/מוצא רצויים בהתאם לתכנון המכשיר. השתמש בחותך מדויק כדי לנקב חורי כניסה של 3.18 מ"מ ו- 4.75 מ"מ עבור התקני BFI ו- FFI למופת, בהתאמה.
- הדבקה של לוחות PDMS ליצירת התקנים
הערה: שלבי הכביסה הבאים (2.2.1-2.2.2) משתמשים בחומר ניקוי קולי מלא במים מטוהרים (ddH2O) ב-37 קילוהרץ. שטיפת לוחות PDMS מסייעת לשפר את ההידבקות המוצלחת44 ולהפחית את הסיכון לזיהום. כדי לתפעל את לוחות ה-PDMS, השתמשו במלקחיים נקיים והתרוממו באמצעות חורי הכניסה כדי למנוע נזק למיקרו-ערוצים או למשטח המכשיר.- טבלו את לוחות ה-PDMS ב-0.5 M NaOH וסוניקציה למשך 5 דקות. יש לשטוף עם ddH2O סטרילי. העבירו לוחות PDMS לתמיסת אתנול של 70% וסוניקאט למשך 5 דקות. יש לשטוף עם ddH2 0 סטרילי.
- טבלו לוחות PDMS לתוך ddH2O סטרילי וסוניקאט במשך 5 דקות. הסר את לוחות ה- PDMS מה- ddH 2 O הסטרילי,יבשבאמצעות אוויר דחוס מסונן, והנח לתוך צלחת פטרי מרובעת סטרילית.
- מכניסים את צלחת הפטרי המרובעת המכילה את לוחות ה-PDMS לתנור בטמפרטורה של 70 מעלות צלזיוס למשך שעה אחת לייבוש. מוציאים מהתנור ומאפשרים להתקרר בסביבה נטולת אבק. נקו את כל האבק מפני השטח של לוחות ה-PDMS באמצעות סרט הדבקה ו/או אוויר דחוס מסונן.
- הפעילו את המשטחים של לוחות PDMS וכלי פטרי עם תחתית זכוכית כדי להיקשר באמצעות מנקה פלזמה עם ההגדרות הבאות: לחץ ואקום 0.75 mbar, הספק 50%, זמן ציפוי 1 דקה. הניחו את המשטחים להיות מופעלים (ולאחר מכן מלוכדים) הפונים כלפי מעלה במנקה הפלזמה.
- הסר את לוחות PDMS ואת צלחות הפטרי בעלות קרקעית הזכוכית ממנקה הפלזמה והקשר על ידי הצבה עדינה של המשטחים המופעלים במגע קונפורמי זה עם זה. קשרו את לוחות ה-BFI וה-FFI PDMS לצלחות פטרי בקוטר 35 מ"מ ו-50 מ"מ (עובי זכוכית 0.17 מ"מ), בהתאמה.
הערה: הקפידו לא להפעיל לחץ רב מדי בעת ההדבקה, מכיוון שהדבר עלול לגרום לקריסת המיקרו-ערוצים. - בדוק אם יש הדבקה מוצלחת על ידי ניסיון פשוט למשוך את לוח ה- PDMS מצלחת הפטרי בעלת תחתית הזכוכית עם פינצטה. דמיינו את המכשירים לפי עין או באמצעות מיקרוסקופיה גנרית כדי להבטיח שלא תהיה קריסה של פתחי החיסון או המיקרו-ערוצים.
הערה: עבור תנאים רוויים (כלומר, תנאים רוויי מים ו/או עשירים בחומרים מזינים), כלול את שלב 2.2.7 של הפרוטוקול. אם נדרשים תנאים בלתי רוויים במים, המשך לשלב 2.2.8. ניתן למלא את המכשירים במים או במדיה. - מלא את המכשירים מיד לאחר ההדבקה על ידי צנרת 100 μL של הפתרון הרצוי עבור התקן BFI (כניסת חיידקים ופתח לרוחב) או 30 μL של מדיה לתוך כל כניסה (60 μL בסך הכל) עבור התקן FFI. אם קיימות בועות אוויר, אלה יתפוגגו בסביבות 10 דקות לאחר המילוי מכיוון ש-PDMS הוא נקבובי.
- הוסיפו ddH2O סטרילי (כ-100-200 μL) בצלחת פטרי כדי לשמור על הלחות.
3. תרבות מיקרוביאלית
הערה: השלבים הבאים מספקים הליך מיקרוביולוגי כללי לתרבית פטרייתית וחיידקית ויש לבצעם בתנאים סטריליים (כלומר, באמצעות להבה או ארון בטיחות מיקרוביולוגי) המתאימים לרמת ההכלה הנדרשת למיקרובים הרצויים. דוגמאות ספציפיות ניתנות בסוף כל סעיף עבור מין בעל עניין.
- תרבות פטרייתית
- הכינו את מדיום התרבות הרצוי בתוספת אגר. Autoclave את המדיום ב 121 °C (64 °F) למשך 15 דקות. אפשרו למדיום להתקרר עד 50 מעלות צלזיוס ולשפוך לתוך צלחות פטרי בקוטר 9 ס"מ, תוך שמירה על תנאים סטריליים.
- השתמשו בבור שעם כדי להסיר תקע בקוטר 4 מ"מ של אגר המכיל תפטיר ממושבת מלאי מקרר של הזן הפטרייתי הרצוי כדי להפעיל את הבידוד. זה נערך כדי להבטיח צמיחה סטנדרטית ונמרצת של הפטרייה לפני חיסון המכשיר.
הערה: המיקרובים יכולים להיות מופעלים גם ממלאי גליצרול, כלומר, מבודדים פטרייתיים המאוחסנים על תקעי אגר בתמיסת גליצרול 50% בטמפרטורה של -70 מעלות צלזיוס41. - מניחים את צד התקע עם תפטיר במגע עם משטח האגר במרכז צלחת הפטרי הלא מנוצלת. החליפו את המכסה על גבי צלחת הפטרי ואטמו לפני הדגירה בטמפרטורה המתאימה לזן הרצוי למשך פרק הזמן הנדרש, בדרך כלל, כ-3 עד 4 ימים.
הערה: תנאי תרבות לדוגמה עבור Trichoderma rossicum: תמצית מאלט אגר, דגירה ב 25 °C בחושך במשך 48 שעות.
- תרבית חיידקים
- פזרו את החיידקים המבודדים הרצויים ממלאי המקור (למשל, מלאי הגליצרול או המושבה הבודדת מצלחת האגר) על צלחת אגר כדי להשיג מושבות חיידקים בודדות ולהבטיח שלא יהיו זיהום45. אטום את הצלחת עם פילם.
- דגירה בטמפרטורה ובמשך ספציפי לבידוד העניין עד שנצפו מושבות בודדות.
- הכינו את מרק התרבות הרצוי. לדוגמה, הוסיפו 10 גרם של טריפטון, 10 גרם של NaCl ו-5 גרם תמצית שמרים לכל 1 ליטר של ddH2O כדי להכין מדיום LB לתרבית של B. subtilis. Autoclave את המדיום ב 121 °C (64 °F) למשך 15 דקות.
- אפשרו לבינוני להתקרר עד לטמפרטורת החדר. הוסיפו את המדיום לבקבוקון תרבית סטרילית בתוך סביבה סטרילית.
- לגעת במושבת חיידקים אחת מצלחת האגר באמצעות לולאת חיסון סטרילית. מעבירים את הלולאה המחוסנת לתוך מדיום התרבית הסטרילית על ידי נגיעה קצרה בנוזל עם הלולאה.
- אטמו את הבקבוקון באמצעות מכסה או רדיד אלומיניום סטריליים, והניחו בתוך אינקובטור רועד למשך הלילה תוך שימוש בהגדרות המתאימות למינים הנבחרים.
הערה: תנאי תרבית לדוגמה עבור B. subtilis: i) תרבית נוזלית - צמיחה אירובית ב 37 °C ב 200 סל"ד ב- LB בינוני ו- ii) תרבית צלחת - טמפרטורת החדר על צלחת LB אגר. עיין בניירות FFI/BFI40,41 לקבלת פרטים נוספים על התרבות זנים פטרייתיים שונים.
4. חיסון מכשירים
הערה: הצעדים הבאים צריכים להתבצע בתוך מכסה מנוע זרימה למינרי באמצעות ציוד סטרילי.
- חיסון פטרייתי
- השתמשו בבור שעם מעוקר (ø = 4 מ"מ) כדי להסיר תקע אגר מהמושבה בשולי תרבות בת 3 ימים (שלב 3.1). ודא שהחזית ההיפלית ההולכת וגדלה נשארת שלמה.
- הכניסו את התקע לתוך הכניסה הפטרייתית, בצד התפטיר כלפי מטה, כאשר כיוון הצמיחה של חזית ההיפל מכוון לכיוון פתחי המיקרו-ערוצים כדי לעודד חדירת היפל של הערוצים.
- חזור על שלבים 4.1.1-4.1.2 עבור המין הפטרייתי השני (אם אתה משתמש במכשיר FFI), תוך החדרת התקע לתוך המפרצון הנגדי. אם אתה משתמש בהתקן BFI, השמיט שלב זה והמשך לשלב 4.1.4.
- אטמו את צלחת הפטרי בסרט שקוף ודגרו בטמפרטורה של 25-28 מעלות צלזיוס בחושך עד לתחילת ההדמיה. קבעו את זמן הדגירה שלפני ההדמיה בהתאם לאירוע הביולוגי המיועד שיש לצפות בו, למשל, עימותים פטרייתיים-פטרייתיים, וקצב הגדילה של המינים הכלולים במכשיר.
- חיסון חיידקים
- דיללו את החיידקים מתרבית לילה (שלב 3.2) ביחס של 1:25 באמצעות אותו מדיום תרבית כפי שפורט בשלב 3.2.3. תרבות במשך 3 שעות ב 37 °C (84 °F).
- לשטוף את החיידקים על ידי גלולה תרבית באמצעות צנטריפוגה ב 2000 x g במשך 10 דקות. יש להשליך את הסופרנטנט ולהחיות את התאים בנפח הרצוי של 0.9% w/v תמיסת נתרן כלורי.
- צנטריפוגה שוב כדי להשיג כדור. יש להשליך את הסופרנטנט ולהחיות את התאים בתווך נוזלי (לדוגמה, C. cinerea מינימלי בינוני ל-OD600 מתוך 1). מטב את הערך OD600 עבור זן החיידקים המדובר.
- הסר את מכשיר ה- BFI מהאינקובטור ופתח אותו בסביבה סטרילית. פיפטה 10 μL של תרחיף לתוך הכניסה החיידקית.
הערה: מטב את תזמוני החיסון המדויקים עבור האינטראקציות החיידקיות-פטרייתיות המדוברות. לדוגמה, הכנס חיידקים למכשיר BFI 18 שעות לאחר חיסון פטרייתי אם משתמשים ב- C. cinerea. - אטמו את צלחת הפטרי עם סרט שקוף והדגרו בטמפרטורה של 25 מעלות צלזיוס בחושך עד לתחילת ההדמיה. אחסן את המכשיר זקוף.
5. מיקרוסקופיה וניתוח תמונות
- מיקרוסקופ
הערה: על החוקר לבחור את השיטה המתאימה להדמיה קונקורדנט עם אופי הניסוי שייערך, לדוגמה, אפיפלואורסצנציה הפוכה בשדה רחב או מיקרוסקופיה קונפוקלית. סקירה כללית ניתנה כאן, שכן פרטים ספציפיים יהיו תלויים בתכונות של מערך המיקרוסקופיה שנבחר.- הפעל את מחשב המיקרוסקופ, הגוף הראשי של המיקרוסקופ (אם רלוונטי), המצלמה, האינקובטור מבוקר הטמפרטורה ומקורות האור. ודא שהמיקרוסקופ הוקם כהלכה, למשל, תאורת Köhler יושמה כראוי להארה אחידה של הדגימה. הפעל את חבילת תוכנת ההדמיה.
הערה: בעת שימוש באינקובטור מבוקר טמפרטורה, חשוב לאפשר לטמפרטורת המיקרוסקופ להתיישב במשך מספר שעות לפני תחילת הניסוי. - הרכיבו את המכשיר המיקרופלואידי לתוך תוסף הבמה. ודא שהמכשיר מאובטח היטב, כלומר באמצעות סרט הדבקה, כדי למנוע פריקה של המכשיר במהלך תנועה שלב פעילה.
- קבל תמונות של המכשירים המחוסנים, למשל, ניסויים בנקודה בודדת או בהילוך מהיר. מפרטי הדמיה מקיפים הרלוונטיים לניסויים שנערכו עם התקני BFI ו- FFI מסופקים בפרסומים הנ"ל בהתאמה 40,41.
הערה: תמונות ברייטפילד נרכשו על ידי שימוש במיקרוסקופיית ניגודיות פאזה כדי לדמיין את התפשטות ההיפל דרך ערוצי הצמיחה באמצעות תוכנת מיקוד אוטומטי והגדלה של פי 10, 0.30 NA (מפתח צמצם מספרי) או הגדלה של 20x, עדשות אובייקטיביות של 0.45 NA. עירור של חלבוני כתב פלואורסצנטי הושג באמצעות מנוע אור פולט אור פולט אור בעל הספק גבוה עם אורכי גל ספציפיים לפלואורופור. - ייצא תמונות לפורמט מתאים לעיבוד תמונה עוקב. לדוגמה, .tiff.
- הפעל את מחשב המיקרוסקופ, הגוף הראשי של המיקרוסקופ (אם רלוונטי), המצלמה, האינקובטור מבוקר הטמפרטורה ומקורות האור. ודא שהמיקרוסקופ הוקם כהלכה, למשל, תאורת Köhler יושמה כראוי להארה אחידה של הדגימה. הפעל את חבילת תוכנת ההדמיה.
- ניתוח תמונות
הערה: המחברים ממליצים על פיג'י46 ככלי לניתוח תמונות, אך חבילות תוכנה אחרות זמינות. להלן דוגמאות לניתוחי תמונות שנערכו באמצעות פיג'י מפרסומי מכשירי BFI ו- FFI שהוצגו. שלבים אלה הם ספציפיים ל-Mac ועשויים להיות שונים במקצת אם אתם משתמשים במחשב אישי.- מדידות קצב גדילה בהיפל
הערה: שיטה זו שימשה בכתב היד BFI40 כדי למדוד את שיעורי הצמיחה של hyphae בודדים.- הורד, התקן והפעל את פיג'י. יבא את רצף התמונה מניסוי בהילוך מהיר על-ידי בחירה באפשרות 'יבא > קובץ > רצף תמונה'. אתר את התיקיה שבה מאוחסנים הנתונים ובחר פתח. בחלון אפשרויות רצף , בחר העדפות ולאחר מכן אישור.
- בחר את סמל הקו הישר משורת הכלים הראשית. מקם את תחילת הקו הישר בקצה קצה ההיפל הגדל על ידי לחיצה ולאחר מכן גרירת הסמן במקביל לנקודה אחרת בתוך החלון. קו צהוב יופיע עם שלוש תיבות המציינות את ההתחלה, נקודת האמצע והסוף של הקו.
- עבור למסגרת הבאה ברצף התמונות על-ידי הקשה והחזקה של Ctrl ו- >. מקם את קצה הקו הישר בקצה ההיקף הגדל על-ידי בחירה וגרירה של התיבה המרובעת למיקום הנכון.
- לחץ והחזק את Ctrl ו- M כדי למדוד את אורך הקו בפיקסלים. חלון תוצאות יופיע עם הנתונים הנמדדים. הגדר את הנתונים המוצגים בחלון תוצאות באופן הבא: לחץ על החלון תוצאות ולאחר מכן בחר תוצאות > הגדרת מדידות.
- עבור למסגרת הבאה ברצף התמונות על-ידי הקשה והחזקה של Ctrl ולאחר מכן >. מקם את תחילת הקו הישר בקצה ההיקף הגדל על-ידי בחירה וגרירה של התיבה המרובעת למיקום הנכון.
- הקש והחזק את Ctrl ולאחר מכן M כדי למדוד את אורך הקו בפיקסלים. חלון תוצאות יופיע עם הנתונים הנמדדים.
- חזור על שלבים 5.2.1.5-5.2.1.6 עד לסיום מדידת הצמיחה של ההיפה בפיקסלים.
- בחר את כל הנתונים בחלון תוצאות . העתק והדבק לתוכנה אחרת, למשל, גיליון אלקטרוני, כדי לעבד את הנתונים. התווה את הצמיחה ההיפלית (בפיקסלים או במיקרומטרים) כפונקציה של זמן וחשב את שיעורי הצמיחה הממוצעים. בצע לפחות שלושה שכפולים ביולוגיים בכל ניסוי.
- מדידות עוצמת פלואורסצנציה
הערה: שיטה זו שימשה בפרסום FFI41 כדי להעריך את השינוי בעוצמת הפלואורסצנציה בהיפאה של Fusarium graminearum 8/1-wt-GFP במגע עם Clonostachys rosea 016 כפונקציה של זמן.- הורד, התקן והפעל את פיג'י. ייבוא רצף תמונה מניסוי בהילוך מהיר על-ידי בחירה באפשרות 'קובץ > ייבוא רצף תמונה >'. אתר את התיקיה שבה מאוחסנים הנתונים ובחר פתח. בחלון אפשרויות רצף בחר העדפות ולאחר מכן אישור.
- ציין אזור עניין (ROI) למדידת עוצמת הפלואורסצנציה המוחלטת של hypha באמצעות הכלי המלבני, הממוקם בסרגל הכלים הראשי. ניתן להגדיר את גודל הריבוע בדיוק באופן הבא: ערוך > בחירה > ציין; ניתן גם לשמור את ההחזר על ההשקעה לעיון עתידי במנהל ההחזר על ההשקעה על-ידי בחירה > עריכה > הוספה למנהל.
- מדוד את עוצמת הפלואורסצנציה המוחלטת (ערך אפור ממוצע) בתוך ההחזר על ההשקעה המוגדר עבור כל תמונה בכל רצף התמונות או הערימה באופן הבא: > תמונה בערימות > מדידת מחסנית. חלון התוצאות ייפתח באופן אוטומטי לאחר שכל התמונות בערימה יעובדו.
הערה: ניתן להגדיר את הנתונים המוצגים בחלון תוצאות באופן הבא: לחץ על חלון התוצאות ולאחר מכן בחר תוצאות > הגדרת מדידות. ודא שערך אפור ממוצע נבחר. - בחר את כל הנתונים בחלון תוצאות . העתק והדבק לתוכנה אחרת, למשל, גיליון אלקטרוני, כדי להתוות את עוצמות הפלואורסצנציה המוחלטות של ההחזר על ההשקעה שצוין כפונקציה של זמן.
- חזור על שלבים 5.2.2.2-5.2.2.4 כדי לאסוף מדידות עוצמת פלואורסצנציה מוחלטות עבור כל ROI, כלומר על hypha של עניין, ליד hypha של עניין או בתוך ערוץ הבקרה המתאים.
- חשב את העוצמות הפלואורסצנטיות היחסיות המתאימות ביחידות שרירותיות (AU), למשל, על-ידי חלוקת עוצמת הפלואורסצנציה המוחלטת של ה-ROI [hypha of interest] בעוצמת הפלואורסצנציה המוחלטת של ה-ROI [ערוץ הבקרה]. עיין בפרסום FFI41 לקבלת פרטים ספציפיים יותר.
- בצע לפחות שלושה שכפולים ביולוגיים בכל ניסוי והתווה את עוצמות הפלואורסצנציה היחסיות כפונקציה של הזמן.
- מדידות קצב גדילה בהיפל
תוצאות
תוצאות מייצגות מוצגות ממכשירי BFI40 ו- FFI41 למופת. ניתן להשיג בקלות מדידות קצב גדילה של Hyphal באמצעות מכשירים אלה בשילוב עם טכניקות מיקרוסקופיה בסיסיות. איור 3A-B ממחיש את האינטראקציות בין חיידקים לפטריות בין C. cinerea hyphae לבין B. subti...
Discussion
מאמר זה מציג פרוטוקול לחקר אינטראקציות פטרייתיות-מיקרוביאליות באמצעות מיקרופלואידיקה של ערוצים. המחברים שואפים להדגים את הרבגוניות של מכשירים אלה ולעודד הסתגלות שתתאים לתחומי העניין של החוקר. באמצעות מכשירי BFI ו-FFI למופת, ניתן לחקור אינטראקציות פטרייתיות-מיקרוביאליות בפירוט רב יותר מאש...
Disclosures
המחברים מצהירים שאין להם אינטרסים מתחרים.
Acknowledgements
אנו מכירים בתמיכה כספית מהמחלקה לביו-הנדסה באימפריאל קולג' בלונדון ומקרן Leverhulme (הפניה למענק מחקר: RPG-2020-352).
Materials
| Name | Company | Catalog Number | Comments |
| Agar | Difco Laboratories | 214010 | Used to solidify culture medium for bacterial and fungal cultivation within Petri dishes |
| Aluminum foil | Fisher Scientific Ltd | 11759408 | |
| AutoCAD 2021 | Autodesk, USA | ||
| Autoclave (VX-75) | Systec | ||
| Centrifuge (5810R) | Eppendorf | ||
| Chlorotrimethysilane | Merck Life Sciences | 386529 | CAUTION: Chlorotrimethylsilane is a hazardous substance. Wear appropriate PPE and handle with care. Avoid contact with skin and eyes and prevent inhalation. Keep away from sources of ignition and use in a well-ventilated area. |
| Cork borer | SLS | COR1000 | |
| Developer solution (mr-Dev 600) | Microresist Technologies | CAUTION: mr-Dev 600 developer solution is flammable | |
| Erlenmeyer flasks | VWR | 214-1108 | e.g. 200 mL; choose size to suit your exact needs |
| Ethanol (70% v/v) | Fisher Scientific Ltd | E/0650DF/15 | Diluted from 99.8% (Analytical Reagent Grade) |
| Fiji | ImageJ | Exemplar software package for imaging processing | |
| Filtered, compressed air | Available as standard in most labs. Altervatively, an oil-free compressor with air regulator can be used. | ||
| Flat-headed wafer tweezers | SLS | INS5026 | |
| Forceps | Fisher Scientific Ltd | 10008051 | Bent, sharp |
| Glass bottom petri dish | World Precision Instruments | FD35-100 | 35 mm |
| Glass bottom petri dish | World Precision Instruments | FD5040-100 | 50 mm |
| Glass crystallisation dishes | VWR | 216-1865 | Used for washing of PDMS slabs |
| Glass crystallisation dishes | VWR | 216-1866 | Used in the development of master moulds |
| Glass media bottles | Fisher Scientific Ltd | 15456113 | e.g. 250 mL; choose size to suit your exact needs |
| Glass syringe (Hamilton) | Fisher Scientific Ltd | 10625251 | Used for dispensing chlorotrimethylsilane |
| Hot plate (HP 160 III BM) | SAWATEC | ||
| Inoculation loop | VWR | COPA175CS01 | |
| Isopropyl alcohol | Sigma-Aldrich | W292907 | |
| Laminar flow hood | Air Science (PCR) | Exemplar laminar flow hood used for device fabrication | |
| LB medium | Fisher Scientific Ltd | BP9723-500 | Exemplar nutrient broth for bacterial overnight culture |
| Light emitting diode light engine (LedHUB) | Omicron-Laserage Laserprodukte GmbH | Exemplar light source that can be used for imaging fungal-microbial interactions (fluorescence) | |
| MA6 Ultraviolet mask aligner | Suss Microtec | ||
| Malt extract | VWR | 84618 | Used to make exemplar fungal culture medium (Malt extract agar) |
| Mask Writer | Applied Materials | 4700DP | Example of a mask writer which can be used to print photo-mask for photolithography |
| Master mould plastic mount | 3D-printed bespoke holder manufactured in-house | ||
| Microbiological safety cabinet (BioMat2) | Contained Air Solutions | Exemplar MSC used for microbial culture and device inoculation | |
| Milli-Q purified water | Available as standard in biology labs. | ||
| NaOH | Fisher Scientific Ltd | BP359-500 | |
| NIS-Elements Advanced Research imaging software | Nikon | Exemplar software package for image acquisition | |
| NIS-Elements Free Viewer | Nikon | Exemplar software package for viewing acquired images | |
| Oven (Binder BD115) | Fisher Scientific Ltd | 15602126 | Used for curing poly(dimethylsiloxane)(PDMS) |
| Oven (CLO-2AH-S) | KOYO | Used for preparing silicon wafers | |
| Parafilm | Bemis | HS234526B | transparent film |
| Petri dishes, square sterile | Fisher Scientific Ltd | 11708573 | 120.5 mm |
| Petri dishes, sterile | Fisher Scientific Ltd | 15370366 | 90 mm |
| Photolithography mask | Micro Lithography Services Ltd. UK | ||
| Plasma cleaner (Zepto) | Diener Electronic | 100012601 | |
| Plastic cup | Semadeni | 8323 | |
| Plastic spatula | Semadeni | 3340 | |
| Portable precision balance (OHAUS Scout) | Fisher Scientific Ltd | 15519631 | Used for weighing PDMS, media components etc. |
| Precision cutter | Syneo | HS1251135P1183 | Cutting edge diameter: 3.18 mm |
| Precision cutter | Syneo | HS1871730P1183S | Cutting edge diameter: 4.75 mm |
| Profilometer | Bruker | Dektak XT-stylus | |
| Razor blades | Häberle Labortechnik | 9156110 | |
| Refridgerator | Haden | 4-6 °C | |
| Retiga R1 CCD camera | Qimaging | Exemplar camera that can be used for imaging fungal-microbial interactions | |
| Scotch magic tape | Office Depot | 3969954 | 19 mm invisible tape; clear tape |
| Shaking incubator (Cole-Parmer SI500) | Fisher Scientific Ltd | 10257954 | |
| Silicon wafer | Inseto | 100 mm | |
| Soda lime glass plate | Inseto | 125 mm x 125 mm x 2 mm. Used to hold photolithography mask in mask aligner | |
| Sodium chloride | Sigma-Aldrich | S7653 | |
| Spincoater | SAWATEC | SM-180-BM | |
| SU-8 2010 photoresist | MicroChem | CAUTION: SU-8 photoresist is hazardous, take care when handling and prevent inhalation and contact with skin. Flammable, potentially carcinogenic and toxic to the environment. | |
| Sylgard 184 elastomer kit | VWR | 634165S | Used for the preparation of poly(dimethylsiloxane)(PDMS) devices |
| Temperature controlled incubator | Okolab | Exemplar incubator that can be used for imaging fungal-microbial interactions | |
| Ti2-E inverted epifluorescence microscope | Nikon | MEA54000 | Exemplar microscope that can be used for imaging fungal-microbial interactions |
| Ultrasonic cleaner S-Line | Fisher Scientific Ltd | FB15050 | |
| Vacuum desiccator | Fisher Scientific Ltd | 10528861 | Silianisation and PDMS degassing should be conducted in separate desiccators |
| x10/0.3 NA CFI Plan Fluor DL objective lens | Nikon | MRH20105 | Exemplar objective lens that can be used for imaging fungal-microbial interactions |
| x20/0.45 NA CFI Plan Fluor DL objective lens | Nikon | MRH48230 | Exemplar objective lens that can be used for imaging fungal-microbial interactions |
References
- Zhu, Y. -. G., Miller, R. M. Carbon cycling by arbuscular mycorrhizal fungi in soil-plant systems. Trends in Plant Science. 8 (9), 407-409 (2003).
- Dai, Z., et al. Long-term nutrient inputs shift soil microbial functional profiles of phosphorus cycling in diverse agroecosystems. The ISME Journal. 14 (3), 757-770 (2020).
- Op De Beeck, M., et al. Regulation of fungal decomposition at single-cell level. The ISME Journal. 14 (4), 896-905 (2020).
- Bender, S. F., et al. Symbiotic relationships between soil fungi and plants reduce N2O emissions from soil. The ISME Journal. 8 (6), 1336-1345 (2014).
- Dullah, S., et al. Melanin production and laccase mediated oxidative stress alleviation during fungal-fungal interaction among basidiomycete fungi. IMA Fungus. 12 (1), 33 (2021).
- Deveau, A., et al. Bacterial-fungal interactions: ecology, mechanisms and challenges. FEMS Microbiology Reviews. 42 (3), 335-352 (2018).
- Bian, R., et al. Facilitative and synergistic interactions between fungal and plant viruses. Proceedings of the National Academy of Sciences of the United States of America. 117 (7), 3779-3788 (2020).
- Jiang, X., Xiang, M., Liu, X. Nematode-trapping fungi. Microbiology Spectrum. 5 (1), (2017).
- Essig, A., et al. a novel peptide-based fungal antibiotic interfering with the peptidoglycan synthesis. Journal of Biological Chemistry. 289 (50), 34953-34964 (2014).
- Tang, H. -. Y., Zhang, Q., Li, H., Gao, J. -. M. Antimicrobial and allelopathic metabolites produced by Penicillium brasilianum. Natural Product Research. 29 (4), 345-348 (2015).
- Bai, Y. -. B., et al. Antifungal activity of griseofulvin derivatives against phytopathogenic fungi In vitro and In vivo and three-dimensional quantitative structure-activity relationship analysis. Journal of Agricultural and Food Chemistry. 67 (22), 6125-6132 (2019).
- Solanki, M. K., et al. Characterization of antagonistic-potential of two Bacillus strains and their biocontrol activity against Rhizoctonia solani in tomato. Journal of Basic Microbiology. 55 (1), 82-90 (2015).
- Jamali, H., Sharma, A., Srivastava, A. K. Biocontrol potential of Bacillus subtilis RH5 against sheath blight of rice caused by Rhizoctonia solani. Journal of Basic Microbiology. 60 (3), 268-280 (2020).
- Válková, H., Novotný, &. #. 2. 6. 8. ;., Malachová, K., Šlosarčíková, P., Fojtík, J. Effect of bacteria on the degradation ability of Pleurotus ostreatus. Science of The Total Environment. 584-585, 1114-1120 (2017).
- Leyva-Rojas, J. A., Coy-Barrera, E., Hampp, R. Interaction with soil bacteria affects the growth and amino acid content of Piriformospora indica. Molecules. 25 (3), 572 (2020).
- Dullah, S., et al. Fungal interactions induce changes in hyphal morphology and enzyme production. Mycology. 12 (4), 279-295 (2021).
- Marfetán, J. A., Romero, A. I., Folgarait, P. J. Pathogenic interaction between Escovopsis weberi and Leucoagaricus sp.: mechanisms involved and virulence levels. Fungal Ecology. 17, 52-61 (2015).
- Cortois, R., De Deyn, G. B. The curse of the black box. Plant and Soil. 350 (1), 27-33 (2012).
- Whitesides, G. M. The origins and the future of microfluidics. Nature. 442 (7101), 368-373 (2006).
- Sackmann, E. K., Fulton, A. L., Beebe, D. J. The present and future role of microfluidics in biomedical research. Nature. 507 (7491), 181-189 (2014).
- Hanson, K. L., et al. Fungi use efficient algorithms for the exploration of microfluidic networks. Small. 2 (10), 1212-1220 (2006).
- Held, M., Edwards, C., Nicolau, D. V. Probing the growth dynamics of Neurospora crassa with microfluidic structures. Fungal Biology. 115 (6), 493-505 (2011).
- Thomson, D. D., et al. Contact-induced apical asymmetry drives the thigmotropic responses of Candida albicans hyphae. Cellular Microbiology. 17 (3), 342-354 (2015).
- Lee, K. K., Labiscsak, L., Ahn, C. H., Hong, C. I. Spiral-based microfluidic device for long-term time course imaging of Neurospora crassa with single nucleus resolution. Fungal Genetics and Biology. 94, 11-14 (2016).
- Asenova, E., Lin, H. Y., Fu, E., Nicolau, D. V., Nicolau, D. V. Optimal fungal space searching algorithms. IEEE Transactions on NanoBioscience. 15 (7), 613-618 (2016).
- Soufan, R., et al. Pore-scale monitoring of the effect of microarchitecture on fungal growth in a two-dimensional soil-like micromodel. Frontiers in Environmental Science. 6, (2018).
- Uehling, J. K., et al. Microfluidics and metabolomics reveal symbiotic bacterial-fungal interactions between Mortierella elongata and Burkholderia include metabolite exchange. Frontiers in Microbiology. 10, 2163 (2019).
- Millet, L. J., et al. Increasing access to microfluidics for studying fungi and other branched biological structures. Fungal Biology and Biotechnology. 6 (8), 1-14 (2019).
- Baranger, C., Fayeulle, A., Le Goff, A. Microfluidic monitoring of the growth of individual hyphae in confined environments. Royal Society Open Science. 7 (8), 191535 (2020).
- Aleklett, K., Ohlsson, P., Bengtsson, M., Hammer, E. C. Fungal foraging behaviour and hyphal space exploration in micro-structured Soil Chips. The ISME Journal. 15 (6), 1782-1793 (2021).
- Aleklett, K., et al. Build your own soil: exploring microfluidics to create microbial habitat structures. The ISME Journal. 12 (2), 312-319 (2018).
- Ellett, F., Jorgensen, J., Frydman, G. H., Jones, C. N., Irimia, D. Neutrophil interactions stimulate evasive hyphal branching by Aspergillus fumigatus. PLOS Pathogens. 13 (1), 1006154 (2017).
- Massalha, H., Korenblum, E., Malitsky, S., Shapiro, O. H., Aharoni, A. Live imaging of root-bacteria interactions in a microfluidics setup. Proceedings of the National Academy of Sciences of the United States of America. 114 (17), 4549-4554 (2017).
- Schmieder, S. S., et al. Bidirectional propagation of signals and nutrients in fungal networks via specialized hyphae. Current Biology. 29 (2), 217-228 (2019).
- Tayyrov, A., Stanley, C. E., Azevedo, S., Künzler, M. Combining microfluidics and RNA-sequencing to assess the inducible defensome of a mushroom against nematodes. BMC Genomics. 20 (1), 243 (2019).
- Stanley, C. E., Grossmann, G., Casadevall i Solvas, X., deMello, A. J. Soil-on-a-Chip: microfluidic platforms for environmental organismal studies. Lab on a Chip. 16 (2), 228-241 (2016).
- Stanley, C. E., vander Heijden, M. G. A. Microbiome-on-a-Chip: new frontiers in plant-microbiota research. Trends in Microbiology. 25 (8), 610-613 (2017).
- Ortseifen, V., Viefhues, M., Wobbe, L., Grünberger, A. Microfluidics for biotechnology: bridging gaps to foster microfluidic applications. Frontiers in Bioengineering & Biotechnology. 8, 589074 (2020).
- Jansson, J. K., Hofmockel, K. S. The soil microbiome-from metagenomics to metaphenomics. Current Opinion in Microbiology. 43, 162-168 (2018).
- Stanley, C. E., et al. Probing bacterial-fungal interactions at the single cell level. Integrative Biology (Camb). 6 (10), 935-945 (2014).
- Gimeno, A., et al. A versatile microfluidic platform measures hyphal interactions between Fusarium graminearum and Clonostachys rosea in real-time. Communications Biology. 4 (1), 262 (2021).
- Duffy, D. C., McDonald, J. C., Schueller, O. J. A., Whitesides, G. M. Rapid prototyping of microfluidic systems in poly(dimethylsiloxane). Analytical Chemistry. 70 (23), 4974-4984 (1998).
- Stanley, C. E., et al. Fabrication and use of the dual-flow-RootChip for the imaging of Arabidopsis roots in asymmetric microenvironments. Bio-protocol. 8 (18), 3010 (2018).
- Choi, C. -. H., Lee, H., Weitz, D. A. Rapid patterning of PDMS microfluidic device wettability using syringe-vacuum-induced segmented flow in nonplanar geometry. ACS Applied Materials & Interfaces. 10 (4), 3170-3174 (2018).
- Sanders, E. R. Aseptic laboratory techniques: plating methods. Journal of Visualized Experiments. (63), e3064 (2012).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Harting, R., et al. Pseudomonas strains induce transcriptional and morphological changes and reduce root colonization of Verticillium spp. Frontiers in Microbiology. 12, 652468 (2021).
- Boenisch, M. J. . Structural and molecular characterisation of the penetration process of Fusarium graminearum during Fusarium head blight infection. , (2013).
- Eynck, C., Koopmann, B., Grunewaldt-Stoecker, G., Karlovsky, P., von Tiedemann, A. Differential interactions of Verticillium longisporum and V. dahliae with Brassica napus detected with molecular and histological techniques. European Journal of Plant Pathology. 118 (3), 259-274 (2007).
- Ghanem, N., Stanley, C. E., Harms, H., Chatzinotas, A., Wick, L. Y. Mycelial effects on phage retention during transport in a microfluidic platform. Environmental Science & Technology. 53 (20), 11755-11763 (2019).
- Alrifaiy, A., Lindahl, O. A., Ramser, K. Polymer-based microfluidic devices for pharmacy, biology and tissue engineering. Polymers. 4 (3), 1349-1398 (2012).
- Duncombe, T. A., Tentori, A. M., Herr, A. E. Microfluidics: reframing biological enquiry. Nature Reviews Molecular Cell Biology. 16 (9), 554-567 (2015).
- Hoelzle, D., et al. Microfluidic device design, fabrication, and testing protocols. Protocol Exchange. , (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved