A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
ביוריאקטור פרפוזיה מרובה זרמים משולב עם פיצול מוצא לתרבית תאים דינמית
In This Article
Summary
מאמר זה מציג שיטה לבנייה והפעלה של מערכת תרבית תאים רב-ערוצית רב-ערוצית בעלות נמוכה למדידת הדינמיקה של הפרשה וקצבי ספיגה של מומסים בתהליכים תאיים. המערכת יכולה גם לחשוף תאים לפרופילי גירוי דינמיים.
Abstract
תפקודים מסוימים של תאים ורקמות פועלים בסולם הזמן הדינמי של דקות עד שעות שנפתרות בצורה גרועה על ידי מערכות תרביות קונבנציונליות. עבודה זו פיתחה מערכת ביוריאקטורים של פרפוזיה בעלות נמוכה המאפשרת להחדיר את מדיום התרבית באופן רציף למודול תרבית תאים ולפצל אותו במודול במורד הזרם כדי למדוד דינמיקה בקנה מידה זה. המערכת בנויה כמעט כולה מחלקים זמינים מסחרית וניתן להקביל אותה כדי לערוך ניסויים עצמאיים בלוחות תרבית תאים קונבנציונליים מרובי בארות בו זמנית. מאמר וידאו זה מדגים כיצד להרכיב את מערך הבסיס, הדורש רק משאבת מזרק רב-ערוצית אחת ואספן שברים שונה כדי להחדיר עד שש תרבויות במקביל. כמו כן, מוצגות גרסאות שימושיות על העיצוב המודולרי המאפשרות דינמיקת גירוי מבוקרת, כגון פולסים מומסים או פרופילים דמויי פרמקוקינטיים. חשוב לציין, כאשר אותות מומסים נעים במערכת, הם מעוותים עקב פיזור מומס. יתר על כן, מתוארת שיטה למדידת התפלגויות זמן המגורים (RTDs) של רכיבי הגדרת הזלוף באמצעות עקיבה באמצעות MATLAB. RTDs שימושיים לחישוב האופן שבו אותות מומסים מעוותים על ידי הזרימה במערכת מרובת התאים. מערכת זו חזקה מאוד וניתנת לשחזור, כך שחוקרים בסיסיים יכולים לאמץ אותה בקלות ללא צורך במתקני ייצור מיוחדים.
Introduction
תהליכים ביולוגיים חשובים רבים מתרחשים בתרביות תאים ורקמות על ציר הזמן של דקות עדשעות 1,2,3. בעוד שחלק מהתופעות הללו עשויות להיות נצפות ומתועדות באופן אוטומטי באמצעות מיקרוסקופיה בהילוך מהיר4, ביולומינסנציה1 או שיטות אחרות, ניסויים הכוללים איסוף דגימות-על של תרביות לצורך אנליזה כימית מבוצעים לעתים קרובות באופן ידני בתרביות תאים סטטיות. דגימה ידנית מגבילה את ההיתכנות של מחקרים מסוימים בשל אי הנוחות של נקודות זמן דגימה תכופות או לאחר שעות העבודה. חסרונות נוספים של שיטות תרבית סטטיות כוללים ניסויים הכוללים חשיפות מבוקרות וחולפות לגירויים כימיים. בתרביות סטטיות, יש להוסיף ולהסיר גירויים באופן ידני, ופרופילי הגירוי מוגבלים לשינויי צעדים לאורך זמן, בעוד ששינויים בינוניים גם מוסיפים ומסירים רכיבים בינוניים אחרים, שיכולים להשפיע על תאים באופן בלתי מבוקר5. מערכות נוזליות יכולות להתגבר על אתגרים אלה, אך מכשירים קיימים מציבים אתגרים אחרים. התקנים מיקרופלואידיים מגיעים עם העלויות הגבוהות של ציוד מיוחד והכשרה לייצור ושימוש, דורשים שיטות מיקרואנליטיות לעיבוד דגימות, ותאים קשים להתאושש מהמכשירים לאחר זלוף6. מעט מערכות מקרופלואידיות נוצרו עבור סוגי הניסויים המתוארים כאן 7,8,9,10, והן בנויות ממספר חלקים מותאמים אישית המיוצרים בתוך הבית ודורשים משאבות מרובות או אספני שברים. יתר על כן, המחברים אינם מודעים למערכות תרביות תאי פרפוזיה מקרופלואידיות הזמינות באופן מסחרי, למעט ביוריאקטורים של מיכלים מעורבבים לתרבית השעיה, אשר שימושיים לייצור ביולוגי, אם כי אינם מיועדים למידול וחקר פיזיולוגיה.
המחברים דיווחו בעבר על תכנון של מערכת ביוריאקטור פרפוזיה בעלות נמוכה המורכבת כמעט כולה מחלקים מסחרייםזמינים 11. גרסת הבסיס של המערכת מאפשרת לשמור תרביות מרובות בלוחית באר בחממת CO2 ולחדור באופן רציף עם מדיום ממשאבת מזרק, בעוד שזרמי המדיום השפכים מהתרביות מחולקים באופן אוטומטי לדגימות לאורך זמן באמצעות אספן שברים עם שינוי מותאם אישית. לפיכך, מערכת זו מאפשרת דגימה אוטומטית של תרבית בינונית סופר-נאטנטית וקלט מומס רציף לתרבויות לאורך זמן. המערכת היא מקרופלואידית ומודולרית וניתנת לשינוי בקלות כדי לענות על הצרכים של תכנוני ניסוי חדשניים.
המטרה הכוללת של השיטה המוצגת כאן היא לבנות, לאפיין ולהשתמש במערכת תרביות תאים פרפוזיה המאפשרת ניסויים שבהם נמדדים שיעורי ההפרשה או הקליטה של חומרים על ידי תאים לאורך זמן, ו/או תאים נחשפים לאותות מומסים מדויקים וחולפים. מאמר וידאו זה מסביר כיצד להרכיב את מערך הבסיס, המסוגל לחדור עד שש תרביות תאים בו זמנית באמצעות משאבת מזרק אחת ואספן שברים שונה. שתי גרסאות שימושיות במערכת הבסיס שעושות שימוש במשאבות ובחלקים נוספים כדי לאפשר ניסויים שחושפים את התאים לאותות ריכוז מומס חולפים, כולל פולסים קצרים ופרופילים דמויי פרמקוקינטיים12, מוצגים גם הם באיור 1.
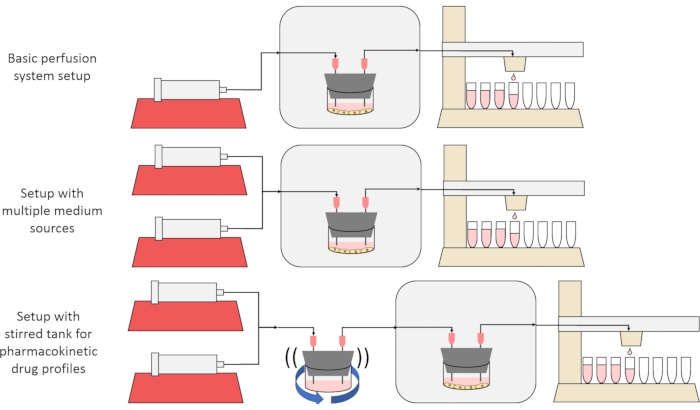
איור 1: שלוש וריאציות על תכנון מערכת הזלוף. (באמצע) מערכת הזלוף עם סטופקוק למספר מקורות בינוניים. (למטה) מערכת הזלוף עם מיכל מעורבב כדי לחקות נפח מעורבב היטב של התפלגות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
עקב פיזור ודיפוזיה בתוך הזרימה, אותות המומס מתעוותים או "נמרחים" כשהם נעים במערכת הזרימה. ניתן לכמת עיוות זה באמצעות שימוש בהתפלגויות זמן מגורים (RTDs)13. מאמר זה מסביר כיצד לבצע ניסויי מעקב על רכיבים של מערכת הזלוף (איור 2), ומספק סקריפטים של MATLAB ליצירת RTDs מנתונים שנמדדו. הסבר מפורט לניתוח זה ניתן למצוא במאמרם הקודם של המחברים11. סקריפטים נוספים של MATLAB מתאימים לפונקציות המתאימות ל-RTDs ומחלצים פרמטרים פיזיקליים, ומבצעים קונבולוציה של אותות אות באמצעות RTDs כדי לחזות כיצד קלט אות המומס על ידי המשתמש יפיץ ויעוות דרך מערכת הזלוף14.
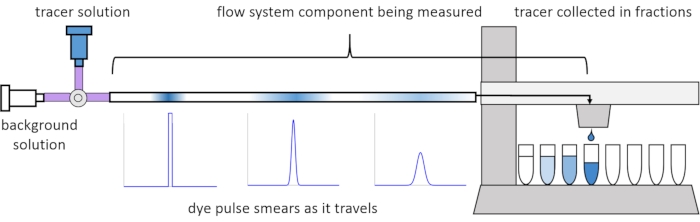
איור 2: התפלגויות זמן מגורים. ה-RTDs של רכיבי מערכת הזרימה, כגון אורך זה של צינורות, נמדדים על ידי הזנת פולס של עוקבים למערכת ומדידת האופן שבו הוא "נמרח" עד שהוא יוצא לשברים שנאספו. נתון זה שונה מ-Erickson et al.11. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. הכינו חלקים לזלוף צלחות היטב
- הכנת צינורות
- חותכים שני אורכים של צינורות סיליקון (קוטר פנימי של 1.6 מ"מ) כדי שכל תרבית תאים תיחרב. ודא שהיצירה המשמשת כצינור במעלה הזרם ארוכה מספיק כדי להגיע ממשאבת המזרק לתרבית התאים בתוך האינקובטור, ושהחלק במורד הזרם יכול להגיע מתרבית התאים למיקום המורחב הרחוק ביותר של אספן השברים.
- תנו לכל פיסת צינורות תווית ייחודית בשני קצותיו עם סרט דביק מסומן.
- הכינו פקקים לצלחת הבאר
- קבל פקק סיליקון אחד עבור כל באר של צלחת הבאר להיות perfused, עם קוטר מתאים כדי להתאים snuggly לתוך הבארות עם אטם אטום.
- חותכים את החומר העודף מתחתית הפקק כך שהם יתאימו לבארות תוך השארת מקום בפנים לאוויר מעל רמת הנוזל המיועדת.
- דוחפים שתי מחטים קהות של 18 גרם דרך כל פקק, לתוך החלק העליון והחוצה מלמטה כדי לשמש ככניסה ויציאה לזרימה דרך הבאר, זה מול זה באופן מוחלט כדי למקסם את המרחק בין קצותיהן בתוך הבאר.
- התאימו את הגבהים של המחטים בתוך הבאר המחוברת, שכן גובה מחט היציאה יקבע את הגובה היציב של רמת הנוזלים בבאר במהלך הזלוף.
הערה: אם הזלוף מתחיל עם מחט היציאה מעל רמת הנוזל, הנוזל יצטבר בבאר עד שהרמה תגיע למחט. אם מתחילים את הזלוף עם מחט היציאה מתחת לרמה הנוזלית, רמת הנוזל תישאר יציבה אלא אם כן בועות אוויר יזרמו לתוך הבאר, מה שיגרום לגובה הנוזלי לרדת עד שהוא יהיה באותו גובה כמו מחט היציאה.
- אסוף חלקים נוספים
- קבל מזרק סטרילי אחד עבור כל תרבית תאים להיות perfused כי הוא גדול מספיק כדי להכיל מספיק תווך עבור perfusion כולו, בתוספת כמות נוספת של מדיום כדי למלא את הצינורות בתחילה.
- כדי שכל תרבות תזכה לתהודה, השיגו מחברים אחד של נקבה לברב ושני מחברי Luer מזכר לברבר, כמו גם שני כובעי לואר נקביים ושני כובעי לואר זכריים.
- ניקוי ועיקור חלקים
- אם נעשה שימוש בחלקים בעבר, נקו אותם על ידי הצמדתם ל-0.1 N NaOH, ולאחר מכן שטיפה במים שעברו דה-יוניזציה.
- על ידי autoclaving או אחר, להבטיח את העקרות של כל החלקים המפורטים לעיל.
2. חותכים בלייזר את המתקן מרובה הראשים ומחברים אותו לאספן שברים
- צור מחדש את מודל המתקן מרובה הראשים מאיור 3 בתוכנית תכנון בעזרת מחשב או הורד את קובץ ה-DXF של הדגם שסופק (קובץ משלים 1).
- השתמש בחותך לייזר כדי לחתוך את העיצוב מ 1/8 גיליון אקריליק.
- הסר את שלושת הברגים המחברים את ראש החלוקה לבסיס הנע של אספן השברים.
- יישרו את שלושת החורים הקטנים ביותר במתקן מרובה הראשים עם חורי הברגים בבסיס הנע, והברגו את הברגים בחזרה דרך החורים כדי להתחבר.
- התאם את ההידוק של שלושת הברגים כדי לכוון את המתקן מרובה הראשים למעלה ולמטה עד ששורת חורי החלוקה מיושרת עם צינורות האיסוף שמתחתיו.
- יש להניח בזהירות את קצוות הפיפטה של 300 μL דרך החורים הרצויים כדי לשמש כטיפים לחלוקה.
הערה: ניתן להשתמש באספן השברים ללא מתקן מרובה הראשים כדי לחדור תרבית תאים בודדת.
3. מדוד RTDs של רכיבים ובצע קונבולוציה של אותות
- הגדירו משאבות ומזרקים לדופק של עוקבים, כפי שמוצג באיור 2.
- קבל שתי משאבות מזרק חד-ערוציות או רב-ערוציות.
- בחר פתרון רקע שייצג את המדיום שישמש במערכת הזרימה במהלך ניסויים בתרביות תאים. ודא שלפתרון הרקע יש תכונות העברת מסה דומות למדיום. במקרים רבים, מים שעברו דה-יוניזציה הם בחירה מתאימה.
- בחר חומר עוקב שייצג את המומס שיעניין אותו במהלך ניסויים בתרביות תאים. ודא שלמעקב יש תכונות העברת מסה דומות למומס העניין, וריכוזו חייב להיות מסוגל להימדד. במקרים רבים, צבע מזון הוא בחירה מתאימה.
- ממיסים את חומר העקיבה בתמיסת הרקע כדי ליצור את תמיסת העקיבה.
- מלאו מזרק אחד בתמיסת רקע וטענו אותו למשאבת מזרק אחת. מלאו מזרק נוסף בתמיסת מעקב וטענו אותו למשאבת המזרק השנייה.
- חברו את שני המזרקים לשתיים מתוך שלוש היציאות של תחנה בעלת ארבעה כיוונים באמצעות מחברי Luer.
- סגור את ה-stopcock לתמיסת הרקע ושאב את תמיסת העקיבה לתוך ה-stopcock עד שהוא מתחיל לטפטף החוצה מהיציאה הפתוחה. עצור את המשאבה ואל תכוונן את המזרק עוד יותר.
הערה: חשוב שהמוט הנע של משאבת המזרק יידחף כלפי מעלה כנגד בוכנות המזרק לפני תחילת החלקים המתוזמנים של הניסוי. זה יאפשר לזרימה להתחיל מיד עם הפעלת המשאבה. אחרת, ניתן להתחיל את המשאבה, אך הזרימה לא תתחיל למעשה עד שהמוט הנע יתפוס את מיקום הבוכנה. - סגור את ה-stopcock לתמיסת העקיבה ושאב את תמיסת הרקע לתוך ה-stopcock עד שכל תמיסת המעקב השיורית תשטוף מהיציאה הפתוחה. עצור את המשאבה ואל תכוונן את המזרק עוד יותר.
- הגדרת רכיב מערכת הזרימה המעניין ואת אספן השברים
- הגדר את רכיב מערכת הזרימה הרצוי לניתוח RTD. ודא שהרכיב שיימדד מסתיים בפיסת צינור במורד הזרם באורך ובגמישות מתאימים כדי להגיע למלקט השברים במהלך הפעולה.
- הכנס את קצה הצינורות במורד הזרם למתקן קצה פיפטה במתקן מרובה הראשים כך שהוא מחובר בצורה מתכרבלת.
- חברו את היציאה הפתוחה של ה-stopcock בעל ארבעת הכיוונים לכניסה של הרכיב שיש למדוד. תמיסת הרקע של המשאבה דרך הרכיב עד שהיא מתמלאת לחלוטין כפי שהיא הייתה יכולה להיות במהלך ניסוי תרבית תאים, והיא מתחילה לטפטף מתוך קצה חלוקת השברים. עצרו את המשאבה.
- הזריקו דופק עקיבה, אספו שברים ומדדו את העקיבה
- הגדר את המשאבה עבור תמיסת המעקב לקצב הזרימה הרצוי. סגור את ה-stopcock לתמיסת הרקע והתחל את הזרימה של תמיסת העקיבה. במקביל, הפעל את אספן השברים.
- המשך את זרימת תמיסת העקיבה למשך פרק זמן קצר כדי להעריך קלט דחף של העקיבה. נמצא כי משך פולס של 10 דקות עובד היטב עבור RTDs בקצב זרימה של 1 מ"ל/שעה.
הערה: אם פעימת המעקב קצרה מדי, לא מספיק עוקב ייכנס לזרימה כדי להיות ניתנת למדידה. אם הדופק ארוך מדי, הוא כבר לא יעריך דחף וישנה את צורת ה- RTD. - בסוף תקופת הדופק של תמיסת המעקב, עצרו את משאבת תמיסת העקיבה. סגור במהירות את ה- stopcock לפתרון המעקב והתחל את הזרימה של תמיסת הרקע באותו קצב זרימה.
- אפשרו לפתרון הרקע לזרום ולאסוף שברים עד שכל העקיבה תעבור דרך המערכת ולתוך השברים שנאספו.
- עצרו את המערכת ומדדו את ריכוז העקיבה בשברים. לכלול רק שברים שניתנו לחלוטין. אם האוסף נעצר באופן חלקי באיסוף של שבר, אל תכלול שבר זה.
- חישוב התפלגות זמן המגורים (RTD) מנתונים שנמדדו ב- MATLAB
הערה: הסבר בכתב על הניתוח שבוצע על ידי כתב MATLAB זה ניתן למצוא בפרסום הקודם של המחברים11, ודיונים על התיאוריה זמינים באופן נרחב בספרות13.- הפק קובץ .xlsx המכיל את נתוני הריכוז בתבנית הגיליון האלקטרוני example_tracer_data.xlsx המסופק בקובץ משלים 2. הזן את ערכי הריכוז של העקיבה בשברים (כל יחידה) בסדר כרונולוגי משמאל לימין בשורה 2. הזן את הזמן שחלף מתחילת הדופק ועד סוף השבר האחרון בתא A5, והזן את אורך פולס העקיבה בדקות בתא A8.
- שמור את קובץ .xlsx בספריית MATLAB.
- פתח את הסקריפט RTD_From_Data.m, מתוך קובץ משלים 3, בעורך MATLAB.
- החלף את שם הקובץ .xlsx בסוגריים בשורה הראשונה של המקטע טען נתונים של קובץ ה- Script בשם קובץ הנתונים החדש .xlsx, בהתאם להוראות הכתובות בקובץ ה- Script. הפעל את הסקריפט.
- ודא שהסקריפט מבצע בהצלחה ניתוח RTD13, מפיק תרשים של RTD ומחזיר את הערך של האינטגרל המספרי מעל RTD השווה ל- 1. מצא את וקטור הזמן (t) ואת וקטור ערכי RTD המשויך (Et) שנשמר על-ידי הסקריפט לספריית MATLAB.
- התאמת פונקציית מודל ל- RTD ב- MATLAB
- פתח את הסקריפט Fit_RTD_Function.m בעורך MATLAB מתוך קובץ משלים 4.
- בחר אחת משלוש פונקציות המודל שצוינו כדי להתאים ל- RTD: מודל הפיזור הצירי13, המתאים ל- RTDs לזרימה למינרית בצינורות גליליים; דגם CSTR13, שמתאים למיכלים מעורבבים היטב; ודגם n-CSTR15, שמתאים בערך ללוחות באר גדולים יותר. כדי להתאים לדגם אחר שאינו כלול כאן, הוסף אותו לסקריפט באותה תבנית.
- הסר את ההערות במקטע של הסקריפט המכיל את הדגם שנבחר להתאמה.
- שנה את הערכים של הניחושים הראשוניים עבור הפרמטרים לאלה המתאימים ל- RTD.
- הפעל את קובץ ה- Script כדי להפיק תרשים של שכבת-העל של פונקציית ההתאמה על נתוני RTD וכדי להדפיס את ערכי הפרמטרים המתאימים עבור הפונקציה. אם ההתאמה גרועה מאוד או שמתרחשות שגיאות, שנה את הניחושים הראשוניים של הפרמטר והפעל שוב את הסקריפט.
- ביצוע קונבולוציה של אות ב- MATLAB
- בחר אות אחד ו- RTD אחד או שני RTD כדי להתפתל.
- פתח את הסקריפט Signal_Convolution.m, מתוך קובץ משלים 5, בעורך MATLAB.
- כדי שכל אחד משני האותות יהיה מפותל (כלומר, אות אחד ו-RTD אחד, או שני RTD), הגדירו וקטור אחד של נקודות זמן במרווחים שווים ביחידות הרצויות ווקטור מתאים של ערכי אות בזמנים אלה.
הערה: הווקטורים של שני האותות חייבים לכלול את אותו מספר אלמנטים ואת אותו גודל שלבי זמן. זו הסיבה שכדאי שה-RTD יהיה פונקציה רציפה שניתן לדגום עבור מספר שרירותי של נקודות בכל מרווח זמן. - הזן את שני האותות לתוך MATLAB והפעל את הסקריפט כדי לקבל את וקטורי הזמן והאות של אות הפלט.
4. הגדירו את מערכת הזלוף הבסיסית עם תאים בצלחת באר
- הכינו את צלחת הבאר
- ודא שלתרבית צלחת הבאר יש את העומק הבינוני המתאים לניסוי הזלוף. בצע כל שינוי סופי במדיום, גירויים או שלבים אחרים לפי הצורך לפני תחילת הזלוף. אם מחלחלים לתאי ההשעיה, יש לבצע צנטריפוגה בצלחת כדי לוודא שהם נמצאים בתחתית.
- בתנאים סטריליים, מכניסים את הפקקים עם המחטים לתרביות הצלחת של הבאר עם המחטים נמשכות למעלה. לאחר שהפקק נמצא במקומו, הורידו את המחטים לגובה הרצוי לזלוף, שכן גובה מחט היציאה קובע את רמת הנוזל היציבה.
- מכסים את המחטים בכובעים של לואר זכר ושומרים את כל צלחת הבאר באינקובטור עד לשימוש.
- הכינו את המזרקים ואת הצינורות במעלה הזרם
- בתנאים סטריליים, מלאו מזרק אחד כדי שכל תרבית תוטמע עם מספיק מדיום למשך הזמן הרצוי של הזלוף, בתוספת מספיק מדיום נוסף כדי למלא את הצינורות במעלה הזרם.
- חברו את הצינורות במעלה הזרם למזרק באמצעות מחבר Luer מנקבה לבר. בקצה השני של הצינור, הכנס מחבר Luer מזכר לבר.
- מחלקים את המדיום מהמזרק עד שהצינור במעלה הזרם מתמלא כולו במדיום.
- מכסה את הקצה הפתוח של הצינור עם כובע לואר נקבה.
הערה: כל המזרקים המשוכפלים חייבים לכלול בדיוק את אותו נפח בשלב זה. אם הנפחים שלהם אינם שווים, הבוכנות שלהם יהיו במיקומים שונים, ולא כולם ישתלבו היטב במשאבת מזרק רב-ערוצית אחת.
- בתנאים סטריליים, הכניסו מחבר Luer מזכר לבר לתוך קצה אחד של הצינורות במורד הזרם, וכיסו אותו בכובע לואר נקבי.
- הביאו בזהירות את כל הצינורות המוכנים, המזרקים וצלחת הבאר לחממה שתשמש לזלוף.
- מקם את משאבת המזרק ואת אספן השברים במיקומים הרצויים ליד האינקובטור. מניחים את משאבת המזרק על גבי האינקובטור או בסמוך לו, ומניחים את אספן השברים ליד האינקובטור, ליד הנמל.
- חברו יחד את הקצוות המכוסים של כל הצינורות במעלה ובמורד הזרם ודחפו אותם מהחלק החיצוני של האינקובטור פנימה דרך היציאה.
- טען את המזרקים לתוך משאבת המזרק והכנס את הקצוות הפתוחים של הצינורות במורד הזרם לתוך קצות הפיפטה של מתקן רב הראשים של אספן השברים.
- בתוך האינקובטור, משוך כמה שיותר רפיון של הצינורות במעלה הזרם לתוך האינקובטור כדי למקסם את אורך הצינורות שדרכם המדיום הזורם יכול לקבל חום ו- CO2 מאוויר האינקובטור. תוך כדי החזקתם במקומם, משכו את הצינורות במורד הזרם אל מחוץ לאינקובטור, מספיק כדי שיוכלו להגיע לנקודה המורחבת הרחוקה ביותר על אספן השברים תוך שמירה על הקצוות המכוסים בתוך האינקובטור.
- עבור כל באר מחוברת, שחרר במהירות את המחטים ואת הצינורות במעלה הזרם ובמורד הזרם עבור באר זו והתחבר אליהם יחד עם מחברי Luer שלהם.
- לאחר שכל החלקים מחוברים, הפעילו לזמן קצר את משאבת המזרק במהירות גבוהה יחסית כדי להבטיח שכל הנחלים זורמים כראוי.
- בשלב זה, אם רוצים להתחיל את הניסוי עם הצינורות במורד הזרם המלאים בתווך, המשיכו להפעיל את המשאבה עד שהכל יתמלא. אחרת, עצרו את המשאבה.
- הגדר את קצב זרימת משאבת המזרק ואת תדירות איסוף השברים והתחל את שתי המכונות בו זמנית כדי להתחיל את הניסוי. אסוף שברים למשך הניסוי הרצוי.
5. הגדירו את מערכת הזלוף עם סטופקוק למספר מקורות בינוניים
- בצע את כל שלבי המשנה של שלב 4.1 לעיל.
- הכינו את שתי המדיות לשימוש בזלוף, ותייגו את המדיום שיחולק תחילה כ-1, ואת השנייה כבינונית 2.
- כדי שכל תרבית תחול, מלאו מזרק אחד במספיק בינוני 1 למשך החלוקה שלו, בתוספת מספיק נפח כדי למלא בתחילה את מערכת הזלוף. מלאו מזרק שני במספיק בינוני 2 למשך החלוקה שלו.
- חברו את שני המזרקים לשתיים מתוך שלוש היציאות של תחנה בעלת ארבעה כיוונים.
הערה: ייתכן שיהיה צורך באורך של צינורות לחיבור המזרקים לסטופקוקים. - הכינו את הסטופר והמזרקים באופן דומה לצעדים 3.1.7-3.1.8 למעלה על ידי סגירת הסטופר לבינוני 1 וחלוקת מדיום 2 לתוך הסטופר עד שהוא רק מתחיל לטפטף החוצה מהיציאה הפתוחה.
- סגור את הסטופר ל-2 בינוני ותחלק את מדיום 1 לתוך הסטלוק עד שכל שאריות המדיום 2 נשטפו מהיציאה הפתוחה.
- חברו את הצינורות במעלה הזרם ליציאת ה-stopcock הפתוחה באמצעות מחבר Luer מנקבה לבר. בקצה השני של הצינור, הכנס מחבר Luer מזכר לבר.
- מחלקים את מדיום 1 מהמזרק עד שהצינור במעלה הזרם מתמלא כולו במדיום.
- המשך עם שלבים 4.3-4.11 לעיל, העמסת שני המזרקים למשאבות מזרקים נפרדות וחלוקת בינוני 1 בלבד.
- הגדר את קצב זרימת משאבת המזרק עבור בינוני 1 ואת תדירות איסוף השברים, והתחל את שתי המכונות בו זמנית כדי להתחיל את הניסוי.
- כאשר יש להחליף את המקור הבינוני, עצרו במהירות את משאבת המזרק לבינוני 1, סובבו את ה-stopcock ל-medium 1, והתחילו את משאבת המזרק לבינונית 2. אם תרצה בהמשך, החלף את המקור בחזרה לבינוני 1 באופן דומה.
- אסוף שברים למשך הניסוי הרצוי.
6. הגדירו את מערכת הזלוף עם מיכל מעורבב כדי לחקות פרמקוקינטיקה
- קבל נתונים פרמקוקינטיים עבור התרופה המעניינת וודא שהיא מורכבת משיא ריכוז ואחריו דעיכה מעריכית.
- לאחר הגדרת השיא לזמן 0 והסרת נקודות נתונים לפני השיא, השתמש בסקריפט Stirred_Tank_Fit.m (קובץ משלים 6) כדי להתאים את משוואת RTD של המיכל המעורבב לנתונים. קלט v (קצב זרימת ההזזה הרצוי) והנתונים יתאימו כזוג וקטורים ישירות לתוך הסקריפט, יחד עם t ו- C עבור ערכי זמן וערכי ריכוז, בהתאמה. הפעל את הסקריפט כדי להדפיס את הפרמטר V, שהוא נפח המיכל המעורבב הנדרש.
- תכננו פריסה למערכת הזלוף שתכלול שתי משאבות מזרקים ושייקר צלחות במעלה הזרם של האינקובטור.
- מדוד את ה- RTDs של רכיבי מערכת הזלוף מעבר לסטופקוק ובצע את פיתול האותות של ה- RTDs עם משכי דופק וריכוזים שונים של תרופות כדי למצוא פרופיל פרמקוקינטי מתאים. השתמש במשוואת RTD של מיכל מעורבב בהתאמה בחישוב זה.
- המשך עם שלבים 5.1-5.8 לעיל.
- השתמש בלוחית באר נוספת בגודל המתאים כמיכל מעורבב עבור ההתקנה. כל באר עשויה לשמש כמיכל מעורבב לתרבות חדורת תרבות אחת. מלאו את הבאר בנפח הנדרש של בינוני, V, ותקעו את הבאר עם המחטים שנמשכו בתחילה למעלה, ואז נדחפו לתחתית הבאר, ותפסו את המחטים.
- טענו את המזרקים לתוך משאבות המזרקים וחברו במהירות את הצינורות מהמזרקים אל מחטי הכניסה המכוסות של המכלים המעורבבים. לאחר מכן חברו את תרבית התאים במעלה פתחי הצינור למחטי היציאה של המכלים המעורבבים.
- המשך עם שלבים 5.9-5.10.
- בזמן הרצוי, עברו לחלוקת מדיום 2 המכיל את התרופה, כמתואר בשלב 5.11. חזרו לבינוני 1 כאשר עירוי התרופה הושלם.
- המשך עם שלב 5.12.
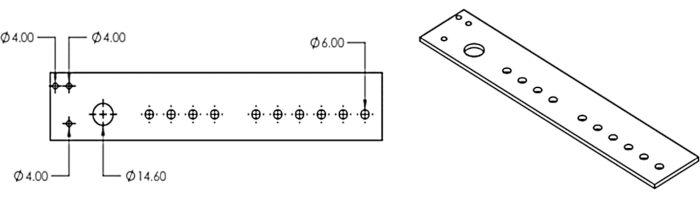
איור 3: המתקן מרובה הראשים. תכנון עבור מתקן רב-ראשים בחיתוך לייזר. נתון זה שונה מ-Erickson et al.11. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
Access restricted. Please log in or start a trial to view this content.
תוצאות
מערכת הזלוף עם מספר מקורות בינוניים מסעיף 5 של הפרוטוקול שימשה למדידת דינמיקת הביטוי של גן מדווח המונעת על ידי גורם הגרעין kappa-light-משפר-שרשרת של גורם שעתוק של תאי B פעילים (NF-κB) בתאי כליה עוברית אנושית 293 (HEK293) בתגובה לפולס של 1.5 שעות של גורם נמק גידול אלפא (TNF-α). תאי HEK293 הומרו ביציבות באמצעות וק?...
Access restricted. Please log in or start a trial to view this content.
Discussion
עבודה זו מתארת את ההרכבה והתפעול של מערכת תרביות תאים פרפוזיה עם מספר מקורות בינוניים שהוכחו באמצעות דוגמה ספציפית שבה נמדדה הדינמיקה של ביטוי גנים מונעי NF-κB בתגובה לדופק חולף של TNF-α. ה-RTDs של רכיבי מערכת הזלוף נמדדו והודגמו, וקונבולוציית האותות שימשה כדי לחזות הן את חשיפת התאים לפולס TNF-α ?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
המחברים מצהירים שאין להם אינטרסים מתחרים.
Acknowledgements
מחקר זה נערך בתמיכה תחת גרנט מס'. R01EB012521, R01EB028782 ו- T32 GM008339 מהמכונים הלאומיים לבריאות.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 18 Gauge 1 1/2- in Disposable Probe Needle For Use With Syringes and Dispensing Machines | Grainger | 5FVK2 | |
| 293T Cells | ATCC | CRL-3216 | HEK 293T cells used in the Representative Results experiment. |
| 96-Well Clear Bottom Plates, Corning | VWR | 89091-010 | Plates for measuring dye concentrations in RTD experiments and GLuc in representative results experiment. |
| BD Disposable Syringes with Luer-Lok Tips, 5 mL | Fisher Scientific | 14-829-45 | |
| BioFrac Fraction Collector | Bio-Rad | 7410002 | Fraction collector that can be used for a single stream, or modified using our method to enable collection from multiple streams. |
| Clear High-Strength UV-Resistant Acrylic 12" x 12" x 1/8" | McMaster-Carr | 4615T93 | This sheet is cut using a laser cutter according to the DXF file in the supplemental materials to produce the multi-head dispenser that can be attached to the BioFrac fraction collector. |
| Coelenterazine native | NanoLight Technology | 303 | Substrate used in Gaussia luciferase bioluminescence assay in representative results. |
| Corning Costar TC-Treated Multiple Well Plates, size 48 wells, polystyrene plate, flat bottom wells | Millipore Sigma | CLS3548 | Used to grow and perfuse 293T cells in representative results. |
| Corning Costar Flat Bottom Cell Culture Plates, size 12 wells | Fisher Scientific | 720081 | Can be plugged and used as a stirred tank to produce pharmacokinetic profiles in perfusion. Can also contain cells for perfusion. |
| DMEM, high glucose | ThermoFisher Scientific | 11965126 | |
| Epilog Zing 24 Laser | Cutting Edge Systems | Epilog Zing 24 | Laser cutter used to produce multi-head dispenser from acrylic sheet. Other laser cutters may be used. |
| Fisherbrand Sterile Syringes for Single Use, Luer-Lock, 20 mL | Fisher Scientific | 14-955-460 | |
| Fisherbrand Sterile Syringes for Single Use, Luer-Lock, 60 mL | Fisher Scientific | 14-955-461 | |
| Fisherbrand Premium Microcentrifuge Tubes: 1.5mL | Fisher Scientific | 05-408-129 | Microcentrifuge tubes for collecting fractions. |
| Fisherbrand Round Bottom Disposable Borosilicate Glass Tubes with Plain End | Fisher Scientific | 14-961-26 | Glass tubes for collecting fractions. |
| Fisherbrand SureOne Micropoint Pipette Tips, Universal Fit, Non-Filtered | Fisher Scientific | 2707410 | 300 ul pipette tips that best fit the multi-head dispenser and tubing to act as dispensing tips. |
| Gibco DPBS, powder, no calcium, no magnesium | Fisher Scientific | 21600010 | Phosphate buffered saline. |
| Labline 4625 Titer Shaker | Marshall Scientific | Labline 4625 Titer Shaker | Orbital shaker used to keep stirred tanks mixed. |
| Masterflex Fitting, Polycarbonate, Four-Way Stopcock, Male Luer Lock, Non-Sterile; 10/PK | Cole-Parmer | EW-30600-04 | Used to join multiple inlet streams for RTD experiments and cell culture experiments. |
| Masterflex Fitting, Polycarbonate, Straight, Female Luer x Cap; 25/PK | Masterflex | UX-45501-28 | |
| Masterflex Fitting, Polypropylene, Straight, Female Luer to Hosebarb Adapters, 1/16" | Cole-Parmer | EW-45508-00 | |
| Masterflex Fitting, Polypropylene, Straight, Male Luer Lock to Hosebarb Adapter, 1/16" ID | Cole-Parmer | EW-45518-00 | |
| Masterflex Fitting, Polypropylene, Straight, Male Luer Lock to Plug Adapter; 25/PK | Masterflex | EW-30800-30 | |
| Masterflex L/S Precision Pump Tubing, Platinum-Cured Silicone, L/S 14; 25 ft | Masterflex | EW-96410-14 | |
| MATLAB | MathWorks | R2019b | Version R2019b. Newer versions may also be used. Some older versions may work. |
| NE-1600 Six Channel Programmable Syringe Pump | New Era Pump Systems | NE-1600 | |
| Rack Set F1 | Bio-Rad | 7410010 | Racks to hold collecting tubes in the fraction collector. |
| Recombinant Human TNF-alpha (HEK293-expressed) Protein, CF | Bio-Techne | 10291-TA-020 | Cytokine used to stimulate 293T cells in representative results. |
| Saint Gobain Solid Stoppers, Versilic Silicone, Size: 00, Bottom 10.5mm | Saint Gobain | DX263015-50 | Fits 48-well plates. |
| Saint Gobain Solid Stoppers, Versilic Silicone, Size: 4 Bottom 21mm | Saint Gobain | DX263027-10 | Fits 12-well plates. |
| Sodium Hydroxide, 10.0 N Aqueous Solution APHA; 1 L | Spectrum Chemicals | S-395-1LT | |
| SolidWorks | Dassault Systems | SolidWorks | CAD software used to create the multi-head dispenser DXF file. |
| Varioskan LUX multimode microplate reader | ThermoFisher Scientific | VL0000D0 | Plate reader. |
| Wilton Color Right Performance Color System Base Refill, Blue | Michaels | 10404779 | Blue food dye containing Brilliant Blue FCF, used as a tracer in RTD experiments. Absorbance spectrum peaks at 628 nm. |
References
- Welsh, D. K., Yoo, S. H., Liu, A. C., Takahashi, J. S., Kay, S. A. Bioluminescence imaging of individual fibroblasts reveals persistent, independently phased circadian rhythms of clock gene expression. Current Biology. 14 (24), 2289-2295 (2004).
- Talaei, K., et al. A mathematical model of the dynamics of cytokine expression and human immune cell activation in response to the pathogen Staphylococcus aureus. Frontiers in Cellular and Infection Microbiology. 11, 711153(2021).
- Kemas, A. M., Youhanna, S., Zandi Shafagh, R., Lauschke, V. M. Insulin-dependent glucose consumption dynamics in 3D primary human liver cultures measured by a sensitive and specific glucose sensor with nanoliter input volume. FASEB Journal. 35 (3), 21305(2021).
- Muzzey, D., van Oudenaarden, A. Quantitative time-lapse fluorescence microscopy in single cells. Annual Review of Cell and Developmental Biology. 25, 301-327 (2009).
- Calligaro, H., Kinane, C., Bennis, M., Coutanson, C., Dkhissi-Benyahya, O. A standardized method to assess the endogenous activity and the light-response of the retinal clock in mammals. Molecular Vision. 26, 106-116 (2020).
- Battat, S., Weitz, D. A., Whitesides, G. M. An outlook on microfluidics: the promise and the challenge. Lab on a Chip. 22 (3), 530-536 (2022).
- Petrenko, V., Saini, C., Perrin, L., Dibner, C. Parallel measurement of circadian clock gene expression and hormone secretion in human primary cell cultures. Journal of Visualized Experiments. (117), e54673(2016).
- Yamagishi, K., Enomoto, T., Ohmiya, Y. Perfusion-culture-based secreted bioluminescence reporter assay in living cells. Analytical Biochemistry. 354 (1), 15-21 (2006).
- Watanabe, T., et al. Multichannel perfusion culture bioluminescence reporter system for long-term detection in living cells. Analytical Biochemistry. 402 (1), 107-109 (2010).
- Murakami, N., Nakamura, H., Nishi, R., Marumoto, N., Nasu, T. Comparison of circadian oscillation of melatonin release in pineal cells of house sparrow, pigeon and Japanese quail, using cell perfusion systems. Brain Research. 651 (1-2), 209-214 (1994).
- Erickson, P., Houwayek, T., Burr, A., Teryek, M., Parekkadan, B. A continuous flow cell culture system for precision cell stimulation and time-resolved profiling of cell secretion. Analytical Biochemistry. 625, 114213(2021).
- Saltzman, W. M. Drug Delivery: Engineering Principles for Drug Therapy. , Oxford University Press. (2001).
- Fogler, H. S. Elements of Chemical Reaction Engineering. 4th edn. , Prentice Hall PTR. Boston. (2006).
- Conesa, J. A. Chemical Reactor Design: Mathematical Modeling and Applications. , Wiley. (2019).
- Toson, P., Doshi, P., Jajcevic, D. Explicit residence time distribution of a generalised cascade of continuous stirred tank reactors for a description of short recirculation time (bypassing). Processes. 7 (9), 615(2019).
- Tamayo, A. G., Shukor, S., Burr, A., Erickson, P., Parekkadan, B. Tracking leukemic T-cell transcriptional dynamics in vivo with a blood-based reporter assay. FEBS Open Biology. 10 (9), 1868-1879 (2020).
- Newell, B., Bailey, J., Islam, A., Hopkins, L., Lant, P. Characterising bioreactor mixing with residence time distribution (RTD) tests. Water Science and Technology. 37 (12), 43-47 (1998).
- Dubois, J., Tremblay, L., Lepage, M., Vermette, P. Flow dynamics within a bioreactor for tissue engineering by residence time distribution analysis combined with fluorescence and magnetic resonance imaging to investigate forced permeability and apparent diffusion coefficient in a perfusion cell culture chamber. Biotechnology and Bioengineering. 108 (10), 2488-2498 (2011).
- Gaida, L. B., et al. Liquid and gas residence time distribution in a two-stage bioreactor with cell recycle. HAL Open Science. , (2008).
- Rodrigues, M. E., Costa, A. R., Henriques, M., Azeredo, J., Oliveira, R. Wave characterization for mammalian cell culture: residence time distribution. New Biotechnology. 29 (3), 402-408 (2012).
- Olivet, D., Valls, J., Gordillo, M. A., Freixó, A., Sánchez, A. Application of residence time distribution technique to the study of the hydrodynamic behaviour of a full-scale wastewater treatment plant plug-flow bioreactor. Journal of Chemical Technology and Biotechnology. 80 (4), 425-432 (2005).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved