A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הדפסה ביולוגית רב-כיוונית קרמית במתלים עמוסי תאים ליצירת אנלוגים לעצם
In This Article
Summary
פרוטוקול זה מתאר טכניקת הדפסה תלת-ממדית לייצור מבנים דמויי עצם על ידי הפקדת דיו סידן פוספט בתמיכה גרעינית מבוססת ג'לטין. אנלוגי עצם מודפסים מופקדים בצורה חופשית, עם גמישות לקציר ישיר של ההדפסה או crosslinking בתוך מטריצת תא חי עבור מבנים multiphasic.
Abstract
מבחינה מבנית, רקמת העצם היא תרכובת אנאורגנית-אורגנית המכילה תאים פעילים מטבולית המוטבעים בתוך מטריצה היררכית ומינרלית מאוד. ארגון זה מאתגר לשכפול בשל הסביבה ההטרוגנית של העצם. הדפסה ביולוגית רב-כיוונית קרמית במתלי תאים (COBICS) היא טכניקת הדפסה ביולוגית מבוססת מיקרוג'ל המשכפלת באופן ייחודי את המבנה המינרלי והתאי של העצם. COBICS מדפיסה מבנים מורכבים ורלוונטיים ביולוגית ללא צורך בחומרי תמיכה להקרבה או בשלבים קשים לאחר העיבוד (למשל, קרינה וסינטר בטמפרטורה גבוהה), שהם שניים מהאתגרים הגדולים ביותר בייצור תוספים של מבנים מחקים עצם. טכניקה זו מתאפשרת באמצעות שחול חופשי של דיו חדשני על בסיס סידן פוספט בתוך תרחיף מיקרוג'ל על בסיס ג'לטין. תכונות עקת התשואה של התרחיף מאפשרות תצהיר ותומכות במבנה העצם המודפס. UV crosslinking וננו-משקעים ואז "נועלים" אותו במקומו. היכולת להדפיס קרמיקה ננו-מובנית של עצם-חיקוי בתוך ביו-חומרים עמוסי תאים מספקת שליטה מרחבית-טמפורלית על ארכיטקטורת מאקרו ומיקרו ומקלה על ייצור בזמן אמת של מבני עצם מורכבים בסביבות קליניות.
Introduction
לעצם יש יכולות התחדשות יוצאות דופן כאחד המבנים הבודדים בגוף שיכולים להחלים על ידי שחזור ההרכב התאי הרגיל שלה, האוריינטציה והחוזק המכני עד לגודל פגם קריטי, כאשר יכולת הריפוי האנדוגנית נפגעת1. העצם, יחד עם הסחוס והרצועות, תומכת ומקלה על תנועת הגוף, תוך אחסון מינרלים ושומנים וייצור תאי דם. כרקמת חיבור קשה וצפופה, העצם מורכבת בעיקר משלב אנאורגני, מים וחומר אורגני המורכב בעיקר מסיבי קולגן2. תאים מוטבעים בתוך מטריצה מינרלית מאוד זו של סיבי קולגן I וגבישי הידרוקסיאפטיט (HA), ויוצרים מבנה היררכי3.
הארגון המורכב של רקמה זו הופך את הייצור של חלופות סינתטיות כדי לשכפל את סביבות המיקרו והננו-סביבה ההטרוגניות של העצם למאתגרות במיוחד3. לשם כך הוצעו מגוון חומרים, כולל ביו-קרמיקה, הידרוג'לים עמוסי תאים וחומרים סינתטיים כפתרונות ליצירת מטריצות עצם. בין טכניקות ייצור הפיגומים, טכניקות מבוססות הדפסה תלת-ממדית התפתחו לאחרונה וקיבלו תשומת לב רבה מקהילת הנדסת הרקמות בשל יכולתן יוצאת הדופן לאפשר ייצור של מבנים מתוחכמים ומדויקים ביותר עם הבטחה גדולה לטיפול ספציפי למטופל 4,5,6 . הידרוג'לים הם הבחירה הפופולרית ביותר של חיקויים של מטריקס וביו-דיו מכיוון שניתן להדפיס אותם יחד עם תאים ומולקולות ביו-אקטיביות, וליצור מבנים פונקציונליים6. עם זאת, הידרוג'לים חסרים את התכונות הפונקציונליות של העצם, כגון חוזק מכני ופאזה אנאורגנית מאוד מסולסלת המכילה תאים פעילים מטבולית.
פיגומים קרמיים מודפסים בתלת-ממד דורשים בדרך כלל שלבים לאחר העיבוד, כולל סינטר, טיפולים בטמפרטורות גבוהות או שימוש בכימיקלים קשים שיש לשטוף ביסודיות לפני יישומי in vitro או in vivo 5. כדי להתמודד עם מגבלות אלה, Lode et al.7 פיתחו לאחרונה משחה מבוססת α טריקלציום פוספט שנוצרה על ידי הידרוקסיאפטיט, שניתן להדפיס ולהגדיר בתנאים פיזיולוגיים. עם זאת, חומר זה עדיין לא יכול להיות מודפס יחד עם תאים חיים כפי שהוא דורש לאחר הטיפול בסביבה לחה ולאחר מכן טבילת תמיסה מימית במשך תקופה ארוכה.
לחלופין, הידרוג'ל עמוס תאים עם חלקיקים אנאורגניים ששולבו הוצע כתחליף למטריצת עצם תלת-ממדית 8,9. למרות יכולתם הרבה לתמוך בחיוניות התאים, הם אינם מסוגלים לשחזר את סביבת רקמת העצם המינרלית הצפופה. Thrivikarman et al.10 אימצו גישה ביומימטית שבה נעשה שימוש במדיום סידן ופוספט על-רווי עם אנלוגיה של חלבון שאינו קולגן כדי לחקות טוב יותר את תצהיר האפטיט הננומטרי. עם זאת, המבנים שלהם עדיין לא יכולים ליצור מבנים תלת-ממדיים קשיחים עם ארכיטקטורה בקנה מידה של מיקרו ומאקרו הדומה לעצם.
המחקר הנוכחי מטפל בליקויים אלה באמצעות פיתוח אסטרטגיית הדפסה לייצור מבנים מחקי עצם, בפאזה אנאורגנית ואורגנית, המסוגלים לשלב הן תאים והן גורמי גדילה11. COBICS משחזר באופן ייחודי את המבנה המינרלי והתאי של העצם באמצעות טכניקת הדפסה ביולוגית מבוססת מיקרוג'ל. הפרוטוקול שלהלן מתאר את תהליך הסינתזה של מיקרו-ג'לים מבוססי דיו עצם וג'לטין ולאחר מכן שילוב תאים המאפשרים COBICS. התהליך מתחיל בסינתזה של החומר המבשר העיקרי של דיו העצם. לאחר מכן, ההידרוג'ל הניתן לקישור צולב מסונתז ונוצר למיקרו-ג'לים. לבסוף, דיו העצם מופקד באופן רב-כיווני באמבט תמיכה של המיקרו-ג'לים העמוסים בתאים (איור 1).
ניתן להדפיס את דיו העצם לתוך כל השעיה של microgels שיש להם את המאפיינים המתאימים תשואה מתח, כלומר, את היכולת fluidize בקצב גזירה מסוים ולאחר מכן לתמוך במבנה המופקד. שתי גישות גמישות הודגמו: תרחיף המורכב ממיקרו-ג'ל ג'לטין ותרחיף המורכב ממיקרו-ג'ל ג'לטין מתקרילט (GelMA). ההשעיה הראשונה מתמוססת כאשר הטמפרטורה עולה ל -37 מעלות צלזיוס, ההטבעה ההפיכה החופשית של טכניקת הידרוג'לים תלויים (FRESH)12, בעוד שהאחרונה יכולה לעבור פוטוקרוסלינק לאחר ההדפסה, למעשה "לתפור" את המיקרוג'לים יחד ולנעול את דיו העצם המודפס במקומו. המחקר הנוכחי מתמקד בשימוש ב-GelMA כמטריצה, שכן הוא מספק את היתרון הייחודי של היכולת לתמוך בצמיחת תאים עם הדפסה באתרה של מבנים מימטיים מורכבים של העצם. בסופו של דבר, גישה זו מאפשרת יצירת מודלים מורכבים של רקמות עם רמות גבוהות של ביומימיקריה והשלכות רחבות על מידול מחלות, גילוי תרופות והנדסה רגנרטיבית.
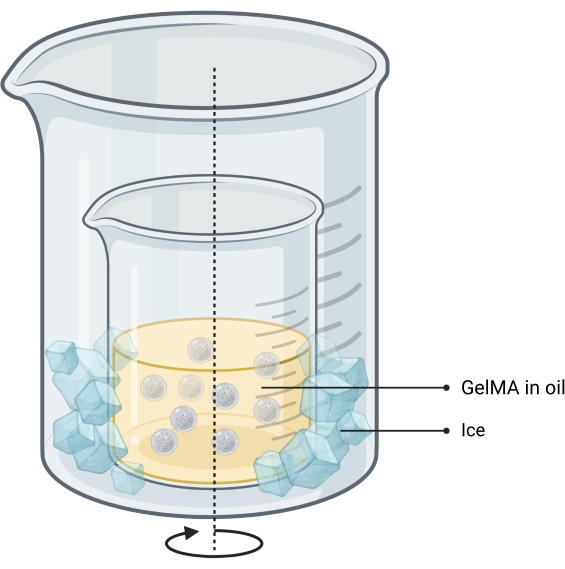
איור 1: סכמטי של זרימת העבודה . (A) דיו העצם מסונתז החל מסינתזה של α-טריקלציום פוספט והשילוב הבא שלה עם גליצרול, פוליסורבט 80 ואמוניום פוספט דו-בסיסי. (B) מיקרו-ג'לים של GelMA מיוצרים בשיטת תחליב המים בשמן. המיקרו-ג'לים המתקבלים הם לאחר מכן (C) מיובשים ו-(D) משולבים עם תאים. לאחר מכן משתמשים בחומרים מרוכבים של תאים-מיקרוג'ל כאמבטיה גרגירית שבה מופקד דיו העצם. (E) המבנה כולו מועבר לאחר מכן להצלבת UV ומועבר לחממה לתרבית. קיצורים: α-TCP = α-טריקלציום פוספט; GelMA =ג'לטין מתקרילט. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
Protocol
1. ייצור דיו עצם
- סינתזה של α-טריקלציום פוספט
- שקלו אבקות סידן מימן פוספט (CaHPO4) וסידן פחמתי (CaCO 3) ביחס טוחן Ca:P של3:2. באמצעות מרית, הומוגניות יסודית של שתי האבקות.
- הוסיפו את תערובת אבקת הסידן מימן פוספט-סידן פחמתי לכור היתוך זירקוניה, כך שהוא לא יותר מ-75% מלא.
הערה: כדי למנוע זיהום, השתמש בכור היתוך חדש או בכור היתוך ששימש בעבר לייצור אותו חומר. לניקוי, יש לשטוף ב-100% אתנול ולייבש באוויר במכסה אדים עד לייבוש מלא לפני הוספת האבקות. - מעבירים את כור ההיתוך לכבשן. מחממים ל-1,400 מעלות צלזיוס בקצב של 5 מעלות צלזיוס לדקה ומחזיקים למשך 3 שעות.
- להרוות את התגובה על ידי הסרת כור ההיתוך מן הכבשן ולהשאיר אותו על גבי בלוק עקשן. תנו לו להתקרר לחלוטין לפני הטיפול.
הערה: יש להשתמש במלקחיים עם כור היתוך באורך מתאים ולהבטיח הגנה מספקת מפני חום. - השתמש טיט ומזיק כדי לשבור ולטחון את עוגת α-TCP כך גרגירים וכתוצאה מכך יש גודל מקסימלי של 200 מיקרומטר.
הערה: השתמש במסננת נירוסטה סטנדרטית כדי להבטיח גודל חלקיקים נכון. - בהמשך טוחנים את הגרגירים באמצעות טחנה פלנטרית בשני שלבים. ראשית, יש להוסיף כדורי זירקוניה מיוצבים 3 מ"מ ביחס משקל של 8:1 כדורים:אבקה, ולאחר מכן 100% אתנול ביחס משקל של 3:1 אתנול:אבקה. הדקו את המכסה וטחנו במשך שעתיים ב-180 סל"ד.
- לאסוף את ההשעיה ולהפריד את הכדורים, באמצעות 100% אתנול לשטיפה.
- מייבשים את המתלה בתנור ב 120 מעלות צלזיוס במשך 24 שעות.
- מוסיפים את האבקה המיובשת לצנצנות הטחינה עם כדורי זירקוניה בקוטר 1 מ"מ ו-100% אתנול באותם יחסי משקל כמו בשלב הראשון. טוחנים במשך שעתיים ב-180 סל"ד, נפרדים ומייבשים.
הערה: הליך הסינתזה כולו מיוצג באיור 1A.
- ניסוח דיו עצם
- כדי ליצור את דיו העצם, הוסיפו 2 גרם אבקת α-TCP לצנצנת טחנת כדורים המכילה 630 מיקרול גליצרול ו-130 מיקרוליטר פוליסורבט 80 תוך ערבוב רציף עם מרית.
- יש להוסיף 100 מ"ג של אמוניום פוספט דו-בסיסי ((NH 4)2HPO4, APD) ולערבב לקבלת תערובת אחידה.
הערה: שאריות מוגזמות של פאזות נוזליות שנותרו על המרית יגרמו לחוסר איזון ביחס בין רכיבי הדיו, ומכאן, לקינטיקה של ההגדרה. - מוסיפים כדור זירקוניה בקוטר 25 מ"מ, מהדקים את המכסה ומניחים אותו בתוך טחנה פלנטרית למשך 60 דקות ב-180 סל"ד, תוך השהיה באמצע הדרך כדי לגרד את דפנות הצנצנת בעזרת מרית.
- באמצעות מרית, טען את הדיו לתוך מזרק 1 מ"ל. יש לעטוף כראוי כדי למנוע מגע עם לחות. יש לאחסן בטמפרטורה של 20°C- אם לא נעשה בה שימוש מיידי.
- אפיון מיקרו-מבנה דיו עצם
- הדפיסו את דיו העצם במים שעברו דה-יוניזציה ואפשרו להגדרה למשך 5 דקות.
- לשטוף את המדגם 3x עם 100% אתנול ולתת לו להתייבש לחלוטין.
- מעיל עם שכבה דקה (עובי 15 ננומטר) של זהב.
- צלם מיקרוגרפים באמצעות מיקרוסקופ אלקטרונים סורק פליטת שדה במתח תאוצה של 5 קילו-וולט.
2. ייצור מתלי מיקרוג'ל להדפסה
- סינתזה של GelMA
הערה: הליך זה נבדק עבור גדלים אצווה המורכבת של 10 גרם ו 20 גרם של ג'לטין. שיטה זו מפרטת מדידות עבור אצווה המשתמשת ב- 10 גרם.- הכינו תמיסה של 10% w/w של ג'לטין מסוג A (חזיר, חוזק פריחה 300) בתמיסת מלח 1x עם אגירת פוספט (PBS) על ידי שקילה של 10 גרם ג'לטין והוספתו לבקבוקון חרוטי עם 90 מ"ל של PBS. מחממים ל-50 מעלות תוך כדי ערבוב עד שהג'לטין מומס לחלוטין.
- מוסיפים 5.796 מ"ל של אנהידריד מתקרילי. מניחים מכסה גומי על הבקבוקון החרוטי וממשיכים לערבב בחושך בטמפרטורה של 50 מעלות צלזיוס למשך 90 דקות.
אזהרה: אנהידריד מתקרילי רעיל בשאיפה או בבליעה והוא מגרה את העור והעיניים. יש לטפל רק בתוך קולט אדים ולהשתמש ב-PPE מתאים. - הרוו את התגובה על ידי דילול תכולת הבקבוקון החרוטי פי שניים באמצעות PBS.
- שקעו בצינורות של 50 מ"ל וצנטריפוגה ב-3,000 × גרם בטמפרטורת החדר למשך 3 דקות כדי להסיר אנהידריד מתקרילי לא פעיל.
- יש להדיח את הסופר-נטנט בתוך צינורות דיאליזה של תאית מנותקת בטמפרטורה של 14 kDa כנגד מים שעברו דה-יוניזציה בטמפרטורה של 40°C למשך 5 ימים, תוך ערבוב עדין. החלף את המים שעברו דה-יוניזציה מדי יום.
- היכונו לאחסון על ידי התרוקנות לתוך צינורות של 50 מ"ל, אבטחת הפקק והכנסתו למקרר למשך 12 שעות. מאחסנים במקרר עד 7 ימים.
- הקפיאו באמצעות חנקן נוזלי ומיד ליופיליז למשך 5 ימים בטמפרטורה של −54 מעלות צלזיוס ו-0.4 mbar.
הערה: ודא שהצינורות מכילים לא יותר מ-40 מ"ל של נוזל בעת הקפאה. לאחר ההקפאה, החליפו את הפקק בכיסוי המאפשר החלפת גזים כגון מגבון משימה עדין מאובטח ברצועה אלסטית. - יש לאחסן את הקצף המתקבל במקפיא בטמפרטורה של −20°C עד שיידרש לסינתזת תרחיף מיקרוג'ל.
- סינתזה של מיקרוג'לים של GelMA
הערה: המיקרו-ג'לים מסונתזים בשיטת תחליב מים בשמן13 (איור 2). שיטה זו נבדקה עבור נפחי תמיסת GelMA של 1-10 מ"ל. ניתן להשתמש באותו פרוטוקול כדי לסנתז מיקרו-ג'לים של ג'לטין המשמשים להדפסת הדפסי עצם עצמאיים.- הכינו תמיסת GelMA של 10% w/w ב-PBS על ידי שקילת ה-GelMA הליופילי, הוספתו לצינור עם PBS וחימום באמבט מים בטמפרטורה של 50°C עד לקבלת לחות מלאה.
- הוסיפו 37 מ"ל שמן לכל 1 מ"ל של תמיסת GelMA לכוס, והבטיחו שהיא לא תהיה מלאה יותר מ-65%.
- התקינו מערכת כפולה על פלטה חמה עם ערבוב מגנטי על ידי הנחת הכוס המכילה שמן בתוך גדולה יותר.
הערה: גודלן של שתי הכוסות צריך להיות כזה שניתן יהיה להפיל קרח בקלות לתוך החלל שבין קירותיהן. ההגדרה מוצגת באיור 2. - מחממים ל-40 מעלות תוך כדי ערבוב.
הערה: ודא שהמערבולת אינה סוערת ובעלת עומק של כשליש מגובה השמן בכוס. - טען את תמיסת GelMA לתוך מזרק והוסף אותה טיפה לתוך שמן הערבוב דרך מסנן של 0.45 מיקרומטר. אפשרו לתחליב להתאזן למשך 10 דקות.
- הפחיתו את הטמפרטורה של האמולסיה ל-15 מעלות צלזיוס כדי לייצב תרמית את הכדורים על ידי הוספת קרח כתוש לחלל שבין שתי הכוסות.
- הוסף אצטון לתחליב המסתובב ביחס נפח של תמיסת GelMA 1:11 לאצטון.
הערה: יש להוסיף את האצטון בעדינות דרך משפך כדי למנוע הפרעה לתחליב. מערבבים במשך 60 דקות. - הדק את תוכן הכוס לתוך צינורות 50 מ"ל, תוך הקפדה לשטוף את קירות הכוס עם אצטון. השאירו למשך 20 דקות כדי לאפשר למיקרוג'לים המיובשים לשקוע לתחתית.
- יש להשליך את הסופרנטנט ולשטוף לפחות 2x עם אצטון.
הערה: הסופרנטנט צריך להיות ברור. - יש לאחד לשפופרת אחת, למלא אצטון ולסוניק במשך 10 שניות. יש לשטוף 2x עם אצטון.
- יש לאחסן באצטון בטמפרטורת החדר עד להצורך בהדפסה.
- הכנת מתלה המיקרוג'ל GelMA להדפסה
- הכינו תמיסה של 1% w/w של GelMA במדיום הנשרים המעובדים (DMEM) של דולבקו על ידי שקילת ג'ל-MA ליופילי לתוך צינור, הוספת DMEM וחימום באמבט מים בטמפרטורה של 50°C עד לקבלת לחות מלאה.
- מאדים את האצטון מהמיקרוג'לים המיובשים ושוקלים את האבקה המתקבלת לתוך צינור. מוסיפים אצטון ומעבירים לסביבה סטרילית.
- כדי ליצור את תמיסת המיקרוג'ל, יש לאדות את האצטון ולהוסיף DMEM, תמיסת GelMA של 1% עם w/w ב-DMEM, ו-2.5% עם ליתיום פניל-2,4,6-טרימתילבנזואיל-פוספינאט (LAP) כדי להשיג חלק אריזה סופי של 30%. יש לתת לחות מלאה למשך 12 שעות לפחות בטמפרטורת החדר. מאחסנים במקרר עד 7 ימים. יש לאפשר הגעה לטמפרטורת החדר לפני השימוש.
הערה: הנפחים של ריאגנטים אלה מבוססים על המשקל היבש של המיקרו-ג'לים וניתן לחשב אותם באמצעות המשוואות בטבלה 1.
| משוואה | |
| x = משקל של מיקרוג'לים יבשים (מ"ג) | |
| נפח של 1% עם GelMA ב-DMEM, a (μL) | a = 21.93x |
| נפח של DMEM, b (μL) | b = 8.773x |
| נפח של 2.5% עם תמיסת LAP, c (μL) | c = 0.6267x |
| נפח כולל של תרחיף מיקרוג'ל המיוצר (μL) | א + ב + ג |
טבלה 1: משוואות לחישוב נפחי הריאגנטים הנדרשים כדי ללחח את מתלי המיקרוג'ל של GelMA. קיצורים: GelMA = ג'לטין מתקרילט; LAP = ליתיום פניל-2,4,6-טרימתילבנזואילפוספינאט.
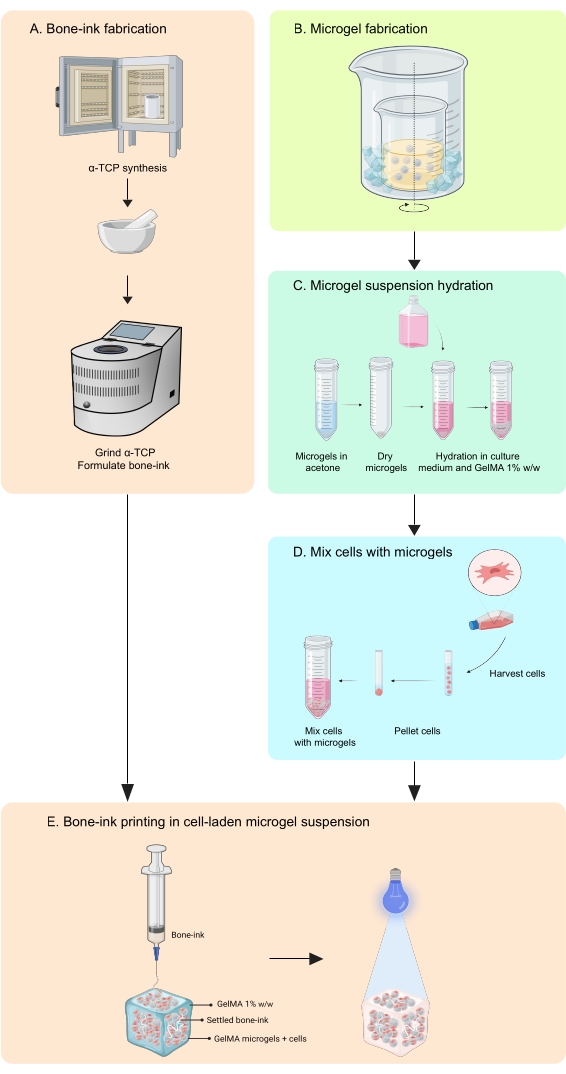
איור 2: סכמת של שיטת תחליב-השמן המשמשת לסינתזת מיקרוג'ל. מערך הכוס הכפולה מראה המכילה את תחליב הערבוב (מסומן בחץ) הממוקם בתוך גדולה יותר כדי לאפשר קירור. קיצור: GelMA = ג'לטין מתקרילט אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
3. הדפסת דיו עצם לתוך מתלי תאים
הערה: מיקרוג'לים מבוססי ג'לטין תומכים בהידבקות של סוגי תאים רבים ושונים, מה שהופך גישה זו למקובלת על תאים בודדים ומרובים בתוך מטריצת המיקרוג'ל. פרוטוקול זה מתאר את הליך השימוש בתאי גזע מזנכימליים (ADSCs) שמקורם בשומן, שכן זהו סוג תא פופולרי וחזק להנדסת רקמות שלד-שריר.
- תרבית את ה-ADSCs ב-DMEM דל גלוקוז בתוספת 10% סרום בקר עוברי ו-1% פניצילין-סטרפטומיצין בטמפרטורה של 37°C ו-5% CO2 עד למפגש.
- נתק את ה- ADSCs מבקבוק תרבית הרקמה על ידי הסרת המדיום, שטיפה עם PBS סטרילי, ודגירה ב 37 °C ו 5% CO2 עם 0.25% טריפסין במשך 3 דקות.
- גלולה את התאים על ידי צנטריפוגה ב 150 × גרם בטמפרטורת החדר במשך 5 דקות.
- לספור את התאים ולחשב 5 × 105 תאים עבור כל 1 מ"ל של מיקרוג'לים GelMA. הקצה את הנפח הנדרש של השעיית התא לצינור נפרד וגלולה כנ"ל.
- בזהירות להסיר supernatant ככל האפשר באמצעות פיפטה, משאיר רק את גלולת התא. הוסף את הנפח הנדרש של תרחיף מיקרוג'ל לכדור ושאף בעדינות כדי להבטיח הפצה שווה של התא.
הערה: אם יש בועות אוויר עודפות במתלים, יש לבצע צנטריפוגה עדינה להסרה ופיפטה למעלה ולמטה כדי לחלק מחדש את התאים. - טען את מתלה המיקרוג'ל עמוס התאים לתוך כור באמצעות פיפטה.
הערה: במחקר הנוכחי הודפסו בתלת-ממד כורים של 10 מ"מ x 10 מ"מ x 3 מ"מ עם קיבולת נפח של 100 μL. - הפקדת דיו עצם באמצעות מזרק 1 מ"ל מצויד במחט 23 גרם.
הערה: ניתן לעשות זאת עם מדפסת תלת-ממד על-ידי התאמה מחדש של מערכת שחול המאפשרת הדפסה ישירות מהמזרק של 1 מ"ל או על-ידי טעינת דיו העצם ישירות לתוך מחסנית ההבלטה של המדפסת (איור 3). - קשר את מבנה המיקרוג'ל של GelMA עמוס התאים והעצמות עם מנורת UV-crosslinker (405 ננומטר) למשך 90 שניות. מעבירים מיד לצלחת באר בגודל מתאים ומכסים ב-DMEM שלם.
הערה: הכורים שהודפסו בתלת-ממד הנ"ל מתאימים ללוחות תרבית תאים של 24 בארות. - דגירה ב-37 מעלות צלזיוס ו-5% CO2. החלף את מדיום התרבות לאחר 24 שעות, ולאחר מכן כל 48-72 שעות לפי הצורך.
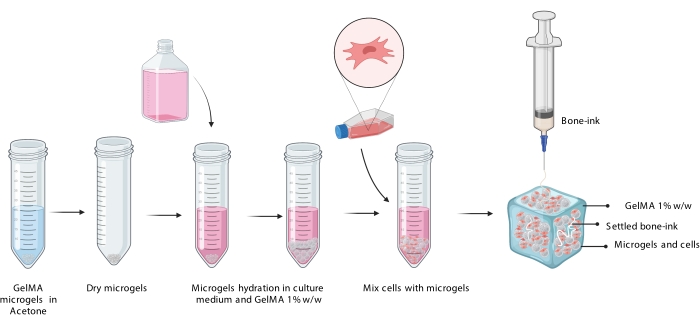
איור 3: ייצוג סכמטי של הליך COBICS המראה את הידרציה של מיקרו-ג'לים, שילוב של תאים, והדפסה מאוחרת יותר של דיו עצם בתרחיף המיקרוג'ל עמוס התאים. קיצור: COBICS = הדפסה ביולוגית רב-כיוונית קרמית בהשעיית תאים; GelMA = ג'לטין מתקרילט. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
4. הערכת כדאיות ושגשוג תאים
- כדי להעריך ציטוטוקסיות של דיו עצם, שמור על מבני COBICS עמוסי תאים במדיום תרבית שלם. בצע בדיקת Live Dead ב-24 שעות, 72 שעות ו-120 שעות (או נקודות זמן רלוונטיות).
- בכל נקודת זמן, לשטוף את המבנים עם PBS, ולאחר מכן להוסיף תמיסה של DMEM ללא פנול המכיל 4 mM קלצין ו 2 mM אתידיום ברומיד. דגירה במשך שעה אחת ב-37 מעלות צלזיוס ו-5% CO2.
- יש לשטוף עם PBS ולהעביר לצלחת עם תחתית זכוכית להדמיה עם מיקרוסקופ קונפוקלי בספקטרום Ex/Em של 494/517 ננומטר ו-528/617 ננומטר.
תוצאות
COBICS מדפיסה מבנים מורכבים ורלוונטיים מבחינה ביולוגית ללא צורך בחומרי תמיכה להקרבה או בשלבים קשים לאחר העיבוד (למשל, קרינה וסינטר בטמפרטורה גבוהה) שהם שניים מהאתגרים הגדולים ביותר בייצור תוספים של מבנים מחקים עצם. כדי להדגים היווצרות COBICS של מבני עצם מורכבים והדפסה משותפת של תאים במתלי מיקר...
Discussion
טכניקת ההדפסה התלת-ממדית COBICS פותחה כדי לאפשר ייצור של מבנים דמויי עצם שעברו מינרליזציה באמצעות שחול לתוך תרחיף מיקרוג'ל הניתן להצלבה המכיל תאים חיים. הטכניקה יושמה על תרחיף מיקרוג'ל מתכלה, והתאים מראים יכולת כדאיות, התפשטות והתמיינות אוסטאוגנית טובה בתוך המערכת11. גורם מרכזי ?...
Disclosures
המחברים מצהירים כי אין להם ניגודי עניינים לחשוף.
Acknowledgements
המחברים מבקשים להודות למועצה הלאומית לבריאות ולמחקר רפואי (מענק מס' GNT1111694 ו-GNT1141602) ולמועצת המחקר האוסטרלית (מענק מס' FT180100417, FL150100060 ו-CE14100036). המחברים מבקשים להודות למתקן ההדמיה הביו-רפואית באוניברסיטת ניו סאות' ויילס. הדמויות נוצרו באמצעות Biorender.com, Adobe Photoshop ו-Adobe Illustrator ויוצאו תחת מנוי בתשלום.
Materials
| Name | Company | Catalog Number | Comments |
| 3D Printer Extruder | Hyrel3D | EMO-25 | |
| 50 mL centrifuge tubes | Falcon | BDAA352070 | |
| Absolute Ethanol 100% Denatured | Chem-Supply | ||
| Acetone | Chem-Supply | 154871 | |
| Alumina crucible | Coors | ||
| Ammonium phosphate dibasic (NaHPO4) | Sigma | A5764 | |
| Autodesk Fusion 360 | Autodesk | ||
| Biosafety cabinet level 2 | |||
| Calcium carbonate | Sigma | 239216 | |
| Calcium hydrogen phosphate (CaHPO4) | Sigma | C7263 | |
| Cell culture flasks | Corning | various volumes used | |
| Cellulose Dialysis Tubes, 14 kDa cut-off | Sigma | D9777 | |
| Centrifuge | Eppendorf | 5430R | |
| Centrifuge | Sigma | 3-16KL | |
| Dispensing Tip, 23 G | Nordson | 7018302 | |
| DMEM, low glucose, pyruvate | Thermo FIsher | 11885084 | |
| DPBS, no calcium, no magnesium | Thermo FIsher | 14190144 | |
| Elevator furnace | Labec | ||
| Engine HR Multihead Printer | Hyrel3D | ||
| Fetal Bovine Serum | Bovogen | ||
| Gelatin type A, from porcine skin | Sigma | G2500 | |
| General Purpose Stainless Steel Tips | Nordson EF | ||
| Glycerol | Sigma | G9012 | |
| Human adipose derived stem cells | ATCC | PCS-500-011 | |
| LSM 800 Confocal Microscope | ZEISS | ||
| Lyophilizer (Alpha 1-4 LDplus) | Christ | 101541 | |
| Magnetic hot plate and stirrer | |||
| Methacrylic anhydride | Sigma | 276685 | |
| Mini 2 Desktop 3D Printer | LulzBot | ||
| Parafilm sealing film | Parafilm | PM996 | |
| Penicillin-Streptomycin | Thermo FIsher | 15140122 | |
| Planetary ball mill | |||
| Planetary ball mill jar | |||
| Polyoxyethylenesorbitan monooleate Tween-80 | Sigma | P6224 | |
| Scanning electron microscope | FEI Nova NanoSEM 450 FE-SEM | ||
| Science Kimwipes Delicate Task Wipers | Kimtech | 18813156 | |
| Stainless steel standard test sieve | |||
| Sunflower Oil | Community Co | ||
| Trypsin-EDTA 0.25% phenol red | Thermo FIsher | 25200056 | |
| ZEN Microscope Software | ZEISS | ||
| Live/Dead viability/ cytotoxicity kit for mammalian cells | Invitrogen | L3224 | |
| DMEM, low glucose, no phenol red | Thermo Fisher | 11054020 |
References
- Bates, P., Ramachandran, M. Bone injury, healing and grafting. Basic Orthopaedic Sciences. The Stanmore Guide. , 123-134 (2007).
- Lin, X., et al. The bone extracellular matrix in bone formation and regeneration. Frontiers in Pharmacology. 11, 757 (2020).
- Reznikov, N., et al. A materials science vision of extracellular matrix mineralization. Nature Reviews Materials. 1, 16041 (2016).
- Kang, H. W., et al. A 3D bioprinting system to produce human-scale tissue constructs with structural integrity. Nature Biotechnology. 34 (3), 312-319 (2016).
- Lin, K., et al. 3D printing of bioceramic scaffolds-Barriers to the clinical translation: From promise to reality, and future perspectives. Materials. 12 (17), 2660 (2019).
- Qu, M., et al. Multi-dimensional printing for bone tissue engineering. Advanced Healthcare Materials. 10 (11), 2001986 (2021).
- Lode, A., et al. Fabrication of porous scaffolds by three-dimensional plotting of a pasty calcium phosphate bone cement under mild conditions. Journal of Tissue Engineering and Regenerative Medicine. 8 (9), 682-693 (2014).
- Bernal, P. N., et al. Volumetric bioprinting of complex living-tissue constructs within seconds. Advanced Materials. 31 (42), 1904209 (2019).
- Diloksumpan, P., et al. Combining multi-scale 3D printing technologies to engineer reinforced hydrogel-ceramic interfaces. Biofabrication. 12 (2), 025014 (2020).
- Thrivikraman, G., et al. Rapid fabrication of vascularized and innervated cell-laden bone models with biomimetic intrafibrillar collagen mineralization. Nature Communications. 10 (1), 3520 (2019).
- Romanazzo, S., et al. Synthetic bone-like structures through omnidirectional ceramic bioprinting in cell suspensions. Advanced Functional Materials. 31 (13), 2008216 (2021).
- Hinton, T. J., et al. Three-dimensional printing of complex biological structures by freeform reversible embedding of suspended hydrogels. Science Advances. 1 (9), 1500758 (2015).
- Phromsopha, T., Baimark, Y. Preparation of starch/gelatin blend microparticles by a water-in-oil emulsion method for controlled release drug delivery. International Journal of Biomaterials. 2014, 829490 (2014).
- Moreno, D., et al. Solid-state synthesis of alpha tricalcium phosphate for cements used in biomedical applications. Boletín de la Sociedad Española de Cerámica y Vidrio. 59 (5), 193-200 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved