A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
שימוש בביזקציה להפחתת דנ"א מיטוכונדריאלי בביצית בקר
* These authors contributed equally
In This Article
Summary
כאן אנו מציגים פרוטוקול להפחתה משמעותית של מספרי העתקת הדנ"א המיטוכונדריאלי בביצת בקר (P < 0.0001). שיטה זו משתמשת בצנטריפוגה ובביסקציה כדי להפחית באופן משמעותי את המיטוכונדריה של הביציות ועשויה לאפשר סיכוי מוגבר להתפתחות בעוברי ההעברה הגרעינית של תאים סומטיים בין-מיניים משוחזרים.
Abstract
העברה גרעינית של תאים סומטיים בין-מיניים (iSCNT) עשויה לשמש להצלת מינים בסכנת הכחדה, אך שתי אוכלוסיות נפרדות של דנ"א מיטוכונדריאלי (mtDNA) קיימות בתוך העובר המשוחזר: אחת בתוך האופלסמה של המקבל ואחת בתוך התא הסומטי התורם. הטרופלזמה מיטוכונדריאלית זו עלולה להוביל לבעיות התפתחותיות בעובר ובעובר. פרוטוקולי שיבוט בעבודת יד כוללים ביסוס ביציות של ביציות, שניתן להשתמש בהן כדי להקטין את מספר העותקים של mtDNA, ובכך להפחית את מידת ההטרופלזמה המיטוכונדרית בעובר משוחזר. צנטריפוגה של ביציות בקר בוגרות ומבוגרות יצרה שבר נראה לעין של צפיפות מיטוכונדריה בקוטב אחד של הביצית. zonae pellucidae של ביציות הוסרו על ידי חשיפה לתמיסת פרונאז. ביזקציה בוצעה באמצעות מיקרובלייד כדי להסיר את שבר המיטוכונדריה הנראה לעין. qPCR שימש לכימות ה-mtDNA הקיים בדגימות דנ"א שחולצו מביציות שלמות ואופלסטים חתוכים, וסיפק השוואה בין מספרי העותקים של mtDNA לפני ואחרי הביזקציה. מספרי העותקים חושבו באמצעות ערכי סף מחזור, נוסחת קו רגרסיה של עקומה סטנדרטית ויחס שכלל את הגדלים המתאימים של מוצרי mtDNA PCR ומוצרי PCR גנומיים. לביצית בקר אחת היה מספר עותק mtDNA ממוצע (סטיית תקן ±) של 137,904 ± 94,768 (n = 38). לאופלסט אחד המדולדל ממיטוכונדריה היה מספר עותקים ממוצע של mtDNA של 8,442 ± 13,806 (n = 33). עותקי mtDNA ממוצעים שנכחו באופלסט עשיר במיטוכונדריה היו 79,390 ± 58,526 עותקי mtDNA (n = 28). ההבדלים בין ממוצעים מחושבים אלה מצביעים על כך שהצנטריפוגה והביסקציה שלאחר מכן יכולים להקטין באופן משמעותי את מספרי העותקים של mtDNA הקיימים באופלסט המדולדל ממיטוכונדריה בהשוואה לביצית המקורית (P < 0.0001, שנקבעה על ידי ANOVA חד-כיווני). הירידה ב-mtDNA אמורה להפחית את מידת ההטרופלזמה המיטוכונדריאלית בעובר משוחזר, וייתכן שהיא מעודדת התפתחות עוברית ועוברית סטנדרטית. תוספת עם תמצית מיטוכונדריאלית מתא התורם הסומטי עשויה גם היא להיות חיונית להשגת התפתחות עוברית מוצלחת.
Introduction
העברה גרעינית של תאים סומטיים (SCNT) כוללת היתוך של ביצית מפוחית אחת ותא סומטי מבעל חיים מאותו המין. ברוב המקרים, הביצית והתא הסומאטי מגיעים מאותו המין, ושיעורי הילודה החיה נמוכים מ-6%1. חלק מהמחקרים כוללים שימוש ב-SCNT בין-מיני (iSCNT), הכולל מיזוג של תא סומטי וביצית שמקורם בשני מינים שונים. במחקרים אלה, שיעורי הילודה החיה נמוכים אף יותר מאשר ב-SCNT - בדרך כלל פחות מ-1%1. עם זאת, ל-iSCNT יש את היכולת לשמש כשיטה להצלת מינים בסכנת הכחדה, שכן תאים סומטיים מבעלי חיים אלה נגישים יותר מתאי הנבט שלהם1. ביציות מקבלות המשמשות ב- iSCNT הן לעתים קרובות מיני מעבדה ביתיים או נפוצים, כגון פרות, חזירים ועכברים. כמה ניסיונות שנעשו עד כה הניבו בהצלחה חיים צעירים, אם כי הצאצאים שהופקו היו בעלי חיים תוך-גנריים (מיני הביציות המקבלים ומיני התאים התורמים היו חברים מאותו סוג)2,3,4. מודלים בין-גנריים (המשתמשים בביצה ותא סומטי מבעלי חיים בסוגים שונים) עדיין לא הניבו בעלי חיים חיים, ורוב העוברים המשוחזרים נעצרים בשלב של 8-16 תאים בהתפתחות במבחנה 5,6,7,8. הסבר אפשרי אחד למעצר התפתחותי עוברי זה הוא התרחשות של הטרופלזמה מיטוכונדריאלית בעוברים - נוכחות של יותר מסוג דנ"א מיטוכונדריה אחד (mtDNA) בתא בודד. הטרופלזמה יכולה להוביל לבעיות כגון חוסר יעילות התפתחותית או כשל בעובר או בחיה החיה1. פתוגנזה יכולה להתרחש גם מאוחר יותר בחייו של החיה9. למרות שבעיה זו קיימת גם אצל צאצאי SCNT, המרכיב הבין-ספציפי בעוברי iSCNT מחריף את הבעיה.
כאשר ה-mtDNA העוברי מגיע משני מינים שונים, המיטוכונדריה של הביציות המקבלות, המייצגות את הרוב, אינן פועלות ביעילות או ביעילות עם גרעין התא התורם 1,10. פערים טקסונומיים גדולים יותר בין שני המינים המשמשים ב-iSCNT ככל הנראה מעצימים בעיה זו; צאצאים חיים תוך-גנריים שהופקו (צאצאי Bos gaurus ו-Bos indicus באמצעות ביציות Bos taurus), כמו גם צאצאים שהופקו באמצעות SCNT מסורתי (למשל, צאצאי Ovis aries באמצעות ביציות של Ovis aries) הוכחו ככימרות (mtDNA משני פרטים היה נוכח בחיות אלה 11,12,13). עם זאת, הם התפתחו הרבה יותר רחוק מעוברי SCNT הבין-גנריים14,15. חילופי המידע בין המיטוכונדריה של הביצית לבין גרעין התא התורם יכולים להיות מוצלחים יותר בעובר התוך-גנרי מאשר בעובר הבין-גנרי16.
כמות ה-mtDNA בביצית שור בוגרת גדולה בערך פי 100 מהכמות שנמצאה בתא סומטי אחד12. הפחתת יחס זה עשויה לעודד את המיטוכונדריה של התאים הסומאטיים להתרבות בתוך העובר המשוחזר, מה שיאפשר לאוכלוסייה גדולה יותר של מיטוכונדריה יצרנית להיות נוכחת16. זה בתורו יכול לספק יותר אנרגיה כדי לענות על הדרישות של העובר המתפתח15. ניסיונות קודמים שנעשו להפחית את מספר העותקים של mtDNA של הביצית או העובר כוללים יישום כימי, מיקרומניפולציה, והשלמת הביצית או העובר עם מיטוכונדריה נוספת ממיני התאים התורמים 16,17,18,19,20. עם זאת, יישום כימי (כגון 2',3'-dideoxycytidine) אינו אידיאלי להתפתחות עוברית, והפחית את מספר העותקים של mtDNA של הביציות בכמחצית18. הפחתה קודמת של mtDNA בביציות על ידי מיקרומניפולציה הסירה רק 64% בממוצע מה-mtDNA17 של הביצית. אף על פי שהתוספת של מיטוכונדריה של תאים תורמים יכולה להיות אפשרות מעשית, השימוש בה עדיין לא הניב חיה בין-גנרית חיה במחקרי iSCNT21.
השימוש בביזקציה להפחתת מספר העותקים של mtDNA של הביציות עדיין לא שימש במחקרים שפורסמו. חיתוך ביציות מתוך כוונה למזג את האופלסטים עם תא סומטי הוא הנחת היסוד של שיבוט בעבודת יד (HMC), אשר בדרך כלל משתמשת בביזקציה כשיטה להסרת גוף הקוטב וצלחת המטאפאזה מהביצית מטאפאזה II (MII). HMC ייצרה בהצלחה צאצאים בכמה מינים, כולל עזים, בקר, חזירים, כבשים וסוסים 22,23,24,25,26, אך בדרך כלל אינה כוללת שלב צנטריפוגה לפני הביזקציה. שילוב צנטריפוגה במהירות גבוהה של הביצית מאפשר בידוד של מיטוכונדריה (ולכן mtDNA) בקוטב אחד של הביצית, אשר לאחר מכן ניתן לחתוך באמצעות microblade כדי להסיר את אותם שברים צפופי מיטוכונדריה. לאחר מכן ניתן למזג שני אופלסטים מדולדלים ממיטוכונדריה עם תא סומטי, כפי שקורה ב-HMC, כדי ליצור עובר משוחזר המכיל הרבה פחות mtDNA ממיני הביציות.
השאלה שאנו מנסים לענות עליה באמצעות פרוטוקול זה היא כיצד להפחית את mtDNA בביצת הבקר על מנת לייצר עובר משוחזר בר קיימא המכיל פחות mtDNA הטרופלסמי. בפרוטוקול זה, הביציות היו צנטריפוגות וחתכו. מספרי העותקים של אופלסט וביצית שלמים mtDNA חושבו כדי לקבוע את היעילות של טכניקה זו בהפחתת מספר העותקים mtDNA של הביצית הבקר.
Access restricted. Please log in or start a trial to view this content.
Protocol
הפרוטוקול הבא תואם את הנחיות הטיפול בבעלי חיים והאתיקה שסופקו על ידי אוניברסיטת יוטה סטייט.
1. הכנת מדיה
- לפני הטיפול בביציות, הכינו את הפתרונות הבאים, כמתואר בטבלה 1: 400 μL של תמיסת היאלורונידאז, 500 μL של מדיית T2, 1,020 μL של מדיית T20 ו-800 μL של מדיית T10.
- חלקו את מדיית T10 לשתי בארות של צלחת בעלת ארבע בארות, 400 מיקרול' לבאר. תייג באר אחת עם "M" ואת השנייה היטב עם "MR". מניחים בחממת CO2 של 5% עד לאחר ההדבקה.
- הכן 500 μL של Cytochalasin B (CB) / נוזל אובידוקטל סינתטי עם HEPES (HSOF). Aliquot 50 μL של תמיסת CB/HSOF לתוך צינור צנטריפוגה נפרד של 1.5 מ"ל.
- הכן 40 μL של פתרון Pronase. צנטריפוגה במשך 30 שניות לפחות ב-2,680 x גרם. מערבבים 20 μL של הסופרנאטנט עם 20 μL של T2 לצינור צנטריפוגה חדש; זה יוצר תמיסת פרונאז מדוללת של 5 מ"ג/מ"ל.
- הכן 3 מ"ל של HSOF. על לוחית חיפוש, בנפרד להפקיד ארבע טיפות 400 μL; הניחו את הצלחת הזו מתחת לסטריאומיקרוסקופ.
- הכן 500 μL של פתרון CB/T20.
2. התבגרות חוץ גופית (IVM) של ביציות בקר
- IVM: קומפלקסים של קומולוס-ביציות (COCs) בשאיפה לתרבית ב-38.5 מעלות צלזיוס בחממת CO2 של 5% למשך 21 שעות במנה בת ארבע בארות של מדיית התבגרות המכילה 10% FBS, 0.26 IU/mL FSH ו-100 פניצילין/סטרפטומיצין U/mL.
- בצע את השלבים הבאים כדי להוקיע את הביציות.
- אסוף את המספר הרצוי של ה- COCs באמצעות פיפטה של 200 μL, והפקיד אותם בתחתית צינור צנטריפוגה של 1.5 μL.
- הוסיפו את אותו נפח של 0.6 מ"ג/מ"ל היאלורונידאז לצינור הצנטריפוגה עם הביציות (כלומר, אם נפח הביציות ומדיה IVM הוא 100 μL, הוסיפו 100 μL של היאלורונידאז).
- פיפט את התמיסה למעלה ולמטה מבלי ליצור בועות, עד שכל תאי הקומולוס הוסרו.
- בדוק את ההבשלה של הביציות.
- השתמשו בפיפטה כדי להוסיף 200 μL של HSOF מאחת מארבע טיפות ה-HSOF שעל צלחת החיפוש לתמיסת הביציות/היאלורונידאז.
- העבירו את הביציות מהטיפה של היאלורונידאז/HSOF והניחו אותן ב-400 μL של טיפת HSOF שאינה בשימוש. שטפו אותן בשתי טיפות HSOF נוספות כדי לסייע בהסרת שאריות תאי היאלורונידאז וקומולוס.
- באמצעות פיפטה בפה (או פיפטה וקצה של 10 μL) והגדלה מיקרוסקופית גבוהה, מגלגלים ובוחרים את הביציות על סמך נוכחות הגוף הקוטבי.
- לאחר מיון הביציות, אספו את המספר הרצוי של ביציות MII שיש לחתוך, והניחו אותן ב-400 μL של טיפת HSOF.
הערה: אם הביציות היו מחוץ לחממה במשך יותר מ -30 דקות, ניתן להכניס את הביציות בחזרה לבאר של מדיית התבגרות ולהניחן באינקובטור מבוקר CO2 כדי לנוח לפחות 30 דקות. הגבל את מספר הביציות שיש לכרות לסכום שניתן לכרות אותו לכמות שניתן לסיים את הכריתה תוך כ-30 דקות כדי למזער את הזמן מחוץ לדגירה. אם יש למזג את האופלסטים עם תא סומטי, להפעילם ולתרבות אותם כעוברים, יש לעטוף ביציות בשלב זה את הביציות.
3. צנטריפוגה של הביציות
הערה: אם ביציות הונחו באינקובטור במדיית ההבשלה, העבירו אותן לטיפה של HSOF שממנה הן נאספו לאחרונה.
- באמצעות פיפטה בפה, אספו את הביציות הבוגרות שנבחרו מטיפת HSOF, והכניסו אותן לצינור בגודל 1.5 מ"ל המכיל 50 μL של תמיסת HSOF/CB. צנטריפוגה הביציות ב 15,000 x g במשך 12 דקות.
הערה: זה לא מזיק שבועות יהיו נוכחות בצינור הצנטריפוגה. - בזמן שהביציות עוברות צנטריפוגות, הכינו את צלחת הביזקציה.
- הכינו את התבנית כפי שמוצג באיור 1 על המכסה של צלחת פטרי 60 מ"מ (20 μL לכל טיפה), וכסו את הטיפות בשמן מינרלי באופן מלא.
- באמצעות טוש בעל קצה דק, סמנו את הקווים שמתחת לצלחת, כפי שמוצג באיור 2.
- ציירו תיבה סביב טיפת הפרונאז וקו בין טיפות CB/T20 לשורה התחתונה של טיפות T20.
- מכסים את המנה במכסה אטום עד להשלמת הצנטריפוגה כדי למנוע שינויים באוסמולאריות של מיקרו-טיפות.
- ברגע שהצנטריפוגה הושלמה, השתמשו בפיפטה של 200 μL כדי לאסוף את הביציות בתוך התמיסה, והעבירו אותן לחלק ריק של לוחית חיפוש חדשה עם ארבע טיפות HSOF של 400 μL.
- לאסוף ולשטוף את הביציות דרך ארבע טיפות HSOF.
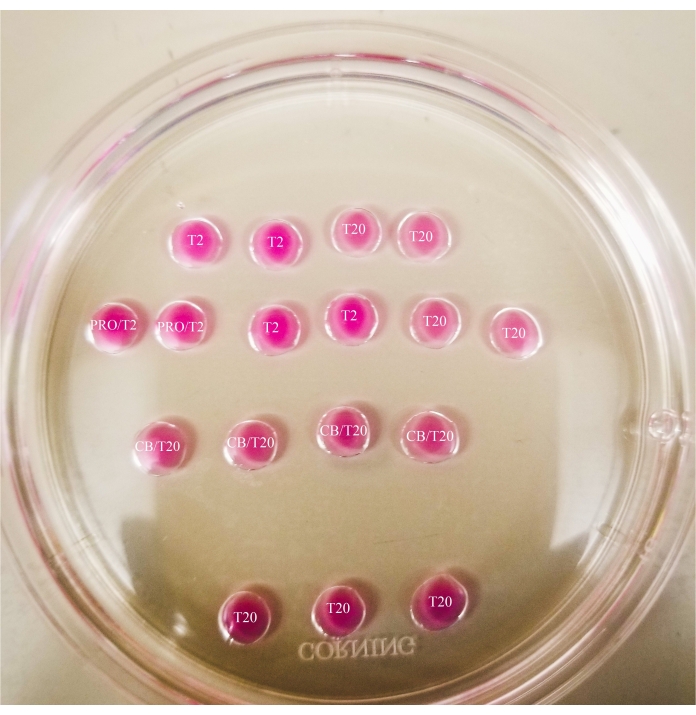
איור 1: צלחת ביזקציה. כל הטיפות המוצגות הן בעלות נפח של 20 μL. לצלחת קוטר של 60 מ"מ. הטיפות כוסו לחלוטין בשמן מינרלי. ביציות יוצבו תחילה בטיפה T2 העליונה והשמאלית ביותר (המצוין כאן עם כוכב). PRO/T2: 10 μL של פרונאז ו-10 μL של T2, בשילוב לפני יצירת מיקרו-טיפות. CB/T20: 1 μL של ציטוכלאסין B לכל 1 מ"ל של T20, בשילוב לפני יצירת מיקרו-טיפות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
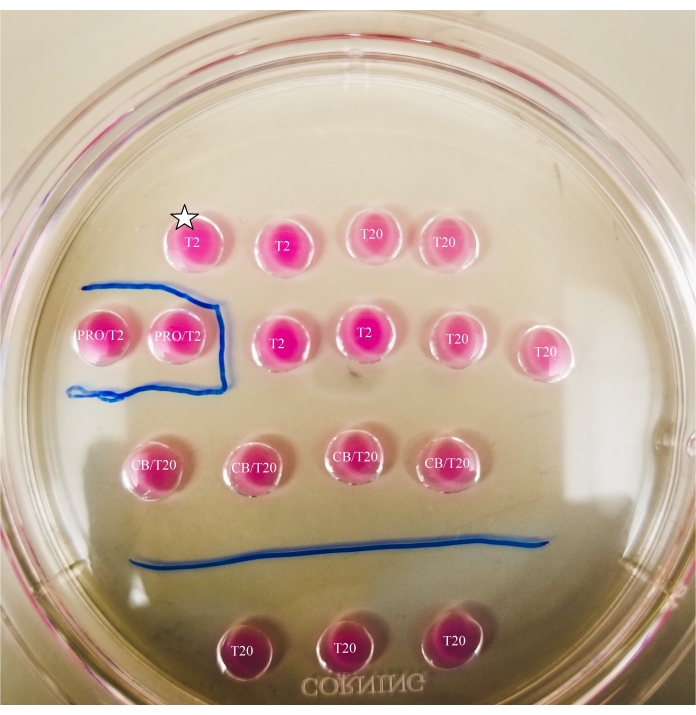
איור 2: לוחית בייסציה מסומנת. הקווים משורטטים עם סמן בעל קצה דק בתחתית הלוח, כדי לספק הפניות מיקום לתצפיות והעברות ביציות ואופלסטים שנעשו מתחת למיקרוסקופ. ביציות יוצבו תחילה בטיפה T2 העליונה והשמאלית ביותר (המצוין כאן עם כוכב). אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
4. הכנת הביצית לביסוס
הערה: התהליך הבא כולל הכנת הביציות לביזקציה.
- הפעל את שלב החימום ל-37 מעלות צלזיוס.
- השתמש בפיפטה בפה כדי להזיז את הביציות הצנטריפוגיות מטיפת HSOF לטיפה השמאלית העליונה T2 של צלחת הביזקציה, ולאחר מכן לשטוף את הביציות דרך שלוש הטיפות הבאות בשורה העליונה (T2, T20, T20, T20).
- להפקיד את הביציות באחת מטיפות הפרונאז, תוך הבטחה שאין כמעט מגע ביניהן.
הערה: הסרת zona pellucida יכולה לקחת כמויות משתנות של זמן, אך מתרחשת בדרך כלל בין 30-120 שניות עם השימוש בשלב חימום. היעדר שלב חימום יתארך הפעם. - התבוננו בביציות עד שיהיה עיוות ברור של ה-zonae pellucidae (ראו איור 3).
- ברגע שביצית בודדת zona pellucida התעוותה, העבירו את הביצית הזו לטיפה T2 השכנה. יש לחזור על הפעולה כאשר ביציות נוספות מתעוותות, עד שכל הביציות הוסרו מהפרונאז והונחו בטיפת T2.
- התבוננו בביציות עד שנותרה רק שכבה דקה של האזור פלוצ'ידה.
- שטפו את הביציות דרך שלוש הטיפות הבאות בתוך השורה (T2, T20, T20, T20), ואז הפקידו אותן בקווים אנכיים בתוך טיפות ה-CB/T20 (ראו איור 4).
- התחילו עם פחות ביציות בקווים האנכיים והגדילו את מספר הביציות בכל טיפה ככל שכישורי הביזיקציה מתקדמים.
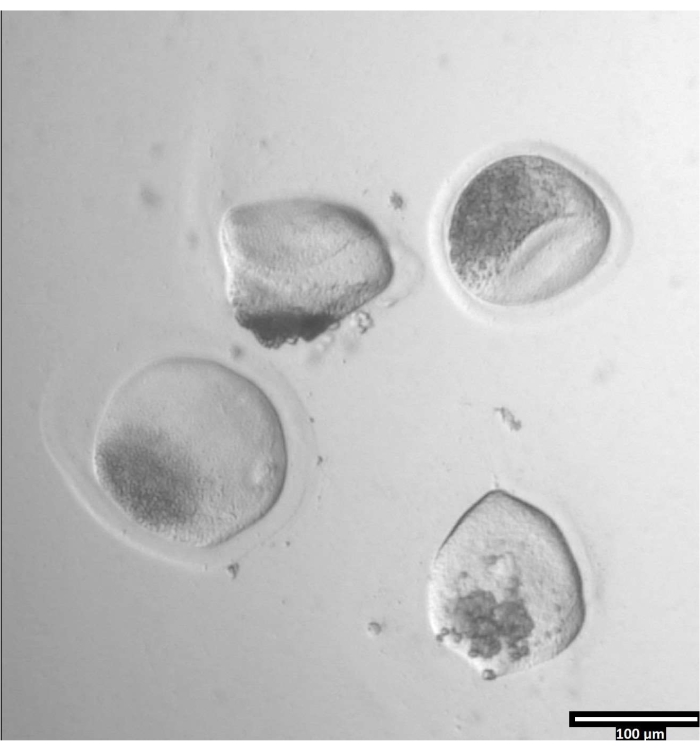
איור 3: הסרת zona pellucida באמצעות pronase. (80x) ביצית zona pellucida תתחיל להיראות מעוותת כאשר הפרונאז השפיע על הזונה פלוצ'ידה מספיק כדי שהביצית תועבר לטיפה T2 הסמוכה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 4: אוריינטציה של ביציות בטיפות ביזקציה. (80x) ביציות ללא מופקדות בכיוון כמעט אנכי בתוך כל טיפת CB/T20 לפני הביזקציה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
5. ביזקציה של הביציות
- התמקדו בטיפה הראשונה, השמאלית ביותר של CB/T20 (ביזקציה) המכילה ביציות, והשתמשו בפיפטה בפה כדי לסובב את הביציות, כך שהחלק הצפוף במיטוכונדריה של כל ביצית פונה לכיוון זרוע המיקרוסקופ או הרחק ממנה.
הערה: החלק הדחוס במיטוכונדריה לא יכיל שומנים, המופיעים כחלק הכהה ביותר של הביצית בעקבות צנטריפוגה. - הנח את קצה המיקרובלייד משמאל לביצית העליונה ביותר, בקו אחד עם החלל ישירות מעל החלק הצפוף במיטוכונדריה. תוך שמירה על קצה הלהב באותו מקום, הנמיכו בזהירות את הלהב כדי לחתוך עד הסוף דרך הביצית.
- יש לוודא כי האופלסט הצפוף במיטוכונדריה והאופלסט המוקטן במיטוכונדריה דומים בגודלם; bisection צריך לחתוך כל ביצית לשניים כדי לייצר שני ooplasts.
הערה: גדלים השוואתיים של אופלסטים המיוצרים מביציה בודדת עשויים להשתנות בהתאם למטרות המחקר; אם יש למזג אופלסטים מופחתי מיטוכונדריה עם תא סומטי, נפחם צריך להיות גדול יותר מהאופלסטים הצפופים במיטוכונדריה." - ודא שהלהב חוצה את הביצית מעל החלק הצפוף במיטוכונדריה ומתחת לחלק הדחוס בשומנים, בקטע הברור ביותר של הביצית הצנטריפוגית.
- יש לוודא כי האופלסט הצפוף במיטוכונדריה והאופלסט המוקטן במיטוכונדריה דומים בגודלם; bisection צריך לחתוך כל ביצית לשניים כדי לייצר שני ooplasts.
- בעת הרמת הלהב, ודא שאותו קו נשמר, וכי קצה הלהב נשאר באותו מקום, ולאחר מכן הרם בעדינות את הקצה מהצלחת.
- חזור על שלבי בייסקציה עבור כל הביציות בתוך טיפת הביזקציה הראשונה. אם ביציות נמצאות בטיפות נוספות, מכוונות וחותכות את הביציות הנותרות.
- באמצעות פיפטה בפה, אספו אופלסטים מופחתי מיטוכונדריה מהטיפה הראשונה של הביסקציה. מקם אותם בטיפה השמאלית T20 הממוקמת בשורה התחתונה של הצלחת. יש לחזור על הפעולה עבור כל טיפות הביסציה הנותרות.
הערה: אופלסטים מופחתי מיטוכונדריה יכילו שומנים, שצבעם כהה יותר משאר הביצית. - באמצעות פיפטה בפה, אספו אופלסטים צפופי מיטוכונדריה מטיפת הביזקציה הראשונה. מקם אותם בטיפת T20 הימנית הממוקמת בשורה התחתונה של הצלחת. יש לחזור על הפעולה עבור כל טיפות הביסציה הנותרות.
הערה: לאזורים צפופי מיטוכונדריה תהיה קונגלומרציה נראית לעין של אברונים שיהיו אפורים בהירים במראה. - שלפו את המנה T10 עם ארבע בארות מהחממה. באמצעות פיפטה בפה, העבירו את כל האופלסטים המופחתים במיטוכונדריה אל הבאר המסומנת "MR", והעבירו את האופלסטים הצפופים במיטוכונדריה אל הבאר המסומנת "M".
- החזירו את צלחת ארבעת הבארים לחממה הנשלטת על ידי CO2. אפשרו לאופלסטים לנוח לפחות 30 דקות לפני כימות mtDNA.
6. כימות של mtDNA
- השתמשו בערכת מיצוי דנ"א שנועדה לחלץ חומר מדגימה קטנה כדי לחלץ דנ"א מדגימות בודדות (ביציות בודדות, אופלסטים בודדים צפופי מיטוכונדריה, אופלסטים בודדים המדולדלים ממיטוכונדריה).
- השתמש בשיטת כימות דנ"א לפי בחירה כדי להבטיח שהדנ"א יופק בהצלחה מכל דגימה. אם תגובת שרשרת פולימראז כמותית (qPCR) לא תושלם באותו זמן, הקפיאו את הדנ"א שחולץ בצינור מסומן במקפיא של -80 מעלות צלזיוס.
- ביצוע qPCR
- עיין בטבלה 2 כדי לקבוע את הנפח של כל מגיב כדי להוסיף לכל צינור qPCR, יחד עם רצפי הפריימרים. פריימרים אלה נועדו להגביר את אזור 12S של mtDNA בקר.
- קבע את זמן הדנטורציה הראשוני למשך 10 דקות, ואחריו 35 מחזורים של: 30 שניות של דנטורציה ב-94 מעלות צלזיוס, 15 שניות של חישול ב-60 מעלות צלזיוס, ו-15 שניות של הארכה ב-72 מעלות צלזיוס. כאשר התגובה הושלמה, רשום את ערכי סף המחזור (Ct).
הערה: על מנת לקבל ערכי מספר עותק mtDNA יחסיים, יש להפיק עקומה סטנדרטית באמצעות דגימות עם כמויות ידועות של מספרי עותק mtDNA, הגדלים באופן אקספוננציאלי. לאחר מכן יש לתפעל את ערכי סף המחזור באמצעות הנוסחאות הבאות כדי לקבוע מספרי עותקים יחסיים של mtDNA. - קבל את ריכוז הדנ"א באמצעות המשוואה שלהלן:
ריכוז הדנ"א = (10(Ct-יירוט/שיפוע)) x נפח נבדק - קבל את מספר העותק באמצעות המשוואה שלהלן:
מספר העתקה =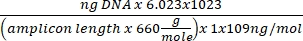
- קבל את מספר העותק באמצעות המשוואה שלהלן:
מספר העתקה לתא = 2 x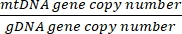
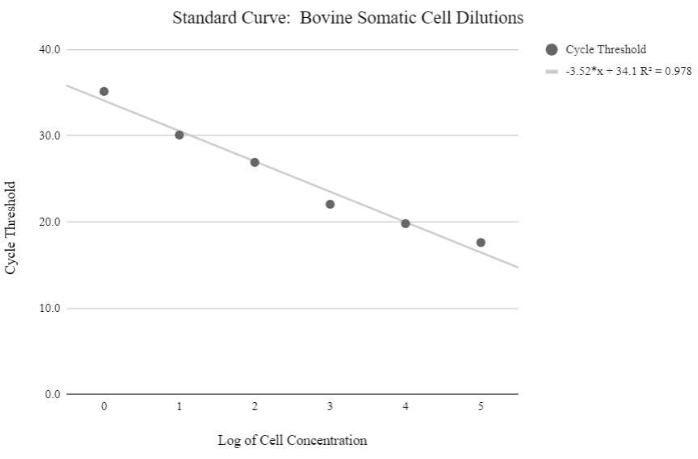
איור 5: עקומת תקן mtDNA של תאים סומטיים. עקומה סטנדרטית זו נוצרה באמצעות כימות mtDNA של ריכוזים לוגריתמיים של תאים סומטיים בקר באמצעות ריאגנטים ותוכנית qPCR כמתואר בשלב פרוטוקול 6.3. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
Access restricted. Please log in or start a trial to view this content.
תוצאות
תוצאות PCR כמותיות (qPCR) משמשות לקביעת הכמויות היחסיות של mtDNA הקיימות בכל אופלסט. התגובה המתוארת נועדה להגביר את אזור 12S של mtDNA בקר.
אם הביזקציה הייתה מוצלחת, לדגימות של ביציות שלמות ואופלסטים צפופי מיטוכונדריה יהיו ערכי Ct דומים. לדגימות מאופלסטים מופחתי מיטוכונדריה יהיו ...
Access restricted. Please log in or start a trial to view this content.
Discussion
לשיטות ששימשו בעבר להפחתת מספרי העותקים של mtDNA בביציות יש חסרונות בהתאמה. הסרה מבוססת מיקרומניפולציה של מיטוכונדריה מביציות מקטינה את מספר העותקים של mtDNA ב-64% 27 בממוצע. שיטה ייחודית, ששימשה בעבר להאנשה, כוללת שימוש בפיפטות פסטר בקוטר קטן ופיצול של ביצית נטולת פלוצ'ידה בגבול שב?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
המחברים מבקשים להודות לעמיתיהם באוניברסיטת יוטה סטייט, לחוקרי מדעי הרבייה בגן החיות של סן דייגו ולד"ר רבקה קרישר מ-Genus PLC.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 1.5 mL centrifuge tubes | Fisher Scientific | 5408129 | |
| 60 mm dish | Sigma-Aldrich | D8054 | |
| Centrifuge | Eppendorf | 5424 | |
| Cytochalasin B | Sigma-Aldrich | C6762 | |
| Fetal Bovine Serum | Sigma-Aldrich | F2442 | |
| M199 Media | Sigma-Aldrich | M4530 | |
| Mineral Oil | Sigma-Aldrich | M8410 | |
| Mini Centrifuge | SCILOGEX | D1008 | |
| mtDNA Primer: Forward (12S) | GGGCTACATTCTCTACACCAAG | ||
| mtDNA Primer: Reverse (12S) | GTGCTTCATGGCCTAATTCAAC | ||
| NanoDrop Spectrophotometer | Thermo Scientific | ND2000 | |
| Opthalmic Scalpel with Aluminum Handle | PFM Medical | 207300633 | Microblade for bisection |
| Protease/pronase | Sigma-Aldrich | P5147 | |
| QIAamp DNA Micro Kit | Qiagen | 56304 | |
| QuantStudio™ 3 - 96-Well 0.2-mL | ThermoFisher | A28567 | |
| Search plate | Fisher Scientific | FB0875711A | |
| SYBR Green qPCR Master Mix | ThermoFisher | K0221 | qPCR master mix |
| Synthetic Oviductal Fluid with HEPES (HSOF) | |||
| ThermoPlate | Tokai Hit | TPi-SMZSSX | Heating stage |
References
- Loi, P., Modlinski, J. A., Ptak, G. Interspecies somatic cell nuclear transfer: A salvage tool seeking first aid. Theriogenology. 76 (2), 217-228 (2011).
- Wani, N. A., Vettical, B. S., Hong, S. B. First cloned Bactrian camel (camelus bactrianus) calf produced by interspecies somatic cell nuclear transfer: A step towards preserving the critically endangered wild Bactrian camels. PLOS ONE. 12 (5), 0177800(2017).
- Oh, H. J., et al. Cloning endangered gray wolves (canis lupus) from somatic cells collected postmortem. Theriogenology. 70 (4), 638-647 (2008).
- Srirattana, K., et al. Full-term development of gaur-bovine interspecies somatic cell nuclear transfer embryos: Effect of trichostatin a treatment. Cellular Reprogramming. 14 (3), 248-257 (2012).
- Kwon, D. K., et al. Blastocysts derived from adult fibroblasts of a rhesus monkey (macaca mulatta) using interspecies somatic cell nuclear transfer. Zygote. 19 (3), 199-204 (2011).
- Lee, E., et al. Production of cloned sei whale (Balaenoptera borealis) embryos by interspecies somatic cell nuclear transfer using enucleated pig oocytes. Journal of Veterinary Science. 10 (4), 285(2009).
- Lorthongpanich, C., Laowtammathron, C., Chan, A. W., Kedutat-Cairns, M., Parnpai, R. Development of interspecies cloned monkey embryos reconstructed with bovine enucleated oocytes. Journal of Reproduction and Development. 54 (5), 306-313 (2008).
- Hong, S. G., et al. Production of transgenic canine embryos using interspecies somatic cell nuclear transfer. Zygote. 20 (1), 67-72 (2011).
- Stewart, J. B., Chinnery, P. F. The dynamics of mitochondrial DNA heteroplasmy: Implications for human health and disease. Nature Reviews Genetics. 16 (9), 530-542 (2015).
- Takeda, K. Mitochondrial DNA transmission and confounding mitochondrial influences in cloned cattle and pigs. Reproductive Medicine and Biology. 12 (2), 47-55 (2013).
- Lanza, R. P., et al. Cloning of an endangered species (Bos Gaurus) using interspecies nuclear transfer. Cloning. 2 (2), 79-90 (2000).
- Evans, M. J., et al. Mitochondrial DNA genotypes in nuclear transfer-derived cloned sheep. Nature Genetics. 23 (1), 90-93 (1999).
- Meirelles, F. V., et al. Complete replacement of the mitochondrial genotype in a Bos indicus calf reconstructed by nuclear transfer to a Bos taurus oocyte. Genetics. 158 (1), 351-356 (2001).
- Beyhan, Z., Iager, A. E., Cibelli, J. B. Interspecies nuclear transfer: Implications for embryonic stem cell biology. Cell Stem Cell. 1 (5), 502-512 (2007).
- Lagutina, I., Fulka, H., Lazzari, G., Galli, C. Interspecies somatic cell nuclear transfer: advancements and problems. Cellular Reprogramming. 15 (5), 374-384 (2013).
- Jiang, Y., et al. Interspecies somatic cell nuclear transfer is dependent on compatible mitochondrial DNA and reprogramming factors. PLoS ONE. 6 (4), 14805(2011).
- Chiaratti, M. R., et al. Embryo mitochondrial DNA depletion is reversed during early embryogenesis in cattle. Biology of Reproduction. 82 (1), 76-85 (2010).
- Spikings, E. C., Alderson, J., John, J. C. Regulated mitochondrial DNA replication during oocyte maturation is essential for successful porcine embryonic development. Biology of Reproduction. 76 (2), 327-335 (2007).
- Cagnone, G. L., et al. Restoration of normal embryogenesis by mitochondrial supplementation in pig oocytes exhibiting mitochondrial DNA deficiency. Scientific Reports. 6 (1), 1-15 (2016).
- Spikings, E. C., Alderson, J., John, J. C. Regulated mitochondrial DNA replication during oocyte maturation is essential for successful porcine embryonic development. Biology of Reproduction. 76 (2), 327-335 (2007).
- Ferreira, A. F., et al. Does supplementation with mitochondria improve oocyte competence? A systematic review. Reproduction. 161 (3), 269-287 (2021).
- Bhat, M. H., et al. Live birth of a pashmina goat kid after transfer of handmade cloned embryos. Journal of Reproduction and Development. , (2019).
- Tecirlioglu, R. T., et al. Birth of a cloned calf derived from a vitrified hand-made cloned embryo. Reproduction, Fertility and Development. 15 (7), 361(2003).
- Zhang, P., et al. Handmade cloned transgenic piglets expressing the nematode fat-1 gene. Cellular Reprogramming. 14 (3), 258-266 (2012).
- Zhang, P., et al. Handmade cloned transgenic sheep rich in omega-3 fatty acids. PLOS ONE. 8 (2), 55941(2013).
- Lagutina, I., et al. Somatic cell nuclear transfer in horses: Effect of oocyte morphology, embryo reconstruction method and donor cell type. Reproduction. 130 (4), 559-567 (2005).
- Chiaratti, M. R., et al. Embryo mitochondrial DNA depletion is reversed during early embryogenesis in cattle. Biology of Reproduction. 82 (1), 76-85 (2010).
- Hosseini, S. M., et al. and efficient method of manual oocyte enucleation using a pulled pasteur pipette. In Vitro Cellular and Developmental Biology - Animal. 49 (8), 569-575 (2013).
- Zampolla, T., Spikings, E., Rawson, D., Zhang, T. Cytoskeleton proteins F-actin and tubulin distribution and interaction with mitochondria in the granulosa cells surrounding stage III zebrafish (danio rerio) oocytes. Theriogenology. 76 (6), 1110-1119 (2011).
- International Union for Conservation of Nature. The IUCN Red List of Threatened Species. International Union for Conservation of Nature. , (2021).
- Berg, D. K., Li, C., Asher, G., Wells, D. N., Oback, B. Red deer cloned from antler stem cells and their differentiated progeny. Biology of Reproduction. 77 (3), 384-394 (2007).
- Gómez, M. C., et al. Birth of African wildcat cloned kittens born from domestic cats. Cloning and Stem Cells. 6 (3), 247-258 (2004).
- Lanza, R. P., et al. Cloning of an endangered species (Bos gaurus) using interspecies nuclear transfer. Cloning. 2 (2), 79-90 (2000).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved