A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
יסודות ההיסטולוגיה וזיהוי מוות תאי ברקמת דבורת הדבש
In This Article
Summary
שיטות אימונוהיסטוכימיות שימושיות במחקר דבורת הדבש כדי לזהות ולהעריך את רמת האפופטוזיס והנמק בבלוטות האמצע והלוע של דבורים בוגרות.
Abstract
דבורי הדבש (Apis mellifera L.) בתוך הכוורת (אחיות ודבורי כוורת אחרות) ומחוץ לכוורת (foragers) חשופות לשינויי אקלים ומזג אוויר, חומרי הדברה שונים, פתוגנים ותת תזונה, הנכנסים בעיקר דרך הפה ומשפיעים בעיקר על דרכי העיכול של דבורים בוגרות. כדי להבין ולמנוע את ההשפעות של גורמי לחץ חיצוניים ופנימיים כאלה על דבורי הדבש, אחת משיטות המחקר השימושיות היא השיטה האימונוהיסטוכימית. פרוטוקול בסיסי מתואר להכנת בלוטות האמצע (ventriculus) וההיפו-לוע (HPGs) של דבורים בוגרות לניתוח היסטולוגי. מתודולוגיה מפורטת מתוארת כדי להעריך את רמת הנזק לתאים ולהבחין בין נמק למוות תאי מתוכנת (אפופטוזיס) כתהליך טבעי של התחדשות רקמות. תוצאות הטיפול בדבורת הדבש הבוגרת בחומצה אוקסלית ובחומרי הדברה (קוטל חרקים ואקריציד) וקביעת מוות תאי בחדר וב- HPGs מוצגות. היתרונות והחסרונות של המתודולוגיה נדונים גם הם.
Introduction
דבורי הדבש (Apis mellifera L.) הן, בין שאר מאביקות הבר, המאביקות החשובות ביותר של צמחים חקלאיים. במשך אלפי שנים, הסביבה המשתנה השפיעה על הדבורים להתאים את המורפולוגיה, הפיזיולוגיה, ההתנהגות והעמידות שלהן למספר פתוגנים וטפילים. לכן, דבורי הדבש פיתחו מגוון רחב מאוד של מינים ותת-מינים ברחבי העולם1. תוצאות אלה עולות בקנה אחד עם ממצאים קודמים, שלפיהם קיימת שונות גנטית במבנה מערכת העיכול של דבורת הדבש, אך גם מצביעות על כך ששינויים במידגוט נובעים מגורמים סביבתיים 2,3.
מערכת העיכול של דבורת הדבש כוללת שלושה חלקים עיקריים: פורגוט, מידגוט (ventriculus) והינדגוט4. החדר הוא איבר חיוני לעיכול אבקה וצוף/דבש; ב hindgut, שליטה אוסמוטית מתרחשת באמצעות ספיגת מים ויונים2. בלוטות ההיפו-לוע (HPGs) של עובדי דבורת הדבש ממוקמות בראש ומסנתזות ומפרישות רכיבי מזון מלכות כדי להאכיל את הברוד, את המלכה ואת חברי המושבה. גודלם משתנה עם הגיל והמשימות ותלוי בתזונה נכונה (אבקה איכותית). עובדי אחיות בגילאי 6 עד 18 ימים מבצעים גידול גזעים, וגודל ה- HPGs גדלב- 5,6. בדבורים, ה-HPGs מתנוונים ומפרישים רק אנזימים החשובים להמרת הסוכרים המורכבים לפשוטים (α-גלוקוזידאזות, לאוצין ארילאמידאז, אינברטאז) בדבש7.
דבורי הדבש נחשפות למספר גורמי עקה ביוטיים וא-ביוטיים8, ומערכת העיכול עלולה להיות מושפעת ממספר ממריצים שליליים. המחסום הראשון המגן על האורגניזם מפני פתוגנים הוא הממברנה הפריטרופית ב midgut, אשר מורכב רירית המעי כדי להגן מפני פתוגנים4. ההתפתחות והתפקוד של HPGs תלויים בתזונה, בגיל ובמצב המושבה9, והם מושפעים מקוטלי חרקים, אקריצידים 10 ופתוגנים11,12,13. שאריות של קוטל בקראיים בכוורת עקב טיפול בהדברת וורואה וחומרי הדברה מהסביבה משפיעים על דבורי מספוא ודבורים אחיות14,15. האיום הגדול ביותר על מושבות דבורי הדבש הוא משמיד הקרדית Varroa, הן כווקטור של וירוסים התורמים לאובדן מושבות16 והן כצרכן של גוף השומן של המארח (איבר חיוני חשוב בדבורי הדבש), וכתוצאה מכך משפיע על גופו של הפרט ועל תפקודי המושבה17.
עם זאת, בתי גידול חקלאיים אינטנסיביים יכולים לספק אספקת מזון לטווח קצר לדבורי הדבש. לכן, תוכניות חקלאיות-סביבתיות צריכות לשפר את הזמינות של פרחי דבש בנופים חקלאיים18. כדי להעריך את המורפולוגיה של תת-מינים שונים 6,19,20,21 או השפעות תת-קטלניות של גורמים אלה ברמת התא או הרקמה, במיוחד midgut ו- HPGs, שיטות היסטולוגיות ואימונוהיסטוכימיות הן מעשיות ומדויקות מספיק כדי לשמש במחקר היסטולוגיה בדבורי דבש.
Access restricted. Please log in or start a trial to view this content.
Protocol
1. היסטולוגיה בסיסית לחקר דבורת הדבש
- דיסקציה של רקמת דבורת הדבש
הערה: לנתיחה של דבורים עובדות, השתמש במיקרוסקופ מנתח עם מקור אור LED. ההגדלה השימושית ביותר היא ~ 20x.- מניפולציה ונתיחה
- בזהירות לקחת דבורה עובד עם מלקחיים ולשים אותו על קרח (או לתוך המקפיא ב -20 מעלות צלזיוס) במשך 2 דקות כדי לשתק אותו22. הצמידו את הדבורה לצלחת הפטרי באלכסון דרך החלק האחורי העליון של בית החזה פעמיים, משמאל לימין ומימין לשמאל.
- יוצקים חרקים מלוחים כדי לכסות את הגוף. הניחו את צלחת הפטרי מתחת למיקרוסקופ, התמקדו והתכווננו.
- הכינו את המכשירים (ראו טבלת חומרים).
- דיסקציה של מידגוט
- התחילו עם הבטן על ידי הכנסת נקודה אחת של המספריים מתחת לטרגיט A5 (איור 1) במרכז הצד הימני של גוף הדבורה. חותכים לטרגיט A2.
- שמור על הלהב הפנימי של המספריים במקביל לצד הגוף כדי למנוע פגיעה באיברים הפנימיים. סובב את המספריים שמאלה ועשה חתך אחד; פנה ימינה ובצע חתך נוסף. פתח בעדינות את החלק השמאלי של הבטן והצמיד אותו. חוזרים על הפעולה בצד השני.
- בעזרת מלקחיים ביד אחת, מושכים בעדינות את בטן דבורת הדבש כלפי מעלה, וביד השנייה חותכים בקצה הוושט. מושכים את הבטן ואת המותניים הרחק מהבטן וחותכים בפי הטבעת. השתמש פיפטה עם תמיסת מלח חרקים ולהסיר כל צואה או חלקים של הרקמה.
- דיסקציה של HPGs
- שיתוק דבורה עובדת על קרח כמתואר בשלב 1.1.1. חותכים את הראש ומניחים אותו על הצלחת הקטנה יותר כשהאנטנות פונות כלפי מעלה. אבטחו את הראש באמצעות שני סיכות: האחת דרך העין המורכבת השמאלית והשנייה דרך העין המורכבת הימנית.
- בצעו חתך על פני העין המורכבת הראשונה בצד הפנימי של הסיכות, המשיכו ללברום, ואז בצעו חתך נוסף בצד השני על פני העין המורכבת השנייה (איור 2).
- נתק את האנטנות. מרימים את המסכה וחותכים היכן שעדיין מחוברים. קח את המלקחיים בזהירות להסיר את הבלוטות יחד עם המוח וחלק מהעיניים המורכבת.
- מניפולציה ונתיחה
- קיבוע, התייבשות והטמעת פרפין
הערה: יש ללבוש כפפות מגן.- מניחים את הרקמה בבקבוקי פניצילין, מלאים 3/4 עם 10% פורמלין. יש לשמור במקרר בטמפרטורה של 4°C.
- לאחר 24 שעות, לייבש את הרקמה בסדרה של אלכוהולים: 70%, 80%, 90%, 100%, במשך שעה אחת כל אחד, 100% 2-פרופנול במשך שעה, 100% 2-פרופנול במשך 12 שעות, ולבסוף 100% 2-פרופנול במשך שעה אחת.
- מניחים את הרקמה בהיסטוקסטים; מסמנים ומניחים אותם בתאי הזכוכית עם 2-פרופנול ופרפין (1:1) באינקובטור בטמפרטורה של 60 מעלות צלזיוס למשך 24 שעות.
- מעבירים את ההיסטוקסטים לתא אחר עם פרפין (I.) למשך 24 שעות נוספות. חזור על ההליך עם פרפין טרי פעמיים נוספות (II. ו- III.), שניהם במשך 24 שעות.
- לבסוף, הכינו את תחנת ההרכבה והתחילו להטמיע את הרקמה בשעווה.
- פתח כל היסטוקסט והסר את הכיסוי. ממלאים את התבנית בשעווה ומניחים בזהירות את הרקמה עם מלקחיים חמים באמצע התבנית.
- מניחים את ההיסטוקססט על התבנית ומכסים אותה מעט בשעווה. מיד מניחים את התבנית על המשטח הקר של תחנת ההרכבה למשך מספר שניות, ואז מניחים אותה על הלוח הקר למשך מספר דקות עד שהשעווה מתקשה ונפרדת מהתבנית יחד ומההיסטוקסט.
- אחסנו את הדוגמאות המוגמרות בקופסה, הרחק מאבק וחום.
- חותכים חתכים דקים של 4 מיקרומטר על מיקרוטום: ראשית, שני חלקים המחוברים זה לזה ולאחר מכן אחד בנפרד. מעבירים את החלקים עם מלקחיים ונותנים להם לצוף על מים מזוקקים (42 מעלות צלזיוס), ואז אוספים אותם במגלשות נקיות על ידי הצבת שני חלקים יחד בצד שמאל של הזכוכית האובייקטיבית והשלישי בצד ימין, ונשארים נפרדים באופן מובהק. השאירו את המגלשות המסומנות למשך הלילה במכשיר החימום ולבסוף אחסנו אותן בקופסה המוקדשת לדגימות היסטולוגיה.
- התייבשות והתייבשות
הערה: יש ללבוש כפפות מגן.- הכינו תשע צנצנות קופלין והכניסו את החלקים לסדרה של חומרי ניקוי (I., II., III.) למשך 5 דקות כל אחד.
- מכניסים ל-2-פרופנול, אתנול 96% (I., II.), אלכוהול 90% ו-80%, ומזקקים מים במשך 3 דקות כל אחד.
- צביעה עם המטוקסילין ואוסין
הערה: יש ללבוש כפפות מגן.- מכינים שש צנצנות קופלין.
- לצביעת המטוקסילין ואוזין (H&E), הכניסו את החלקים המיובשים והמיובשים להמטוקסילין למשך 5 דקות, ואז הניחו אותם בזהירות מתחת למי הברז הזורמים למשך 2 דקות. ואז לשים אותם לתוך מים מזוקקים במשך 1 דקות ו eosin במשך 4 דקות (עבור eosin, צנצנת קופלין אינו הכרחי).
- מניחים את השקופיות באתנול 96% למשך דקה אחת, לאחר מכן 2-פרופנול למשך 2 דקות, ולבסוף לסוכן הסליקה למשך 2 דקות.
- הוסיפו מדיום הרכבה וכוס כיסוי ותנו להם להתייבש. התבונן תחת מיקרוסקופ אור.
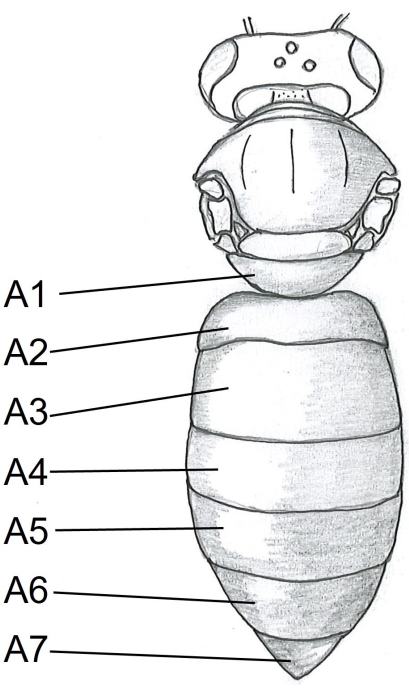
איור 1: מבט דורסלי על גוף דבורת הדבש. A1-A7 טרגיטים. את ההוראות המפורטות על דיסקציה של דבורת הדבש ניתן למצוא ב- Carreck et al.24. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
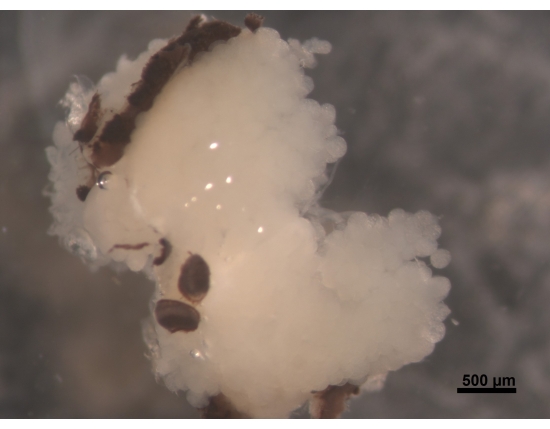
איור 2: מבט דורסלי של HPGs, חלקים של עיניים מורכבות המחוברים למוח (לא נראה לעין). לדבורה עובדת צעירה בגילאי 5 עד 6 ימים יש HPGs לבנים שמנמנים וקרמיים. האצ'יני ממוקמים על המוח וממלאים את אזור הראש בענפים המגיעים לחלק האחורי של המוח. בדבורים, בלוטות אלה מכווצות מאוד ומותירות רק שרידים דקים דמויי חוטים. מסיבה זו, עדיף להסיר בלוטות יחד עם המוח כדי להקל על הליכים נוספים, כדי למנוע אובדן הרקמה. סרגל קנה מידה = 500 מיקרומטר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
2. זיהוי מוות תאי במקטעי רקמות
- ערכת זיהוי אפופטוזיס (בדיקה A)
הערה: פעל בהתאם לפרוטוקול היצרן (עיין בטבלת החומרים).- מכינים את צנצנות הקופלין.
- לאחר התייבשות והתייבשות (ראו שלב 1.3), טבלו את השקופיות בתמיסת NaCl של 0.85%, ולאחר מכן בתמיסת מלח עם אגירת פוספטים (PBS) (5 דקות).
- שים את השקופיות ב 4% paraformaldehyde 2 x 15 דקות.
- הניחו את השקופיות שטוחות במיכל והוסיפו 100 מיקרולטר של תמיסת פרוטאינאז K (20 מיקרוגרם למ"ל), ואז השאירו אותן למשך 10-30 דקות.
- מקם את השקופיות ב- PBS (5 דקות).
- מקמו את השקופיות ב-4% פרפורמלדהיד ב-PBS (5 דקות).
- לטבול את השקופיות ב- PBS (2 x 5 דקות).
- מניחים את השקופיות שטוחות במיכל, מוסיפים 100 μL של מאגר שיווי משקל, ומשאירים אותן למשך 5-10 דקות.
- הוסף 100 μL של תערובת תגובה TdT. שים מגבות נייר בתוך המיכל, סביב המגלשות, להרטיב את המגבות עם מים, ולאחר מכן לכסות עם ניילון נצמד. דגירה מגלשות במשך 60 דקות ב 37 מעלות צלזיוס.
- החזירו את המגלשות למדף הכתמים וטבלו ב-2x מלח-נתרן ציטראט (SSC) למשך 15 דקות.
- לטבול את השקופיות 3 x 5 דקות ב- PBS, לאחר מכן ב- 0.3% מי חמצן למשך 3-5 דקות, ואז שוב ב- PBS, 3 x 5 דקות.
- שוב, מניחים את המגלשות שטוחות במיכל, מוסיפים 100 μL של Streptavidin HRP (חזרת peroxidase), ולהשאיר במשך 30 דקות (לכסות עם ניילון נצמד).
- לטבול את השקופיות 3 x 5 דקות ב- PBS.
- הנח את המגלשות שטוחות במיכל והוסף 100 μL של תמיסת 3,3'-diaminobenzidine (DAB). חפשו רקע חום בהיר.
- החזירו את המגלשות למדף ושטפו אותן מספר פעמים במים (מזוקקים פעמיים).
- הרכב את המגלשות מתחת לכיסויי זכוכית במדיום הרכבה והשאר שטוח לייבוש.
- התבונן תחת מיקרוסקופ אור.
- ערכת זיהוי אפופטוזיס (בדיקה B)
הערה: פעל בהתאם לפרוטוקול היצרן (עיין בטבלת החומרים).- מכינים צנצנות קופלין.
- הכינו פרוטאינאז K (20 מיקרוגרם/מ"ל מדולל ב-PBS).
- לאחר הסרת השעווה וייבוש מחדש של החלקים (שלב 1.3), מקם את השקופיות ב- PBS למשך 5 דקות.
- הניחו את השקופיות שטוחות במיכל והוסיפו פרוטאינאז K (20 מיקרוגרם/מ"ל, 60 מיקרון לדגימה של 5 סמ"ר).
- שטפו את המגלשות 2 על 2 דקות במים מזוקקים.
- להרוות פרוקסידאז אנדוגני (ב-3% מימן פרוקסידאז) בטמפרטורת החדר.
- שטפו את המגלשות 2 x 5 דקות עם PBS או מים.
- הניחו את המגלשות שטוחות במיכל והפעילו את חיץ שיווי המשקל (75 μL/5 ס"מ2) למשך 10 שניות בטמפרטורת החדר.
- בזהירות לנגב סביב הרקמה.
- יש להוסיף את האנזים TdT (דאוקסינוקלאוטידיל טרנספראז סופני) לכל מקטע ולדגור בתא לח למשך שעה אחת בטמפרטורה של 37 מעלות צלזיוס. שים מגבות נייר בתוך המגש, סביב המגלשות, להרטיב את המגבות במים, ולכסות אותם בניילון נצמד.
- לאחר הדגירה, הכניסו את הדגימות למדף והשאירו אותן במאגר עצירה/שטיפה (10 דקות).
- יש לחמם את הצמד נגד דיגוקסיגנין לטמפרטורת החדר.
- לשטוף את השקופיות ב- PBS (3 x 1 דקות).
- נגבו בזהירות סביב הרקמה.
- יש להוסיף שתי טיפות של מצומד אנטי-דיגוקסיגנין-פרוקסידאז (65 μL/5 סמ"ר) למקטעים ולדגור במשך 30 דקות במיכל לח.
- לאחר שטיפה ב-PBS 4x2 דקות, הכינו מצע פרוקסידאז בעל חוזק עבודה, טפחו בעדינות על עודפי נוזלים ושאפו סביב המקטע.
- מכסים את החלקים במצע פרוקסידאז (75 μL/5 cm²) ומכתימים למשך 5 דקות. הניחו שקופית מתחת למיקרוסקופ וקבעו את זמן הצביעה האופטימלי.
- שטפו את המגלשות במדף מכתים במים מזוקקים (3 x 1 דקות).
- דגרו את המגלשות במים מזוקקים למשך 5 דקות.
- מכתים נגדיים באמצעות המטוקסילין למשך 2 דקות.
- הניחו את המגלשה מתחת למי ברז זורמים למשך 3 דקות.
- שטפו את המגלשה במים מזוקקים.
- הרכב את המגלשות מתחת לכיסויי זכוכית במדיום הרכבה והשאר שטוח לייבוש.
- התבונן תחת מיקרוסקופ אור.
- ערכת זיהוי אפופטוזיס (בדיקה C)
הערה: פעל בהתאם לפרוטוקול היצרן (עיין בטבלת החומרים).- מכינים את צנצנות הקופלין.
- יש לייבש את חלקי הרקמה ולייבש אותם מחדש (ראו שלב 1.3).
- לדגום את הרקמה עם פרוטאינאז K (15-30 דקות ב 37 מעלות צלזיוס).
- החזירו את המגלשות לארון התקשורת ושטפו 2x ב-PBS.
- מכסים ב-50 מיקרוגרם של 'תערובת תגובת TUNEL'. מניחים מגבות נייר רטובות בתוך המיכל, מכסים אותן בניילון נצמד ומשאירים אותן למשך 60 דקות בחום של 37 מעלות צלזיוס.
- יש לשטוף 3x עם PBS.
- מניחים את השקופיות במיכל ומייבשים את האזור סביב דגימת הרקמה.
- הוסף 50 μL של Converter-AP לדגימה ודגרה במיכל לח למשך 30 דקות ב- 37 °C.
- יש לשטוף 3 פעמים ב-PBS.
- מוסיפים 50-100 μL של תמיסת מצע ומשאירים למשך 10 דקות בחושך.
הערה: שימו לב לכתמים תחת מיקרוסקופ אור. - שטפו את השקופיות 3x עם PBS.
- יש לנטרל את הכתמים על ידי העברת חלקים להמטוקסילין למשך 2 דקות ולאחר מכן לשטוף בזהירות במי ברז זורמים למשך 5 דקות.
- הרכיבו את המגלשות מתחת לכיסויי זכוכית במדיום הרכבה מימי והשאירו אותן שטוחות לייבוש.
- התבונן תחת מיקרוסקופ אור. הערך את התאים הנגועים (החיוביים) על-ידי ספירת 70 עד 100 תאים בכל דגימה של מידגוט או HPGs תחת מיקרוסקופ אור.
Access restricted. Please log in or start a trial to view this content.
תוצאות
זיהוי מוות תאי במרכז הגוף
דבורים עובדות חדשות (Apis mellifera carnica) מהמכוורת הניסיונית במכון החקלאי של סלובניה בלובליאנה טופלו בנפרד ב-3% חומצה אוקסלית (OA)23. OA משמש לעתים קרובות בגידול דבורים לבקרת הרס Varroa . לאחר הטיפול, הדבורים העובדות (שלוש מכל קבוצה) היו משותקות ?...
Access restricted. Please log in or start a trial to view this content.
Discussion
באורגניזמים חיים, מוות תאי מוגדר כאפופטוזיס או נמק25 ויכול להיות מלווה באוטופגיה26. ההבדל בין תאים אפופטוטיים לנמקיים הוא שאפופטוזיס הוא סוג של מוות תאי מתוכנת ומופיע בתאים רגילים, בעוד נמק מתרחש עקב תנאים קטלניים (למשל, תאונה, מחלה)27,28<...
Access restricted. Please log in or start a trial to view this content.
Disclosures
למחבר אין ניגודי עניינים.
Acknowledgements
אני מודה על תמיכת סוכנות המחקר הסלובנית, מענק מס 'P4-133.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 2-Propanol | |||
| ApopTag Peroxidase kit (ApopTag Peroxidase In Situ Apoptosis Detection) | Sigma-Aldrich | S7100 | Assay B, https://www.sigmaaldrich.com/SI/en/product/mm/s7100?gclid=CjwKCA jw7vuUBhBUEiwAEdu2pPanI9SE j81ZTl-nLHEoxXAv7ViKwPA_QRx H7fciMRNcYwR7lbPQbhoCqcQQA vD_BwE; Positive controls included in S7101 |
| Covers | |||
| DeadEnd Colorimetric TUNEL system | Promega | G7360 | Assay A, https://worldwide.promega.com/products/cell-health-assays/apoptosis-assays/deadend-colorimetric-tunel-system/?catNum=G7360 |
| Dissecting microscope (for bee dissection) | Zeiss | ||
| Distilled water | |||
| Embedding cassette | |||
| EnVision System alkaline phosphatase kit | Dako | ||
| Eosin Y Solution | Sigma-Aldrich | alcoholic | |
| Ethanol | 95% (or less pure), 90%, 80% | ||
| Faramount mounting medium, aqueous | Dako | mounting medium | |
| Flattening table | Leica | HI1220 | |
| Forceps (for bee dissection) | Fine science tools | 11294-00 | Standard #4 |
| Formalin 10% | Formaldehyde | ||
| Hematoxylin | Sigma-Aldrich | ||
| HistoChoice Clearing Agent | Sigma-Aldrich | clearing agent | |
| Hydrogen peroxidase 3% | |||
| Incubator | BioRad | ||
| Insect pins (for bee dissection) | Entosphinx | 44594 | Insect pins stainless steel – white, size 2 |
| ISCDDK, AP (In Situ Cell Death Detecteion Kit, Alkaline Phosphatase) | Roche | 11684809910 | Assay C, https://www.sigmaaldrich.com/deepweb/assets/sigmaaldrich/product/documents/362/737/11684809910b ul.pdf |
| KH2PO4 | |||
| Lab clock | |||
| Light microscope | Leica | ||
| Microscope slides | Box with the slides must be preserved in a plastic wrap to prevent dust | ||
| Microtome | Leica | ||
| Modular tissue embedding station | Leica | ||
| Na2HPO4 | |||
| NaCl | |||
| Paraformaldehyde 4% | |||
| Paraplast | Leica | ||
| Pasteur pipettes | 1.5 mL; 3 mL | ||
| PBS | |||
| Petri dish (for bee dissection) | Filled with condensation silicon (Xantoprene L blue and Universal liquid plus activator) | ||
| Proteinase K | Merck | 21627 | |
| Ringers' solution (for bee dissection) | 7.5 g NaCL, 2.38 g Na2HPO4, 2.72 g KH2PO4, 1 L distilled water | ||
| Scissors (for bee dissection) | Fine science tools | 1406-09, 14061-09 | Straight and curved, 9 cm |
| Universal liquid plus activator (for bee dissection) | Kulzer | ||
| Watchmaker’s forceps (for bee dissection) | Fine science tools | 91100-12 | |
| Water bath | Leica | ||
| Watercolor brush | 2x | ||
| Xantoprene L blue (for bee dissection) | Kulzer |
References
- Ruttner, F. Naturgeschichte der Honigbienen. , Ehrenwirth. München. (1992).
- Jordan, R. Kleine Bienenkunde. Österreichischer Agrarverlag Wien München. , 41-45 (1964).
- Snodgrass, R. E. The Anatomy of the Honey Bee. The Hive and the Honey Bee. , Dadant and Sons. 111-113 (1975).
- Snodgrass, R. E. The Anatomy of the Honey Bee. , Cornell University Press. (2004).
- Hrassnigg, N., Crailsheim, K. Adaptation of hypopharyngeal gland development to the brood status of honeybee (Apis mellifera L.) colonies. Journal of Insect Physiology. 44 (10), 929-939 (1998).
- Smodiš Škerl, M. I., Gregorc, A. Characteristics of hypopharyngeal glands in honeybees (Apis mellifera carnica) from a nurse colony. Slovenian Veterinary Research. 52 (2), 67-74 (2015).
- Kubo, T. Change in the expression of hypopharyngeal-gland proteins of the worker honeybees (Apis mellifera L.) with age and/or role. Journal of Biochemistry. 119 (2), 291-295 (1996).
- Sammataro, D., Yoder, J. A. Honey bee colony health: Challenges and sustainable solutions. , Taylor & Francis Group. 302(2012).
- Crailsheim, K., Stolberg, E. Influence of diet, age and colony condition upon intestinal proteolytic activity and size of the hypopharyngeal glands in the honeybee (Apis mellifera L.). Journal of Insect Physiology. 35 (8), 595-602 (1998).
- Smodiš Škerl, M. I., Gregorc, A. Heat shock proteins and cell death in situ localisation in hypopharyngeal glands of honeybee (Apis mellifera carnica) workers after imidacloprid or coumaphos treatment. Apidologie. 41 (1), 73-86 (2010).
- Gregorc, A., Bowen, I. D. The histochemical characterisation of cell death in honeybee larvae midgut after treatment with Paenibacillus larvae, Amitraz and Oxytetracycline. Cell Biology International. 24 (5), 319-324 (2000).
- Higes, M., et al. Apoptosis in the pathogenesis of Nosema ceranae (Microsporidia: Nosematidae) in honey bees (Apis mellifera). Environmental Microbiology Reports. 5 (4), 530-536 (2013).
- Kurze, C., et al. Infection dynamics of Nosema ceranae in honey bee midgut and host cell apoptosis. Journal of Invertebrate Pathology. 154, 1-4 (2018).
- Johnson, R. M. Honey bee toxicology. Annual Review of Entomology. 60 (1), 415-434 (2005).
- Gashout, H. A., Guzman-Novoa, E., Goodwin, P. H. Synthetic and natural acaricides impair hygienic and foraging behaviors of honey bees. Apidologie. 51 (6), 1155-1165 (2020).
- McMenamin, A. J., Genersch, E. Honey bee colony losses and associated viruses. Current Opinion in Insect Science. 8, 121-129 (2015).
- Ramsey, S. D., et al. Varroa destructor feeds primarily on honey bee fat body tissue and not hemolymph. Proceedings of the National Academy of Sciences USA. 116 (5), 1792-1801 (2019).
- Requier, F., et al. Honey bee diet in intensive farmland habitats reveals an unexpectedly high flower richness and a major role of weeds. Ecological Applications. 25 (4), 881-890 (2015).
- Santos, C., Serrão, J. Histology of the ileum in bees (Hymenoptera, Apoidea). Brazilian Journal of Morphological Sciences. 23 (3), 405-413 (2006).
- Suwannapong, G., Saichon, C., Benbow, M. Histochemical comparison of the hypopharyngeal gland in Apis cerana Fabricius, 1793 workers and Apis mellifera Linnaeus, 1758 workers. Psyche: A Journal of Entomology. , (2010).
- Ceylan, A., Sevin, S., Özgenç, Ö Histomorphological and histochemical structure of the midgut and hindgut of the Caucasian honey bee (Apis mellifera caucasia). Turkish Journal of Veterinary and Animal Sciences. 43 (6), 747-753 (2019).
- Human, H., et al. Miscellaneous standard methods for Apis mellifera research. Journal of Apicultural Research. 52 (4), 1-53 (2013).
- Gregorc, A., Smodiš Škerl, M. I. Toxicological and immunohistochemical testing of honeybees after oxalic and rotenone treatments. Apidologie. 38 (3), 296-305 (2007).
- Carreck, N. L., et al. Standard methods for Apis mellifera anatomy and dissection. Journal of Apicultural Research. 52 (4), 1-40 (2013).
- Bowen, I. D., Bowen, S. M., Jones, A. H. Mitosis and apoptosis: Matters of Life and Death. , Chapman & Hall. London. (1998).
- Eisenberg-Lerner, A., et al. Life and death partners: apoptosis, autophagy and the cross-talk between them. Cell Death and Differentiation. 16 (7), 966-975 (2009).
- Bowen, I. D., Mullarkey, K., Morgan, S. M. Programmed cell death in the salivary gland of the blow fly Calliphora vomitoria. Microscopy Research Techniques. 34, 202-207 (1996).
- D'Arcy, M. S. Cell death: a review of the major forms of apoptosis, necrosis and autophagy. Cell Biology International. 43 (6), 582-592 (2019).
- Matylevitch, N. P., et al. Apoptosis and accidental cell death in cultured human keratinocytes after thermal injury. American Journal of Pathology. 153 (2), 567-577 (1998).
- Perry, S. W., Epstein, L. G., Gelbard, H. A. Simultaneous in situ detection of apoptosis and necrosis in monolayer cultures by TUNEL and trypan blue staining. BioTechniques. 22 (6), 1102-1106 (1997).
- Cuello-Carrion, F. D., Ciocca, D. Improved detection of apoptotic cells using a modified in situ TUNEL technique. Journal of Histochemistry and Cytochemistry. 47 (6), 837-839 (1999).
- Gregorc, A., Bowen, I. D. Programmed cell death in the honeybee (Apis mellifera L.) larvae midgut. Cell Biology International. 21 (3), 151-158 (1997).
- Gregorc, A., Pogačnik, A., Bowen, I. D. Cell death in honey bee (Apis mellifera) larvae treated with oxalic or formic acid. Apidologie. 35 (5), 453-460 (2004).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved