A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מדידת הדחיסות של תאים וגרעין על בסיס מיקרו-מכשיר אקוסטופלואידי
In This Article
Summary
כאן מוצג פרוטוקול לבניית מערכת מהירה ולא הרסנית למדידת דחיסות התא או הגרעין על בסיס מיקרו-מכשיר אקוסטופלואידי. נחקרו שינויים בתכונות המכניות של תאי הגידול לאחר מעבר אפיתליאלי-מזנכימלי או קרינה מייננת, המדגימים את סיכויי היישום של שיטה זו במחקר מדעי ובפרקטיקה הקלינית.
Abstract
מכניקת התאים ממלאת תפקיד חשוב בגרורות סרטניות, טרנספורמציה ממאירה של תאים, ורגישות רדיו. במהלך תהליכים אלה, חקר התכונות המכניות של התאים הוא לעתים קרובות מאתגר. שיטות מדידה קונבנציונליות המבוססות על מגע כגון דחיסה או מתיחה מועדות לגרום נזק לתאים, ומשפיעות על דיוק המדידה ועל תרבית התאים שלאחר מכן. מדידות במצב דבק יכולות גם הן להשפיע על הדיוק, במיוחד לאחר הקרנה מכיוון שקרינה מייננת תשטח תאים ותגביר את ההדבקה. כאן פותחה מערכת מדידה של מכניקת התא המבוססת על שיטה אקוסטופלואידית. ניתן להשיג את דחיסות התא על ידי רישום מסלול תנועת התא תחת פעולת הכוח האקוסטי, אשר יכול לממש מדידה מהירה ולא הרסנית במצב מושעה. מאמר זה מדווח בפירוט על הפרוטוקולים לתכנון שבבים, הכנת דגימה, הקלטת מסלול, חילוץ וניתוח פרמטרים. הדחיסות של סוגים שונים של תאי גידול נמדדה על בסיס שיטה זו. מדידת הדחיסות של הגרעין הושגה גם על ידי התאמת תדר התהודה של הקרמיקה הפיאזואלקטרית ורוחב המיקרו-ערוץ. בשילוב עם אימות ברמה המולקולרית של ניסויים אימונופלואורסצנטיים, הושוו דחיסות התאים לפני ואחרי מעבר אפיתל למעבר מזנכימלי (EMT) המושרה על ידי תרופות. יתר על כן, השינוי של דחיסות התא לאחר קרינת רנטגן עם מינונים שונים נחשף. שיטת המדידה של מכניקת התא המוצעת במאמר זה היא אוניברסלית וגמישה ויש לה סיכויי יישום נרחבים במחקר מדעי ובפרקטיקה הקלינית.
Introduction
תכונות מכניות של תאים ממלאות תפקיד חשוב בגרורות סרטניות, טרנספורמציה ממאירה של תאים, ורגישות רדיו-רגישות 1,2. כדי לקבל הבנה מעמיקה של תפקידן של התכונות המכניות של התא בתהליך הנ"ל, מדידה מדויקת של מכניקת התאים היא קריטית, והמדידה לא אמורה לגרום נזק לתאים לצורך תרבית וניתוח עתידיים. תהליך המדידה צריך להיות מהיר ככל האפשר, אחרת הכדאיות של התאים עלולה להיות מושפעת אם תאים מוסרים מסביבת הטיפוח במשך זמן רב.
שיטות המדידה הקיימות של מכניקת התאים מתמודדות עם מגבלות מסוימות. שיטות מסוימות, כגון ציטומטריה של פיתול מגנטי, פינצטה מגנטית ומיקרורולוגיה העוקבת אחר חלקיקים, גורמות נזק לתאים עקב החדרת חלקיקים לתאים 3,4,5. שיטות המודדות על ידי מגע עם תאים, כגון מיקרוסקופ כוח אטומי (AFM), שאיפת מיקרו-פיפטה, מיקרו-התכווצות וטכניקת לוחות מקבילים, מועדות גם הן לפגיעה בתאים וקשה להגדיל את התפוקה ב-6,7,8. בנוסף, קרינה מייננת תשטח תאים ותגביר את הידבקותם9; לכן יש צורך למדוד מכניקה של תאים שלמים בהשעיה.
בתגובה לאתגרים הנ"ל, פותחה מערכת מדידה של מכניקת התא המבוססת על שיטה אקוסטופלואידית 10,11,12,13,14. רוחב הערוץ מותאם לחצי אורך הגל האקוסטי, ובכך יוצר צומת גל עומד בקו האמצע של המיקרו-ערוץ. תחת פעולה של כוח קרינה אקוסטית, התאים או חרוזים סטנדרטיים יכולים לעבור לצומת הלחץ האקוסטי. מכיוון שהתכונות הפיזיקליות של החרוזים הסטנדרטיים (גודל, צפיפות ודחיסות) ידועות, ניתן לקבוע את צפיפות האנרגיה האקוסטית. לאחר מכן, ניתן להשיג את דחיסות התאים על ידי רישום מסלולי התנועה של תאים בשדה האקוסטי. ניתן להשיג מדידה לא הרסנית בתפוקה גבוהה של תאים במצב השעיה. מאמר זה יציג את העיצוב של השבב המיקרופלואידי, הקמת המערכת ושלבי המדידה. מדידה של סוגים שונים של תאים סרטניים בוצעה כדי לאמת את הדיוק של השיטה. היקף היישום של שיטה זו הורחב למבנים תת-תאיים (כגון גרעין) על ידי התאמת תדר התהודה של הקרמיקה הפיאזואלקטרית ורוחב המיקרו-ערוץ. בנוסף, נחקרו השינויים בדחיסות התאים לאחר EMT הנגרם על ידי תרופות או קרינת רנטגן במינונים שונים. התוצאות מדגימות את הישימות הרחבה של שיטה זו ככלי רב עוצמה לחקר הקשר בין שינויים ביוכימיים לבין תכונות מכניות של תאים.
Protocol
1. ייצור והרכבה של המיקרו-מכשיר האקוסטופלואידי
- ייצור השבב המיקרופלואידי.
- תכנן שבב חד-ערוצי עם כניסה ושקע אחד בלבד, כפי שמוצג באיור 1. למדידת תאים, יש לשמור על החתך המלבני של המיקרו-ערוץ ברוחב של 740 מיקרומטר ובעומק של 100 מיקרומטר. למדידת גרעין התא, שנה את רוחב ועומק המיקרו-ערוץ ל-250 מיקרומטר ו-100 מיקרומטר, בהתאמה.
- הכינו את המיקרו-ערוץ על פרוסת סיליקון באמצעות תחריט יונים תגובתי. אטמו את החלק העליון של המיקרו-ערוץ עם חתיכת זכוכית שקופה העמידה בחום על ידי הדבקה אנודית15. לשטוף את השבבים עם מנקה קולי במשך 10 דקות. יבשו אותם בתנור ייבוש בטמפרטורה של 50 מעלות צלזיוס לשימוש מאוחר יותר.
- לייצר בלוקים פולידימתילסילוקסן (PDMS).
- הוסיפו 30 מ"ל של פרה-פולימר לצלחת זכוכית בקוטר 100 מ"מ. הוסף 3 מ"ל של סוכן ריפוי מראש פולימר עם מזרק.
הערה: יחס הנפח של חומר הריפוי והקדם-פולימר הוא 1:10. - ערבבו במרץ את חומר הקדם-פולימר והריפוי PDMS עם מוט זכוכית למשך כ-10 דקות. חפש בועות אוויר קטנות ומופרדות באופן אחיד בתמיסה, המציינות כי קדם-פולימר PDMS וסוכן ריפוי מעורבים היטב.
- מניחים את צלחת הזכוכית במייבש ואקום ומפנים במשך 15-25 שניות. חוזרים על תהליך זה עד שאין בועות אוויר בתערובת.
- מניחים את צלחת הזכוכית בתנור ייבוש בטמפרטורה של 50 מעלות צלזיוס למשך שעה כדי לאפשר לתערובת להירפא. לאחר הדגירה, השתמש באזמל כדי לחתוך את ה- PDMS לגושים בגודל מתאים באורך של כ-1.2 ס"מ וברוחב של 1 ס"מ.
הערה: אורך בלוק PDMS תואם לרוחב השבב, והרוחב נבחר כדי להבטיח שיש מספיק מקום באמצע עבור הקרמיקה הפיאזואלקטרית כאשר שני בלוקי PDMS מודבקים על השבב.
- הוסיפו 30 מ"ל של פרה-פולימר לצלחת זכוכית בקוטר 100 מ"מ. הוסף 3 מ"ל של סוכן ריפוי מראש פולימר עם מזרק.
- קשר את בלוק PDMS לשבב.
- נקב חורים בבלוק PDMS ליציאות כניסה ויציאה עם מחט חלולה בקוטר 1 מ"מ. שים את בלוקים PDMS ואת השבב (הצד האחורי למעלה) במנקה פלזמה למשך דקה אחת.
- יישר את החורים בגושי PDMS עם כניסת השבב ושקע. לחץ בעדינות על בלוקי PDMS לשבב במשך 15 שניות. זה אמור לגרום להדבקה להתרחש בין בלוקים PDMS ואת פני השטח של השבב.
- חבר את קטטר הפוליטטרפלואורואתילן (PTFE) לשבב (איור 2B).
- חותכים שתי חתיכות של קטטר PTFE בקוטר פנימי של 0.8 מ"מ ואורך של 10 ס"מ. כופפו מחט מנירוסטה בקוטר פנימי של 0.7 מ"מ ובאורך של 1.5 ס"מ על 90° לצורת L. חבר אותו לקצה אחד של הקטטר. הכינו שני קטטרים כאלה עם מחטים.
- הכנס את מחטי הנירוסטה לתוך החורים של בלוקי PDMS. עבור הכניסה, חבר מחט חלוקה של 19 גרם לקצה השני של הקטטר כמחבר למזרק.
- לאחר השלמת השלבים לעיל, להזריק מים deionized כדי לבדוק את ההידוק של הערוץ הכולל. אטום למים פירושו חותם טוב.
- מכלול קרמי פיאזואלקטרי (איור 2C)
- השתמש בחותך חוט יהלום כדי לחתוך יריעות קרמיקה פיאזואלקטריות בקוטר של 2 ס"מ לארבע רצועות ברוחב של 5 מ"מ.
- ודא שתדר התהודה של הקרמיקה הפיאזואלקטרית תואם את רוחב המיקרו-ערוץ של השבב. עבור מיקרו-ערוץ ברוחב 740 מיקרומטר ו-250 מיקרומטר, השתמש בקרמיקה פיאזואלקטרית עם תדרי תהודה של 1 מגה-הרץ ו-3 מגה-הרץ, בהתאמה.
- חוטי ריתוך משני צידי הקרמיקה הפיאזואלקטרית בקצה אחד.
- הדביקו את הקרמיקה הפיאזואלקטרית לאמצע החלק האחורי של השבב בדבק ציאנואקרילט.
- כדי לפזר את הדבק באופן שווה, הניחו טיפת דבק על הקרמיקה הפיאזואלקטרית, החליקו את הדבק עם קיסם והסירו את עודפי הדבק. לאחר מכן, לחץ במהירות על השבב והמשיך ללחוץ במשך כדקה. ודא כי קרמיקה piezoelectric ואת השבב מחוברים היטב ומגע שווה.
- הרכיבו את המיקרו-מכשיר (איור 2D).
- חותכים חתיכת PDMS (באורך של כ-1.5 ס"מ וברוחב של 1 ס"מ) כבסיס למיקרו-מכשיר. באמצעות סרט הדבקה דו-צדדי, הדביקו צד אחד של הבסיס לכניסה וליציאה של בלוקי PDMS, ואת הצד השני למגלשת זכוכית שקופה. תקן את כל המיקרו-מכשיר לשלב המיקרוסקופ כדי לשמור את השבב במישור מוקד אחד.
2. הכנת דוגמאות
- הכנת תמיסות חלקיקים סטנדרטיות פוליסטירן.
- הוסיפו 0.05 מ"ל של תמיסת חלקיקי פוליסטירן (בקוטר 6 מיקרומטר) (2.1 x 108 חלקיקים/מ"ל) ל-10 מ"ל של תמיסת מלח חצובה בפוספט (PBS) וערבבו היטב.
הערה: על מנת להפחית את שגיאת המדידה הנגרמת כתוצאה משינוי צפיפות האנרגיה האקוסטית, תמיסת חלקיקי הפוליסטירן הייתה מעורבבת עם תמיסת הדגימה בכל ניסוי ככיול.
- הוסיפו 0.05 מ"ל של תמיסת חלקיקי פוליסטירן (בקוטר 6 מיקרומטר) (2.1 x 108 חלקיקים/מ"ל) ל-10 מ"ל של תמיסת מלח חצובה בפוספט (PBS) וערבבו היטב.
- הכנת השעיות התא.
- יש לשטוף את התאים הדבקים (לדוגמה, MCF7, MDA-MB-231, HCT116) בטמפרטורה של 90% (~ 5 x 105 תאים ) עם PBS. יש להוסיף 500 μL 0.25% טריפסין (1x) למשך 1-2 דקות בטמפרטורת החדר (25°C). הסר את הטריפסין, הוסף 1 מ"ל בינוני שלם וצור השעיית תא על ידי פיפטינג.
- צנטריפוגה מתלה התא ב 100 x גרם במשך 5 דקות. הסר את supernatant ו resuse ב 0.5-1 מ"ל של PBS על מנת לקבל השעיה התא. התאים נספרו עם המוציטומטר והריכוז היה בערך 3-5 x 105 תאים למ"ל.
- הכנת השעיית גרעין התא
- בצע את שלב 2.2. לאחר מכן, הסר את הסופרנטנט והוסף 200 μL של מגיב מיצוי חלבון ציטופלסמי A (בתוספת 1% PMSF) לכל גלולה של 20 μL (כ -5 מיליון תאים) ומערבבים היטב.
- מערבבים את התערובת הנ"ל ב 220 x גרם במשך 5 שניות, ולאחר מכן מניחים על אמבט קרח במשך 10 דקות. לאחר הדגירה, הוסיפו לתמיסה 10 μL של מגיב מיצוי חלבון ציטופלסמי B.
- וורטקס ב 220 x גרם במשך 5 שניות. מניחים על אמבט קרח למשך דקה אחת ומערבבים שוב ב 220 x גרם במשך 5 שניות. לאחר מכן, לבסוף צנטריפוגה ב 1,000 x גרם במשך 5 דקות ב 4 מעלות צלזיוס.
הערה: יחס הנפח של ריאגנטים למיצוי חלבון ציטופלסמי A ו-B הוא 20:1. - הסר את supernatant ולהשהות את הכדור ב 1 מ"ל של PBS. לאחר מכן, צנטריפוגה ב 1,000 x גרם ב 4 ° C למשך 4 דקות. הסר את הסופר-נאטנט והשהה ב-100 μL של PBS כהשעיית גרעין התא.
- הוסיפו טריפן כחול לתרחיף גרעין התא הנ"ל והכתימו אותו בטמפרטורת החדר (25 מעלות צלזיוס) למשך 4 דקות. יחס הנפח של תמיסת טריפן כחולה לתרחיף הגרעין הוא 1:1. ספרו את מספר הגרעינים מתחת למיקרוסקופ ההפוך עם מטרה של פי 10.
הערה: כדי לזהות בבירור את גרעיני התאים מתחת למיקרוסקופ, נדרש צביעה כחולה טריפאן. תמיסת Trypan blue צריכה להיות באמבט מים בטמפרטורה של 37 מעלות צלזיוס למשך 10 דקות לפני השימוש להכתמה יעילה. - דלל את תרחיף גרעין התא הנ"ל עם חיץ PBS לריכוז של 2-3 x 105 גרעין למ"ל. סנן את תרחיף גרעין התא דרך מסננת של 70 מיקרומטר.
3. מדידת הדחיסות של התא והגרעין
- הגדרת מערכת המדידה (איור 3)
- הפעל את מקור האור של המיקרוסקופ ופתח את תוכנת המצלמה. השתמש במטרה 4x כדי למצוא את המיקום האמצעי של המיקרו-ערוץ, כלומר את המיקום של הקרמיקה הפיאזואלקטרית.
- חבר את החוטים וריתך אותם להדקים החיוביים והשליליים של פלט מחולל האותות על הקרמיקה הפיאזואלקטרית, בהתאמה.
- מניחים את המזרק על משאבת המיקרו-הזרקה ומחברים אותו לקטטר הכניסה. הניחו מיכל קטן בקצה קטטר היציאה כדי להחזיק את הנוזל הזורם מתוך המיקרו-ערוץ.
- קביעת פרמטרי מדידה
- שאפו את תמיסת חלקיקי הפוליסטירן עם המזרק והזריקו אותו למיקרו-ערוץ השבב. הימנע מבועות אוויר במיקרו-ערוץ השבב כדי להבטיח מדידה מדויקת. ודא כי חלקיקים מופצים באופן שווה במיקרו-ערוץ השבב.
הערה: ניתן לבצע מדידה ללא זרימה או משאבת מזרק. במידת הצורך, יש להגדיר את קצב הזרימה של משאבת המיקרו-הזרקה לערך מתאים. כאן, טווח קצב הזרימה הוא 0-20 μL / h. - הגדר את הפלט של מחולל האותות לאות סינוס עם תדר של 1 MHz (3 MHz למדידת גרעין התא) ומתח שיא לשיא (Vpp) של 10 V.
- כוונן את תדירות האות עד שנצפה שהחלקיקים נעים לעבר קו האמצע של המיקרו-ערוץ ונשארים בתנועה קדימה לאורך קו האמצע לאחר שהגיעו לקו האמצע (איור 4).
הערה: מהירות החלקיקים הנעים לכיוון קו האמצע נקבעת על ידי משרעת המתח, הניתנת להתאמה בין 5 Vpp ל- 20 Vpp.
- שאפו את תמיסת חלקיקי הפוליסטירן עם המזרק והזריקו אותו למיקרו-ערוץ השבב. הימנע מבועות אוויר במיקרו-ערוץ השבב כדי להבטיח מדידה מדויקת. ודא כי חלקיקים מופצים באופן שווה במיקרו-ערוץ השבב.
- מדידת תאים וגרעינים
- מערבבים 1 מ"ל תא או תרחיף גרעין עם תמיסת החלקיקים הסטנדרטית ביחס של 1:1 ומזריקים אותו למיקרו-ערוץ עם מזרק.
- התחל להקליט במצלמת CCD כאשר התאים או הגרעינים נכנסים לשדה הראייה. לאחר מכן, הפעל את מחולל האותות. הפסק להקליט כאשר התאים או הגרעינים מגיעים לקו האמצע.
- יש לשטוף את המיקרו-ערוץ במים שעברו דה-יוניזציה, 75% אלכוהול ומים שעברו דה-יוניזציה ברצף לשימוש מאוחר יותר.
4. עיבוד נתונים
- מיפוי מסלולי חלקיקים או תאים.
- ייבא את הסרטון שצולם לתוכנת ImageJ: הקובץ > פתוח> בחר תיקייה. לחץ על צורת האליפסה בסרגל הכלים של תוכנת ImageJ כדי לבחור תא מעניין ואת החלקיק הסמוך לו (איור 5).
- כפי שמוצג באיור 5, פרמטרי מדידה מוגדרים מראש בתוכנת ImageJ כ'ניתוח→ ' הגדר מדידה →שטח', 'סנטרואיד', 'תווית תצוגה'.
- לקיחת המסגרת שבה תא המטרה או החלקיק עוברים תזוזה אורכית כמסגרת ההתחלה; הקלט את מיקום הפיקסלים וגודלו של התא או החלקיק בכל מסגרת עד שיגיע לקו האמצע של המיקרו-ערוץ. ייצא את הנתונים כקובץ גיליון אלקטרוני וחזור על השלב עד לקבלת מסלולים עבור כל התאים המעניינים.
- תיאום טרנספורמציה ותיקון.
- רשום את קואורדינטות הפיקסלים של ארבע פינות המיקרו-ערוץ בשדה ראייה זה כ- (0, y1), (0, y2), (x3, y3), (x4, y4). כאן x3 = x4.
- עבור כל נקודת מדידה (xi, yi), חשב את הקואורדינטות החדשות (xi', yi') לאחר תיקון סיבוב באמצעות הנוסחאות הבאות:
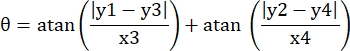
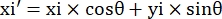

- המרת קואורדינטות פיקסלים לקואורדינטות בגודל אמיתי. ניתן לקבל את הקואורדינטות בפועל על ידי הכפלת קואורדינטות פיקסלים ביחס. היחס היה הרוחב הממשי של המיקרו-ערוץ חלקי רוחב הפיקסלים (H) של המיקרו-ערוץ.
- שנה ותקן את קואורדינטות הפיקסלים של התאים והחלקיקים המתקבלים בשלב 4.1 לנתוני מסלול התנועה הסופי. כל הקואורדינטות פחות הקואורדינטות של הפינה השמאלית התחתונה, כלומר (0, y2). קצב המסגרות של הווידאו הוא 40 פריימים לשנייה, כך להכפיל את מספר המסגרות המתאימות לכל קואורדינטות על ידי 0.025 s כדי לקבל את הזמן של תנועת החלקיקים, ובכך לקבל את השינוי של המיקום בכיוון y עם הזמן.
- חשבו את צפיפות האנרגיה האקוסטית (איור 6A,B).
- תנועת התא או החלקיק בכיוון Y מונעת על ידי הכוח האקוסטי F ac והכוח ההידרודינמי FD. חשב את מסלול התנועה באמצעות הנוסחאות הבאות:
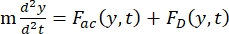 (1)
(1)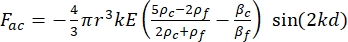 (2)
(2)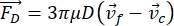 (3)
(3)
כאשר r ו-D הם הרדיוס והקוטר של התא או החלקיק, ρ ו-β הם הצפיפות והדחיסות, ν הוא וקטור המהירות. הכתבים המשניים c ו - f מציינים את התא ואת הנוזל, בהתאמה. d הוא המרחק מצומת הלחץ האקוסטי הקרוב ביותר, μ הוא הצמיגות הדינמית של הנוזל, k הוא מספר הגל, ו - E הוא צפיפות האנרגיה האקוסטית.
הערה: הצפיפות של MCF7, HCT116, A549 וגרעיני התא הייתה 1068 ק"ג/מ"ר 3, 1077 ק"ג/מ"ר 3, 1073 ק"ג/מ"ק 3 ו-1155 ק"ג/מ"ק 3, בהתאמה 12,16,17. - על פי הנוסחאות המתוארות בשלב 4.3.1, השתמש בתוכנת MATLAB כדי לקבל את הפתרון המספרי עבור מסלול החלקיקים הסטנדרטי תחת השדה האקוסטי עם שיטת הפרש סופי.
- בטווח השדה האקוסטי המוגדר מראש, שנה את צפיפות האנרגיה האקוסטית והתאם את הפתרון המספרי (המתקבל בשלב 4.3.2) ואת מסלול התנועה הנמדד (המתקבל בשלב 4.2) עבור החלקיק הסטנדרטי. בחר את התוצאה המתאימה ביותר בהתאם לשגיאת ריבוע ממוצע ההתאמה. צפיפות האנרגיה האקוסטית המתקבלת כאן משמשת כפרמטר לחישוב הבא של דחיסות התא.
- תנועת התא או החלקיק בכיוון Y מונעת על ידי הכוח האקוסטי F ac והכוח ההידרודינמי FD. חשב את מסלול התנועה באמצעות הנוסחאות הבאות:
- חשב את דחיסות התאים (איור 6C,D).
- הגדר את צפיפות האנרגיה האקוסטית לערך המתקבל בשלב 4.3.3.
- על פי הנוסחאות המתוארות בשלב 4.3.1, השתמש בתוכנת MATLAB כדי לקבל את הפתרון המספרי למסלול התא מתחת לשדה האקוסטי בשיטת הפרש סופי.
- בדומה לשלב 4.3.3, בטווח הדחיסות המוגדר מראש, שנה את הדחיסות והתאם את הפתרון המספרי (המתקבל בשלב 4.4.2) ואת מסלול התנועה הנמדד עבור התא (המתקבל בשלב 4.2). השתמש במקדם הדחיסות המתאים לתוצאה המתאימה ביותר כדחיסות התא הנמדדת.
תוצאות
כאן, העבודה הציגה פרוטוקול לבניית מערכת מדידת דחיסות תאים מהירה ולא הרסנית המבוססת על מיקרו-מכשיר אקוסטופלואידי והדגימה את יתרונותיה למדידת תאים וגרעין במצבים שונים. איור 1 מראה את הסכימה של הערוץ המיקרופלואידי. הרכיבים וההרכבה של המיקרו-מכשיר האקוסטופלואידי מוצגים
Discussion
שיטות מדידה נפוצות במכניקת התא הן AFM, שאיפת מיקרו-פיפטה, שיטות מיקרופלואידיות, טכניקת לוחות מקבילים, פינצטה אופטית, אלונקה אופטית ושיטות אקוסטיות20. שיטות מיקרופלואידיקה יכולות לעבוד עם שלוש גישות: מיקרו-כיווץ, זרימה מאריכה וזרימת גזירה. ביניהם, אלונקה אופטית, פינצטה אופטית, שי...
Disclosures
למחברים אין אינטרסים כספיים מתחרים או ניגודי עניינים אחרים.
Acknowledgements
מחקר זה נתמך על ידי הקרן הלאומית למדעי הטבע של סין (מספרי מענקים 12075330 ו- U1932165) והקרן למדעי הטבע של מחוז גואנגדונג, סין (מענק מספר 2020A1515010270).
Materials
| Name | Company | Catalog Number | Comments |
| 0.25% trypsin(1x) | GIBCO | 15050-065 | |
| 502 glue | Evo-bond | cyanoacrylate glue | |
| A549 | ATCC | CCL-185 | lung adenocarcinoma |
| Cytonucleoprotein and cytoplasmic protein extraction kit | Beyotime | P0027 | Contains cytoplasmic protein extraction reagents A and B |
| Dulbecco’s modified Eagle medium (DMEM) | corning | 10-013-CVRC | |
| Fetal Bovine Srum(FBS) | AUSGENEX | FBS500-S | |
| HCT116 | ATCC | CCL247 | colorectal carcinoma |
| Heat-resistant glass | Pyrex | ||
| Leibovitz’s L-15 medium | GIBCO | 11415-064 | |
| MCF-7 | ATCC | HTB-22 | breast Adenocarcinoma |
| MDA-MB-231 | ATCC | HTB-26 | breast Adenocarcinoma |
| Minimum Essential Medium (MEM) | corning | 10-010-CV | |
| Penicillin-Streptomycin | GIBCO | 15140-122 | |
| Phosphate buffer | corning | 21-040-cvc | |
| PMSF | Beyotime | ST506 | 100mM |
| Polybead Polystyrene Red Dyed Microsphere | polysciences | 15714 | The diameter of microshpere is 6.00µm |
| propidium iodide(PI) | Sigma-Aldrich | P4170 | |
| SYLGARD 184Silicone ELASTOMER | Dow-Corning | 1673921 | Contains prepolymers and curing agents |
| Trypan Blue | Beyotime | C0011 |
References
- Wirtz, D., Konstantopoulos, K., Searson, P. C. The physics of cancer: the role of physical interactions and mechanical forces in metastasis. Nature Reviews. Cancer. 11 (7), 512-522 (2011).
- Frame, F. M., et al. HDAC inhibitor confers radiosensitivity to prostate stem-like cells. British Journal of Cancer. 109 (12), 3023-3033 (2013).
- Tseng, Y., Kole, T. P., Wirtz, D. Micromechanical mapping of live cells by multiple-particle-tracking microrheology. Biophysical Journal. 83 (6), 3162-3176 (2002).
- Möller, W., Brown, D. M., Kreyling, W. G., Stone, V. Ultrafine particles cause cytoskeletal dysfunctions in macrophages: role of intracellular calcium. Particle and Fibre Toxicology. 2, 7 (2005).
- Wang, X., et al. A three-dimensional magnetic tweezer system for intraembryonic navigation and measurement. IEEE Transactions on Robotics. 34 (1), 240-247 (2018).
- Machida, S., et al. Direct manipulation of intracellular stress fibres using a hook-shaped AFM probe. Nanotechnology. 21 (38), 385102 (2010).
- Bufi, N., et al. Human primary immune cells exhibit distinct mechanical properties that are modified by inflammation. Biophysical Journal. 108 (9), 2181-2190 (2015).
- Hogan, B., Babataheri, A., Hwang, Y., Barakat, A. I., Husson, J. Characterizing cell adhesion by using micropipette aspiration. Biophysical Journal. 109 (2), 209-219 (2015).
- Jung, J. -. W., et al. Ionising radiation induces changes associated with epithelial-mesenchymal transdifferentiation and increased cell motility of A549 lung epithelial cells. European Journal of Cancer. 43 (7), 1214-1224 (2007).
- Hartono, D., et al. On-chip measurements of cell compressibility via acoustic radiation. Lab-on-a-Chip. 11 (23), 4072-4080 (2011).
- Sitters, G., et al. Acoustic force spectroscopy. Nature Methods. 12 (1), 47-50 (2015).
- Augustsson, P., Karlsen, J. T., Su, H. -. W., Bruus, H., Voldman, J. Iso-acoustic focusing of cells for size-insensitive acousto-mechanical phenotyping. Nature Communications. 7 (1), 11556 (2016).
- Cushing, K. W., et al. Ultrasound characterization of microbead and cell suspensions by speed of sound measurements of neutrally buoyant samples. Analytical Chemistry. 89 (17), 8917-8923 (2017).
- Riaud, A., Wang, W., Thai, A. L. P., Taly, V. Mechanical characterization of cells and microspheres sorted by acoustophoresis with in-line resistive pulse sensing. Physical Review Applied. 13 (3), 034058 (2020).
- Petersson, F., Aberg, L., Swärd-Nilsson, A. -. M., Free Laurell, T. flow acoustophoresis: microfluidic-based mode of particle and cell separation. Analytical Chemistry. 79 (14), 5117-5123 (2007).
- Griwatz, C., Brandt, B., Assmann, G., Zänker, K. S. An immunological enrichment method for epithelial cells from peripheral blood. Journal of Immunological Methods. 183 (2), 251-265 (1995).
- Katholnig, K., Poglitsch, M., Hengstschläger, M., Weichhart, T. Lysis gradient centrifugation: a flexible method for the isolation of nuclei from primary cells. Methods in Molecular Biology. 1228, 15-23 (2015).
- Fu, Q., Zhang, Y., Huang, T., Liang, Y., Liu, Y. Measurement of cell compressibility changes during epithelial-mesenchymal transition based on acoustofluidic microdevice. Biomicrofluidics. 15 (6), 064101 (2021).
- Zhang, Y., et al. Ionizing radiation-induced DNA damage responses affect cell compressibility. Biochemical and Biophysical Research Communications. 603, 116-122 (2022).
- Hao, Y., et al. Mechanical properties of single cells: Measurement methods and applications. Biotechnology Advances. 45, 107648 (2020).
- Yousafzai, M., et al. Effect of neighboring cells on cell stiffness measured by optical tweezers indentation. Journal of Biomedical Optics. 21 (5), 057004 (2016).
- Wei, M. -. T., et al. A comparative study of living cell micromechanical properties by oscillatory optical tweezers. Optics Express. 16 (12), 8594-8603 (2008).
- Khan, Z. S., Vanapalli, S. A. Probing the mechanical properties of brain cancer cells using a microfluidic cell squeezer device. Biomicrofluidics. 7 (1), 011806 (2013).
- Hirawa, S., Masudo, T., Okada, T. Acoustic recognition of counterions in ion-exchange resins. Analytical Chemistry. 79 (7), 3003-3007 (2007).
- Joosse, S. A., Gorges, T. M., Biology Pantel, K. detection, and clinical implications of circulating tumor cells. EMBO Molecular Medicine. 7 (1), 1-11 (2015).
- Martin, O. A., Anderson, R. L., Narayan, K., MacManus, M. P. Does the mobilization of circulating tumour cells during cancer therapy cause metastasis. Nature Reviews Clinical Oncology. 14 (1), 32-44 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved