Method Article
שימוש בהדמיית in vivo לבדיקת פנוטיפים של מורפוגנזה בזנים מוטנטיים של קנדידה אלביקנס במהלך זיהום פעיל בפונדקאי של יונקים
In This Article
Summary
כתב יד זה מתאר שיטה לסינון ספריות מוטנטיות בגודל בינוני של קנדידה אלביקנס עבור פנוטיפים של מורפוגנזה במהלך זיהום פעיל בפונדקאי של יונקים באמצעות מיקרוסקופיה קונפוקלית לא פולשנית.
Abstract
קנדידה אלביקנס היא פתוגן אנושי חשוב. יכולתו לעבור בין צורות מורפולוגיות היא מרכזית לפתוגנזה שלו; שינויים מורפולוגיים אלה מווסתים על ידי רשת איתות מורכבת הנשלטת בתגובה לגירויים סביבתיים. רכיבים רגולטוריים אלה נחקרו מאוד, אך כמעט כל המחקרים משתמשים במגוון גירויים במבחנה כדי להפעיל נימה. כדי לקבוע כיצד מורפוגנזה מווסתת במהלך תהליך הפתוגנזה, פיתחנו מערכת מיקרוסקופיה in vivo כדי לקבל תמונות ברזולוציה מרחבית גבוהה של אורגניזמים העוברים היווצרות היפאלית בתוך פונדקאי היונקים. הפרוטוקול המוצג כאן מתאר את השימוש במערכת זו כדי לסנן אוספים קטנים של זנים מוטנטיים של C. albicans , ומאפשר לנו לזהות רגולטורים מרכזיים של מורפוגנזה כפי שהיא מתרחשת באתר ההדבקה. מוצגות תוצאות מייצגות, המוכיחות כי לחלק מהרגולטורים של מורפוגנזה, כגון רגולטור השעתוק Efg1, יש פנוטיפים עקביים במבחנה וב- in vivo , בעוד שלרגולטורים אחרים, כגון אדניל ציקלאז (Cyr1), יש פנוטיפים שונים באופן משמעותי in vivo בהשוואה ל- in vitro.
Introduction
קנדידה אלביקנס היא פתוגן פטרייתי אנושי נפוץ, הגורם למחלות רירית, מחלה מופצת וזיהומים מקומיים ברקמות1. תכונה מרכזית של הפיזיולוגיה של C. albicans היא הצמיחה הפולימורפית המורכבת שלה, הקשורה לתפקידה הן כקומנסל והן כפתוגן 2,3,4. בתנאים מזינים עשירים במבחנה בטמפרטורה של 30 מעלות צלזיוס, הוא גדל בדרך כלל כשמרים ניצני ביצית. מגוון של טריגרים סביבתיים, כולל מחסור בחומרים מזינים, שינויי pH, צמיחה בטמפרטורה של 37 מעלות צלזיוס, חשיפה לסרום וגדילה כאשר הם מוטמעים באגר, גורמים למעבר לדפוס גדילה מקוטב, וכתוצאה מכך נוצרים היפאה אמיתית ו/או פסאודו-היפאה5. התחלת הצמיחה המקוטבת והצמיחה הנובעת מכך של אורגניזמים נימה מכונה מורפוגנזה.
בגלל החשיבות של מורפוגנזה באלימות של האורגניזם, הוויסות של היווצרות hyphal נחקר בהרחבה 6,7. קיימת רשת מורכבת של מסלולי איתות וויסות שעתוק המפעילה מורפוגנזה. למרות הקשר בין מורפוגנזה של C. albicans לבין פתוגנזה, רוב המחקרים שחקרו מורפוגנזה השתמשו בגירויים חוץ-גופיים כדי לעורר היווצרות היפלים. מתברר יותר ויותר כי המודלים השונים של נימה במבחנה אינם זהים מבחינת המסלולים הרגולטוריים האינדיבידואליים המגורה. יתר על כן, תנאי גידול במבחנה אינם תואמים באופן הדוק את הסביבה המורכבת של המארח. בהתחשב בחשיבותו של C. albicans כפתוגן אנושי, מטרת פרוטוקול זה היא לחקור את המורפוגנזה שלו במהלך זיהום פעיל בפונדקאי יונק באמצעות מערכת עם תפוקה מתונה, ובכך לאפשר לחוקר לסנן ספריות מוטנטיות של C. albicans.
כדי להקל על חקירות אלה, פותחה מערכת הדמיה in vivo המאפשרת לנו לקבל תמונות ברזולוציה מרחבית גבוהה של תאי C. albicans במהלך זיהום של פינה של עכבר מורדם באמצעות מיקרוסקופ קונפוקלי הפוך 8,9,10. מכיוון שהעור של הפינה הוא דק למדי, תמונות אלה ניתן להשיג ללא צורך דיסקציה רקמות. לפיכך, נתוני פנוטיפ כמותיים ניתן למדוד באתר של זיהומים פעילים בתוך הרקמה המארחת. הפרוטוקול המתואר כאן כולל טרנספורמציה של זן ייחוס וזן מוטנטי אחד או יותר עם קלטות ביטוי חלבון פלואורסצנטיות שונות11,12. לאחר מכן, הזנים המבטאים חלבון פלואורסצנטי מעורבבים ומוזרקים יחד באופן תוך-עורי. לאחר ההדבקה, הדמיה confocal משמש לכמת הן את תדירות החוטים ואת אורך החוטים שנוצרו. הנתונים המתקבלים מהזנים המוטנטיים מנורמלים לאלה המתקבלים מזן הייחוס, הנמצא באותו אזור רקמות, ובכך מספקים בקרה פנימית. מערכת זו אפשרה לנו לסנן בהצלחה מספר סדרות של זנים מוטנטיים מסוג C. albicans, שלרבים מהם יש פגמים במורפוגנזה במבחנה 9,10. רבים מהזנים האלה נימה בקלות in vivo, מה שמדגיש את החשיבות של מודלים in vivo לחקר מורפוגנזה.
Protocol
המחקרים בפרוטוקול זה אושרו על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים של אוניברסיטת איווה (IACUC). עיין בהנחיות ה- CDC לציוד ונהלים לעבודה עם אורגניזמים BSL213.
1. הכנת זני קנדידה אלביקנס
- זהה זן ייחוס מתאים לשימוש כבקרה חיובית. ודא שזן זה תואם באופן הדוק את הזנים הניסיוניים מבחינת השושלת והמניפולציות הגנטיות שלו.
הערה: עבור הניסויים המייצגים שהוצגו כאן, המוטנטים נוצרו מהזנים המתוארים ב- Homann, et al.14, שנבנו מ- SN152. מוטנטים אלה הם Arg-. לכן, זן הייחוס שנבחר היה SN250, שנוצר גם הוא מ- SN152 והוא גם Arg-. גורמי עקה תזונתיים הם קריטיים בוויסות של צמיחה מקוטבת בשמרים Saccharomyces cerevisiae15; הם גם היו מעורבים נימה ב C. albicans ופטריות אחרות16,17,18. לכן, יש להתאים את זן הייחוס לאוקסוטרופיות עם זני הניסוי במידת האפשר, כדי למנוע השפעות מבלבלות פוטנציאליות של לחץ תזונתי. - בחרו במבנים של ביטוי חלבון פלואורסצנטי. בעת סינון מגוון זנים ניסיוניים, צור זן ייחוס המבטא חלבון פלואורסצנטי אחד והשתמש בחלבונים פלואורסצנטיים אחרים כדי לסמן את הזנים המוטנטיים.
הערה: הנתונים המייצגים המוצגים כאן משתמשים ב-NEON עבור זן הייחוס וב-iRFP עבור הזנים המוטנטיים. ניתן להשתמש בכל חלבון פלואורסצנטי אם הוא מתבטא מאוד, בהיר יחסית, ומסוגל להיות נרגש/מזוהה על ידי המיקרוסקופ שבו נעשה שימוש. ניסויי בקרה שהשוו זני ייחוס המבטאים חלבונים פלואורסצנטיים שונים לא הדגימו כל השפעה של ביטוי חלבון פלואורסצנטי על מורפוגנזה. - שנו את הזנים בעזרת מבנים של ביטוי חלבון פלואורסצנטי.
הערה: מוסדות רבים דורשים שימוש באמצעי זהירות ביולוגיים ברמה 2 לעבודה עם C. albicans. כל העבודות צריכות להתבצע בהתאם לתקנות הבטיחות המקומיות. ללא קשר לתקנות המקומיות, חוקרים העובדים עם C. albicans חייבים להיות מאומנים בטיפול בטוח של האורגניזם.- שנה את זני הייחוס והניסוי באמצעות פרוטוקולים סטנדרטיים של ליתיום אצטט19.
הערה: הניסויים המתוארים כאן משתמשים בפלסמידים pENO1-NEON-NAT R ו-pENO1-iRFP-NATR, המסופקים בנדיבות על ידי ד"ר רוברט וילר11,12. פלסמידים עברו ליניאריזציה באמצעות NotI9. - בחר את הטרנספורמנטים על סמך צמיחה על נורסותריצין או מדיום בחירה רלוונטי אחר.
- זהה טרנספורמטורים מוצלחים. בחרו מעט תאים מכל מושבה באמצעות קיסם ואז ערבבו אותם עם טיפת מים של 2.5 מיקרולטר במגלשה במיקרוסקופ. יש למרוח מכסה ולבחון בהגדלה של 10x-40x. יש לבחון באמצעות מערכת הדמיה קונפוקלית (המשמשת להמשך הפרוטוקול) או כל מיקרוסקופ פלואורסצנטי סטנדרטי רחב שדה. לטרנספורמטורים מתאימים יהיה אות בהיר עם אורכי גל עירור ופליטה מתאימים.
הערה: לקבלת התוצאות המייצגות, זני NEON המבטאים הודגמו באמצעות מיקרוסקופ פלואורסצנטי זקוף עם מסנן מעבר ארוך עם מסנן עירור פס פס 472/30 ננומטר, מסנן פליטת פס פס פס של 520/35 ננומטר, ומפצל קרן דיכרואי בעל קצה יחיד של 495 ננומטר. מכיוון ש-iRFP אינו נראה לעין, זני iRFP המבטאים הודגמו באמצעות מערכת המיקרוסקופיה הקונפוקלית המשמשת להדמיית in vivo , תוך שימוש בלייזר 638 ננומטר לעירור וגילוי אור פליטה מ-655-755 ננומטר.- לחלופין, יש להעריך פלואורסצנטיות של מושבה מקרוסקופית באמצעות סטריאומיקרוסקופיה פלואורסצנטית, מערכות עירור פלואורסצנטיות ידניות, או מערכות גילוי פלואורסצנטיות המשמשות בדרך כלל לג'לים ולכתמים מערביים.
- צור מלאי מקפיא של חומרי שינוי צורה שנבחרו.
- שנה את זני הייחוס והניסוי באמצעות פרוטוקולים סטנדרטיים של ליתיום אצטט19.
- חיסון YPD (דקסטרוז פפטון תמצית שמרים) מצע מוצק עם ייחוס המבטא חלבון פלואורסצנטי וזני ניסוי ממלאי מקפיא 3 ימים לפני ההזרקה, באמצעות קיסם כדי להעביר פיסת אורגניזמים ממלאי המקפיא למדיה המוצקה של YPD. דגירה ב 30 °C (80 °F) במשך 2 ימים.
- עבור כל זן, יש לחסן בקבוקון המכיל 25 מ"ל של YPD עם תאי C. albicans שנלקחו ממספר מושבות יום אחד לפני ההזרקה. עשו זאת על ידי שימוש בקיסם כדי להעביר פיסת אורגניזמים ממושבה אחת ל-YPD; חזור מספר פעמים כדי לקבל תאים מכמה מושבות שונות. דגירה לילה ב-30 מעלות צלזיוס באינקובטור שייקר מסלולי ב-175 סל"ד.
הערה: חשוב להשתמש במושבות מרובות כמקור לאינוקולום מכיוון של - C. albicans יש תדירות גבוהה של שינויים גנטיים ספונטניים. שימוש במספר מושבות בעת הפעלת תרבית אינוקולום ממזער את הסיכוי שכל האורגניזמים באינוקולום נובעים מהורה עם שינויים ספונטניים משמעותיים. - ביום ההזרקה:
- צנטריפוגה 1 מ"ל של התרבות במשך 2 דקות ב 500 x גרם.
- שטפו את התרבית שלוש פעמים עם 1 מ"ל של תמיסת מלח סטרילית של דולבקו (dPBS). לאחר הכביסה הסופית, להשעות את הכדור ב 1 מ"ל של dPBS סטרילי.
- לדלל דגימה של תרבית שטף בשעה 1:100 ולספור באמצעות hemocytometer.
- התאם את צפיפות התרבית השטופה ל-1 x 108 אורגניזמים למ"ל באמצעות dPBS.
- עבור כל קבוצת זנים שיש להזריק, צור את האינוקולום על ידי ערבוב נפחים שווים של זן הייחוס וזן הניסוי(ים). זה שומר על צפיפות האינוקולום ב 1 x 108 אורגניזמים למ"ל.
הערה: מספר הזנים שניתן להעריך בכל אוזן מוגבל על ידי היכולת של מערכת המיקרוסקופיה המשמשת להבחין בבירור את האות מכל חלבון פלואורסצנטי. - לאחר הכנת האינוקולום, המשך ישירות לזריקות בעלי החיים. אין לאחסן את החיסון לפני השימוש.
2. הכנת בעלי חיים
- קבל אישור מהוועדה המוסדית המקומית לטיפול ושימוש בבעלי חיים או מהגוף המנהל המקומי הרלוונטי.
- השג עכברים בני 6-12 שבועות מספק או מתוכנית רבייה. עכברי בית במתקן שבו הם יחיו לאורך כל הניסוי לפחות שבוע לפני החיסון.
הערה: לקבלת התוצאות המייצגות, נעשה שימוש בעכברי DBA2/N נקבות בנות 6 שבועות. - יש להאכיל בעלי חיים בצ'או נטול כלורופיל במשך 7 ימים לפחות לפני החיסון.
3. הסרת שיער וחיסון
- לגרום למישור ניתוחי של הרדמה (איור 1).
אזהרה: חומרי הרדמה בשאיפה הם חומרים מסוכנים ועלולים לגרום לגירוי בעיניים או בעור, כמו גם לרעילות במערכת העצבים. יש לעקוב אחר כל המדיניות והנהלים המוסדיים ונוהלי הבטיחות הכללי במעבדה לשימוש בחומרי הרדמה בשאיפה. רק אנשים שהוכשרו בשימוש בחומרי הרדמה בשאיפה רשאים לבצע שלבים אלה. שיטות העבודה המקובלות כוללות לבישת כפפות, מעיל מעבדה, הגנה על העיניים, שימוש במערכת הרדמה וניהול רשומות קפדני בהתאם להנחיות המוסדיות.- מניחים עכבר בתא אינדוקציה של הרדמה שחומם מראש. שמור על בעל החיים בסביבה חמה לאורך הרדמה כללית. השיגו זאת באמצעות רפידות חימום המיועדות למטרה זו ושלב מיקרוסקופ מחומם. אין להשתמש בכרית חימום ללא מרשם, שכן היא עלולה להתחמם יתר על המידה ולגרום לכוויות.
- ספק 2%-3% איזופלוראן לתא האינדוקציה עד שהעכבר איבד את רפלקס הימין שלו והנשימה איטית ויציבה. נקה את חדר האינדוקציה של ההרדמה והעבר את החיה לחרוט אף שאינו rebreather המספק 1%-2% isoflurane.
- אמת את מישור ההרדמה באמצעות רפלקס כיווץ הבוהן או מנגנוני אימות אחרים. במהלך הניסוי, עקבו אחר דפוס הנשימה ומישור ההרדמה של החיה, והתאימו את ריכוז ההרדמה לפי הצורך.
- יש למרוח חומר סיכה לעיניים למניעת התייבשות הקרנית.
- הסרת שיער (איור 1C,D)
- יש למרוח קרם דפילציה ללא מרשם בנדיבות על המשטח הפנימי והחיצוני של שתי האוזניים באמצעות צמר גפן.
- לאחר 2-3 דקות (או לפי הוראות היצרן), נגבו בעדינות את האוזן עם כרית גזה יבשה כדי להסיר את כל השמנת והשיער. נגבו פעמיים נוספות עם רפידות גזה רוויות במים סטריליים להסרה מלאה של שאריות קרם דפילציה. אי הסרת כל קרם הדפילציה תגרום לגירוי/דלקת בעור.
- הזרקה (איור 1E, F)
- נגבו את פני האוזן כדי להזריק כרית גזה רוויה ב-70% אתנול והניחו לה להתייבש באוויר.
- מערבבים היטב את האינוקולום על ידי היפוך מספר פעמים או מערבולת.
- שאבו 20-30 μL של אינוקולום לתוך מזרק אינסולין. כשהם מחזיקים את המחט כלפי מעלה, מקישים על המזרק בעדינות כדי לוודא שכל האוויר בחבית נמצא בחלק העליון. יש לפלוט בזהירות אוויר ועודפי אינוקולום בחזרה לצינור האינוקולום או לצינור פסולת, כך שהבוכנה תהיה בסימן 10 μL.
- לבישת אצבעון על אצבע או אגודל של היד הלא דומיננטית, ייצבו את האוזן על ידי עטיפתה על פני האצבע. לחלופין, יש למרוח סרט עור דו-צדדי (סרט אופנה) ללא מרשם על צינור פלסטיק חרוטי קטן או בעל תחתית עגולה ולעטוף את האוזן על פני הסרט. היזהרו לא לנתק את חרוט האף בהרדמה בזמן שאתם עושים זאת. זה יכול להיות מועיל להדביק את חרטום האף על משטח העבודה.
הערה: ניתן להזריק את הצד הפנימי או החיצוני של האוזן בהתאם לנוחות הפיזית של החוקר. עבור מיקרוסקופיה, הקפידו למקם את העכבר כך שצד האוזן המוזרק פונה לכיוון העדשה האובייקטיבית. - שמירה על מחט המזרק מקבילה כמעט לחלוטין לעור והימנעות מוורידים גדולים, מחדירים את קצה המחט לשכבה החיצונית ביותר של העור עד שהשיקוע רק מכוסה.
- לאט להזריק את inoculum intradermally. הזרקה תוך-עורית טובה תעלה בועה קטנה בעור. יש לשמור את המחט במקומה למשך 15-20 שניות לפני הוצאתה מהאוזן כדי למזער את הדליפה.
- אם הצד התחתון של אוזן החיה נעשה לח, המחט הייתה עמוקה מדי ועברה דרך האוזן לחלוטין. במקרה כזה, חזור על ההזרקה באזור אחר של האוזן.
- חזור על התהליך באמצעות האוזן השנייה של החיה. ניתן לעשות זאת עם אותם זנים של C. albicans עבור שכפול או עם קבוצה שונה של זנים C. albicans.
- אם לא הדמיה מיד, למקם את החיה בתא התאוששות מחומם. התבונן בבעל החיים עד שהתאושש מההרדמה ולאחר מכן החזיר אותו לכלוב הדיור שלו.
- בהתאם לפרוטוקולים המוסדיים, יש לסמן בבירור את הכלוב בתוויות ביו-האזרד ולציין כי בעלי החיים בכלוב נגועים בקנדידה אלביקנס.
- השלם את כל הרשומות הנדרשות הקשורות להרדמה של בעלי חיים וכל פרקטיקה מוסדית נדרשת אחרת.
- אחסן את בעל החיים בתנאי מתקן לבעלי חיים תוך שימוש באמצעי זהירות ברמה 2 של בטיחות ביולוגית של בעלי חיים.
4. כימות מורפוגנזה במבחנה לצורך השוואה לתוצאות in vivo
- באמצעות אותן תרביות שטופות ששימשו להכנת האינוקולום, ליצור דילול של 1:50 של אורגניזמים ב- RPMI1640 + 10% סרום בקר עוברי מומת בחום ולדגור ב 37 מעלות צלזיוס עם רעידות במשך 4 שעות. לחלופין, ניתן להשתמש במדיות אחרות הממריצות מורפוגנזה במבחנה .
- צנטריפוגה את הדגימה במשך 5 דקות ב 500 x g ו resuge ב 0.5 מ"ל של dPBS.
- יש לדלל את הדגימה ביחס של 1:10, להניח 2.5 μL מהדגימה המדוללת על שקופית מיקרוסקופ, ולכסות אותה בכיסוי.
- בחנו את הדגימה באמצעות מיקרוסקופ פלואורסצנטי. סופרים לפחות 100 תאים, ורושמים את מספר תאי השמרים והתאים הננימים עבור כל זן. בתוצאות המייצגות המוצגות כאן, תא נימה מוגדר ככל תא שאורכו יותר מפי שניים מאורכו של תא האם.
הערה: כימות של מורפוגנזה חוץ גופית יכול להיעשות באותו יום כמו חיסון של בעלי החיים. ניתן ליזום את בדיקת המורפוגנזה במבחנה בעת הכנת האינוקולום להזרקה ולבצע את חיסון בעלי החיים במהלך תקופת הדגירה של 4 שעות. אם כל ההליכים בבעלי חיים הושלמו לפני תום תקופת הדגירה של 4 שעות, המשך ישירות לבדיקה של תאים מגורה במבחנה . לחלופין, ניתן להחיות תאים בפורמלדהיד של 3.7% ב-dPBS (בשלב 4.2) ולאחסן אותם בטמפרטורה של 4 מעלות צלזיוס למשך מספר ימים. לאחר מכן ניתן לכמת את האורגניזמים הקבועים ככל שהזמן מאפשר. אין לעכב את חיסון בעלי החיים לצורך בדיקת כימות במבחנה .
5. הכנה להדמיית in vivo
- הכן את המיקרוסקופ (איור 2A).
- הפעל את כל ציוד המיקרוסקופיה והפעל את תוכנת ההדמיה.
- אם אפשרות זו זמינה, טען את כל הגדרות ההדמיה שנקבעו מראש.
- הפעל את הלייזרים והגלאים הדרושים כדי לזהות את החלבונים הפלואורסצנטיים הנמצאים בשימוש.
- הפעל את שלב המיקרוסקופ המחומם ואפשר לו להתחמם ל -37 מעלות צלזיוס.
הערה: ניתן להשתמש במיקרוסקופ עם תא סביבתי סגור לחלוטין ולא במה מחוממת. - קבעו נקודת ייחוס של ציר z כאשר מישור המיקוד נמצא במשטח העליון של הכיסוי. ניתן לעשות זאת על ידי הדבקת מכסה במקום מעל פתח הבמה והנחת טיפת מים על המכסה. השתמש במטרה "יבשה" בהגדלה נמוכה יותר (10x) כדי להתמקד בקצה טיפת המים ולאחר מכן הגדר את נקודת ההתייחסות של ציר z. השתמשו במגבת כדי לספוג את המים מהכיסוי לפני שאתם מסירים אותם מהבמה.
- סובבו את מטרת מרחק העבודה הארוך מאוד למקומה והניחו טיפה של נוזל טבילה על העדשה. הנמיכו את העדשה כדי למנוע נזק אפשרי בעת הנחת הכיסוי.
- הניחו כיסוי #1.5 מעל פתח הבמה והדביקו אותו במקומו. ודא שהסרט מכסה באופן מלא את כל קצוות הכיסוי כדי למנוע מנוזל להתפתל מתחת לכיסוי להחליק לתוך המיקרוסקופ. הרם את המטרה לנקודת הייחוס של ציר z כך שנוזל הטבילה יהיה במגע הן עם העדשה האובייקטיבית והן עם הכיסוי.
- הכינו מספר חתיכות של סרט דביק רגיש ללחץ כך שיהיו מוכנות לשימוש בעת מיקום האף והעכבר.
- הפעל את כל ציוד המיקרוסקופיה והפעל את תוכנת ההדמיה.
- גרום הרדמה כללית בעכבר כדי להצטלם כנ"ל (שלב 3.1).
- מקם את העכבר (איור 2B-D).
- אבטחו חרוט אף בהרדמה על במת המיקרוסקופ כאשר חרוט האף ממוקם כך שהוא יכסה את האף של החיה במלואה כאשר החיה נמצאת בעמדה להדמיה. ניתן להשיג זאת ביתר קלות עם שני חוקרים. בקשו מהחוקר הראשון למקם את אפו של העכבר המרדים לתוך חרטום האף ולהזיז את העכבר למקומו לצורך הדמיה תוך שהוא ממשיך להחזיק את חרטום האף מעל האף של החיה. בקשו מהחוקר השני להדביק את האף ואת הצינורות למקומם כך שהם ישבו ביציבות על אפו של העכבר. לאחר שהאף מודבק במקומו, השאירו אותו שם למשך שארית סשן ההדמיה.
- לאחר הקמת המקום הטוב ביותר למקם את nosecone, לציין את המיקום שלה. בפגישות הדמיה עוקבות, ניתן לאבטח את האף לשלב שלפני הבאת בעל החיים למיקרוסקופ.
- הניחו טיפת מים סטריליים על הכיסוי מעל העדשה האובייקטיבית.
- מקם את העכבר על במת המיקרוסקופ. ודאו שהאוזן נמצאת מעל טיפת המים ושטוחה כנגד הכיסוי.
- השתמשו בכיסוי שני (עליון) כדי לשטח את האוזן.
- מקם את קצה הכיסוי במקביל לגוף העכבר, כאשר הקצה נוגע בעכבר במקום שבו האוזן פוגשת את הראש.
- הנמיכו את הקצה החופשי של הכיסוי לשלב המיקרוסקופ בתנועת ציר. כאשר הכיסוי מגיע כנגד שלב המיקרוסקופ, הוא ישטח את האוזן. היזהרו לא ליצור קפלים או רכסים באוזן.
- הדביקו את הכיסוי העליון במקומו בצורה מאובטחת, כך שהוא יחזיק מספיק לחץ כדי לשמור על האוזן שטוחה. היזהר לא לתפוס את השיער של העכבר או שפם בקלטת.
- אלא אם כן נעשה שימוש במיקרוסקופ עם תא סביבתי, לכסות באופן רופף את גוף העכבר עם וילון סטרילי כדי לשמור על סביבה נורמותרמית.
- זהה תחום עניין.
- ודאו שהמטרה נמצאת בנקודת ההתייחסות של ציר z.
- באמצעות הדמיית אור לבן/שדה רחב, התאימו את מישור המיקוד לרקמת האוזן. אסטרטגיה טובה היא להתמקד בכלי הדם - אם ניתן לראות תאי דם אדומים נעים בכלי הדם, מישור המיקוד נמצא בתוך הרקמה.
- אם המיקרוסקופ מצויד ביכולת פלואורסצנטית בשדה רחב, השתמש בו כדי לזהות תחום עניין. אם לא, השתמש בהדמיה קונפוקלית. באופן כללי, שימוש במיקרוסקופיה רחבת שדה לזיהוי תחומי עניין הוא מהיר יותר ודורש פחות הקרנה של רקמת האוזן.
- באמצעות קוביית סינון לזיהוי החלבון הפלואורסצנטי המתבטא בזן הייחוס, זהה שדה ראייה בעל אות פלואורסצנטי מזן הייחוס. יש לזכור כי אור מחוץ למיקוד ככל הנראה ימנע את היכולת להתמקד באורגניזמים בודדים. מטרת שלב זה היא לזהות תחום עניין להדמיה קונפוקלית.
- שינוי לקוביית סינון שתזהה את החלבון הפלואורסצנטי המתבטא על ידי הזנים הניסיוניים ותוודא את נוכחותם בשדה הראייה שנבחר.
6. הדמיה
- קבע את ההגדרות.
- בזמן שתוכנת ההדמיה נמצאת במצב קונפוקלי חי, בחנו את תחום העניין כאשר מישור המוקד מועבר דרך ציר z. בחרו מישור ציר z עם אות חזק מכל החלבונים הפלואורסצנטיים הנמצאים בשימוש.
- התאם את עוצמת הלייזר ו/או מהירות ההדמיה כדי לקבל אות חזק מספיק כך שניתן יהיה לקבוע מורפולוגיה עבור כל התאים בשדה הראייה. כדי למנוע נזק לרקמות, השתמש בעוצמת הלייזר הנמוכה ביותר האפשרית.
הערה: כמו בכל הדמיה, קיים איזון בין עוצמת לייזר, מהירות רכישה ורזולוציה. זהה הגדרות המזהות בבירור את המורפולוגיה של האורגניזם תוך איזון מהירות ועוצמת לייזר כדי למזער את ההקרנה של רקמת האוזן. מכיוון שההדמיה מתרחשת דרך הדרמיס החיצוני, נדרש כוח לייזר גבוה יותר לעירור מהנדרש בדרך כלל להדמיה קונפוקלית של דגימות מסורתיות המותקנות על שקופיות. למרבה המזל, רמת הרזולוציה המרחבית הנדרשת לניתוח המורפולוגיה אינה קיצונית. לפיכך, קבלת תמונות עם אות מספיק כדי לקבוע את המורפולוגיה של האורגניזם מבלי לגרום נזק לרקמות היא ברת השגה בקלות. - לאחר קביעת פרמטרים אלה, השתמש בהם לאורך כל סשן ההדמיה כדי לשמש כנקודת התחלה למפגשי ההדמיה הבאים. לכן כדאי לשמור את הגדרות ההדמיה.
הערה: אזורים בודדים של זיהום עשויים להיות רדודים יותר או עמוקים יותר בתוך הרקמה. אזורים עמוקים יותר עשויים לדרוש עלייה בכוח הלייזר. מכיוון שבדיקה זו מסתמכת על ההתפלגות המרחבית של האות ולא על עוצמתו, מקובל לשנות את הגדרות התמונה בין השדות לפי הצורך.
- קבל את התמונות.
- בחר שדה ראייה שיש לו היווצרות נימה ברורה בזן הייחוס ושבו רוב האורגניזמים מפוזרים מספיק כדי שניתן יהיה לקבוע את המורפולוגיה שלהם.
- הגדר את מישור המיקוד העליון והתחתון עבור z-stack. אין צורך לכסות את כל עומק האזור הנגוע, אך יש לזכור כי אורגניזמים בחלק העליון או התחתון של נפח התמונה אינם נכללים בדרך כלל בניתוח.
- רכשו תמונות z-stack, צבעו פסאודו בכל ערוץ כדי להבחין בין כל זן, ושכבו את הערוצים. שמור את התמונות.
- חזור על הפעולה עבור שדות תצוגה אחרים. מורפוגנזה יכולה להשתנות ממיקום למיקום; לכן, חשוב לרכוש ולנתח לפחות שלושה שדות מכל אוזן.
7. ניתוח דו מימדי ידני: תדירות הנימה
- השתמש בתוכנת הדמיה כדי לבצע הקרנה מרבית של z-stack לתמונה דו-ממדית. ההוראות המובאות כאן הן עבור FIJI / תמונה J.
- פתח תמונות מיקרוסקופיה באמצעות תוכנת ImageJ.
- במידת הצורך, יש למרוח פסאודו-צבע על כל ערוץ כדי לאפשר זיהוי פשוט של כל זן C. albicans. לשם כך, לחץ על תמונה > טבלת בדיקת מידע > צבע LUT ובחר את צבע פסאודו שנבחר.
- המירו את קובץ האוסף לתמונה דו-ממדית של הקרנה בעוצמה מרבית:
- בחר בקובץ z-stack. לחץ על תמונות > ערימות > הקרנה Z.
- בחר במישור העליון והתחתון ובחר בסוג ההקרנה עוצמה מקסימלית.
- ספרו כל אורגניזם שנראה בתמונות ההקרנה המרביות לפי סוג זן (מובחן לפי צבע ערוץ) ומורפולוגיה.
- אורגניזמים החופפים באופן משמעותי או אזורים עם צפיפות אורגניזמים גבוהה מאוד יהיו קשים לספירה מדויקת. אל תכלול אותם מהספירה, אך היזהר לא להציג הטיה נגד צורות נימה, אשר נוטים יותר לחפוף.
- צורות נימה המקרינות היישר לתוך ערימת z או מחוצה לה יופיעו כאובייקטים עגולים קטנים בהקרנה מרבית. באופן דומה, אורגניזמים שנחתכים על ידי גבול התמונה עשויים להיראות כמו שמרים מכיוון שהחוט נמצא מחוץ לשדה הראייה. לפיכך, ניתוח דו מימדי תמיד יעריך יתר על המידה את אחוז צורות השמרים. מכיוון שזה יתרחש באופן שווה עם זן הייחוס והניסוי(ים), תמיד השווה את תוצאות הניסוי לזו של זן ייחוס.
- בצע השוואות סטטיסטיות של התוצאות כפי שהוכתבו על ידי תכנון הניסוי.
8. ניתוח דו מימדי ידני: אורך נימה
- עבור C. albicans, היווצרות נימה סוטה יכולה להתרחש מכיוון ש: א) פחות תאי שמרים "אם" עוברים מורפוגנזה, ב) חוטים גדלים בקצב איטי יותר, או ג) צמיחת נימה יזומה אך לא נשמרת. כדי להעריך אפשרויות אלה, כמת את אורך נתיב העקומה של כל נימה בתמונת ההטלה המרבית כפונדקאית עבור האורך התלת-ממדי האמיתי (נדון בהמשך).
- כאשר ניצן מתפתח על תא אם, לא ניתן לדעת אם הוא יהפוך לנימה או לשמרים. כדי להבטיח שרק תאים נימה ייכללו בניתוח זה, יש למדוד רק אורגניזמים שבהם תא הבת הוא לפחות כפול מאורכו של תא האם.
- פתח את תמונת ההקרנה המרבית שנוצרה בשלב 7.
- בערכת הכלים ImageJ, לחץ באמצעות לחצן העכבר הימני על הכלי קו ישר/מקוטע ובחר באפשרות קו מקוטע. אפשרות הקו המקוטע מאפשרת למשתמש למדוד את אורך החוט לאורך נתיב מעוקל, הכרח בהתחשב בפלסטיות של חוטי C. albicans.
- מדוד את אורך החוט מצוואר הניצן ועד לקצה הצומח של הנימה. לחץ לחיצה ימנית על צוואר הניצן; המצביע ישתנה לריבוע קטן. עקבו אחר החוט לאורכו, תוך לחיצה על מרכז החוט בכל פעם שיש עקומה, סיבוב או שינוי של הציר הארוך של הנימה. לחץ פעמיים בקצה הגדל של החוט.
- לחץ על Control + M. פעולה זו תפתח חלון קופץ המפרט את מדידות השטח, הממוצע, הדקות, המקסימום והאורך. לאחר מדידת כל נימה, לחצו שוב על Control + M כדי להוסיף את המדידה הנוכחית לטבלת המדידות.
- לאחר מדידת כל החוטים, העתק והדבק את מדידות האורך בקובץ ניתוח נתונים.
- בצע ניתוח סטטיסטי כדי להעריך את התפלגות אורכי החוטים בזן הייחוס ובזן המוטנטי.
9. ניתוח תלת מימדי ידני
- כדי לקבל מדידה מדויקת יותר של מורפוגנזה שמונעת הערכת יתר של צורות שמרים ועשויה לאפשר הבחנה בין פסאודו-היפא ל-hyphae, גלול ידנית למעלה ולמטה דרך ערימת z תוך הערכת המורפולוגיה של כל אורגניזם בשלושה ממדים.
- לחלופין, צרו תמונה תלת-ממדית של כל z-stack ונתחו את הצורה של כל אורגניזם תוך כדי סיבוב התמונה.
10. ניתוח אוטומטי
- באמצעות תוכנת ההדמיה, הפוך את ספירת האורגניזמים ואת המורפולוגיה שלהם לאוטומטית בשניים או שלושה ממדים.
הערה: אלגוריתמים מסוימים להבחנה בין סוגי מורפולוגיה יכולים לגרום להטיה. לפיכך, אסטרטגיות אוטומציה צריכות להיות מאומתות בקפידה ביחס לתכנון הניסוי. ניתוח תמונות אוטומטי מתוכנן ומאומת היטב יכול להגדיל את התפוקה של שלב הניתוח.
תוצאות
התוצאות המוצגות כאן מבוססות על דוחות 9,10 שפורסמו בעבר. מטרת ניתוח זה היא להעריך באופן כמותי את יכולתם של זני C. albicans מוטנטיים לעבור מורפוגנזה במהלך זיהומים פעילים. קשה להעריך את הפרמטרים האופייניים המבדילים בין פסאודוהיפאה ל-hyphae באורגניזמים הגדלים בשלושה ממדים בסביבת in vivo מורכבת. זה נכון במיוחד כאשר מסתכלים על חתכים דו מימדיים שנוצרו על ידי הדמיה confocal. לכן, ניתוח סינון זה מתמקד בזיהוי אורגניזמים הגדלים כנימים לעומת שמרים. עבור מחקרי המשך באמצעות ניתוח מעמיק יותר, כולל שחזורים תלת מימדיים, ניתן להתאים שיטה זו כדי להפלות שמרים, hyphae ו pseudohyphae.
הביטוי של חלבון פלואורסצנטי בזן ייחוס או מוטנטי של C. albicans מאפשר זיהוי ישיר של מורפולוגיה של זן in vivo (איור 3 ואיור 4). באופן כללי, ניתוח מיקרוסקופיית אור כמותית מבוצע בצורה הטובה ביותר כאשר מעטים עד אף אחד מהפיקסלים בתמונה רוויים. עבור פרוטוקול זה, עם זאת, רוויה של התמונה לעתים קרובות מפשט את הניתוח. לוקליזציה של חלבונים פלואורסצנטיים אינה אחידה בכל התא ולעתים קרובות היא גבוהה יותר בשמרים האם מאשר בחוטים. למרבה המזל, לצורך חקירת המורפוגנזה, ההתפלגות המרחבית של האות, ולא עוצמתו, מגדירה את התוצאה. לכן, קבלת תמונות שבהן רוויים פיקסלים רבים משפרת את היכולת לכמת מורפוגנזה בבדיקה זו.
כדי להמחיש את החשיבות של הערכת מורפוגנזה in vivo, מוצגות תוצאות מייצגות עבור זן הייחוס (SN250) ושני מוטאנטים: האחד חסר את גורם השעתוק Efg1 והשני חסר אדניליל ציקלאז Cyr1. במבחנה, אף אחד מהזנים הללו לא גדל כחוטים20,21. כאשר מגדלים אותו במבחנה במדיום RPMI בתוספת סרום של 10%, זן הייחוס יוצר במהירות חוטים, בעוד שהזנים efg1ΔΔ ו-cyr1ΔΔ אינם (איור 3 ואיור 4). בתנאים אלה, המוטציה efg1ΔΔ מציגה צמיחה מקוטבת במקצת, כאשר תאי הבת מוארכים מעט בהשוואה לתאי האם. זה מדגיש את החשיבות של שימוש בהגדרה ברורה של נימה. כל הגדרה כזו היא כברירת מחדל שרירותית, אך היא הכרחית להערכה עקבית של הפנוטיפ. עבור מחקרים אלה, תבנית נימה של גדילה מוגדרת כאורגניזם עם הממד הארוך ביותר של תא בת יותר מפי שניים מזה של תא האם. באמצעות הגדרה זו, תאי efg1ΔΔ המוארכים אינם נימה.
בהתאם לפנוטיפ ה-in vitro שלו, ה-efg1 ΔΔ מציג פגם נימה משמעותי ב-vivo: כ-9% מתאי ה-EFG1ΔΔ גדלו כחוטים in vivo (איור 3). לעומת זאת, 53% מהתאים המוטנטיים cyr1ΔΔ גדלו כחוטים in vivo (איור 4). אף על פי שמספר התאים המוטנטים cyr1 ΔΔ שעברו נימה in vivo היה נמוך משמעותית מזן הייחוס, היכולת של מוטנט cyr1ΔΔ ליצור חוטים in vivo מייצגת שינוי משמעותי מהיעדר מוחלט של מורפוגנזה במבחנה. מבחינה חזותית, החוטים שנוצרו על ידי מוטנט cyr1ΔΔ נראו קצרים יותר מזן הייחוס. כדי להעריך זאת באופן כמותי, אורך נתיב העקומה של התאים הננימים נמדד באמצעות הקרנה דו-ממדית של תמונות in vivo (איור 4E). האורך החציוני של חוטי cyr1ΔΔ היה קצר ב-29% מהחוטים של זן הייחוס.
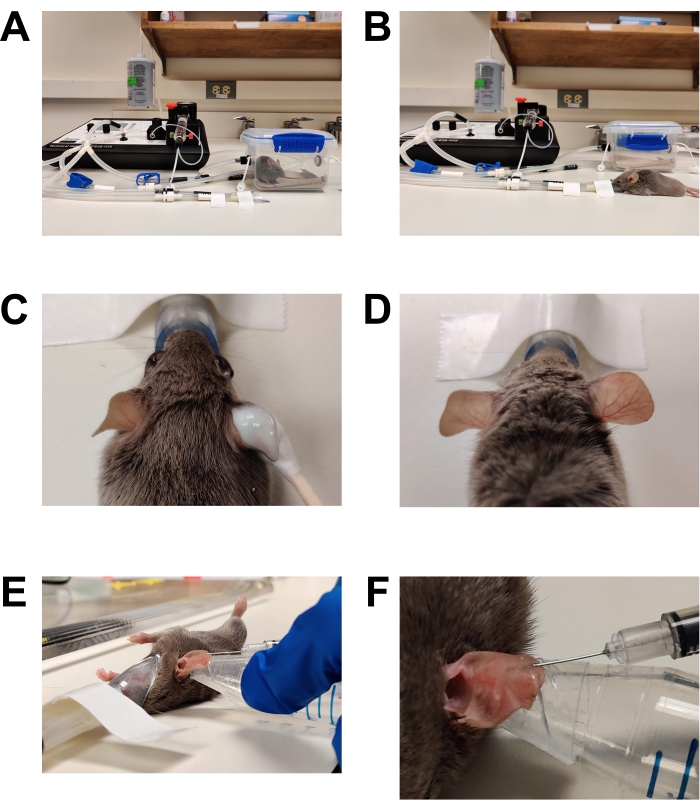
איור 1: הרדמה וחיסון . (A) אינדוקציה של הרדמה באמצעות תא אינדוקציה. (B) ההרדמה נשמרת באמצעות חרוט אף, המאפשר למקם מחדש את העכבר לפי הצורך. (C) קרם להסרת שיער נמרח באמצעות אפליקטור בעל קצה כותנה. ג'ל סיכה לעיניים הוחל כדי להגן על העיניים במהלך הרדמה. (D) הסרת שיער יעילה של אוזן ימין. השווה לאוזן שמאל שלא טופלה. (E) הזרקה תוך-עורית של C. albicans לתוך אוזן העכבר. האוזן מוחזקת במקומה באמצעות קצה של צינור חרוטי עטוף בסרט עור דו צדדי (סרט אופנה). (F) תקריב של הזרקה תוך-עורית. בועה חיוורת נוצרת בעור, המהווה סימן למיקום תוך-עורי מוצלח. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 2: הכנה להדמיה. (A) שלב מיקרוסקופ מוכן להדמיה. חרוט האף בהרדמה מאובטח במקומו. על הבמה מודבקת מכסה מכסה את פתח העדשה. פיסות קלטות נוספות זמינות. השלב המחומם מחומם מראש ל -37 מעלות צלזיוס (לא מוצג). (B) מיקום העכבר המרדים לתוך חרוט האף בהרדמה. (C) העכבר מסובב מעט כך שצד האוזן שחוסן פונה לכיוון המכסה התחתון/העדשה האובייקטיבית. לאחר מכן משטחים את האוזן כנגד הכיסוי התחתון ומאובטחים במקומם על ידי הנחת כיסוי שני על גבי האוזן. (D) הכיסוי העליון מודבק לבמה כדי לאבטח את האוזן במקומה ביחס לשלב המיקרוסקופ. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 3: מורפולוגיה במבחנה וב-in vivo של הזן המוטנטי efg1ΔΔ. (A) תמונת שדה רחב של זנים מוטנטיים מסוג WT ו-EFG1ΔΔ לאחר אינדוקציה במבחנה של נימה על ידי גידול תאים ב-RPMI + 10% סרום בטמפרטורה של 37 מעלות צלזיוס למשך 4 שעות. סרגלי קנה מידה מייצגים 10 מיקרומטר. ניגודיות התמונה הותאמה באמצעות תוכנת עריכת תמונות כדי להקל על הצפייה. (B) אחוז החוטים במבחנה שנצפו בזנים המוטנטיים WT ו-EFG1ΔΔ. Und = בלתי ניתן לגילוי (לא זוהו חוטים). גובה הבר מייצג את האחוז החציוני של תאים נימה משלושה ניסויים בלתי תלויים שבהם כימתו לפחות 100 תאים. קווי השגיאה מציינים סטיית תקן (התוצאות הושוו על-ידי מבחן t של התלמיד, p < 0.001). (C) מיקרוגרף קונפוקלי של WT (ירוק) ומוטנט EFG1ΔΔ (אדום) הגדל ב- vivo 24 שעות לאחר החיסון. חצים מציינים דוגמאות של תאים מוטנטיים מסוג EFG1ΔΔ העונים על ההגדרה שלנו של "נימה". סרגל קנה המידה מייצג 50 מיקרומטר. (D) אחוז הנימה in vivo שנצפתה בזנים המוטנטיים WT ו - efg1ΔΔ. גובה המוט מייצג את האחוז החציוני של תאים נימה משני ניסויים בלתי תלויים. קווי השגיאה מציינים סטיית תקן (התוצאות הושוו על ידי מבחן t של התלמיד, p < 0.001). אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
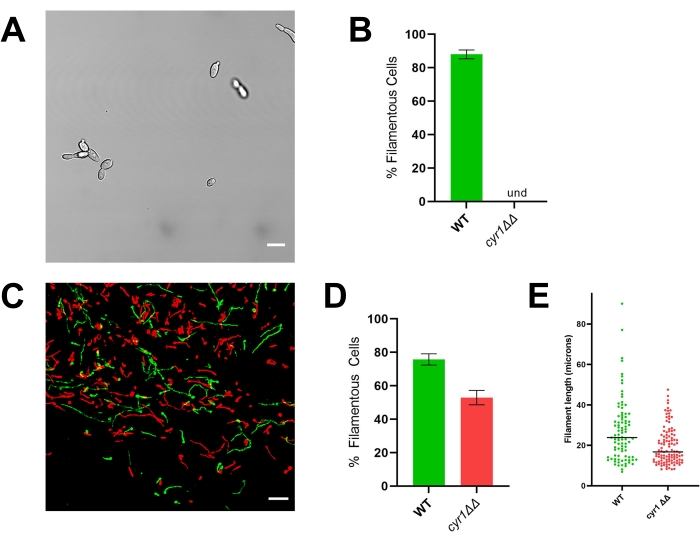
איור 4: מורפולוגיה במבחנה וב-in vivo של הזן המוטנטי cyr1 ΔΔ. (A) תמונת שדה רחב של הזן המוטנטי cyr1ΔΔ לאחר אינדוקציה חוץ גופית של נימה על ידי גידול תאים בסרום RPMI + 10% בסרום בטמפרטורה של 37 מעלות צלזיוס למשך 4 שעות. סרגל קנה המידה מייצג 10 מיקרומטר. ניגודיות התמונה הותאמה באמצעות תוכנת עריכת תמונות כדי להקל על הצפייה. (B) אחוז החוטים במבחנה שנצפו בזנים המוטנטיים WT ו-cyr1ΔΔ. Und = בלתי ניתן לגילוי (לא זוהו חוטים). גובה הבר מייצג את האחוז החציוני של תאים נימה משלושה ניסויים בלתי תלויים שבהם כימתו לפחות 100 תאים. קווי השגיאה מציינים סטיית תקן (התוצאות הושוו על-ידי מבחן t של התלמיד, p < 0.001). (C) מיקרוגרף קונפוקלי של WT (ירוק) ומוטנט cyr1ΔΔ (אדום) הגדל ב- vivo 24 שעות לאחר החיסון. סרגל קנה המידה מייצג 50 מיקרומטר. (D) אחוז הנימה in vivo שנצפתה בזנים המוטנטיים WT ו-cyr1ΔΔ. גובה המוט מייצג את האחוז החציוני של תאים נימה משני ניסויים בלתי תלויים. קווי השגיאה מציינים סטיית תקן (התוצאות הושוו על-ידי מבחן t של התלמיד, p < 0.001). (E) התפלגות אורך החוטים in vivo, כפי שהיא נמדדת על ידי אורך נתיב העקומה בהיטל דו-ממדי של מחסנית z. כל נקודה מייצגת את אורכו של נימה אחת. תאים שגדלו כשמרים לא נכללו בניתוח זה. סרגל מציין את אורך החוט החציוני. התפלגות האורכים שונה באופן משמעותי כאשר מנתחים אותה באמצעות מבחן U של מאן-וויטני (p < 0.001). אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
Discussion
מודל זה משתמש במיקרוסקופיה קונפוקלית כדי לקבל תמונות של אורגניזמים מסוג C. albicans כשהם גדלים בתוך רקמה של פונדקאי של יונקים, ובכך מאפשר לנו להעריך פנוטיפים של מורפוגנזה במהלך זיהום פעיל. תהליך המורפוגנזה הוא מרכזי בפתוגנזה של C. albicans ונחקר באופן נרחב באמצעות מגוון של מבחנים במבחנה 2,3,4. עם זאת, שום בדיקה במבחנה אינה יכולה לדגום באופן מלא את הסביבה הביוכימית והמבנית המורכבת של המארח.
הפרוטוקול המתואר כאן מתמקד בשימוש במערכת הדמיה in vivo זו כדי להקרין סדרה/ספרייה של מוטציות C. albicans כדי לזהות את הגנים המעורבים במורפוגנזה במהלך זיהום. השימוש בזני C. albicans המבטאים חלבונים פלואורסצנטיים שונים מאפשר לנו לכמת מורפוגנזה in vivo של זנים מוטנטיים של C. albicans בהשוואה לזן ייחוס. השוואת מורפוגנזה במוטציה לזן הייחוס באותו אזור של זיהום מבטיחה שהאורגניזמים ייחשפו לסביבות זהות. זה מאפשר מדידה כמותית של אחוז התאים העוברים נימה, כמו גם את מידת הנימה. הנורמליזציה של המדידות של הזן המוטנטי לאלה של זן הייחוס מאפשרת לנו להשוות טוב יותר את הביצועים של מוטנט אחד למשנהו.
התוצאות המייצגות המוצגות כאן מדגימות את הפוטנציאל לפער משמעותי בין הפנוטיפים in vitro ו - in vivo . הזן המוטנטי C. albicans efg1ΔΔ משמש לעתים קרובות כבקרה שלילית עבור מבחני מורפוגנזה מכיוון שהוא אינו מצליח לנחם כמעט בכל התנאים במבחנה 20. אף על פי שתוצאות ה-in vivo היו דומות מאוד לתוצאות במבחנה , אפילו הזן הקשה הזה יצר מדי פעם חוטים בסביבת הרקמה המארחת (איור 3). זה מדגיש את כוחה של הסביבה המארחת בהפעלת מורפוגנזה.
לעומת זאת, הזן המוטנטי cyr1ΔΔ מדגים מחלוקת משמעותית בין גידול במבחנה לגידול in vivo; אף על פי שאף אחד מהתאים המוטנטים לא עובר נימה במבחנה, כמחצית מהתאים גדלים כחוטים in vivo (איור 4)10,21. באופן מעניין, חוטים אלה היו קצרים משמעותית מאלו שנוצרו על ידי זן הייחוס, מה שמרמז על כך ש- CYR1 תורם לקצב צמיחת החוטים או ליכולת לשמור על פנוטיפ נימה. כדי להקל על ניתוח אורך החוטים, אורך נתיב העקומה של החוטים נמדד באמצעות הקרנה דו-ממדית של התמונות. בהיטלים דו-ממדיים של חוטים הגדלים בשלושה ממדים, כל נימה הגדלה על ציר שאינו מקביל למישור xy תקרין כקצרה מאורכה האמיתי. מכיוון שהתחזות זו מתרחשת גם עבור זן הייחוס, הערכת התפלגות אורכי החוטים בהקרנה דו-ממדית עדיין מאפשרת השוואה כמותית בין זני הייחוס לזנים המוטנטיים. ניתוח אורך החוט בשניים ולא בשלושה ממדים דורש ניתוח תמונה פחות אינטנסיבי; לכן, זה יכול להתבצע במהירות יחסית על מחשב שולחני טיפוסי. שימוש בניתוח פשוט יותר זה מאפשר לכלול את התפלגות אורך החוטים כחלק מפרוטוקול סינון, ומעניק הבנה מעמיקה יותר של היכולת של כל מוטציה לעבור מורפוגנזה מבלי לגרום לעיכובים משמעותיים בתפוקה.
המחקרים המייצגים שהוצגו כאן בוצעו באמצעות עכברי DBA2/N, אשר יש להם פגם במערכת המשלים שלהם הגורם לכשל בגיוס נויטרופילים לאתר של זיהום C. albicans 22. מטרת המחקרים הללו הייתה לחקור מנגנונים של ויסות נימה C. albicans בתוך הרקמה המארחת. לכן נעשה שימוש בעכברי DBA2/N כדי להימנע מבלבול התוצאות בגלל רגישות או עמידות של זן בודד לנויטרופילים. מכיוון שתגובת הנויטרופילים נגד C. אלביקנס יכולה להשפיע על נימה23, גיוס נויטרופילים לאתר ההדבקה עלול להשפיע על התוצאות של בדיקת מורפוגנזה. אם זן מסוים מסוגל לנימה in vivo אך מעוכב מאוד מ-filamentation כאשר קיימים נויטרופילים, נימה תזוהה בעכברי DBA2/N, אך לא סביר שניתן יהיה לראות אותה בעת שימוש בעכברים עם כימוטקסיס נויטרופילי שלם. לכן, המתח של העכבר המשמש כמארח הוא גורם חשוב בעת שימוש בפרוטוקול זה.
התצפית שלפיה הזן המוטנטי efg1ΔΔ אינו מצליח ליצור נימה in vivo אינה קשורה לתגובות נויטרופילים מארחים, מאחר שגם זן זה אינו מצליח ליצור נימה במבחנה. החוט שנצפה in vivo עם זן cyr1ΔΔ הוא מחלוקת עם כישלונו נימה במבחנה. נתונים ממודל דגי הזברה של זיהום C. albicans מצביעים על כך שנויטרופילים מגיבים חשובים במניעת מורפוגנזה24. לכן, השימוש בעכברי DBA2/N, שאין להם תגובות נויטרופילים, לא צפוי להסביר את העלייה בנימה של cyr1ΔΔ in vivo בהשוואה ל- in vitro. אף על פי כן, סביבת in vivo משפיעה בבירור על המורפוגנזה של זן cyr1ΔΔ; לפיכך, חקירה נוספת של זן זה עשויה לספק מידע חשוב על הרגולציה של C. albicans morphogenesis במהלך זיהומים פעילים. הפרוטוקול המתואר כאן נועד לשמש כבדיקת סינון לזיהוי זנים כגון זן cyr1ΔΔ שישמש במחקרים עתידיים.
השימוש במערכת הרדמה של גז בזרימה נמוכה עוזר מאוד לפרוטוקול הזה (איור 1A,B). במהלך הפיתוח הראשוני של פרוטוקול זה, עכברים הורדו באמצעות קוקטייל הרדמה בהזרקה של קטמין מעורבב עם קסילזין. בעוד שניתן היה לבצע הדמיה מוגבלת בשיטת הרדמה זו, משך ההרדמה היה בלתי צפוי, ודרש סיום מהיר של מפגשי ההדמיה כדי למנוע מהעכבר להתאושש מההרדמה במהלך ההדמיה. מערכות הרדמה מסורתיות בשאיפה הן מגושמות ודורשות קצב זרימה גבוה של גזי הרדמה, שלעתים קרובות דורשים שימוש בהם בתוך מכסה אדים. לפיכך, מערכות הרדמה מסורתיות בשאיפה יהיו קשות מאוד לשימוש עם אילוצי החלל של מיקרוסקופ קונפוקלי מבלי לחשוף בשוגג את החוקרים לחומרי ההרדמה. השימוש במערכת הרדמה בשאיפה בזרימה נמוכה מאפשר הרדמה עקבית של החיה תוך שמירה על סביבה בטוחה לחוקר. חרטום האף בעל הזרימה הנמוכה מאפשר מיקום קל של החיה הן לחיסון והן למיקרוסקופיה. צינורות ההובלה הקטנים בנפח נמוך מאפשרים שימוש בצינורות ארוכים יחסית, מה שמאפשר למקם את מכונת ההרדמה במרחק מספיק כדי לא להפריע למיקרוסקופיה.
הכלורופיל שנמצא בצ'או עכברי טיפוסי מוביל לאוטופלואורסצנציה משמעותית של רקמות25. הדבר יוצר רעש משמעותי בתמונות, ומקשה על השגת תמונות באיכות גבוהה וברזולוציה מרחבית גבוהה. כאשר בעלי חיים הוזנו בצ'או ללא כלורופיל במשך 7 ימים לפני ההדמיה, הרקע מאוטופלואורסצנציה פחת באופן משמעותי ברקמות, אך כלורופיל שהופקד בשיער המשיך להיות בעייתי. הסרת השיער מהפינה באמצעות קרם דפילציה כימי ללא מרשם יעילה במזעור האוטופלואורסצנטיות בשיער (איור 1C,D). לפיכך, השילוב של צ'או ללא כלורופיל והסרת שיער נאותה הפחית באופן משמעותי את ה-autofluorescence ושיפר את איכות התמונה באופן דרמטי. מכיוון שהשיער מוסר מהאוזן לפני ההדמיה, צבע השיער של החיה אינו משפיע על מערכת זו. פרוטוקול זה שימש בהצלחה לחקר זיהומים מסוג C. albicans בעכברי BALB/c (לבן), C57BL/6 (שחור) ו-DBA2/N (חום). ניתן להשתמש בפרוטוקול גם עם עכברי נוקאאוט C57BL/6 הסובלים ממחסור בגנים מארחים שונים; זה יאפשר חקירות עתידיות של האופן שבו מערכת החיסון של היונקים המארחים משפיעה על נימה. מאפיין אחד של מודל זה שלא נדון בפרוטוקול זה הוא שמכיוון שמערכת הדמיה זו אינה פולשנית, ניתן לדמות את אותה חיה שוב ושוב במשך מספר ימים, מה שמאפשר לעקוב אחר התקדמות ההדבקה הבודדת לאורך זמן. סביר להניח שתכונה זו תשחק תפקיד מפתח במחקרים עתידיים על האינטראקציה בין המארח לפתוגן.
לסיכום, פרוטוקול זה מביא לתמונות ברזולוציה מרחבית גבוהה של C. albicans הגדלים ברקמה של פונדקאי יונק חי, ומאפשר הערכה מדויקת של מורפוגנזה בזנים מוטנטיים 8,9,10. התוצאות המוצגות כאן מדגימות כיצד ניתן להשתמש בפרוטוקול זה כדי לסנן ספרייה של מוטנטים של C. albicans. מבין המוטנטים של C. albicans שנבדקו עד כה, חלק גדול מהמוטנטים עם פגמים ידועים במורפוגנזה במבחנה עוברים בקלות נימה in vivo 9,10. זה מדגיש את החשיבות של הכללת מערכת in vivo כמו זו בניסויים שנועדו להבהיר את המנגנונים של C. albicans פתוגנזה.
Disclosures
למחברים אין ניגודי עניינים לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי מענק NIH 1R01AI33409 והמחלקה לרפואת ילדים, מכללת קארבר לרפואה, אוניברסיטת איווה.
Materials
| Name | Company | Catalog Number | Comments |
| #1.5 coverslips | Thermo-Fisher | 20811 | large enough to cover the universal stage opening |
| 0.1 mL Insulin syringes | EXELint | 26018 | Can use syringes that are 5/16"–1/2" long and 29–32 G |
| 3.7% formaldehyde in dPBS | Sigma-Aldrich | SHBJ5734 | |
| 70% Ethanol/30% water | Decon Laboratories | A05061001A | |
| Alcohol prep pads | Covidien | 5110 | Alternative: gauze pads soaked in 70% isopropyl alcohol |
| C.albicans reference strain and experimental strains | SN250 | FGSC Online Catalog | The specific C. albicans strain varies with experiment and the investigators goals. We have used strains derived from SC5314 as well as other clinical isolates. |
| Chlorophyl free mouse chow | Envigo | 2920x | |
| Computer | Dell | Optiplex 7050 | Computer that can run imaging software for acquisition and for analysis of images. A variety of imaging software is available and varies with the specific microscope and user system. |
| Cotton tip applicator | Pro Advantage | 76200 | |
| DBA2/N (6-12 week old mice) | BALB/c and C57/BL6 mice can also be used. The latter allow for the use of widely available knockout mouse models as well as mouse models in which individual cell types, such as phagocytes, are identified by their expression of fluorescent proteins. | ||
| Double sided tape designed to hold fabric to skin (fashion tape) | local pharmacy or grocery store | Double sided adhesive tape designed for keeping clothing in place over human skin. This is typically available over the counter in pharmacies and variety stores. It is important to use this type of tape as it is designed for gentle adherence to skin. Examples: https://www.amazon.com/Womens-Fashion-Clothing-Transparent-Suitable/dp/B08S3TWR3H/ref=sr_1_40?crid=2UWFL8FMFAKGM&keywords =fashion+tape&qid=1649174406&sprefix= fashion+tape%2Caps%2C70&sr=8-40 https://www.amazon.com/Fearless-Tape-Sensitive-Clothing-Transparent/dp/B07QY8V5XT/ref=sr_1_26?crid=2UWFL8FMFAKGM&keywords =fashion+tape&qid=1649174320&sprefix= fashion+tape%2Caps%2C70&sr=8-26 https://www.amazon.com/Hollywood-Fashion-Secrets-Tape-Floral/dp/B009RX77MK/ref=sr_1_29?crid=2UWFL8FMFAKGM&keywords =fashion+tape&qid=1649174406&sprefix= fashion+tape%2Caps%2C70&sr=8-29 | |
| Dulbecco's phosphate buffered saline | Gibco / Thermo-Fisher | 14190-144 | Must be sterile; open a new container for every experiment |
| Fetal bovine serum | Gibco / Thermo-Fisher | 26140-079 | |
| Gauze pad | Pro Advantage | P157112 | |
| Gel eye lurbicant | local pharmacy or grocery store | ||
| ImageJ or FIJI analysis software | NIH | ImageJ (FIJI) | |
| Isoflurane | Akorn | J119005 | |
| Leica DMi8 (SP8 platform) with Leica 11506375 objective lens | Leica | DMi8 (SP8) | The objective lens (Leica 11506375) used here is a 25x water immersion lens to allow us to have a high NA (0.95) while approximating the refractive index of the ear tissue. The microscope (Leica DMi8 (SP8 platform) has 488 nm and 638 nm diode laser lines and is equipped with filter-free spectral detection with computer controlled adjustable bandwidth for detection of emission light. The stage must have enough clearance to allow the objective to reach the bottom coverslip without hitting the stage. |
| Low-flow anesthesia system or traditional anesthesia vaporizer | Kent Scientific International | SomnoSuite | |
| Nair hair remover lotion | local pharmacy or grocery store | Over the counter depilatory cream | |
| Nourseothricin | Jena Bioscience | AB-101L | |
| pENO1-NEON-NATR pENO1-iRFP-NATR plasmids | Fluorescent protein expression transformation constructs generously given to us by Dr. Robert Wheeler (Seman, et al., 2018, Infection and Immunity; Bergeron, et al., 2017, Infection and Immunity) | ||
| Pressure sensitive laboratory tape | Tape & Label Graphic Systems Inc | 1007910 | |
| RPMI1640 cell culture medium | Gibco / Thermo-Fisher | 11875-093 | |
| Thimble, plastic 15 mL conical tube, or Falcon 5 mL round bottom polystyrene tubes | Falcon | 352196 | To safely hold the animals ear during injectinos |
References
- Lopes, J. P., Lionakis, M. S. Pathogenesis and virulence of Candida albicans. Virulence. 13 (1), 89-121 (2022).
- Saville, S. P., Lazzell, A. L., Monteagudo, C., Lopez-Ribot, J. L. Engineered control of cell morphology in vivo reveals distinct roles for yeast and filamentous forms of Candida albicans during infection. Eukaryotic Cell. 2 (5), 1053-1060 (2003).
- Arita, G. S., et al. Cell wall associated proteins involved in filamentation with impact on the virulence of Candida albicans. Microbiological Research. 258, 126996(2022).
- Rai, L. S., Wijlick, L. V., Bougnoux, M. E., Bachellier-Bassi, S., d'Enfert, C. Regulators of commensal and pathogenic life-styles of an opportunistic fungus-Candida albicans. Yeast. 38 (4), 243-250 (2021).
- Sudbery, P. E. Growth of Candida albicans hyphae. Nature Reviews Microbiology. 9 (10), 737-748 (2011).
- Basso, V., d'Enfert, C., Znaidi, S., Bachellier-Bassi, S. From genes to networks: The regulatory circuitry controlling candida albicans morphogenesis. Current Topics in Microbiology and Immunology. 422, 61-99 (2019).
- Mancera, E., et al. Evolution of the complex transcription network controlling biofilm formation in Candida species. Elife. 10, 64682(2021).
- Mitra, S., Dolan, K., Foster, T. H., Wellington, M. Imaging morphogenesis of Candida albicans during infection in a live animal. Journal of Biomedical Optics. 15 (1), 010504(2010).
- Wakade, R. S., Huang, M., Mitchell, A. P., Wellington, M., Krysan, D. J. Intravital imaging of Candida albicans identifies differential in vitro and in vivo filamentation phenotypes for transcription factor deletion mutants. mSphere. 6 (3), 0043621(2021).
- Wakade, R. S., Kramara, J., Wellington, M., Krysan, D. J. Candida albicans filamentation does not require the cAMP-PKA pathway in vivo. mBio. 13 (3), 0085122(2022).
- Bergeron, A. C., et al. Candida albicans and Pseudomonas aeruginosa interact to enhance virulence of mucosal infection in transparent zebrafish. Infection and Immunity. 85 (11), 00475(2017).
- Seman, B. G., et al. Yeast and filaments have specialized, independent activities in a zebrafish model of Candida albicans infection. Infection and Immunity. 86 (10), 00415-00418 (2018).
- Centers for Disease Control and Prevention. Biosafety in Microbiological and Biomedical Laboratories (BMBL). 6th edition. , Available from: https://www.cdc.gov/labs/BMBL.html (2020).
- Homann, O. R., Dea, J., Noble, S. M., Johnson, A. D. A phenotypic profile of the Candida albicans regulatory network. Plos Genetics. 5 (12), 1000783(2009).
- Cullen, P. J., Sprague, G. F. The regulation of filamentous growth in yeast. Genetics. 190 (1), 23-49 (2012).
- Herrero, A. B., et al. Control of filament formation in Candida albicans by polyamine levels. Infection and Immunity. 67 (9), 4870-4878 (1999).
- Ahmad Hussin, N., et al. Biotin auxotrophy and biotin enhanced germ tube formation in Candida albicans. Microorganisms. 4 (3), 37(2016).
- Nantel, A., et al. Transcription profiling of Candida albicans cells undergoing the yeast-to-hyphal transition. Molecular Biology of the Cell. 13 (10), 3452-3465 (2002).
- Noble, S. M., Johnson, A. D. Strains and strategies for large-scale gene deletion studies of the diploid human fungal pathogen Candida albicans. Eukaryotic Cell. 4 (2), 298-309 (2005).
- Glazier, V. E. EFG1, Everyone's favorite gene in Candida albicans: A comprehensive literature review. Frontiers in Cellular Infection and Microbiology. 12, 855229(2022).
- Huang, G., Huang, Q., Wei, Y., Wang, Y., Du, H. Multiple roles and diverse regulation of the Ras/cAMP/protein kinase A pathway in Candida albicans. Molecular Microbiology. 111 (1), 6-16 (2019).
- Saville, S. P., Lazzell, A. L., Chaturvedi, A. K., Monteagudo, C., Lopez-Ribot, J. L. Use of a genetically engineered strain to evaluate the pathogenic potential of yeast cell and filamentous forms during Candida albicans systemic infection in immunodeficient mice. Infection and Immunity. 76 (1), 97-102 (2008).
- Brothers, K. M., Newman, Z. R., Wheeler, R. T. Live imaging of disseminated candidiasis in zebrafish reveals role of phagocyte oxidase in limiting filamentous growth. Eukaryotic Cell. 10 (7), 932-944 (2011).
- Brothers, K. M., et al. NADPH oxidase-driven phagocyte recruitment controls Candida albicans filamentous growth and prevents mortality. PLoS Pathogens. 9 (10), 1003634(2013).
- Holmes, H., Kennedy, J. C., Pottier, R., Rossi, R., Weagle, G. A recipe for the preparation of a rodent food that eliminates chlorophyll-based tissue fluorescence. Journal of Photochemistry and Photobiology. B: Biology. 29 (2-3), 199(1995).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved