Method Article
ייצור, סינון בתפוקה גבוהה וביו-בנקאות של ספרואידים לבביים פלוריפוטנטיים שמקורם בתאי גזע המושרים על ידי בני אדם
* These authors contributed equally
In This Article
Summary
מוצגת כאן סדרה של פרוטוקולים ליצירה ושימור בהקפאה של ספרואידים לבביים (CSs) מקרדיומיוציטים פלוריפוטנטיים המושרים על ידי בני אדם שמקורם בתאי גזע בתרבית בפורמט רב-ממדי בעל תפוקה גבוהה. מודל תלת מימדי זה מתפקד כפלטפורמה חזקה למידול מחלות, הקרנות בתפוקה גבוהה, ושומר על הפונקציונליות שלו לאחר שימור בהקפאה.
Abstract
קרדיומיוציטים פלוריפוטנטיים המושרים על ידי בני אדם שמקורם בתאי גזע (hiPSC-CMs) הם בעלי חשיבות עליונה עבור מודלים וטיפולים במחלות לב אנושיות. לאחרונה פרסמנו אסטרטגיה חסכונית להרחבה מסיבית של hiPSC-CMs בשני ממדים (2D). שתי מגבלות עיקריות הן חוסר בשלות תאים והיעדר סידור ומדרגיות תלת-ממדיים (3D) בפלטפורמות סינון בתפוקה גבוהה (HTS). כדי להתגבר על מגבלות אלה, הקרדיומיוציטים המורחבים מהווים מקור תאים אידיאלי ליצירת תרבית תאי לב תלת-ממדית וטכניקות הנדסת רקמות. האחרון מחזיק פוטנציאל גדול בתחום הלב וכלי הדם, מתן HTS מתקדם יותר רלוונטי פיזיולוגית. כאן, אנו מתארים זרימת עבודה תואמת HTS עם מדרגיות קלה לייצור, תחזוקה וניתוח אופטי של ספרואידים לבביים (CS) בפורמט של 96 בארות. CSs קטנים אלה חיוניים כדי למלא את הפער הקיים במודלים הנוכחיים של מחלות מבחנה ו / או דור עבור פלטפורמות הנדסת רקמות תלת ממדיות. ה-CSs מציגים מורפולוגיה, גודל והרכב תאי מובנים מאוד. יתר על כן, hiPSC-CMs בתרבית כמו CSs להציג התבגרות מוגברת וכמה תכונות תפקודיות של הלב האנושי, כגון טיפול סידן ספונטני ופעילות התכווצות. על ידי אוטומציה של זרימת העבודה המלאה, החל מדור CSs ועד ניתוח פונקציונלי, אנו מגדילים את יכולת השחזור תוך ובין-אצווה כפי שמודגם על ידי הדמיה בתפוקה גבוהה (HT) וניתוח טיפול בסידן. הפרוטוקול המתואר מאפשר מידול של מחלות לב והערכת השפעות תרופתיות/טיפוליות ברמת התא הבודד בתוך סביבת תאים תלת-ממדית מורכבת בתהליך עבודה אוטומטי לחלוטין של HTS. בנוסף, המחקר מתאר הליך פשוט לשימור ארוך טווח ובנקאות ביולוגית של ספרואידים שלמים, ובכך מספק לחוקרים את ההזדמנות ליצור אחסון רקמות פונקציונלי של הדור הבא. HTS בשילוב עם אחסון לטווח ארוך יתרום באופן משמעותי למחקר תרגומי במגוון רחב של תחומים, כולל גילוי ובדיקת תרופות, רפואה רגנרטיבית ופיתוח טיפולים מותאמים אישית.
Introduction
הגילוי של תאי גזע פלוריפוטנטיים המושרים על ידי בני אדם (hiPSCs) הציע הזדמנויות חסרות תקדים לחקר התפתחות אנושית ומחלות ברמה התאית. במהלך העשור האחרון, באמצעות לקחים התפתחותיים, נקבעו פרוטוקולים שונים כדי להבטיח את ההבחנה היעילה של hiPSCs לקרדיומיוציטים (CMs)1,2,3,4. קרדיומיוציטים הנגזרים מ-hiPSC (hiPSC-CMs) יכולים לשמש כמשאב למידול מחלות לב וכלי דם תורשתיות גנטית (CVD), בדיקת בטיחות הלב עבור תרופות חדשות ואסטרטגיות התחדשות לב 5,6,7,8. למרות התמיינות הלב המכוונת של hiPSCs, מספרי CM בלתי מוגדרים נותרו אתגר בתחום הלב, שכן hiPSC-CMs בוגרים בדרך כלל אינם מתרבים, ותאים אנושיים ראשוניים אינם זמינים בכמויות גבוהות.
לאחרונה, תיארנו כי הפעלת איתות Wnt במקביל עם תרבית צפיפות תאים נמוכה הביאה לתגובת שגשוג מסיבית (עד פי 250) של hiPSC-CMs 9,10. אסטרטגיה חסכונית זו להרחבה מסיבית של hiPSC-CMs באמצעות מעבר סדרתי בפורמט בקבוק תרבות מאפשרת סטנדרטיזציה ובקרת איכות של מספר רב של hiPSC-CMs פונקציונליים. בנוסף, כדי לעמוד בקצב הביקוש לאצוות גדולות של hiPSC-CMs מתורמים שונים, הביו-בנקאות של hiPSC-CMs תוארה10. עם זאת, מונושכבות קרדיומיוציטים שנזרעו בצלחות תרבית סטנדרטיות אלה אינן מייצגות את המבנה התלת-ממדי המורכב הקיים בלב. יתר על כן, חוסר הבשלות של hiPSC-CMs נותר מכשול, ובכך נכשל בחיקוי הפנוטיפ הביולוגי והפיזיולוגי של הסביבה הקרדיווסקולרית in vivo.
פותחו מודלים תלת-ממדיים חדשניים במבחנה שבהם hiPSC-CMs מראים התנהגות פיזיולוגית קרובה יותר כגון ארגון עצמי 11,12, עיצוב מחדש של מטריצה חוץ-תאית (ECM) 13, התבגרות משופרת 14,15,16 והתכווצות מסונכרנת17,18,19 . מודלים תלת-ממדיים שימשו לגילוי תרופות, בדיקות לב-ריאוקסיות של תרופות, מידול מחלות, טיפולים רגנרטיביים, ואפילו הניסויים הקליניים הראשונים 20,21,22,23,24. אחד המודלים הנפוצים ביותר הוא רקמת לב מהונדסת מבוססת פיברין (EHT), המציגה סידור דמוי רקמה והתכווצות לב13,17,25. בעבר, הראינו כי EHTs שנוצרו מ-hiPSC-CMs מורחבים הציגו התכווצות דומה לזו של hiPSC-CMs לא מורחבים, והדגימו פונקציונליות תאית ללא פשרות לאחר הרחבה9. עם זאת, למרות שהדור של EHTs מ- hiPSC-CMs כבר מבוסס היטב, צפויות התפתחויות נוספות לגבי הקמת פלטפורמת הערכת HT. כאן, הדור המהיר של מספר גדול של כדורי לב צוברים את עצמם (CSs) בפורמט 96 באר מאפשר שיפור בתנאי תלת מימד למטרות סינון בתפוקה גבוהה (HTS).
בסך הכל, היתרון של CSs כתרבית תאים תלת-ממדית הוא יכולת השחזור והמדרגיות הגבוהה שלהם. בפרט, CSs בשילוב עם טיפול בדגימות רובוטיות יכולים לתקנן ולהפוך את תרבות CS, טיפול תרופתי וניתוח תוכן גבוהלאוטומטיים 20. כאן, אנו מתארים פרוטוקולים ממוטבים ליצירת CSs בעלי טוהר גבוה ובאיכות גבוהה, אשר ניתן לשמר בהקפאה ביעילות ולבדוק את תפקוד הלב על ידי ביצוע מדידות ארעיות Ca2+ באמצעות מערכת רכישה וניתוח סידן אופטית. דגם זה מספק כלי פשוט אך רב עוצמה לביצוע מסכים בעלי תפוקה גבוהה על מאות עד אלפי ספרואידים17,18.
Protocol
הערה: hiPSC-CMs המשמשים במחקר זה נוצרו על פי פרוטוקולי גידול hiPSC והתמיינות CMשתוארו קודם לכן 26,27. לחלופין, ניתן להרחיב ולשמר בהקפאה את hiPSC-CMs כפי שפורסם לאחרונה לפני הפעלת פרוטוקול CS (סעיף 4)10.
1. הכנת מדיה, תמיסות ואליציטוטים של תרביות תאים
- הכנת מדיום בסיסי
- אזנו פניצילין-סטרפטומיצין ואת המדיום (RPMI 1640) לטמפרטורת החדר (RT) וודאו שהוא הופשר לחלוטין. מערבבים 500 מ"ל של המדיום ו-5 מ"ל של עט/סטרפטוקוקוס. יש לאחסן ב-4°C למשך עד 8 שבועות; יש לאזן ל-37°C לפני השימוש.
- הכנת RPMI + B27
- אזנו את תוסף B27 ואת המדיום הבסיסי ל-RT. הקפידו להפשיר את התוסף לחלוטין. מערבבים 490 מ"ל של המדיום הבסיסי ו 10 מ"ל של תוספת B27 50x. יש לאחסן ב-4°C למשך עד שבועיים; יש לאזן ל-37°C לפני השימוש.
- הכנת מדיית ציפוי מחדש hiPSC-CM
- הוסף מעכב חלבון קינאז (ROCK) המכיל סליל משויך Rho (ריכוז סופי של 2 מיקרומטר) והחלפת סרום נוקאאוט 10% (KSR) למדיית RPMI + B27. הוסף מעכב ROCK ישירות למדיית RM לפי הצורך. אין לאחסן מדיה תרבותית לאחר התוסף.
- הכנת מדיית הפשרה CM
- יש להוסיף ריכוז של 1:100 של תוסף הישרדות תאים (למשל, Revitacell) ו-20% KSR למדיה RPMI + B27 ולאזן ל-37°C לפני השימוש.
- הכנת תוסף התבגרות
- נוסחת ההבשלה הבינונית28 שתוארה קודם לכן מורכבת מ: 3 mM גלוקוז, 10 mM L-לקטט, 5 מ"ג / מ"ל ויטמין B12, 0.82 mM ביוטין, 5 mM קריאטין מונוהידרט, 2 mM טאורין, 2 mM L-קרניטין, 0.5 mM חומצה אסקורבית, 1x NEAA, 0.5% (w / v) albumax, 1x B27, ו 1% KOSR. כדי להכין בקבוק מלא אחד (500 מ"ל) של תוסף התבגרות, להסיר 65 מ"ל מבקבוק DMEM ללא גלוקוז ולהשלים עם 2.7 גרם של גלוקוז, 5.6 גרם של L-לקטט, 0.025 מ"ג של ויטמין B12, 1 מ"ג של ביוטין, 3.73 גרם של קריאטין מונוהידרט, 1.25 גרם של טאורין, 1.975 גרם של L-קרניטין, 0.7125 גרם של חומצה אסקורבית, 50 מ"ל של NEAA, 12.5 גרם של אלבומקס, ו 5 מ"ל של פניצילין-סטרפטומיצין.
- יש לסנן דרך יחידת מסנן חד פעמית סטרילית עם קרום פוליאתרסולפון (PES) בעל נקבובית בגודל 0.22 מיקרומטר.
- Aliquot לתוך 45 מ"ל (להכין 500 מ"ל של בינוני התבגרות) או 4.5 מ"ל (להכין 50 מ"ל של מדיום התבגרות). יש לאחסן בטמפרטורה של 20°C למשך עד 6 חודשים.
- הכנת מדיית הבשלה
- אזנו את תוסף B27, נוקאאוט SR, פניצילין-סטרפטומיצין, תוסף ההתבגרות28 ומדיום DMEM ללא גלוקוז ב- RT. הקפידו להפשיר את התוסף לחלוטין. מערבבים 435 מ"ל של DMEM ללא גלוקוז בינוני עם 10 מ"ל של תוסף B27 50x, 5 מ"ל של פניצילין-סטרפטומיצין, 5 מ"ל של נוקאאוט SR, ו 45 מ"ל של תוספת התבגרות. יש לאחסן ב-4°C למשך עד שבועיים; יש לאזן ל-37°C לפני השימוש.
- הכנת מדיום בהיר פלואור
- יש לאזן פניצילין-סטרפטומיצין ומדיום פלואורובריט DMEM ב-RT. יש לוודא שהתוסף מופשר לחלוטין. מערבבים 500 מ"ל של מדיום פלואורבריט DMEM עם 5 מ"ל של פניצילין-סטרפטומיצין. יש לאחסן ב-4°C למשך עד חודש אחד; יש לאזן ל-37°C לפני השימוש.
- הכינו את תמיסת הדטרגנטים הלא יוניים
- יש לערבב 20% עם אבקת ניקוי אל-יונית (לדוגמה, F-127) עם PBS. יש לסנן באמצעות מסנן 0.22 מיקרומטר ולאחסן בטמפרטורה של 4°C למשך עד 6 חודשים; יש לאזן ב-RT לפני השימוש.
- הכינו צבע סידן בינוני
- ערבבו את תמיסת הדטרגנט הלא יוני (ריכוז סופי של 0.04% v/v) ו-0.1x של צבע הסידן (למשל, Cal520 AM) במדיום בהיר פלואור. בצינור חרוטי של 50 מ"ל, הוסף 10 μL של Cal520 ו- 20 μL של תמיסת הדטרגנט הלא יוני. מערבבים עד להמסה מלאה. שמור את התמיסה בחושך לפני הוספה לתאים.
2. הכנת מאגרים
- הכנת מאגר חדירות וחסימה: מאגר זה מכיל 10 מ"ל PBS, 5% wt/v BSA ו-0.3% v/v Triton-X-100.
- הכן את מאגר ציטומטריית הזרימה: מאגר זה מכיל 50 מ"ל PBS, 1% wt/v BSA ו- 0.3% v/v Triton-X-100.
- מאגר שטיפת ציטומטריה זרימה: מאגר זה מכיל 50 מ"ל PBS ו-1% wt/v BSA.
- מאגר כביסה ספרואידי (SWB): מאגר זה מכיל 1 מ"ל של Triton-X-100, 2 מ"ל של 10% (w/v ב-DPBS) SDS, ו-2 גרם BSA ב-1 ליטר PBS.
הערה: SWB ניתן לאחסן ב 4 ° C עד שבועיים. - הכן את תמיסת ההטבעה (ES): כדי להכין 100 מ"ל של תמיסת ההטבעה, ערבב 50 מ"ל גליצרול עם 9.09 מ"ל של dH2O, 1 מ"ל של חיץ Tris (1 M, pH 8.0) ו- 200 μL של EDTA (0.5 M). מוסיפים 22.7 גרם פרוקטוז ומערבבים בחושך עד להמסה. כאשר ברור, מוסיפים 22.2 גרם פרוקטוז ומערבבים עד להמסה. לאחר מכן מוסיפים 15 גרם של אוריאה ומערבבים עד להמסה (לאחסן ב 4 ° C בחושך).
- הכן מאגר PBT (PBS עם Tween-20). מאגר זה מכיל PBS/Tween-20 (0.1% v/v). עבור 1 L של PBS, להוסיף 1 מ"ל של Tween-20.
3. הכנת מולקולות קטנות
- לשחזר אבקת thiazovivin (מעכב רוק) ב 10 mM aliquots של 50 μL ב DMSO ולאחסן ב -20 ° C עד 6 חודשים. יש להגן מפני אור.
- הכן 2.5 mM aliquots של 10 μL כל אחד של Cal-520 AM ב DMSO ולאחסן אותם ב -20 ° C עד 6 חודשים. יש להגן מפני אור.
4. דור כדורי לב
הערה: עבור כמויות גדולות יותר של CSs, זרע עד 1 מיליון CMs בלוח חיבור 6 באר נמוך במיוחד עם 2 מ"ל של hiPSC-CM ציפוי מחדש. מחקר זה השתמש במינימום של 2,500 (2.5k CS) עד 20,000 (20k CS) hiPSC-CMs לכל באר של צלחת 96 באר.
- עבור צלחת אחת של 96 בארות, הכינו תרבית תאים המכילה מינימום של 2 x 106 קרדיומיוציטים שמקורם בתאי גזע פלוריפוטנטיים המושרים על ידי בני אדם (hiPSC-CMs)10.
- כאשר hiPSC-CMs בתרבית מגיעים למפגש, הוסף 0.1 מ"ל / ס"מ2 של תמיסת ניתוק לב סטרילית (למשל, טריפל) לכל באר. לדגור על הצלחת ב 37 ° C במשך 15 דקות.
- באמצעות צינור 5 מ"ל, לנתק מכנית את התאים על ידי שטיפה עם 2 מ"ל של מדיום בסיסי חם כדי לבצע השעיה של תא בודד. לאשר את הניתוק עם מיקרוסקופ שדה בהיר (4x הגדלה); התאים ייראו לבנים ובעלי צורה עגולה.
- העבר את מתלה התא לצינור חרוטי 15 מ"ל וצנטריפוגה למשך 3 דקות ב 300 x גרם.
- שאפו את הסופרנאטנט והשהו מחדש את התאים ב-1 מ"ל של מצע ציפוי מחדש hiPSC-CM.
- באמצעות קצה צינור של 1,000 μL, נתק מכנית את כדורית התא. הפתרון נראה הומוגני לאחר שלוש או ארבע תערובות. ספור את התאים. מעבירים את כמות התאים המתאימה ב-100 מיקרוליטר של מדיום הציפוי מחדש לכל חיבור נמוך במיוחד בתחתית עגולה 96-באר.
- מניחים את צלחת CSs על שייקר מסלול ב 70 סל"ד באינקובטור במשך 24 שעות. הגדר את תנאי האינקובטור ל- 37 ° C, 5% CO 2, 21% O2 ו- 90% לחות.
- לשאוף 50 μL של בינוני מכל באר ולהוסיף 100 μL של RPMI + B27 בינוני לכל באר במשך 48 השעות הראשונות.
הערה: יש לשמור תמיד 50 μL של המדיום בצלחת 96 בארות כדי למנוע שאיפה מקרית וקרע ספרואידי. - שואפים 100 μL של המדיום מכל באר ומוסיפים 100 μL של מדיום ההתבגרות לכל באר. לשמור על התאים במדיום ההתבגרות ולרענן את המדיום כל 2-3 ימים.
5. שימור בהקפאה של CSs
הערה: ניתן לשמור CSs בהקפאה לאחסון לטווח ארוך. שימור בהקפאה יכול להתבצע מהיום השלישי לאחר יצירת CSs. CSs יכול להישמר בהקפאה ישירות בבארות של צלחת 96 בארות או כתרחיף CS ב cryovials.
- מצננים מראש את הצלחת על ידי הנחת הצלחת על קרח למשך 10 דקות.
- צנטריפוגה את צלחת הספרואיד במשך 3 דקות ב 70 x גרם.
- מוציאים את הסופרנאטנט עד שנשאר 50 μL ומוסיפים 200 μL של מדיום הקפאה hiPSC קר כקרח לכל באר.
הערה: שמור את השעיית CS על קרח למשך כל תקופת ההליך. במקרה של צלחת 6 בארות עם ספרואידים, להקפיא באר אחת ב 500 μL הקפאה בינונית cryovial. - אטמו את הצלחת בסרט איטום צלחת.
הערה: יש לאחסן את הצלחת בעלת 96 הקידוחים בקופסת פוליסטירן, או, כאשר אינה זמינה, ניתן לייצר תבנית סיליקון כמתואר בשלב 5.5.1. - כדי להבטיח חילופי חום אחידים בין צלחת הבאר למקפיא, הכניסו את הצלחת בזהירות לקופסת פוליסטירן או בתבנית סיליקון.
- להכנת תבנית הסיליקון: ערבבו במרץ שני רכיבים של ערכת אלסטומר הסיליקון ביחס של 10:1. בטלו את הבועות מהתמיסה באמצעות משאבת ואקום למשך 15-20 דקות. לאחר מכן, יצקו את התמיסה בתוך החלק התחתון של צלחת הבאר ונטרלו את הבועות באמצעות משאבת ואקום למשך 10 דקות. מכניסים את התבנית לתנור ומרפאים ב-60 מעלות למשך 8 שעות לקבלת אלסטומר גמיש למחצה שמתקלף מהצלחת.
- מקפיאים את הצלחת ב -80 ° C למשך מינימום של 4 שעות בקופסת פוליסטירן או תבנית סיליקון מוכנה.
- מעבירים את הצלחת למיכל חנקן נוזלי או למקפיא בטמפרטורה של -150°C לאחסון לטווח ארוך.
6. הפשרת ספרואידים לבביים
הערה: אין להפשיר יותר מצלחת אחת בכל פעם כדי להבטיח תהליך הפשרה מהיר.
- מכינים 20 מ"ל של 37 °C מחומם מראש בינוני בסיסי בצינור חרוטי 50 מ"ל.
- אספו את צלחת התא עם CSs מהחנקן הנוזלי והניחו אותה באינקובטור למשך 15 דקות. הגדר את תנאי האינקובטור ל- 37 ° C, 5% CO 2, 21% O2 ו- 90% לחות.
- מוציאים את הסופרנאטנט ואת שאריות גלולת התא, ומרחפים מחדש כל באר בתווך בסיסי חם. השתמש 200 μL של בינוני לכל באר.
- צנטריפוגה למשך 3 דקות ב 70 x גרם.
- חזור על שלבים 6.3 ו- 6.4.
- מוציאים את הסופרנאטנט עד שנשארת כדורית התא ומוסיפים 200 מיקרוליטר של מדיום הפשרת CM בכל באר.
- מניחים את צלחת CSs על שייקר מסלול ב 70 סל"ד באינקובטור במשך 24 שעות. הגדר את תנאי האינקובטור ל- 37 ° C, 5% CO 2, 21% O2 ו- 90% לחות.
- לשאוף 50 μL של המדיום מכל באר ולהוסיף 100 μL של RPMI + B27 בינוני לכל באר במשך 48 השעות הראשונות.
- שואפים 100 μL של המדיום מכל באר ומוסיפים 100 μL של מדיום התבגרות לכל באר. לשמור על התאים במצע ההתבגרות ולרענן את המדיום כל 2-3 ימים.
7. הערכה של Ca2+ transients תוך תאי
הערה: ניתוחים קיסריים נמצאים בתרבית במשך 3 שבועות בסך הכל; שבועיים לפני ההקפאה, ושבוע לאחר ההפשרה. הבקרות ה'טריות' מותאמות לגיל.
- לאחר שבוע של תרבית, ה- CSs המופשרים הם אופטימליים לטיפול בסידן הדמיה אופטית. השתמש בצבע סידן (למשל, Cal520AM) כדי להעריך את הספיגה והשחרור של Ca2+ מהתאים.
- טפלו בהם עם 100 מיקרוליטר של צבע סידן בינוני לכל באר ודגרו במשך 60 דקות באינקובטור. הגדר את תנאי האינקובטור ל- 37 ° C, 5% CO 2, 21% O2 ו- 90% לחות.
הערה: Cal520AM רגיש לאור. בצע את כל הליכי הטעינה והניסויים בחושך. - הכינו את מערכת רכישת הסידן וניתוחו.
- הפעל את המיקרוסקופ, וודא שאפשרות הבקרה הסביבתית מופעלת.
- כוונן את מידות צמצם המצלמה והמסגור כדי למזער את שטח הרקע.
הערה: כאן, נעשה שימוש במיקרוסקופ Leica Thunder DMi8; מערכות מיקרוסקופ אחרות ישימות גם כן עד שהן מאפשרות קצב דגימה מעל 30 פריימים לשנייה (FPS).
- הקליטו סרטון עם זרם עקבי של 2-10 פסגות תוך 10 שניות וסרוק על פני הצלחת בת 96 הקידוחים, בתחילה נע שמאלה, ואז כלפי מטה בצורה זיג-זג כדי לכסות את הצלחת כולה. למדוד את אות הסידן באמצעות לייזר 488 ננומטר; הגדר את הניגודיות לרקע שחור עם אות ירוק בהיר במהלך שחרור סידן.
- לאחר רכישת Ca2+ transients, לנתח את הנתונים עם תוכנת ניתוח עקבות פלואורסצנטי (למשל, CyteSeer, Vala Sciences) על פי הוראות היצרן.
8. ניתוח ציטומטריית זרימה של ספרואידים לבביים מנותקים
הערה: במחקר זה, ציטומטריית זרימה שימשה כדי לקבוע את הכדאיות של CSs לפני ואחרי תהליך ההפשרה.
- אסוף את ה- CSs בצינור חרוטי של 15 מ"ל באמצעות צינור 5 מ"ל כדי למנוע נזק ספרואידי וצנטריפוגה למשך 3 דקות ב 70 x גרם. שאפו את הסופרנאטנט והוסיפו 1 מ"ל PBS.
- צנטריפוגה למשך 3 דקות ב 200 x גרם. לשאוף את supernatant ולנתק את CSs על ידי הוספת 1 מ"ל של תמיסת ניתוק לב (למשל, טריפל). יש לדגור על הצינור בטמפרטורה של 37°C למשך 15 דקות.
- באמצעות פיפט 5 מ"ל, לנתק מכנית את התאים על ידי שטיפה עם 2 מ"ל של מדיום בסיסי עד תאים בודדים ניתן לראות כאשר נצפה תחת המיקרוסקופ.
- צנטריפוגה למשך 3 דקות ב 200 x גרם.
- שאפו את הסופרנאטנט וקבעו את ה-CMs עם 200 μL של תמיסת 4% פרפורמלדהיד (PFA) ב-1x PBS. דגירה במשך 10 דקות ב- RT.
- צנטריפוגה למשך 3 דקות ב 200 x גרם. שאפו את הסופרנאטנט והוסיפו 1 מ"ל PBS.
הערה: נקודת השהיה: ניתן לאחסן את hiPSC-CMs הקבועים בטמפרטורה של 4°C למשך עד 4 שבועות. - העבר את מתלה התא לצינור FACS וצנטריפוגה למשך 3 דקות במהירות של 200 x גרם. לשאוף את supernatant ו resuspend 1 x 105 תאים ב 50 μL של מאגר permeabilization.
- לדגור על התאים במשך 30 דקות ב 4 ° C.
- לניתוח ציטומטריה של זרימה אימונופלואורסצנטית, בצע שלבים 8.9.1-8.9.4.
- השהה מחדש את התאים במאגר ציטומטריית הזרימה (50 μL) המכיל את נוגדן α-אקטינין בדילול של 1:300. בצינור FACS אחר, השהה מחדש 1 x 105 תאים במאגר ציטומטריית הזרימה (50 μL) עם בקרת האיזוטיפ המתאימה (לדוגמה, עכבר FITC IgM, איזוטיפ κ [דילול 1:200]). באופן דומה, להשהות מחדש 1 x 105 תאים ב 50 μL של מאגר ציטומטריית זרימה עבור בקרה שלילית.
- לדגור על התאים במשך 30 דקות ב 4 ° C.
- הוסף 2.5 מ"ל של חיץ ציטומטריית זרימה וצנטריפוגה את התאים ב 200 x גרם במשך 3 דקות ב 4 ° C; השליכו את הסופרנאטנט וחזרו על שלב השטיפה פעמיים.
- להשהות מחדש את התאים ב 50 μL של חיץ ציטומטריית זרימה עם נוגדן משני עז נגד עכבר (דילול 1:300).
הערה: הניחו את הצינורית בחושך מכיוון שתמיסת הנוגדנים המשנית רגישה לאור.
- לבדיקת כדאיות עם פרופידיום יודיד (PI), הוסיפו 150 מיקרוליטר פאי לדגימה (1:1,000) ודגרו במשך 15 דקות.
הערה: יש להניח את הצינור בחושך מכיוון שתמיסת PI רגישה לאור. - התאימו את השערים בהתאם לאסטרטגיית ה-gating הסטנדרטית כפי שמוצג באיור משלים 1 ונתחו את התאים באמצעות ציטומטר זרימה.
9. צביעה אימונופלואורסצנטית של ספרואידים תלת ממדיים שלמים
הערה: פרוטוקול זה מבוסס על פרוטוקול הדמיה תלת-ממדית ברזולוציה גבוהה של אורגנואידים שלמים על תיוג אימונופלואורסצנטי, שפורסם בעבר29 והותאם לכדורי לב. במהלך ההליך, ניתן לצפות את כל קצות הפיפט והצינורות החרוטיים ב-1% wt/v BSA-PBS על מנת למנוע מהספרואידים להידבק לפלסטיק. כדי לצפות את החומרים, יש לטבול ב-1% BSA-PBS. היזהר לא לפגוע spheroids באמצעות pipet 5 מ"ל, הימנעות הפרעה מכנית.
- אסוף את ה- CSs בצינור מצופה 15 מ"ל עם צינור 5 מ"ל. הספרואידים נראים לעין. לאסוף ~ 20-50 spheroids לכל שילוב נוגדנים. צנטריפוגה למשך 3 דקות ב 70 x גרם ולשאוף את supernatant.
- יש להשהות בזהירות את הספרואידים ב-1 מ"ל של תמיסת פרפורמאלדהיד (PFA) 4% קרה כקרח ב-1x PBS באמצעות קצה מצופה של 1 מ"ל.
- תקן ב 4 ° C במשך 45 דקות. לאחר 20 דקות, השהה מחדש בעדינות את הספרואידים באמצעות קצה מצופה של 1 מ"ל. זה מאזן קיבוע בין כל הספרואידים.
- הוסף 10 מ"ל של PBS קר כקרח לצינור וערבב בעדינות על ידי היפוך הצינור. יש לדגור במשך 10 דקות ב-4°C ולסובב מטה ב-70 x גרם למשך 3 דקות.
הערה: משלב זה ואילך, בדרך כלל אין צורך בציפוי של קצוות ושפופרות חרוטיות מכיוון ש- CSs אינם נדבקים לקצה לאחר הקיבוע. - חסום את ה- CSs על ידי השעיה מחדש של הגלולה ב- SWB קר כקרח (200 מיקרוליטר SWB לכל באר) והעבר את הספרואידים לצלחת תרבית תרחיף של 24 בארות.
הערה: ניתן לפצל CSs מגלולה אחת גדולה על פני בארות מרובות כדי לבצע כתמים שונים. השתמש ~ 20-50 CSs לכל שילוב נוגדנים. - יש לדגור בטמפרטורה של 4°C למשך 15 דקות לפחות.
- הוסף 200 μL של SWB בבאר ריקה כדי לשמש כבאר התייחסות.
הערה: עבור צביעה immunofluorescent, צלחות 48 או 96 באר יכול לשמש גם כדי להפחית את השימוש נוגדנים. עם זאת, ניתן להפחית את תוצאות הכתמים והכביסה בשל הנפח הקטן יותר לכל באר. - אפשרו לכדוריות לשקוע בתחתית הצלחת, על ידי השארת הצלחת מוטה בזווית של 45° למשך 5 דקות.
- הסר את SWB, משאיר את CSs ב 200 μL של SWB (להשתמש הפניה היטב כדי להעריך את נפח מינימלי של 200 μL).
- הוסף 200 μL של SWB עם נוגדנים ראשוניים מרוכזים פי 2 (למשל, ɑ-actinin [1:200] ו Troponin T [1:200]) ודגור לילה ב 4 ° C תוך נדנוד / רעד (40 סל"ד על שייקר אופקי).
- למחרת, להוסיף 1 מ"ל של SWB לכל באר.
- אפשרו לכדוריות לשקוע בתחתית הצלחת על ידי השארת הצלחת בזווית של 45° למשך 5 דקות.
- הסר את SWB, משאיר 200 μL בצלחת. הוסף 1 מ"ל של SWB ולשטוף במשך 2 שעות עם נדנוד איטי / טלטול.
- חזור על שלבים 9.12 ו- 9.13 פעמיים נוספות.
- אפשר ל- CSs להתיישב בתחתית הצלחת על ידי השארת הצלחת מוטה ב- 45° למשך 5 דקות. הסר את SWB, משאיר 200 μL בכל באר
- הוסף 200 μL של SWB עם נוגדנים משניים, נוגדנים מצומדים, וצבעים מרוכזים פי 2 (למשל, DAPI [1 מיקרוגרם / מ"ל], עכבר-AF488 [1:500], ארנב-AF568 [1:500]), ודגור לילה ב 4 ° C בחושך, תוך נדנוד איטי / רועד.
- למחרת, חזור על שלבים 9.12 ו- 9.13 פעמיים נוספות.
- בזהירות להעביר את CSs לצינור 1.5 מ"ל ולסובב למטה ב 70 x גרם במשך 3 דקות.
- הסר כמה שיותר מה- SWB על ידי צנרת מבלי להפריע ל- CSs.
- הוסף את תמיסת ההטבעה (ES; לפחות 50 μL, ב- RT) באמצעות קצה של 200 μL עם הקצה חתוך והשהה מחדש בעדינות כדי למנוע היווצרות בועות ודגרה ב- RT למשך 20 דקות.
- בינתיים, צרו מיכל מרובע על מגלשת זכוכית עם לק או חומר איטום מסיליקון.
- חותכים את הקצה של קצה 200 μL ומעבירים את CSs ב- ES למרכז המיכל הריבועי.
- מניחים מעל כיסוי מרובע. כדי להפחית את בועות האוויר, הניחו תחילה צד אחד של הכיסוי, לאחר מכן הורידו לאט את הכיסוי מצד אחד לשני עד שלא יהיה אוויר כלוא מתחת לפני השטח, ולאחר מכן שחררו את הכיסוי.
- יש לדחוף בעדינות את כל קצוות הכיסוי כדי לאטום אותו ללק או לחומר איטום סיליקון.
- השאר את המגלשה למשך הלילה ב- RT. למחרת, השקופית מוכנה להדמיה.
הערה: ניקוי אופטי על-ידי ES עלול לגרום להתכווצות קלה של רקמות. עם זאת, זה לא יכול להשפיע על המורפולוגיה הכוללת של CSs. הליך הצביעה ניתן להשהות כאן על ידי אחסון שקופיות ב 4 ° C (לפחות 1 שבוע) או ב -20 ° C (לפחות 6 חודשים).
תוצאות
הפרוטוקול שמוצג באיור 1A מתאר את היצירה של CSs מ-hiPSC-CMs שהורחבו בעבר. ה-CSs רוכשים מבנה תלת-ממדי ביום הראשון שלאחר הזריעה בלוחות עגולים-תחתונים בעלי חיבור נמוך במיוחד, וניתן לגדל אותם בתרבית במשך עד 6 שבועות (איור 1B). כפי שהוערך על-ידי צביעה אימונופלואורסצנטית, רוב התאים ב-CSs בני 3 שבועות ביטאו חלבונים סרקומריים כמו α-אקטינין וטרופונין T, והציגו ארגון סרקומר סדיר (איור 1C). לכימות תאים חיוביים α-אקטינין בוצע ניתוח ציטומטריית זרימה. בהתאם לתוצאות האימונופלואורסצנטיות, נתוני ציטומטריית הזרימה הדגימו רמות גבוהות דומות של α-אקטינין הן ביום 0 (76.9% ±-16.6%) והן ב-CSs בני 3 שבועות (71.1% ±-22.7%) (איור 1D), מה שמצביע על הרכב תאי קבוע וטהור מאוד במהלך התרבית. היה ביטוי מוגבר של גנים לבביים עבור צמתים (GJA1, JPH2 ו-PKP2), דסמוזומים (DES) ומיטוכונדריה (ATP5A) בספרואידים שמקורם ב-hiPSC-CM (יום 42) לעומת hiPSC-CMs שגודלו בתרבית דו-ממדית במשך 90 יום (איור 1E). הביטוי של גנים אלה הוא סימן ההיכר של אינטראקציה תא-תא והתבגרות30.
לאחר מכן, התכונות הפונקציונליות של CSs, כלומר קצב פעימות וטיפול Ca2+, הוערכו בנקודות זמן שונות (איור 2). פרמטרים חולפים של סידן כגון זמן עלייה, זמן שיא, זמן דעיכה ומשך מעבר סידן (CTD90) הוערכו כפי שמצוין באיור 2A,B. אחוז המכות של CSs דומה בשלושת השבועות הראשונים שלאחר הדור, אך ירד משמעותית בשבוע 6 (Wk6) CSs (איור 2C). שיעור המכות הופחת משמעותית ב-Wk3 בהשוואה ל-Wk1, ובדומה לאחוז המכות ב-CSs, ירד באופן דרמטי ב-Wk6 (איור 2D). ב-Wk6 נצפתה הידרדרות ב-CS, מה שיכול להסביר את הירידה הן בקצב המכות והן במספר ה-CSs המכים. מדידה של פרמטרים חולפים של סידן הצביעה על ערך שיא גבוה משמעותית ב-Wk2 (איור 2E), בעוד שזמן העלייה, זמן הדעיכה ו-CTD90 גדלו משמעותית ב-Wk3 בהשוואה ל-Wk1 (איור 2F-H ). יחד, תוצאות אלה מראות כי ספרואידים שמקורם ב-hiPSC-CM הם אופטימליים מבחינה תפקודית בסביבות שבועות 2 ו-3 לאחר הדור.
איור 3 מראה את ההשפעה של גודל הספרואיד על קצב המכות והטיפול בסידן. CSs נוצרו על-ידי זריעה של 2.5 x 10 4, 5 x 10 4, 10 x 10 4 ו-20 x 10 4 hiPSC-CMs בבאר של צלחת של 96 בארות עבור סך של 24 CSs/wells לכל תנאי (איור 3A). כצפוי, גודל הספרואיד גדל ככל שמספר התאים שנעשה בהם שימוש גדל, ונע בין 178 ±-36 מיקרומטר ל-351 ±-65 מיקרומטר (איור 3A, פאנל ימני). Ca2+ transients נמדדו בניתוחים קיסריים בני 3 שבועות בארבע צפיפויות זריעה שונות (איור 3B). מדידות של CSs מכים הצביעו על כך שרק כ-50% מה-CSs הקטנים יותר (2.5K ו-5K-CSs) הכו, בעוד שאחוז ה-CSs הגדולים יותר (10K ו-20K-CSs) היה גבוה משמעותית (כ-85%) (איור 3C). קצב מכות דומה (כ-28 פעימות לדקה) הוצג על-ידי 5K-, 10K ו-20K-CSs, שהיה גבוה משמעותית בהשוואה ל-2.5K-CSs (איור 3D). ערכי השיא של תמונות סידן היו דומים בכל התנאים שנבדקו (איור 3E), אולם זמן העלייה (איור 3F), זמן הדעיכה (איור 3G) ו-CTD90 (איור 3H) גדלו באופן משמעותי ב-CSs גדולים יותר (10K ו-20K-CSs) בהשוואה לקטנים יותר (2.5K- ו-5K-CS). יחד, תוצאות אלה מראות כי ספרואידים שמקורם ב-hiPSC-CM הם אופטימליים לטיפול בסידן כאשר משתמשים בצפיפות זריעה בין 10K ל-20K hiPSC-CMs / באר.
לאחר מכן, הערכנו את ההשפעה של שימור בהקפאה על הכדאיות והתפקוד של CS. לפני הניתוח, ניתוחים קיסריים מופשרים נשמרו בתרבית במשך שבוע אחד (איור 4A). כפי שניתן לראות הן בבדיקות ציטומטריית זרימה (איור 4B) והן בבדיקות כדאיות תאים Calcein-AM (איור 4C), שימור קריוגני לא השפיע על כדאיות התאים בתוך CSs. נוסף על כך, CSs מופשרים הראו רמות ביטוי דומות של חלבונים סרקומריים בהשוואה ל-CSs טריים תואמי גיל (איור 4D). נתונים אלה מצביעים על כך שניתן לשמור ביעילות CSs בהקפאה לצורך ניתוח תפקודי לב לאחר מכן ובדיקות סקר בתפוקה גבוהה.
לבסוף, פעילות המכות והטיפול ב-Ca2+ נמדדו הן ב-CSs טריים והן בהקפאה (איור 5). אחוז המכות נמדד בנקודות זמן שונות לאחר ההפשרה, בהתאמה, 2, 5 ו-7 ימים. בעוד שרוב הניתוחים הקיסריים הטריים הראו פעילות פעימה לאורך זמן, ברור שה-CSs שנשמרו בהקפאה נזקקו לעד שבוע אחד של תרבית כדי לשחזר את פעילות הפעימות שלהם (איור 5B). לא חל שינוי משמעותי בשיעור המכות של CSs מופשרים לעומת טריים; אולם לא נצפתה פעילות פעימות ספונטנית בחלק מהניתוחים הקיסריים הקפואים (איור 5C). אף על פי שערכי השיא הופחתו באופן משמעותי ב-CSs קפואים/מופשרים בהשוואה לטריים (איור 5D), לא נצפו שינויים משמעותיים בזמן העלייה, בזמן הדעיכה וב-CTD90 של CSs קפואים/מופשרים בהשוואה לטריים (איור 5E-G). נתונים אלה מצביעים על כך שלאחר ההפשרה, חשוב לתת ל-CSs להתאושש באינקובטור לפחות שבוע לפני מדידת פעילות פעימות ו-Ca2+ חולף.
יחד, תוצאות אלה מראות כי שימור בהקפאה של ספרואידים שמקורם ב-hiPSC-CM משמר את יכולת הקיום של קרדיומיוציטים, את המבנה הסרקומרי ואת המאפיינים התפקודיים שלהם כגון פעילות פעימות ספונטנית וטיפול בסידן. לפיכך, ספרואידים הנגזרים מ- hiPSC-CM מייצגים מודל מתאים לשחזור מדויק של אלקטרופיזיולוגיה של הלב במבחנה.
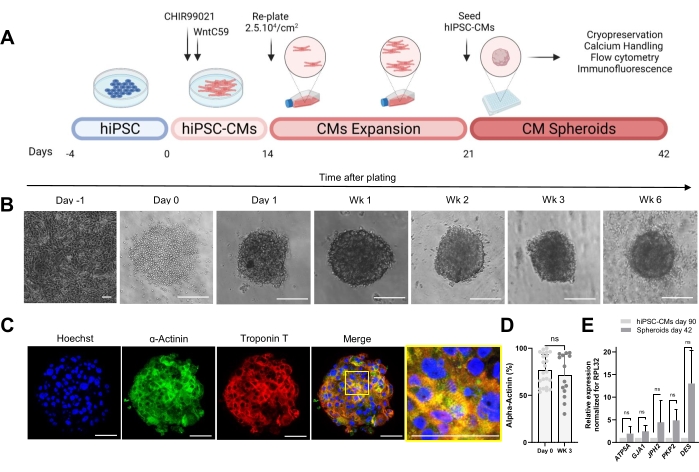
איור 1: יצירת ספרואידים לבביים . (A) ייצוג סכמטי של התמיינות לבבית מכוונת מבוססת Wnt, ההתרחבות הבאה של hiPSC-CMs, ויצירת CSs. נוצר עם biorender.com. (B) תמונות בשדה בהיר בנקודות זמן שונות של תרבית CS. סרגל קנה מידה, 200 מיקרומטר. Wk מייצג את השבוע. (C) תמונות אימונופלואורסצנטיות מייצגות עבור חלבונים סרקומריים לבביים α-אקטינין וטרופונין T ב-CSs בני 3 שבועות. אימונופלואורסצנציה: Hoechst (כחול), α-actinin (ירוק) וטרופונין T (אדום). סרגל קנה מידה, 200 מיקרומטר. התמונה הממוזגת המוגדלת מימין מציגה את ארגון הסרקומרה. סרגל קנה מידה, 50 מיקרומטר. (D) כימות ציטומטריית זרימה של תאים חיוביים α-אקטינין לפני (יום 0) ו-3 שבועות לאחר היווצרות CSs. (n = 14-23 לכל תנאי. (E) RT-qPCR בוצע על hiPSC-CMs בתרבית במשך 90 יום (2D) ודגימות ספרואידים בתרבית במשך 42 יום כדי לקבוע רמות ביטוי של גנים לבביים שונים הקשורים לצמתי תאים, חוטי ביניים ומיטוכונדריה. (n = 1-3 קבוצות). הנתונים מיוצגים כממוצע ± SD. NS (לא משמעותי) כפי שמחושב על ידי מבחן t לא מזווג. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
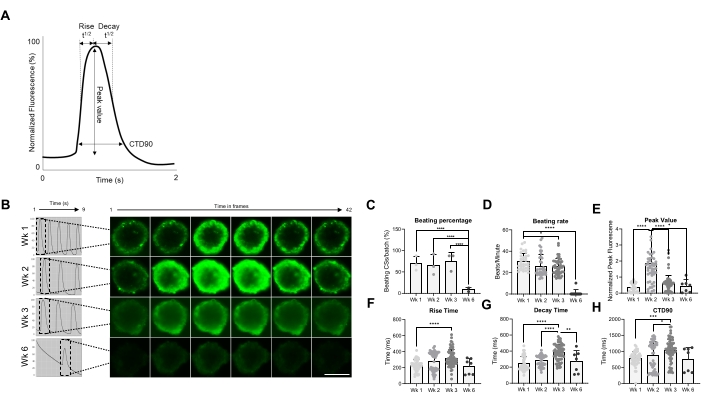
איור 2: קצב מכות וטיפול בסידן בניתוחים קיסריים בשבועות שונים לאחר הדור. (A) דוגמאות לפרמטרים חולפים של סידן שחושבו על ידי אלגוריתם ניתוח מדעי Vala בתוכנת Cyteseer. (B) עקבות סידן חולפים מייצגים ותמונות בהילוך מהיר של CSs בנקודות זמן שונות (שבועות) לאחר הדור. סרגל קנה מידה, 200 מיקרומטר. (C) כימות מהלך הזמן של פעילות פעימות ספונטניות מבוטא כאחוז ה-CSs המכים. (D) קצב הכאה של CSs במהלך זמן הטיפוח. (ה-ה) כימות של מעברי הסידן המראים ערך שיא, זמן עלייה, זמן ריקבון ו- CTD90. הנתונים המוצגים הם ממוצעים ± SD. משכפלים ביולוגיים = שלושה, משכפלים טכניים = 38, 50, 66 ו-7, בהתאמה. *p < 0.05, ****p < 0.001; ANOVA חד-כיווני ואחריו מבחן השוואות מרובות פוסט-הוק של Tukey. קיצורים; CTD = משך סידן חולף, Wk = שבוע, CSs = כדורי לב אנושיים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
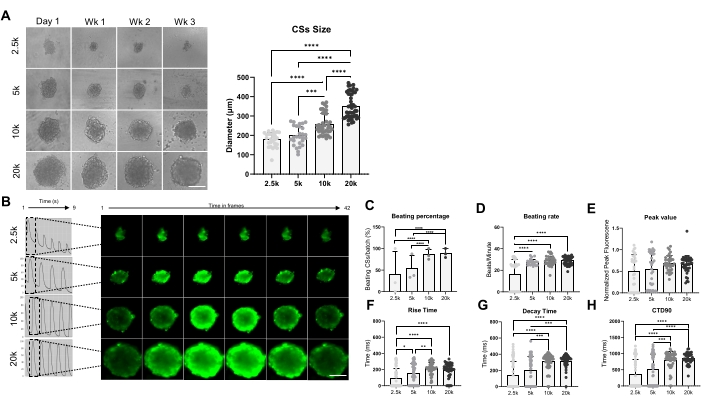
איור 3: קצב מכות וטיפול בסידן ב-CSs שנוצרו באמצעות צפיפויות שונות של זריעת תאים. (A) מדידות שדה בהיר (משמאל) וגודל (מימין) של CSs שנוצרו באמצעות מספרים שונים של hiPSC-CMs. סרגל קנה מידה, 200 מיקרומטר. (B) עקבות סידן חולפים מייצגים ותמונות קיטועי זמן של 2.5K-20K-CSs. (ג,ד) אחוזי חבטה וקצב חבטות של 2.5K-20K-CSs. (ה-ה) ערך שיא, זמן עלייה, זמן דעיכה ו- CTD90 ב- 2.5K-20K-CSs. הנתונים ממוצעים ± SD. משכפלים ביולוגיים = שלושה, משכפלים טכניים = 28-39. *p < 0.05, ****p < 0.001; ANOVA חד-כיווני ואחריו מבחן השוואות מרובות פוסט-הוק של Tukey. קיצורים: CTD = משך מעבר סידן, Wk = שבוע, k = x 1,000 תאים, CSs = ספרואידים לב. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
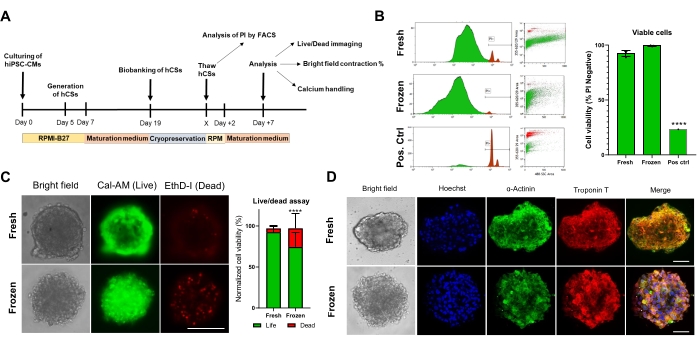
איור 4. השפעת שימור בהקפאה על כדאיות ומבנה כדורי הלב. (A) ייצוג סכמטי של ייצור מדעי המחשב, ביו-בנקאות עוקבת והפשרה. (B) בדיקת כדאיות תאי ציטומטריה של זרימה הן ב-CSs טריים והן בהקפאה. כבקרה חיובית, נעשה שימוש בטיפול עם 10% פתרון Triton-X למשך 5 דקות. (n = 4 לכל תנאי). הנתונים מיוצגים כממוצע ± SD. ****p < 0.001; ANOVA חד-כיווני ואחריו מבחן השוואות מרובות פוסט-הוק של Tukey. (C) בדיקת כדאיות תאי Calcein-AM ב-CSs טריים לעומת מופשרים לאחר 7 ימים של תרבית (n = 15-17 לכל מצב, ****p < 0.001, על ידי מבחן t זוגי; סרגל קנה מידה, 200 מיקרומטר). (D) צביעה מייצגת של שדה בהיר (משמאל) ואימונופלואורסנציה עבור ביטוי α-אקטינין וטרופונין T ב-CSs טריים ומופשרים. אימונופלואורסצנטיות: Hoechst (כחול), α-actinin (ירוק) וטרופונין T (אדום). התמונות הממוזגות מימין מציגות קטעי סרקומרה ב- CSs. סרגל קנה מידה, 50 מיקרומטר. קיצורים: X = יום הפשרה לפי בחירה, PI = יודיד פרופידיום, Cal-AM = calcein-AM, EthD-I = Ethidium Homodimer I. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
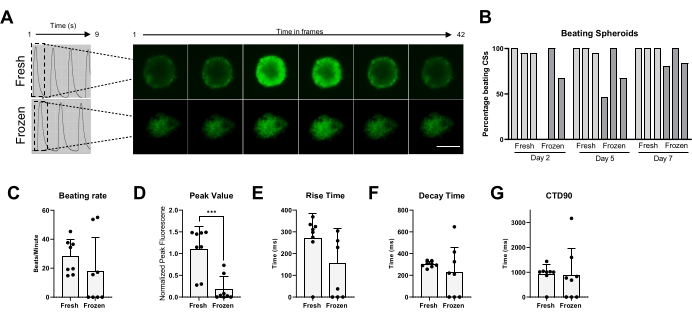
איור 5: מעברי סידן ב-CSs טריים לעומת מופשרים. (A) עקבות סידן חולפים מייצגים ותמונות בהילוך מהיר של ה-CSs לפני שימור בהקפאה ושבוע לאחר ההפשרה. (B) אחוז הכאה של כדורי לב טריים וקפואים/מופשרים. עמודות מייצגות ניסויים בודדים. (C) קצב הכאה של כדורי לב טריים וקפואים/מופשרים. (ד-ג) כימות פרמטרים חולפים של סידן: ערך שיא, זמן עלייה, זמן ריקבון ו-CTD90. הנתונים הם ממוצעים ± SD. *p < 0.05, ****p < 0.001; ANOVA חד-כיווני ואחריו מבחן השוואות מרובות פוסט-הוק של Tukey. קיצורים; CTD = משך סידן חולף, CSs = ספרואידים לבביים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
איור משלים 1: אסטרטגיות gating מייצגות לניתוח ציטומטריית זרימה. (A) אסטרטגיית gating מייצגת עבור hiPSC-CMs חיוביים α-אקטינין באוכלוסייה טהורה לעומת בקרה שלילית ובקרת איזוטיפ. מספר התאים המנותחים α-אקטינין חיוביים הוא 25 x 105. קיצורים; SSC = פיזור צד, PI+ = פרופידיום יודיד חיובי. (B) אסטרטגיית גטינג מייצגת לניתוח הכדאיות הן בבקרה הטרייה, המופשרת, החיובית (Triton-X) והן בבקרה השלילית (לא מוכתמת). אנא לחץ כאן כדי להוריד קובץ זה.
Discussion
גילוי תרופות לבביות נפגע על ידי הסתמכות על מודלים לא אנושיים של בעלי חיים ותאיים עם תפוקה לא מספקת ונאמנות פיזיולוגית לביצוע מדויק של קריאות. לביולוגיה של hiPSC-CM בשילוב עם מכשור HT ובדיקות פיזיולוגיות יש פוטנציאל להציג מחדש מודלים אנושיים לשלבים המוקדמים ביותר של מודלים של מחלות לב וגילוי תרופות. פיתחנו שיטה תלת ממדית לייצור רקמת לב המייצרת CSs איכותיים ופונקציונליים למידול אופטימלי של מחלות לב ופלטפורמת סינון תרופות. בנוסף, שילוב טכנולוגיית הספרואידים במערכות ביוריאקטורים תלת-ממדיות לייצור תעשייתי של רכב חשמלי מאפשר צעד הכרחי לקראת תרגום קליני של טיפול מבוסס EV. השיטה המתוארת כאן מסתמכת על מספר גורמים מכריעים והיא גרסה של פרוטוקולים קיימים 9,10,28,29. שיטות אלה כוללות: 1) יצירת מבנים רקמתיים תלת-ממדיים, 2) מספר התאים האופטימלי והתזמון לפני ההקרנה, 3) שיפור הרגישות ויכולת התפוקה הגבוהה של מכשירים, ו-4) היכולת להקפיא את הספרואידים לפני כל ניתוח פונקציונלי. בניגוד לפרוטוקולים שתוארו בעבר, הפרוטוקול המוצע מתאר ייצור של עד 1,500 ספרואידים ליום ואת ההתאמה ל-HTS. ניתוח קונבנציונלי של מאה תרכובות מעל 6 x 0.5 מנות יומן עבור 10 עותקים משוכפלים באמצעות מערכות הדמיית סידן קיימות של 96 בארות או רקמות לב מהונדסות מרובות 24 בארות דורש כ 500 מיליון עד 3 מיליארד hiPSC-CMs31,32. היישום המוצע הופך את בדיקות הלב לפחות יקרות ויעילות בזמן בהשוואה למערכות הקונבנציונליות, שכן לוחות 96 בארות דרשו רק 10% מצפיפות הזריעה בהשוואה לשיטה המתוארת. יתר על כן, בהשוואה לפרוטוקולים קודמים, כגון שיטת הטיפה התלויה, יצירת ספרואידים על ידי צבירה עצמית בלוחות חיבור נמוכים במיוחד מאפשרת הדמיה אוטומטית באיכות גבוהה של מיקרו-רקמות בודדות33.
מודל תלת-ממדי קטן זה מחקה את הפנוטיפ הביולוגי והפיזיולוגי של הסביבה הקרדיווסקולרית in vivo . כפי שהוכח בעבר, מעברי סידן גדלים באופן דרמטי במבנים תלת-ממדיים של רקמת לב בהשוואה לתרביות תאים חד-שכבתיות דו-ממדיות34.
לאחר מכן, מצאנו כי צפיפות הזריעה וזמן גידול נכון הם גם גורמים קריטיים לסינון מוצלח של ניתוח קיסרי. הצפיפות של 10K-20K hiPSC-CMs לכל ספרואיד והבדיקות בין שבועות 2-3 לאחר הדור היו אופטימליות, בעוד שספרואידים קטנים מדי או ישנים מדי מראים טיפול בסידן מופרע (איור 2 ואיור 3). לכן, חשוב לשמור על צפיפות זריעה עקבית ככל האפשר, שכן הגודל משפיע על הפרמטרים הפונקציונליים. כמו כן, למרות ששיטה אופטית זו מספקת תוצאות טובות עבור תרביות תלת-ממדיות חיות כרקמה שלמה, השגת נתונים בתוך ספרואידים גדולים יותר ברמה (תת-תאית) תאית היא מאתגרת מבלי להסתמך על שיטות היסטולוגיה הגוזלות זמן. לאחרונה פורסמו מספר גישות המשתמשות ב"ניקוי אופטי", המאפשר רכישת ספרואידים תלת-ממדיים שלמים עם אפשרות לכימות חד-תאי של סמנים. כאן, התאמנו פרוטוקול של 3 ימים מקצירת CS לניתוח תמונה, אשר מותאם להדמיה תלת-ממדית באמצעות מיקרוסקופ קונפוקלי29 (איור 1C ואיור 4D).
לבסוף, עם הגידול ביישומי רקמת לב תלת-ממדית וביישומים מסחריים, הביקוש לאחסון לטווח ארוך ולביו-בנקאות ספציפית למטופל מתורמים שונים עולה. שימור בהקפאה היא אסטרטגיה יעילה ליצירת לוחות HTS מאצוות מרובות לאורך זמן. הקפאה של hiPSC-CMs תוארה בעבר ואינה שונה בהשוואה לסוגי תאים אחרים בתרבית 10,35,36. לאחרונה תוארו גישות להקפאת לוחות עם תאים דו-ממדיים37. כאן, מצאנו שערכת השימור הקריוגנית PSC היא המצב האופטימלי ביותר בהשוואה לשלושה אחרים (הנתונים לא מוצגים) והשתמשנו במדיום זה להקפאה יעילה של ספרואידים. לאחר שימור בהקפאה, הכדאיות נשארת גבוהה (איור 4B,C), אך התכונות האלקטרופיזיולוגיות של CSs מושפעות ונדרשת תקופת דגירה לאחר ההפשרה. ואכן, שבוע לאחר ההפשרה, CSs הציגו פעילות פעימות ספונטנית וטיפול בסידן. עם זאת, תואר כי hiPSC-CMs טריים והתאוששו לא תמיד מראים תכונות מולקולריות ופיזיולוגיות זהות38. מגבלה זו צריכה להילקח בחשבון כאשר hiPSC-CMs שמורים בהקפאה משמשים להערכת קריאות לב המושרות על ידי תרופות. יתר על כן, למרות שאנו מווסתים ביעילות את מספר התאים לכל ספרואיד ואת העיתוי האופטימלי של הדמיה חולפת סידן, ניתן לשפר את הספרואידים הלבביים על ידי ערבוב תאי קרדיומיוציטים שמקורם ב- hiPSC עם תאי אנדותל, פיברובלסטים, צמתי תאים, ומטריצות חוץ-תאיות, כגון chitosan, קולגן IV, פיברונקטין , מטריג'ל או למינין, המחקים את סביבת הלב in vivo 39, 40. בסך הכל, אנו מציעים פרוטוקול שלב אחר שלב כדי ליצור ביעילות CSs המתאימים ליישומים במורד הזרם כגון מידול מחלות ובדיקת תרופות HT.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
ברצוננו להכיר במדעי VALA עבור חבילת התוכנה Cyteseer ואופטימיזציה של ניתוח הסידן התלת-ממדי האוטומטי. ברצוננו להכיר בתמיכה במענק מקרן PLN (RM). P.A.D. ו- F.S. נתמכים על ידי CUREPLaN Leducq. J.P.G.S. נתמך על ידי H2020-EVICARE (#725229) של מועצת המחקר האירופית (ERC). J.W.B. נתמך על ידי UMC Utrecht Clinical Fellowship, מלגת מכון הלב ההולנדי ומענק הכישרונות הצעירים CVON-Dosis; קרן הלב ההולנדית (CVON-Dosis 2014-40). N.C. נתמכת על ידי תוכנית הכבידה "חומרים מונעים רגנרציה" על ידי הארגון ההולנדי למחקר מדעי (RegmedXB #024.003.013), ופעולות מארי סקלודובסקה-קירי (הסכם מענק RESCUE #801540). V.S.-P. נתמך על ידי קרן הברית (UMCU, UU, TU/e). A.v.M. נתמכת על ידי הפרויקט BRAVE במימון האיחוד האירופי (H2020, ID:874827)
Materials
| Name | Company | Catalog Number | Comments |
| 24 wells suspenion plate | Corning | 3738 | |
| 96 wells Ultra-Low Attachment Multiple Well Plate | Corning | CLS3474-24EA | |
| Albumax | Thermo Fisher Scientific | 11020021 | |
| Anti-α-Actinin (Sarcomeric) antibody | Sigma-Aldrich | A7811 | Dilution: 1:200 |
| Anti-Cardiac Troponin T antibody (ab45932) | Abcam | ab45932 | Dilution: 1:200 |
| Ascorbic acid | Sigma-Aldrich | A8960 | |
| B-27 supplement | Thermo Fisher Scientific | 17504-044 | |
| Biotin | Sigma-Aldrich | B4639 | |
| Bovine serum albumin fraction V (BSA) | Roche | 10735086001 | |
| Cal-520, AM | Abcam | ab171868 | |
| Confocal microscope | Leica | DMi8 | |
| Confocal microscope software | Leica | Las X | |
| Conical tubes 15 mL | Greiner Bio-One | 5618-8271 | |
| Creatine monohydrate | Sigma-Aldrich | C3630 | |
| DAPI | Thermo Fisher Scientific | D3571 | Concentration: 1 µg/mL |
| DMEM no glucose | Thermo Fisher Scientific | 11966025 | |
| EDTA | Thermo Fisher Scientific | 15575020 | |
| Fructose | Sigma-Aldrich | 76050771.05 | |
| Glucose | Sigma-Aldrich | G7021 | |
| Glycerol | Boom | 76050771.05 | |
| Goat anti-mouse Alexa Fluor 488 | Invitrogen | A11029 | Dilution: 1:500 |
| Goat anti-rabbit Alexa Fluor 568 | Invitrogen | A11011 | Dilution: 1:500 |
| Horizontal shaker | IKA | 4003000 | |
| Human induced pluripotent stem cell lines | (Stanford Cardiovascular Institute (S-CVI) Biobank) | CVI-273 (control 1) | |
| Human induced pluripotent stem cell lines | Germany | 141 (control 2) 144 (control 3) | |
| Hydrochloric acid (HCl) | Ajax Firechem | 265.2.5L-PL | 10 M stock solution, corrosive |
| Isotype control, FITC mouse IgM κ isotype | BD | 556652 | |
| KnockOut Serum Replacement | Thermo Fisher Scientific | 10828 | Protect from light |
| L-carnitine | Sigma-Aldrich | C0283 | |
| Myocyte calcium and contractility system | Leica | Thunder, DMi8 | |
| Non essential amino acids (NEAA) | Thermo Fisher Scientific | 11140 | |
| Paraformaldehyde solution 4% in 1x PBS, pH 7.0–7.6 | Santa Cruz | SC281692 | Hazardous |
| PBS, pH 7.4 | Thermo Fisher Scientific | 10010023 | |
| Penicillin/streptomycin | Thermo Fisher Scientific | 15140 | |
| PES Membrane Vacuum Filter system | Corning | 431097 | |
| PI/RNase Staining Solution | Invitrogen | F10797 | Dilution: 1:1000 |
| Pluronic F-127 | Sigma-Aldrich | P2443 | |
| PSC Cryopreservation Kit | Thermo Fisher Scientific | A2644601 | |
| RevitaCell | Thermo Fisher Scientific | A2644501 | |
| RPMI 1640 medium | Thermo Fisher Scientific | 11875 | |
| Silicone Elastomer Kit | SYLGARD | 184 | |
| Sodium dodecyl sulfate solution (10%) | Sigma-Aldrich | 71736 | |
| Sodium L-Lactate | Sigma-Aldrich | 71718 | |
| Taurine | Sigma-Aldrich | T0625 | |
| Tris Fisher | Scientific | 11486631 | |
| Triton X-100 | Merck | X100-1L | Hazardous |
| Trypan blue solution, 0.4% | Thermo Fisher Scientific | 15250061 | |
| TrypLE Select Enzyme (10x) | Thermo Fisher Scientific | A1217701 | |
| Tween-20 | Sigma-Aldrich | P1379 | |
| Urea | Sigma-Aldrich | 51456 | |
| Vitamin B12 | Sigma-Aldrich | V6629 | |
| Y-27632 dihydrochloride (Rho-kinase inhibitor) | Tocris | 1254 | Protect from light |
References
- Burridge, P. W., et al. Chemically defined and small molecule-based generation of human cardiomyocytes. Nature Methods. 11 (8), 855-860 (2014).
- Kattman, S. J., et al. Stage-specific optimization of activin/nodal and BMP signaling promotes cardiac differentiation of mouse and human pluripotent stem cell lines. Cell Stem Cell. 8 (2), 228-240 (2011).
- Lian, X., et al. Robust cardiomyocyte differentiation from human pluripotent stem cells via temporal modulation of canonical Wnt signaling. Proceedings of the National Academy of Sciences. 109 (27), 1848-1857 (2012).
- Paige, S. L., et al. Endogenous Wnt/beta-catenin signaling is required for cardiac differentiation in human embryonic stem cells. PLoS One. 5 (6), 11134 (2010).
- Gintant, G., et al. Use of human induced pluripotent stem cell-derived cardiomyocytes in preclinical cancer drug cardiotoxicity testing: A scientific statement from the American Heart Association. Circulation Research. 125 (10), 75-92 (2019).
- Ahmed, R. E., et al. A brief review of current maturation methods for human induced pluripotent stem cells-derived cardiomyocytes. Frontiers in Cell and Developmental Biology. 19 (8), 178 (2020).
- Liu, C., et al. Generating 3D human cardiac constructs from pluripotent stem cells. EBioMedicine. 76, 103813 (2022).
- Musunuru, K., et al. Induced pluripotent stem cells for cardiovascular disease modeling and precision medicine: A scientific statement from the American Heart Association. Circulation: Genomic and Precision Medicine. 11 (1), 000043 (2018).
- Buikema, J. W., et al. Wnt activation and reduced cell-cell contact synergistically induce massive expansion of functional human iPSC-derived cardiomyocytes. Cell Stem Cell. 27 (1), 50-63 (2020).
- Maas, R. G. C., et al. Massive expansion and cryopreservation of functional human induced pluripotent stem cell-derived cardiomyocytes. Cell STAR Protocols. 2 (1), 100334 (2021).
- Tremblay, C., et al. A new construction technique for tissue-engineered heart valves using the self-assembly method. Tissue Engineering Part C: Methods. 20 (11), 905-915 (2014).
- Lewis-Israeli, Y. R., et al. Self-assembling human heart organoids for the modeling of cardiac development and congenital heart disease. Nature Communications. 12 (1), 5142 (2021).
- Goldfracht, I., et al. Engineered heart tissue models from hiPSC-derived cardiomyocytes and cardiac ECM for disease modeling and drug testing applications. Acta Biomaterialia. 1 (92), 145-159 (2019).
- Fleischer, S., et al. Comprehensive human stem cell differentiation in a 2D and 3D mode to cardiomyocytes for long-term cultivation and multiparametric monitoring on a multimodal microelectrode array setup. Biosensors and Bioelectronics. 126, 624-631 (2019).
- Branco, M. A., et al. Transcriptomic analysis of 3D cardiac differentiation of human induced pluripotent stem cells reveals faster cardiomyocyte maturation compared to 2D culture. Science Reports. 9 (1), 9229 (2019).
- Ergir, E., et al. Generation and maturation of human iPSC-derived cardiac organoids in long term culture. bioRxiv. , (2022).
- Lemoine, M. D., et al. Human iPSC-derived cardiomyocytes cultured in 3D engineered heart tissue show physiological upstroke velocity and sodium current density. Scienctific Reports. 7 (1), 5464 (2017).
- Kofron, C. M., et al. A predictive in vitro risk assessment platform for pro-arrhythmic toxicity using human 3D cardiac microtissues. Science Reports. 11 (1), 10228 (2021).
- Giacomelli, E., et al. Human-iPSC-derived cardiac stromal cells enhance maturation in 3D cardiac microtissues and reveal non-cardiomyocyte contributions to heart disease. Cell Stem Cell. 26 (6), 862-879 (2020).
- Richards, D. J., et al. Human cardiac organoids for the modelling of myocardial infarction and drug cardiotoxicity. Nature Biomedical Engineering. 4 (4), 446-462 (2020).
- Tenreiro, M. F., et al. Next generation of heart regenerative therapies: progress and promise of cardiac tissue engineering. npj Regenerative Medicine. 6 (1), 30 (2021).
- Hansen, A., et al. Development of a drug screening platform based on engineered heart tissue. Circulation Research. 107 (1), 35-44 (2010).
- McDermott-Roe, C., et al. Investigation of a dilated cardiomyopathy-associated variant in BAG3 using genome-edited iPSC-derived cardiomyocytes. Journal of Clinical Investigation Insight. 4 (22), 128799 (2019).
- National Library of Medicine (U.S.). Safety and efficacy of induced pluripotent stem cell-derived engineered human myocardium as biological ventricular assist tissue in terminal heart failure. National Library of Medicine. , (2020).
- Ronaldson-Bouchard, K., et al. Advanced maturation of human cardiac tissue grown from pluripotent stem cells. Nature. 556 (7700), 239-243 (2018).
- Oh, J. G., et al. Generation of ventricular-like HiPSC-derived cardiomyocytes and high-quality cell preparations for calcium handling characterization. Journal of Visualized Experiments. 155, 60135 (2020).
- Lian, X., et al. Directed cardiomyocyte differentiation from human pluripotent stem cells by modulating Wnt/β-catenin signaling under fully defined conditions. Nature Protocols. 8 (1), 162-175 (2013).
- Feyen, D. A. M., et al. Metabolic maturation media improve physiological function of human iPSC-derived cardiomyocytes. Cell Reports. 32 (3), 107925 (2020).
- van Ineveld, R. L., et al. Single-cell resolution three-dimensional imaging of intact organoids. Journal of Visualized Experiments. (160), e60709 (2020).
- Guo, Y., Pu, W. T. Cardiomyocyte maturation: New phase in development. Circulation Research. 126 (8), 1086-1106 (2020).
- Ding, B., et al. Three-dimensional renal organoids from whole kidney cells: Generation, optimization, and potential application in nephrotoxicology in vitro. Cell Transplantation. 29, 963689719897066 (2020).
- Denning, C., et al. Cardiomyocytes from human pluripotent stem cells: From laboratory curiosity to industrial biomedical platform. Biochimica Biophysica Acta. 1863, 1728-1748 (2016).
- Amaral, R. L. F., et al. Comparative analysis of 3D bladder tumor spheroids obtained by forced floating and hanging drop methods for drug screening. Frontiers in Physiology. 8, 605 (2017).
- Daily, N. J., et al. Improving cardiac action potential measurements: 2D and 3D cell culture. Journal of Bioengineering and Biomedical Science. 5 (3), 168 (2015).
- Preininger, M. K., et al. Cryopreservation of human pluripotent stem cell-derived cardiomyocytes: Strategies, challenges, and future directions. Advances in Experimental Medicine and Biology. 951, 123-135 (2016).
- Kim, Y. Y., et al. Cryopreservation of human embryonic stem cells derived-cardiomyocytes induced by BMP2 in serum-free condition. Reproductive Science. 18 (3), 252-360 (2011).
- Daily, M. I., et al. Cryopreservation of primary cultures of mammalian somatic cells in 96-well plates benefits from control of ice nucleation. Cryobiology. 93, 62-69 (2020).
- Zhang, J. Z., et al. Effects of cryopreservation on human induced pluripotent stem cell-derived cardiomyocytes for assessing drug safety response profiles. Stem Cell Reports. 16 (1), 168-181 (2021).
- Yeh, H. -. Y., et al. The calcium-dependent regulation of spheroid formation and cardiomyogenic differentiation for MSCs on chitosan membranes. Biomaterials. 33 (35), 8943-8954 (2012).
- Scalise, M., et al. From spheroids to organoids: The next generation of model systems of human cardiac regeneration in a dish. International Journal of Molecular Sciences. 22 (24), 13180 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved