Method Article
מודל מעיים-על-שבב לחקר ציר המיקרוביום-מערכת העצבים של המעי
In This Article
Summary
neuroHuMiX הוא מודל מעיים על שבב מתקדם לחקר האינטראקציות של תאים חיידקיים, אפיתליאליים ועצביים בתנאי תרבית משותפת פרוקסימלית ומייצגת. מודל זה מאפשר לפענח את המנגנונים המולקולריים העומדים בבסיס התקשורת בין מיקרוביום המעי למערכת העצבים.
Abstract
גוף האדם מאוכלס על ידי לפחות אותו מספר של תאים מיקרוביאליים כפי שהוא מורכב מתאים אנושיים, ורוב המיקרואורגניזמים האלה ממוקמים במעיים. אף על פי שיחסי הגומלין בין מיקרוביום המעי והפונדקאי נחקרו רבות, האופן שבו מיקרוביום המעי מתקשר עם מערכת העצבים האנטרית עדיין אינו ידוע במידה רבה. נכון להיום, מודל פיזיולוגי מייצג במבחנה לחקר אינטראקציות מיקרוביום-מערכת העצבים במעיים אינו קיים.
כדי למלא את הפער הזה, פיתחנו את מודל המעיים-על-שבב בין אדם למיקרוביאלי (HuMiX) על-ידי החדרת תאי עצב אנטריים פלוריפוטנטיים מושרים שמקורם בתאי גזע לתוך המכשיר. המודל שנוצר, "neuroHuMiX", מאפשר תרבית משותפת של תאים חיידקיים, אפיתליאליים ועצביים על פני תעלות מיקרופלואידיות, המופרדות על ידי ממברנות חדירות למחצה. למרות ההפרדה בין סוגי התאים השונים, התאים יכולים לתקשר זה עם זה באמצעות גורמים מסיסים, ובו זמנית לספק הזדמנות לחקור כל סוג תא בנפרד. מערך זה מאפשר תובנות ראשונות על האופן שבו מיקרוביום המעי משפיע על תאי העצב האטריים. זהו צעד ראשון קריטי בלימוד והבנה של ציר המיקרוביום-מערכת העצבים במעי האנושי.
Introduction
מיקרוביום המעי האנושי ממלא תפקיד מכריע בבריאות האדם ובמחלות. הוא נחקר בהרחבה בעשור וחצי האחרונים, ותפקידו הפוטנציאלי בוויסות בריאות ומחלות נקבע כעת1. הפרעה במיקרוביום המובילה לקהילה מיקרוביאלית לא מאוזנת (דיסביוזיס) הועלתה השערה כמעורבת בפתוגנזה של הפרעות כרוניות רבות, כגון השמנת יתר, מחלות מעי דלקתיות וסרטן המעי הגס, או אפילו מחלות נוירודגנרטיביות כגון מחלת פרקינסון 2,3.
אמנם מיקרוביום המעי האנושי נקשר למחלות נוירולוגיות, אבל עדיין לא ברור כיצד מיקרוביום המעי מתקשר עם מערכת העצבים האנטרית ומשפיע עליה. מכיוון שמערכת העצבים האנטרית האנושית אינה נגישה בקלות למחקר מיידי, מודלים של בעלי חיים שימשו בניסויים עד כה4. עם זאת, בהתחשב בהבדלים לכאורה בין מודלים של בעלי חיים לבני אדם5, הפיתוח של מודלים במבחנה המחקים את המעיים האנושיים הוא עניין מיידי. בהקשר זה, התחום המתפתח והמתקדם של תאי גזע פלוריפוטנטיים מושרים אנושיים (iPSCs) אפשר לנו להשיג נוירונים אנטריים מייצגים (ENs)6. ENs שמקורם ב-iPSC מאפשרים לחקור את מערכת העצבים האנטרית במודלים של תרביות מבחנה, כגון תוספות תרבית תאים, אורגנואידים או איברים על שבב 7,8.
HuMiX (ראשי תיבות של Human Microbial crosstalk) הוא מודל מעי על שבב המחקה את המעי האנושי9. מודל HuMiX הראשוני (להלן המכשיר הראשוני) הכיל תאי אפיתל (Caco-2) ותאי חיידקים10,11. אולם כדי לחקור את הקשר בין מיקרוביום המעי למערכת העצבים, הוכנסו למערכת גם ENs6 שמקורם ב-iPSC (איור 1). התרבית המשותפת הפרוקסימלית של תאי עצב, אפיתל וחיידקים מאפשרת ניתוח של סוגי התאים השונים בנפרד וחקר יחסי הגומלין בין סוגי התאים השונים בסביבה המחקה את זו של המעי האנושי.
בשנים האחרונות חלה התקדמות בפיתוח מודלים לחקר איברים בדרכים ייצוגיות יותר מבחינה פיזיולוגית באמצעות מודלים של איברים על שבב (למשל, מעיים על שבב). מודלים אלה מייצגים יותר את סביבת המעיים האנושית בשל אספקה קבועה של חומרי מזון וסילוק פסולת, כמו גם ניטור בזמן אמת של, למשל, רמות חמצן או שלמות מחסום 8,12. מודלים אלה מאפשרים באופן ספציפי לחקור את ההשפעות של חיידקי מעיים על תאים מארחים. עם זאת, כדי להיות מסוגלים להשתמש באיברים על שבב כדי לחקור את יחסי הגומלין בין מיקרוביום המעי לבין מערכת העצבים, תאים עצביים צריכים להיות משולבים במערכות כאלה. לכן, המטרה של המשך פיתוח HuMiX וביסוס מערכת neuroHuMiX (להלן המכשיר) הייתה לפתח מודל מעיים על שבב, הכולל תאים עצביים אנטריים בתרבית משותפת פרוקסימלית עם תאי אפיתל מעיים וחיידקים.
Protocol
1. תרבית תאים ומיון
- תאי עצב אנטריים פלוריפוטנטיים מושרים שמקורם בתאי גזע
הערה: תאי גזע iPSCs 6 שבועות לפני תחילת ריצה. פרוטוקול הבידול עבור ה-ENs הותאם מ-Fattahi et al.6.- תרבית את iPSCs על צלחת מצופה ג'ל מטריצה 6 בארות ב 2 מ"ל / באר של מדיום תרבית iPSC בתוספת 1% פניצילין-סטרפטומיצין (P / S).
- במפגש של 80%-90%, מעבירים את התאים, זורעים בצלחת מצופה ג'ל מטריצה באמצעות אותו תווך, דוגרים ב-37°C, 5%CO2 ו-90% לחות יחסית (RH).
- עבור נגזרת iPSC, לאחר שני מעברים לאחר ההפשרה, במפגש של 80%-90%, זרעו את התאים בצלחת 6 בארות מצופת ג'ל מטריצה בצפיפות של 100,000 תאים/באר. לדגור במדיה המתוארת לעיל + מעכב ROCK Y-27632 (1:2,000) במשך 24 שעות ב 37 ° C.
- לאחר 24 שעות, החלף את התווך הסופרנטנטי בתווך יום 0, לפי טבלה 1. כלול פקד אחד היטב שישמש כבקרה שלילית במהלך מיון התאים לתהליך הנגזרת. שמור היטב על הבקרה בהרכב המדיה של יום 0 למשך כל תקופת הנגזרת. החליפו את המדיום כל יומיים מימים 2 עד 10, לפי טבלה 1.
- ביום ה-11, מיין את התאים עבור תאים חיוביים ל-CD49d, אשר ישמשו בשלבים הבאים של פרוטוקול זה.
- אחסן את התאים למיון בהתבסס על תאים חיוביים CD49d, כמו גם את הבקרה היטב. צנטריפוגה את התאים במשך 3 דקות ב 300 × גרם. יש להשהות מחדש את כדורית התא באלבומין 2% בסרום בקר (BSA) + 1% P/S במי מלח חוצצי פוספט 1x (PBS).
- חלק כל תא (מאוגד ובקרה) לשניים: מכתים חלק אחד עם נוגדן CD49d אנטי אנושי, ואת החלק השני עם נוגדן בקרת איזוטיפ.
- שער אוכלוסיית התאים הראשית ולאחר מכן שער תאים בודדים, שעל בסיסו ייבחרו התאים המציגים CD49d על פני השטח שלהם. אסוף תאים אלה לשלב הבא של התמיינות.
הערה: בדרך כלל, 30%-40% מהתאים הממוינים הם חיוביים ל- CD49d.
- העבר שניים עד ארבעה מיליון תאים ממוינים לצלחת אחת בת 6 בארות של צלחת חיבור נמוכה במיוחד במדיה N2B27 (ראה טבלה 2) + FGF2 + CHIR למשך 4 ימים כדי לאפשר היווצרות ספרואידים.
- ביום ה-15, יש לצלחת מחדש את הספרואידים על צלחת 6 בארות מצופות פולי L-אורניתין/למינין/פיברונקטין (P/L/F) ב-2 מ"ל/באר של מדיה N2B27 עם GDNF וחומצה אסקורבית (AA). החלף את המדיום כל 2-3 ימים.
הערה: יחס ציפוי: פולי L-אורניתין, 15 מיקרוגרם / מ"ל; למינין, 2 מיקרוגרם/מ"ל; פיברונקטין, 2 מיקרוגרם/מ"ל ב-1x PBS. - לאחר 3 שבועות, השתמש בתאים לחיסון במכשיר.
- קאקו-2
הערה: הפשירו תאי Caco-2 לפחות שבוע לפני ריצה.- זרעו בקבוק T75 עם 1 × 106 תאי Caco-2 בתוסף גלוטמין RPMI 1640 + HEPES + סרום בקר עוברי 10% (FBS); יש לדגור ב-37°C, 5%CO2 ו-90% RH.
הערה: עבור ניסויים אלה, באופן אידיאלי להשתמש Caco-2 במעבר הראשון או השני שלהם לאחר ההפשרה.
- זרעו בקבוק T75 עם 1 × 106 תאי Caco-2 בתוסף גלוטמין RPMI 1640 + HEPES + סרום בקר עוברי 10% (FBS); יש לדגור ב-37°C, 5%CO2 ו-90% RH.
2. הכנה לריצה של HuMiX
- הכנת מכסה פוליקרבונט וציפויו
- Autoclave זוג מכסי פוליקרבונט (PC) יחד עם ארבעה ברגים באמצעות מחזור המכשיר הראשוני (ראה טבלה 3 לפרטים).
- בארון בטיחות ביולוגית, הכנס ארבעה ברגים בכל פינה של מכסה המחשב התחתון (ראה איור 3) והעבר לצלחת פטרי מרובעת סטרילית לתהליך ציפוי דו-שלבי.
- ביום הראשון, הוסף 2 מ"ל של 1.5% פולי L-אורניתין ב- PBS (1x) לאמצע מכסה המחשב. יש לדגור למשך הלילה בטמפרטורה של 37°C, 5%CO2 ו-90% לחות יחסית (RH).
- למחרת, הסר את התמיסה והחלף אותה בתמיסה המכילה 0.2% למינין ו -0.2% פיברונקטין ב- PBS (1x) כדי לכסות את פני השטח של תא העצב. יש לדגור על המכסה למשך הלילה בטמפרטורה של 37°C, 5%CO2 ו-90% RH.
- לאחר הדגירה, יש לשמור את תמיסת הציפוי על מכסה המחשב האישי ולסגור את צלחת הפטרי בעזרת סרט איטום. הניחו אותם בטמפרטורה של 4°C לאחסון עד לשימוש.
- לפני השימוש, הסירו את תמיסת הציפוי, וייבשו באוויר בארון בטיחות ביולוגית למשך 30 דקות עד שהציפוי יבש לחלוטין.
- הכנת אטם וציפויו
הערה: סעיף זה מתאר כיצד להכין אטמים על-ידי הדבקת ממברנות חדירות למחצה לאטמי סיליקון. לאחר שלב אוטוקלאבינג ראשוני, האטמים מצופים בקולגן או מוצין כדי לאפשר הידבקות של תאי אפיתל מעיים או חיידקים. הקרום המצופה במוצין מחקה את מחסום הריר שנמצא במעי האדם.- חברו קרום פוליקרבונט בגודל 1 מיקרומטר לאטם הקולגן וקרום פוליקרבונט בגודל 50 ננומטר בין אטמי הכריך התחתון והעליון. בצע Autoclave של האטמים עם הממברנות המחוברות באמצעות מחזור המכשירים הראשוני של ההתקן (ראה טבלה 3).
- כדי לצפות את הממברנות, מניחים כל אטם בכלי ריבועי סטרילי.
הערה: הציפוי נעשה בתנאים סטריליים בארון בטיחות ביולוגית.- עבור אטם קולגן, להוסיף 3 מ"ל של קולגן (50 מיקרוגרם / מ"ל) לממברנה לדגור במשך 3 שעות ב 37 ° C.
הערה: היזהר לא לגעת בקרום עם קצה פיפטה בעת הוספת הקולגן כדי למנוע נזק לממברנה. - לציפוי המוצין, מניחים את אטם הכריך עם האטם העליון כלפי מעלה בצלחת פטרי כדי לצפות את הצד העליון של הממברנה ב-3 מ"ל מוצין (0.025 מ"ג/מ"ל). לדגור את האטמים ב 37 ° C במשך 1 שעה.
- עבור אטם קולגן, להוסיף 3 מ"ל של קולגן (50 מיקרוגרם / מ"ל) לממברנה לדגור במשך 3 שעות ב 37 ° C.
- לאחר זמן הדגירה, שאפו את תמיסות הקולגן והמוצין מאטמים בהתאמה וייבשו את הממברנה באוויר בארון בטיחות ביולוגית למשך 30 דקות. סוגרים את הכלים, אוטמים בסרט איטום מעבדה ומאחסנים את האטמים בטמפרטורה של 4°C עד לשימוש.
- הרכבת אבובים
הערה: סעיף זה מתאר כיצד להרכיב את הצינור לזילוח ההתקן. לפני ההרכבה, autoclave כל חתיכות ו / או לקנות את אלה ארוזים בנפרד באריזה סטרילית. הכניסו את כל הרכיבים לארון בטיחות ביולוגית.- השתמש בשלושה קווי צינור עבור כל מכשיר ועבור כל קו צינור, חתיכה אחת של צינור משאבה, שתי חתיכות של צינורות מרפרן ארוכים (20 ס"מ), שתי חתיכות של צינורות מרפרן קצרים (8 ס"מ), מחט אחת של 40 מ"מ עבור בקבוק היציאה, מחט אחת של 120 מ"מ עבור בקבוקי זרימה של 250 מ"ל או מחט 80 מ"מ עבור בקבוקי זרימה קטנים יותר, שלושה מחברי Luer to barb זכריים ושבעה נקבות, שלושה מתאמי Luer ושני שסתומי סטופקוק תלת-כיווניים.
- הרכיבו קווי צינורות משמאל לימין באמצעות הרכיבים האוטומטיים והמעוקרים שצוינו לעיל (איור 4).
הערה: יש לרסס כל רכיב באתנול בשיעור 70% בין כל שלב חיבור.
- הכנת מדיה
הערה: סעיף זה מתאר כיצד להכין את המדיום לסוגי התאים השונים במכשיר, וכן כיצד להעביר את המדיום לבקבוקי הסרום באופן סטרילי.- תוספת RPMI 1640 עם 10% 0.22 מיקרומטר מסונן, FBS מנוטרל חום. השלם את המדיה N2B27 טרי עם GDNF ו- AA.
- מעבירים את המדיום לבקבוקי הסרום בתנאים סטריליים. העבר 200 מ"ל של מדיה RPMI 1640 לבקבוקים של 250 מ"ל ו- 30 מ"ל של מדיה N2B27 לבקבוקים של 50 מ"ל.
- הכינו מדיום חיידקי (RPMI 1640 + 10% FBS + 5% מדיום תרבית דה מאן, רוגוסה ושפרה [MRS]) בשלב מאוחר יותר, מכיוון שהדבר נדרש רק במהלך 24 השעות האחרונות של הניסוי.
- סוגרים את הבקבוקים עם מחיצה, אלומיניום מכווץ אותם, ו autoclave.
- כדי להעביר את המדיה, הסר את כיווץ האלומיניום באמצעות מכסה מתאים (קוטר = 20 מ"מ). הסירו גם את המחיצה. בזהירות לשפוך את המדיום מוכן לתוך בקבוקי הסרום מבלי לגעת בבקבוק.
- כדי לעקר, יש להבעיר את פתח הבקבוק באמצעות מבער Bunsen נייד. אטמו את הבקבוקים על ידי ריסוס המחיצה באתנול 70%, הוספתו לבקבוק וסגירתו עם כיווץ אלומיניום באמצעות מכופף איטום.
- מניחים את הבקבוקים הסגורים באינקובטור ב 37 ° C, 5% CO2 במשך 24 שעות כדי לחמם את המדיום ל 37 ° C, כמו גם כדי לוודא שאין סימנים גלויים של זיהום לפני השימוש בקבוקי מדיה עבור המכשיר.
3. התחלת HuMiX
- הרכבת NeuroHuMiX
הערה: סעיף זה מסביר כיצד להרכיב את ההתקן. בקיצור, מערכת ההידוק מעוקרת ומהודקת מחדש, ולאחר מכן מכסה המחשב התחתון ממוקם על בסיס המהדק. לאחר מכן, האטמים המצופים ומכסי המחשב העליונים נערמים זה על זה, ואחריו החלק העליון של המהדק. לבסוף, המהדק מהדק כדי לדחוס את האטמים ולהפוך את המערכת ללא דליפה ואטומה לגז. איור 4 מתאר את החלקים השונים הדרושים להרכבה.- בצע Autoclave של מלחציים ושני מכסי המחשב (עליון ותחתון) לפני ההרכבה.
- הדקו את הברגים המשמשים להרכבת החלקים העליונים והתחתונים של המהדק (איור 4C,D). פתח את הברגים לפני תהליך autoclaving והידק אותם מחדש מאוחר יותר.
- העבר את מכסה המחשב התחתון המצופה והמיובש (שלב 2.2.3) (איור 4 A1) מצלחת הפטרי המרובעת לחלק העליון של בסיס המהדק על-ידי החזקת ארבעת הברגים בפינות מכסה המחשב.
הערה: הימנע מלגעת במכסה המחשב כדי להפחית את הסיכון לזיהום. - הניחו את אטם תא האפיתל כשהוא פונה כלפי מעלה (כלומר, עם הממברנה למעלה) על מכסה המחשב באמצעות פינצטה סטרילית. השתמשו בברגים כדי ליישר את האטם ואת מכסה המחשב כדי לוודא שפתחי הכניסה והשקע בפינות המכסה מיושרים עם הפתחים באטם (איור 3).
- בעזרת הפינצטה הסטרילית, מניחים את אטם הסנדוויץ' מעל אטם הקולגן, כשהצד העליון פונה כלפי מעלה.
- הניחו את מכסה המחשב העליון על אטם הכריך. כדי להפחית את הסיכון לזיהום, עשו זאת על ידי נגיעה רק בשולי המכסה (אין לגעת בחלק העליון או התחתון של המכסה). ודא שהברגים על מכסה המהדק מתיישרים עם פתח הכניסה והשקע במכלול הממברנה, ושהברגים ממכסה המחשב התחתון מתאימים לפתח מכסה המחשב העליון.
- כדי לסגור את ההתקן, הנח את מכסה המהדק (החלק העליון של המהדק) על מכסה המחשב. ודא שפתחי המכסה חופפים לפתחי הכניסה והשקע של מכסה המחשב העליון. סגור את התפחים. שמור את המכשיר הסגור (איור 5) מתחת למכסה המנוע כדי להתחבר לקווי הצינור הדרוכים (שלב 3.2.6).
- הנחת קווי אבובים
הערה: סעיף זה מתאר כיצד לחבר את הצינור לבקבוקים הנכנסים והיוצאים, כמו גם למשאבה, ולאחר מכן לכוון את הצינור עם מדיום כדי להסיר את כל שאריות המוצרים המשמשים במהלך ניקוי ועיקור, ולוודא שאין בועות בצינורית.- הנחת קווי הצינורות מתבצעת בארון הבטיחות הביולוגית. הכנס מחטי אוורור עם מסננים במחיצה של כל בקבוק זרימה ויציאה. בעזרת פינצטה נקייה וסטרילית, הכנס את מחטי ה-120 מ"מ לבקבוקי הסרום בנפח 250 מ"ל. הכנס את המחטים בקוטר 80 מ"מ לבקבוקי הסרום של 50 מ"ל.
- הכנס את המחטים בקוטר 40 מ"מ, בקצה כל קו צינורות, לבקבוק סרום יציאה. בכל מכשיר, ישנם שני בקבוקי זרימה עבור שלושת קווי הצינורות. המחטים בקוטר 40 מ"מ של קווי האפיתל והצינור העצבי מחוברות לאותו בקבוק יציאה להשלכה בינונית. קו צינור החיידקים עובר לבקבוק היציאה השני.
- הכנס את קווי צינורות המשאבה לקלטות המשאבה. ודא שהסטופקוקים התלת-כיווניים של קווי הצינורות פתוחים כולם.
- בהתחלה, כוונו את המשאבה הפריסטלטית לכוון את המדיה מהזרימה לבקבוק הזרימה במהירות של 5 סל"ד (ראו טבלה 4).
הערה: במהלך פרימת קו אבובים, ניתן להגדיל את המהירות עד 10 סל"ד כדי להאיץ את התהליך. - הפעל את המשאבה על ידי לחיצה על לחצן התחל וודא שכיוון פעולת השאיבה הוא בכיוון השעון. ברגע שהתקשורת נופלת לתוך בקבוקי היציאה, יש לוודא שאין נזילות ולא נותרות בועות אוויר בקווי הצינורות ובנקודות החיבור. הסר את כל הבועות שנותרו על ידי הקשה על הצינור והמחברים או על ידי הגדלת מהירות המשאבה.
- כאשר כל קווי הצינור נופלים לתוך בקבוקי היציאה, הגדר את קצב הזרימה ל -2 סל"ד לחיבור המכשיר הראשוני.
- פרימת המכשיר
הערה: סעיף זה מתאר כיצד לכוון את המכשיר עם מדיום תרבית תאים כדי להבטיח שכל התאים מלאים ומצופים מראש בתווך, כך שלא יישארו בועות במערכת והתאים יוכלו להיצמד בקלות במהלך החיסון.- פרימת המכשיר מתבצעת בארון הבטיחות הביולוגית בתנאים סטריליים. כדי לחבר את המכשיר, התחל על ידי חיבור הקו העצבי, החדר התחתון של המכשיר.
- כדי לחבר קו, סגור את שסתומי הסטופקוק התלת-כיווניים (איור 5C), החל מהצד היוצא, שבו הצינור הקצר מנותק ממחבר Luer הנשי ומחובר ליציאת היציאה מהמכשיר, על-ידי דחיפת הצינור מעל המשקוף. כדי להבטיח חיבור תקין ולהפחית את הסיכוי לדליפות ו/או זיהום, ודא שהצינור בא במגע עם המכסה על ידי דחיפתו כל הדרך למטה מעל המחבר. חבר את צינורות הזרימה באותו אופן. לאחר חיבור מלא של קו אחד למכשיר (זרימה ויציאה), פתח את הסטופקוקים התלת-כיווניים.
- חזור על השלב הקודם עם קו האפיתל, ולאחר מכן עם קו החיידקים. שמור על המשאבה בקצב זרימה של 2 סל"ד. הגדל את מהירות המשאבה ל -2.5 סל"ד, אך לא גבוה יותר, על מנת למנוע דליפות עקב הצטברות לחץ. אפשרו למשאבה להפעיל את התאים במכשיר.
- יש לעקוב אחר היציאות של בקבוקי הסרום בכל עת. אם בועות אוויר נתקעות בתאים, בקווים או במחברים, קו צינורות עם בועת אוויר בפנים לא ייפול יותר בתא היציאה. כדי להיפטר מבועות אוויר, תחילה תן למכשירים לפעול במשך כמה דקות. אם פעולה זו אינה פותרת את הבעיה, סגור את אחד הקווים האחרים שיורדים לפרק זמן קצר על-ידי סגירת הסטופקוק התלת-כיווני של היציאה.
- ברגע שכל תאי המכשיר מוכנים במלואם - כל התאים מלאים בתווך תרבית תאים ולא נשארות בועות במכשיר - הפחיתו את מהירות המשאבה ל-0.5 סל"ד. המכשיר מוכן כעת לחיסון תאים.
4. הכנת תאים וחיסון
הערה: סעיף זה מתאר כיצד להכין את סוגי התאים השונים הדרושים לחיסון המכשיר, וכן כיצד לחסן אותם במכשיר באופן סטרילי וללא החדרת בועות אוויר. יתר על כן, הוא מתאר כיצד לבצע רענון בינוני לתאי העצב, וכיצד להכין מדיום לתרבית החיידקים במכשיר.
- תאי אפיתל
- נתקו את תאי Caco-2 מהבקבוק באמצעות חומצה טריפסין-אתילאנדיאמיןטטראצטית (EDTA), השהו מחדש בסל"ד 1640 + 10% FBS, וספרו במונה תאי נויבאואר באמצעות בדיקת ההרחקה הכחולה של טריפאן. צנטריפוגו את תרחיף תאי Caco-2 (3 דקות, 300 × גרם), והשליכו את הסופרנאטנט כדי להסיר את שאריות הטריפסין-EDTA. השהה מחדש את תאי Caco-2 ב- RMPI 1640 + 10% FBS כדי להשיג השעיה של 350,000 תאים / מ"ל. עבור כל מכשיר, נפח של 1.5 מ"ל נדרש.
- העבר 1.5 מ"ל של תרחיף התא Caco-2 לתוך מזרק סטרילי 2 מ"ל והסר כל אוויר או בועות שנותרו במזרק.
- סגור את שסתומי הסטופקוק התלת-כיווניים של צינורות תאי החיידקים והנוירונים. נתק את הצינורית של תאי החיידקים והעצבים מהמשאבה על ידי הסרת הקלטות עם הצינור המתאים מהרוטור.
- פתח את המכסה של שסתום הסטופקוק התלת-כיווני של צינור הזרימה המוביל לתא האפיתל וסובב את שסתום הסטופקוק התלת-כיווני כדי להפנות את הזרימה הבינונית מהמכשיר ל'מחבר הפתוח' (איור 5C). אפשר לתווך לזרום עד שתופיע טיפה של תווך בקצה הפתוח של שסתום הסטופקוק התלת-כיווני.
- הכנס את המזרק המכיל את תאי האפיתל ל'מחבר הפתוח' בשיטת חיבור טיפה-טיפה כדי לאפשר החדרת המזרק למחבר ללא הכנסת בועות אוויר. סובב את השסתום של הסטופקוק התלת-כיווני כדי לעצור את זרימת התווך מבקבוק הזרימה (דרך המשאבה) ולאפשר זרימה מהמזרק המחובר למכשיר הראשוני. נתקו את תעלת האפיתל מהמשאבה.
- לחץ לאט על המזרק כדי לחסן את תא האפיתל עם השעיית התא. יש לוודא שכטיפה אחת לכל 3 שניות נכנסת לבקבוק היוצא.
- הוסף 1.5 מ"ל של השעיית התא, ולאחר מכן סגור את השסתום של סטופקוק תלת כיווני החוצה. נתקו את המזרק וסגרו את הקצה הפתוח של הסטופקוק המשולש עם הפקק. השאירו את התא סגור למשך שעתיים לפחות. בינתיים, לחסן את התאים העצביים.
- תאי עצב
- נתק את התאים העצביים מהבאר על ידי השעיית התאים במדיה מהבארות המתאימות באמצעות פיפטה. לחסן כל מכשיר עם תאים בזרימה מלאה מבאר אחת (9.6 ס"מ2) של צלחת 6 בארות.
- השהה מחדש את גלולת התא בנפח הבינוני המתאים N2B27 (1.5 מ"ל מדיה לכל מכשיר) + 1 מיקרוליטר של פיברונקטין / מ"ל של השעיית התא. העבר 1.5 מ"ל של תרחיף התא המרחף לתוך מזרק 2 מ"ל והסר את כל בועות האוויר שנותרו במזרק. מניחים את המזרק המלא בצינור חרוטי סטרילי של 50 מ"ל ומעבירים לארון הבטיחות הביולוגית המכיל את מכשיר HuMiX המוכן.
- בצע את אותו תהליך חיסון כפי שתואר קודם לכן עבור חיסון תא אפיתל, למעט שינוי קו הצינור. כאן, נתקו את קווי צינור החיידקים והאפיתל מהמשאבה.
- לאחר חיסון תאי עצב, סגור את כל הסטופקוקים התלת-כיווניים של קווי הצינור והתנתק מהמשאבה. מקם את המכשיר באינקובטור ב 37 ° C ו 5% CO2. השאר את כל הערוצים סגורים למשך שעתיים כדי לאפשר לתאים להתחבר.
- לאחר שעתיים, חברו את תעלות החיידקים והאפיתל למשאבה ופתחו את הזרימה והזרימה התלת-כיוונית של שני הקווים. שמור על החדר העצבי סגור במהלך 14 הימים הבאים של הפעלת המכשיר הראשוני, למעט במהלך שינוי בינוני.
- במהלך 14 יום ריצה, לשנות את המדיום של החדר העצבי כל 3-4 ימים. לרענון בינוני, יש להכין 3 מ"ל מדיום N2B27 טרי לכל מכשיר ולהעביר לבקבוק סרום סטרילי בנפח 20 מ"ל. סוגרים את בקבוק הסרום במדיום בעזרת מחיצה סטרילית ואטם אלומיניום.
- הכנס אוורור ומחט 80 מ"מ לתוך המחיצה של הבקבוק החדש. החליפו את בקבוק המדיה הישן בחדש באינקובטור על ידי ניתוק הלואר הגברי ממחט הבקבוק הישן למחט של הבקבוק החדש.
- חבר את הקלטת עם צינור המשאבה של החדר העצבי למשאבה ופתח את הסטופקוקים התלת-כיווניים. תן למדיה לזרום ב 0.5 סל"ד במשך 2 שעות לפני סגירת הסטופק המשולש של הצינור העצבי והתנתקות מהמשאבה, עד חילופי המדיום הבא.
5. תרבית חיידקים וחיסון
הערה: במחקר זה, ביום ה-12, תרבית נוזלית של זן Limosilactobacillus reuteri F275 הוחייתה מחדש ממלאי גליצרול. בהתאם לצרכים או לעיצובי המחקר, ניתן להשתמש בזני חיידקים אחרים.
- הכינו שלושה צינורות עם 5 מ"ל של ציר MRS - צינור בקרה סטרילי אחד ושניים לחיסון L. reuteri. בעזרת לולאת חיסון, מגרדים את החלק העליון של מלאי הגליצרול ומעבירים אותו לצינורית אחת. חזור על הפעולה עם צינורית חיסון שנייה. לדגור את הצינורות ב 37 ° C, 170 סל"ד לילה.
הערה: אין לתת למלאי הגליצרול להפשיר. - הכינו מדיום טרי למכשירים הראשוניים על ידי ערבוב Roswell Park Memorial Institute (RPMI) 1640 + 10% FBS עם 5% מרק MRS. הכינו 25 מ"ל לכל מכשיר והעבירו לבקבוקי סרום של 100 מ"ל בתנאים סטריליים. סוגרים את הבקבוקים עם מחיצה סטרילית וכיווץ אלומיניום. הניחו את הבקבוקים באינקובטור בטמפרטורה של 37°C, 5% CO2 למשך הלילה.
- לפני חיבור הבקבוקים לקו צינור החיידקים, הוסף מחט אוורור ומחט 80 מ"מ לכל בקבוק של מדיה RPMI 1640/MRS.
- הכינו צינורות חדשים, כל אחד עם 3 מ"ל של RPMI 1640 + 10% FBS + 5% מרק MRS. הכינו לפחות שני צינורות, בקרה אחת וצינור אחד לכל מכשיר. יש לחסן 15 μL של תרבית הלילה L. reuteri (צפיפות אופטית [OD] > 2) בשניים מהצינורות החדשים שהוכנו.
- לדגור את הצינורות במשך 1 שעה ב 37 ° C, 170 סל"ד, ולאחר מכן OD של 0.05-0.10 הוא הגיע, המקביל ~ 1 × 107 יחידות יצירת מושבה (CFU) / מ"ל. מעבירים 1.5 מ"ל למזרק 2 מ"ל (אחד לכל מכשיר). השתמש בשאר המתלים החיידקיים לציפוי CFU ולהכתמה חיה/מתה.
- עבור חיסון חיידקי של המכשיר, בצע את אותו הליך שהוזכר בשלב 4.1, אלא שכאן קווי הצינור העצבי והאפיתל סגורים.
- לאחר החיסון, סגור גם את קו צינור החיידקים, על ידי סגירת השסתומים וניתוק מהמשאבה למשך 30 דקות. חבר את קווי צינור האפיתל והבקטריאלי ופתח שוב. תן למכשירים לפעול עוד 24 שעות ב 37 ° C ו 0.5 סל"ד.
6. פתיחה ודיגום של HuMiX
הערה: הסעיף הבא מתאר את הדגימה של סוגי תאים שונים. לדוגמה, כדורי תאים עצביים משמשים למיצוי RNA ולתגובת שרשרת כמותית של פולימראז (qPCR), כדוריות חיידקיות למיצוי DNA וריצוף גנים 16S rRNA, וסופרנאטנטים לבדיקות אימונוסורבנטיות מקושרות אנזימים (ELISAs) ובדיקות אחרות (למשל, בדיקת לקטט).
- ביום ה-14, יום הפתיחה, סוגרים את כל הסטופק התלת-כיווני, מנתקים את הצינורות מהמשאבה ומוציאים את מכשיר האינקובטור לספסל המעבדה.
הערה: בעת העברת ההתקן, הקפד לשמור על ההתקן בפועל אופקי. - הסר את קווי הצינור המחוברים למכשיר לפני פתיחה איטית של המהדק והסר את מכסה המהדק. בזהירות, הסר את מכסה המחשב העליון, אסוף את המדיה בצינור מיקרוצנטריפוגה של 1.5 מ"ל והנח אותו על קרח.
- הסר בעדינות את אטם הכריך, תוך איסוף התקשורת מתא האפיתל; היזהר לא לגעת בשכבת התא. מניחים את אטם הכריך בצלחת פטרי מרובעת ומוסיפים תמיסת NaCl סטרילית 0.9% ב- H2O לתא החיידקים עד לכיסוי מלא של התא (כ -1 מ"ל).
- הסר באיטיות את אטם הקולגן תוך איסוף המדיה מהחדר העצבי והעברתו לצינור מיקרוצנטריפוגה. מניחים את כל צינורות המדיה על קרח. הכניסו את אטם הקולגן לתבנית מרובעת והוסיפו בעדינות כמה מיליליטרים של 1x PBS לשכבת Caco-2 עד ששכבת התא תכסה במלואה.
- הניחו את מכסה המחשב התחתון בצלחת פטרי מרובעת והוסיפו בעדינות כ-2 מ"ל של 1x PBS על גבי התאים העצביים, כך שהם לא יתייבשו במהלך תהליך הדגימה.
- צנטריפוגה את צינור המדיה החיידקי ב 5,000 × גרם במשך 5 דקות ב 4 ° C. צנטריפוגה את צינורות האפיתל והמדיה העצבית ב 300 × גרם במשך 5 דקות ב 4 °C. לאחר הצנטריפוגה, מעבירים את הסופרנאטנט של כל צינור לצינור מיקרוצנטריפוגה חדש ומניחים אותו מיד על קרח יבש.
- תאי אפיתל
- הסר בעדינות את PBS מהאטם ואסוף בצינור חרוטי של 15 מ"ל. מוסיפים 2 מ"ל טריפסין לתאים ודגרים על האטם במשך 5 דקות ב-37°C, 5% CO2. הוסף 2 מ"ל של RPMI 1640 לאטם לאחר הדגירה, להשעות מחדש את התאים, ולאסוף עוד 15 מ"ל צינור חרוט.
- צנטריפוגה שני צינורות במשך 5 דקות ב 300 × גרם. השליכו את הסופרנטנט. להשעות מחדש את הגלולה מן PBS לשטוף ב 300 μL של PBS ואת גלולת התא ב 1 מ"ל של PBS.
- העבר 50 μL מכל צינור לצינור מיקרוצנטריפוגה של 0.5 מ"ל עבור מונה התאים האוטומטי וספירת תאי בדיקת הרחקה כחולה טריפאן. העבר את גלולת התא המרחף (1 מ"ל) לצינור 1.5 מ"ל וצנטריפוגה ב 300 × גרם למשך 5 דקות.
- הסר את supernatant ו resuspend את גלולת התא ב 250 μL של חיץ ליזיס + 1% בטא-מרקפטואתנול ומניחים את הצינור על קרח יבש.
- תאי עצב
- קח את צלחת פטרי מרובעת, עם מכסה המחשב התחתון ושקוף עם תאים עצביים מהשלב הקודם (6.5) למיקרוסקופ ניגודיות פאזה הפוכה.
הערה: בעת הזזת מכסה המחשב עם PBS עליו, היה עדין מאוד, מכיוון שהרשת העצבית מתנתקת בקלות רבה. - בצע בדיקת איכות אחרונה לפני החיסון על ידי התבוננות במורפולוגיה ובצפיפות התא של תאי העצב באמצעות מיקרוסקופ שדה בהיר. ודא כי התאים נדדו מן הספרואידים וכי רשת עצבית נוצרה. הרשת העצבית צריכה להיות כ 90% confluent. לפרטים נוספים, עיין ב-Fattahi et al.6.
- על הספסל, להשעות מחדש את התאים PBS ולאסוף בצינור 1.5 מ"ל. צנטריפוגה את הצינור ב 300 × גרם במשך 3 דקות. יש להשליך את הסופרנטנט, להשהות מחדש את גלולת התא ב-250 מיקרוליטר של חיץ ליזיס + 1% בטא-מרקפטואתנול, ולהניח על קרח יבש.
הערה: צביעת Immunofluorescence (IF) יכולה להיעשות על התאים העצביים על מכסה המחשב. אם צביעת IF היא הבדיקה המועדפת כדי לא להרוס את הרשת העצבית, התאים צריכים להיות קבועים על מכסה המחשב עם 4% paraformaldehyde (PFA), אשר מונע שימוש חוזר של מכסה המחשב בניסויים עתידיים.
- קח את צלחת פטרי מרובעת, עם מכסה המחשב התחתון ושקוף עם תאים עצביים מהשלב הקודם (6.5) למיקרוסקופ ניגודיות פאזה הפוכה.
- תאי חיידקים
- להשהות מחדש את תאי החיידק המחוברים לממברנה בתמיסת NaCl 0.9%. אם התאים מחוברים היטב, השתמש בעדינות במגרד תאים כדי לנתק את תאי החיידקים מהממברנה.
הערה: שימוש במגרד יכול להזיק לתאים, להגדיל את ההסתברות לראות יותר תאים מתים. - לאסוף את השעיית התא בצינור חרוטי 15 מ"ל. הוסף את הגלולה שנותרה מהמדיה שנאספה בעבר לצינור החרוטי 15 מ"ל. צנטריפוגה ב 5,000 × גרם במשך 5 דקות ב 4 ° C. יש להשליך את הסופרנאטנט ולהשהות מחדש את גלולת התא ב-1 מ"ל של תמיסת NaCl של 0.9%.
- חלק נפח זה לשלושה חלקים: אחד להקפאת גלולה חיידקית למיצוי חומצות גרעין (650 μL), אחד לציפוי CFU (50 μL) על לוחות MRS, ואחד להכתמה חיה/מתה (300 μL). להכנת הגלולה למיצוי חומצת גרעין, מעבירים את תרחיף התא לצינור מיקרוצנטריפוגה, צנטריפוגה ב 5,000 × גרם למשך 5 דקות ב 4 מעלות צלזיוס ומשליכים את הסופרנטנט. מניחים את גלולת התא על קרח יבש.
- בסוף הדגימה, מעבירים את כל הצינורות על קרח יבש למקפיא של -80 מעלות צלזיוס לאחסון לניתוחים מאוחרים יותר במורד הזרם.
הערה: Supernatant יכול לשמש גם לניתוח ספקטרומטריית מסה כרומטוגרפית גז (GC-MS). יתר על כן, במהלך הפתיחה, ניתן לחלק את הממברנה המצופה בקולגן לחלקים שונים לאנליזות שונות - מחצית אחת תשמש לצביעת IF occludin, חלק אחר למיצוי RNA לניתוח ביטוי גנים נוסף, וחלק נוסף לספירת תאים.
- להשהות מחדש את תאי החיידק המחוברים לממברנה בתמיסת NaCl 0.9%. אם התאים מחוברים היטב, השתמש בעדינות במגרד תאים כדי לנתק את תאי החיידקים מהממברנה.
תוצאות
ב-neuroHuMiX תרבתנו יחד שלושה סוגי תאים שונים – תאים חיידקיים, אפיתליאליים ותאי עצב (איור 1). כדי לוודא שכל התאים בני קיימא, ביצענו בדיקות שונות על סוגי התאים השונים. לדוגמה, ביצענו ספירת CFU על תאי חיידקים, ספירת תאים ומבחני כדאיות תאים על תאי אפיתל, בעוד שתאי העצב הוערכו באמצעות אנליזות מיקרוסקופיות.
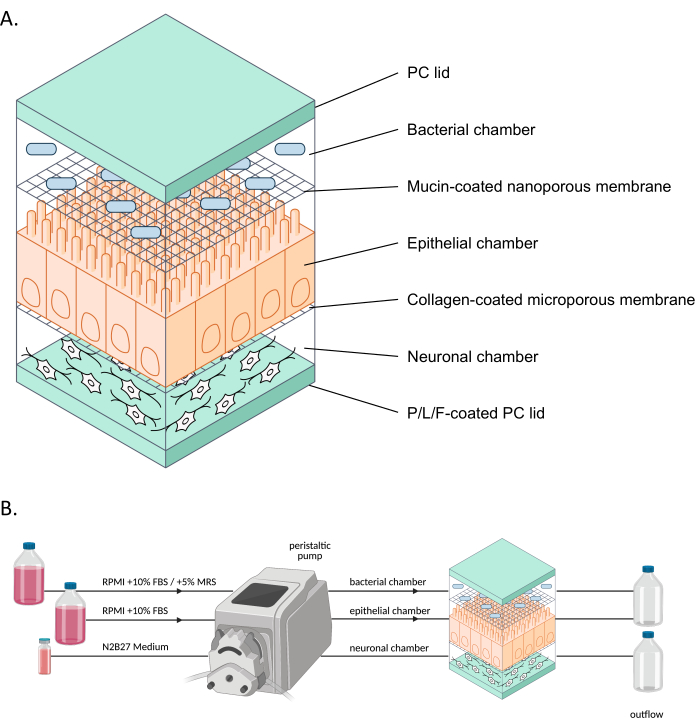
איור 1: ייצוג סכמטי של neuroHuMiX ומערך הניסוי שלו . (A) שלושת התאים מוחזקים בין שני מכסי מחשב כדי לשמור אותם סגורים. כל תא מלא בתווך מסוים עבור התאים הגדלים בתוכו. התאים השונים מופרדים על ידי קרומים חדירים למחצה המאפשרים תקשורת תאית באמצעות גורמים מסיסים העוברים את הממברנות. (B) ייצוג של מערך neuroHuMiX. כל תא מחובר לבקבוקי מדיה שונים. עבור תא החיידקים, במשך 12.5 הימים הראשונים, התא מחובר ל- RPMI + 10% FBS, לפני שהוא משתנה במשך 36 השעות האחרונות ל- RPMI + 10% FBS + 5% MRS. קיצורים: PC = פוליקרבונט; P / L / F = פולי L-ornithine/laminin/fibronectin; RPMI = מדיום תרבית תאים של מכון הזיכרון רוזוול פארק; MRS = מדיום תרבות דה מאן, רוגוסה ושפרה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
כדי לקבוע אם התאים מחוברים כראוי, עם פתיחת המכשירים הערכנו את היווצרות שכבת התא על הממברנה המצופה בקולגן (איור 6A). כדי לוודא שהתאים במכשיר היו בני קיימא, בוצעה ספירת מונה תאים אוטומטית (איור 6B) וספירת תאי הרחקה בצבע כחול טריפאן (איור 6C). הבדיקות בוצעו על תאי Caco-2 משלושה מערכי HuMiX שונים: (i) Caco-2 בתרבית עם ENs, (ii) Caco-2 בתרבית עם L. reuteri, ו-(iii) המכשיר הכולל תרבית משותפת של כל שלושת סוגי התאים. בדיקות סטטיסטיות באמצעות ANOVA חד-כיווני לא הניבו הבדלים משמעותיים בין סוגי התאים, דבר המצביע על כך שתאי Caco-2 נותרו בני קיימא בכל הגדרות המכשיר הראשוניות והתנאים שנבדקו במחקר זה. זה מדגיש את העובדה שלצפיפות החיידקים שהושגה במהלך התרבית המשותפת של L. reuteri ושני סוגי התאים האנושיים אין השפעות ציטוטוקסיות על התאים האנושיים.
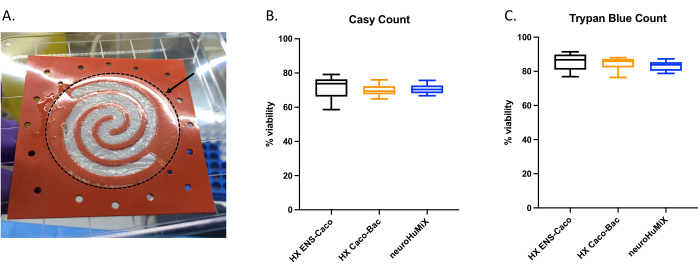
איור 6: הערכה של תאי Caco-2 על הממברנה המצופה קולגן. (A) שכבה של תאי Caco-2 על הממברנה המצופה בקולגן לאחר הפתיחה. החץ מציין את הממברנה המצופה קולגן, המוקפת בעיגול מקווקו. תאי Caco-2 גדלו על צורת הספירלה על הממברנה. כדאיות תאים של תאי Caco-2 לאחר 14 יום ב- HuMiX. ספירת התאים הושגה באמצעות (B) מונה התאים האוטומטי ו-(C) ספירת התאים של בדיקת ההדרה הכחולה של טריפאן. ספירת תאי Caco-2 נקבעה מתצורות תרבית שונות במכשיר הראשוני: תרבית משותפת עם נוירונים אנטריים (ENs) (שחור), תרבית משותפת עם L. reuteri (כתום), ובמכשיר (ENs ו-L. reuteri) (כחול). בוצעה ANOVA חד-כיוונית, שהראתה שאין הבדל משמעותי בין מערכי התרבות השונים (ANOVA חד-כיוונית, p = 0.1234 [ns]; קווי שגיאה מציינים שגיאת תקן). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
כדי שנוכל לגדל L. reuteri עם תאי יונקים, תחילה ביצענו אופטימיזציה והתאמה של מצע התרבית לשימוש במכשיר. מצאנו כי תערובת של 5% של MRS בסל"ד 1640 (בתוספת 10% FBS) התאימה באופן אופטימלי לגדילה של L. reuteri, בעוד שלא הייתה ציטוטוקסית עבור תאי היונקים ששימשו בבדיקות אלה. לאחר מכן, בוצעה ספירת CFU כדי להעריך את הצמיחה של L. reuteri כאשר תרבית במכשיר במשך 24 שעות. ספירת CFU הוערכה עבור שתי הגדרות מכשיר ראשוניות שונות (איור 7) - L. reuteri בתרבית משותפת עם Caco-2 ו- L. reuteri במכשיר. בשני המערכים ספירות ה-CFU היו שונות באופן משמעותי מהחיסון HuMiX ומהתאים שנקטפו (ANOVA חד-כיווני, p = 0.0002), מה שמצביע על גדילה של תאי החיידק בתוך המכשיר הראשוני.
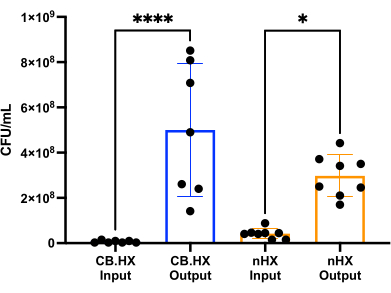
איור 7: Limosilactobacillus reuteri CFU ספירה של החיסון (מדולל 1:100,000) ולאחר 24 שעות ב- HuMiX. שני מערכים שונים: תאי Caco-2 בתרבית משותפת עם L. reuteri והמכשיר. ANOVA חד-כיווני מראה הבדל משמעותי (p = 0.0002 [***]) בין החיסון לבין התאים שנקטפו, כלומר החיידקים גדלים בתוך HuMiX. קווי שגיאה מציינים את השגיאה הסטנדרטית. קיצורים: CB. HX = Caco-2 חיידקים HuMiX; nHX = neuroHuMiX. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
כדי להעריך אם תרבית ה-ENs בתוך המכשיר תשנה את הפנוטיפ של התאים, נצפתה המורפולוגיה הגסה של ה-ENs באמצעות מיקרוסקופ ניגודיות פאזה הפוך. במהלך שלב זה הוערכו הן המפגש והן המורפולוגיה של EN. הקמת רשת עצבית קונפלואנטית הצביעה על כך שהתאים התחברו היטב למכסה המחשב של המכשיר המצופה. חשוב לציין, זה מדגיש את הרעיון שהם גדלו בתרבות משותפת עם Caco-2 ו L. reuteri. הקצה בין הרשת העצבית הנפגשת לבין הספירלה המסומנת באטם היה ברור בבירור (איור 8).
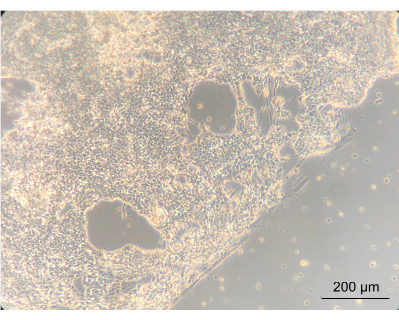
איור 8: תאי עצב אנטריים לאחר 14 יום של תרבית במכשיר. בצד שמאל של התמונה, תאי העצב גדלו לשכבה מתמזגת על הספירלה. הקצה, בין השכבה העצבית לבין החלל ללא תאים, הוא קצה הספירלה; מוגדל פי 10, סרגל קנה מידה = 200 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 2: מכסים המשמשים במכשיר. התמונות מציגות מכסי מחשב עליונים (משמאל) ותחתונים (מימין). גודל כל צד של מכסה המחשב הוא 6.4 ס"מ. קיצור: PC = פוליקרבונט. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 3: אטם תא אפיתל במכסה המחשב התחתון. תצוגה עליונה של אטם תא האפיתל הממוקם על מכסה המחשב התחתון (משמאל), ותצוגה תחתונה (מימין) המציגה את היישור של אטם תא האפיתל עם הכניסות והשקעים של מכסה המחשב התחתון. כל צד של האטמים, כמו גם מכסה המחשב, מודד 6.4 ס"מ. קיצור: PC = פוליקרבונט. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 4: הרכבת המכשיר. (A) חלקים שונים להרכבת HuMiX: (1) מכסה מחשב תחתון; (2) אטם עם קרום מיקרו-נקבובי מצופה קולגן, המונח על גבי (1); (3) אטם סנדוויץ' שביניהם קרום ננו-נקבובי מצופה מוצין ומונח על גבי (2); (4) מכסה מחשב עליון מונח מעל (3). מידותיו של כל צד של האטמים ומכסי המחשב הוא 6.4 ס"מ. (B) כל החלקים מ-(A) מונחים יחד. (ג,ד) תצוגה מורכבת של התקן-עליון (משמאל) וצד (ימין). B ממוקם במערכת ההידוק כדי לסגור את המערכת. (C) כל צד של המהדק העליון הוא בגודל 8 ס"מ. קיצור: PC = פוליקרבונט. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
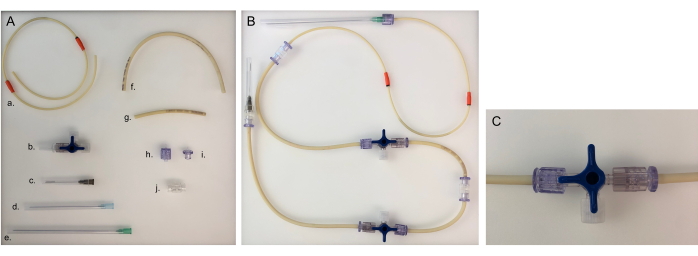
איור 5: חלקים הדרושים לקו צינורות וקו צינורות מורכב לתא אחד. (א) חלקים שונים לבניית קו צינורות: א. קו צינורות משאבה; ב. סטופק תלת-כיווני; ג. מחט 40 מ"מ; ד. מחט 80 מ"מ; ה. מחט 120 מ"מ; ו. קו צינורות ארוך (20 ס"מ); ז. קו צינורות קצר (8 ס"מ); ח. זכר לואר; i. נקבה Luer; י. מתאם. (B) קו צינורות מורכב לתא החיידק או האפיתל. עבור החדר העצבי, מחט 120 מ"מ יהיה צורך לשנות למחט 80 מ"מ. (C) שסתום סטופקוק תלת-כיווני הסתובב כדי להפנות את זרימת המדיום מהמכשיר ל'מחבר הפתוח' ולסגור את התא. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
| יום | 0 | 2 | 4 | 6 | 8 | 10 |
| הרכב מדיה | 100% E6 | 100% E6 | 75% E6 | 50% E6 | 25% E6 | 100% N2 |
| + LDN | + LDN | 25% N2 | 50% N2 | 75% N2 | + LDN | |
| + SB | + SB | + LDN | + LDN | + LDN | + SB | |
| + צ'יר | + SB | + SB | + SB | + צ'יר | ||
| + צ'יר | + צ'יר | + צ'יר | + RA | |||
| + RA | + RA | |||||
| מולקולה | [ריכוז] | |||||
| LDN | 100 נאנומטר | |||||
| אס.בי.איי | 10 מיקרומטר | |||||
| אנונימי | 3 מיקרומטר | |||||
| חומצה רטינואית (RA) | 1 מיקרומטר |
טבלה 1: הרכב מדיה.
| מדיה | רכיבים (ריכוזים המפורטים בטבלת החומרים) | נפח (מ"ל) |
| חומרי הדפסה N2 (50 מ"ל) | DMEM-F12 | 48 |
| תוספת N2 | 0.5 | |
| ל-גלוטמין | 0.5 | |
| פניצילין/סטרפטומיצין | 0.5 | |
| NEAA | 0.5 | |
| N2B27/ENS מדיה (50 מ"ל) | נוירובזל | 48 |
| תוספת N2 | 0.5 | |
| ל-גלוטמין | 0.5 | |
| פניצילין/סטרפטומיצין | 0.5 | |
| B27-A | 0.5 |
טבלה 2: מתכוני מדיה.
| טמפרטורת עיקור (°C) | 116 |
| זמן עיקור (מינימום) | 20 |
| זמן ייבוש (מינימום) | 10 |
| פולסים | 3 |
| טמפרטורת קצה (°C) | 99 |
טבלה 3: ריצת HuMiX autoclave.
| סיבובים לדקה (סל"ד) | קצב זרימה ממוצע (μL/min) |
| 0.5 | 13 |
| 2 | 79 |
| 5 | 180 |
טבלה 4: קצבי הזרימה של המשאבה הפריסטלטית.
Discussion
כיום נקבע כי מיקרוביום המעי האנושי משפיע על בריאותו ומחלתו של הפונדקאי. למרות הידע המצביע על חשיבות המיקרוביום שלנו, במיוחד בהפרעות נוירולוגיות כמו אלצהיימר או פרקינסון 3,13, עדיין לא ידוע כיצד מיקרוביום המעי מתקשר עם מערכת העצבים האנטרית, ולאחר מכן עם המוח.
מודל מייצג לחקר יחסי הגומלין בין מיקרוביום המעי למערכת העצבים לא היה זמין עד כה. מחקרים הנוגעים לציר מעי-מוח בוצעו באופן מסורתי באמצעות מודלים של מורין13. עכברים ובני אדם חולקים 85% מהרצפים הגנומיים שלהם14, אך ישנם הבדלים משמעותיים שיש לקחת בחשבון כאשר משווים עכברים לבני אדם. לגבי המעיים, חשוב לציין כי בהשוואה לבני אדם, עכברים הם אוכלי עשב בלבד. כתוצאה מכך, מערכת העיכול שלהם שונה באורכה ובמאפייניה, כגון 'ריקון קיבה'14. מוחות מורינים מראים גם הבדלים חשובים, לפיהם המבנה הכולל בין עכברים לבני אדם שונה15. חשוב לציין שלבני אדם יש זמני מחזור תאים ארוכים יותר של אבות עצביים15. כתוצאה מכך, חשוב לפתח מודלים מייצגים הכוללים תאים שמקורם בבני אדם, כולל תאי מעיים ותאי עצב5. בהקשר זה, פיתוח מודלים מחקריים יותר הניתנים לשחזור באמצעות מבחנה מפחית את הצורך בשימוש במודלים של בעלי חיים ומשפר את יכולת השחזור.
neuroHuMiX הוא גרסה מתקדמת של דגםHuMiX הקודם 9. HuMiX הוא מודל מעי על שבב המאפשר תרביות משותפות פרוקסימליות ומייצגות של תאי אפיתל וחיידקים. תקשורת תא-תא אפשרית באמצעות תרבית משותפת פרוקסימלית ודיפוזיה של גורמים מופרשים ומטבוליטים באמצעות ממברנות חדירות למחצה. עם זאת, כדי להרחיב את התועלת של המכשיר הראשוני כדי ללמוד את סביבת המעיים האנושית, הכנסת סוג תא נוסף נדרש. כדי להתמודד עם זה, neuroHuMiX, שפותח עם הכנסת ENs שמקורם ב- iPSC, מאפשר תרבית משותפת פרוקסימלית של חיידקים, תאי אפיתל מעיים ו- ENs. המודל המתקבל במבחנה מאפשר לנו לענות על שאלות הנוגעות למיקרוביום המעי האנושי ביחס למערכת העצבים האנושית. לגידול משותף של סוגי תאים שונים, במיוחד תרביות משותפות של תאים וחיידקים של יונקים, יש כמה אתגרים, כולל אובדן כדאיות, היצמדות לקויה ואובדן כללי במפגש16. כאן, הוכחנו שבתוך המכשיר הזה, אנו מסוגלים לגדל במשותף שלושה סוגי תאים שונים בתוך אותה מערכת תוך שמירה על כדאיות התא גבוהה.
שלב קריטי בפרוטוקול הוא להבטיח מפגש של תאי העצב - 80%-90% מפגש תאים וכדאיות - לפני החיסון למכשיר. מכיוון שלא ניתן להעריך את גדילת התאים במהלך הריצה, יש חשיבות עליונה לוודא שהתאים מתלכדים וגדלים היטב לפני הכנסתם למודל. בעוד שזה עשוי להיות גורם מגביל, הכדאיות הכוללת והמפגש שנצפו בתוך המכשיר הם בדרך כלל גבוהים.
המכשיר מחובר באמצעות צינורות למשאבה פריסטלטית. לכל תא יש את קו הצינור הספציפי שלו. הצינור כולל צינור משאבה המאפשר שימוש במשאבה פריסטלטית לזילוח התווך, וכן צינורות המחברים את צינורות המשאבה למכשיר וצינור המחבר את המכשיר לבקבוקי היציאה/פסולת. יציאות דגימה כלולות לפני ואחרי המכשיר, כדי לאפשר חיסון ודיגום של אמצעי היציאה. כל תא יכול להיות מחובר למדיום אחר, המאפשר את תנאי התרבית הטובים ביותר עבור כל סוג תא בודד. ניתן לפתוח או לסגור כל תא בהתאם לצרכים הספציפיים לאספקה בינונית. במכשיר, החדר העצבי נשאר סגור במשך רוב הניסוי, בעוד שתאי החיידקים והאפיתל פתוחים כל הזמן, כלומר הם מקבלים תווך טרי לאורך כל ריצת הניסוי. כדי לוודא שהמדיום זורם ללא הפרעה, חשוב שלא יישאר אוויר בצינורות, במחברים או במכשיר. לכן, חשוב תחילה לתת למכשירים לרוץ במשך מספר דקות בשלב הפריימינג. פעולה זו פותרת לעתים קרובות את הבעיה. אם לא, ניתן לסגור את אחד הקווים האחרים שנושרים לפרק זמן קצר על ידי סגירת הסטופקוק המשולש של היציאה. פעולה זו מנתבת מחדש את התווך לקו עם בועת האוויר, ובכך פותרת את הבעיה על ידי דחיפת הבועה החוצה דרך הצינור.
עבור כל ניסוי בתרבית תאים, התווך הוא מרכיב מרכזי, כאשר לכל סוג תא יש את התווך המתאים לו. במערך של תרבית משותפת, המדיום צריך להיות תואם לא רק לסוג התא הגדל בו, אלא גם לסוגי התאים האחרים בתוך התרבית המשותפת. זה לא שונה עבור המכשיר, מה שמציב אתגר נוסף מכיוון שיש לנו שלושה תאים שונים עם שלושה סוגי תאים שונים בתוך תאי חיידקים, אפיתל ותאי עצב. עם זאת, הראינו כי על ידי שינוי המדיה החיידקית - עם תוספת של 5% MRS ל- RPMI 1640 עם 10% FBS - כל סוגי התאים, במיוחד תאי חיידקים ואפיתל, יכולים להיות מתורבתים בהצלחה בתוך המערכת. עם זאת, במכשיר, סוגי תאים שונים מתורבתים בסמיכות, ולכן אינם נמצאים במגע ישיר זה עם זה. למרות שזה לא מייצג באופן מלא את המגע הישיר בין תאים במעיים האנושיים, ולכן מגבלה, מצב התרבית המשותפת הפרוקסימלי והמייצג הוא חוזק לניתוחים במורד הזרם. גורמים מסיסים מתחלפים בין התאים וסוגי התאים השונים; לפיכך, התאים עדיין מתקשרים זה עם זה. בנוסף, העובדה שניתן לקצור ולנתח את סוגי התאים בנפרד מאפשרת לנו לחקור את ההשפעה של מיקרוביום בריא ו/או חולה על סוגי תאים שונים (כולל תאים עצביים) ובכך לקבוע/לאחזר קריאות ספציפיות לסוג התא. מגבלה נוספת היא שלא ניתן לעקוב אחר המורפולוגיה של התאים במהלך ריצת הניסוי, מכיוון שניתן רק לפתוח את המכשיר ולבדוק את התאים בסוף כל ניסוי.
למיטב ידיעתנו, neuroHuMiX הוא מודל המעיים על שבב הראשון הכולל ENs. זהו צעד לקראת הבהרת התקשורת בין מיקרוביוטת המעיים לבין מערכת העצבים האנטרית. זהו מודל המאפשר לחקור את יחסי הגומלין בין זן חיידקי, שכבת אפיתל ו-ENs. העיצוב שלה מאפשר לנו ללמוד את חילופי הגורמים מסיסים המופרשים על ידי סוגי תאים שונים ואת השפעתם אחד על השני. בעתיד, יהיה חשוב לא רק שיהיו תאי אפיתל שמקורם ב-iPSC, אלא גם תאי אפיתל שמקורם ב-iPSC בתוך המכשיר, כדי להפוך את המכשיר למודל מותאם אישית. חשוב לציין, מודל מותאם אישית זה יכול לשמש לבדיקת קדם, פרו וסינביוטיקה 10,11 ואולי לפתח בדיקות סקר מותאמות אישית וגישות טיפוליות17. נוירו-HuMiX מותאם אישית יוכל בסופו של דבר לשפוך אור על "החומר האפל" של מיקרוביום המעי האנושי ועל יחסי הגומלין שלו עם מערכת העצבים לאורך ציר המיקרוביום-מערכת העצבים של המעי, ולסלול את הדרך להערכה טיפולית ולהתערבויות.
אנו יכולים להסיק כי היכולת לקבל מעי על שבב כולל המערכת העצבית האנטרית היא חיונית להתקדמות במחקר ובהבנה של אינטראקציות לאורך ציר המיקרוביום-מערכת העצבים של המעי. NeuroHuMiX מאפשר לנו לחקור את ההשפעות של מיני חיידקים על תאים מארחים ומספק לנו בסיס טוב לשפר את המודל עוד יותר בדרך ייצוגית עוד יותר מבחינה פיזיולוגית.
Disclosures
P.W. מצהיר שהוא רשום כממציא פטנטים PCT/EP2013/056607, PCT/EP2016/062024, PCT/US2017/061602 ו-PCT/EP2019/081424. P.W., C.S. ו-L.G. מצהירות שהן רשומות כממציאות LU503075 פטנט.
Acknowledgements
המחברים רוצים להודות לד"ר ג'ארד סטרנקרט על שסיפק לנו את התאים מקו K7. ברצוננו גם להודות למשתפי הפעולה הוותיקים ד"ר פרדריק זנהאוזןרן ומתיו ו' בארט מאוניברסיטת אריזונה על עזרתם בהיבטים ההנדסיים. ברצוננו גם להודות לד"ר ולנטינה גלאטה על עזרתה בעיצוב הייצוג הסכמטי של neuroHuMiX. פרויקט זה קיבל מימון ממועצת המחקר האירופית (ERC) במסגרת תוכנית המחקר והחדשנות Horizon 2020 של האיחוד האירופי (הסכם מענק 863664). איור 1 נוצר חלקית באמצעות Biorender.com.
Materials
| Name | Company | Catalog Number | Comments |
| 2-Mercaptoethanol | Sigma Aldrich | 10712 | |
| Aeration cannula (length: 1.10 diameter: 30 mm) | VWR (B.Braun) | BRAU4190050 | |
| Agar-agar | Merck Millipore | 1.01614.1000 | |
| Aluminium Crimp | Glasgerätebau Ochs | 102050 | |
| Ascorbic acid | Sigma Aldrich | A4544 | |
| B-27 Supplement Minus Vitamin A (50x) | Gibco | 12587-010 | |
| Bacterial Cell Membrane, pore size: 1 µm | VWR (Whatman) | 515-2084 | |
| Caco-2 cells | DSMZ | ACC169 | |
| Cell Counter & Analyzer CASY | OMNI Life Sceince | ||
| CHIR | Axon Mechem BV | CT99021 | |
| Collagen I, Rat Tail | Invitrogen | A1048301 | |
| Costar 6-well Clear Flat Bottom Ultra-Low Attachment Plates | Corning | 3471 | |
| Difco Lactobacilli MRS Broth | BD Biosciences | 288130 | |
| Discofix 3-way stopcock | B. Braun | BRAU40951111 | |
| DMEM/F12, no glutamine | Thermofisher Scientific | 21331020 | |
| Dulbecco's Phosphate-Buffered Saline, D-PBS | Sigma Aldrich | 14190-169 | |
| Essential 6 Medium | Thermofisher Scientific | A1516401 | |
| Essential 8 Medium | Thermofisher Scientific | A1517001 | |
| Female Luer Lock to Barb Connector | Qosina | 11733 | |
| FGF2 | R&D Systems | 233-FB | |
| Fibronectin | Sigma Aldrich | F1141 | |
| Foetal Bovine Serum, FBS | Thermofisher Scientific | 10500-064 | |
| GDNF | PeproTech | 450-10 | |
| Human Cell Membrane, pore size: 50 nm | Sigma Aldrich (GE Healthcare) | WHA111703 | |
| HuMiX Gasket Collagen | Auer Precision | 216891-003 | |
| HuMiX Gasket Sandwich Bottom | Auer Precision | 216891-002 | |
| HuMiX Gasket Sandwich Top | Auer Precision | 216891-001 | |
| iPSC | Max Planck Institute for Molecular Biomedicine | K7 line | |
| L-Glutamine (200 mM) | Gibco | 25030081 | |
| Laminin from Engelbreth-Holmswarm | Sigma Aldrich | L2020 | |
| LDN193189 | Sigma Aldrich | SML0559 | |
| Limosilactobacillus reuteri | ATCC | 23272 | |
| Live/Dead BacLight Bacterial Viability kit | Thermofisher Scientific | L7012 | |
| Male Luer with Spin Lock to Barb | Qosina | 11735 | |
| Marprene tubing (0.8 mm x 1.6 mm) | Watson-Marlow | 902.0008.J16 | |
| Matrigel hESC-qualified matrix | Corning | 354277 | |
| Mucin, from porcine stomach | Sigma Aldrich | T3924 | |
| N2 Supplement (100x) | Gibco | 17502048 | |
| NEAA | Thermofisher Scientific | 11140050 | |
| Needle (length: 120 mm; diameter: 0.80 mm) | B.Braun (color code: green) | 466 5643 | |
| Needle (length: 40 mm; diameter: 0.70 mm) | Henke Sass Wolf (color code: black) | 4710007040 | |
| Needle (length: 80 mm; diameter: 0.60 mm) | B.Braun (color code: blue) | 466 5635 | |
| Neurobasal Medium | Gibco | 21103049 | |
| PE/Cy7 anti-human CD49d antibody | Biolegend | 304314 | |
| Penicillin-Streptomycin | Sigma Aldrich | P0781 | |
| Peristaltic pump | Watson-Marlow | 205CA | |
| Poly-L-ornithine Hydrobromide | Sigma Aldrich | P3655 | |
| Polycarbonate lids (HuMiX) | University of Arizona | HuMiX 1.0 / 2.0 | |
| Retinoic Acid | Sigma Aldrich | R2625 | |
| RLT Buffer (RNeasy Minikit) | Qiagen | 74104 | |
| RPMI 1640 Medium | Thermofisher Scientific | 72400-021 | |
| SB431542, ALK inhibitor | Abcam | ab120163 | |
| Serum bottles | Glasgerätebau Ochs | 102091 | |
| Syringe | BD Biosciences | 309110 | |
| Trypsin-EDTA solution | Sigma Aldrich | T3924 | |
| Y-27632 Dihydrochloride | R&D Systems | 1254 |
References
- Heintz-Buschart, A., Wilmes, P. Human gut microbiome: function matters. Trends in Microbiology. 26 (7), 563-574 (2018).
- Toor, D., et al. Dysbiosis disrupts gut immune homeostasis and promotes gastric diseases. International Journal of Molecular Sciences. 20 (10), 2432 (2019).
- Braak, H., de Vos, R. A. I., Bohl, J., Del Tredici, K. Gastric α-synuclein immunoreactive inclusions in Meissner's and Auerbach's plexuses in cases staged for Parkinson's disease-related brain pathology. Neuroscience Letters. 396 (1), 67-72 (2006).
- Schmit, K. J., et al. Dietary fibre deprivation and bacterial curli exposure shift gut microbiome and exacerbate Parkinson's disease-like pathologies in an alpha-synuclein-overexpressing mouse. bioRxiv. , (2022).
- Fritz, J. V., Desai, M. S., Shah, P., Schneider, J. G., Wilmes, P. From meta-omics to causality: experimental models for human microbiome research. Microbiome. 1 (1), 14 (2013).
- Fattahi, F., et al. Deriving human ENS lineages for cell therapy and drug discovery in Hirschsprung disease. Nature. 531 (7592), 105-109 (2016).
- Wu, Q., et al. Organ-on-a-chip: Recent breakthroughs and future prospects. BioMedical Engineering Online. 19 (1), 9 (2020).
- May, S., Evans, S., Parry, L. Organoids, organs-on-chips and other systems, and microbiota. Emerging Topics in Life Sciences. 1 (4), 385-400 (2017).
- Shah, P., et al. A microfluidics-based in vitro model of the gastrointestinal human-microbe interface. Nature Communications. 7, 11535 (2016).
- Greenhalgh, K., et al. Integrated in vitro and in silico modeling delineates the molecular effects of a synbiotic regimen on colorectal-cancer-derived cells. Cell Reports. 27 (5), 1621-1632 (2019).
- Mao, J. H., et al. Genetic and metabolic links between the murine microbiome and memory. Microbiome. 8 (1), 53 (2020).
- Moysidou, C. M., Owens, R. M. Advances in modelling the human microbiome-gut-brain axis in vitro. Biochemical Society Transactions. 49 (1), 187-201 (2021).
- Kim, S., et al. Transneuronal propagation of pathologic α-synuclein from the gut to the brain models Parkinson's disease. Neuron. 103 (4), 627-641 (2019).
- Hugenholtz, F., de Vos, W. M. Mouse models for human intestinal microbiota research: a critical evaluation. Cellular and Molecular Life Sciences. 75 (1), 149-160 (2018).
- Marshall, J. J., Mason, J. O. Mouse vs man: Organoid models of brain development & disease. Brain Research. 1724, 146427 (2019).
- Goers, L., Freemont, P., Polizzi, K. M. Co-culture systems and technologies: taking synthetic biology to the next level. Journal of the Royal Society Interface. 11 (96), 20140065 (2014).
- Sedrani, C., Wilmes, P. Toward hypothesis-driven, personalized microbiome screening. Cell Reports Methods. 2 (1), 100139 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved