A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הערכת יעילותן של חומצות פרוקסי אורגניות למיגור ביופילמים חלביים בגישה המשלבת שיטות סטטיות ודינמיות
In This Article
Summary
פרוטוקול זה מתאר גישה המשלבת שיטות סטטיות ודינמיות להערכת יעילותן של חומצות פרוקסי אורגניות למיגור ביופילמים בתעשיית החלב. גישה זו עשויה לשמש גם לבדיקת יעילותן של פורמולציות ביולוגיות או כימיות חדשות לשליטה בביופילמים.
Abstract
נוכחותם של ביופילמים בתעשיית החלב מעוררת דאגה רבה, שכן הם עלולים להוביל לייצור מוצרי חלב לא בטוחים ומשתנים בשל עמידותם הגבוהה לרוב נהלי הניקיון במקום (CIP) המשמשים לעתים קרובות במפעלי עיבוד. לכן, הכרחי לפתח אסטרטגיות חדשות לבקרת ביופילם עבור תעשיית החלב. פרוטוקול זה נועד להעריך את יעילותן של חומצות פרוקסי אורגניות (חומצות פראצטיות, פרפרופיוניות ופרלקטיות וחומר חיטוי מסחרי על בסיס חומצה פראצטית) להשמדת ביופילמים חלביים באמצעות שילוב של שיטות סטטיות ודינמיות. כל חומרי החיטוי נבדקו על החיידקים החזקים ביותר מייצרי ביופילם בביופילם יחיד או מעורב באמצעות בדיקת ריכוז מיגור הביופילם המינימלי (MBEC), שיטת סינון סטטית בעלת תפוקה גבוהה. זמן מגע של 5 דקות עם חומרי החיטוי בריכוזים המומלצים הצליח לחסל הן את הביופילמים הבודדים והן את הביופילמים המעורבים. מחקרים נמשכים כעת כדי לאשר תצפיות אלה באמצעות כור ביופילם של המרכז לבקרת מחלות (CDC), שיטה דינמית לחיקוי תנאים באתרם . סוג זה של ביוריאקטור מאפשר שימוש במשטח נירוסטה, המהווה את רוב הציוד והמשטחים התעשייתיים. נראה כי התוצאות הראשוניות מהכור מאשרות את יעילותן של חומצות פרוקסי אורגניות כנגד ביופילמים. הגישה המשולבת המתוארת במחקר זה עשויה לשמש לפיתוח ובדיקה של פורמולציות ביולוגיות או כימיות חדשות לשליטה בביופילמים ולחיסול מיקרואורגניזמים.
Introduction
תעשיית החלב היא מגזר תעשייתי מרכזי ברחבי העולם, כולל בקנדה, שם יש יותר מ -10,500 רפתות המייצרות כמעט 90 מיליון hL חלב מדי שנה1. למרות דרישות ההיגיינה המחמירות המוטלות בתעשיית החלב, כולל במפעלי עיבוד, החלב מהווה מדיום תרבית נהדר למיקרואורגניזמים, ולכן מוצרי חלב עשויים להכיל מיקרואורגניזמים, כולל קלקול או מיקרואורגניזמים פתוגניים. פתוגנים אלה יכולים לגרום למחלות שונות; לדוגמה, Salmonella sp. ו Listeria monocytogenes יכול לגרום גסטרואנטריטיס ודלקת קרום המוח, בהתאמה2. מיקרואורגניזמים מקולקלים יכולים להשפיע על האיכות והתכונות האורגנולפטיות, של מוצרי חלב על ידי ייצור גזים, אנזימים חוץ-תאיים או חומצות3. המראה והצבע של החלב עשויים גם להשתנות, למשל על ידי Pseudomonas spp.4.
חלק מהמיקרואורגניזמים האלה יכולים ליצור ביופילמים על משטחים שונים, כולל נירוסטה. ביופילמים כאלה מאפשרים התמדה וכפל של מיקרואורגניזמים על פני השטח של הציוד, ובכך זיהום של מוצרי חלב5. ביופילמים בעייתיים גם בשל יכולתם לעכב מעבר חום ולהאיץ את הקורוזיה של הציוד, מה שמוביל להחלפה מוקדמת של הציוד ובכך להפסדים כלכליים6.
נהלי ניקוי במקום (CIP) מאפשרים לתעשיית המזון לשלוט בצמיחת מיקרואורגניזמים. הליכים אלה כוללים שימוש רציף של נתרן הידרוקסידי, חומצה חנקתית, ולפעמים חומרי חיטוי המכילים חומצה היפוכלורית וחומצה פראצטית 7,8. למרות חומצה hypochlorous יעיל מאוד נגד מיקרואורגניזמים, זה גם מגיב עם חומר אורגני טבעי, גרימת היווצרות של תוצרי לוואי רעילים9. חומצה פראצטית אינה מייצרת תוצרי לוואי מזיקים10; עם זאת, יעילותו נגד ביופילמים בתעשיית המזון משתנה מאוד10,11. לאחרונה, חומצות פרוקסי אחרות, כולל חומצות פרפרופיוניות ופרלקטיות, נחקרו בזכות הפעילות האנטי-מיקרוביאלית שלהן, ונראה שהן חלופה טובה לשליטה בגדילה מיקרוביאלית בביופילמים12,13.
לכן, מחקר זה נועד להעריך את יעילותן של חומצות פרוקסי אורגניות (חומצות פראצטיות, פרפרופיוניות ופרלקטיות וחומר חיטוי מבוסס חומצה פראצטית) לחיסול ביופילמים של מוצרי חלב באמצעות גישה המשלבת את בדיקת ריכוז מיגור הביופילם המינימלי (MBEC), שיטת סינון סטטית בתפוקה גבוהה, וכור ביופילם של המרכז לבקרת מחלות (CDC), שיטה דינמית המחקה באתרה תנאים. בדיקת MBEC מכונה להלן "לוחות מיקרוטיטר ביופילם" בפרוטוקול. הפרוטוקול המוצג כאן והתוצאות המייצגות מדגימים את יעילותן של חומצות פרוקסי אורגניות ואת יישומן הפוטנציאלי לשליטה בביופילמים מיקרוביאליים בתעשיית החלב.
Protocol
העבודה הכלולה במאמר זה דורשת מעבדה ברמת בטיחות ביולוגית 2 ואושרה בעבר (פרויקט מספר 119689) על ידי ועדת הבטיחות הביולוגית המוסדית של אוניברסיטת לאוואל.
הערה: תרשים הזרימה באיור 1 מייצג סיכום של מתודולוגיה המשלבת גישות סטטיות ודינמיות ששימשה להערכת היעילות של חומצות פרוקסי אורגניות להשמדת ביופילמים.
1. הכנת חומרים
- מבודדים מיקרוביאליים
- הפעל את ארון הבטיחות הביולוגי (BSC) 15 דקות לפני השימוש ונקה אותו עם תמיסת אלכוהול של 70% (v/v).
- ברגע שה-BSC סטרילי, הניחו בקבוקון של המבודד המיקרוביאלי לבדיקה (Pseudomonas azotoformans או Brevundimonas vesicularis במחקר זה), לולאה מחסנת, צינור של 15 מ"ל מלא ב-10 מ"ל של מרק סויה טריפטי סטרילי (TSB) ומערבל מערבולת. לפני המיקום BSC, לחטא את כל החומרים עם אלכוהול.
- מערבול בקבוקון של בידוד מיקרוביאלי כדי הומוגניזציה של התרבית.
- להעביר 20 μL של בידוד מיקרוביאלי לתוך 10 מ"ל של TSB סטרילי הכלול צינור 15 מ"ל לדגור אותו ב 30 ° C במשך 16-24 שעות עם תסיסה ב 160 סל"ד.
אזהרה: יש להשתמש ב- B. vesicularis במעבדה ברמת הכלה 2 בהתאם להנחיות הנדרשות לטיפול באורגניזמים פתוגניים. המטפל חייב להיות מאומן כראוי ועליו ללבוש משקפי בטיחות, כפפות ומעיל.
- חומרי חיטוי
- להכנת תמיסת חומצה פרוקסי אורגנית (60 מ"ל), הוסיפו 24 מ"ל מי חמצן ו-36 מ"ל חומצה (חומצה אצטית, פרופיונית או לקטית) לצלוחית ארלנמאייר בנפח 250 מ"ל. לאחר מכן, הוסף נפח מוגדר מראש של 10 M חומצה גופרתית (655 μL עבור חומצה peracetic, 635 μL עבור חומצה perpropionic, או 715 μL עבור חומצה פרלקטית). נערו בעדינות את הבקבוק כדי לערבב, והכניסו את הבקבוק לאמבט מים בטמפרטורה של 30 מעלות צלזיוס בתוך מכסה המנוע הכימי. דוגרים על הבקבוק במשך יומיים, עם ערבוב עדין בכל בוקר.
הערה: חומר החיטוי המסחרי המבוסס על חומצה פראצטית (ראה טבלת חומרים) סופק ישירות על ידי היצרן.
אזהרה: יש להשתמש בחומרי החיטוי מתחת למכסה מנוע כימי. יש ללבוש משקפי בטיחות וכפפות למשך הניסוי. לקבלת מידע נוסף על חומרי החיטוי, עיין בגיליון נתוני בטיחות החומרים המתאים. - בצע טיטרציה של מי חמצן כמתואר להלן.
- הניחו ריקה של 300 מ"ל על איזון אנליטי (ראו טבלת חומרים) וטו את קנה המידה. שוקלים כ-0.23 גרם חומר חיטוי לתוך הכד ומציינים את המשקל המדויק שנוסף. מוסיפים 100 גרם של תמיסת חומצה גופרתית קרה 1 N לתוך הכד, מוסיפים חטיף ערבוב מגנטי לתוך הכד ומניחים אותו על צלחת ערבוב.
- תן לפתרון לערבב עד הומוגניזציה מלאה. לאחר מכן, הוסף שלוש טיפות של תמיסת מחוון פרואין (0.1 wt% ב- H2O) לתוך הכד, וטיטראט עם תמיסת צריום סולפט 0.1 N עד שתמיסה משתנה מצבע ורוד סלמון לצבע תכלת. שים לב לנפח של תמיסת צריום סולפט שנוספה.
- חישוב אחוז מי חמצן באמצעות הנוסחה הבאה:
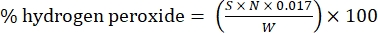 (1)
(1)
כאשר S הוא נפח תמיסת צריום סולפט שנוספה, N הוא הנורמליות של תמיסת צריום סולפט (0.1 N), W הוא משקל הדגימה (~0.2300 גרם), ו- 0.017 = (1 mol H 2 O 2/2 mol Ce) × (34.0147 גרם H 2 O 2 /1 mol H 2 O)2× (1ליטר / 1,000 מ"ל)
- בצע טיטרציה של peroxyacids אורגני כמתואר להלן.
- הוסף 20 מ"ל של תמיסת יודיד אשלגן 7.5% (w/v) לתוך כוסית. טיטרט לאט עם תמיסת נתרן תיוסולפט 0.1 N עד שהצבע הכחול של התמיסה מתחיל להפוך לחום/כתום בהיר.
- הוסף 2 מ"ל של תמיסת עמילן (1 wt% ב H2O) לכוס וטיטרט עם תמיסת נתרן תיוסולפט 0.1 N עד שתמיסה משתנה משחור לכתום. שים לב לנפח של תמיסת נתרן thiosulfate בשימוש.
- חשב את אחוז peroxyacid אורגני עם הנוסחה הבאה:
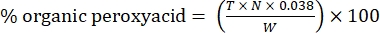 (2)
(2)
כאשר T הוא נפח תמיסת הנתרן תיוסולפט בשימוש, N הוא הנורמליות של תמיסת הנתרן תיוסולפט (0.1 N), W הוא משקל הדגימה (~0.2300g), ו- 0.038 = (1 mol CH 3 COOOH/1 mol I 2) × (1 mol I 2/2 mol S 2 O 3) × (76.06 גרם/1 מולCH3 COOOH) × (1 ליטר/1,000 מ"ל)
הערה: חזור על שלב 1.2.2 ושלב 1.2.3 עם שתי דגימות נוספות כדי לבצע כל בדיקה בשלשה.
- להכנת תמיסת חומצה פרוקסי אורגנית (60 מ"ל), הוסיפו 24 מ"ל מי חמצן ו-36 מ"ל חומצה (חומצה אצטית, פרופיונית או לקטית) לצלוחית ארלנמאייר בנפח 250 מ"ל. לאחר מכן, הוסף נפח מוגדר מראש של 10 M חומצה גופרתית (655 μL עבור חומצה peracetic, 635 μL עבור חומצה perpropionic, או 715 μL עבור חומצה פרלקטית). נערו בעדינות את הבקבוק כדי לערבב, והכניסו את הבקבוק לאמבט מים בטמפרטורה של 30 מעלות צלזיוס בתוך מכסה המנוע הכימי. דוגרים על הבקבוק במשך יומיים, עם ערבוב עדין בכל בוקר.
2. היווצרות ביופילמים בודדים ומעורבים
- לוחות מיקרוטיטר ביופילם
- מערבול הצינור המכיל את תרבית החיידקים (20 μL של הזן + 10 מ"ל של מדיום TSB, מוכן בשלב 1.1.4). בצע דילול וציפוי סדרתי על אגר סויה טריפטי (TSA) כדי לקבוע את ספירת תאי החיידקים (cfu) של תרבית הלילה. לאחר מכן, להעביר 100 μL של התרבית לתוך 10 מ"ל של מדיום TSB סטרילי (עבור ריכוז סופי של כ 2 x 107 cfu/mL).
הערה: עבור הבדיקה עם הביוריאקטור, נפח של 100 μL של בידוד מיקרוביאלי מועבר לתוך 100 מ"ל של TSB סטרילי. - מערבלים את הצינור. עבור כל חיידק, מעבירים את תרבית החיידקים המדוללת לצלחת מיקרוטיטר הביופילם (150 מיקרוליטר לבאר) בטריפליקט באמצעות פיפטה רב ערוצית. עומס 150 μL של TSB בינוני לתוך שלוש בארות חדשות שישמשו בקרה. יש לדגור על צלחת המיקרוטיטר של הביופילם (ראו טבלת חומרים) בטמפרטורה של 30°C למשך 24 שעות ללא תסיסה.
הערה: לבדיקות ביופילם מעורבות, הוסף 75 μL מכל תרחיף לקבלת נפח כולל של 150 μL. לוח המיקרוטיטר של הביופילם מכיל יתדות בעפעפיו, שעליהן נוצרים הביופילמים.
- מערבול הצינור המכיל את תרבית החיידקים (20 μL של הזן + 10 מ"ל של מדיום TSB, מוכן בשלב 1.1.4). בצע דילול וציפוי סדרתי על אגר סויה טריפטי (TSA) כדי לקבוע את ספירת תאי החיידקים (cfu) של תרבית הלילה. לאחר מכן, להעביר 100 μL של התרבית לתוך 10 מ"ל של מדיום TSB סטרילי (עבור ריכוז סופי של כ 2 x 107 cfu/mL).
- ביוריאקטור
- נקו וייבשו באוויר את חלקי הביוריאקטור (ראו טבלת חומרים) בהתאם להוראות היצרן, והמשיכו להכין את הכור כמתואר להלן.
- ראשית, הניחו את הלהב השטוח בתוך זכוכית 1 ליטר (ביוריאקטור), המחוברת למחזיק שלה על ידי מוט מגנטי, ושמרו על המערך במצב זקוף באמצעות מוט הפלסטיק המחובר בצד הפנימי של מכסה הביוריאקטור.
- הניחו את הקופונים או המגלשות מפלדת אל-חלד (ראו טבלת חומרים) על מוטות הפוליפרופילן שלהם באמצעות המברג, והכניסו אותם לתוך החורים במכסה, מבלי להכניס את פיני היישור שלהם לחריצים, כדי לאפשר לאדים לברוח במהלך העיקור.
- כסו את כל פתחי האוורור של הביוריאקטור ברדיד אלומיניום, ועטפו את שאר הציוד, כלומר את הצינור L/S 18 (ID = 7.9 מ"מ) ואת L/S 16 (ID = 3.1 מ"מ), את שבר זרימת הזכוכית, את מכסי המיכלים, את המברגים, את המלקחיים ואת מסנני 0.2 מיקרומטר, ברדיד אלומיניום.
הערה: הכנס את צינור הסיליקון (ראה טבלת חומרים) למוט הממוקם על המשטח הפנימי של מכסה המכל הבינוני. - Autoclave הביוריאקטור להגדיר במחזור יבש ב 121 ° C במשך 20 דקות.
- בצע היווצרות ביופילם בביוריאקטור במצב אצווה (צעד ראשון).
- ב- BSC, חבר קצה אחד של הצינור L/S 18 לפיית היציאה של הביוריאקטור, ושמור את הקצה השני עטוף ברדיד אלומיניום כדי לשמור על סטריליות.
- הסר קופון אחד או מחזיק שקופיות אחד ממכסה הביוריאקטור והנח אותו בצינור סטרילי של 50 מ"ל. לאחר מכן, מלאו את הכד של הביוריאקטור ב-340 מ"ל של 300 מ"ג/ליטר TSB בינוני דרך החור שנכבש על ידי המוט באמצעות פיפטה סרולוגית של 50 מ"ל.
- חסן את מדיום התרבית בביוריאקטור עם 1 מ"ל של התמיסה החיידקית (~ 108 cfu/mL של P. azotoformans) באמצעות פיפטה של 5 מ"ל דרך אותו פתח ששימש קודם לכן, ולאחר מכן החזיר את המוט למקומו המקורי. מקם את המוטות שכבר ממוקמים בחורי המכסה כך שהפינים יתאימו לחריצים המתאימים שלהם.
- מניחים מסנן טיהור אוויר חיידקי 0.2 מיקרומטר בקצה הצינור בקוטר הקטן ביותר, הממוקם על מכסה הביוריאקטור. הצינור השני באותו קוטר נשאר מחובר באופן קבוע עם מכסה בורג מתכת או תקע סיליקון שנסגר בחוזקה.
- הניחו את הביוריאקטור למשך 24 שעות מעל פלטת החימום בטמפרטורה של 30°C וערבבו ב-130 סל"ד.
הערה: ליצירת ביופילם רב-מינים, השתמש בנפח שווה של תרביות החיידקים השונות כדי לקבל נפח כולל של 1 מ"ל עבור החיסון.
- ביצוע היווצרות ביופילם בביוריאקטור במצב זרימה רציפה (שלב שני).
- הניחו קרבוי המכיל 18 ליטר מים מזוקקים סטריליים ב-BSC, והוסיפו 2 ליטר של 1,000 מ"ג/ליטר מדיום תרבית TSB לקבלת ריכוז סופי של 100 מ"ג/ליטר.
- מכסים את המיכל במכסה הסטרילי שלו, שאליו מחוברים שני צינורות. הראשון הוא צינור סיליקון המקובע על הפן הפנימי של הכובע ומשמש לשאיבת המדיום. הצינור השני (L/S 16) מחובר ליציאה החיצונית כדי לאפשר לנוזל לזרום לכיוון הביוריאקטור. הניחו מסנן של 0.2 מיקרומטר לתוך הצינור השני על מכסה המיכל הבינוני.
- חבר צינור שני זה למשאבה הפריסטלטית וחבר את הקצה השני לשבר זרימת הזכוכית, אשר מוכנס לאחר מכן לתוך הצינור הגדול יותר על מכסה הביוריאקטור.
- השתמש עוד 20 ליטר carboy כדי לאסוף את השפכים מן bioreactor. חבר את קצה הצינור המחובר לפיית מוצא הביוריאקטור למכסה מיכל הפסולת. הכנס מסנן 0.2 מיקרומטר לתוך הצינור הזמין על מכסה מיכל זה.
- הפעל את המשאבה הפריסטלטית בקצב זרימה של 11.3 מ"ל/דקה, והשאר את המערכת פועלת למשך 24 שעות.
הערה: קצב הזרימה (11.3 מ"ל/דקה) של מדיום התרבית או החלב ששימש במהלך היווצרות הביופילם בביוריאקטור נקבע על ידי חלוקת 340 מ"ל (המתאים לנפח הנוזל בתוך הכור) בזמן מגורים של 30 דקות.
- לשחזר את הביופילם החיידקי.
- כבו את המשאבה הפריסטלטית והפסיקו לערבב ולחמם את הביוריאקטור.
- בזהירות להסיר כל מוט מן bioreactor, ולשטוף את הקופונים או שקופיות 3x ב 40 מ"ל של PBS כדי לחסל חיידקים פלנקטוניים. לאחר מכן, שחררו את הקופונים או המגלשות לתוך צינורות חרוטיים סטריליים של 50 מ"ל המכילים 40 מ"ל PBS באמצעות מברג מתאים. סובבו את הצינורות במשך 30 שניות, העבירו אותם למתלה הממוקם באמבט סוניקטור, והפעילו את הצינורות במהירות של 40 קילוהרץ למשך 30 שניות (מה שדורש הספק של 110 וואט). חזור על פעולה זו 3x.
- אסוף את מתלי הביופילם של 40 מ"ל בצינורות חרוטיים סטריליים של 50 מ"ל, ולאחר מכן שטוף את הקופונים או המגלשות עם 2 מ"ל של תמיסת PBS סטרילית. לשחזר את נוזל שטיפה זה ולהוסיף אותו השעיה biofilm כבר נאסף.
- מנה את החיידקים הקיימים בביופילם: עם השעיית הביופילם המתקבלת, בצע דילולים סדרתיים פי 10, ולאחר מכן צלחת 100 μL של דילולים 10-5 ו -10-6 על TSA במשולש. לדגור את הצלחות ב 30 ° C במשך 24 שעות. ספרו את מספר המושבות הקיימות על לוחות האגר, וחשבו את צפיפות החיידקים על הקופונים והמגלשות (חיידקים סיסליים בני קיימא) על פי ASTM E2562-1714 באמצעות הנוסחה הבאה:
 (3)
(3)
כאשר X הוא מספר היחידות יוצרות המושבה (CFU), B הוא הנפח המצופה (0.1 מ"ל), V הוא הנפח שבו הביופילם מושהה (תמיסת המלאי), A הוא פני השטח של הקופון או השקף המכוסה על ידי הביופילם, ו-D הוא גורם הדילול.
- נקו וייבשו באוויר את חלקי הביוריאקטור (ראו טבלת חומרים) בהתאם להוראות היצרן, והמשיכו להכין את הכור כמתואר להלן.
3. הערכה כמותית של יעילות חומצות פרוקסי אורגניות למיגור ביופילמים
- לוחות מיקרוטיטר ביופילם
- הוסף 200 μL של מלוחים חוצצי פוספט (1x PBS) לשלוש בארות של מיקרו-צלחת בת 96 בארות.
- העבירו את המכסה של מיקרו-צלחת הביופילם, עם ביופילמים שנוצרו על היתדות, למיקרו-צלחת בת 96 בארות המכילה PBS למשך 10 שניות על מנת לשטוף את הביופילמים ולחסל חיידקים פלנקטוניים.
- הכינו את חומרי החיטוי בריכוזים הנדרשים (למשל, 25 חל"מ, 50 חל"מ, 500 חל"מ, 1,000 חל"מ, 5,000 חל"מ, 10,000 חל"מ ו-25,000 חל"מ חומר פעיל).
הערה: כל הדילולים נעשים באופן אספטי באמצעות מים מזוקקים סטריליים. - הוסף 200 μL מכל ריכוז של חומר חיטוי לבארות של צלחת מיקרוטיטר חדשה בת 96 בארות במשולש. מעבירים את מכסה צלחת המיקרוטיטר של הביופילם על צלחת מיקרוטיטר זו בעלת 96 בארות המכילה את חומרי החיטוי, ודגרים על הצלחת בטמפרטורת החדר למשך זמן החשיפה הרצוי.
- הוסף 200 μL של מרק מנטרל Dey-Engley לבארות של צלחת מיקרוטיטר חדשה של 96 בארות. מעבירים את המכסה של צלחת מיקרוטיטר הביופילם על צלחת מיקרוטיטר 96 בארות המכילה את המרק המנטרל. אטמו את צלחת המיקרוטיטר בפרפילם, והניחו אותה בסוניק האמבטיה במהירות של 40 קילוהרץ למשך 30 דקות.
- לאחר 30 דקות, להסיר את צלחת microtiter מן sonicator ולהסיר את parafilm. מעבירים 100 μL מהעמודה הראשונה של צלחת 96 בארות המכילה את הביופילמים המנותקים בעקבות סוניקציה לשורה הראשונה של לוח מיקרוטיטר חדש בעל 96 בארות.
- הוסף 180 μL של PBS סטרילי 1x לבארות של microplate 96 בארות החדש (מוכן בשלב 3.1.6), למעט השורה הראשונה. העברת 20 μL של תמיסת הביופילם מהשורה הראשונה לבארות בשורה השנייה המכילה 180 μL של 1x PBS (שורה 2, דילול: 10−1). לאחר מכן, העבירו 20 μL של הנוזל הכלול בשורה השנייה לבארות בשורה הבאה המכילות 180 μL של 1x PBS (שורה 3, דילול: 10−2). חזור על אותו הליך כדי להשיג דילולים בין 10-5 ל-10-7.
- לחסן 100 μL של דילולים על TSA, ולדגור את הצלחות על פי הפרמטרים הדרושים לצמיחה של כל חיידק.
- לאחר הדגירה, ספרו את ה-cfus וחשבו את צפיפות log 10 עבור כל יתד ואת הפחתת log10 בכל ריכוז חומר חיטוי בעזרת המשוואות הבאות:
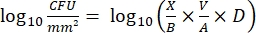 (4)
(4)
כאשר X הוא היחידות יוצרות המושבה הנספרות במקום, B הוא הנפח המצופה (0.01 מ"ל), V הוא נפח הבאר (0.20 מ"ל), A הוא שטח הפנים של היתד (46.63 מ"מ2) ו-D הוא הדילול.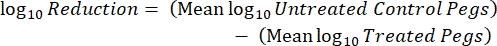 ש"ק (5)
ש"ק (5) - חזור על כל ניסוי 3 פעמים בימים בלתי תלויים.
הערה: "הריכוז המינימלי של חומר חיטוי שמחסל את הביופילם", או MBEC, מתאים לריכוז החיטוי הנמוך ביותר שאינו מראה צמיחת חיידקים.
- ביוריאקטור
הערה: ההליך של תקן ASTM E2871-1915 הוא ואחריו לבצע בדיקה זו עם P. azotoformans PFlA1.- התחל ביצירת הביופילמים על הקופונים בביוריאקטור, כמתואר בשלב 2.2. לאחר מכן, הסר את המוט המחזיק את הקופונים ושטוף אותו בתוך צינור חרוטי המכיל 30 מ"ל של PBS.
- זרוק כל קופון לתוך צינור חרוטי סטרילי 50 מ"ל באמצעות מברג, ולאחר מכן הוסף 4 מ"ל של תמיסת peroxyacid אורגנית המתאימה או PBS עבור הבקרה. דוגרים במשך 5 דקות, ולאחר מכן מוסיפים 36 מ"ל של מרק מנטרל Dey-Engli. מערבולת במשך 30 שניות, ולאחר מכן סוניקציה ב 40 קילוהרץ במשך 30 שניות באמצעות אמבט סוניקטור. חזור על התהליך 3x כדי לקבל את השעיית הביופילם.
- באופן דומה, שוטפים את כל המוטות האחרים ומשחזרים את הביופילמים מהקופונים. בצע דילול סדרתי של השעיית הביופילם והצלחת 0.1 מ"ל על מדיום TSA. לדגור את הצלחות ב 30 ° C במשך 24 שעות.
- לאחר הדגירה, ספרו את ה-cfus, ולאחר מכן חשבו את צפיפות הביופילם עבור כל קופון (Eq. 6), צפיפות היומן הממוצעת (LD) עבור כל קבוצה של שלושה קופונים מאותו מוט, כולל טיפול ובקרה (Eq. 7), והפחתת היומן עבור חומר החיטוי (Eq. 8) באמצעות המשוואות הבאות:
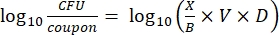 (6)
(6)
כאשר X הוא הממוצע של יחידות יוצרות המושבה הנספרות/קופון, B הוא הנפח המצופה (0.1 מ"ל), V הוא נפח חומר החיטוי או PBS בתוספת מנטרל (40 מ"ל), ו-D הוא הדילול.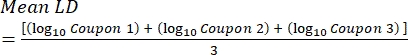 (7)
(7)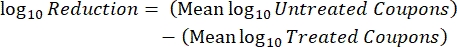 (8)
(8)
4. הערכה איכותית של יעילות חומצות פרוקסי אורגניות לחיסול ביופילמים
הערה: לאחר שטופלו בחומרי החיטוי (שלב 3.1.1 עד שלב 3.1.5), הוכנו ונותחו ונותחו ביופילמים של P. azotoformans שנוצרו על יתדות לוח מיקרוטיטר הביופילם בשיטה הסטטית על ידי תצפית על מיקרוסקופים אלקטרונים וקונפוקליים סורקים.
- מיקרוסקופ אלקטרונים סורק (SEM)
- הוסף 200 μL של 1x PBS לשלוש בארות של מיקרו-צלחת של 96 בארות. העבירו את המכסה מצלחת מיקרוטיטר הביופילם (שלב 3.1.5) למיקרו-צלחת בעלת 96 בארות המכילה PBS, והשאירו אותו בטמפרטורת החדר למשך 10 שניות כדי לחסל את המרק המנטרל Dey-Engli.
- הסר את היתדות מצלחת מיקרוטיטר הביופילם באמצעות צבת אף מחט מעוקרת. הכניסו כל יתד לבקבוקון ריק מתחת למכסה מנוע, והוסיפו לכל בקבוקון קיבוע ראשוני (5% גלוטראלדהיד ב-0.1 M Na cacodylate buffer pH 7.5). מכסים כל בקבוקון ודוגרים עליו בטמפרטורה של 4°C למשך 24 שעות.
- לאחר הדגירה, decant את fixative עם פיפטה, ולהשליך את כל הפסולת הנוזלית במיכל מתאים. הסירו את הפקקים של כל בקבוקון והניחו אותם במכסה מנוע לייבוש באוויר למשך 72 שעות.
- הרכיבו את הדגימות על גבעולי אלומיניום (ראו טבלת חומרים) על ידי מריחת שרף אפוקסי (ראו טבלת חומרים) על המשטח העליון השטוח של כל גבב. לאחר מכן, הצמידו בזהירות את היתדות לגבעולים בעזרת מלקחיים.
- מתכת את הדגימות עם מרזב זהב EMS950x + 350s (ראה טבלת חומרים) למשך 4 דקות בלחץ ארגון 2 x 10−1 בר וזרם 20 mA. בצעו הארקה מתאימה על ידי צביעת צד היתד שאינו חשוף לזהב בצבע כסף (ראו טבלת חומרים).
- קבל תמונות במיקרוסקופ אלקטרונים סורק באמצעות ממשק המשתמש של בקרת SEM גרסה 6.28 (ראה טבלת חומרים). מתח התאוצה ששימש במחקר זה היה 15 קילו וולט, וההגדלות היו פי 300 ופי 2,000.
- מיקרוסקופ קונפוקלי
- הוסף 200 μL של 1x PBS לשלוש בארות של צלחת מיקרוטיטר 96 בארות. העבירו את המכסה מהמיקרו-צלחת של הביופילם לצלחת בעלת 96 בארות המכילה את PBS, והשאירו אותו למשך 10 שניות כדי לחסל את המרק המנטרל של דיי-אנגלי.
- הכינו תמיסות של כתמים פלואורסצנטיים על ידי הוספת 3 מיקרוליטר של כתם פלואורסצנטי ירוק ו-3 מיקרוליטר של כתם פלואורסצנטי אדום (ראו טבלת חומרים) ל-1 מ"ל מים סטריליים.
- הוסף 200 μL של תמיסת צביעה לבאר אחת של צלחת microtiter 96 באר. מעבירים את המכסה מצלחת המיקרוטיטר של הביופילם לצלחת בעלת 96 בארות המכילה את תמיסת הצביעה. מכסים את צלחת מיקרוטיטר הביופילם ברדיד אלומיניום, ודגרים על הדגימה במשך 20-30 דקות בטמפרטורת החדר.
- הוסף 200 μL של מים מעוקרים לתוך בארות של microplate 96 בארות. לאחר מכן, העבירו את המכסה מהמיקרו-צלחת של הביופילם למיקרו-צלחת של 96 בארות המכילה את המים, והשאירו אותה עד לתצפית.
- דמיינו את הביופילמים שנוצרו על היתדות באמצעות מיקרוסקופ סריקת לייזר קונפוקלי (ראו טבלת חומרים) עם יעד DIC שמן 63x/1.40. רכוש את התמונות באמצעות התוכנה המשויכת (ראה טבלת חומרים). אורכי הגל של עירור הפלואורסצנטי ששימשו לכתמים הפלואורסצנטיים הירוקים והאדומים היו 482 ננומטר ו-490 ננומטר, בהתאמה.
הערה: לקבלת התוצאות הטובות ביותר, חותכים ומניחים את היתד בכלי פטרי בקוטר 60 מ"מ וממלאים את הכלי במים סטריליים.
תוצאות
ניתוח SEM מראה נוכחות של ביופילמים המיוצרים על-ידי P. azotoformans PFl1A על יתדות המיקרו-לוחות של הביופילם (איור 2A). ניתן להבחין במבנה ביופילם תלת מימדי. P. azotoformans PFl1A זוהה בעבר כיצרן ביופילם חזק (A570 > 1.5) באמצעות לוחות מיקרוטיטר96 בארות 12.
נוסף ע...
Discussion
בדיקת MBEC (בדיקת מיקרו-צלחות ביופילם) הייתה השיטה הראשונה שהוכרה כבדיקת ביעור ביופילם סטנדרטית על ידי ASTM17. המחקר שלנו ואחרים הראו כי ישנם שני שלבים קריטיים בעת שימוש בבדיקה זו: שלב הסוניקציה (זמן ועוצמה) וזמן הטיפול בחומר חיטוי18. סטיוארט ופרקר הציעו גם פרמטרים אחרי...
Disclosures
המחברים מצהירים כי אין להם ניגודי עניינים.
Acknowledgements
מחקר זה נתמך על ידי Consortium de Recherche et Innovations en Bioprocédés Industriels au Québec (CRIBIQ) (2016-049-C22), Agropur, Groupe Sani Marc ומועצת המחקר למדעי הטבע וההנדסה של קנדה (NSERC) (RDCPJ516460-17). אנו מודים לתרזה פניקוני על הביקורת על כתב היד.
Materials
| Name | Company | Catalog Number | Comments |
| 0.2 µm filters | Corning | 09-754-28 | diameter: 50 mm, PTFE- Membrane |
| 316 stainless-steel disc coupon | Biosurface Technologies Corporation | RD128-316 | |
| 316 stainless-steel slide coupon | Biosurface Technologies Corporation | CBR 2128-316 | |
| 96-microtiter plate | Corning | 07-200-89 | cell Culture-Treated, flat-Bottom Microplate |
| Acetic acid | Sigma Aldrich | 27225 | store at RT |
| Aluminium stubs | Electron Microscopy Science | 75830-10 | 32x5mm |
| Aqueous glutaraldehyde EM Grade 25% | Electron Microscopy Sciences | 16220 | store at -20 °C |
| AB204-S/FACT Analytical balance | Mettler Toledo | AB204-S | |
| Bacterial Vent Filter (0.45 µm) | Biosurface Technologies Corporation | BST 02915 | |
| BioDestroy | Groupe Sani Marc | 09-10215 | commercial peracetic acid-based disinfectant, store at RT |
| Carboy LDPE 20 L | Cole Parmer | 06031-52 | |
| CDC biofilm reactor | Biosurface Technologies Corporation | CRB 90 | bioreactor |
| Cerium (IV) sulphate | Thermo Scientific | 35650-K2 | store at RT |
| Confocal laser scanning microscope LSM 700 | Zeiss | LSM 700 | |
| Dey-Engley neutralizing broth | Millipore | D3435-500G | store at 4 °C |
| EMS950x + 350s gold sputter | Electron Microscopy Sciences | ||
| Epoxy resin | Electron Microscopy Sciences | 14121 | with BDMA |
| Ethyl alcohol 95%, USP | Greenfield global | P016EA95 | store at RT |
| Ferroin indicator solution | Sigma Aldrich | 318922-100ML | store at RT |
| Filling/venting cap | Cole Parmer | RK-06258-00 | |
| FilmTracer LIVE/DEAD Biofilm Viability Kit | Invitrogen | L10316 | fluorescent cell viability kit (SYTO 9: green fluorescent stain, Propidium iodide: red fluorescent stain), store at - 20 °C |
| Glass flow break | Biosurface Technologies Corporation | FB 50 | |
| Gold with silver paint | Electron Microscopy Sciences | 12684-15 | |
| Heating plate set | Biosurface Technologies Corporation | 110V Stir Plate | |
| Hex screwdriver | Biosurface Technologies Corporation | CBR 5497 | |
| Hydrogen peroxide | Sigma | 216763 | store at 4 °C |
| Inoculating loops | VWR | 12000-812 | sterile, 10 µl |
| Lactic acid | Laboratoire MAT | LU-0200 | store at RT |
| MASTERFLEX L/S 7557-04 W/ 7557-02 with EASY-LOAD II peristaltic pump and 77200-50 Head | Cole Parmer | 77200-60 | |
| MBEC (Minimum Biofilm Eradication Concentration) assay biofilm inoculator with a 96-well base | Innovotech | 19111 | Biofilm microtiter plate |
| Oxford agar base | Thermo Scientific | OXCM0856B | store at 4 °C |
| Plastic coupon holder | Biosurface Technologies Corporation | CBR 2203 | |
| Plastic slide holder rod | Biosurface Technologies Corporation | CBR 2203-GL | |
| Potassium iodide | Fisher Chemical | P410-500 | store at RT |
| Precision slotted screwdriver (1.5 mm x 40 mm) | Wiha | 26015 | |
| Propionic acid | Laboratoire MAT | PF-0221 | store at RT |
| Sartorius BCE822-1S Entris® II Basic Essential Toploading Balance | Cole Parmer | UZ-11976-3 | |
| Scanning electron microscope JSM-6360LV model | JEOL | JSM-6360LV | SEM and user control interface |
| Screw cap tube, 15 mL | Sarstedt | 62.554.205 | (LxØ): 120 x 17 mm, material: PP, conical base, transparent, HD-PE |
| Screw cap tube, 50 mL | Sarstedt | 62.547.205 | (LxØ): 114 x 28 mm, material: PP, conical base, transparent, HD-PE |
| Sodium Cacodylate Trihydrate | Electron Microscopy Sciences | 12300 | store at -20 °C |
| Sodium thiosulfate | Thermo Scientific | AC124270010 | store at RT |
| Sonication bath | Fisher | 15-336-122 | 5,7 L |
| Starch solution | Anachemia | AC8615 | store at RT |
| Sulfuric acid | Sigma Aldrich | 258105-500ML | store at RT |
| Tryptic soy agar | BD Bacto | DF0369-17-6 | store at RT |
| Tryptic soy broth | BD Bacto | DF0370-17-3 | store at RT |
| Tubing Masterflex L/S 16 25' | Cole Parmer | MFX0642416 | |
| Tubing Masterflex L/S 18 25' | Cole Parmer | MFX0642418 | |
| Tygon SPT-3350 silicon tubing | Saint-Gobain | ABW18NSF | IDx OD: 1/4 in.x 7/16 in. |
| Vortex | Cole Parmer | UZ-04724-00 | |
| Water bath | VWR | 89202-970 | |
| Zen software | Zeiss |
References
- Canada's dairy industry at a glance. Canadian Dairy Information Centre Available from: https://agriculture.canada.ca/en/canadas-agriculture-sectors/animal-industry/canadian-dairy-information-centre/canadas-dairy-industry-glance (2017)
- Oliver, S. P., Jayarao, B. M., Almeida, R. A. Foodborne pathogens in milk and the dairy farm environment: food safety and public health implications. Foodborne Pathogens and Disease. 2 (2), 115-129 (2005).
- Fondation de technologie laitière du Québec. . Science et technologie du lait. 3rd edn. , (2018).
- Evanowski, R., et al. Short communication: Pseudomonas azotoformans causes gray discoloration in HTST fluid milk. Journal of dairy science. 100, 7906-7909 (2017).
- Bower, C. K., McGuire, J., Daeschel, M. A. The adhesion and detachment of bacteria and spores on food-contact surfaces. Trends in Food Science & Technology. 7 (5), 152-157 (1996).
- Gupta, S., Anand, S. Induction of pitting corrosion on stainless steel (grades 304 and 316) used in dairy industry by biofilms of common sporeformers. International Journal of Dairy Technology. 71 (2), 519-531 (2018).
- Marchand, S., et al. Biofilm formation in milk production and processing environments; Influence on milk quality and safety. Comprehensive Reviews in Food Science and Food Safety. 11 (2), 133-147 (2012).
- Silva, H. O., et al. Efficiency of different disinfectants on Bacillus cereus sensu stricto biofilms on stainless-steel surfaces in contact with milk. Frontiers in Microbiology. 9, 2934 (2018).
- Sedlak, D. L., von Gunten, U. Chemistry. The chlorine dilemma. Science. 331 (6013), 42-43 (2011).
- vander Veen, S., Abee, T. Mixed species biofilms of Listeria monocytogenes and Lactobacillus plantarum show enhanced resistance to benzalkonium chloride and peracetic acid. International Journal of Food Microbiology. 144 (3), 421-431 (2011).
- Saa Ibusquiza, P., Herrera, J. J., Cabo, M. L. Resistance to benzalkonium chloride, peracetic acid and nisin during formation of mature biofilms by Listeria monocytogenes. Food Microbiology. 28 (3), 418-425 (2011).
- Goetz, C., Larouche, J., Velez Aristizabal, M., Niboucha, N., Jean, J. Efficacy of organic peroxyacids for eliminating biofilm preformed by microorganisms isolated from dairy processing plants. Applied and Environmental Microbiology. 88 (4), 0188921 (2022).
- Vimont, A., Fliss, I., Jean, J. Study of the virucidal potential of organic peroxyacids against norovirus on food-contact surfaces. Food and Environmental Virology. 7 (1), 49-57 (2015).
- ASTM E2562-17. Standard Test Method for Quantification of Pseudomonas aeruginosa Biofilm Grown with High Shear and Continuous Flow using CDC Biofilm Reactor. ASTM International Available from: https://www.astm.org/e2562-17.html (2017)
- ASTM E2871-19. Standard Test Method for Evaluating Disinfectant Efficacy Against Pseudomonas aeruginosa Biofilm Grown in CDC Biofilm Reactor Using Single Tube Method. ASTM International Available from: https://www.astm.org/e2871-19.html (2019)
- Niboucha, N., et al. Comparative study of different sampling methods of biofilm formed on stainless-steel surfaces in a CDC biofilm reactor. Frontiers in Microbiology. 13, 892181 (2022).
- ASTM E2799-17. Standard Test Method for Testing Disinfectant Efficacy against Pseudomonas aeruginosa Biofilm using the MBEC Assay. ASTM International Available from: https://www.astm.org/e2799-17.html (2022)
- Parker, A. E., et al. Ruggedness and reproducibility of the MBEC biofilm disinfectant efficacy test. Journal of Microbiological Methods. 102, 55-64 (2014).
- Stewart, P. S., Parker, A. E. Measuring antimicrobial efficacy against biofilms: A meta-analysis. Antimicrobial Agents and Chemotherapy. 63 (5), 00020 (2019).
- Lindsay, D. K., Fouhy, K., Loh, M., Malakar, P. The CDC biofilm bioreactor is a suitable method to grow biofilms, and test their sanitiser susceptibilities, in the dairy context. International Dairy Journal. 126, 105264 (2022).
- Buckingham-Meyer, K., Goeres, D. M., Hamilton, M. A. Comparative evaluation of biofilm disinfectant efficacy tests. Journal of Microbiological Methods. 70 (2), 236-244 (2007).
- Goeres, D. M., et al. Statistical assessment of a laboratory method for growing biofilms. Microbiology (Reading). 151, 757-762 (2005).
- Williams, D. L., Woodbury, K. L., Haymond, B. S., Parker, A. E., Bloebaum, R. D. A modified CDC biofilm reactor to produce mature biofilms on the surface of peek membranes for an in vivo animal model application. Current Microbiology. 62 (6), 1657-1663 (2011).
- Pieranski, M. K., Rychlowski, M., Grinholc, M. Optimization of Streptococcus agalactiae biofilm culture in a continuous flow system for photoinactivation studies. Pathogens. 10 (9), 1212 (2021).
- Mendez, E., Walker, D. K., Vipham, J., Trinetta, V. The use of a CDC biofilm reactor to grow multi-strain Listeria monocytogenes biofilm. Food Microbiology. 92, 103592 (2020).
- Salgar-Chaparro, S. J., Lepkova, K., Pojtanabuntoeng, T., Darwin, A., Machuca, L. L. Nutrient level determines biofilm characteristics and subsequent impact on microbial corrosion and biocide effectiveness. Applied and Environmental Microbiology. 86 (7), 02885 (2020).
- Goeres, D. M., Simoes, M., Borges, A., Chaves Simoes, L., et al. Design and Fabrication of Biofilm Reactors. Recent Trends in Biofilm Science and Technology. , 71-88 (2020).
- Fjeld, C. S., Schüller, R. B. Biofilm formation during hexadecane degradation and the effects of flow field and shear stresses. Annual Transactions - The Nordic Rheology Society. 21, 341-346 (2013).
- Gilmore, B. F., Hamill, T. M., Jones, D. S., Gorman, S. P. Validation of the CDC biofilm reactor as a dynamic model for assessment of encrustation formation on urological device materials. Journal of Biomedical Materials Research Part B: Applied Biomaterials. 93 (1), 128-140 (2010).
- Picioreanu, C., van Loosdrecht, M. C., Heijnen, J. J. Two-dimensional model of biofilm detachment caused by internal stress from liquid flow. Biotechnology and Bioengineering. 72 (2), 205-218 (2001).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved