Method Article
שימוש בשיטות זעיר פולשניות להערכת ניצול דלק ומקצבים צירקדיים אצל מבוגרים
In This Article
Summary
מוצג פרוטוקול חדשני וזעיר פולשני להערכת ההשפעה הסינרגטית של ניצול דלק ומקצבים צירקדיים על אנשים מזדקנים, תוך שימוש בתאים חד-גרעיניים בדם היקפי.
Abstract
הזדקנות קשורה לשינויים פיזיולוגיים מרובים התורמים באופן סינרגטי ובלתי תלוי לנכות גופנית ולסיכון למחלות כרוניות. למרות שהאטיולוגיה של מוגבלות פיזית הקשורה לגיל היא מורכבת ורב-גורמית, נראה כי הירידה בתפקוד המיטוכונדריה עולה בקנה אחד עם התקדמות הירידה התפקודית אצל מבוגרים רבים. הסיבה לירידה בתפקוד המיטוכונדריה עם ההזדקנות עדיין חמקמקה, אבל מחקרים חדשים מצביעים על כך שגם חילוף החומרים של הדלק וגם השעון הביולוגי יכולים להשפיע על תפקוד המיטוכונדריה.
מחקרים אחרונים קבעו כי השעון הביולוגי מופרע עם ההזדקנות, וכי לשיבושים במקצבים הצירקדיים יש השלכות פתולוגיות המשפיעות על תפקוד המיטוכונדריה וחופפות למחלות כרוניות רבות הקשורות לגיל. השיטות הכמותיות הנוכחיות להערכה ישירה של תפקוד המיטוכונדריה הן פולשניות ודורשות בדרך כלל ביופסיית שריר, מה שעלול להוות קשיים בגיוס משתתפים ובהיענות למחקר, בהתחשב ברמות הנתפסות של כאב וסיכון פוטנציאליים. לפיכך, הותאם פרוטוקול חדשני ולא פולשני יחסית להערכת שינויים בתפקוד המיטוכונדריה ברמה התאית ובדפוסים הצירקדיים אצל מבוגרים. באופן ספציפי, מנתח שטף מטבולי בזמן אמת משמש להערכת התפקוד הביו-אנרגטי המיטוכונדריאלי של תאי דם לבנים תחת זמינות מצע דיפרנציאלי.
הביטוי של גנים של שעון ביולוגי בתאי דם לבנים כדי להצליב עם הביו-אנרגטיקה המיטוכונדריאלית ותוצאות השעון הביולוגי מנותח גם הוא. מאמינים כי גישות מתודולוגיות חדשניות אלה יסייעו לניסויים קליניים עתידיים על ידי מתן שיטות זעיר פולשניות לחקר העדפת מצע מיטוכונדריאלי ומקצבים צירקדיים במבוגרים.
Introduction
ההתקדמות במאה האחרונה הובילה לעלייה בתוחלת החיים ובאוכלוסיית המבוגרים המזדקנים. במבט לעתיד, אחוז המבוגרים בני 65 ומעלה צפוי לעלות ב-5% בין השנים 2020 ל-2050 בארצות הברית1. עלייה זו בתוחלת החיים אינה מרמזת על עלייה בתוחלת החיים - תקופת החיים הקשורה לתפקוד עצמאי. המציאות היא שההזדקנות מלווה באינספור שינויים ביולוגיים המשפיעים על חילוף החומרים והפיזיולוגיה של התאים, ומייצרים ירידה הדרגתית בתפקוד הקוגניטיבי והפיזי 2,3. ככל שתוחלת החיים האנושית ממשיכה לעלות, יש צורך גדול יותר לשמר יכולת תפקודית ועצמאות בגיל4.
ידוע זה מכבר כי הירידה בתפקוד הגופני ובעצמאות עם הגיל היא רב-גורמית, אם כי היא קשורה לעתים קרובות להופעת מחלות כרוניות ואירועי הסתה חריפים5. לעומת זאת, הוכח כי ירידות אלה בביצועים הגופניים ובמאפייני השרירים קשורות להתפתחות נכות עם הגיל ללא קשר ברור למחלה אחת6. עם הקשיים לדעת את האטיולוגיה המדויקת של מחלות כרוניות ונכות פיזית, ליקויים בתפקוד המיטוכונדריה חשבו כי הם חופפים להופעה והתקדמות של מחלות כרוניות ואובדן תפקוד גופני אצל מבוגרים מזדקנים 7,8.
המיטוכונדריה מספקת את רוב האדנוזין טריפוספט (ATP), הדרוש לתהליכים תאיים רבים9. רקמות חמצון מאוד מסתמכות על מיטוכונדריה לייצור אנרגיה נאות; עם ההזדקנות, יכולת החמצון וירידה בסינתזת ATP המיטוכונדריאלית. ירידה זו נובעת בחלקה מנזק חמצוני ל-DNA המיטוכונדריאלי (mtDNA), המביא להצטברות מצטברת של מוטציות ומחיקות mtDNA10. הצטברות של מוטציות ומחיקות mtDNA גורמת לירידה בהיווצרות חלבוני שרשרת הובלת אלקטרונים פונקציונליים, ובכך גורמת ליכולת מופחתת של תאים לייצר ATP. הירידה הקשורה לגיל בתפקוד המיטוכונדריה בולטת ביותר ברקמות חמצון מאוד, כגון הלב ושריר השלד11. מחקרים הראו כי המיטוכונדריה של שריר הגסטרוקנמיוס בדגימות חולדות מבוגרות מציגה ירידה של כ-50% בייצור ותכולת ה-ATP בהשוואה לדגימות צעירות יותר12. יתר על כן, הוכח כי יכולת ייצור ה-ATP המיטוכונדריאלי בשרירי השלד האנושי פוחתת בכ-8% לעשור של חיים13. ממצאים אלה מצביעים על כך שירידות תלויות גיל בתפקוד המיטוכונדריה עשויות לתרום לירידה בייצור האנרגיה באורגניזמים.
מווסת מרכזי של פעילות המיטוכונדריה נחשב לקולטן המופעל על ידי פרוקסיזום γ (PPARγ) coactivator-1 (PGC-1α)14. הידרדרות בפעילות PGC-1α או ירידה בשכיחותו מובילה לירידה בפעילות החמצון המיטוכונדריאלית וכתוצאה מכך לפגיעה בייצור האנרגיה. יתר על כן, ירידה באיכות המיטוכונדריה עלולה להשפיע על איכות שרירי השלד ובהמשך להוביל להתפתחות או החמרה של סרקופניה, דינפניה וירידה ביכולת התפקודית15,16. עדויות לירידה מקבילה הקשורה לגיל בתפקוד המיטוכונדריה ובאיכות שרירי השלד מצביעות על קשר בין פגיעה במיטוכונדריה לפתוגנזה של ירידה תפקודית17. לאחרונה, זה אושר בקרב קשישים מתפקדים המתגוררים בקהילה, מה שמראה כי הפחתה בחילוף החומרים של שרירי השלד במיטוכונדריה מנבאת ירידה בניידות באוכלוסייה זו18. למרות שהמנגנון המדויק המוביל לירידה במיטוכונדריה עם הגיל אינו ברור, עדויות עדכניות הדגישו יחסי גומלין בין השעון הביולוגי לתפקוד המיטוכונדריה, עם השלכות על ניצול דלק מיטוכונדריאלי וביוגנזה19.
ניצול דלק
נראה כי תפקוד המיטוכונדריה מושפע מחילוף החומרים של הדלק וסוג הדלק המשמש ברמה התאית ברקמת שריר השלד11. בתקופות של דלדול דלק, במיוחד דלדול פחמימות בבני אדם, העדפת הדלק לייצור אנרגיה (מיטוכונדריאלית) משתנה. ברמות גלוקוז נמוכות, העדפת הדלק עוברת מגלוקוז לחומצות שומן וגופי קטון שמקורם בחומצה. מתג מטבולי זה מסומן על ידי ויסות יתר של חילוף החומרים של השומנים באדיפוציטים ואחריו שחרור מוגבר של קטונים לדם4. נראה כי למעבר בניצול הדלק מגלוקוז לקטונים עם דיאטה קטוגנית יש השפעה מיטיבה על ייצור מיני חמצן פעילים במיטוכונדריה, הגנה נוגדת חמצון, סינתזת ATP וביוגנזה20.
המעבר המטבולי ממטבוליזם של פחמימות לשומנים מתרחש בתקופות של זמינות נמוכה של חומרים מזינים סביבתיים וכאשר מאגרי הגליקוגן התרוקנו. כאשר מתג זה מופעל, טריגליצרידים מאוחסנים מתפרקים לגליצרול, מצע לגלוקונאוגנזה, וחומצות שומן חופשיות, המועברות לכבד כדי להתחמצן באמצעות חמצון β לאצטיל קו-אנזים A (אצטיל CoA). גופי קטון מסונתזים, בעיקר בכבד, על ידי עיבוי דו-שלבי של שלוש מולקולות אצטיל CoA ל-β-הידרוקסי-β-מתילגלוטריל-CoA, אשר לאחר מכן מעובדים עוד יותר לגופי קטון, כולל אצטואצטט ו-3-βeta הידרוקסיבוטיראט21. גופי קטון אלה מופצים לרקמות בכל הגוף, כאשר הצריכה הגבוהה ביותר מתרחשת בלב, במוח ובשרירי השלד21. עם ההזדקנות, חמצון חומצות השומן המיטוכונדריאליות נפגע, ובכך משפיע על המתג המטבולי22. הוצע כי ליקויים בניצול הדלק המיטוכונדריאלי מובילים לתפקוד לקוי נוסף של המיטוכונדריה, אשר בתורו תורם למחלות הקשורות לגיל ולירידה תפקודית23.
שינויים בצריכת החמצן המיטוכונדריאלית של תאים חד-גרעיניים בדם היקפי (PBMCs) נחקרו כדי להעריך את הדפוסים הקשורים לתפקוד לקוי וכלי דם. הרטמן ועמיתיו ערכו מחקר שמטרתו לקבוע את המתאם בין צריכת חמצן להתרחבות בתיווך מגוון, שנמצא כמצביע על קשר בין תפקוד לקוי של המיטוכונדריה לתפקוד לקוי של תאי השריר החלקבכלי הדם 24. לגבי איברים אחרים, PBMCs נמצאו בקורלציה עם תפקוד קוגניטיבי ומוחי גבוה יותר, כפי שנקבע על ידי רספירומטריה25. לפיכך, ביו-אנרגטיקה ויכולת נשימה של PBMC יכולים לשמש כסמנים ביולוגיים פוטנציאליים להערכת היכולת התפקודית של איברים או רקמות בכל הגוף.
שעון ביולוגי
גורם חשוב נוסף המשפיע על בריאות המיטוכונדריה הוא השעון הביולוגי. מקצבים צירקדיים הם תנודות של ~24 שעות בהתנהגות ובפיזיולוגיה המתרחשות בהיעדר רמזים סביבתיים26. מקצבים אלה מתפקדים בצורה מנבאת כדי לתמוך בהומאוסטזיס של המערכת והרקמות. המנגנון העומד בבסיס השעון הביולוגי הוא לולאת משוב שעתוק-תרגום הנקראת השעון הביולוגי27. הוכח במהלך 15 השנים האחרונות כי מנגנון השעון הביולוגי קיים כמעט בכל התאים בגוף28. בנוסף לשמירת הזמן, מנגנון השעון המולקולרי תורם גם לתוכנית יומית של ביטוי גנים, המכונה פלט שעון ביולוגי29. הגנים של פלט השעון הם ייחודיים לכל סוג רקמה וקשורים מבחינה תפקודית למסלולים החשובים לחילוף חומרים של תאים, אוטופגיה, תיקון והומאוסטזיס. עדויות עדכניות הראו כי בריאות המיטוכונדריה תלויה בתפקוד השעון הביולוגי ומשפיעה על תפקוד המיטוכונדריה, כולל ביוגנזה מיטוכונדריאלית, ניצול דלק ומיטופאגיה30.
עדויות מתפתחות במחקרים פרה-קליניים וקליניים הוכיחו כי במהלך ההזדקנות, ישנן הפרעות בשעון הביולוגי31. אלה כוללים שיבושים במחזורי שינה וערות רגילים, משרעת מופחתת במקצבי טמפרטורת הליבה של הגוף, ויכולת הסתגלות מאוחרת לשינויים בשלב31. מחקר אחד, למשל, אתגר את המערכת הצירקדית של עכברים בוגרים וזקנים (20+ חודשים) על ידי הזזת לוח הזמנים של האור ב-6 שעות. נמצא כי לעכברים הישנים לקח זמן רב יותר לאמן מחדש את דפוסי הפעילות שלהם ללוח הזמנים החדש32. בהתאם לשינויים בהתנהגות הצירקדית, ניתוח שעוני הרקמה מצא כי שעוני הרקמה המרכזיים וההיקפיים נפגעו בקבוצת ההזדקנות.
לאחרונה, מספר קבוצות ביצעו ניתוח טרנסקריפטומי של השעון הביולוגי ותפוקת השעון על פני רקמות שונות בגיל33. תוצאות המחקרים הללו מדגישות שיש תכנות מחדש בקנה מידה גדול של תפוקת השעון הביולוגי עם הגיל. משמעות הדבר היא שלמרות ששעון הליבה שומר על פונקציית תזמון, הגנים המיועדים לביטוי יומיומי שונים במידה רבה. לדוגמה, שני מחקרים אספו ביופסיות שריר מנבדקים אנושיים כל 4 שעות במשך 24 שעות, התוצאות קבעו כי השיא והשפל של ביטוי הגנים בשעון מתהפכים בין מכרסמים ליליים לבני אדם יומיים 34,35,36. זה מצביע על כך שכאשר משווים את ביטוי גן השעון על סמך שלב פעיל לעומת מנוחה (ולא אור לעומת חושך), דפוסי ביטוי גן השעון בשרירים כמעט זהים בין המינים. מוצע כי שינוי זה הקשור לגיל בתפוקת השעון גורם לליקויים בוויסות המסלולים הכוללים את סימני ההיכר הידועים של ההזדקנות, כגון תפקוד המיטוכונדריה, נזק ותיקון DNA ואוטופגיה37.
רציונל המחקר
הקשר בין תפקוד המיטוכונדריה לירידה בתפקוד הגופני מבוסס היטב. עם זאת, הגורם הבסיסי לתפקוד לקוי של המיטוכונדריה נותר נושא לוויכוח. מחקרים אחרונים מצביעים על כך שניצול דלק תאי ושעון ביולוגי עשויים לשחק תפקיד בתהליך זה. שיטות מסורתיות להערכת תפקוד המיטוכונדריה, כגון מדידת צריכת חמצן מיטוכונדריאלית בדגימת ביופסיה של שריר, נתפסות לעתים קרובות ככואבות ופולשניות, מה שעלול להרתיע השתתפות, במיוחד באוכלוסיות עם מסת שריר נמוכה, כגון מבוגרים שבריריים וסרפניים38.
בהתחשב במגבלות אלה, יש צורך בשיטה פחות פולשנית להערכת שינויים בניצול הדלק התאי ובשעון הביולוגי אצל מבוגרים. מחקר זה נועד להעריך פרוטוקול חדשני, זעיר פולשני, שניתן להשתמש בו כדי להעריך את חילוף החומרים של הדלק ואת השעון הביולוגי באוכלוסייה זו. תוצאות מחקר זה יתרמו להבנה טובה יותר של שינויים הקשורים לגיל והתגובה להתערבויות רפואיות או התנהגותיות, וישמשו מודל למחקרים עתידיים בתחום.
Protocol
נהלים הכוללים משתתפים אנושיים אושרו על ידי ועדת האתיקה של המחקר (מדיניות האתיקה של פלורידה 1.0104) ומועצת הביקורת המוסדית של אוניברסיטת פלורידה.
1. תפקוד מיטוכונדריאלי
- בידוד תאים חד-גרעיניים בדם היקפי (PBMCs)
- אסוף PBMCs באמצעות צינורות איסוף דם מיוחדים של 8 מ"ל (16 מ"מ x 125 מ"מ; מכילים נוגד קרישה נתרן ציטראט 0.1 M או נוגד קרישה נתרן הפרין) (ראה טבלת חומרים).
הערה: צינורות איסוף הדם מכילים אמצעי הפרדת דם המורכב מג'ל פוליאסטר תיקסוטרופי ומדיום שיפוע (ראה טבלת חומרים) כדי לשפר את ההפרדה של תאי דם לבנים. - עבד את צינורות הכנת התאים בנפח 8 מ"ל תוך שעתיים לאחר האיסוף כדי להשיג תוצאות ברות קיימא.
- מערבבים את צינורות איסוף הדם לאחר מילויים בדם (על ידי היפוך עדין או במיקסר) ושומרים בטמפרטורת החדר (RT) למשך שעתיים לכל היותר.
- צנטריפוגה של צינורות איסוף הדם ברוטור מתנדנד מתאים ב-2,000 × גרם למשך 15 דקות (או שווה ערך ל-30,000 גרם-דקה; אל תעלה על 2,000 × גרם) ב-RT.
הערה: צינורות אלה גבוהים יותר מצינור צנטריפוגה רגיל של 15 מ"ל; לכן, יש להקדיש תשומת לב נוספת לשימוש ברוטור הנכון. - שואבים וזורקים למיכל פסולת ביולוגית מסוכנת ~80% משכבת הפלזמה, ואוספים את שכבת התאים מצינור איסוף הדם (באמצעות פיפט העברה) בצינור צנטריפוגה של 15 מ"ל.
הערה: בעת שימוש בצינור של 15 מ"ל, הוסף 7 מ"ל של שכבת תאים ומלא ל-14 מ"ל במי מלח סטריליים עם חוצץ פוספט (PBS). היחס בין תאים ל-PBS צריך להיות 1:1. השתמש במספר צינורות במידת הצורך. מערבבים בעדינות על ידי היפוך. - צנטריפוגה ברוטור מתנדנד החוצה ב-900 × גרם למשך 5 דקות (או שווה ערך ל-4,500 גרם-דקה) ב-RT.
- מבלי להפריע לגלולת התא, שאפו את תמיסת ה-PBS והשליכו אותה למיכל פסולת ביולוגית מסוכנת.
- השעו מחדש את גלולת התא ב-1 מ"ל של מדיום בסיסי (BM; ראה טבלת חומרים) על ידי טריטוציה עדינה. מוסיפים את ה-BM לסך של 10 מ"ל, ומערבבים בעדינות על ידי היפוך. ביצוע ספירת תאים.
- צנטריפוגה את מתלה התא ברוטור מתנדנד החוצה ב-900 × גרם למשך 5 דקות ב-RT.
הערה: כאשר משתמשים בתאים באותו יום להערכה הביו-אנרגטית, המשך לשלב 1.1.10; אם התאים קפואים לאחסון, המשך לשלב 1.1.13. - חשב את נפח מדיום הבדיקה (AM; ראה טבלת חומרים) להשעיה מחדש של כדור התא הבא כדי להשיג את ריכוז התא הרצוי.
הערה: לדוגמה, עבור צפיפות זריעה של 150,000 תאים/באר ב-50 מיקרוליטר, הריכוז הרצוי של תרחיף התאים הוא 3 מיליון תאים/מ"ל. - מבלי להפריע לכדור התא, שאפו את הסופרנטנט והשליכו אותו למיכל פסולת מסוכנת ביולוגית.
- השעו מחדש את כדור התא בעדינות ב-1 מ"ל או פחות מ-AM. הוסף AM לנפח המחושב הכולל עבור ריכוז התאים הרצוי. התאים מוכנים כעת לזריעה בצלחת תרבית תאים מצופה (ראו טבלת חומרים).
הערה: השלבים הבאים מיועדים להקפאת התאים לאחסון (1.1.13-1.1.16) ואינם חלים על ההליך באותו יום. - עבור תאים מקפיאים יש לשאוב את הסופרנטנט מבלי להפריע לכדור התא ולהשליך אותו למיכל פסולת מסוכנת ביולוגית.
- השעו בעדינות את התאים במצע הקפאה (ראה טבלת חומרים) בריכוז הרצוי (5-10 מיליון תאים/מ"ל). Aliquot רצתה נפחים בקריוביאלים מסומנים.
- הקפאה איטית של תרחיף התאים באמצעות מיכל הקפאה (ראה טבלת חומרים) למשך 4 שעות לפחות או לילה בטמפרטורה של -80 מעלות צלזיוס.
- לאחר 4 שעות, או למחרת בבוקר, העבירו את הקריוביאלים לאחסון חנקן נוזלי, שם הם אמורים לשכון בשלב האדים.
- יום לפני המדידה, צפו את תחתיות הבאר של מיקרו-צלחת תרבית תאים (ראו טבלת חומרים) בדבק תאים (ראו טבלת חומרים). הכן את הדבק לפי הוראות היצרן, בריכוז מומלץ של 22.4 מיקרוגרם/מיקרוליטר, על ידי דילול הנפח המתאים של תמיסת מלאי הדבק ב-0.1 M נתרן ביקרבונט (pH 8.0). מרחו 25 מיקרוליטר דבק על כל באר של המיקרו-צלחת של תרבית התאים.
- לאחר 20 דקות, שואבים את הנוזל שנותר מכל באר ושוטפים את הבארות פעמיים עם 200 מיקרוליטר מים סטריליים ומטוהרים. הניחו לצלחת להתייבש בארון הבטיחות הביולוגית (למשך ~2 שעות).
- עוטפים את הצלחת בנייר אלומיניום או מניחים אותה בכלי משני סגור, ושומרים במקרר בטמפרטורה של 4 מעלות צלזיוס.
- אסוף PBMCs באמצעות צינורות איסוף דם מיוחדים של 8 מ"ל (16 מ"מ x 125 מ"מ; מכילים נוגד קרישה נתרן ציטראט 0.1 M או נוגד קרישה נתרן הפרין) (ראה טבלת חומרים).
- הערכה ביו-אנרגטית של PBMCs עם מנתח שטף מטבולי בזמן
הערה: שימוש במנתח שטף ובקורא רב-מצבי (ראה טבלת חומרים), נקבע צפיפות זריעה אופטימלית של 150,000 PBMCs לבאר, ריכוז סופי של 2 מיקרומטר של 2 מיקרומטר וריכוז סופי של Hoechst 33342 של 4 מיקרומטר (עם זמן דגירה של לפחות 20 דקות לאחר ההזרקה).- כדי להרטיב את מחסניות החיישן עם הידרובוסטר, הסר את מחסנית החיישן עם לוחית השירות מהקופסה והנח את "חיישן החיישן למעלה" על הספסל. הכניסו 200 מיקרוליטר של קליברנט (ראה טבלת חומרים) לכל באר של לוחית השירות והניחו את ההידרובוסטר בחוזקה על לוחית השירות, ואחריו את מחסנית החיישן. בדוק והסר בועות אוויר כלואות, והנח באינקובטור 37 מעלות צלזיוס שאינו CO2 למשך הלילה.
- הפעל את מנתח השטף ולאחר מכן פתח את תוכנת ניתוח הבדיקה (ראה טבלת חומרים). הגדר את הטמפרטורה ל-37 מעלות צלזיוס. השאירו את המכשיר דולק למשך הלילה כדי לאפשר ייצוב של הטמפרטורה שנקבעה.
הערה: ניתן לבצע את שלבי התכנות הבאים (1.2.4-1.2.10) יום לפני או ביום הניסוי - כדי לתכנת את קובץ תוכנת ניתוח הבדיקה (ראה טבלת חומרים), פתח את התבנית לבדיקת מתח חמצון מצע. עבור אל הגדרות קבוצתיות, פתח את הכרטיסייה אסטרטגיות הזרקה, ערוך את מבחן המתח של מעכב + תת-שור למבחן מאמץ של אטומוקסיר + תת-שור, והוסף שתי אסטרטגיות הזרקה נוספות: מבחן מאמץ UK5099 + תת-שור ומבחן מאמץ BTPES + תת-שור. בתוך כל אסטרטגיית הזרקה, בתוך חלון מצב ההזרקה, לחץ על A עבור יציאה A והזן את הריכוז הסופי של המעכב המתאים (אטומוקסיר: 4 מיקרומטר; UK5099: 2 מיקרומטר; BTPES: 3 מיקרומטר).
- לחץ על יציאות B, C ו-D, והזן את הריכוזים הסופיים המתאימים (יציאה B: ריכוז אוליגומיצין [1.50 מיקרומטר], יציאה C: FCCP [2.0 מיקרומטר]; יציאה D: רוטנון + אנטימיצין A [0.5 מיקרומטר]). הוסף את Hoechst 33342, 4 μM לחלון התרכובות עבור יציאה D.
- פתח את הכרטיסייה טיפולים מקדימים ובחר טיפולים מקדימים, אם רלוונטי. לדוגמה: ביקורת, ניסיונית, או מקובלת (למשל, בסיס ומעקב). הוסף תיאורים בחלון שמתחת, במידת הצורך.
- פתח את הכרטיסייה Assay Media ומהתפריט הנפתח Media , בחר RPMI Medium, pH 7.4, הזן את מספר האצווה, הצוות המכין את המדיה, זמן ההכנה והתוספים שנוספו למדיה (10 מ"מ גלוקוז, 2 מ"מ גלוטמין, 1 מ"מ פירובט; ראה טבלת חומרים).
- פתח את הכרטיסיה סוג תא והזן מזהה נושא PBMC כשם, PBMC כסוג התא, 150000 כצפיפות הזריעה, מזהה נושא כמקור, צוות שהכין את התאים, תאריך ההכנה ויום הפשרת התא, אם רלוונטי.
- לחץ על צור קבוצות, עבור אל מפת לוחות, והקצה את הבארות של צלחת 96 הבארות לקבוצות המתאימות. שמור על בארות A1, A12, H1 ו-H12 שהוקצו כבארות רקע.
- עבור אל פרוטוקול, סמן את התיבה שיווי משקל (הגדרת ברירת מחדל), והזן את המידע הבא: קו בסיס: חמישה מחזורי מדידה: ערבוב של 3 דקות, המתנה של 0 דקות ומדידה של 3 דקות; מדיה או מעכב (יציאה A): שישה מחזורי מדידה: ערבוב של 3 דקות, המתנה של 0 דקות ומדידה של 3 דקות; אוליגומיצין (יציאה B): שלושה מחזורי מדידה: תערובת של 3 דקות, המתנה של 0 דקות ומדידה של 3 דקות; FCCP (יציאה C): שלושה מחזורי מדידה: תערובת של 3 דקות, המתנה של 0 דקות ומדידה של 3 דקות; רוטנון + אנטימיצין A + Hoechst 33342 (יציאה D): שלושה מחזורי מדידה: ערבוב של 3 דקות, המתנה של 0 דקות ומדידה של 3 דקות.
- ביום ההערכה הביו-אנרגטית, קח את המיקרו-צלחת של תרבית התאים המצופה מהמקרר ואפשר לה להתחמם ל-RT בארון הבטיחות הביולוגית.
- הכן מדיום בדיקה (AM) על ידי ערבוב של 97 מ"ל של BM שחומם מראש ותוספי מזון: 1 מ"ל פירובט (ריכוז סופי: 1 מ"מ), 1 מ"ל גלוקוז (ריכוז סופי 10 מ"מ) ו-1 מ"ל גלוטמין (ריכוז סופי: 2 מ"מ). הנח את ה-AM ב-37 מעלות צלזיוס בחממה שאינה CO2 עד לשימוש.
- כדי לזרוע את התאים, הוסף 50 מיקרוליטר של תרחיף תאים (מ-1.1.12) המכיל 150,000 PBMCs לכל באר, למעט A1, H1, A12 ו-H12 ( שהוקצו כבארות רקע).
קריטי: צפיפות הזריעה האופטימלית נקבעה בעבר. - כסו את לוחית התא במכסה שלה ואפשרו 60 דקות של מנוחה של תאים ב-RT בארון הבטיחות הביולוגית כדי להקל על פיזור אחיד של התאים.
קריטי: הצג את התאים במיקרוסקופ כדי להבטיח חלוקת תאים הומוגנית רצויה על פני הבאר. - להדמיית תאים, הפעל את הקורא הרב-מצבי (ראה טבלת החומרים) כמה שעות לפני הדגירה הראשונה של התא; המתן להשלמת פרוטוקול האתחול של הקורא לפני פתיחת תוכנת ההדמיה (ראה טבלת החומרים). פתח את תוכנת ההדמיה והגדר את טמפרטורת החימום מראש ל-37 מעלות צלזיוס.
- כדי להכין את ריאגנטים לבדיקה, עקוב אחר הוראות ערכת הבדיקה כדי להרכיב מחדש את הריאגנטים, עם שינויים קלים כמתואר בטבלה 1.
קריטי: הריכוזים הסופיים האופטימליים של FCCP ו-Hoechst33342 נקבעו בעבר. - לאחר מנוחת התא של 60 דקות, בדוק את הבארות במיקרוסקופ תרבית תאים ושים לב לכל חריגות הראייה, כגון הצטברות תאים.
- צנטריפוגה את לוחית תרבית התאים ב-RT בצנטריפוגה עם רוטור מתנדנד החוצה למיקרו-פלטות ב-60 × גרם למשך דקה אחת, עם תאוצה מינימלית ומינימום שבירה; סובב שוב את הצלחת והצנטריפוגה בחום של 40 × גרם למשך דקה. הגדר את התאוצה והשבירה למינימום. דגרו על התאים למשך 25-30 דקות בטמפרטורה של 37 מעלות צלזיוס בחממה שאינה CO2 .
הערה: כאשר מתבצעת הדמיית תאים, לוחית התא מודגרת בקורא הרב-מצבי שחומם מראש במקום זאת (ראה טבלת החומרים), ותמונת שדה בהיר מצולמת של כל באר במהלך תקופת הדגירה הזו (דגירה ראשונה של התא). - סרוק את הברקוד של לוחית תרבית התאים עם סורק הברקוד (ראה טבלת חומרים), בחר התחל סריקת Brightfield, הנח את לוחית תרבית התאים על מגש הצלחת והתחל את נסיגת המגש. בחר בארות המכילות תאים לסריקה והתחל את הסריקה.
- במהלך הדגירה הראשונה של התאים, טען את היציאות של מחסנית החיישן עם הריאגנטים, כפי שמצוין בטבלה 1: יציאה (A): 20 מיקרוליטר של AM (בקרות), אטומוקסיר (מעכב הובלת חומצות שומן ארוכות שרשרת למיטוכונדריה), UK 5099 (2-Cyano-3-(1-phenyl-1H-indol-3-yl)-2-propenoic acid; מעכב של נשא פירובט מיטוכונדריאלי), או BPTES (Bis-2-(5-phenylacetamido-1, 3,4-תיאדיאזול-2-יל)אתיל סולפיד; מעכב המרת גלוטמין לגלוטמט); יציאה (B): 22 מיקרוליטר של אוליגומיצין (מעכב ATP סינתאז); יציאה (C): 25 מיקרוליטר של FCCP (מפרק קרבוניל ציאניד-4 (טריפלואורומטוקסי) פנילהידרזון); יציאה (D): 27 מיקרוליטר של רוטנון/אנטימיצין A/Hoechst 33342 (מעכבים של קומפלקס מיטוכונדריאלי I ו-III, בהתאמה, וצבע גרעיני). החזר את מחסנית החיישן לחממה שאינה CO2 של 37 מעלות צלזיוס למשך 5 דקות נוספות.
הערה: פעל בהתאם להוראות היצרן לטעינת יציאות. - הוציאו את צלחת תרבית התאים מהחממה או מקורא הצלחות לאחר הדגירה הראשונה של התא ולאחר השלמת הדמיית התא (אם רלוונטי), והוסיפו AM חם לכל באר לנפח סופי של 180 מיקרוליטר לבאר. הנח את לוחית התא ב-37 מעלות צלזיוס בחממה שאינה CO2 למשך 15-25 דקות נוספות (דגירה שנייה של תאים).
- התחל את הבדיקה המטבולית על ידי התחלת כיול החיישן במהלך הדגירה השנייה של התא. לחץ על הפעל בדיקה כאשר הבדיקה מוכנה להתחלה עם כיול מחסנית החיישן. כאשר תתבקש, העבר את מחסנית החיישן מהחממה שאינה CO2 של 37 מעלות צלזיוס למגש מנתח השטף והתחל את הכיול. עקוב אחר הנחיית תוכנת ניתוח הבדיקה והחלף את לוחית השירות עבור לוחית התא לאחר השלמת הכיול.
הערה: הכיול אורך כ-20 דקות. - לאחר הבדיקה המטבולית, עקוב אחר הנחיית התוכנה והסר את מחסנית החיישן ואת לוחית התא מהמכשיר. הסר את מחסנית החיישן מלוחית התא וכסה את לוחית התא במכסה שלה.
- לאחר קביעת זמן הדגירה של צבע Hoechst בניסויים ראשוניים, סרוק את הברקוד של הצלחת ופעל לפי הנחיות התוכנה כדי לקבל תמונה פלואורסצנטית של כל באר המכילה תא עם הקורא הרב-מצבי.
הערה: תוכנת ניתוח ההדמיה והבדיקה מתממשקת, ומאפשרת ייבוא של נתוני ספירת התאים לקובץ נתוני ניתוח הבדיקה לצורך נורמליזציה של נתונים לספירת התאים.
2. ביטוי גנים של שעון ביולוגי
הערה: ביטוי המשתתפים של גני שעון מ-PBMCs ייבדק על ידי בידוד RNA באמצעות ערכת הדם RNA (ראה טבלת חומרים).
- משוך 3 מ"ל מדם המשתתף ישירות לתוך צינור RNA (ראה טבלת חומרים) עם 6 מ"ל של ריאגנטים מייצבים. מערבולת למשך 10 שניות לערבוב מלא.
הערה: אם ריאגנטים מייצבים אינם מעורבבים היטב עם דגימת הדם של המשתתף, קיים סיכון מוגבר לטעות במחקר. - העבר 1.0 מ"ל מדגימת הדם המיוצבת לצינור של 15 מ"ל, עם 5 מ"ל של מאגר ליזיס אריתרוציטים. דגירה על קרח למשך 10-15 דקות. מערבולת את הצינור פי 2 במהלך הדגירה. צנטריפוגה את הצינור ב-4 מעלות צלזיוס ב-400 × גרם למשך 10 דקות.
- זהה את הכדור ושפך בזהירות את הסופרנטנט המכיל כדוריות דם אדומות שעברו ליזה. הוסף 2 מ"ל של מאגר ליזה אריתרוציטים (ראה טבלת חומרים), השהה מחדש את התאים, מערבולת לזמן קצר וצנטריפוגה ב-400 × גרם למשך 10 דקות ב-4 מעלות צלזיוס.
- יוצקים את הסופרנטנט ומשאירים את הצינור הפוך על נייר סופג למשך 1-2 דקות. מחק כל נוזל סביב שפת הצינור בנייר נקי לפני השלב הבא.
- הוסף בזהירות 600 מיקרוליטר של מאגר ליזה RNA (ראה טבלת חומרים). בהתאם לפרוטוקול היצרן, הוסף β-מרקפטואתנול והשהה מחדש את הגלולה.
- הכניסו את הליזט ישירות להומוגניזטור חד פעמי של ליזט תאים (ראה טבלת חומרים) עמוד ספין המונח בצינור איסוף של 2 מ"ל וצנטריפוגה למשך 2 דקות במהירות מקסימלית להומוגניזציה. השלך את עמודת הסיבוב החד פעמית של הומוגנייזר ליזט תאים ושמור את הליזט ההומוגני.
- הוסף נפח אחד (600 מיקרוליטר) של 70% אתנול לליזט ההומוגני וערבב על ידי פיפטינג. צנרת בזהירות את הדגימה, כולל כל משקעים שאולי נוצרו, לתוך עמוד סיבוב חדש בצינור איסוף של 2 מ"ל, אך אל תרטיב את השפה. צנטריפוגה ל-15 שניות ב->8,000 × גרם.
- העבר את עמודת הסיבוב (ראה טבלת חומרים) לצינור איסוף חדש של 2 מ"ל. מרחו 700 מיקרוליטר של מאגר כביסה מחמיר (ראה טבלת חומרים) על עמוד הסיבוב והצנטריפוגה למשך 15 שניות ב->8,000 × גרם לכביסה. השלך את הזרימה.
- פתח בזהירות את עמוד הסיבוב והוסף 500 מיקרוליטר של מאגר כביסה עדין (ראה טבלת חומרים). סגור את המכסה והצנטריפוגה במהירות מלאה (20,000 × גרם) למשך 3 דקות.
- העבירו את עמוד הסיבוב לתוך צינור מיקרו-צנטריפוגה בנפח 1.5 מ"ל והזרמו 30-50 מיקרוליטר של מים נטולי RNase ישירות על קרום הסיליקה. צנטריפוגה למשך דקה אחת ב->8,000 × גרם כדי לסלק את ה-RNA. חזור על הפעולה פעם נוספת.
הערה: ניתן לאחסן את ה-RNA בטמפרטורה של -80 מעלות צלזיוס. - בצע טיפול DNase בעמודה באמצעות ערכת DNase נטולת RNase (ראה טבלת חומרים), בהתאם לפרוטוקול היצרן.
- צור cDNA באמצעות 500 ננוגרם של RNA כולל ומערכת תגובת שרשרת פולימראז (PCR) בזמן אמת (ראה טבלת חומרים), על פי פרוטוקול היצרן. יש לדלל את כל דגימות ה-cDNA ביחס של 1:25 במים נטולי RNase ולהשתמש ב-4 מ"ל לביצוע PCR של שעתוק הפוך כמותי (qRT-PCR).
- השתמש בשיטת הוספת פריימר (ראה טבלת חומרים) כדי להשלים qRT-PCR עם 10 מ"מ מכל אחד מהפריימרים המוצגים בטבלה 2. השלם qRT-PCR באמצעות מערכת בזמן אמת (ראה טבלת חומרים).
- לנרמל את רמות ה-mRNA של הגנים שנבחרו באמצעות רמות mRNA Rpl26 . השתמש בשיטת 2-DDCt כדי לחשב את הכימות היחסי.
- כדי לקבוע אם הביטוי של mRNA נתון הפגין תנודה צירקדית, השתמש במבחן מבוסס סבירות LR_rhythmicity39 (באמצעות p≤ 0.01) לזיהוי קצב צירקדי בתנאי ניסוי אחד40.
3. תוכנית ניתוח נתונים
הערה: מלאי רפואי ישמש לסיווג משתתפים על סמך שימוש בתרופות43.
- השתמש במודל ליניארי של השפעות מעורבות, שבו יש לכלול גיל, מין, משקל, גובה, לחץ דם, דופק וגורמי סיכון אחרים כמשתנים משותפים.
- יש לכלול מונח אפקט אקראי כדי להסביר את מתאם הנתונים בתוך הנבדק.
- לצורך התאמת מודל, יש ליישם בחירת משתנה לאחור עם העיקרון ההיררכי.
- מהדגם המותאם, מדוד שינויים מנקודת זמן 1 לנקודת זמן 2, בהינתן כל המשתנים במודל המותאם.
תוצאות
הפרוטוקול המוצע כולל נתונים ראשוניים המשמשים כאימות למתודולוגיה. הפרוטוקול משלב מנתח שטף מטבולי בזמן אמת לבחינת תפקוד המיטוכונדריה וניצול דלק תאי, ומיצוי RNA ו-qRT-PCR לניתוח גנים של קצב צירקדי (למשל, BMAL1, CLOCK, Nfil2, Nr1d1, Dbp, Cry1, Per2).
קצב צריכת החמצן (OCR) של PBMCs אנושיים מבודדים מחמישה משתתפי ביקורת, 10 ימים לאחר ניתוח ראשוני, מוצג באיור 1. הנתונים משמשים להשוואת ערכים לפני ואחרי ומציגים את הערכים הממוצעים עבור נשימה בסיסית, תגובה חריפה, נשימה מקסימלית וקיבולת פנויה לאחר הזרקת בקרה, אטומוקסיר, UK5099 ו-BPTES. יש לציין כי איור 1C מראה תגובה חריפה שלילית משמעותית לאחר הזרקת האטומוקסיר, אך לא נצפו השפעות משמעותיות על נשימה בסיסית, נשימה מקסימלית או קיבולת עודפת.
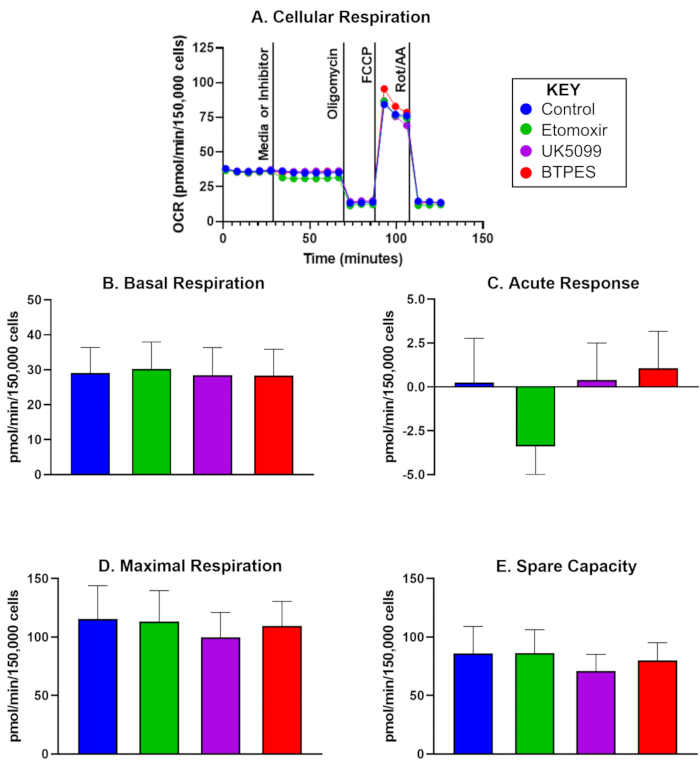
איור 1: צריכת חמצן של תאים חד-גרעיניים מבודדים בדם היקפי אנושי (PBMCs). (A) קצב צריכת חמצן בזמן אמת (OCR; pmol/(min∙150,000 תאים) של PBMCs שבודדו מנבדק ביקורת, נמדד עם מנתח שטף ומוערך באמצעות מבחן חמצון הסובסטרט. התאים נזרעו בצפיפות של 150,000 תאים לבאר. ההזרקה הראשונה הייתה מדיה (בקרה) או מעכב (אטומוקסיר, UK5099, או BPTES; ראה טקסט לפרטים) והתרחשה לאחר מדידת קצב הנשימה התאית הבסיסית. התגובה החריפה למגבלת הסובסטרט המיטוכונדריאלי נקבעה כהבדל של OCR בסיסי לפני ואחרי הזרקת מעכב. אוליגומיצין, מעכב סינתאז ATP, מעכב נשימה משולבת בייצור ATP ומניב נשימה של דליפת פרוטונים. FCCP, הניתוק, גורם לנשימה מקסימלית ולא מצומדת; רוטנון ואנטימיצין A (מעכבי קומפלקס I ו-III, בהתאמה) מעכבים את כל הנשימה מלבד הנשימה הלא מיטוכונדריאלית (ראה טקסט לפרטים). (ב-ה) כימות הנשימה התאית (n = 5; הנתונים מיוצגים כממוצע ± SD). (B) OCR בסיסי לפני הזרקת מעכב, (C) תגובה חריפה למעכב (שינוי ב-OCR ביחס לקצב הבסיסי לפני הזרקת המעכב), (D) OCR מקסימלי, ו-(E) קיבולת פנויה (הבדל בין OCR מקסימלי ל-OCR בסיסי לאחר ההזרקה הראשונה). התגובה החריפה (C) להזרקת אטומוקסיר עשויה להצביע על תלות גבוהה יותר של OCR בחומצת שומן כמצע אנרגיה בתנאים בסיסיים בהשוואה לקבוצות הסובסטרט האחרות, ללא השפעה ניכרת על OCR במהלך דרישת אנרגיה גבוהה (D). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
| תרכובת | AM (μL) נוסף לתרכובת | מלאי (מיקרומטר) | מלאי (μL) למלאי עבודה | AM (μL) עבור מלאי עבודה | מלאי עבודה (μM) | מלאי עבודה (μL) [יציאה] | קונקציה סופית (מיקרומטר) |
| אטומוקסיר | 700 | 160 | 500 | 1500 | 40 | 20 [א] | 4 |
| UK5099 | 700 | 80 | 500 | 1500 | 20 | 20 [א] | 2 |
| BPTES | 700 | 120 | 500 | 1500 | 30 | 20 [א] | 3 |
| Oligo | 420 | 150 | 300 | 2700 | 15 | 22 [ב] | 1.5 |
| FCCP | 720 | 100 | 600 | 2400 | 20 | 25 [ג] | 2 |
| ריקבון/AA/H | 540 | 50 | 300 | 2700 | 5 | 27 [ד] | 0.5 |
טבלה 1: הכנת ריאגנטים לבדיקת חמצון המצע וריכוזי המלאי, העבודה והפתרונות הסופיים. כל הריאגנטים הם חלק ממבחן המתח של מיטו התא או ערכות בדיקת מתח חמצון המצע. קיצורים: oligo = oligomycin; FCCP = מפרק קרבוניל ציאניד-4 (טריפלואורומטוקסי) פנילהידרזון; ריקבון/AA/H = רוטנון/אנטימיצין A/Hoechst 33342. אטומוקסיר, UK5099, BTPES: מעכבי חומצות שומן, גלוקוז וחמצון גלוטמין, בהתאמה.
| צרפת | קדימה – GCACGACGTTCTTTCTTCTGT |
| הפוך – GCAGAAGCTTTTTCGATCTGCTTTTTT | |
| שעון | פורוורד – CGTCTCAGACCCTTCCTCAAC |
| הפוך – GTAAATGCTGCCTGGGTGGA | |
| Cry1 | קדימה – ACTGCTATTGCCCTGTTGGT |
| הפוך – GACAGGCAAATAACGCCTGA | |
| פר1 | פורוורד – ATTCGGGTTACGAAGCTCCC |
| הפוך - GGCAGCCCTTTCATCCACAT | |
| פר2 | קדימה – CATGTGCAGTGGAGCAGATTC |
| הפוך – GGGGTGGTAGCGGATTTCAT | |
| Rev-erb α | פורוורד – ACAGATGTCAGCAATGTCGC |
| הפוך - CGACCAAACCGAACAGCATC |
טבלה 2: פריימרים של גנים של שעון ביולוגי.
Discussion
הירידה בתפקוד המיטוכונדריה ובוויסות השעון הביולוגי עם הגיל נתפסים יותר ויותר כגורמים תורמים למחלות הקשורות לגיל. שינוי השעון הביולוגי באמצעות שינויים באורח החיים, כגון תזונה ופעילות גופנית, מייצג אסטרטגיה פוטנציאלית לקידום הזדקנות בריאה ולהפחתת ירידה בניידות הקשורה להזדקנות. עם זאת, השיטות הנוכחיות להערכה ישירה של תפקוד המיטוכונדריה הן פולשניות ולעתים קרובות דורשות ביופסיית שריר, מה שעלול להוות אתגרים בגיוס ושימור משתתפים עקב כאב וסיכונים נתפסים.
הערכת סמנים של בריאות צירקדית ומטבולית באמצעות שיטות פחות פולשניות, כגון איסוף דם, תספק תוצאות חשובות לחקר ובדיקת מטרות טיפוליות במחקרים עתידיים. לשיטות זעיר פולשניות אלה יש פוטנציאל לקדם מאוד את התחום על ידי מתן תובנות חדשות לגבי יחסי הגומלין המורכבים בין השעון הביולוגי לבריאות המטבולית והשפעתם על התפקוד. מטרת מחקר זה היא להעריך את הקשר בין חילוף החומרים של האנרגיה התאית לשעון הביולוגי. בפרט, ניתוח שטף ביו-אנרגטי משמש להערכת תפקוד המיטוכונדריה בתנאי זמינות סובסטרט שונים, יחד עם ניטור ביטוי גנים של קבוצת גנים צירקדיים בתאי הדם הלבנים של המשתתפים. על ידי שימוש בשתי זרועות הניתוח, הביו-אנרגטי וביטוי הגנים, ניתן להשיג הבנה מקיפה של הקשר בין שני התהליכים הבסיסיים הללו.
הניתוח הסטטיסטי של נתוני סדרות זמן אלה מנקודת מבט צירקדית מציע תובנה לגבי העוצמה, הטווח והתזמון של המקצבים הצירקדיים. לסיכום, השילוב של ניתוח ביטוי גנים, ביו-אנרגטיקה תאית ומדדים מטבוליים ברמת האורגניזם מהווה גישה חדשה וחדשנית שתשפוך אור על יחסי הגומלין בין חילוף החומרים האנרגטי למקצבים הצירקדיים בבני אדם.
במחקר פיילוט זיהינו תגובה חריפה ב-OCR של PBMCs להגבלה של ניצול חומצות שומן (בעקבות הזרקת אטומוקסיר, מעכב של קרניטין פלמיטואיל טרנספראז 1a). ממצא זה מצביע על כך שב-PBMCs מקבוצה מסוימת זו של משתתפים, עשויה להיות תלות בחומצות שומן כמצע אנרגיה במהלך הנשימה הבסיסית. עם זאת, הנשימה המקסימלית לא הושפעה, מה שמרמז על כך שמקורות אנרגיה חלופיים, כגון גלוקוז וגלוטמין, עשויים לפצות על ניצול מופחת של חומצות שומן במהלך דרישת אנרגיה גבוהה. מחקרים עתידיים צריכים לחקור האם א) ביו-אנרגטיקה של PBMCs משקפת את האנרגטיקה של כל הגוף ו-ב) האם התערבויות כגון אכילה מוגבלת בזמן יכולות להשפיע על העדפות מצע האנרגיה.
ישנם מספר שלבים קריטיים הנוגעים לניתוח השטף של PBMCs. ראשית, לפני הערכת דגימות הניסוי, יש לייעל את צפיפות זריעת התאים (תאים לבאר) על ידי הקפדה על התפלגות אחידה רציפה של תאים בתוך כל באר ועל פני כל צלחת, יש לייעל את ריכוז ה-FCCP הסופי על ידי הפעלת ריצות בדיקת ריכוזים באמצעות הריכוזים 0, 0.125, 0.25, 0.5, 1.0 ו-2.0 מיקרומטר, ובמידת הצורך, יש לבצע אופטימיזציה של צביעת Hoechst 33342 על ידי ביצוע הוראות היצרן. שנית, הנורמליזציה של הנתונים המטבוליים לפרמטרים תאיים היא קריטית להשוואת הנתונים בין ניסויים. בפרוטוקול הנוכחי מתוארת ספירת תאים לאחר סיום בדיקת מנתח השטף באמצעות תאים מוכתמים Hoechst 33342 ומכשיר הדמיית תאים. אם מכשיר מתאים אינו זמין, ניתן ליישם שיטות נורמליזציה חלופיות, כגון חלבון סלולרי כולל או תכולת DNA גרעינית לכל באר. יש שינוי בולט שניתן להשתמש בו בתוך הפרוטוקול, בהשוואה לאלה שהוצעו. באופן ספציפי, ניתן להשלים את הפרוטוקול באמצעות ערכת בדיקה בודדת עבור כל אחד משלושת המעכבים, בהשוואה לשתי הערכות המוצעות כאן בלבד (ראה טבלת חומרים).
השימוש ב-PBMCs כתחליף לחקר יחסי הגומלין בין חילוף חומרים אנרגטי ומקצבים צירקדיים אצל מבוגרים מוגבל על ידי ההנחה שתגובתם לטיפול יכולה לשקף במדויק את התגובה ברקמות ואיברים אחרים. למרות שגישה זו היא חדשנית וזעיר פולשנית, חשוב להכיר בכך שרקמות ואיברים שונים, כגון המוח, הכבד ושרירי השלד, עשויים להגיב בצורה שונה בתנאים שונים. מחקר פרה-קליני הראה כי ביטוי גן השעון השתנה בעכברים שניזונו וצמים, מה שהוביל לוויסות חלקי של גנים המכוונים ל-BMAL1 ברקמת הכבד והשריר, אך לוויסות מופחת של אחרים41. רקמות ואיברים היקפיים אלה מייצגים מאוד תהליכים מטבוליים ויכולים להיות מושפעים מרמזים סביבתיים המשפיעים על מנגנוני ביטוי גנים של שעון42. יש צורך במחקר נוסף כדי להבין באופן מלא את הקשר בין רקמות היקפיות, איברים והשעון הביולוגי המרכזי.
מגבלה נוספת היא שהמשתתפים אינם נפסלים על נטילת מרשם כלשהו, מה שעלול להוות מגבלות על ניתוח סטטיסטי. כדי לנטרל מגבלה זו, במחקר עתידי, ייעשה שימוש במלאי רפואי, אשר אומת באוכלוסיות של מבוגרים הנוטלים תרופות43. המשתתפים יסווגו על סמך התרופות המומלצות שנרשמו בסעיף סקירת הנתונים של הפרוטוקול. ישנן בסך הכל שלוש קטגוריות, מבחינת תרופות שהוכחו כ-1) מאיצות ירידה תפקודית, 2) ירידה תפקודית איטית ו-3) משפיעות על תפקוד שרירי השלד.
לבסוף, יכולת החמצון המיטוכונדריאלית של שרירי השלד האנושיים אכן מציגה קצב יום-לילה, שמגיע לשיא בין 18:00 ל-23:00 ויורד בין 08:00 ל-11:00 בבוקר44. עדיין לא ברור אם זה נכון לגבי יכולת החמצון המיטוכונדריאלית של PBMCs. עם זאת, נתונים ראשוניים מצביעים על כך ש-PBMCs ומטבוליזם מיטוכונדריאלי קשורים45. בהתחשב בכך שהמידע על ביופסיות שריר והשינויים ב-PBMCs אינו ברור כל כך, יש לנקוט משנה זהירות בעת ניתוח התוצאות. בהתחשב במגבלה זו, חשוב לזכור מידע זה בעת הערכה ופיתוח פרוטוקול, מכיוון שהוא עשוי לספק הקשר ותובנה חשובים שיכולים לסייע בהבטחת התוקף והיעילות של הפרוטוקול.
למיטב ידיעתנו, אף מחקר קודם לא העריך את דפוסי ניצול הדלק או השעון הביולוגי באמצעות השיטות המוצעות בפרויקט זה. מטרתנו היא לבחון את ההיענות של סמנים של ניצול דלק מיטוכונדריאלי ובריאות הצירקדית לשינויים. מחקר זה מציג שיטה זעיר פולשנית למדידת סמן ביולוגי רגיש ביותר, שיכולה לשמש כחלופה במחקרים התערבותיים עתידיים שבהם ביופסיית שריר אינה אפשרית.
Disclosures
למחברים אין ניגודי אינטרסים לחשוף.
Acknowledgements
מחקר זה מומן על ידי מרכז העצמאות של האמריקאים המבוגרים (NIH/NIA P30AG028740), בסיוע המכון למדע קליני ותרגומי (NIH/NCRR UL1TR000064).
Materials
| Name | Company | Catalog Number | Comments |
| Agilent Technologies Cell Imaging | Agilent Technologies | Cell image software | |
| Agilent/Seahorse Wave desktop program | Agilent Technologies | 5994-0039EN | Software used to analyse data from the celluar analyser and stress test assay |
| Agilent/Seahorse XFe96 Flux Analyzer | Agilent Technologies | S7800B | Real-time cellular flux analyzer; flux analyser |
| Bar Code Reader | Agilent Technologies | G2615-90007 | |
| Seahorse Wave Desktop Software | Agilent technologies | Data acquisition software; assay analysis; wave program | |
| Seahorse XF 1.0 M Glucose solution | Agilent Technologies | 103577-100 | Supplement to basal medium to make assay medium |
| Seahorse XF 100 mM Pyruvate solution | Agilent Technologies | 103578-100 | Supplement to basal medium to make assay medium |
| Seahorse XF 200 mM Glutamine solution | Agilent Technologies | 103579-100 | Supplement to basal medium to make assay medium |
| Seahorse XF Cell Mito Stress Test | Agilent Technologies | 103015-100 | Mitochondrial bioenergetic function assay |
| Seahorse XF Mito Fuel Flex Test | Agilent Technologies | 103260-100 | Mitochondrial bioenergetic function assay |
| Seahorse XF RPMI Medium | Agilent Technologies | 103576-100 | Basal medium for PBMCs |
| Seahorse XFe96 FluxPak mini | Agilent Technologies | 102601-100 | Sensor cartridges and cell culture microplates |
| Cytation 1 Cell Imaging Multi-Mode Reader | Agilent/BioTek | Multimode reader to image cells | |
| CPT Sodium Heparin Tube, 16 x 125 mm x 8.0 mL | Becton Dickinson | 362753 | Blood collection tubes for isolation of peripheral blood mononuclear cells |
| CellTak Cell and Tissue Adhesive | Corning | 354240 | Cell adherent to coat cell culture microplate |
| Phosphate Buffered Saline | Corning | 21-040-CV | Buffer to wash blood cells |
| Ficoll Paque Plus | Cytiva | GE17-1440-02 | Gradient medium |
| Lunar Prodigy DXA scanner | General Electric | EN 60601-2-7 5.1 | Whole body lean mass and fat/lean tissue mass ratio |
| Freezing container, Nalgene Mr. Frosty | MilliporeSigma | C1562 | Freezing container used to slow-freeze cell suspension |
| Buffer EL. | Qiagen | 79217 | Erythrocyte lysis buffer |
| Buffer RLT | Qiagen | 79216 | RNA lysis buffer |
| Buffer RPE | Qiagen | 1018013 | Mild washing buffer |
| Buffer RW1 | Qiagen | 1053394 | Stringent washing buffer |
| QIAamp DNA Micro Kit | Qiagen | 56304 | DNA preps: QIAamp MinElute Columns, Proteinase K, Carrier RNA, Buffers, Collection Tubes (2 ml) |
| QIAamp RNA Blood Mini Kit | Qiagen | 52304 | RNA blood kit; Used to isolate RNA |
| QIAshredder | Qiagen | 79656 | disposable cell-lysate homogenizers |
| RNase-Free DNase Set | Qiagen | 79254 | Used to perform DNA digest |
| 2-Mercaptoethanol (Reagent) | Thermo Fisher Scientific | MFCD00004890 | |
| 2-mL collection tubes, 100 count | Thermo Fisher Scientific | AM12480 | |
| Fast SYBR Green Master Mix | Thermo Fisher Scientific | 4385612 | Primers are added to this and used to carry out qRT-PCR |
| Microcentrifuge Tubes, 1.5 mL | Thermo Fisher Scientific | 69715 | Used to hold RNA purification filter during RNA purification |
| Narrow p1000 pipette tips | Thermo Fisher Scientific | 02-707-402 | |
| QuantStudio 3 Real-Time PCR System, MiniAmp Plus Thermal Cycler, and 96-Well Plates Package | Thermo Fisher Scientific | A40393 | |
| Tempus Blood RNA Tube | Thermo Fisher Scientific | 4342792 | RNA Tube |
| Tempus Spin RNA Isolation kit | Thermo Fisher Scientific | 4380204 | RNA extraction and isolation |
References
- UN Department of Economic and Social Affairs. Population Division 2019, World Population Prospects. UN Department of Economic and Social Affairs. , (2019).
- Anton, S., Leeuwenburgh, C. Fasting or caloric restriction for healthy aging. Experimental Gerontology. 48 (10), 1003-1005 (2013).
- Dziechciaż, M., Filip, R. Biological psychological and social determinants of old age: Bio-psycho-social aspects of human aging. Annals of Agricultural and Environmental Medicine. 21 (4), 835-838 (2014).
- Anton, S. D., et al. Flipping the metabolic switch: understanding and applying the health benefits of fasting. Obesity. 26 (2), 254-268 (2018).
- Fried, L. P., Guralnik, J. M. Disability in older adults: evidence regarding significance, etiology, and risk. Journal of the American Geriatrics Society. 45 (1), 92-100 (1997).
- Manini, T. Development of physical disability in older adults. Current Aging Science. 4 (3), 184-191 (2011).
- Chung, H. Y., et al. Molecular inflammation: underpinnings of aging and age-related diseases. Ageing Research Reviews. 8 (1), 18-30 (2009).
- Sun, N., Youle, R. J., Finkel, T. The mitochondrial basis of aging. Molecular Cell. 61 (5), 654-666 (2016).
- Tarasov, A. I., Griffiths, E. J., Rutter, G. A. Regulation of ATP production by mitochondrial Ca2. Cell Calcium. 52 (1), 28-35 (2012).
- Chistiakov, D. A., Sobenin, I. A., Revin, V. V., Orekhov, A. N., Bobryshev, Y. V. Mitochondrial aging and age-related dysfunction of mitochondria. Biomed Research International. 2014, 238463 (2014).
- Boengler, K., Kosiol, M., Mayr, M., Schulz, R., Rohrbach, S. Mitochondria and ageing: role in heart, skeletal muscle and adipose tissue. Journal of Cachexia, Sarcopenia, and Muscle. 8 (3), 349-369 (2017).
- Drew, B., et al. Effects of aging and caloric restriction on mitochondrial energy production in gastrocnemius muscle and heart. American Journal of Physiology Regulatory, Integrative and Comparative Physiology. 284 (2), R474-R480 (2003).
- Short, K. R., et al. Decline in skeletal muscle mitochondrial function with aging in humans. Proceedings of the National Academy of Sciences. 102 (15), 5618-5623 (2005).
- Musci, R. V., Hamilton, K. L., Miller, B. F. Targeting mitochondrial function and proteostasis to mitigate dynapenia. European Journal of Applied Physiology. 118 (1), 1-9 (2018).
- Picca, A., et al. Targeting mitochondrial quality control for treating sarcopenia: lessons from physical exercise. Expert Opinion on Therapeutic Targets. 23 (2), 153-160 (2019).
- Fernandez-Marcos, P. J., Auwerx, J. Regulation of PGC-1α, a nodal regulator of mitochondrial biogenesis. The American Journal of Clinical Nutrition. 93 (4), 884-890 (2011).
- Kim, Y., Triolo, M., Hood, D. A. Impact of aging and exercise on mitochondrial quality control in skeletal muscle. Oxidative Medicine and Cellular Longevity. 2017, 3165396 (2017).
- Wang, H., Hiatt, W. R., Barstow, T. J., Brass, E. P. Relationships between muscle mitochondrial DNA content, mitochondrial enzyme activity and oxidative capacity in man: alterations with disease. European Journal of Applied Physiology and Occupational Physiology. 80 (1), 22-27 (1999).
- Tian, Q., et al. Muscle mitochondrial energetics predicts mobility decline in well-functioning older adults: The baltimore longitudinal study of aging. Aging Cell. 21 (2), e13552 (2022).
- Sardon Puig, L., Valera-Alberni, M., Cantó, C., Pillon, N. J. Circadian rhythms and mitochondria: connecting the dots. Frontiers in Genetics. 9, 452 (2018).
- Gano, L. B., Patel, M., Rho, J. M. Ketogenic diets, mitochondria, and neurological diseases. Journal of Lipid Research. 55 (11), 2211-2228 (2014).
- Liesa, M., Shirihai, O. S. Mitochondrial dynamics in the regulation of nutrient utilization and energy expenditure. Cell Metabolism. 17 (4), 491-506 (2013).
- Lesnefsky, E. J., Chen, Q., Hoppel, C. L. Mitochondrial metabolism in aging heart. Circulation Research. 118 (10), 1593-1611 (2016).
- Hartman, M. L., et al. Relation of mitochondrial oxygen consumption in peripheral blood mononuclear cells to vascular function in type 2 diabetes mellitus. Vascular Medicine. 19 (1), 67-74 (2014).
- Mahapatra, G., et al. Blood-based bioenergetic profiling is related to differences in brain morphology in African Americans with Type 2 diabetes. Clinical Science. 132 (23), 2509-2518 (2018).
- Moore-Ede, M. C. Physiology of the circadian timing system: predictive versus reactive homeostasis. The American Journal of Physiology. 250 (5), R737-R752 (1986).
- Young, M. W. Life's 24-hour clock: molecular control of circadian rhythms in animal cells. Trends in Biochemical Sciences. 25 (12), 601-606 (2000).
- Yoo, S. H., et al. PERIOD2::LUCIFERASE real-time reporting of circadian dynamics reveals persistent circadian oscillations in mouse peripheral tissues. Proceedings of the National Academy of Sciences. 101 (15), 5339-5346 (2004).
- Zhang, R., Lahens, N. F., Ballance, H. I., Hughes, M. E., Hogenesch, J. B. A circadian gene expression atlas in mammals: implications for biology and medicine. Proceedings of the National Academy of Sciences. 111 (45), 16219-16224 (2014).
- de Goede, P., Wefers, J., Brombacher, E. C., Schrauwen, P., Kalsbeek, A. Circadian rhythms in mitochondrial respiration. Journal of Molecular Endocrinology. 60 (3), R115-R130 (2018).
- Hood, S., Amir, S. The aging clock: circadian rhythms and later life. The Journal of Clinical Investigation. 127 (2), 437-446 (2017).
- Sellix, M. T., et al. Aging differentially affects the re-entrainment response of central and peripheral circadian oscillators. The Journal of Neuroscience. 32 (46), 16193-16202 (2012).
- Sato, S., et al. Circadian reprogramming in the liver identifies metabolic pathways of aging. Cell. 170 (4), 664-677 (2017).
- Lundell, L. S., et al. et al. feeding alters lipid and amino acid metabolite rhythmicity without perturbing clock gene expression. Nature Communications. 11 (1), 4643 (2020).
- Perrin, L., et al. Transcriptomic analyses reveal rhythmic and CLOCK-driven pathways in human skeletal muscle. eLife. 7, e34114 (2018).
- Gutierrez-Monreal, M. A., Harmsen, J. -. F., Schrauwen, P., Esser, K. A. Ticking for metabolic health: the skeletal-muscle clocks. Obesity. 28, S46-S54 (2020).
- Wolff, C. A., et al. Defining the age-dependent and tissue-specific circadian transcriptome in male mice. bioRxiv. 42 (1), 111982 (2023).
- Wilson, D., Breen, L., Lord, J. M., Sapey, E. The challenges of muscle biopsy in a community based geriatric population. BMC Research Notes. 11 (1), 830 (2018).
- Ding, H., et al. Likelihood-based tests for detecting circadian rhythmicity and differential circadian patterns in transcriptomic applications. Briefings in Bioinformatics. 22 (6), 224 (2021).
- Ding, Z., Lamb, T. M., Boukhris, A., Porter, R., Bell-Pedersen, D. Circadian clock control of translation initiation factor eIF2α activity requires eIF2γ-dependent recruitment of rhythmic PPP-1 phosphatase in Neurospora crassa. mBio. 12 (3), e00871 (2021).
- Di Francesco, A., Di Germanio, C., Bernier, M., de Cabo, R. A time to fast. Science. 362 (6416), 770-775 (2018).
- Kalfalah, F., et al. Crosstalk of clock gene expression and autophagy in aging. Aging. 8 (9), 1876-1895 (2016).
- Psaty, B. M., et al. Assessing the use of medications in the elderly: methods and initial experience in the cardiovascular health study. Journal of Clinical Epidemiology. 45 (6), 683-692 (1992).
- van Moorsel, D., et al. Demonstration of a day-night rhythm in human skeletal muscle oxidative capacity. Molecular Metabolism. 5 (8), 635-645 (2016).
- Janssen, J. J. E., et al. Extracellular flux analyses reveal differences in mitochondrial PBMC metabolism between high-fit and low-fit females. American Journal of Physiology. Endocrinology and Metabolism. 322 (2), E141-E153 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved