A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
שיטות אופטימליות לקיבוע פני השטח של קולגנים ומבחני קשירת קולגן
* These authors contributed equally
In This Article
Summary
עבודה זו מציגה פרוטוקול אופטימלי לקיבוע וכימות קולגן מסוג I ו-III על גבי מיקרו-פלטות, ואחריו פרוטוקול בדיקת קשירה משופר במבחנה לחקר אינטראקציות קולגן-תרכובת באמצעות שיטת פלואורסצנטיות שנפתרה בזמן. ניתוח הנתונים שלב אחר שלב ופרשנות הנתונים הבאים מסופקים.
Abstract
פיברוזיס מתרחשת ברקמות שונות כתגובה מתקנת לפציעה או נזק. עם זאת, אם מוגזם, פיברוזיס יכול להוביל להצטלקות רקמות ולאי-ספיקת איברים, הקשורים לתחלואה ותמותה גבוהים. קולגן הוא הגורם העיקרי לפיברוזיס, כאשר קולגן מסוג I וסוג III הם הסוגים העיקריים המעורבים במחלות פיברוטיות רבות. בניגוד לפרוטוקולים קונבנציונליים המשמשים לקיבוע חלבונים אחרים (למשל, אלסטין, אלבומין, פיברונקטין וכו'), פרוטוקולים מקיפים לקיבוע סוגים שונים של קולגנים על מנת לייצר ציפויים יציבים אינם זמינים. קיבוע קולגן הוא מאתגר באופן מפתיע, כי תנאי ניסוי מרובים עשויים להשפיע על יעילות הקיבוע, כולל סוג הקולגן, ה-pH, הטמפרטורה וסוג המיקרו-פלטה. כאן, מסופק פרוטוקול מפורט לקיבוע וכימות קולגנים מסוג I ו-III הניתנים לשחזור וכתוצאה מכך ג'לים/סרטים יציבים וניתנים לשחזור. יתר על כן, עבודה זו מדגימה כיצד לבצע, לנתח ולפרש מחקרי קשירה פלואורסצנטיים שנפתרו בזמן במבחנה כדי לחקור את האינטראקציות בין קולגנים ותרכובות קושרות קולגן מועמדות (למשל, פפטיד מצומד לכלאט מתכת הנושא, למשל, יורופיום [Eu(III)]). גישה כזו יכולה להיות מיושמת באופן אוניברסלי ביישומים ביו-רפואיים שונים, כולל תחום ההדמיה המולקולרית לפיתוח בדיקות הדמיה ממוקדות, פיתוח תרופות, מחקרי רעילות תאים, מחקרי התפשטות תאים ובדיקות אימונולוגיות.
Introduction
הצטברות רקמת חיבור סיבית כחלק מתהליך ריפוי הפצעים הטבעי לאחר פגיעה ברקמות ידועה בשם פיברוזיס. עם זאת, אם שקיעת הרקמה הסיבית לא מצליחה להסתיים וממשיכה מעבר למה שנדרש לתיקון רקמות, אז פיברוזיס הופכת להיות מוגזמת 1,2. פיברוזיס מוגזם פוגע בפיזיולוגיה ובתפקוד של האיברים ועלול להוביל לנזק לאיברים ואולי לאי ספיקת איברים 3,4,5. שני גורמים עיקריים לפיברוזיס הם חלבוני המטריצה החוץ-תאית (ECM) קולגן מסוג I וסוג III6. קולגן הוא חלבון מבני המצוי באיברים שונים המהווה כשליש מתכולת החלבון הכוללת בגוף האדם1. ישנם 28 סוגים שונים של קולגנים המזוהים על ידי ריצוף גנום אנושי, והשכיחים ביותר הם הקולגנים הסיביים7. הקולגן הסיבי העיקרי הוא קולגן מסוג I, המספק ל-ECM חוזק מתיחה ועמידות בפני דפורמציה8. קולגן סוג III הוא מרכיב מבני המספק גמישות ומשתלב עם קולגן סוג I. הוא מתבטא במהלך האמבריוגנזה ונמצא באופן טבעי בכמויות קטנות בעור בוגר, בשרירים ובכלי דם9.
סינתזת קולגן in vivo מתחילה בתהליך תוך-תאי בו mRNA מתועתק בגרעין ואז עובר לציטופלזמה, שם הוא מתורגם. לאחר התרגום, השרשרת שנוצרה עוברת שינוי לאחר התרגום ברטיקולום האנדופלזמי, שם נוצר פרו-קולגן (מבשר הקולגן). לאחר מכן פרו-קולגן עובר למנגנון גולגי לשינוי סופי לפני שהוא מופרש לחלל החוץ-תאי10. באמצעות מחשוף פרוטאוליטי, פרו-קולגן הופך לטרופוקולגן. לאחר מכן זה מקושר באמצעות מסלול צולב בתיווך אנזימטי המזרז על ידי האנזים ליזיל אוקסידאז (LOX) או באמצעות מסלול צולב לא מתווך אנזימטי הכולל את תגובת מייארד11. פרוטוקולים לשיבוש קולגן במבחנה מסתמכים בעיקר על יכולתו של קולגן להרכיב את עצמו. קולגן מופק מרקמות על סמך מסיסותו, אשר תלויה במידה רבה במידת הקישור הצולב של סיבי קולגן בודדים7. קולגן סיבי מומס בחומצה אצטית, וסיבים יכולים להשתנות כאשר ה-pH והטמפרטורה מותאמים12. במבחנה, ניתן לראות את הפיברילוגנזה של קולגן כתהליך דו-שלבי7. השלב הראשון הוא שלב הגרעין, שבו סיבי קולגן יוצרים דימרים וסיבי טרימר לפני שהם מסודרים מחדש ליצירת מבנה סלילי משולש. השלב השני הוא שלב הצמיחה, שבו הסיבים מתחילים לצמוח לרוחב וגורמים להיווצרות רצועת D אופיינית, הנצפית בדרך כלל על ידי שינויים בעכירות7. מחקרי מיקרוסקופ כוח אטומי (AFM) גילו גם כי לקולגן מסוג I וסוג III יש מאפיינים שונים (טבלה 1)13.
כדי לחקור את האינטראקציות הנקשרות בין קולגן לתרכובות אחרות, קולגן צריך להיות משותק באופן חוזר לבארות של מיקרו-פלטות. ישנם פרוטוקולים שונים לקיבוע קולגן מסיס 14,15,16. מיקרו-פלטות זמינות מסחרית המצופות מראש בקולגן משמשות בדרך כלל לתרבית תאים. עם זאת, למיקרו-לוחות מצופים מראש יש שכבה דקה מאוד של כמות לא ידועה של קולגן המצופה על הבארות, מה שהופך אותם ללא מתאימים לבדיקות קשירה במבחנה. ישנם מספר אתגרים בעת קיבוע קולגן לבארות הצלחת. אחד האתגרים המרכזיים הוא בחירת סוג מתאים של מיקרו-לוחית, מכיוון שלסוגים שונים של קולגנים (למשל, סוג I ו-III) יש תכונות כימיות שונות, ולכן הם משתקים בצורה יציבה ויעילה יותר בהתאם לחומר של המיקרו-לוחית. אתגר נוסף הוא תנאי הניסוי של פרוטוקול הקיבוע, שכן תהליך הפיברילוגנזה תלוי במספר גורמים, כולל טמפרטורה, pH, ריכוז מלאי הקולגן והריכוז היוני של המאגר7.
לחקר האינטראקציות בין הקולגן (המטרה) לתרכובות אחרות (כלומר, פפטיד מטרה), יש צורך גם לפתח מבחן סינון חזק כדי לחקור את הספציפיות והסלקטיביות של התרכובת כלפי המטרה על ידי מדידת קבוע הדיסוציאציה, Kd. מיקום שיווי המשקל של היווצרות קומפלקס דו-מולקולרי בין חלבון (קולגן) לליגנד מתבטא במונחים של קבוע האסוציאציה Ka, שגודלו פרופורציונלי לזיקה המחייבת. עם זאת, לרוב, ביוכימאים מבטאים קשרי זיקה במונחים של קבוע דיסוציאציה של שיווי משקל, Kd, של הקומפלקס הדו-מולקולרי, המוגדר כ-Kd = 1/Ka (Kd והוא ההופכי של Ka). ככל שערך ה-Kd נמוך יותר, כך חוזק הקישור בין החלבון לליגנד חזק יותר. היתרון בשימוש ב-Kd להשוואת זיקת הקישור של ליגנדים שונים לאותו חלבון (ולהיפך) קשור לעובדה שהיחידות של Kd עבור קומפלקס דו-מולקולרי הן mol/L (כלומר, יחידת ריכוז). ברוב תנאי הניסוי, ערך ה-Kd תואם את ריכוז הליגנד שמוביל לרוויה של 50% של אתרי הקישור הזמינים על המטרה בשיווי משקל17,18. קבוע הדיסוציאציה מופק בדרך כלל על ידי ניתוח התפוסה החלקית של הקולטן (FO), המוגדרת כיחס בין אתרי הקישור התפוסים לסך אתרי הקישור הזמינים, כפונקציה של ריכוז הליגנד. ניתן לעשות זאת בתנאי שקיימת בדיקה אנליטית המסוגלת להבחין ולמדוד את כמות הליגנד הקשור.
ניתן לבצע בדיקות קשירת ליגנד במבחנה בשיטות ביואנליטיות שונות, כולל פוטומטריה אופטית, שיטות רדיוליגנד, ספקטרומטריית מסה פלזמה בצימוד אינדוקטיבי (ICP-MS) ותהודה פלזמון פני השטח (SPR). בין השיטות הפוטומטריות, אלה המבוססות על פליטת פלואורסצנטיות דורשות בדרך כלל תיוג של ליגנדים או חלבונים עם פלואורופורים כדי להגביר את הרגישות ולשפר את גבול הזיהוי של הבדיקה. כלאטים של יוני לנתניד (III) מסוימים, כגון Eu(III), אטרקטיביים מאוד כפלואורופורים מכיוון שיש להם תזוזות סטוקס גדולות, פסי פליטה צרים (המספקים יחס אות לרעש טוב), פוטוהלבנה מוגבלת ואורך חיים ארוך של פליטה. חשוב לציין, המאפיין האחרון מאפשר שימוש בפלואורסצנציה שנפתרה בזמן (TRF) מפלואורופורים Eu(III) כדי לבטל אוטופלואורסצנטיות רקע19. בגרסת הבדיקה האימונולוגית הפלואורסצנטית של לנתניד (DELFIA) המשופרת בדיסוציאציה של בדיקת TRF מבוססת Eu(III), ליגנדים המסומנים בכלאט Eu(III) שאינו זוהר מודגרים עם הקולטן המשותק על מיקרו-לוחות. קומפלקס הליגנד/קולטן המסומן מופרד מהליגנד הלא קשור, והפלואורסצנציה של Eu(III) מופעלת על ידי דיסוציאציה של קומפלקס Eu(III) ב-pH חומצי, ואחריו קומפלקס מחדש עם כלאטור משפר פלואורסצנטי ליצירת קומפלקס Eu(III) מוטבע במיצלה, פלואורסצנטי מאוד20.
ניתן להשיג את שלב הדה-קומפלקסציה באופן סביר עם כלאטורים, כגון דיאתילאנטריאמין פנטאצטט (DTPA), המראים קינטיקה מהירה של דה-קומפלקסציה. עם זאת, קומפלקסים של Eu(III) עם כלאטורים מקרוציקליים מסוימים, כגון DOTA (1,4,7,10-tetraazacyclododecane1,4,7,10-tetraacetic acid) ונגזרותיו המונואמידיות (DO3AAm), מראים יציבות תרמודינמית גבוהה ואינרטיות קינטית גבוהה מאוד. במקרה זה, יש לבצע אופטימיזציה מדויקת של שלבי הפירוק כדי להשיג הפעלה מספקת וניתנת לשחזור של TRF21 מבוסס Eu(III). ראוי לציין כי קומפלקסים של לנתניד (Ln(III))-DOTA ו-Ln(III)-DO3AAm הם אלה הנפוצים ביותר כחומרי ניגוד להדמיה מולקולרית in vivo על ידי טכניקות הדמיית תהודה מגנטית (MRI)22. לפיכך, בדיקת TRF מבוססת Ln(III) היא הכלי הנבחר לחקור במבחנה את זיקת הקישור של בדיקות מולקולריות MRI עם המטרות הביולוגיות המיועדות להן. נכון לעכשיו, חסרים פרוטוקולים מקיפים וניתנים לשחזור לקיבוע קולגן מסוג I וסוג III וצינור הניתן לשחזור לביצוע ניסויי TRF קשירת Eu(III) במבחנה . כדי להתגבר על מגבלות אלה, פותחו שיטות הניתנות לשחזור להרכבה עצמית ולקיבוע קולגן מסוג I וסוג III ויצירת ג'לים וסרטים יציבים, בהתאמה, עם ריכוז מספיק של קולגן הנדרש לבדיקות קשירה במבחנה . מוצג פרוטוקול אופטימלי עבור Eu(III) TRF של קומפלקסים מבוססי Eu(III)-DO3Aam אינרטיים ביותר. לבסוף, מודגמת בדיקת TRF מותאמת למיקרו-צלחת Eu (III) למדידת ה-Kd של ליגנדים המסומנים ב-Eu(III) לקראת קולגן מסוג I וסוג III משותק (איור 1).
Protocol
הערה: כל מידע המוצר המשמש לעבודה זו מוצג בטבלת החומרים.
1. קיבוע קולגן
הערה: ודא שלכל באר במיקרופלייט המשמשת במהלך בדיקת הכריכה יש בארות סמוכות פנויות כדי למנוע פלואורסצנטיות צולבת. בצעו את החלק הזה של הפרוטוקול על קרח מכיוון שקולגן מתאסף מעצמו בטמפרטורות עולות וברמות ה-pH. בצע הליך זה במכסה המנוע של תרבית רקמות ובתנאים סטריליים מכיוון שהמיקרו-פלטות מודגרות לאחר מכן בחממת תרבית רקמות (TC).
- אימוביליזציה של קולגן מסוג I על המיקרו-לוחות של 96 בארות (איור 2)
יום 1- הכינו מגש סיליקון עם קרח. הניחו את הבקבוקון המכיל קולגן מסוג I, מי מלח קרים פי 10 עם חוצץ פוספט (PBS), ואת המיקרו-פלטות על קרח, ורססו הכל באתנול 70%. הנח את החומר מתחת למכסה המנוע TC.
- לנטרל את הקולגן באמצעות נפחים שווים של קולגן מסוג I ו-10x PBS (pH 7.4).
- הפוך את התמיסה כמה פעמים, וודא שלא ייווצרו בועות.
- הוסיפו 100 מיקרוליטר של הקולגן המנוטרל לכל באר אחרת ולכל שורה אחרת של המיקרופלייט, ודגרו בטמפרטורה של 37 מעלות צלזיוס למשך 18-20 שעות כדי לאדות את הקולגן עד ליובש.
יום 2 - שטפו את המיקרו-פלטות עם 100 מיקרוליטר של 1x PBS, pH 7.4, פעמיים כדי להסיר קולגן לא קשור.
- העבירו את המיקרו-פלטות לתוך החממה בטמפרטורה של 37 מעלות צלזיוס למשך שעתיים נוספות לייבוש לפני השימוש בהן לניסויי קשירה נוספים.
- אימוביליזציה של קולגן מסוג III על המיקרו-לוחות של 96 בארות (איור 3)
יום 1- הכינו מגש סיליקון עם קרח. הניחו את הבקבוקון המכיל קולגן מסוג III, את ה-PBS הקר פי 10 ואת המיקרו-פלטות על קרח, ורססו הכל באתנול 70%. הנח את החומר מתחת למכסה המנוע TC.
- לנטרל את הקולגן באמצעות נפחים שווים של קולגן מסוג III ו-10x PBS (pH 7.4).
- הוסיפו 70 מיקרוליטר של הקולגן המנוטרל לכל באר אחרת ולכל שורה אחרת של המיקרו-פלטה, ודגרו בטמפרטורה של 37 מעלות צלזיוס למשך שעתיים על ידי הנחת המיקרו-פלטה מתחת למכסה המנוע של תרבית הרקמה כדי לאדות את הקולגן ליובש.
יום 2 - שטפו את המיקרו-פלטות עם 70 מיקרוליטר של 1x PBS, pH 7.4, פעמיים כדי להסיר קולגן לא קשור.
- העבירו את המיקרו-פלטות לחממה למשך שעה בטמפרטורה של 37 מעלות צלזיוס, ולאחר מכן העבירו את המיקרו-פלטות לספסל, והניחו לשעה אחת להתייבש לפני השימוש בהן בניסויי קשירה נוספים.
2. הערכת יציבות הג'לים/סרטי הקולגן המשותקים
- דגירה עם PBS למשך שעה
הערה: במהלך ניסוי הקשירה, דגרו את הקולגן המשותק עם התרכובת המעניינת. חשוב לחקור את היציבות של ג'ל או סרט הקולגן שנוצר. לשם כך, מדוד את היציבות של שלושה תנאים: אין שטיפה = מודד את הקולגן המשותק מיד לאחר הדגירה; כביסה = מודד את הקולגן המשותק לאחר שטיפת הצלחת פעמיים עם 100 מיקרוליטר PBS; ו-1 שעה PBS mimic & wash = מודד את הקולגן המשותק לאחר דגירה של שעה אחת עם PBS ולאחר מכן שתי שטיפות עם PBS. להלן מוסברת שיטת הדגירה של PBS.- הוסף 70 מיקרוליטר PBS (1x) לכל אחת מהבארות המצופות בקולגן, ודגר את המיקרופלייט בטמפרטורת החדר למשך שעה.
- שאפו את עודפי הנוזל מכל באר באמצעות פיפטה, ושטפו עם PBS (1x) פעמיים לפני ביצוע בדיקת כימות החלבון המתוארת להלן.
- כימות כמות הקולגן המשותק באמצעות בדיקת חומצה ביסינכונית (BCA)
הערה: השתמש בערכת בדיקת החלבון Pierce BCA (טבלת החומרים) בהתאם להוראות היצרן. קבע תקני קולגן מתאימים לבדיקה זו. טווח הריכוזים של קולגן I הוא בין 0-3,000 מיקרוגרם/מ"ל ושל קולגן III בין 0-750 מיקרוגרם/מ"ל. בסך הכול, קבעו 11 תקנים לכל קולגן.- הכן את הנפח הכולל של מגיב העבודה (WR) הדרוש על ידי ביצוע הוראות היצרן.
- הוסף 25 מיקרוליטר מכל אחד מתקן הקולגן לבארות המיקרופלייט (בשכפול). פתרונות אלה משמשים לשרטוט העקומה הסטנדרטית.
- הוסף 200 מיקרוליטר של תמיסת ריאגנט עובדת לכל אחת מהבארות המכילות את התקנים והבארות המצופות בריכוזים לא ידועים של קולגן.
- הניחו את המיקרופלייט על שייקר צלחת למשך 30 שניות. מכסים את המיקרו-פלטות, ודוגרים בחום של 37 מעלות צלזיוס למשך 30 דקות.
- הסר את המיקרו-פלטות והניח להתקרר בטמפרטורת החדר. מדוד את הספיגה ב-560 ננומטר באמצעות קורא צלחות.
- שרטט עקומת כיול על ידי התוויית A560 (AU) כנגד הריכוז (μg/mL) של 11 התמיסות הסטנדרטיות, והשתמש בעקומת הכיול כדי לחשב את כמות הקולגן.
3. מבחן קשירת ליגנד TRF Europium (III) (איור 1)
הערה: התרכובת המשמשת היא פפטיד קושר-קולגן (CBP) מועמד המסומן בקומפלקס Eu(III)-DO3AAm יחיד, המכונה Eu(III)-DO3AAm-CBP (איור 4).
- דגירה של הלוחות המצופים בקולגן עם תרכובת Eu(III)-DO3AAm-CBP
- הכן פתרונות של תרכובת Eu(III)-DO3AAm-CBP בריכוזים הנעים בין 0.1-15 מיקרומטר (0.1 מיקרומטר, 0.5 מיקרומטר, 1 מיקרומטר, 3 מיקרומטר, 5 מיקרומטר, 7 מיקרומטר, 10 מיקרומטר ו-15 מיקרומטר) ב-1x PBS.
- הוסף 75 מיקרוליטר מכל ריכוז של תרכובת לבארות מצופות קולגן (לוח A). בצע את הניסוי בשלוש עותקים כדי לחשב את כמות התרכובת שנקשרת לקולגן.
- השתמש בצלחת לא מצופה שנייה (לוח B), והוסף 75 מיקרוליטר מכל תרכובת לבארות הריקות כדי לחשב את הקישור הלא ספציפי של התרכובת לצלחת. השתמש בשלושה פליקטים עבור כל ריכוז.
- דגרו את המיקרו-צלחות למשך שעה בטמפרטורת החדר.
- בעזרת פיפטה, שאפו והשליכו את התמיסה העודפת מכל באר, ושטפו את הבארות עם 1x PBS פעמיים כדי להסיר עודף תרכובת לא קשורה. בצעו שלב זה באמצעות המיקרו-פלטות המצופות בקולגן והלא מצופות.
- לצלחת שלישית לא מצופה (לוח C), הוסף 10 מיקרוליטר מאותו טווח של ריכוזי Eu(III)-DO3AAm-CBP (בשכפול). השתמש בקריאת הקרינה מה-Eu(III)-DO3AAm-CBP בתמיסה כדי ליצור עקומת כיול.
הערה: אין לשטוף או לשאוב את התמיסה מצלחת זו.
- מיצוי חומצה של קריאות Europium (III) וקריאות פלואורסצנטיות שנפתרו בזמן (TRF)
הערה: אנא עיין במידע המשלים על ההכנה והכיול של נפחי התמיסה החומצית (AS) ותמיסת החציצה (BS). נפחי ה-AS וה-BS הנדרשים להשגת pH אופטימלי היו 54 מיקרוליטר ו-46 מיקרוליטר, בהתאמה, בעבודה זו. בצע את הפעולה הבאה בלוח A, לוח B ולוח C.- הוסף 54 מיקרוליטר של תמיסה חומצית (AS) לכל באר, והנח את הצלחת בחממה בטמפרטורה של 37 מעלות צלזיוס למשך 90 דקות, כסה את המיקרו-צלחות בנייר כסף כדי למנוע אידוי. יש לשלוט בקפידה על הטמפרטורה וזמן הדגירה כדי להשיג פירוק הניתן לשחזור.
- הוסף 46 מיקרוליטר של תמיסת חציצה (BS) לכל באר, ונער בעדינות את הצלחת למשך 30 שניות.
- הוסף 100 מיקרוליטר של תמיסת שיפור (ES), ונער את הצלחת למשך 30 שניות.
- המתן 30 דקות לפני קריאת הצלחת באמצעות קורא לוחות TRF. השתמש בפרמטרים המפורטים בטבלה 2.
4. ניתוח נתונים
- כימות ריכוז הקולגן המשותק על הבארות
- השג את המשוואה של עקומת הכיול של A560 (AU) לעומת הריכוז (μg/mL) של 11 הפתרונות הסטנדרטיים.
- השתמש בקריאות הספיגה המתקבלות מהבארות המכילות את תקני הקולגן.
- ערכו טבלאות של הערכים הממוצעים מהבארות הכפולות, ושרטטו את הספיגה הממוצעת מול ריכוזי החלבון (קולגן) הידועים (μg/mL) כדי לקבל את המשוואה עבור העקומה הסטנדרטית.
- השתמש בערכי הספיגה כדי לחשב את המסה (מיקרוגרם) והריכוז (M) של קולגן משותק.
- חשב את ערכי הספיגה הממוצעים על פני שלוש הבארות שהכילו קולגן משותק, ורשום את סטיית התקן.
- השתמש במשוואת העקומה הסטנדרטית המתקבלת מהעקומה הסטנדרטית של הקולגן (שלב 2.2.6) כדי להמיר את הספיגה הנמדדת מהבארות המצופות בקולגן לתיאום. מכאן, חשב את ריכוז הקולגן ששותק בתוך בארות הניסוי במיקרוגרם/מ"ל.
- המר את הריכוז המחושב בשלב 4.1.2.2 (מיקרוגרם/מ"ל) תחילה לגרם/ליטר ולאחר מכן, בהתבסס על המשקל המולקולרי של הקולגן, לטוחנת (M).
- לבסוף, חשב את מסת הקולגן המשותק בכל באר על ידי חלוקת הריכוז בנפח הקולגן שנוסף לבאר (100 מיקרוליטר לקולגן מסוג I ו-70 מיקרוליטר לקולגן מסוג III).
- השג את המשוואה של עקומת הכיול של A560 (AU) לעומת הריכוז (μg/mL) של 11 הפתרונות הסטנדרטיים.
- חישוב קבוע הדיסוציאציה (Kd) (איור 4)
- חלץ את קריאות הקרינה.
- ייצא את קריאות הקרינה מקורא הלוחות לגיליון אלקטרוני.
הערה: במבחני קשירה, חשוב לקחת בחשבון את הקישור הלא ספציפי הפוטנציאלי של תרכובת למשטח הפלסטיק של הלוחות. - חשב את הערכים הממוצעים של מדידות משולשות מכל ריכוז תרכובת עבור שלושת הלוחות השונים: קריאות הכריכה הספציפיות מהבארות המצופות (לוח A), הכריכה הלא ספציפית מהבארות הלא מצופות (לוח B) וסך ה- Eu(III)-DO3AAm-CBP בתמיסה בבארות הלא מצופות (לוח C).
- קבע את ערכי הקרינה עבור התרכובת המאוגדת על ידי הפחתת קריאות הקרינה של הבארות הלא מצופות (לוח B) מזו של הבארות המצופות (לוח A).
משוואה 1: קביעת הקרינה הקשורה17:
פלואורסצנציה קשורה = ספציפית (בארות מצופות) - לא ספציפית (בארות לא מצופות) - צור עקומת כיול באמצעות הקריאות מהתרכובת המסומנת ב-Eu (III) בתמיסה (לוח C). שרטט את קריאות הקרינה המתקבלות כנגד ריכוז התרכובת המסומנת ב-Eu(III). בצע התאמת רגרסיה ליניארית.
- ייצא את קריאות הקרינה מקורא הלוחות לגיליון אלקטרוני.
- המר את קריאות הקרינה לריכוזים.
- המר את קריאות הקרינה המאושרת (שלב 4.2.3) לריכוז באמצעות עקומת הקרינה הסטנדרטית מהנתונים שנוצרו באמצעות ריכוזי התרכובות בתמיסה (שלב 4.2.1.4).
הערה: כאשר משווים את תכונות הקישור של תרכובת אחת לחלבוני מטרה שונים המשתקעים בריכוזים שונים, יהיה צורך לקחת בחשבון את האחרון בעת חישוב כמות התרכובת הקשורה למטרה (כלומר, תרכובת/חלבון קשור). - חלקו את ריכוז התרכובת הקשורה בריכוז החלבון המשותק בבאר.
הערה: לחישוב זה, השתמש בריכוז הקולגן המשותק שחושב לאחר הדגירה של הבארות עם PBS למשך שעה אחת (מה שנקרא ניסוי חיקוי PBS; סעיף 2.1 לעיל). זאת כדי לקחת בחשבון אובדן פוטנציאלי של קולגן במהלך שלב הדגירה ושלב הכביסה שלא יתרום לאות הקרינה הסופי. - שרטט את הנתונים באמצעות תרשים פיזור המכיל את ריכוזי התרכובת על ציר ה-x (μM) ואת התרכובת/חלבון הקשור על ציר ה-y.
- המר את קריאות הקרינה המאושרת (שלב 4.2.3) לריכוז באמצעות עקומת הקרינה הסטנדרטית מהנתונים שנוצרו באמצעות ריכוזי התרכובות בתמיסה (שלב 4.2.1.4).
- השג את ערכיKd .
- התאם את הנתונים שנרכשו בשלב 4.2.2.3 באמצעות שני מודלים קינטיים מחייבים אפשריים: כריכה באתר אחד וכריכה באתר אחד עם מדרון גבעה. המשוואות עבור כל דגם מוצגות באיור 6.
- בחר את המודל המספק התאמה לא משתמעת לשתי פנים עם ערך ה-R בריבוע הגבוה ביותר בעת התאמת הנתונים.
- אל תכלול את החריגים עבור כל קבוצה של קריאות פלואורסצנטיות לריכוז לצלחת.
- לחשב את ערך ה-Kd הסופי, ולהציג את הנתונים כממוצע ± סטיית תקן של ניסויים בלתי תלויים.
הערה: לקבלת תוצאות חזקות, בצע מדידות משולשות בתוך כל צלחת ולפחות שלושה ניסויים עצמאיים עם מיקרו-לוחות שונים.
- חשב את התפוסה החלקית (FO).
הערה: ממשוואה 2, ריכוז המטרה אינו ידוע, ולכן, על ידי שימוש באלגברה וב-Kd, ממשוואה 3, נוצרת משוואה מעשית לחישוב התפוסה החלקית בצורה של משוואה 4.
משוואה 2: הגדרת תפוסה חלקית17:
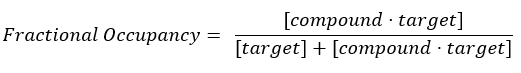
משוואה 3: קבוע הדיסוציאציה, Kd, שהוא הריכוז שבו התרכובת תופסת 50% מהמטרה בשיווי משקל17:
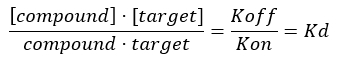
משוואה 4: משוואה מסודרת מחדש לחישוב משוואת FO17:
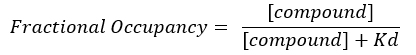
- חשב את ה-FO באמצעות ערכי ה-Kd הבלתי תלויים המתקבלים עבור כל צלחת בודדת. שרטט את התוצאות, הממוצע וסטיות התקן של ה-FO כנגד ריכוז התרכובת.
- דווח על ה- FO עם ערכים הנעים בין 0 ל- 1 או כאחוז עם ערכים הנעים בין 0%-100%.
- חלץ את קריאות הקרינה.
תוצאות
הערכת היציבות והריכוז של קולגן מסוג I וסוג III המשותק בג'לים/יריעות
כימות ריכוז הקולגן המשותק לבאר בוצע באמצעות שלושה תנאים שונים: א) בבארות ללא שטיפה עם PBS לאחר קיבוע החלבונים (ללא שטיפה); ב) בבארות עם שלב שטיפה (פעמיים עם PBS) לאחר קיבוע כדי להסיר כל חלבון לא מצופה; ?...
Discussion
עבודה זו מציגה שיטה הניתנת לשחזור לקיבוע קולגן מסוג I וסוג III. הוא גם מדגים פרוטוקול לרכישה, ניתוח ופירוש של נתוני קשירת TRF במבחנה Eu(III) כדי לאפיין את תכונות הקישור של ליגנד מועמד לקולגן מסוג I ו-III. הפרוטוקולים לקיבוע קולגן מסוג I וסוג III המוצגים כאן פותחו ועברו אופטימיז?...
Disclosures
למחברים אין ניגודי אינטרסים לחשוף.
Acknowledgements
אנו אסירי תודה למממנים הבאים על תמיכתם בעבודה זו: (1) מועצת המחקר הרפואי הבריטית (MR/N013700/1) וקינגס קולג' לונדון חבר בשותפות הכשרת הדוקטורט של MRC במדעים ביו-רפואיים; (2) מענק תוכנית BHF RG/20/1/34802; (3) מענק פרויקט BHF PG/2019/34897; (4) מענק מרכז קינגס BHF למצוינות במחקר RE/18/2/34213; (5) תוכנית יוזמת המילניום המדעית של ANID - ICN2021_004; ו-(6) FB210024 מענק ANID Basal.
Materials
| Name | Company | Catalog Number | Comments |
| 10x PBS | Gibco | 14200075 | Use this to make 1x PBS by diluting in water (1:10) |
| 10x PBS | Gibco | 14200075 | Use this to make 1x PBS by diluting in water (1:10) |
| 2M HCL | Made in house and details are in the supporting document | ||
| 2M HCL | Made in house and details are in the supporting document | ||
| 2M Sodium hydroxide +2M Glycine | Made in house and details are in the supporting document | ||
| 2M Sodium hydroxide +2M Glycine | Made in house and details are in the supporting document | ||
| Cell-star 96 well microplate | Greiner Bio-One | 655 160 | |
| Cell-star 96 well microplate | Greiner Bio-One | 655 160 | |
| DELFIA enhacement solution | Perkin Elmer | 1244-104 | |
| DELFIA enhacement solution | Perkin Elmer | 1244-104 | |
| Ice | |||
| Ice | |||
| Infinite 200 PRO NanoQuant microplate reader | TECAN | ||
| Infinite 200 PRO NanoQuant microplate reader | TECAN | ||
| Non-binding (NBS) 96 well microplates | Corning | 3641 | |
| Non-binding (NBS) 96 well microplates | Corning | 3641 | |
| pH electrode Inlab Routine | Mettler Toledo | 51343050 | |
| pH electrode Inlab Routine | Mettler Toledo | 51343050 | |
| pH meter (sevenCompact) | Mettler Toledo | ||
| pH meter (sevenCompact) | Mettler Toledo | ||
| Pierce BCA protein assay kit | Thermofisher | 23227 | |
| Pierce BCA protein assay kit | Thermofisher | 23227 | |
| Tissue culture incubator (37 °C, 5% CO2) | |||
| Type I bovine collagen, 3 mg/mL | Corning | 354231 | |
| Type III human placenta collagen, 0.99 mg/mL | Advanced Biomatrix | 5021 |
References
- Distler, J. H. W., et al. Review: Frontiers of antifibrotic therapy in systemic sclerosis. Arthritis and Rheumatology. 69 (2), 257-267 (2017).
- Wynn, T. A. Fibrotic disease and the TH1/TH2 paradigm. Nature Reviews Immunology. 4 (8), 583-594 (2004).
- Saha, P., et al. Magnetic resonance T1 relaxation time of venous thrombus is determined by iron processing and predicts susceptibility to lysis. Circulation. 128 (7), 729-736 (2013).
- Mirshahi, M., et al. Defective thrombolysis due to collagen incorporation in fibrin clots. Thrombosis Research. 8, 73-80 (1988).
- Comerota, A. J. The ATTRACT trial: Rationale for early intervention for iliofemoral DVT. Perspectives in Vascular Surgery and Endovascular Therapy. 21 (4), 221-225 (2009).
- Bateman, E. D., Turner-Warwick, M., Adelmann-Grill, B. C. Immunohistochemical study of collagen types in human foetal lung and fibrotic lung disease. Thorax. 36 (9), 645-653 (1981).
- Pawelec, K. M., Best, S. M., Cameron, R. E. Collagen: A network for regenerative medicine. Journal of Materials Chemistry B. 4 (40), 6484-6496 (2016).
- Frantz, C., Stewart, K. M., Weaver, V. M. The extracellular matrix at a glance. Journal of Cell Science. 123 (24), 4195-4200 (2010).
- Copes, F., Pien, N., Van Vlierberghe, S., Boccafoschi, F., Mantovani, D. Collagen-based tissue engineering strategies for vascular medicine. Frontiers in Bioengineering and Biotechnology. 7, 166 (2019).
- Veis, A. The biochemistry of collagen. Annals of Clinical and Laboratory Science. 5 (2), 123-131 (1975).
- Bielajew, B. K., Hu, J. C., Athanasiou, K. A. Collagen: Quantification, biomechanics, and role of minor subtypes in cartilage. Nature Reviews Materials. 5, 730-747 (2020).
- Zhao, Z., et al. Structural and functional plasticity of collagen fibrils. DNA and Cell Biology. 38 (4), 367-373 (2019).
- Eryilmaz, E., Teizer, W., Hwang, W. In vitro analysis of the co-assembly of type-I and type-III collagen. Cellular and Molecular Bioengineering. 10 (1), 41-53 (2017).
- Jagnow, J., Clegg, S. Klebsiella pneumoniae MrkD-mediated biofilm formation on extracellular matrix- and collagen-coated surfaces. Microbiology. 149 (9), 2397-2405 (2003).
- O'Sullivan, D., O'Neill, L., Bourke, P. Direct plasma deposition of collagen on 96-well polystyrene plates for cell culture. ACS Omega. 5 (39), 25069-25076 (2020).
- Caravan, P., et al. Collagen-targeted MRI contrast agent for molecular imaging of fibrosis. Angewandte Chemie - International Edition. 46 (43), 8171-8173 (2007).
- Copeland, R. A. . Enzymes: A Practical Introduction to Structure, Mechanism, and Data Analysis. , (2000).
- Salahudeen, M. S., Nishtala, P. S. An overview of pharmacodynamic modelling, ligand-binding approach and its application in clinical practice. Saudi Pharmaceutical Journal. 25 (2), 165-175 (2017).
- Bünzli, J. C. G., Piguet, C. Taking advantage of luminescent lanthanide ions. Chemical Society Reviews. 34 (12), 1048-1077 (2005).
- Hemmilii, I. Luminescent lanthanide chelates - A way to more sensitive diagnostic methods. Journal of Alloys and Compounds. 225 (1-2), 480-485 (1995).
- De Silva, C. R., Vagner, J., Lynch, R., Gillies, R. J., Hruby, V. J. Optimization of time-resolved fluorescence assay for detection of europium-tetraazacyclododecyltetraacetic acid-labeled ligand-receptor interactions. Analytical Biochemistry. 398 (1), 15-23 (2010).
- Digilio, G., Lacerda, S., Lavin Plaza, B., Phinikaridou, A. Extracellular matrix targeted MRI probes. Analysis & Sensing. 3 (1), (2022).
- Phinikaridou, A., et al. Tropoelastin: A novel marker for plaque progression and instability. Circulation. Cardiovascular imaging. 11 (8), 007303 (2018).
- Guzaeva, T. V., et al. Protein A used in DELFIA for the determination of specific antibodies. Immunology Letters. 35 (3), 285-289 (1993).
- Nasiri, A. H., Nasiri, H. R. Polymerase assays for lead discovery: An overall review of methodologies and approaches. Analytical Biochemistry. 563, 40-50 (2018).
- Capuana, F., et al. Imaging of dysfunctional elastogenesis in atherosclerosis using an improved gadolinium-based tetrameric MRI probe targeted to tropoelastin. Journal of Medicinal Chemistry. 64 (20), 15250-15261 (2021).
- Drescher, D. G., Drescher, M. J., Ramakrishnan, N. A. Surface plasmon resonance (SPR) analysis of binding interactions of proteins in inner-ear sensory epithelia. Methods in Molecular Biology. 493, 323-343 (2009).
- Murali, S., Rustandi, R. R., Zheng, X., Payne, A., Shang, L. Applications of surface plasmon resonance and biolayer interferometry for virus-ligand binding. Viruses. 14 (4), 717 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved