Method Article
מדידת פעילות קספז באמצעות בדיקה פלואורומטרית או ציטומטריית זרימה
In This Article
Summary
הפרוטוקול הנוכחי מתאר שתי שיטות למדידת פעילות הקספז באמצעות מצע פלואורוגני באמצעות ציטומטריית זרימה או ספקטרופלואורומטר.
Abstract
ההפעלה של פרוטאזות ציסטאין, הידועות בשם קספזות, נותרה תהליך חשוב בצורות רבות של מוות תאי. קספזות הם יוזמים ותליינים קריטיים של אפופטוזיס, הצורה הנחקרת ביותר של מוות תאי מתוכנת. אפופטוזיס מתרחשת במהלך תהליכים התפתחותיים והיא אירוע הכרחי בהומאוסטזיס רקמות. פירופטוזיס היא צורה נוספת של מוות תאי המשתמשת בקספזות והיא תהליך קריטי בהפעלת מערכת החיסון באמצעות הפעלת הדלקת, מה שמביא לשחרור של בני משפחת אינטרלוקין-1 (IL-1). כדי להעריך את פעילות הקספז, ניתן להעריך את מצעי המטרה. עם זאת, רגישות יכולה להוות בעיה בעת בחינת תאים בודדים או פעילות ברמה נמוכה. אנו מדגימים כיצד ניתן להשתמש במצע פלואורוגני עם בדיקה מבוססת אוכלוסייה או בדיקה של תא בודד על ידי ציטומטריית זרימה. בעזרת בקרות נכונות, ניתן להשתמש ברצפי חומצות אמינו שונים כדי לזהות אילו קספזות פעילות. באמצעות בדיקות אלה, זוהה אובדן סימולטני של מעכבי חלבוני אפופטוזיס על גירוי גורם נמק הגידול (TNF), אשר גורם בעיקר אפופטוזיס במקרופאגים ולא צורות אחרות של מוות תאי.
Introduction
קספזות מעורבות במספר צורות של מוות תאי מתוכנת. אפופטוזיס היא הצורה הנחקרת ביותר של מוות תאי מתוכנת והיא קשורה לפעילות קספז1. לכל הקספזות יש תת-יחידה קטליטית גדולה וקטנה. לקספאז-1, קספאז-4, קספאז-5, קספאז-9 וקספאז-11 יש תחום הפעלה וגיוס של קספז (CARD), וקספאז-8 וקספאז-10 מכילים תחומי אפקט מוות (DED)2,3,4,5 (טבלה 1). אפופטוזיס יכול להתחיל על ידי שני מסלולים עיקריים: המסלול החיצוני והמסלול הפנימי. המסלול האפופטוטי החיצוני מופעל על ידי קולטני מוות, שהם חלק ממשפחת גורמי נמק הגידול (TNFSF). קולטני מוות הם בעלי תחומי DED, המאפשרים פעילות קספאז-86. המסלול האפופטוטי הפנימי כולל הפעלה של קספאז-9 לאחר היווצרות האפופטוזום, הדורש שחרור של ציטוכרום c ו- Apaf-17. ההפעלה של קספאז יוזם, קספאז-8 או קספאז-9, מובילה לפיצול ולהפעלה עוקבת של קספזות התליין, שהן קספאז-3, קספאז-6 וקספאז-7. זיהוי העובדה שהקספזות התליין פעילות מצביע על כך שהתאים עוברים אפופטוזיס, והפעלה זו נחשבת לגורם חשוב בהגדרת אופן המוות התאי.
הפעלת קספז היא גם צומת קריטי לוויסות דלקת ולהשראת צורות חלופיות של מוות תאי מתוכנת. לדוגמה, הפעלת קספאז-1 מובילה להבשלה של ציטוקינים מעודדי דלקת ממשפחת אינטרלוקין-18. השחרור וההפעלה של ציטוקינים ממשפחה זו, במיוחד IL-1β ו- IL-18, נובעים ממחשוף גסדרמין D והיווצרות נקבוביות בקרום הפלזמה 9,10. תיקון לקוי של נקבוביות גסדרמין D עלול לגרום לסוג של מוות תאי המכונה פירופטוזיס11. יתר על כן, פעילות קספאז-8 גורמת לעיכוב מוות תאי בלתי תלוי בקספאז המכונה נקרופטוזיס12. חלבון סרין/תראונין קינאז 1 (RIPK1) הוא אחד הגורמים הקריטיים בנקרופטוזיס ובהנעת דלקת המווסתת על ידי NF-kB. מודלים הראו כי RIPK1 נבקע על ידי קספאז-8, וכתוצאה מכך מגביל איתות NF-kB, אפופטוזיס ונקרופטוזיס13,14. לכן, זיהוי הפעילות של קספזות שונות יכול לסייע בהבנת הדלקת הנובעת מכך ואופן מוות תאי.
ללא תלות בתפקוד הקספזות בוויסות אופני מוות תאי, פעילות הקספז יכולה גם לווסת משפחות ציטוקינים אחרות, כגון אינטרפרון (IFN), בתגובה לזיהום15,16. בנוסף, קספזות מעורבות בתפקודים שאינם מוות תאי, כולל החלטות על גורל התא, תיקון והתחדשות רקמות, גידולים באמצעות תיקון DNA ותפקוד סינפסות עצביות. הפעילות של קספזות בתפקידים לא קטלניים אלה נחשבת מוגבלת על ידי לוקליזציה תאית וכמות של קספזות. לכן, כימות רמת פעילות הקספז עשוי בהחלט להגדיר אם תא עובר מוות תאי או אם הקספז ממלא תפקיד בתפקוד שאינו מוות תאי 4,17,18.
ניתן להעריך את פעילות הקספז במספר שיטות. כתם מערבי לקספזות שסועות ולמצעים שלהן שימש כאינדיקטור לפעילות, אך בדיקות אלה איכותיות במקרה הטוב. כדי לקבוע אם פעילות הקספז קשורה למוות תאי, מדידה כמותית היא אידיאלית. מכיוון שקספזות חותכות מצעים באתר זיהוי המורכב מארבע חומצות אמינו, פותחו שיטות קולורימטריות, לומינסנציה או פלואורומטריות. עם זאת, נראה כי לקספזות יש פלסטיות בזיהוי המצע שלהן19,20. רצף הזיהוי אינו משויך לתחומי החלבונים (טבלה 1). רצף הטטרפפטיד DEVD, לעומת זאת, יכול לשמש לזיהוי פעילות קספאז-3 וקספאז-720,21.
חיקויי סמאק הם תרכובות המכוונות למעכבי חלבוני אפופטוזיס (IAPs). השימוש בחיקוי Smac בתת-קבוצה של תאים סרטניים גורם לתאים להיות רגישים למוות תאי הנגרם על ידי TNF22. במקרופאגים ראשוניים, חיקויי Smac גורמים למוות תאי ללא תוספת אקסוגנית של TNF23,24. אובדן cIAP1 על ידי השפלה הנגרמת על ידי Smac גורם לייצור TNF. אם מזוהה פעילות קספז, משמעות הדבר היא שהתאים לא מתו על ידי נקרופטוזיס אלא באופן אפופטוטי. בשיטה זו, זיהוי של מצע DEVD שסוע משמש לזיהוי פעילות קספאז-3/קספאז-7. ניסויים נוספים לאישור מוות תאי אפופטוטי פורסמו בעבר24.
Protocol
המחקר הנוכחי בוצע באישור ובהתאם להנחיות הוועדה האתית לבעלי חיים של אוניברסיטת ציריך (#ZH149/19). עכברי C57Bl/6J זכרים בגילאי 8-16 שבועות, שגודלו ושוכנו בתנאים ספציפיים נטולי פתוגן (SPF), שימשו במחקר הנוכחי. העצמות השלמות יכולות להישמר על קרח בתמיסת מלח חוצצת סטרילית של האנק (HBSS) עם 2% סרום בקר עוברי מומת בחום (FBS). מח עצם נאסף מעצם הירך והטיביה של העכבר25 ביום ההתמיינות. שתי השיטות להערכת פעילות קספז יכולות לשמש עבור סוגי תאים אחרים, כולל ראשוניים ומותמרים.
1. הבחנה בין מקרופאגים שמקורם במח עצם (BMDM)
הערה: בצע את כל השלבים במכסה מנוע זרימה למינרית של תרבית רקמה, והשתמש בטכניקות אספטיות סטריליות.
- הכינו מזרק 1 מ"ל עם מחט 21 גרם.
- הוסף 5 מ"ל HBSS + 2% FBS לצינור 15 מ"ל.
- בעזרת מלקחיים סטריליים, לוקחים עצם ירך נכרתה, ומחדירים את המחט לפתח עצם הירך. מחזיקים את עצם הירך ב- HBSS + 2% FBS, שוטפים את מח העצם החוצה עד שהעצם לבנה. שוטפים את השוקה באותו אופן. המשך לשטוף את הפתרון כדי להשיג השעיה של תא יחיד.
- צנטריפוגה את המתלה החד-תאי במהירות של 200 x גרם למשך 4 דקות בטמפרטורת החדר (RT).
- הסר את supernatant באמצעות שואב ואקום. הקש על הצינור כדי להשהות מחדש בעדינות את הכדור. הוסיפו 1 מ"ל של חיץ ליזה של תאים אדומים (ראו טבלת חומרים) וערבבו בעדינות עם פיפטה P1,000. יש לדגור ב-RT למשך דקה.
- הוסף 10 מ"ל HBSS + 2% FBS, וצנטריפוגה ב 200 x גרם למשך 4 דקות ב- RT.
- הסר את הסופרנטנט, והשהה מחדש ב- 10 מ"ל של מדיום תרבית מקרופאגים שמקורו במח עצם (BMDM).
הערה: מדיום תרבית BMDM מורכב מ-DMEM דל גלוקוז בתוספת של 10% FBS, 20 נ"ג/מ"ל M-CSF, פניצילין (50 U/mL) וסטרפטומיצין (50 מיקרוגרם/מ"ל) (ראה טבלת חומרים). לחלופין, ניתן להחליף 20% מדיום מותנה L929 ב- M-CSF. - הוסיפו 15 מ"ל של מדיום תרבית BMDM לשתי צלחות פטרי בקוטר 15 ס"מ. הוסף 5 מ"ל של תמיסת התא הבודד לכל צלחת.
הערה: אין להשתמש בצלחות שטופלו בתרבית רקמות. צלחות המטופלות בתרבית רקמות מגבילות את ההתבדלות. - מניחים את הכלים ב 37 ° C, 5% CO2, במשך 6 ימים.
הערה: ניתן לקצור את BMDMs לאחר 5-7 ימים. זמני דגירה ארוכים יותר להתמיינות מובילים לביטוי מוגבר של חלבון אנטי-אפופטוטי26.
2. קציר, זריעה וטיפול בתאים
הערה: בצע את כל השלבים במכסה מנוע זרימה למינרית של תרבית רקמה, והשתמש בטכניקות אספטיות סטריליות. מקרופאגים ממוינים לחלוטין נצמדים לצלחת, ומאפשרים הפרדה קלה, בעוד תאים צפים יכולים להיזרק לפח. ניתן להשתמש במי מלח חוצצי פוספט (PBS) עם או בלי Ca2 + ו- Mg2+.
- לאחר 6 ימי דגירה, מוציאים את התאים הצפים והמדיום מהצלחת באמצעות אספירטור.
- הוסיפו 5 מ"ל PBS לכל צלחת בקוטר 15 ס"מ. הסר את PBS מהצלחת באמצעות אספירטור.
- הוסיפו 2 מ"ל טריפסין (ראו טבלת חומרים) לכל צלחת. דוגרים על הצלחת עד שהקשה עדינה על הצלחת משחררת את התאים. קח 5 מ"ל של מדיום תרבית BMDM, וקצור את התאים מהצלחת.
- מעבירים לצלחת השנייה בקוטר 15 ס"מ, וקוצרים את התאים מהצלחת. הסר את תרחיף התא מהצלחת לתוך צינור 50 מ"ל. קח 5 מ"ל נוספים של מדיום תרבית BMDM, ושטוף את שתי הצלחות כדי להבטיח שכל התאים נאספו. הכניסו את תרחיף התא לאותו צינור של 50 מ"ל.
- קח 10 μL של תרחיף התא, וספור באמצעות hemacytometer באמצעות דילול 1: 1 עם כחול טריפאן.
הערה: ניתן להשתמש גם במוני תאים אוטומטיים כאשר הם מכוילים לגודל המקרופאגים. - זרעו את המקרופאגים בצפיפות של 1 x 106 תאים/מ"ל. BMDMs זרעים ב 2 x 10 6 תאים / באר בצלחת6 באר לספק כ 2 מ"ג / מ"ל חלבון סה"כ. אפשרו לתאים להיצמד לצלחת למשך 6 שעות לפחות לפני הטיפול.
הערה: עבור סוגי תאים אחרים, יש לקבוע את הריכוז האופטימלי. - טפלו במקרופאגים באמצעות חיקוי Smac (תרכובת A, ראו טבלת חומרים)22 ב-250 ננומטר וב-500 ננומטר במשך 16 שעות.
הערה: כלול בקרה חיובית לגרימת אפופטוזיס ומחשוף קספאז-3 כדי להבטיח שהבדיקה עובדת. גורמים נפוצים לאפופטוזיס כוללים staurosporine ו etoposide. עבור קווי תאים רבים לעבור אפופטוזיס, 0.1-10 מיקרומטר עבור 16 שעות של גירוי מספיק.
3. הכנת ליזטים של תאים מתאים מטופלים
הערה: שלב זה חייב להיעשות על קרח, והריאגנטים והחומרים חייבים להיות מקוררים מראש.
- מעבירים את הצלחות המכילות את התאים המטופלים אל הקרח. לאסוף את התווך מתרבית התא לתוך צינור 1.5 מ"ל, צנטריפוגה ב 300 x גרם במשך 5 דקות ב 4 ° C, לשאוף את התווך, ולשים את הצינור על קרח. זה מאפשר את האוסף של התאים שהתנתקו מן הצלחת.
- הוסיפו 1 מ"ל PBS קר לצלחת תרבית התאים לשטיפת התאים, ושאפו את כל PBS. הוסף 100 μL של טריפסין לתאים (אם עובדים עם צלחת 6 באר). אפשרו לטריפסין להרים את התאים מהצלחת, ואספו אותם לתוך צינור 1.5 מ"ל. השתמש 1 מ"ל של PBS קר כדי להבטיח שכל התאים נאספו.
הערה: אם עובדים עם תאי תרחיף, העבר בעדינות את התווך והתאים לצינור של 1.5 מ"ל. - צנטריפוגה את התאים ב 300 x גרם במשך 5 דקות ב 4 ° C. הסר את הסופרנאטנט, והשהה מחדש במאגר ליזה DISC 100 μL (150 mM נתרן כלורי, 2 mM EDTA, 1% Triton X-100, 10% גליצרול, 20 mM Tris, pH 7.5, ראה טבלת חומרים).
- לדגור את הדגימות על קרח במשך 20 דקות.
- צנטריפוגה את הליזטים ב~ 12,000 x גרם למשך 10 דקות ב 4 ° C כדי להניף את החלק הבלתי מסיס.
- מעבירים 25 μL של הליזט לצלחת לבנה בעלת תחתית שטוחה של 96 בארות עבור בדיקת הפעילות קספאז-3/קספאז-7 (שלב 5).
הערה: אין להפריע לכדור. זהו החלק הבלתי מסיס של התא ליזט. - מעבירים 10 μL של הליזט הנותר לצלחת שקופה בעלת תחתית שטוחה של 96 בארות לבדיקת חומצה ביכומונית (BCA) (שלב 4). זה ישמש לנורמליזציה של הדגימות.
- שמרו את שתי הצלחות על קרח לעיבוד נוסף.
הערה: בשלב זה ניתן לאטום את הצלחות בכיסוי דבק ולאחסן בטמפרטורה של 20°C למשך כ-4 שבועות.
4. כימות חלבונים באמצעות בדיקת BCA
הערה: ניתן להשתמש בריאגנטים או בדיקות אחרות כדי לכמת את כמות החלבון בכל דגימה. במבחן מבוסס האוכלוסייה, ניתן להשוות את הדגימות על ידי נרמול כמות החלבון המשמשת בבדיקה.
- הכינו ריכוזי חלבון סטנדרטיים בין 0 מיקרוגרם/מ"ל ל-2,000 מק"ג/מ"ל (0 מיקרוגרם/מ"ל, 25 מק"ג/מ"ל, 125 מיקרוגרם/מ"ל, 250 מיקרוגרם/מ"ל, 500 מיקרוגרם/מ"ל, 750 מיקרוגרם/מ"ל, 100 מיקרוגרם/מ"ל, 1,500 מיקרוגרם/מ"ל, 2,000 מיקרוגרם/מ"ל) עם אלבומין בסרום בקר (BSA). הכינו פריטים ריקים עם מאגר ליזיס בלבד.
- הוסף 10 μL מכל תקן לצלחת בעלת תחתית שטוחה של 96 בארות המכילה את הדגימות, המוזכרות בשלב 3.7.
- ערבבו מגיב BCA 1 עם מגיב BCA 2 ביחס של 50:1 (ראו טבלת חומרים). הוסף 200 μL של מגיב BCA מעורב לכל דגימה ותקן.
- יש לדגור בטמפרטורה של 37°C למשך 30 דקות.
- למדוד את הספיגה ב 562 ננומטר על מכשיר פלואורומטרי, ולכמת את ריכוז החלבון עם העקומה הסטנדרטית.
5. בדיקה מבוססת אוכלוסייה לפעילות קספאז-3/קספאז-7
הערה: אין לאפשר לתאי הליזטים שבצלחת לשבת על קרח במשך יותר מ-3 שעות. אם קיימת פעילות קספז, זה גדל עם הזמן למרות שהמדגם נמצא על קרח. אם הדגימות הוקפאו, הפשירו אותן על קרח, והמשיכו מיד לאחר הפשרת הליזטים.
- הפעל את המכשיר הפלואורומטרי (ראה טבלת חומרים) וחמם את המכשיר ל- 37 ° C. הכינו את התסריט כאמור:
- בצע קריאות בודדות כל דקה במשך 40 דקות על מנת לקבוע את הקינטיקה של התגובה.
- הגדר את העירור ל- 360 ננומטר ואת הפליטה ל- 465 ננומטר. עשרה הבזקים לכל באר מספיקים.
- הכינו את הבקרה החיובית של קספאז-3 רקומביננטי (ראו טבלת חומרים). יש לערבב 1 U של האנזים רקומביננטי קספאז-3 ב-50 μL של חיץ ליזה (צינור 1). הוסף 25 μL של חיץ ליזיס לשלושה צינורות נוספים. העבר 25 μL מצינור 1 לצינור 2. מערבבים על ידי pipetting.
- חזור על הפעולה עבור צינור 3 וצינור 4. צינור 5 יכיל רק 50 μL של חיץ ליזיס. הוסף 25 μL מכל תקן לצלחת הלבנה בעלת תחתית שטוחה של 96 בארות עבור בדיקת הפעילות קספאז-3, המוזכרת בשלב 3.6.
- הכינו תערובת תגובה ראשית לבדיקת פעילות קספז על קרח. לתגובה אחת, יש לערבב 50 μL של 2x caspase cleavage buffer (0.2M HEPES pH 7.5; 20% סוכרוז או PEG; 0.2% CHAPS), 5 μL של 1 mM DEVD-AMC (מצע קספאז-3 טטרפפטיד), 2 μL של 500 mM DTT, ו-18 μL של מים שעברו דה-יוניזציה (ראו טבלת חומרים).
- הוסף 75 μL של תערובת התגובה לכל דגימה ותקן לקבלת נפח תגובה כולל של 100 μL.
- מדוד מיד את הפלואורסצנטיות באמצעות המכשיר הפלואורומטרי שהוגדר בשלב 5.1.
- עבור כל מדידה פלואורסצנטית, החסר את קריאת הפלואורסצנטיות עבור הריק (חיץ ליזיס בלבד) מפלואורסצנטיות הדגימה. לנרמל את הקריאה על ידי חלוקה לפי ריכוז החלבון של המדגם (מחושב בשלב 4.5)27:
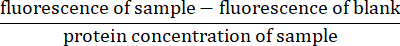
- חישוב קצב פעילות הקספז על ידי קביעת שיפוע הפלואורסצנטיות המנורמלת על ציר y וזמן על ציר x.
6. בדיקת תא בודד (ניתוח ציטומטריית זרימה) לפעילות קספאז-3/קספאז-7
- זרעו את התאים כמתואר בסעיף 2.
- קצרו את התאים לתוך צינור פוליסטירן 5 מ"ל. אם עובדים עם תאים דבקים, לאסוף את המדיום לתוך צינור 5 מ"ל. הוסף 1 מ"ל של PBS קר לצלחת תרבית התא, ולאסוף את PBS לתוך צינור 5 מ"ל. הוסף טריפסין לתאים (100 μL אם עובדים עם מנות 6 באר). אפשרו לטריפסין להרים את התאים מהצלחת, ואספו לתוך צינור 5 מ"ל. השתמש 1 מ"ל של PBS קר כדי להבטיח שכל התאים נאספו.
הערה: אם עובדים עם תאי תרחיף, העבירו בעדינות את המדיום והתאים לצינור של 5 מ"ל. - צנטריפוגה הדגימות ב 300 x גרם במשך 5 דקות, 4 ° C. הסר את supernatant באמצעות שואב ואקום.
- מכינים את תערובת הצביעה. ריכוז הצביעה האופטימלי הוא 1 x 10 6-2 x 106 תאים ב 50 μL. לדלל את המצע הפלואורוגני בהתאם להוראות היצרן (ראה טבלת חומרים, ציטומטריית זרימה). קח 1 μL של מצע המלאי, ודלל ב 150 μL של PBS. הוסף 50 uL לדגימה.
- יש לדגור על הדגימות בטמפרטורה של 37°C למשך 30 דקות המוגנות מפני אור, תוך ערבוב כל 15 דקות.
- עם ציטומטר הזרימה המשמש במחקר זה, השתמש בלייזר האדום ב 640 ננומטר, ולזהות באמצעות 675/25 ננומטר. הפעל תחילה את דגימת הבקרה הלא מוכתמת, וקבל מינימום של 10,000 אירועים של האוכלוסייה הרצויה. אל תכלול את הפסולת באמצעות שער (P1) בתרשים נקודות FSC-A ו- SSC-A.
- השתמש בהיסטוגרמה המציגה את האירועים בשער P1 ובזיהוי מצע הקספז (ציר Y) כדי לקבוע את עוצמת הפלואורסצנטיות החציונית (MFI).
הערה: מצע הקספז המתואר בשיטה זו דורש עירור ב- 590 ננומטר ופולט ב- 628 ננומטר.
- השתמש בהיסטוגרמה המציגה את האירועים בשער P1 ובזיהוי מצע הקספז (ציר Y) כדי לקבוע את עוצמת הפלואורסצנטיות החציונית (MFI).
תוצאות
מקרופאגים ראשוניים של עכברים נבדלו במשך 6 ימים. לאחר 6 ימים, התאים נקצרו, נספרו ונזרעו. נעשה שימוש בטיפולים הבאים: ללא טיפול ומימטי Smac (תרכובת A)22 ב-250 ננומטר וב-500 ננומטר במשך 16 שעות (איור 1). הניסוי בוצע בשכפול כדי לאפשר הערכה של הפעלת קספאז-3/קספאז-7 על ידי בדיקה מבוססת אוכלוסייה או אנליזה של תא בודד באמצעות ציטומטריית זרימה.
ריכוז החלבונים של הליזטים התאיים כומת באמצעות בדיקת BCA (טבלה משלימה 1). זה הכרחי כדי להבטיח שכמות החלבון המשמשת בבדיקת הפעילות של קספאז-3/קספאז-7 זהה בין הדגימות. בבדיקה מבוססת אוכלוסייה זו, ניתן להציג את הנתונים בשתי דרכים. הראשונה היא להראות את הקינטיקה על-ידי שרטוט הפלואורסצנטיות המותאמת (ציר y) לעומת הזמן (ציר x) (איור 2A). לחלופין, ניתן לחשב את השיפוע כדי להשוות ישירות בין הדגימות (איור 2B). העלייה בשיפוע בטיפול חיקוי Smac של 500 ננומטר לא הייתה משמעותית בהתבסס על ANOVA חד-כיווני רגיל עם השוואות מרובות (מבחן ההשוואה המרובה של דנט28).
לצורך ניתוח פעילות קספאז-3/קספאז-7 באמצעות ציטומטריית זרימה, נקצרו התאים והסופרנאטנט. תאים לא מוכתמים או פלואורסצנטיות מינוס אחד שימשו כבקרה שלילית, כמו גם התאים שלא טופלו. היסטוגרמה של התאים שנאספו על-ידי ציטומטריית זרימה הראתה שינוי בפלואורסצנטיות עבור התאים שטופלו במימטיקה של Smac בהשוואה לתאים שלא טופלו (איור 2C). הנתונים יכולים להיות מוצגים כעוצמת פלואורסצנטיות חציונית (איור 2D) או כשינוי קפל מעל התאים שלא טופלו (איור 2E).

איור 1: תרשים זרימה של המחקר . (A) עצם הירך והטיביאס נכרתו מעכברי C57Bl/6. העצמות היו סמוקות ומובחנות ב 20 ng / mL M-CSF במשך 6 ימים. (B) ביום השישי נקצרו, מקרופאגים נקצרו, ונזרעו מחדש לטיפול. קבוצה אחת של תאים נקצרו עבור ליזטים והוערכו על ידי פעילות פלואורוגנית, ואילו הקבוצה השנייה נקצרה, הודגרה עם המצע הפלואורוגני, והוערכה על ידי ציטומטריית זרימה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
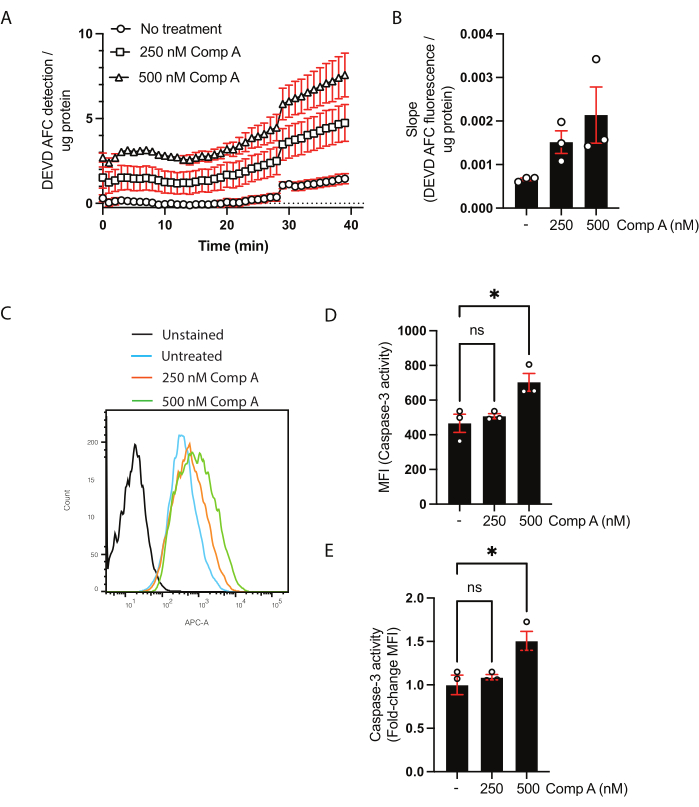
איור 2: בדיקה קינטית לפעילות קספאז-3/קספאז-7 ופיצול מצע לפי ציטומטריית זרימה. (A,B) נתונים מייצגים של הבדיקה הקינטית לפעילות קספאז-3/קספאז-7 (C-E) ומחשוף המצע לפי ציטומטריית זרימה. המקרופאגים טופלו בשני ריכוזים של Smac mimetic (תרכובת A; 250 ננומטר ו-500 ננומטר) במשך 16 שעות. (A) איתור מצע DEVD AFC שסוע לאורך זמן. הנתונים נורמלו לריכוז החלבון בדגימה. (B) קצב המחשוף (שיפוע) של DEVD AFC עבור כל דגימה נורמל למדרון הלא מטופל והוצג כשינוי הקיפול מעל התאים הלא מטופלים. (C) זרימה של היסטוגרמות ציטומטריות של התאים המודגרים עם מצע קספאז-3. (ד,ה) השוואת MFI ושינוי קיפול ב- MFI בהשוואה למדגם שלא טופל. כל נקודת נתונים מייצגת מדגם בלתי תלוי; ממוצע ± שגיאת תקן של הממוצע מוצגים; *p < 0.05 באמצעות ANOVA חד-כיווני ומבחני השוואה מרובים (מבחן ההשוואה המרובה של Dunnett). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
| קספז | מינים | רצף המצע | תחומי חלבונים | ||
| קספאז-1 | Hs, ממ | (W/L) EHD | CARD, תחום גדול, תחום קטליטי קטן | ||
| קספאזה-2 | Hs, ממ | DEXD | CARD, תחום גדול, תחום קטליטי קטן | ||
| קספאז-4 | Hs | (W/L) EHD | CARD, תחום גדול, תחום קטליטי קטן | ||
| קספאז-5 | Hs | (W/L) EHD | CARD, תחום גדול, תחום קטליטי קטן | ||
| קספאז-9 | Hs, ממ | (I/V/L) E(H/T)D | CARD, תחום גדול, תחום קטליטי קטן | ||
| קספאז-11 | מ"מ | (W/L) EHD | CARD, תחום גדול, תחום קטליטי קטן | ||
| קספאז-12 | מ"מ | אטד | CARD, תחום גדול, תחום קטליטי קטן | ||
| קספאזה-8 | Hs, ממ | (I/V/L) E(H/T)D | DED, תחום גדול, תחום קטליטי קטן | ||
| קספאז-10 | Hs | (I/V/L) E(H/T)D | DED, תחום גדול, תחום קטליטי קטן | ||
| קספאז-3 | Hs, ממ | DEXD | תחום גדול, תחום קטליטי קטן | ||
| קספאז-6 | Hs, ממ | (I/V/L) E(H/T)D | תחום גדול, תחום קטליטי קטן | ||
| קספאז-7 | Hs, ממ | DEXD | תחום גדול, תחום קטליטי קטן | ||
| קספאז-14 | hs, מ"מ | (W/L) EHD | תחום גדול, תחום קטליטי קטן | ||
| קלף | תחום ההפעלה והגיוס של קספז | ||||
| דד | תחום אפקט המוות | ||||
| Hs | הומו סאפיאן | ||||
| מ"מ | שריר שרירי | ||||
טבלה 1: ספציפיות המצע ותחומי החלבונים של הקספזות. הטבלה לקוחה מתוך McStay et al.20; שאליני ואח' 3; ואן אופדנבוש ולמקנפי4.
טבלה משלימה 1: אנליזה קינטית של DEVD. אנא לחץ כאן כדי להוריד טבלה זו.
Discussion
בשיטה זו, מצע פלואורוגני משמש בבדיקה מבוססת אוכלוסייה או באנליזה של תא בודד למדידת פעילות קספאז-3/קספאז-7. שתי השיטות מודדות את פעילות הקספז באופן כמותי על בסיס מחשוף המצע. יתרון אחד הוא היכולת להשתמש בשיטות אלה עבור דגימות רבות. בשיטות אלה, פעילות קספאז-3/קספאז-7 מזוהה במקרופאגים ראשוניים המטופלים במימטיקת Smac.
היבט קריטי של הבדיקה הפלואואורומטרית מבוססת האוכלוסייה הוא הזמן מליזיס לקריאת הפלואורסצנציה. הדגימות חייבות להישמר על קרח לאורך כל ההליך, במיוחד לפני "קריאת" הבדיקה. זה מונע מחשוף מוקדם ופלואורסצנטיות של המצע. באמצעות הבדיקה מבוססת האוכלוסייה, ייתכן שיהיה צורך בפחות אופטימיזציה. כמות החלבון המשמשת בבדיקה מנורמלת, ומאפשרת להשוות ישירות את הדגימות. אזהרה אחת היא שבשלב מאוחר של מוות תאי אפופטוטי, כמות החלבון הכוללת מופחתת; לפיכך, זיהוי של פעילות קספז עשוי להיות בלתי אפשרי. קינטיקה שונה או מינונים שונים לטיפול מומלץ לעקוף בעיה זו. בנוסף, ניתן להשתמש בתוכנות אחרות כדי להעריך במדויק את קצב פעילות הקספז מלבד התוכנה המתוארת בשיטה זו.
עבור הבדיקה הציטומטרית של הזרימה, נדרשים מספיק אירועים או תאים כדי לשער את האוכלוסיות בביטחון. בנוסף, ייתכן שיהיה צורך באופטימיזציה נוספת בבדיקה מבוססת זרימה כדי להשיג את היחס האופטימלי בין המצע למספר התא. עם זאת, עם ציטומטריית זרימה, שיטה זו מתאימה עצמה למדידת פרמטרים נוספים, כגון סמני פני התא לזיהוי סוג התא.
הן האוכלוסייה והן שיטות חד-תאיות יכולות לשמש לקספזות אחרות. עם זאת, חשוב לזכור כי רצף הזיהוי מופלה פחות עבור קספזות אחרות. לפיכך, יש להשתמש בשיטות אחרות לפעילות קספז. זה כולל עיכוב של פעילות קספז, CRISPR או הפלת קספזות ספציפיות, וכתם מערבי כדי לזהות את המחשוף של מצעים ידועים.
שיטה חלופית אחת לזיהוי פעילות קספז היא הדמיית קיטועי זמן. אותו מצע קספז חדיר יכול לשמש יחד עם סמנים אחרים של כדאיות, כגון נספח V, כדי לספק מידע על הקינטיקה של מוות תאי. הדמיה גם תפריד בין פעילות הקספז לבין הישרדות התא, ותאפשר זיהוי כמויות תת-קטלניות של פעילות קספז באוכלוסיית תאים. הפונקציות הלא קטלניות של קספאז-3/קספאז-7 קשורות לוויסות אנטי-ויראלי בתאי מערכת החיסון המולדת29, במיוחד הפעלת IFN מסוג I באמצעות שחרור DNA מיטוכונדריאלי15,16. לכן, בדיקות אלה למדידת פעילות קספז הן קריטיות לזיהוי מצבים שונים של מוות תאי ועשויות להיות שימושיות בהערכת תפקודים שאינם מוות תאי.
Disclosures
למחברים אין ניגודי עניינים לחשוף.
Acknowledgements
W.W.W. נתמך על ידי מענק עמית מחקר רפואי Clöetta, S.R. נתמך על ידי CanDoc UZH Forschungskredit, ו- J.T. נתמך על ידי מועצת המלגות הסינית.
Materials
| Name | Company | Catalog Number | Comments |
| 1.5 mL microfuge tubes | Sarstedt | 72.706.400 | |
| 15 cm Petri plates | Sarstedt | 82.1184.500 | |
| 37 degree incubator shaker | IKA shaker KS 4000i | 97014-816 | distributed by VWR |
| 6-well cell culture dish | Sarstedt | 83.392 | |
| 96 well flat bottom, white polystyrene, non-sterile | Sigma | CLS3600 | |
| 96 well flat plate | Sarstedt | 82.1581 | |
| Ac-DEVD-AFC | Enzo Life Sciences | ALX-260-032-M005 | Caspase-3 substrate |
| BD Fortessa | BD | any flow cytometer with the appropriate excitation and emission detector will work | |
| b-glycerolphosphate | Sigma | G9422-10G | |
| caspase-3 recombinant | Enzo Life Sciences | ALX-201-059-U025 | |
| CHAPS | Sigma | 1.11662 | |
| DMEM, low glucose, pyruvate | Thermoscientific | 31885023 | |
| DMSO | Sigma | D8418-250ML | |
| EDTA | Sigma | 03685-1KG | |
| EGTA | Sigma | 324626-25GM | |
| Etoposide | MedChem Express | HY-13629 | |
| FBS | Thermoscientific | 26140 | |
| Flow cytometry tubes | Falcon | 352008 | |
| Flowjo | Flowjo | A license in required but any program that can analyze .fcs files will suffice | |
| Glycerol | Sigma | G5516-500ML | |
| HEPES | Sigma | H4034 | |
| Magic Red caspase-3/7 assay kit; flow cytometry or imaging | Immunochemistry Technologies | 935 | |
| M-CSF | ebioscience | 14-8983-80 | now a subsidiary of Thermoscientific |
| M-Plex | Tecan | any fluorometric reader will work with the appropriate excitation and emission detectors | |
| NaCl | Roth | 3957.1 | |
| PBS pH 7.4 | Thermoscientific | 10010023 | |
| Penicillin-Streptomycin-Glutamine (100X) | Thermoscientific | 10378016 | |
| Pierce BCA Protein Assay Kit | ThermoFisher Scientific | 23225 | protein concentration assay |
| protease inhibitors | Biomol | P9070.100 | |
| Smac mimetic, Compound A | Tetralogics | also known as 12911; structure shown in supplementary figures of Vince et al., Cell 2007 | |
| Sodium Fluoride | Sigma | S7920-100G | |
| sodium orthovanadate | Sigma | S6508-10G | |
| sodium pyrophosphate | Sigma | P8010-500G | |
| Staurosporine | MedChem Express | HY-15141 | |
| sucrose | Sigma | 1.07687 | |
| Tris Base | Sigma | T1503-1KG | |
| Triton X100 | Sigma | T8787-50ML | |
| TrypLE | Thermoscientific | A1285901 | In the protocol, it is listed as Trypsin |
References
- Ramirez, M. L. G., Salvesen, G. S. A primer on caspase mechanisms. Seminars in Cell and Developmental Biology. 82, 79-85 (2018).
- Nicholson, D. W., Thornberry, N. A. Caspases: Killer proteases. Trends in Biochemical Sciences. 22 (8), 299-306 (1997).
- Shalini, S., Dorstyn, L., Dawar, S., Kumar, S. Old, new and emerging functions of caspases. Cell Death and Differentiation. 22 (4), 526-539 (2014).
- Van Opdenbosch, N., Lamkanfi, M. Caspases in cell death, inflammation, and disease. Immunity. 50 (6), 1352-1364 (2019).
- Kesavardhana, S., Malireddi, R. K. S., Kanneganti, T. -. D. Caspases in cell death, inflammation, and pyroptosis. Annual Review of Immunology. 38, 567-595 (2020).
- Fu, T. -. M., et al. Cryo-EM structure of caspase-8 tandem DED filament reveals assembly and regulation mechanisms of the death-inducing signaling complex. Molecular Cell. 64 (2), 236-250 (2016).
- Jiang, X., Wang, X. Cytochrome c promotes caspase-9 activation by inducing nucleotide binding to Apaf-1. Journal of Biological Chemistry. 275 (40), 31199-31203 (2000).
- Christgen, S., Place, D. E., Kanneganti, T. -. D. Toward targeting inflammasomes: Insights into their regulation and activation. Cell Research. 30 (4), 315-327 (2020).
- Shi, J., et al. Cleavage of GSDMD by inflammatory caspases determines pyroptotic cell death. Nature. 526 (7575), 660-665 (2015).
- Sborgi, L., et al. GSDMD membrane pore formation constitutes the mechanism of pyroptotic cell death. EMBO Journal. 35 (16), 1766-1778 (2016).
- Rühl, S., et al. ESCRT-dependent membrane repair negatively regulates pyroptosis downstream of GSDMD activation. Science. 362 (6417), 956-960 (2018).
- Declercq, W., Takahashi, N., Vandenabeele, P. Dual face apoptotic machinery: From initiator of apoptosis to guardian of necroptosis. Immunity. 35 (4), 493-495 (2011).
- Newton, K., et al. Cleavage of RIPK1 by caspase-8 is crucial for limiting apoptosis and necroptosis. Nature. 574, 428-431 (2019).
- Fritsch, M., et al. Caspase-8 is the molecular switch for apoptosis, necroptosis and pyroptosis. Nature. 575, 683-687 (2019).
- White, M. J., et al. Apoptotic caspases suppress mtDNA-induced STING-mediated type I IFN production. Cell. 159 (7), 1549-1562 (2014).
- Rongvaux, A., et al. Apoptotic caspases prevent the induction of type I interferons by mitochondrial DNA. Cell. 159 (7), 1563-1577 (2014).
- Nakajima, Y. -. I., Kuranaga, E. Caspase-dependent non-apoptotic processes in development. Cell Death and Differentiation. 24, 1422-1430 (2017).
- Kumar, S., Dorstyn, L., Lim, Y. The role of caspases as executioners of apoptosis. Biochemical Society Transactions. 50 (1), 33-45 (2022).
- Agniswamy, J., Fang, B., Weber, I. T. Plasticity of S2-S4 specificity pockets of executioner caspase-7 revealed by structural and kinetic analysis. FEBS Journal. 274 (18), 4752-4765 (2007).
- McStay, G. P., Salvesen, G. S., Green, D. R. Overlapping cleavage motif selectivity of caspases: implications for analysis of apoptotic pathways. Cell Death and Differentiation. 15 (2), 322-331 (2008).
- Thornberry, N. A., et al. A combinatorial approach defines specificities of members of the caspase family and granzyme B. Functional relationships established for key mediators of apoptosis. Journal of Biological Chemistry. 272 (29), 17907-17911 (1997).
- Vince, J. E., et al. IAP antagonists target cIAP1 to induce TNFalpha-dependent apoptosis. Cell. 131 (4), 682-693 (2007).
- McComb, S., et al. cIAP1 and cIAP2 limit macrophage necroptosis by inhibiting Rip1 and Rip3 activation. Cell Death and Differentiation. 19 (11), 1791-1801 (2012).
- Wong, W. W. -. L., et al. cIAPs and XIAP regulate myelopoiesis through cytokine production in an RIPK1- and RIPK3-dependent manner. Blood. 123 (16), 2562-2572 (2014).
- Liu, X., Quan, N. Immune cell isolation from mouse femur bone marrow. Bio-Protocol. 5 (20), e1631 (2015).
- Lin, H., Chen, C., Chen, B. D. Resistance of bone marrow-derived macrophages to apoptosis is associated with the expression of X-linked inhibitor of apoptosis protein in primary cultures of bone marrow cells. Biochemical Journal. 353 (Pt 2), 299-306 (2001).
- . Caspase activity assay buffer. Cold Spring Harbor Protocols. , (2015).
- Mackridge, A., Rowe, P. One-way analysis of variance (ANOVA) - Including Dunnett's and Tukey's follow up tests. Practical Approach to Using Statistics in Health Research: From Planning to Reporting. , 93-103 (2018).
- Chen, H., Ning, X., Jiang, Z. Caspases control antiviral innate immunity. Cellular and Molecular Immunology. 14 (9), 736-747 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved