Method Article
עריכה גנטית של תאי Rhesus Macaque B ראשוניים
In This Article
Summary
אנו מציגים שיטה לתרבית ועריכה גנטית של תאי מקוק B רזוס ראשוניים באמצעות CRISPR/Cas9 וסרוטיפ 6 הקשור לנגיף אדנו רקומביננטי לחקר טיפולים בתאי B.
Abstract
תאי B וצאצאיהם הם המקורות לנוגדנים בעלי ביטוי גבוה. יכולות ביטוי החלבונים הגבוהות שלהם, יחד עם השפע שלהם, הנגישות הקלה שלהם דרך הדם ההיקפי והיכולת להעברות אימוץ פשוטות, הפכו אותם למטרה אטרקטיבית לגישות עריכת גנים לביטוי נוגדנים רקומביננטיים או חלבונים טיפוליים אחרים. העריכה הגנטית של תאי B ראשוניים של עכברים ובני אדם היא יעילה, ומודלים של עכברים למחקרי in vivo הראו הבטחה, אך היתכנות ומדרגיות עבור מודלים גדולים יותר של בעלי חיים לא הוכחו עד כה. לכן, פיתחנו פרוטוקול לעריכת תאי B ראשוניים של מקוק רזוס במבחנה כדי לאפשר מחקרים כאלה. אנו מדווחים על תנאים לתרבית חוץ גופית ולעריכה גנטית של תאי מקוק B רזוס ראשוניים מתאי דם חד-גרעיניים היקפיים או מטחול באמצעות CRISPR/Cas9. כדי להשיג אינטגרציה ממוקדת של קלטות גדולות (<4.5 קילובייט), נכלל פרוטוקול מהיר ויעיל להכנת סרוטיפ 6 וירוס הקשור באדנו רקומביננטי כתבנית תיקון מכוונת הומולוגיה באמצעות וקטור עוזר אדנו-ויראלי התומך בטטרציקלין. פרוטוקולים אלה מאפשרים לחקור טיפולים פוטנציאליים בתאי B בקופי מקוק רזוס.
Introduction
תאי B הם הבסיס לחסינות הומורלית. עם הפעלתם על ידי אנטיגן קוגניטיבי ואותות משניים, תאי B נאיביים יוצרים תאי מרכז נבט B, תאי זיכרון B ותאי פלזמה1. האחרון הוא המקור לנוגדנים המופרשים המתווכים את תפקודי ההגנה של רוב החיסונים הזמינים כיום2. תאי פלזמה תוארו כמפעלי נוגדנים מכיוון שהם מפרישים כמויות עצומות של נוגדנים לסרום - בערך 2 ננוגרם/יום/תא3, בהיקף של 7-16 גרם / ליטר בסרום, מה שהופך את הנוגדנים לאחד משלושת החלבונים הנפוצים ביותר בסרום4. תאי B נמצאים בשפע בדם ולכן ניתן להשיגם בקלות ולהחדיר אותם בחזרה לאדם.
תכונות אלה הפכו את תאי B למטרה של מאמצי תרפיה תאית לעריכה גנטית של קולטן תאי B (BCR) ולבטא נוגדנים מנטרלים באופן רחב (bNAbs) לנגיף הכשל החיסוני האנושי (HIV)5,6,7,8,9,10,11,12,13,14,15 וחלבונים אחרים 16, 17,18,19,20,21. גישות כאלה הראו פוטנציאל במחקרי עכברים רבים in vivo 7,8,10,11,16,22. עם זאת, עדיין יש להתגבר על מספר משוכות עבור תרגום קליני 9,15,23, ביניהן בטיחות, משך וגודל היעילות הטיפולית, כמו גם הרחבה לבעלי חיים גדולים יותר כגון פרימטים לא אנושיים (NHPs). ואכן, NHPs, ובמיוחד קופי מקוק רזוס, שיש להם היסטוריה ארוכה במחקר נוגדנים ו- HIV24,25, הם המודל המתאים ביותר לבדיקת פרמטרים אלה.
כאן, פיתחנו פרוטוקולים המאפשרים לטפל בבעיות אלה. עד כה, מחקרים מעטים ניסו לגדל תאי Rhesus macaque B ex vivo, ורק ברירה חיובית באמצעות CD20 דווחה לטיהור תאי rhesus macaque B26,27,28. קבענו פרוטוקול לבידוד תאי Rhesus macaque B שלא נגעו בהם על ידי דלדול שלילי של סוגי תאים אחרים. יתר על כן, תנאי גידול מוגדרים לעריכה גנטית ממוקדת של תאי Rhesus macaque B. פרוטוקול זה מתאר את השימוש ב-CRISPR/Cas9 ribonucleoproteins (RNPs) וב-recombinant adeno-associated virus serotype 6 (rAAV6) כתבנית תיקון מכוונת הומולוגיה (HDRT) לעריכת גנים של תאי Rhesus macaque B בתרבית. באמצעות פרוטוקול זה, יעילות עריכה של עד 40% עם תוספות גדולות (~ 1.5 kb) הושגו. אנו מציגים גם שיטה מהירה וחסכונית לייצור rAAV6 באמצעות עוזר אדנו-ויראלי29 תומך טטרציקלין ומשתיק את עצמו כדי לאפשר בדיקה מהירה של HDRT בפורמט זה. יחד, פרוטוקולים אלה מתארים זרימת עבודה יעילה לעריכה גנטית של תאי Rhesus macaque B (איור 1), המאפשרת הערכה של טיפולים בתאי B במודל NHP.
כדי להתחיל את הניסויים, חומר תורם ניתן להזמין ממקורות מסחריים או להשיג על ידי phlebotomies או כריתת טחול. במחקר זה, הפלבוטומיות ואיסוף הדם בוצעו כפי שתואר קודם30 באמצעות נוגד הקרישה EDTA. כדי להשיג תאי מקוק מסוג Rhesus מקוק B ראשוניים, בוצעו כריתות טחול חלקיות (25%-50%) או שלמות באמצעות טכניקות שדווחו קודם לכן31. החיות היו בצום לילה לפני הניתוח. בקצרה, במהלך הניתוח, הבטן נחתכה והוכן עם קרצוף לסירוגין של כלורהקסידין ו 70% אלכוהול איזופרופיל שלוש פעמים. בוצע חתך (5-10 ס"מ) בבטן כדי לזהות ולבודד את הטחול. כלי הדם של הטחול נקשרו בתפרים או במלחציים וסקולריים. החתך נסגר בשתי שכבות עם תפרים פולידיוקסאנון PDS 4-0. כריתת טחול בוצעה פעם אחת עבור חיה בודדת. מתלים חד-תאיים הוכנו מטחול מקוק על ידי השרייה באמצעות מסננות תאים. תאים חד-גרעיניים מתרחיפים של תאי דם וטחול הוכנו באמצעות צנטריפוגה הדרגתית של צפיפות ואוחסנו בחנקן נוזלי.
Protocol
כל ההליכים והניסויים בבעלי חיים בוצעו על פי פרוטוקולים שאושרו על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים של המכון הלאומי לאלרגיה ומחלות זיהומיות, המכונים הלאומיים לבריאות. סיכום הפרוטוקולים הבאים מוצג באיור 1. קופי מקוק רזוס זכרים ונקבות (Macaca mulatta) ממוצא גנטי הודי בגילאי 2-8 שנים שוכנו וטופלו בהתאם להנחיות הוועדה לטיפול ושימוש בחיות מעבדה במתקן ברמת בטיחות ביולוגית 2.
זהירות: כל הניסויים בוצעו בהתאם לאמצעי הזהירות האוניברסליים לפתוגנים הנישאים בדם, עם טכניקות סטריליות/אספטיות וציוד בטיחות ביולוגית מתאים ברמה 2 במנדפים של זרימה למינרית.
1. ייצור rAAV6
- הכן את הריאגנטים לייצור rAAV6.
- תכנן ושכפל את תבנית התיקון מכוונת ההומולוגיה בין חזרות המסוף ההפוכות (ITR) של AAV2 ב- pAAV הווקטורי באמצעות טכניקות סטנדרטיות. ודא שזרועות ההומולוגיה הן לפחות ~ 250 bp מכל צד, אך רק 60 bp עשוי להספיק, אם כי זרועות הומולוגיה ארוכות יותר עדיפות אם עיצוב המבנה מאפשר זאת. אם רצפי מטרה של אחד מה-sgRNA המשומשים נמצאים ב-HDRT, הסירו אותם באמצעות מוטציות שקטות, שהן היעילות ביותר במוטיב הפרוטוספייסר הסמוך או באזור הזרעים של אתר המטרה.
הערה: ניתן לבצע סינתזת גנים בשילוב עם הרכבת גיבסון לשיבוט יעיל32. הכן Maxiprep של שיבוט נכון עבור transfection. עבור תכנון sgRNA, מומלץ CHOPCHOP33, ורשימה של כלים נוספים ניתן למצוא בכתובת https://zlab.bio/guide-design-resources. קיבולת האריזה המרבית עבור AAV כולל ITR היא ~ 4.7 kb. AAV6 הוא הסרוטיפ הנפוץ ביותר לעריכת תאים המטופויטיים, במיוחד תאי B9. סרוטיפים אחרים של AAV לעריכה גנטית של תאי Rhesus macaque B לא נבדקו, אך AAV28 ו- AAV-DJ10,11 שימשו במחקרי עכברים. - הכינו מדיום תרבית 293AAV ומדיום ייצור לפי טבלה 1 וטבלה 2. מסנן סטרילי דרך יחידת מסנן קרום פוליאתרסולפון (PES) 0.2 מיקרומטר. יש לאחסן בטמפרטורה של 4°C.
- הכינו תמיסת פוליאתילנימין (PEI) 1x (1 מ"ג/מ"ל, 100 מ"ל).
- בכד זכוכית של 250 מ"ל, מחממים ~ 70 מ"ל של H2O במיקרוגל למשך ~30 שניות, ולאחר מכן מוסיפים 100 מ"ג PEI. מוסיפים מערבל מגנטי ומערבבים עד שה-PEI מומס ברובו.
- כוונן את ה- pH ל- 7 עם 1 M HCl, ולאחר מכן מלא עד 100 מ"ל עם H2O, המתן 10 דקות, בדוק שוב את ה- pH וכוונן במידת הצורך.
- סנן סטרילי את תמיסת PEI דרך יחידת מסנן קרום PES של 0.2 מיקרומטר, aliquot ואחסון -20°C. לאחר ההפשרה, ניתן לאחסן את התמיסה ב 4 מעלות צלזיוס למשך עד חודשיים.
- הכינו תמיסת 5x פוליאתילן גליקול (PEG)/NaCl.
- שוקלים 400 גרם PEG 8,000 ו-24 גרם NaCl.
- הוסיפו מערבל מגנטי לכוס זכוכית בנפח 2 ליטר, הוסיפו את ה-PEG 8,000 וה-NaCl ושטפו ב~550 מ"ל מים נטולי יונים.
- מערבבים עם חימום, ומביאים לרתיחה או 80-90 מעלות צלזיוס עד להמסה מלאה.
- כוונן את ה- pH ל~ 7.4 עם 1 M NaOH, ולאחר מכן כוונן את עוצמת הקול ל- 1 L באמצעות גליל מדידה, והעבר אותו לבקבוק זכוכית 2 L עם המערבל המגנטי.
- הוציאו את הבקבוק, הבוחש המגנטי והתמיסה באמבט מים למשך 30 דקות בטמפרטורה של 121°C.
- לאחר האוטוקלאבינג, קררו את התמיסה בחדר קר תוך כדי ערבוב באמצעות המערבל המגנטי למניעת הפרדה לפאזות שונות. Aliquot במידת הצורך, ולאחסן ב 4 °C.
- הכן את מאגר הניסוח.
- ערבבו 500 מ"ל של DPBS עם 50 μL של 10% F-68 פלורוני. יש לסנן סטרילי דרך יחידת מסנן קרום PES בגודל 0.2 מיקרומטר, ולאחסן בטמפרטורת החדר (RT).
- תכנן ושכפל את תבנית התיקון מכוונת ההומולוגיה בין חזרות המסוף ההפוכות (ITR) של AAV2 ב- pAAV הווקטורי באמצעות טכניקות סטנדרטיות. ודא שזרועות ההומולוגיה הן לפחות ~ 250 bp מכל צד, אך רק 60 bp עשוי להספיק, אם כי זרועות הומולוגיה ארוכות יותר עדיפות אם עיצוב המבנה מאפשר זאת. אם רצפי מטרה של אחד מה-sgRNA המשומשים נמצאים ב-HDRT, הסירו אותם באמצעות מוטציות שקטות, שהן היעילות ביותר במוטיב הפרוטוספייסר הסמוך או באזור הזרעים של אתר המטרה.
- תרבית תאים, טרנספקציה והתמרה לייצור rAAV6
- הפשרה, תרבית והקפאה של תאי 293AAV כמתואר על ידי היצרן באמצעות מדיום התרבית 293AAV לעיל וטריפסין-EDTA לפיצול. מומלץ להקפיא כמה מעברים מוקדמים ולהשתמש בתאים לייצור AAV לפני שהם מגיעים למעבר 40.
- לייצור rAAV6, זרעו ארבע צלחות תרבית תאים בקוטר 15 ס"מ עם 5 x 106 תאים ב-30 מ"ל כל אחת. התאים מוכנים לטרנספקציה בדרך כלל 1-2 ימים לאחר הזריעה כאשר הם מגיעים למפגש של 80%-90%.
- הפשירו Maxiprep של פלסמיד pAAV המכיל HDRT שייארז לתוך AAV6. השהה 85.6 מיקרוגרם של פלסמיד pAAV ב 3 מ"ל של מדיום DMEM טהור.
- להמיס 342 μL של 1 מ"ג/מ"ל תמיסת PEI ב-3 מ"ל של מדיום DMEM טהור. דגרו על שני הפתרונות למשך 10 דקות ב-RT.
- מערבבים את שני צינורות 3 מ"ל לצינור אחד של ~ 6.4 מ"ל של תערובת טרנספקציה, ודגרים במשך 20 דקות ב- RT.
- בינתיים, הפשירו את וקטור העזר RepCap6 התומך בטטרציקלין, התומך בטטרציקלין, מהמקפיא בטמפרטורה של 80°C באמבט מים של 37°C. כדי להתמיר את תאי 293AAV, הוסף את וקטור העזר בריבוי זיהומים (MOI) של 25 באמצעות מינון זיהומי חציוני של תרבית רקמה (TCID 50) ובהנחה של 1.15 x10 7 תאים לצלחת; בדרך כלל, 2-10 μL משמש לכל צלחת 15 ס"מ. נענעו וערבלו את הכלים בעדינות לפיזור.
- לאחר הדגירה של תערובת transfection, להוסיף 1.6 מ"ל ממנו טיפה על פני כל אחד מארבעת הכלים 15 ס"מ. יש לדגור על 37°C ו-5% CO2 למשך הלילה.
הערה: לחלופין, אם וקטורי rAAV6 המעניינים כבר זמינים, ניתן להשתמש בווקטורים אלה כדי לספק את הגנום הנגיפי שיש לארוז, מה ששולל את הצורך בפלסמידים כלשהם עם מערכת זו ומניב טיטרים rAAV6 דומים. עבור גישה זו, תאי 293AAV מומרים יחד עם rAAV6 הרצוי ב- MOI של 50 (מבוסס על עותקי גנום rAAV6 [GC]/mL) יחד עם וקטור המסייע. - למחרת, בזהירות לשאוף ולהשליך את מדיום התרבית, ולהחליף עם 30 מ"ל של מדיום ייצור מחומם מראש. דוגרים עוד 96 שעות לפני הקציר. לא מומלץ שינוי בינוני נוסף כדי למקסם את התשואות.
- קציר וטיהור של AAV6 רקומביננטי מן המדיום
- מבלי לנתק תאים מהצלחת, אספו את כל הסופרנאטנט של התא ליחידת סינון עם קרום PES של 0.2 מיקרומטר הגדול לפחות ב-50% מנפח המדיום שיש לסנן. לאחר מכן, סנן את supernatant.
הערה: אם רוצים יבולים גבוהים יותר של rAAV6, ניתן לקצור את התאים ולחלץ את ה-rAAV מכדורית התא באמצעות ערכות מסחריות או פרוטוקולים מבוססים34,35. מכיוון ש-AAV6 מופרש ברובו לתווך36, נעשה שימוש רק בסופרנאטנט, מה שהפחית את העבודה, העלות והזמן. - הוסף תמיסת 5x PEG/NaCl לסופרנאטנט המסונן ב-25% מהנפח שנאסף; זה בדרך כלל 30 מ"ל אם ארבעה כלים 15 ס"מ של 30 מ"ל משמשים.
- מערבבים היטב על ידי היפוך, ולאחר מכן לדגור לילה ב 4 °C כדי לזרז את החלקיקים הנגיפיים.
הערה: חלקיקי AAV יציבים עד יומיים בתמיסה זו. - מקררים מראש צנטריפוגת דלי נדנדה עם 250 מ"ל של תוספות צינור ל -4 מעלות צלזיוס. הכינו יחידת מסנן צנטריפוגלית של 4 מ"ל עם חיתוך של 100 kDa ומסנן מזרק PES הידרופילי של 0.22 מיקרומטר על ידי טיפול מקדים בכל ממברנה עם 2 מ"ל של 10% F-68 פלורוני למשך שעה לפחות אחת ב-RT.
- מעבירים את תערובת AAV-PEG/NaCl לתוך צינור בנפח 250 מ"ל, צנטריפוגה בטמפרטורה של 2,500 x גרם למשך שעה אחת ב-4°C, ולאחר מכן מסירים בזהירות את כל הסופרנאטנט בשאיפה.
- יש להשהות מחדש את הגלולה הנגיפית בצבע בז' ללבן על ידי ערבול של 4 מ"ל של 1 M HEPES עד להשעיה מלאה. במידת הצורך, תן לו לעמוד במשך 5 דקות, מערבול שוב. השהה מחדש באמצעות פיפטה סרולוגית 5 מ"ל, ולהעביר את הנפח הכולל לתוך צינור 15 מ"ל.
- במכסה אדים, הוסיפו נפח שווה של כלורופורם לתרחיף הנגיף - בדרך כלל 4 מ"ל.
- מערבל במרץ במשך 2 דקות, ולאחר מכן צנטריפוגה ב 1,000 x גרם במשך 5 דקות ב RT.
- אספו את השכבה העליונה (סופרנאטנט המכיל AAV) בצינור חדש של 50 מ"ל, והשליכו את השכבה התחתונה (כלורופורם).
זהירות: תמיסות המכילות כלורופורם הן פסולת מסוכנת. פעל בהתאם להנחיות המוסדיות לסילוקו. - מניחים את הסופרנאטנט המכיל AAV מתחת למכסה אדים, ונותנים לכלורופורם הנותר להתאדות למשך 30 דקות.
- בינתיים, לשטוף את יחידת המסנן הצנטריפוגלי מראש מסנן מזרק.
- הוסף 1.5 מ"ל של חיץ ניסוח ליחידת המסנן הצנטריפוגלי שטופלה מראש. צנטריפוגה במהירות 3,500 x גרם למשך 10 דקות ב-15°C ברוטור דלי מתנדנד. חזור על שלב זה עם 4 מ"ל של חיץ ניסוח כדי לשטוף את הממברנה.
- שטפו את מסנן המזרק פעמיים עם 5 מ"ל של חיץ פורמולציה באמצעות מזרק 5 מ"ל.
- טען את ~4 מ"ל של סופרנאטנט המכיל AAV ממיצוי הכלורופורם לתוך מזרק 5 מ"ל, חבר את מסנן המזרק השטוף וסנן ישירות ליחידת המסנן הצנטריפוגלי.
- צנטריפוגה בטמפרטורה של 3,500 x גרם למשך 25 דקות ב-15°C, ולאחר מכן אשרו שתמיסת ה-AAV במסנן היא בסביבות 50-100 μL. אם נפח התמיסה הוא >100 μL, המשך לצנטריפוגה.
- לאחר הסרת התסנין, מוסיפים 4 מ"ל של חיץ פורמולציה בתוך יחידת המסנן הצנטריפוגלי, ומערבבים את התמיסה באופן אחיד על ידי פיפט. צנטריפוגה ב 3,500 x גרם במשך 25 דקות ב 15 ° C, ולאחר מכן לאשר כי פתרון AAV במסנן הוא בין 50-100 μL. אם נפח התמיסה הוא >100 μL, המשך לצנטריפוגה. חזור על שלב זה לשטיפה נוספת.
- לאחר הצנטריפוגה הסופית, לאשר את נפח הפתרון הוא 50-70 μL; אם לא, המשיכו לצנטריפוגה. מעבירים את התכשיר לצינור של 1.5 מ"ל. Aliquot אם תרצה, ולאחסן ב -80 ° C.
- מבלי לנתק תאים מהצלחת, אספו את כל הסופרנאטנט של התא ליחידת סינון עם קרום PES של 0.2 מיקרומטר הגדול לפחות ב-50% מנפח המדיום שיש לסנן. לאחר מכן, סנן את supernatant.
- קביעת טיטר רקומביננטי AAV6 על ידי qPCR
הערה: פריימרים qPCR anneal באזור ITR וצריך, לכן, להיות מתאים לכל המבנים המשוכפלים לתוך pAAV.- הפשיר aliquot של rAAV6 להיות titered ו aliquot של חומר עזר AAV6. חומר הייחוס AAV6 צריך להיות קרוב ל 4 x 1011 GC / mL; אחרת, התאימו את הדילולים בהתאם.
- בצע DNase I digest כדי להסיר כל DNA פלסמיד חופשי שנותר בהכנת rAAV6 על ידי שילוב של 2.0 μL של הדגימה או חומר ייחוס AAV6 עם 15.6 μL של H 2 O נטול נוקלאז,2.0μL של 10x DNase I חוצץ, ו 0.4 μL של DNase I.
- מערבבים ודוגרים בעדינות במשך 30 דקות ב-37°C ולאחר מכן מעבירים לקרח. זהו דילול 1 (ראה טבלה 3).
- הכינו דילול סדרתי פי חמישה של כל הדגימות וחומר הייחוס AAV6 כמו בטבלה 3 להלן עם מים.
- הכינו תערובת מאסטר qPCR ירוקה של SYBR. בכל באר, יש לערבב 4.7 μL של מים נטולי נוקלאז עם 10 μL של תערובת מאסטר SYBR Green, 0.15 μL של פריימר ITR קדימה ב-100 μM, ו-0.15 μL של פריימר ITR הפוך ב-100 μM.
הערה: כל דגימה נמדדת בכפילות, עם 16 בארות עבור תקן הייחוס, 8 בארות לכל דגימה ו-2 בארות עבור בקרה ללא תבנית. הכינו 10% יותר תערובת מאסטר כדי לקחת בחשבון את שגיאת הפיפט. - בלוח תגובה אופטי של 96 בארות או 384 בארות, טען 15 μL / well של תערובת האב qPCR ירוקה של SYBR.
- לאחר מכן, טען 5 μL של דגימות וחומר ייחוס AAV6 או מים נטולי נוקלאז עבור הבקרה ללא תבנית. עבור תקן הייחוס AAV6, דילול עומס 2 לדילול 9. עבור דגימות, דילול עומס 5 לדילול 8. למדוד כל דילול בכפילות. הימנעו מבועות.
- אטמו את הצלחת הטעונה בסרט אופטי שקוף, צנטריפוגה ב 800 x גרם למשך דקה אחת ב- RT, וטענו את הצלחת למכשיר qPCR עם ההתקנה המתאימה של 96 באר או 384 בארות.
- הגדר והפעל את מכשיר qPCR באמצעות זיהוי SYBR עם תנאי המחזור הבאים: 98 ° C למשך 3 דקות, ולאחר מכן 40 מחזורים של 98 ° C עבור 15 שניות ו- 58 ° C במשך 30 שניות, ולאחר מכן עקומת התכה.
- נתח את הנתונים באמצעות תוכנת המכשיר תוך שימוש בריכוז חומר הייחוס AAV6 בעותקי גנום למילימטר (GC/mL) כעקומה הסטנדרטית (ראה טבלה 3). חישוב הריכוז הסופי של הדגימה על ידי הכפלה בגורם הדילול.
- ודא שהעקומה הסטנדרטית R2 קרובה ל -1.0, יעילות ה- PCR היא 90%-110%, קו הבסיס הוסר, עקומת ההיתוך מראה שיא יחיד, ערכי C t משתנים בהתאם לדילולים, והכפילויות הן בטווח של 0.5 Ct; אחרת, לא לכלול חריגים. צפו לתשואות כמו באיור 2.
2. הכנת מדיה וגירויים של תאי B
- הכן אמצעי הפשרה: שלב RPMI-1640 עם 20% FCS. מסנן סטרילי דרך יחידת מסנן קרום PES בגודל 0.2 מיקרומטר. יש לאחסן בטמפרטורה של 4°C.
- הכן מדיום תרבית תאי B: שלב את הריאגנטים בטבלה 4, ולאחר מכן סנן סטרילי דרך יחידת מסנן קרום PES של 0.2 מיקרומטר. יש לאחסן בטמפרטורה של 4°C.
- השהה מחדש כל אחד מממריצי תאי B בטבלה 5 בריכוזי מלאי בתווך תרבית תאי B, למעט CpG ODN שיש להשהות מחדש במים נטולי נוקלאז. יש לאחסן בטמפרטורה של -80°C.
- אם אתם מבצעים דלדול שלילי של תאי B שאינם תאי B (שלב 4 אופציונלי), הכינו DPBS (ללא סידן, ללא מגנזיום) עם 2% FCS (DPBS 2% FCS). מסנן סטרילי דרך יחידת מסנן קרום PES בגודל 0.2 מיקרומטר. יש לאחסן בטמפרטורה של 4°C.
3. הכנה ותרבית של תאי מקוק רזוס B
הערה: PBMCs מקוק רזוס שמור בהקפאה או splenocytes משמשים להגדרת תרבית התא30,31.
- הפשרה מראש בינונית ותרבית תאי B באמבט מים של 37 מעלות צלזיוס. הפשירו את הממריצים של תאי B מטבלה 5 על קרח.
- הכינו צינור בגודל מתאים המכיל אמצעי הפשרה שחומם מראש. זה צריך להיות באופן אידיאלי יותר מ 10 פעמים נפח של תאים מופשרים.
- הפשיר אחד או שניים cryovials של PBMCs או splenocytes בכל פעם באמבט מים 37 ° C, ו decant לתוך צינור מוכן עם מדיום שחומם מראש. שטוף את cryotubes כדי לאסוף את כל התאים.
- צנטריפוגה את התאים ב 200 x גרם במשך 10 דקות ב RT.
הערה: הגדרות צנטריפוגות אלה מפחיתות את זיהום טסיות הדם תוך שמירה על תפוקת PBMC. ניתן להשתמש במהירויות גבוהות יותר כגון 350 x גרם למשך 5 דקות. - להשהות את התאים ב 10 מ"ל מדיום הפשרה לשטיפה.
- חזור על שלב 3.4 ושלב 3.5 עבור סך של שלוש צנטריפוגות כדי להסיר את המדיום המקפיא. לאחר הצנטריפוגה האחרונה, השהה מחדש את התאים ב ~ 5 x 106 תאים / מ"ל בתווך תרבית תאי B.
הערה: תרביות הפרוטוקול לעיל מכילות תכשירי PBMC או טחול שלמים עם זיהום על ידי תאים אחרים. אם נדרשות תרביות תאי B טהורות יותר, אם כי בתפוקה הכוללת הכוללת של תאי B מופחתת משמעותית, המשך לשלב 4. לא נצפו הבדלים ביעילות העריכה בין שתי השיטות. - לדלל aliquot של 10 μL של תאים לפי הצורך עם מדיום תרבית תא B לספירה. ספירה באמצעות המוציטומטר וצביעה כחולה טריפאן, המשלבת נפחים שווים של תאים מרחפים ותמיסת טריפאן כחולה 0.4%.
- התאם את ריכוז התא ל 3 x 106 תאים / מ"ל עם מדיום תרבית תאי B בהתאם לספירת התא. לאחר מכן, הוסיפו את הממריצים של תאי B לריכוזים הסופיים שלהם לפי טבלה 5, וערבבו.
- מעבירים את התאים לצלחת תרבית תאים מתאימה. בסך הכל, מומלץ 0.6 x 10 6-0.7 x 106 תאים/ס"מ2. לדגור על התאים ב 37 ° C עם 5% CO 2 במשך 48 שעות ±2 שעות.
4. דלדול שלילי אופציונלי של תאים שאינם B
הערה: התפוקה והטוהר תלויים באחוז הקלט של תאי B בקרב PBMCs, אשר יכול להיות שונה באופן דרסטי בין קופי מקוק רזוס בודדים27. צפה לטוהר של 80%-95%, יעילות של 60% ו- 1 x 10 6-1.5 x 106 תאים מ- 1 x 107 PBMCs.
- לאחר השטיפה האחרונה (שלב 3.6), השהה מחדש את התאים ב- 1 x 108 תאים/מ"ל ב- DPBS 2% FCS ובלוק Fc אנושי מדולל 1:200. ספירת התאים מבוססת על מספר התאים המופשרים.
- דגרו במשך 15 דקות על קרח כדי לחסום את קולטני ה-Fc, ולאחר מכן הוסיפו את הנוגדנים הביוטיניליים בטבלה 6. דוגרים עוד 20 דקות על קרח.
- מלא את הצינור עם DPBS 2% FCS, וסחרור ב 200 x גרם במשך 10 דקות ב 4 ° C.
- השהה מחדש את התאים ב- DPBS 2% FCS ב- 80% מהנפח משלב 4.1 (כלומר, 80 מיקרוליטר לכל 1 x 107 תאים).
- הוסף חרוזי סטרפטאבידין מגנטיים לתרחיף התא ב-20% מהנפח משלב 4.1 (כלומר, 20 מיקרוליטר חרוזים לכל 1 x 107 תאים).
- דוגרים על התאים במשך 15 דקות על קרח, ומתסיסים מדי פעם.
- בינתיים, לכל 1 x 108 תאים, להכין מפריד מגנטי עם עמוד דלדול מגנטי גדול מסנן טרום הפרדה. שטפו את מסנן קדם-ההפרדה ואת העמוד עם 2 מ"ל של DPBS 2% FCS לפי זרימת כוח הכבידה, והשליכו את הזרימה. התקן צינור איסוף של 15 מ"ל.
הערה: השימוש בעמודות אחרות כגון עמודות בחירה חיובית או מערכות טיהור חרוזים מגנטיות אחרות עלול להפחית באופן דרסטי את הטוהר. - לאחר הדגירה, מלא את התאים ל 0.5 מ"ל עם DPBS 2% FCS אם נפח הוא <0.5 מ"ל. אם עוצמת הקול היא ≥0.5 מ"ל, פשוט המשך.
- טען את מתלה התא לתוך מסנן טרום ההפרדה על העמודה המוכנה, ולאסוף את הזרימה דרך לתוך צינור 15 מ"ל.
- יש להקפיד פעמיים על תאי B מועשרים שאינם מאוגדים על-ידי הוספת 1 מ"ל של DPBS 2% FCS למסנן טרום ההפרדה. אספו את התאים הלא קשורים לאותו צינור על ידי זרימת כוח הכבידה.
הערה: אלוציה נוספת עשויה להגדיל באופן שולי את התשואה. ניתן להעריך את הטוהר והיעילות על ידי ציטומטריית הזרימה של תאי הקלט, התאים המועשרים והתאים הנשמרים על העמודה. כדי להשיג את התאים השמורים בעמודה, הסר את העמודה מהמגנט ושטוף עם 3 מ"ל של DPBS 2% FCS באמצעות הבוכנה שסופקה. אם תרצה, הערך את הטוהר לפי ציטומטריית זרימה כמו באיור 3 באמצעות ריאגנטים בטבלה 7. - צנטריפוגה את תאי B המועשרים ב 200 x גרם במשך 10 דקות ב 4 ° C.
- השהה מחדש את התאים ב ~ 5 x 106 תאים / מ"ל בתווך תרבית תאי B, והמשך בשלב 3.7.
5. עריכת גנים ראשונית של תאי Rhesus macaque B
- לאחר הפעלת תאי Rhesus macaque B במשך 48 שעות ± 2 שעות, להכין את ריאגנטים אלקטרופורציה ו transduction.
- DMSO טרום חם, מאגר דופלקס ללא נוקלאז, חיץ T וחיץ E (ערכת אלקטרופורציה של 10 μL) או E2 (ערכת אלקטרופורציה של 100 μL) מערכת האלקטרופורציה ל- RT.
- הפשירו את הממריצים rAAV6 HDRT ותאי B מטבלה 5 על קרח.
- השהה מחדש את ה-sgRNA מסוג CRISPR-Cas9 ב-100 מיקרומטר במאגר דו-צדדי. צור מחדש במשך 10 דקות ב- RT, וערבב על ידי ערבול והחלקה. יש לשמור את ה-sgRNA המשוחזר על קרח עד לשימוש. יש לאחסן בטמפרטורה של -80°C.
הערה: ניתן לתכנן את CRISPR-Cas9 sgRNA עם כלים מקוונים שונים (ראה 1.1.1) והוא יכול להשתנות באופן דרסטי ביעילות החיתוך שלהם. בדיקה אמפירית של יעילות החיתוך מומלצת באמצעות בדיקות כגון TIDE37 או ICE38. - לכל אלקטרופורציה של 10 מיקרוליטר, הכינו 550 מיקרוליטר של מדיום תרבית תאי B עם כל הממריצים מטבלה 5, והוסיפו 1% DMSO. שנה את קנה המידה של הנפחים פי 10 עבור אלקטרופורציות של 100 μL. לחלופין, 10% של מדיום זה יכול להיות מוכן ללא אנטיביוטיקה antimycotic, אשר מגדיל מעט את הכדאיות התא לאחר transfection.
- לכל אלקטרופורציה של 10 μL, הכינו באר של צלחת תרבית תאים של 48 בארות עם 50 μL של מדיום תרבית תאי B עם ממריצים וללא אנטיביוטיקה-אנטי-מיקוטית, אם משתמשים בה. עבור אלקטרופורציות של 100 μL, פיפטה 500 μL לתוך בארות של צלחת 6 בארות.
- הוסף rAAV6 HDRT למדיום הבארות, עד 20% מהנפח בבאר. יש לכוון ל-MOIs בטווח של 1 x 10 5-1 x 10 6 בהתבסס על מספר התאים לכל טרנספקציה (10 μL אלקטרופורציה: 5 x 10 5 תאים; 100 μL אלקטרופורציה:5 x 106 תאים) וה-GC בהכנת rAAV6. ריכוזי מלאי rAAV6 גבוהים של 5 x 1013 GC/mL עד 5 x 1014 GC/mL מומלצים להשגת MOI גבוה עם נפחים נמוכים.
הערה: MOI נמוך יותר עלול להוביל ליעילות עריכה מופחתת, ו- MOI של 5 x 105 בדרך כלל קרוב ליעילות העריכה המרבית שראינו. לא נצפתה השפעה של MOI משתנה על יכולת הקיום של תאי B. מומלץ לכלול פקדים ללא rAAV6 HDRT, ללא טרנספקציה של RNP וללא שניהם. - מחממים מראש את הכלים המוכנים ואת שאר המדיום על ידי העברתם לאינקובטור ב 37 ° C עם 5% CO2.
- לכל אלקטרופורציה של 10 μL, הכינו 1.15 μL של ריבונוקלאו פרוטאין (RNP): ערבבו 0.4 μL של 61 μM Cas9 עם 0.75 μL של 100 μM sgRNA בחיץ דו-צדדי. הכינו תוספת (מומלץ 30% יותר עבור אלקטרופורציה בודדת) בשל טעות צנרת וכדי למנוע בועות בעת העמסת קצות האלקטרופורציה. יש לשנות קנה מידה פי 10 לקבלת קצוות של 100 μL.
- יש לדגור על ה-RNP במשך 15 דקות לפחות ב-RT לפני ערבוב עם התאים. לאחר הדגירה, ניתן לשלב מספר RNPs אם יש להתמקד ביותר ממוקד אחד בו זמנית. לא נצפו הבדלים משמעותיים ביעילות עם עד שלושה מוקדים בו זמנית.
- בינתיים, להכין את התאים להתחשמלות. שמור על התאים ב- RT בכל עת כדי למנוע זעזועי טמפרטורה. קצרו את התאים לאחר 48 שעות ± שעתיים של תרבית לכלי מתאים. שטפו את הכלים עם DPBS כדי לאסוף את מספר התאים המרבי.
- צנטריפוגה את התאים ב 200 x g במשך 10 דקות ב RT. להשליך את supernatant, ולהשהות מחדש את התאים DPBS ב ~ 2 x 106 תאים / מ"ל.
- שלב 10 μL של תמיסת 0.4% כחול טריפאן עם 10 μL של תרחיף התא, וספירת באמצעות המוציטומטר.
הערה: בשלב זה, עקב אובדן במהלך הקציר והשטיפה, צפו לכ-60% מהתאים שהוכנסו לתרבית 48 שעות ± שעתיים קודם לכן. - בינתיים, צנטריפוגו את התאים ב 200 x גרם במשך 10 דקות ב RT. השליכו את הסופרנטנט, והקפידו למזער את כל ה- DPBS שנותרו. השהה מחדש את התאים במאגר T שחומם מראש (RT) בגודל 5.55 x 107 תאים/מ"ל בהתבסס על ספירת התאים לעיל.
- הגדר את מערכת הטרנספקציה על-ידי הפעלת המכונה והגדרתה ל- 1,350 וולט, 15 אלפיות השנייה ופעימה אחת. מניחים את תחנת הפיפט בתוך מכסה המנוע של הזרימה הלמינרית
- עבור כל קבוצה של 10 אלקטרופורציות, להכין צינור transfection עם 3 מ"ל של חיץ E (עבור 10 μL transfections) או E2 (עבור 100 μL transfections). הכנס את הצינור לתחנת פיפטה.
- לכל אלקטרופורציה של 10 μL, שלב 1.15 μL של RNP עם 9 μL של תאים. ודא שיש נפח מספיק (+ 30%) כדי למנוע שאיפת אוויר לתוך קצה האלקטרופורציה. יש לדגור ב-RT למשך 1-2 דקות לפני ההתחשמלות.
- יש לשאוף 10 μL או 100 μL של RNP ותערובת תאים לתוך קצה אלקטרופורציה בגודל המתאים על פיפטת אלקטרופורציה, להכניס את פיפטה טעונה לתחנת פיפטה, ולהתחיל את electroporation. ודאו שהקצוות נקיים לחלוטין מבועות אוויר כדי למנוע קשתות. צפה במהלך אלקטרופורציה כדי לוודא שקשת אינה מתרחשת.
- להוציא מיד את התאים electroporated לתוך מוכן, מראש מחומם מראש, נפח קטן של בינוני עם או בלי rAAV6 בתוך 48-well (10 μL transfections) או צלחת 6-well (100 μL transfections). חזור על שלבים 5.15-5.17 עם שאר הדגימות. הוסף דגימות בקרה ללא העברה לבארות התרבית.
- לדגור על התאים ב 37 ° C עם 5% CO 2 במשך 4 שעות ±2 שעות, ולאחר מכן להוסיף את המדיום מוכן מראש תרבית תאי B מחומם מראש המכיל ממריצים, DMSO, אנטיביוטיקה / antimycotic: 450 μL עבור 10 μL transfections או 4.5 מ"ל עבור 100 μL transfections.
- המשך את הדגירה ב 37 ° C עם 5% CO2 במשך 12-24 שעות. לאחר מכן, יש לשנות את מדיום תרבית התאים מדיום ל-B המכיל ממריצים ואנטיביוטיקה/אנטי-מיקוטית ללא DMSO אם יש צורך בתרבית מורחבת. ניתוח של ה- DNA הגנומי יכול להיעשות לאחר 24 שעות. ניתן להשתמש ב-Digital droplet PCR באמצעות פריימר מחוץ לזרוע ההומולוגיה ובפריימר בתוך העלון כדי לכמת את יעילות העריכה39. ביצוע PCR כדי להגביר את אתר ההכנסה ורצף Sanger כדי לוודא עריכה נכונה.
- לצורך ניתוח רמות החלבון, תרבית את התאים במשך 40-48 שעות לאחר אלקטרופורציה כדי לאפשר שינויים בביטוי החלבון, ובצע ניתוח על ידי ציטומטריית זרימה באמצעות ריאגנטים בטבלה 7.
תוצאות
הייצור של rAAV6 עם השימוש בעוזר אדנו-ויראלי תומך טטרציקלין ומשתיק את עצמו הביא לייצור של 4 x10 10 GC/mL של מדיום תרבית תאים בממוצע, ובכך עלה על הייצור באמצעות טרנספקציה משולשת סטנדרטית ללא עוזר פי 30-40 (איור 2).
הטיהור האופציונלי של תאי מקוק B רזוס הביא לסילוק הרוב המכריע של תאי T CD3+ ותאי מיאלואיד CD14+ ו / או CD16+, עם טוהר של 80%-95% תאי CD20+ B המתקבלים באופן שגרתי (איור 3). בהתבסס על התכנונים הקודמים שלנו בתאי מורין B7, פיתחנו שיטה לערוך את הספציפיות של קולטן תאי B של תאי מקוק B רזוס ובו זמנית לשמור על הדרה אללית ברוב המכריע של תאי B על ידי מחיקת שרשראות אור נוגדנים אנדוגניות באמצעות שיבוש האזור הקבוע שלהם. בנינו HDRT ללא מקדם שיוכנס למוקד IGH בין הגן האחרון של IGHJ לבין משפר Eμ של תאי Rhesus macaque B (איור 4). מבנה זה משתמש במקדם VH אנדוגני של אזור VDJ המסודר מחדש באופן טבעי במעלה הזרם בתאי B בוגרים, ולכן אינו מבוטא על ידי גנום AAV אפיזומלי. יתר על כן, מבנה זה דורש שחבור לתוך אזורים קבועים שרשרת כבדה של נוגדנים במורד הזרם כדי לבוא לידי ביטוי על פני התא. לכן, קשירת אנטיגן ספציפית על פני התא המוצגת על ידי ציטומטריית זרימה מצביעה על אינטגרציה נכונה של מוקד המטרה וכי הרצף שהוכנס הוא פונקציונלי.
ארזנו מבנה כזה המקודד נוגדן Ab1485, נוגדן אנטי-HIVbNAb 40 שמקורו במקוק רזוס, לתוך rAAV6 והשתמשנו בו כדי לערוך תרביות טחול של מקוק רזוס ראשוני מופעל או PBMC, כפי שתואר לעיל (איור 5A). הפרוטוקול שמר על כדאיות תאים גבוהה (~90%) ובו זמנית מחק את ביטוי שרשרת האור ב~80% מתאי B. רוב תאי B עדיין ביטאו את האיזוטיפ IgM (איור 5B). התוספת של rAAV6 המקודד את ה-HDRT של Ab1485 הביאה לעריכת גנים ולביטוי פני השטח של Ab1485 ב-16%-21% מתאי B (איור 5A), אם כי בעוצמה פלואורסצנטית נמוכה יותר בשרשראות נוגדנים מאשר בתאי B לא ערוכים (איור 5A בלוח הימני, איור 5C). זה עשוי להיות תוצאה של תחרות אפיטופית בין כתם האנטיגן לבין חד שבטיים המשמשים לזיהוי BCR פני השטח בציטומטריית זרימה, כמו גם ביטוי חלבון מופחת בפועל בשל האופי הפוליציסטרוני של HDRT ושחבור פחות יעיל. תוספת של 1% DMSO ואינקובציות מורחבות ומרוכזות עם rAAV6 HDRT בדרך כלל הגבירו את יעילות העריכה (איור 6A-C). באמצעות השיטה הספציפית הזו, בדרך כלל 5%-20%, ועד 40%, יעילות העריכה מושגת בהתאם לקוף רזוס בודד (איור 5A, איור 6A-E) ולאיכות של אצוות rAAV6 HDRT (איור 6E). בסך הכל, אנו מציגים פרוטוקולים לייצור יעיל של rAAV6, כמו גם תרבית, טיהור ועריכה גנטית של תאי מקוק B רזוס.
| ריאגנטים | נפח | מניות | ריכוז סופי |
| DMEM, גלוקוז גבוה | 500 מ"ל | 1 x | ~ 88.5% |
| FCS, מנוטרל חום | 50 מ"ל | 1 x | ~ 8.85% |
| אנטיביוטיקה/אנטי-מיקוטית | 5 מ"ל | פי 100 | 1 x |
| גלוטמין | 5 מ"ל | 200 מ"מ | 2 מ"מ |
| נתרן פירובט | 5 מ"ל | 100 מ"מ | 1 מ"מ |
טבלה 1: מדיום תרבית התאים 293AAV.
| ריאגנטים | נפח | מניות | ריכוז סופי |
| DMEM, גלוקוז גבוה | 500 מ"ל | 1 x | ~ 95.2% |
| FCS, מנוטרל חום | 10 מ"ל | 1 x | ~ 1.9% |
| אנטיביוטיקה/אנטי-מיקוטית | 5 מ"ל | פי 100 | 1 x |
| גלוטמין | 5 מ"ל | 200 מ"מ | 2 מ"מ |
| נתרן פירובט | 5 מ"ל | 100 מ"מ | 1 מ"מ |
טבלה 2: אמצעי ייצור התאים 293AAV.
| סדרת דילול | נפח הדגימה (μL) | מדלל ונפח | גורם דילול | דילול מוחלט | דגם AAV6 |
| GC/מ"ל | |||||
| דילול 1 | דגימה של 2 μL או תקן ייחוס AAV ב- 4.1 x 1011 GC/מ"ל | 18 μL DNAseI מאגר ואנזים | פי 10 | פי 10 | 4.1 x 1010 |
| דילול 2 | 15 מיקרוליטר דיל. 1 | 60 μL H2O | פי 5 | פי 50 | 8.2 x 109 |
| דילול 3 | 20 מיקרוליטר דיל. 2 | 80 μL H2O | פי 5 | פי 250 | 1.6 x 109 |
| דילול 4 | 20 מיקרוליטר דיל. 3 | 80 μL H2O | פי 5 | פי 1250 | 3.3 x 108 |
| דילול 5 | 20 μL דיל. 4 | 80 μL H2O | פי 5 | פי 6250 | 6.6 x 107 |
| דילול 6 | 20 מיקרוליטר דיל. 5 | 80 μL H2O | פי 5 | 31250 x | 1.3 x 107 |
| דילול 7 | 20 μL דיל. 6 | 80 μL H2O | פי 5 | 156250 x | 2.6 x 106 |
| דילול 8 | 20 μL דיל. 6 | 80 μL H2O | פי 5 | 781250 x | 5.24 x 105 |
| דילול 9 | 20 מיקרוליטר דיל. 7 | 80 μL H2O | פי 5 | 3906250 x | 1.05 x 105 |
טבלה 3: טבלת דילול qPCR.
| מגיב | נפח | מניות | ריכוז סופי |
| RPMI-1640 | 420 מ"ל | 1 x | 84% |
| FCS, מנוטרל חום | 50 מ"ל | 1 x | 10% |
| אנטיביוטיקה/אנטי-מיקוטית | 5 מ"ל | פי 100 | 1 x |
| גלוטמין | 5 מ"ל | 200 מ"מ | 2 מ"מ |
| נתרן פירובט | 5 מ"ל | 100 מ"מ | 1 מ"מ |
| HEPES | 5 מ"ל | 1 מטר | 10 מ"מ |
| 2-B-מרקפטו-אתנול | 550 מיקרוליטר | 55 מ"מ | 55 מיקרומטר |
| חומצות אמינו לא חיוניות | 5 מ"ל | פי 100 | 1 x |
| אינסולין-טרנספרין-סלניום | 5 מ"ל | פי 100 | 1 x |
טבלה 4: מדיום תרבית תאים B.
| מגיב | דילול | מניות | ריכוז סופי |
| MegaCD40L | 1:1000 | 100 מיקרוגרם/מ"ל | 100 נ"ג/מ"ל |
| CpG ODN | 1:300 | 1 מ"ג/מ"ל | 3.33 מיקרוגרם/מ"ל |
| באף אנושי | 1:1000 | 40 מיקרוגרם/מ"ל | 40 ננוגרם/מ"ל |
| IL-2 אנושי | 1:1000 | 50 מיקרוגרם/מ"ל | 50 נ"ג/מ"ל |
| IL-10 אנושי | 1:1000 | 50 מיקרוגרם/מ"ל | 50 נ"ג/מ"ל |
טבלה 5: ממריצים של תאי B.
| נוגדן | שיבוט | דילול | קונק סופי. |
| CD3 אנטי-אנושי | FN-18 | 1:40 | 2.5 מיקרוגרם/מ"ל |
| CD8a אנטי-אנושי | RPA-T8 | 1:200 | 2.5 מיקרוגרם/מ"ל |
| CD14 אנטי-אנושי | M5E2 | 1:200 | 2.5 מיקרוגרם/מ"ל |
| CD16 אנטי-אנושי | 3G8 | 1:200 | 2.5 מיקרוגרם/מ"ל |
| CD33 אנטי-אנושי | AC104.3E3 | 1:50 | 1 בדיקה |
| CD64 אנטי-אנושי | 10.1 | 1:800 | 0.625 מיקרוגרם/מ"ל |
| CD66 אנטי-אנושי | טט2 | 1:11 | 1 בדיקה |
| CD89 אנטי-אנושי | A59 | 1:800 | 0.625 מיקרוגרם/מ"ל |
טבלה 6: נוגדנים לדלדול אופציונלי של תאים שאינם מסוג B.
| מגיב | סוג/שיבוט | דילול/ריכוז עבודה |
| CD14 אנטי אנושי AlexaFluor647 | M5E2 | 1:50 |
| CD16 אנטי אנושי AlexaFluor700 | 3G8 | 1:50 |
| CD20 PECy7 אנטי-אנושי | 2H7 | 1:50 |
| CD3 PE אנטי-אנושי | SP34-2 | 1:50 |
| זומבי-ניר | - | 1:500 |
| HLA-DR BV605 אנטי-אנושי | L243 | 1:200 |
| נגמ"ש אנטי אנושי מסוג Ig light chain lambda | MHL-38 | 1:50 |
| שרשרת אור קאפה אנטי-אנושית FITC | רב-שבטי | 1:500 |
| IgM BV421 אנטי-אנושי | MHM-88 | 1:50 |
| אנטיגן RC1, ביוטינילציה אקראית | - | 5 מיקרוגרם/מ"ל |
| סטרפטאווידין-PE | - | 1:500 |
טבלה 7: ריאגנטים ציטומטריים של זרימה לניתוח.
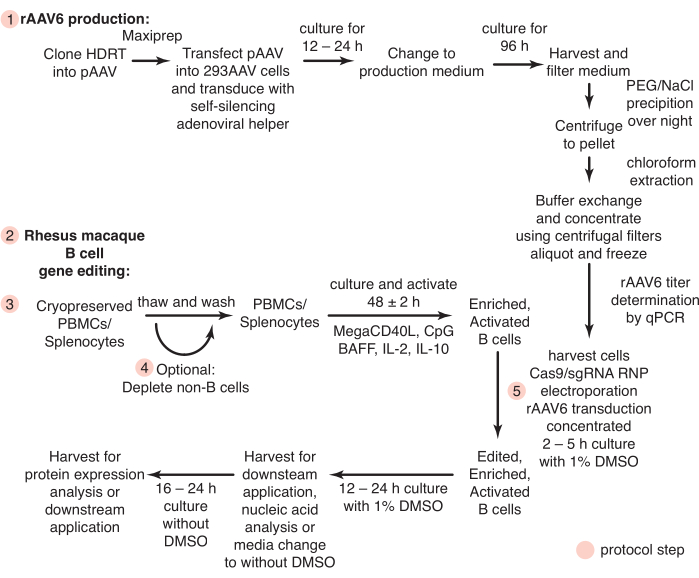
איור 1: סקירה סכמטית של ייצור rAAV6 ועריכה גנטית של תאי מקוק B רזוס ראשוניים. הפרוטוקולים מחולקים לייצור rAAV6 (שלב 1) ולעריכה גנטית של תאי Rhesus macaque B (שלבים 2-5), כולל שלב אופציונלי לדלדול תאים שאינם B (שלב 4). שלבים בפרוטוקולים מסומנים בעיגולים אדומים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
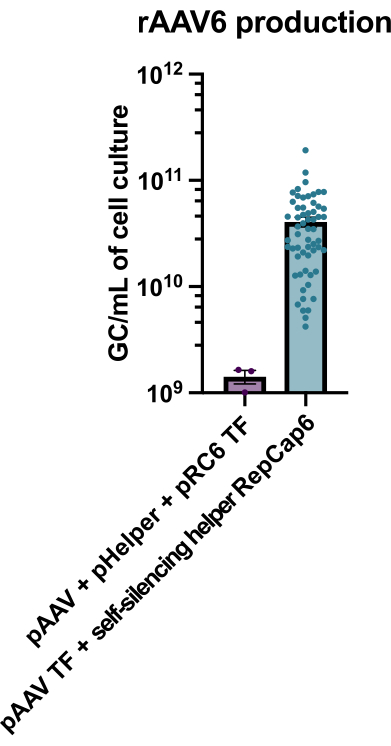
איור 2: תפוקות גבוהות של rAAV6 באמצעות עוזר אדנו-ויראלי להשתקה עצמית. rAAV6 הופק באמצעות השיטות המתוארות כאן (pAAV transfection [TF] + Self-silencing helper RepCap6, self-silencing adenoviral helper) או transfection משולש טיפוסי ללא עוזר של pAAV, pHelper ו-pRepCap6 (pRC6). rAAV6 טוהר מהסופרנאטנט של התא בלבד. השיטות המשתמשות בווקטורים המסייעים אדנו-ויראליים להשתקה עצמית הפיקו פי 30-40 יותר rAAV על ידי qPCR, כמתואר לעיל. כל נקודה מייצגת ייצור rAAV בודד באמצעות מבני pAAV שונים מ-2 עד 20 ניסויים עצמאיים. ממוצע ± SEM הוא מתווה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
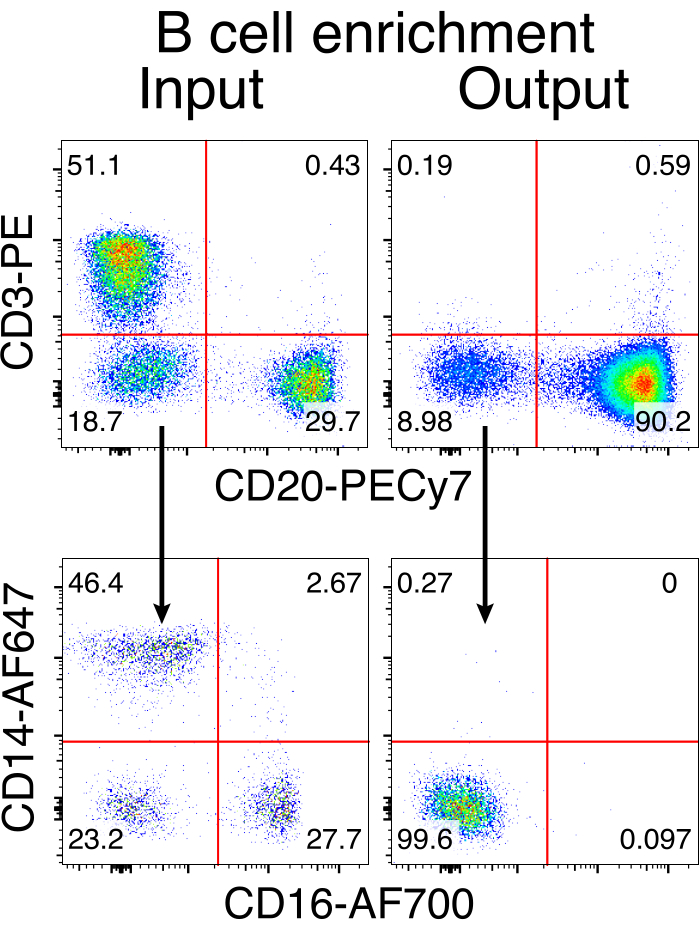
איור 3: העשרת תאי B על-ידי דלדול שלילי של תאים שאינם מסוג B. תאי מקוק Rhesus B הועשרו מ-PBMCs באמצעות הפרוטוקול המתואר והועשרו לטוהר של 90%. הקלט לפני ההעשרה והתפוקה לאחר ההעשרה מוצגים. מגודר על PBMCs חיים, סינגלט. נציג של חמישה ניסויים עצמאיים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
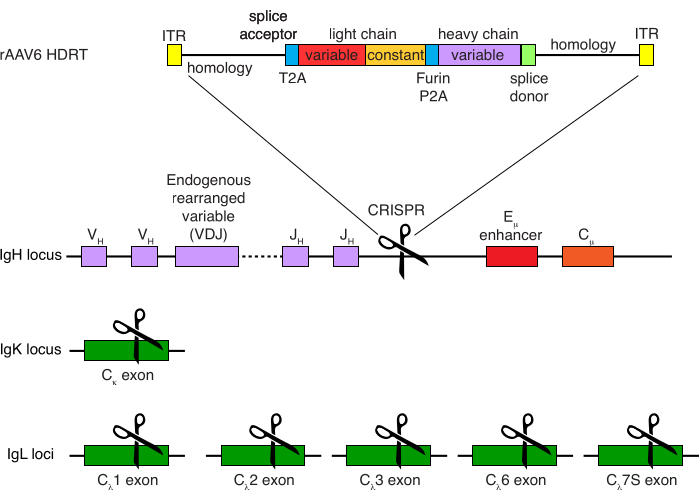
איור 4: אסטרטגיית מיקוד המשמשת לעריכת הספציפיות של קולטן תא B של תאי Rhesus macaque B. rAAV6 הופק והכיל את ה-HDRT המתואר. ה-HDRT מורכב מזרוע הומולוגיה של 266 bp 5 אינץ', ואחריה 111 bp של מקוק רזוס IGHM אקסון 1 splice acceptor, ואז מקשר GSG עם רצף פפטידי 2A של וירוס Thosea asigna (T2A), ואחריו רצף מוביל ושרשרת האור המלאה של נוגדן מקוק רזוס Ab1485 כ-rhesus macaque IGLC1. אחריו מופיע אתר מחשוף פורין, מקשר GSG, ורצף פפטידי 2A של טסכווירוס חזירי (Furin-P2A), ואחריו רצף מוביל נוסף ומשתנה השרשרת הכבדה Ab1485, ואחריו 52 bp של רצף תורם השפריץ של rhesus macaque IGHJ4, כדי לאפשר שחבור לאזורים קבועים במורד הזרם של שרשרת נוגדנים כבדים, וזרוע הומולוגיה של 514 bp. מבנה זה היה ממוקד לתוך מוקד IGH בין הגן IGHJ האחרון לבין משפר Eμ באמצעות רצף המטרה sgRNA GAGATGCCAGAGCAAACCAG. שתי זרועות ההומולוגיה תוכננו להסתיים באתר החיתוך של sgRNA זה, ובכך להסיר את רצף המטרה ולאפשר יעילות אינטגרציה אופטימלית. במקביל, כדי לשמור על הרחקה אללית ועל ביטוי של קולטן תא B יחיד, מחקנו שרשראות אור אנדוגניות באמצעות sgRNA המכוון ל-rhesus macaque IGKC עם רצף המטרה GGCGGGAAGATGAAGACAGA ו-IGLC1, IGLC2, IGLC3, IGLC6 ו-IGLC7S באמצעות רצף המטרה CTGATCAGTGACTTCTACCC. ה-HDRT כלל מוטציות שקטות המונעות את פיצול רצף IGLC1 על ידי sgRNA זה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
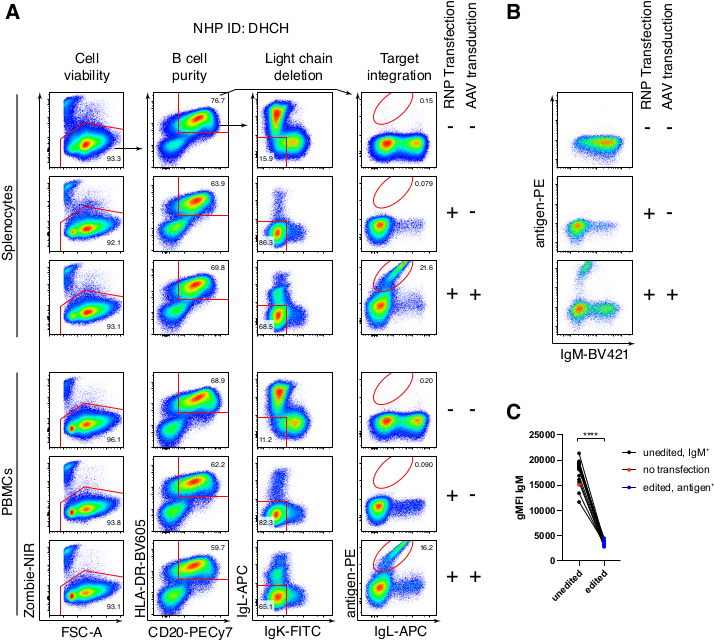
איור 5: עריכה גנטית של תאי Rhesus macaque B ראשוניים . (A) טחול ראשוני (פאנל עליון) או PBMCs (פאנל תחתון) מאותו מקוק רזוס גודלו בתרבית ללא דלדול של תאים שאינם מסוג B ונערכו כמתואר לעיל. אסטרטגיית המיקוד הייתה כפי שניתן לראות בתרשים 4. יומיים לאחר ההתחשמלות, התאים נקצרו ונצבעו על פני השטח לצורך ניתוח ציטומטרי של זרימה. העמודה השמאלית הייתה מגודרת על תאי סינגלט, והעמודות האחרות היו מגודרות, כפי שמצוין בשורה העליונה. הכדאיות של התאים, טוהר תאי B, יעילות המחיקה של שרשראות האור ויעילות הדפיקה של Ab1485 על ידי צביעה באנטיגן הספציפי RC141 מסומנים בדגימות לא מטופלות, RNP נגועות או RNP נגועות + rAAV6 מומרים (MOI = 5 x 105). מייצג שישה ניסויים עצמאיים עם תאים מקופי מקוק רזוס שונים. (B) ביטוי IgM בפקדי תאי Rhesus macaque B בתרבית או לאחר עריכה ו-(C) עוצמת פלואורסצנטיות ממוצעת גיאומטרית (gMFI) של IgM על תאי B שלא איבדו ביטוי Ig עקב מיקוד IgLC ו-IgKC (לא ערוך) או תאי B הקושרים את האנטיגן הצפוי (ערוך). הנקודה האדומה מציינת את gMFI של תאי ביקורת B לא נגועים בתרבית. מציין P < 0.0001 במבחן T זוגי. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
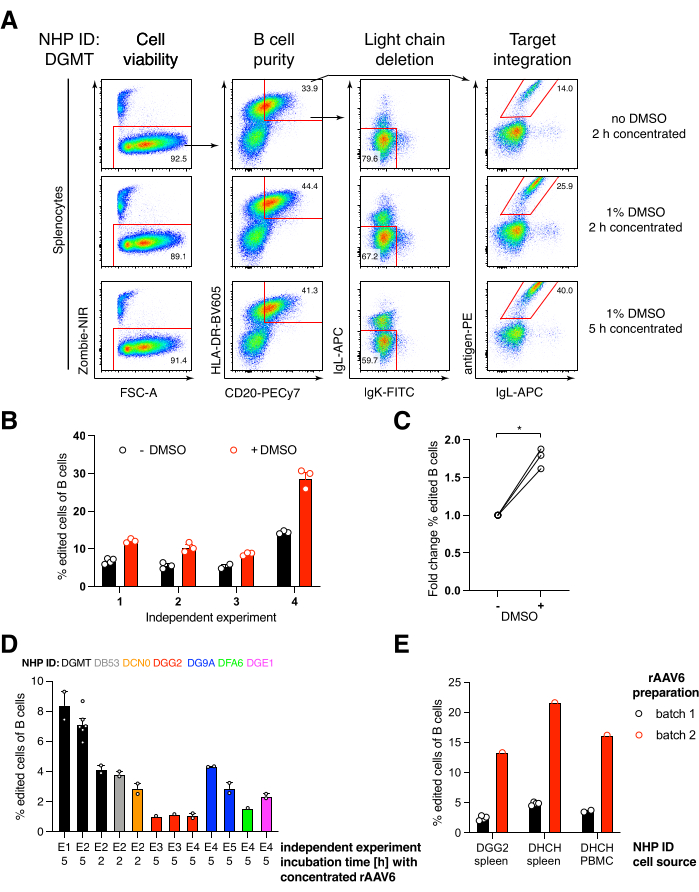
איור 6: השפעות DMSO, דגירה מרוכזת ממושכת עם rAAV6 HDRT, איכות אצווה rAAV ויכולת שחזור בקרב NHPs תורמים שונים על יעילות עריכת גנים בתאי מקוק B רזוס ראשוניים . (A) הטחול תורבתו ונערכו כמתואר. לאחר אלקטרופורציה, 5 x 105 תאים גודלו בתרבית בינונית עם או בלי 1% DMSO והודגרו ב 50 μL של תווך המכיל rAAV6 HDRT ב MOI של 5 x 10 5 במשך 2 שעות או5 שעות לפני תוספת של עוד 450 μL של תווך. התאים נותחו יומיים לאחר חשמול באמצעות ציטומטריית זרימה, כמו באיור 5. נציג של ארבעה ניסויים עצמאיים. (B) כימות של (A) על פני ארבעה ניסויים בלתי תלויים. הנקודות מצביעות על שכפולים טכניים עם הגדרות טרנספקציה של 1,350 וולט, 10-20 מילישניות ומשך אלקטרופורציה של פולס אחד וריכוזי DMSO הנעים בין 0.75%-1.25%. (C) שינוי קיפול ממוצע ביעילות העריכה מ-(B). * p > 0.05 במבחן Mann-Whitney U. (D) יעילות עריכה על פני ניסויים עצמאיים עם קופי מקוק שונים באמצעות אצווה מסחרית rAAV6 בעלת יעילות נמוכה יותר. (E) יעילות עריכה באמצעות שתי אצוות מסחריות שונות של rAAV6 שלתוכן אותו מבנה נארז בתאי B של שני NHPs שונים באותו ניסוי. הנקודות מציינות שכפולים טכניים עם הגדרות טרנספקציה של 1,350 וולט, 10-20 אלפיות השנייה ואלקטרופורציה של פולס אחד. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Discussion
הפרוטוקולים המוצגים כאן מספקים שיטה מהירה ויעילה ליצירת תפוקות וטיטרים גבוהים של rAAV6s כ- HDRT ושיטות חדשניות לעריכה גנטית יעילה של תאי מקוק B ראשוניים מסוג rhesus במבחנה.
פרוטוקול הייצור של rAAV6 הוא פשוט ומהיר יחסית, ומאפשר ייצור ובדיקה של מבנים רבים ושונים בו זמנית ללא עבודה מוגזמת. אם תרצה, rAAV6 יכול להיות מטוהר עוד יותר באמצעות פרוטוקולים מבוססים כגון יודיקסנול הדרגתי ultracentrifugation34 או מימי דו פאזי חלוקה35 לפני חילופי חיץ וריכוז.
למרות שזה הפחית את התשואה הכוללת, בחרנו להשתמש רק במדיום תרבית תאים מופחת בסרום לטיהור rAAV6 במקום בטיהור מכדורית התא, מכיוון שרוב rAAV6 משתחרר למדיום36, וטיהור מכדורית התא מוסיף יותר עלות ועבודה. השימוש בעוזר אדנו-ויראלי המנטרל את עצמו הגדיל את התשואות פי 30-40 בממוצע, ואיפשר בדיקה של מבנים ארוזים לתוך AAV6 בצלחת אחת של 15 ס"מ. למרות ששיטת הטיהור שלנו היא בסיסית, באמצעות שיטה זו, אנו מקבלים שונות קטנה יחסית מאצווה לאצווה ביעילות עריכת גנים או בכדאיות התא לאחר התמרה באמצעות קווי תאים שונים או תאים ראשוניים אחרים (הנתונים אינם מוצגים).
פיתחנו פרוטוקול טיהור תאי Rhesus macaque B כדי להשיג תאי B ראשוניים שלא נגעו בהם תוך שימוש בדלדול שלילי של אוכלוסיות לא רצויות. למרות שאינו הכרחי לעריכת גנים של תאים אלה, הוא מספק דרך להשיג אוכלוסייה טהורה יחסית של תאי מקוק מקוק B ראשוניים עבור יישום זה או יישומים אחרים אם סוגי תאים אחרים יפריעו למטרות הניסוי. עם זאת, טוהר מגיע במחיר של תפוקה כוללת מופחתת של תאי B. יש לציין כי הן עבור תרביות תאי B המועשרות והן עבור תרביות תאי B שאינן מועשרות, החלק של תאי B בתכשירי PBMC או הטחול הראשוניים הוא קריטי. עבור PBMCs בפרט, אנו ממליצים לסנן קופי מקוק שונים עבור אנשים עם אחוז גבוה של תאי B בדם היקפי כדי לקבל מספר גבוה של תאי B לניסויים, שכן ערך זה יכול להיות שונה באופן דרמטי בין אנשים27. PBMCs ניתן להשיג על ידי דימום רגיל או leukapheresis42.
פרוטוקול עריכת הגנים מוביל לעריכה גנטית יעילה, בדרך כלל בין 60%-80% מתאי הנוק-אאוט ל-5%-20% מתאי B הנוק-אין, אף על פי שהשגנו עד 90% נוק-אאוט BCR ו-40% BCR נוק-אין תאי B (איור 5 ואיור 6).
הפרמטרים העיקריים לעריכה יעילה של תאי Rhesus macaque B הם יעילות החיתוך של sgRNA, פרמטרי האלקטרופורציה, MOI ואיכות הכנת rAAV6. יעילות החיתוך של sgRNA מועמדים צריכה להיקבע אמפירית כדי לאפשר עריכה ועיצוב אופטימליים של HDRT. פרמטרי האלקטרופורציה המוצגים כאן מאזנים יעילות עם כדאיות להשגת המספר הכולל המרבי של תאי B ערוכים ולא האחוז הגבוה ביותר של תאי B ערוכים. אם נדרש אחוז גבוה יותר של תאים ערוכים, מומלץ להשתמש במתח מוגבר (עד 1,750 וולט) או באורכי פולס משתנים (10-30 מילישניות), אם כי ניתן לראות יותר מוות תאי. הבחנו גם ביעילות עריכה מעט גבוהה יותר בתאי B ספלניים בהשוואה לתאי B מ-PBMCs מאותו אדם (איור 5); עם זאת, הסיבה הבסיסית לכך אינה ידועה כרגע.
מצאנו שתוספת של 1% DMSO לאחר אלקטרופורציה הגדילה באופן משמעותי את יעילות עריכת הגנים ב~40% בתאי Rhesus macaque B מבלי להשפיע על יכולת הקיום של התא (איור 6A-C), בהתאם לדיווחים בתאים אחרים43. עם זאת, יש להימנע מתרבית מורחבת ב-1% DMSO ועלולה להשפיע על כדאיות התא. DMSO עשוי להיות מושמט לחלוטין אם תרצה.
תרבית התאים בנפח קטן לאחר אלקטרופורציה במשך מספר שעות יחד עם rAAV6 מובילה ליעילות עריכה גבוהה יותר, כנראה בשל העברה טובה יותר של HDRT על ידי rAAV6, ומכאן, ריכוז תוך תאי גבוה יותר של HDRT בזמן הרלוונטי כאשר Cas9 פעיל. מצאנו שגידול התאים בדרך זו במשך עד 8 שעות לא השפיע על יכולת הקיום של התא, אולם יעילות העריכה לא עלתה באופן דרמטי מעבר ל-5 שעות (איור 6). אם נדרש רק הסתרה במקום נוק-אין, שלב זה עשוי להיות מושמט.
לסיכום, אנו מציגים פרוטוקולים מקיפים לעריכה גנטית של תאי מקוק B רזוס במבחנה ולייצור rAAV6 HDRT הדרוש להזנה יעילה של מבנים רצויים. פרוטוקולים אלה מאפשרים בדיקה מהירה וחסכונית של מבנים רבים ארוזים כ-rAAV6 ומאפשרים בדיקה פרה-קלינית של ההיתכנות והמדרגיות של טיפולים בתאי B במודל פרימטים לא אנושי רלוונטי יותר.
Disclosures
לא מוכרזים אינטרסים מתחרים.
Acknowledgements
ברצוננו להודות להארי ב. גריסטיק ופמלה ביורקמן על אספקת האנטיגן RC1 ולכל מעבדות נוסנצווייג ומרטין על דיון ביקורתי. עבודה זו נתמכה על ידי מענק קרן ביל ומלינדה גייטס INV-002777 (ל- M.C.N.) ותוכנית המחקר האינטרמורלית של המכון הלאומי לאלרגיה ומחלות זיהומיות, המכונים הלאומיים לבריאות. (ר"ג ומ.א.מ). M.C.N. הוא חוקר HHMI.
Materials
| Name | Company | Catalog Number | Comments |
| 1.5 mL tube sterile, Dnase, Rnase and purogen free | Stellar Scientific | T17-125 | or similar |
| 10 mL serological pipette, polystyrene, sterile, nonpyrogenic, DNase-/RNase-free, and Human DNA-free | Corning | 4488 | or similar |
| 15 cm tissue culture dish | Falcon | 353025 | or similar |
| 15 mL polypropylene conical tybe | Falcon | 352097 | or similar |
| 25 mL serological pipette, polystyrene, sterile, nonpyrogenic, DNase-/RNase-free, and Human DNA-free | Corning | 4489 | or similar |
| 250 mL polypropylene conical tybe | Corning | 430776 | or similar |
| 293AAV cell line | Cell Biolabs | AAV-100 | |
| 2-B-mercapto-ethanol, 55mM (1000x) | Gibco | 21985-023 | |
| 48-well tissue culture plate | Corning | 3548 | or similar |
| 5 mL serological pipette, polystyrene, sterile, nonpyrogenic, DNase-/RNase-free, and Human DNA-free | Corning | 4487 | or similar |
| 5 mL syringes with Luer-Lok Tip | BD | 309646 | or similar |
| 50 mL polypropylene conical tybe | Falcon | 352070 | or similar |
| 50 mL serological pipette, polystyrene, sterile, nonpyrogenic, DNase-/RNase-free, and Human DNA-free | Corning | 4490 | or similar |
| 6-well tissue culture plate | Falcon | 353046 | or similar |
| AAV-6 Packaging System (plasmids) | Cell Biolabs | VPK-406 | |
| AAV6 Reference Materials (full capsids) | Charles River | RS-AAV6-FL | |
| Accu-jet S Pipette Controller | Brand | 26350 | or similar pipette controller |
| Antibiotic/Antimycotic 100x | Gibco | 15260-062 | |
| anti-human CD14 AlexaFluor647 | Biolegend | 301812 | |
| anti-human CD14 biotin | BioLegend | 301826 | |
| anti-human CD16 AlexaFluor700 | BD Biosciences | 557920 | |
| anti-human CD16 biotin | BioLegend | 302004 | |
| anti-human CD20 PECy7 | Biolegend | 302312 | |
| anti-human CD3 biotin | Thermo Fisher | APS0309 | |
| anti-human CD3 PE | BD Biosciences | 552127 | |
| anti-human CD33 biotin | Miltenyi | 130-113-347 | |
| anti-human CD64 biotin | BioLegend | 305004 | |
| anti-human CD66 biotin | Miltenyi | 130-100-143 | |
| anti-human CD89 biotin | BioLegend | 354112 | |
| anti-human CD8a biotin | BioLegend | 301004 | |
| anti-human HLA-DR BV605 | Biolegend | 307640 | |
| anti-human Ig light chain lambda APC | Biolegend | 316610 | |
| anti-human IgM BV421 | Biolegend | 314516 | |
| anti-Human Kappa Light Chain FITC | Fisher Scientific | A18854 | |
| Autoclave | Steris | Amsco Lab 250 | or similar |
| Cell culture CO2 incubator | Fisher Scientific | 51026331 | or similar |
| Centrifugal Filter Unit (Amicon Ultra - 4, 100 kDa) | Millipore | UFC810024 | |
| Centrifuge 5920 R | Eppendorf | EP022628188 | or any other, coolable swinging bucket centrifuge with inserts for 96-well plates, 15, 50 and 250 mL size tubes |
| Chloroform | Fisher Scientific | C298SK-4 | |
| Cpg ODN | Invivogen | tlrl-2395 | |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | 34869-500ML | |
| DMEM, High Glucose | Gibco | 11965092 | |
| DNaseI (RNase-free) | New England Biolabs | M0303L | |
| DPBS, no calcium, no magnesium | Gibco | 14190144 | |
| Electroporation kit (Neon Transfection System 10 µL) | Fisher Scientific | MPK1096 | or other sizes or 100 uL transfection kit MPK 10096 |
| Electroporation system (Neon Transfection System) | Fisher Scientific | MPK5000 | |
| FCS | Hyclone | SH30910.03* | |
| Ficoll-PM400 (Ficoll-Paque PLUS) | Cytiva | 17144002 | or similar |
| Fume Hood | Fisher Scientific | FH3943810244 | or similar |
| Glutamine 200 mM | Gibco | 25030-081 | |
| Graduated Cylinder 1L | Corning | 3022-1L | or similar |
| Hemocytometer | Sigma-Aldrich | Z375357-1EA | or similar |
| HEPES 1M | Gibco | 15630-080 | |
| HEPES 1M | Gibco | 15630-080 | |
| Hot Plate Magnetic Stirrer | Fisher Scientific | SP88857200 | or similar |
| Human BAFF | Peprotech | 310-13 | |
| Human BD Fc Block | BD | 564220 | |
| Human IL-10 | Peprotech | 200-10 | |
| Human IL-2 | Peprotech | 200-02 | |
| Hydrochloric acid | Fisher Scientific | A144S-500 | |
| Hydrophilic Polyethersulfone Syringe Filters, (Supor membrane), Sterile - 0.2 µm, 25 mm | Pall | 4612 | |
| Insulin-Transferin-Selenium, 100x | Gibco | 41400-045 | |
| ITR primer forward: GGAACCCCTAGTGATGGAGTT | Integrated DNA Technologies | custom | |
| ITR primer reverse: CGGCCTCAGTGAGCGA | Integrated DNA Technologies | custom | |
| Laminar flow biosafety cabinet | The Baker Company | SG403A | or similar |
| Large magnetic depletion (LD) Column | Miltenyi Biotec | 130-042-901 | |
| Magentic seperator (MidiMACS separator and multistand) | Miltenyi Biotec | 130-090-329 | |
| Magnetic stir bar | Fisher Scientific | 14-512-127 | or similar |
| Magnetic streptavidin beads (Streptavidin MicroBeads) | Miltenyi Biotec | 130-048-101 | |
| Maxiprep kit | Machery-Nagel | 740414.5 | or similar |
| Media Bottles 2L with cap | Cole-Parmer | UX-34514-26 | or similar |
| MegaCD40L | Enzo | ALX-522-110-C010 | |
| MicroAmp Optical 384-well Reaction Plate | Fisher Scientific | 4309849 | |
| MicroAmp Optical Adhesive Film | Fisher Scientific | 4311971 | |
| Microcentrifuge 5424 R | Eppendorf | 5404000014 | or any other table top centrifuge for 1.5 mL tubes |
| Microwave oven | Panasonic | NN-SD987SA | or similar |
| Nikon TMS Inverted Phase Contrast Microscope | Nikon | TMS | or any other Inverted phase-contrast microscope for cell culture |
| Non-essential amino acids, 100x | Gibco | 11140-050 | |
| Nuclease-free Duplex buffer | Integrated DNA Technologies | 11-01-03-01 | |
| Nuclease-free Water | Qiagen | 129115 | |
| pH meter | Mettler Toledo | 30019028 | or similar |
| Pipetman Classic Starter Kit, 4 Pipette Kit, P2, P20, P200, P1000 and tips | Gilson | F167380 | or similar set of pipettes and tips |
| Pluronic F-68 10 % | Gibco | 24040-032 | |
| Polyethylene Glycol 8000 | Fisher Scientific | BP233-1 | |
| Polyethylenimine, Linear, MW 25000, Transfection Grade (PEI 25K | Polysciences | 23966-100 | |
| Precision Balance | Mettler Toledo | ME4001TE | or similar |
| Pre-Separation Filters (30 µm) | Miltenyi Biotec | 130-041-407 | |
| Pyrex glass beaker 2 L | Cole-Parmer | UX-34502-13 | or similar |
| Pyrex glass beaker 250 mL | Millipore Sigma | CLS1000250 | or similar |
| qPCR Instrument | Fisher Scientific | 4485691 | or similar |
| RC1 antigen randomly biotinylated | Bjorkman lab, CalTech | in house | |
| RPMI-1640 | Gibco | 11875-093 | |
| S.p. Cas9 Nuclease | Integrated DNA Technologies | 1081059 | |
| Scientific 1203 Water Bath | VWR | 24118 | or any water bath set to 37 °C |
| Sodium chloride | Sigma-Aldrich | S7653-5KG | |
| Sodium hydroxide | Sigma-Aldrich | S8045-500G | |
| Sodium Pyruvate 100 mM | Gibco | 11360-070 | |
| Sterile Disposable Filter Units with PES Membranes | Thermo Scientific Nalgene | 567-0020 | |
| Streptavidin-PE | BD Biosciences | 554061 | |
| SYBR Green Master Mix | Fisher Scientific | A25742 | |
| Tetracycline-enabled, self-silencing adenoviral vector RepCap6 | Oxgene | TESSA-RepCap6 | |
| Trypan Blue Solution, 0.4% | Gibco | 15250061 | |
| Trypsin-EDTA (0.05%), phenol red | Gibco | 25300054 | |
| Water Purification System | Millipore Sigma | ZEQ7000TR | or similar |
| Zombie-NIR | Biolegend | 423106 |
References
- Victora, G. D., Nussenzweig, M. C. Germinal centers. Annual Review of Immunology. 40, 413-442 (2022).
- Plotkin, S. A. Correlates of protection induced by vaccination. Clinical and Vaccine Immunology. 17 (7), 1055-1065 (2010).
- Brinkmann, V., Heusser, C. H. T cell-dependent differentiation of human B cells into IgM, IgG, IgA, or IgE plasma cells: High rate of antibody production by IgE plasma cells, but limited clonal expansion of IgE precursors. Cellular Immunology. 152 (2), 323-332 (1993).
- Chernecky, C. C., Berger, B. J. . Protein Electrophoresis - Serum., 6th edition. , 917-920 (2013).
- Balazs, A. B., et al. Antibody-based protection against HIV infection by vectored immunoprophylaxis. Nature. 481 (7379), 81-84 (2011).
- Greiner, V., et al. CRISPR-mediated editing of the B cell receptor in primary human B cells. iScience. 12, 369-378 (2019).
- Hartweger, H., et al. HIV-specific humoral immune responses by CRISPR/Cas9-edited B cells. Journal of Experimental Medicine. 216 (6), 1301-1310 (2019).
- Huang, D., et al. Vaccine elicitation of HIV broadly neutralizing antibodies from engineered B cells. Nature Communications. 11, 5850 (2020).
- Jeske, A. M., Boucher, P., Curiel, D. T., Voss, J. E. Vector strategies to actualize B cell-based gene therapies. Journal of Immunology. 207 (3), 755-764 (2021).
- Nahmad, A. D., et al. In vivo engineered B cells secrete high titers of broadly neutralizing anti-HIV antibodies in mice. Nature Biotechnology. 40 (8), 1241-1249 (2022).
- Nahmad, A. D., et al. Engineered B cells expressing an anti-HIV antibody enable memory retention, isotype switching and clonal expansion. Nature Communications. 11, 5851 (2020).
- Voss, J. E., et al. Reprogramming the antigen specificity of B cells using genome-editing technologies. eLife. 8, 42995 (2019).
- Pesch, T., et al. Molecular design, optimization, and genomic integration of chimeric B cell receptors in murine B cells. Frontiers in Immunology. 10, 2630 (2019).
- Cheong, T. C., Compagno, M., Chiarle, R. Editing of mouse and human immunoglobulin genes by CRISPR-Cas9 system. Nature Communications. 7, 10934 (2016).
- Rogers, G. L., Cannon, P. M. Genome edited B cells: A new frontier in immune cell therapies. Molecular Therapy. 29 (11), 3192-3204 (2021).
- Hung, K. L., et al. Engineering protein-secreting plasma cells by homology-directed repair in primary human B cells. Molecular Therapy. 26 (2), 456-467 (2018).
- Johnson, M. J., Laoharawee, K., Lahr, W. S., Webber, B. R., Moriarity, B. S. Engineering of primary human B cells with CRISPR/Cas9 targeted nuclease. Scientific Reports. 8, 12144 (2018).
- Wu, C. M., et al. Genetic engineering in primary human B cells with CRISPR-Cas9 ribonucleoproteins. Journal of Immunological Methods. 457, 33-40 (2018).
- Luo, B., et al. Engineering of alpha-PD-1 antibody-expressing long-lived plasma cells by CRISPR/Cas9-mediated targeted gene integration. Cell Death and Disease. 11 (11), 973 (2020).
- Laoharawee, K., et al. Genome engineering of primary human B cells using CRISPR/Cas9. Journal of Visualized Experiments. (165), e61855 (2020).
- Laoharawee, K., Johnson, M. J., Moriarity, B. S. CRISPR/Cas9-mediated genome engineering of primary human B cells. Methods in Molecular Biology. 2115, 435-444 (2020).
- Moffett, H. F., et al. B cells engineered to express pathogen-specific antibodies protect against infection. Science Immunology. 4 (35), (2019).
- Hartweger, H., Nussenzweig, M. C. CRISPR comes a-knock-in to reprogram antibodies in vivo. Nature Biotechnology. 40 (8), 1183-1184 (2022).
- Nishimura, Y., Martin, M. A. Of mice, macaques, and men: Broadly neutralizing antibody immunotherapy for HIV-1. Cell Host & Microbe. 22 (2), 207-216 (2017).
- Shedlock, D. J., Silvestri, G., Weiner, D. B. Monkeying around with HIV vaccines: Using rhesus macaques to define 'gatekeepers' for clinical trials. Nature Reviews Immunology. 9 (10), 717-728 (2009).
- Kreuser, S., et al. Efficient methods for generation and expansion of, and gene delivery to rhesus macaque plasma B cells. bioRxiv. , (2021).
- Gujer, C., Sundling, C., Seder, R. A., Karlsson Hedestam, G. B., Lore, K. Human and rhesus plasmacytoid dendritic cell and B-cell responses to Toll-like receptor stimulation. Immunology. 134 (3), 257-269 (2011).
- Kim, J. S., et al. Cell enrichment-free massive ex-vivo expansion of peripheral CD20(+) B cells via CD40-CD40L signals in non-human primates. Biochemical and Biophysical Research Communications. 473 (1), 92-98 (2016).
- Su, W., et al. Self-attenuating adenovirus enables production of recombinant adeno-associated virus for high manufacturing yield without contamination. Nature Communications. 13, 1182 (2022).
- Endo, Y., et al. Short- and long-term clinical outcomes in rhesus monkeys inoculated with a highly pathogenic chimeric simian/human immunodeficiency virus. Journal of Virology. 74 (15), 6935-6945 (2000).
- Balaphas, A., Buchs, N. C., Meyer, J., Hagen, M. E., Morel, P. Partial splenectomy in the era of minimally invasive surgery: The current laparoscopic and robotic experiences. Surgical Endoscopy. 29 (12), 3618-3627 (2015).
- Gibson, D. G., et al. Enzymatic assembly of DNA molecules up to several hundred kilobases. Nature Methods. 6 (5), 343-345 (2009).
- Labun, K., et al. CHOPCHOP v3: Expanding the CRISPR web toolbox beyond genome editing. Nucleic Acids Research. 47, 171-174 (2019).
- Strobel, B., Miller, F. D., Rist, W., Lamla, T. Comparative analysis of cesium chloride- and iodixanol-based purification of recombinant adeno-associated viral vectors for preclinical applications. Human Gene Therapy Methods. 26 (4), 147-157 (2015).
- Guo, P., et al. Rapid and simplified purification of recombinant adeno-associated virus. Journal of Virological Methods. 183 (2), 139-146 (2012).
- Vandenberghe, L. H., et al. Efficient serotype-dependent release of functional vector into the culture medium during adeno-associated virus manufacturing. Human Gene Therapy. 21 (10), 1251-1257 (2010).
- Brinkman, E. K., Chen, T., Amendola, M., van Steensel, B. Easy quantitative assessment of genome editing by sequence trace decomposition. Nucleic Acids Research. 42 (22), 168 (2014).
- Conant, D., et al. Inference of CRISPR edits from Sanger trace data. The CRISPR Journal. 5 (1), 123-130 (2022).
- Wilkinson, A. C., et al. Cas9-AAV6 gene correction of beta-globin in autologous HSCs improves sickle cell disease erythropoiesis in mice. Nature Communications. 12, 686 (2021).
- Wang, Z., et al. A broadly neutralizing macaque monoclonal antibody against the HIV-1 V3-Glycan patch. eLife. 9, 61991 (2020).
- Escolano, A., et al. Immunization expands B cells specific to HIV-1 V3 glycan in mice and macaques. Nature. 570 (7762), 468-473 (2019).
- Pathiraja, V., Matar, A. J., Gusha, A., Huang, C. A., Duran-Struuck, R. Leukapheresis protocol for nonhuman primates weighing less than 10 kg. Journal of the American Association for Laboratory Animal Science. 52 (1), 70-77 (2013).
- Stratigopoulos, G., De Rosa, M. C., LeDuc, C. A., Leibel, R. L., Doege, C. A. DMSO increases efficiency of genome editing at two non-coding loci. PLoS One. 13 (6), 0198637 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved