Method Article
שימוש בריאגנטים ייחוס כדי לאשר את החוסן של מבחני שחרור ציטוקינים לחיזוי בטיחות נוגדנים חד-שבטיים
In This Article
Summary
השימוש בריאגנטים ייחוס לבדיקת שחרור ציטוקינים מאפשר פרופילי בטיחות במבחנה הניתנים לשחזור וסטנדרטיים יותר של נוגדנים חד-שבטיים אימונותרפיים. כאן אנו מתארים כיצד ניתן להשתמש במבחני שחרור ציטוקינים לצד פאנל ריאגנטים ייחוס כדי לחזות את בטיחותם של כמה נוגדנים חד-שבטיים טיפוליים.
Abstract
תרופות נוגדנים חיסוניות חדשות שנועדו לעורר ישירות תאים חיסוניים ספציפיים או להגביר בעקיפין את התגובה החיסונית על ידי חסימה או הפעלה של מווסת אנדוגני של מערכת החיסון הן בעלות פוטנציאל לגרום לתופעות לוואי חמורות הקשורות למערכת החיסון כגון תסמונת שחרור ציטוקינים (CRS). לכן חיוני להעריך את פרופיל הבטיחות של תרופות כאלה בשילוב של ניסויים in vivo ו-in vitro לפני מתן מנה ראשונה בבני אדם. מבחני שחרור ציטוקינים (CRAs), שבהם הנוגדנים המוצעים מתורבתים יחד עם תאי חיסון אנושיים (כגון תאים חד-גרעיניים בדם היקפי (PBMCs), דם מלא או אחר) ונמדדת כמות הציטוקינים הדלקתיים המיוצרים, הם קריטיים לזיהוי סכנה. עם זאת, מעבדות שונות המשתמשות בנוגדני בקרה שונים עלולות לאיים על ההרמוניזציה של CRAs, ובקרות רלוונטיות מבחינה קלינית (כגון TGN1412) יכולות להיות קשות להשגה, מה שעלול להוביל לתוצאות או נתונים פחות מדויקים או אמינים שקשה להשוות בין מעבדות. הכללת בקרות חיוביות ושליליות ב-CRA יכולה להבטיח את הדיוק והאמינות של התוצאות. המכון הלאומי לתקנים ובקרה ביולוגיים (NIBSC) ייצר פאנל של בקרות נוגדנים ליופיליים המיועדים לשימוש בפלטפורמות CRA שונות כדי לתאם את התוצאות במעבדות שונות ובשיטות בדיקה. קבוצה של שלושה נוגדנים חיוביים שונים כוללת אנטי-CD52, אנטי-CD3 ואנטי-CD28 סופראגוניסט (SA), הידועים כגורמים ל-CRS תלוי מינון בחולים. לכל נוגדן מסופק נוגדן בקרה שלילי תואם איזוטיפ. פאנל זה של ריאגנטים ייחוס הוכח בעבר כבעל יכולת שחזור בין-מעבדתית טובה והם בקרות מתאימות להגברת הביטחון והחוסן של נתוני בטיחות ממגוון פלטפורמות CRA.
Introduction
שחרור ציטוקינים מושרה יכול להיות השפעה צפויה ורצויה של כמה נוגדנים חד-שבטיים אימונומודולטוריים (mAbs). עם זאת, שחרור בלתי צפוי של ציטוקינים פרו-דלקתיים יכול לגרום לתסמונת שחרור ציטוקינים (CRS) בחולים המאופיינים בחום, עייפות ואפילו אי ספיקת איברים מרובים1. לכן חיוני ש-mAbs חדשים ייבדקו במבחנה על הפוטנציאל שלהם לגרום ל-CRS על ידי מדידת שחרור ציטוקינים במבחן שחרור ציטוקינים (CRA).
TGN1412 הוא נוגדן חד שבטי שפותח כטיפול פוטנציאלי ללוקמיה לימפוציטית כרונית של תאי B על ידי פעולה כסופר-אגוניסט CD28 (CD28SA), המסוגל להפעיל לימפוציטים מסוג T על ידי קישור צולב של הקולטן CD282. בשנת 2006, שישה מתנדבים בריאים שקיבלו TGN1412 בניסוי קליני חוו תופעות לוואי חמורות, כולל CRS, תוך שעות מקבלת התרופה1. זה הוביל להפסקת הניסוי והוצאת TGN1412 מהמשך פיתוח. נוגדנים אחרים הידועים כגורמים ל-CRS כתופעת לוואי כוללים את האנטי-CD52 mAb, Campath-1H3, והאנטי-CD3 mAb, Muromonab (OKT3)4. בהתחשב ביכולתם לגרום ל-CRS תלוי מינון בחולים, TGN1412, OKT3 ו-Campath-1H הם נוגדני בקרה חיוביים מתאימים ליצירת תוצאות חזקות ואמינות מ-CRA. עם זאת, נוגדנים אלה לא היו ניתנים להשגה בקלות בעבר בגלל עלויות גבוהות או זמינות מוגבלת.
עם זאת, פאנל ייחוס ליופילי מחודש של שלושת הנוגדניםהללו 5,6,7 לצד בקרות שליליות תואמות איזוטיפ הפך לאחרונה לזמין על ידי המכון הלאומי לתקנים ובקרה ביולוגיים (NIBSC). פאנל זה של ריאגנטים ייחוס הוכח בעבר כבעל יכולת שחזור בין-מעבדתית טובה8 ולכן הוא בקרה מתאימה להגברת הביטחון והחוסן של נתוני בטיחות ממגוון פלטפורמות CRA. לפיכך, הרציונל מאחורי השימוש בפרוטוקול זה לצד ריאגנטים אלה הוא לשפר את ההרמוניזציה של CRA, כאשר היתרון של ריאגנטים אלה אושר במחקר שיתופי בינלאומי8.
כאן אנו מתארים כיצד להשתמש בצורה הטובה ביותר בפאנל זה של ריאגנטים ייחוס ב-CRA של PBMC בשלב מוצק (SP) וב-CRA של דם מלא (WB) בשלב מימי (AQ) כדי לחזות CRS המושרה על ידי נוגדנים. שני פורמטי ה-CRA הללו משלימים בשל אופן הצגת הנוגדנים (עקיף לשלב המוצק לעומת ישיר לשלב הימי) ובשל העובדה שהם מכוונים לקבוצות שונות של תאי מגיבים. ניתן להתאים את אותו פרוטוקול לשימוש עם דם מלא מדולל (dWB) או עם אנדותל: תרביות PBMC.
Protocol
הפרוטוקול הבא עוקב אחר ההנחיות של ועדת האתיקה של המחקר NIBSC. בהתאם לתקנות ולהנחיות החלות, קבל הסכמה מדעת בכתב של תורם בריא או מטופלים. השתמש בטכניקות סטריליות כדי לבצע את כל שלבי ההכנה של הפרוטוקול במכסה המנוע של תרבית תאים בזרימה למינרית. ראה טבלת חומרים לפרטים על כל הריאגנטים והציוד.
1. הכנת צלחות מצופות עם mAb לבדיקת שלב מוצק (SP)
- הרכיבו מחדש את תכולת אמפולות המגיב הייחוס עם 1 מ"ל מים מזוקקים סטריליים. אפשר 5-10 דקות להתייבשות לפני ערבוב תמיסת הנוגדנים והעברתו לצינור מכוסה סטרילי.
- לאחר בנייה מחדש ב-1 מ"ל מים, ריכוז המלאי של הנוגדנים הרקומביננטיים הבאים יהיה 200 מיקרוגרם/מ"ל: אנטי-CD3 (15/162), אנטי-CD52 (15/178), בקרת איזוטיפ IgG1K (15/198) עבור אנטי-CD52, בקרת איזוטיפ IgG2a (15/218) עבור אנטי-CD3, בקרת איזוטיפ IgG4 (15/232) עבור אנטי-CD28SA.
- לאחר בנייה מחדש ב-1 מ"ל מים, ריכוז המלאי של אנטי-CD28SA (15/144) יהיה 100 מיקרוגרם/מ"ל. לאחסון לטווח קצר עד 7 ימים, העבירו את החומר המחודש בצינור מכוסה סטרילי ל -4 מעלות צלזיוס.
- לדלל את הנוגדנים המשוחזרים ולבדוק את הנוגדנים ל-10 מיקרוגרם/מ"ל ב-PBS סטרילי ולצפות את הבארות של צלחת מיקרוטיטר סטרילית שאינה מטופלת ב-U-bottom עם 100 מיקרוליטר של תמיסת נוגדנים מדוללת (1 מיקרוגרם/באר) ולדגור למשך הלילה ב-4 מעלות צלזיוס.
הערה: חשוב להשתמש בלוחות פוליפרופילן לספיגת חלבון, שכן אלה שימשו לאימות הריאגנטים הסטנדרטיים9.
2. הכנת PBMCs
- אסוף לפחות 30 מ"ל של דם מלא היקפי (WB) לתוך צינורות המכילים הפרין/הפרין והפוך מספר פעמים כדי להבטיח תערובת נכונה עם נתרן הפרין.
- העברת 15 מ"ל של WB בצינור נפרד לשימוש מאוחר יותר בהכנת בדיקת דם מלא בשלב מימי (שלב 3.1)
- יש לדלל את 15 מ"ל הדם הנותרים ביחס נפח של 1:1 עם PBS או מדיה RPMI-1640 נטולת סרום ולשכב בעדינות את הדם המדולל על גבי 15 מ"ל של מדיום שיפוע צפיפות (למשל, לימפופרפ, Ficoll-Hypaque) בשפופרת של 50 מ"ל.
- צנטריפוגה של הצינור ב-500 x גרם למשך 20 דקות בטמפרטורת החדר ברוטור מתנדנד החוצה ללא בלם ועם תאוצה מופחתת להפרדת הדם למרכיביו השונים.
- לאחר הצנטריפוגה, שיפוע הצפיפות ייפרד כשכבה עליונה של פלזמה ואחריה שכבה דקה של מעיל באפי המכילה PBMCs ושכבה תחתונה המכילה תאי דם אדומים (RBCs) וגרנולוציטים פולימורפו-גרעיניים כולל נויטרופילים ואאוזינופילים. קצרו בזהירות את ה-PBMCs על ידי החדרת פיפטה ישירות דרך שכבת הפלזמה העליונה ל-PBMCs. לחלופין, הסר את השכבה העליונה לפני איסוף התאים.
- השהה בעדינות את שכבת האפי ב-10 מ"ל של PBS או מדיה RPMI-1640 ללא סרום. צנטריפוגה את הצינור שוב ב-500 x גרם למשך 10 דקות כדי לגלול את התאים. הסר את הסופרנטנט והשליך אותו.
- חזור על שלב הכביסה 2.6. ולהשעות את הגלולה ב-2 מ"ל של RPMI עם 10% FCS (RPMI-1640 מלא, cRPMI)
- ספירת תאים באמצעות המוציטומטר10.
- התאם PBMCs לריכוז של 1 x 106 תאים/מ"ל ב-cRPMI.
3. הכנת בדיקת שחרור ציטוקינים בשלב מימי (AQ) בדם מלא (WB)
- הוסף 190 מיקרוליטר WB לבארות של צלחת פוליסטירן תחתונה U של 96 בארות. אם עדיין לא ב-100 מיקרוגרם/מ"ל, יש לדלל מראש את כל הנוגדנים לטיפול וריאגנטים ל-100 מיקרוגרם/מ"ל ב-PBS.
- הוסף 10 מיקרוליטר של נוגדנים מדוללים ל-190 מיקרוליטר של WB כדי לתת ריכוז נוגדנים סופי של 5 מיקרוגרם/מ"ל נוגדן ב-95% WB.
- דגירה של צלחת למשך 48 שעות בחממה לחה בטמפרטורה של 37 מעלות צלזיוס.
4. הכנת בדיקת שחרור ציטוקינים PBMC בשלב מוצק (SP)
- בעזרת פיפטה רב-ערוצית הסר והשליך את תמיסת הנוגדנים מהצלחות המצופות (המתואר בשלב 1), מלא מאגר ריאגנטים ב-PBS ושטוף את הצלחת פי 3 עם 200 מיקרוליטר PBS כדי להסיר mAbs לא קשורים.
- הוסף 200 מיקרוליטר של תרחיף התאים משלב 2.8 לכל באר. דגרו את הצלחת למשך 48 שעות בחממה לחה בטמפרטורה של 37 מעלות צלזיוס, 5% CO2.
5. איסוף סופרנטנט או פלזמה
- לאחר הדגירה למשך 48 שעות עם mAbs בקרה ובדיקה, צלחות צנטריפוגה ב-400 x גרם למשך 5 דקות ואוספות את המדיום או הפלזמה הממוזגים בתא, תוך הקפדה לא להפריע לגלולת התא. הקפיאו את הסופרנטנט או הפלזמה שנאספו בטמפרטורה של -20 מעלות צלזיוס.
הערה: הקפד לא להפריע לכדור כדוריות הדם האדומות בעת איסוף הפלזמה.
6. ביצוע כימות של ציטוקינים בסופרנטנט או בפלזמה
- באמצעות הסופרנטנט או הפלזמה שנאספו, בצע ניתוח ציטוקינים של ריכוזי IFN-γ, IL-2, TNF-α ו-IL-6 באמצעות אפשרות המולטיפלקס המועדפת. שיטה לדוגמה לניתוח ציטוקינים מרובים באמצעות בדיקת חרוז ציטומטרי פורסמה בעבר11.
הערה: אנא עיין בטבלת החומרים עבור ערכת המולטיפלקס ששימשה ביצירת התוצאות המייצגות.
תוצאות
תוצאות בדיקת ה-SP אמורות להדגים שחרור של IL-2, IFN-γ, IL-6 ו-TNF-α12 בטווח pg/mL מכל נוגדני הבקרה החיוביים לאחר 48 שעות וצריכות להיות גדולות יותר באופן מובהק סטטיסטית מבקרות איזוטיפ תואמות. התוצאות המייצגות שלנו מדגימות כי נוגדני הבקרה החיוביים, αCD28, αCD3 ו-αCD28SA גורמים לרמות גבוהות משמעותית של IFN-γ , IL-6 ו-TNF-α בהשוואה לבקרות איזוטיפ תואמות, כאשר הם מופעלים במבחן PBMC SP (איור 1). בדיקה זו מאופיינת גם בשינוי קיפול גבוה של שחרור IL-2 מגירוי עם αCD28SA בהשוואה לאיזוטיפ התואם שלו (859.0). בעוד ש-αCD3 ו-αCD52, למרות שהם עדיין גורמים לביטוי IL-2, גורמים לשינויי קיפול נמוכים יותר מאשר αCD28SA (6.2 ו-3.3 עבור αCD3 ו-αCD52, בהתאמה, איור 2).
בבדיקת WB AQ (איור 3), רמת הציטוקינים הניתנים לזיהוי נמוכה באופן ניכר מאשר בבדיקת PBMC SP אך מאופיינת ברגישות גדולה יותר לגירוי על ידי נוגדן αCD52 (איור 2 ואיור 3) עם שינויי קיפול ממוצעים של IL-2, IFN-γ ו-IL-6 מעל 100.
נוגדן בדיקה שעבורו ניתן לצפות כי מינון עתידי ראשון בבני אדם לא יגרום לעלייה משמעותית בלתי צפויה בשחרור ציטוקינים בהשוואה לבקרות איזוטיפ רלוונטיות. אם כי, במקום לעצור את הפיתוח של mAb טיפולי חדש, יש לשקול תוצאה חיובית ב-CRA כחלק מניהול הסיכון/תועלת13. בעת פיתוח פלטפורמת CRA חדשה, יש לחזור על הבדיקה באמצעות קבוצה שונה של תורמים כדי להבטיח שחזור של הפלטפורמה. יש לתת חשיבות גם לשונות התגובה בין התורמים14, ולכן מומלץ ניסוי חזקהיטב 15. על מנת להבין את רוחב התגובות ולקבל ייצוג מלא של השונות שניתן לראות בתגובות התורם, יש לבצע את הבדיקה באופן אידיאלי עם מספר תורמים בודדים בנוסף לבדיקת הטיפול בניסויי שכפול.

איור 1: שחרור ציטוקינים מניסוי PBMC-SP. תוצאות מייצגות של שחרור IFN-γ, IL-2, IL-6 ו-TNF-α שהתקבלו ממבחני שחרור ציטוקינים PBMC-SP (3 ניסויים עצמאיים שכל אחד מהם מכיל 5-8 תורמים לניסוי; n=8, n=10, n=5 [מלמעלה למטה]) לאחר 48 שעות בעת שימוש בנוגדני ריאגנט ייחוס. קיצורים: PBMC = תאים חד-גרעיניים בדם היקפי; SP = שלב מוצק; IFN-γ = אינטרפרון-גמא; IL-2 = אינטרלוקין 2; IL-6 = אינטרלוקין 6; TNF-α = גורם נמק גידול אלפא. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
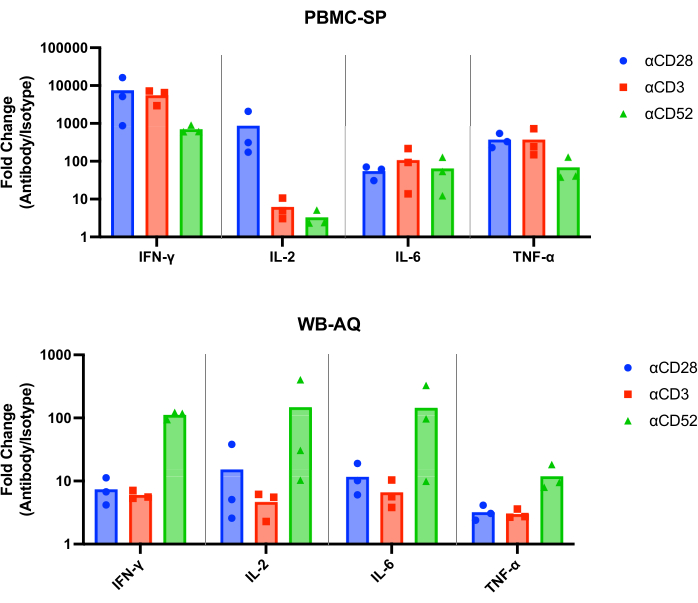
איור 2: עלייה בשינוי קיפול הציטוקינים מניסויי PBMC-SP ו-WB-AQ. שינוי קיפול של שחרור IFN-γ, IL-2, IL-6 ו-TNF-α של ריאגנטים ייחוס נוגדנים מעוררי CRS ביחס לבקרות האיזוטיפ התואמות שלהם, המתקבלות ממבחני שחרור ציטוקינים PBMC-SP ו-WB-AQ לאחר 48 שעות. קיצורים: PBMC = תאים חד-גרעיניים בדם היקפי; SP = שלב מוצק; WB = דם מלא; AQ = מימי (פאזה); IFN-γ = אינטרפרון-גמא; IL-2 = אינטרלוקין 2; IL-6 = אינטרלוקין 6; TNF-α = גורם נמק גידול אלפא; CRS = תסמונת שחרור ציטוקינים. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
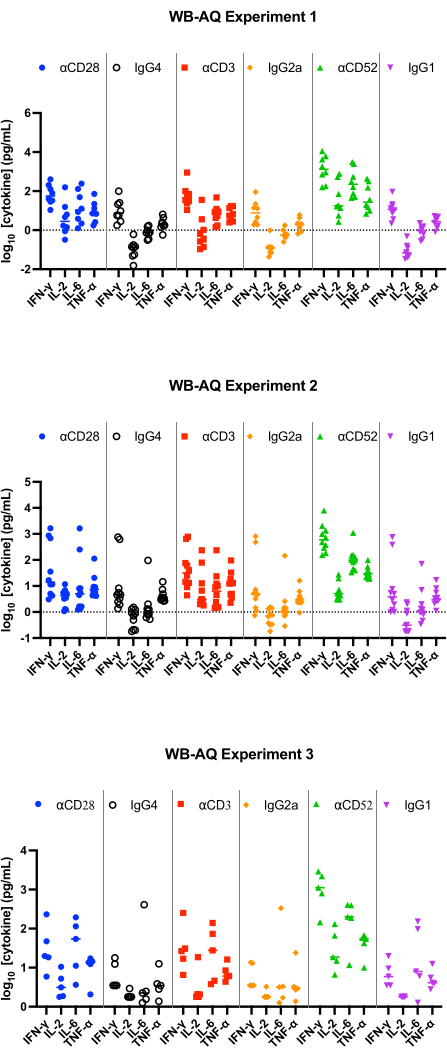
איור 3: שחרור ציטוקינים מניסוי WB-AQ. תוצאות מייצגות של שחרור IFN-γ, IL-2, IL-6 ו-TNF-α שהתקבלו ממבחני שחרור ציטוקינים WB-AQ (3 ניסויים עצמאיים שכל אחד מהם מכיל 5-8 תורמים לניסוי; n=8, n=10, n=5 [מלמעלה למטה]) לאחר 48 שעות בעת שימוש בנוגדנים ריאגנטים ייחוס. קיצורים: WB = דם מלא; AQ = מימי (פאזה); IFN-γ = אינטרפרון-גמא; IL-2 = אינטרלוקין 2; IL-6 = אינטרלוקין 6; TNF-α = גורם נמק גידול אלפא. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
Discussion
מתוארות כאן שיטות למדידת שחרור ציטוקינים מ-PBMCs ו-WB לאחר גירוי בתיווך נוגדנים מצלחת מצופה נוגדנים או עם נוגדן בתמיסה, באמצעות פאנל של ריאגנטים ייחוס לבקרה חיובית ושלילית. לכל אחת מהבדיקות הללו יש חוזקות וחולשות משלה. מבחני PBMC ו-WB משלימים מכיוון ששיעור התאים החיסוניים השונים כגון לימפוציטים, מונוציטים וגרנולוציטים שונה בשתי מטריצות הניסוי המשמשות ל-CRAs. מעניין לראות שלמרות שבדיקת WB עשויה לייצג טוב יותר את המצב in vivo בניגוד למונוקולטורה PBMC, הפלטפורמה הקודמת פחות מנבאת את הסיכון ל-CRS בתיווך תאי T מ-TGN1412 ו-OKT315; תוצאה של גליקופורין A על RBCs המעכב התרחבות תאי T בתיווך IL-216. עם זאת, חיזוי הסיכון ל-CRS מאנטי-CD52 נותר על כנו ב-WB CRA, עקב נוכחותם של נויטרופילים (שאבדו במהלך שיטות שיפוע צפיפות קונבנציונליות המתוארות בשלב 2, המשמשות לבידוד PBMC).
הפורמט של ה-CRA (מצגת SP או AQ) הוא קריטי לזיהוי מנגנון ספציפי של CRS. לדוגמה, הצגת פאזה מימית של ה-mAb ללימפוציטים אנושיים17,18, שהופעלה במהלך בדיקות בטיחות פרה-קליניות במבחנה של TGN1412 לא הצליחה לזהות סיכון CRS ככל הנראה עקב היעדר אשכולות ומעורבות של קולטני תאים מקומיים19 וכתוצאה מכך הפעלת תאי T בתיווך נוגדנים בשלב מימי. למעשה, ניתן היה לזהות במדויק CRS בתיווך TGN1412 רק בפורמט SP המשכפל באופן מלאכותי קישור צולב של קולטן Fc-gamma (FcγR), כפי שמוצג כאן, או על ידי תחול תלוי מגע בתרבית PBMC בצפיפות גבוהה ואינטראקציה של Fc עם תאי חיסון CD32+ (כגון תאי B20 ומונוציטים21).
בנוסף לפלטפורמות אלו, ישנן דרכים אחרות לבצע CRA עם מערכות קו-תרבותיות מורכבות יותר. דוגמה ל-CRA חלופי לאלה המתוארים בשיטות אלה היא תרבית משותפת של PBMCs עם תאי אנדותל צמיחת דם אוטולוגיים (BOECs)22. בדיקה זו תוארה ב-2015 כשיפור לבדיקת HUVEC:PBMC הקונבנציונלית של תורם מעורב על ידי הסרת אי ההתאמה המבלבלת של הרקמות. הוא מפגין רגישות טובה יותר ל-anti-CD28SA CRS מאשר מבחן WB, וגם מתגבר על המגבלה של בדיקת המונוקולטורה PBMC על ידי חיקוי השילוב של תאי אנדותל ולויקוציטים הקיימים in vivo, אך במחיר של שלבים פרוצדורליים ארוכים יותר הדורשים טכניקות תרבית תאים מיוחדות22.
יתר על כן, בעוד שפרוטוקול זה מתמקד באופן ספציפי בשחרור IFN-γ, IL-2, IL-6 ו-TNF-α, עמיתים ב-MHRA בחנו בעבר את IL-12 ואחרים במסגרת זו23. ייצור IL-12 מוגבר על ידי נוגדני CRS חיוביים אלה, אם כי הוא אינו רגיש במיוחד, ולכן אולי אינו מנבא טוב ל-CRS בשיטה זו. ציטוקינים, כגון IL-15 בין היתר, מעולם לא נבדקו למרות ש-4 הציטוקינים שהוערכו בפרוטוקול שלנו מספקים אינדיקציה טובה לסיכון פוטנציאלי ל-CRS. כמובן, בהתאם לשיטה ולנוגדנים שנבדקו ניתן להעריך ציטוקינים אחרים.
ביחד, תצפיות אלה מדגישות את החשיבות של ציון שלמרות שהשימוש בריאגנטים ייחוס יכול לסייע בזיהוי סיכון CRS לנוגדנים חדשים, יש לנקוט בזהירות כדי להימנע מפלטפורמת CRA לא אופטימלית שעלולה להיכשל בזיהוי פוטנציאל CRS. באופן מכריע, מנגנון הפעולה החזוי של תרופה, בין אם באמצעות אזור ה-Fc שלו או פעולתו המשוערת על תאים המבטאים אנטיגן, חייב להתאים לביולוגיה של הבדיקה. לכן, בעוד שהבדלים במנגנון הפעולה של ריאגנטים טיפוליים וייחוס לבדיקה שנדונו במאמר זה עשויים להוות מגבלה פוטנציאלית באופן ש-CRA רלוונטי לנוגדני הבדיקה עשוי להיות לא תואם לביולוגיה של ריאגנטים הייחוס, הבדיקה מספקת פלטפורמה חזקה ואמינה לזיהוי סכנות. עם זאת, תוצאות ממספר פורמטים של CRA המכסים מנגנוני פעולה שונים ותת-קבוצות של תאים חיסוניים עשויות להיות נחוצות לביטחון אופטימלי בנתוני הערכת הבטיחות.
Disclosures
EM הועסקה בעבר על ידי הסוכנות הרגולטורית לתרופות ומוצרי בריאות (MHRA). לסופרים הנותרים אין ניגודי אינטרסים.
Acknowledgements
עבודה זו מומנה על ידי המכון הלאומי לתקנים ובקרה ביולוגיים. אנו מודים לסנדרה דיבולד על סקירת כתב היד ועל הערות והצעות מועילות. אנו מודים גם לקה סנג איונג על צילום הסרטון.
Materials
| Name | Company | Catalog Number | Comments |
| 1.5 ml Microcentrifuge Tubes, Natural (Sterile) | Starlab | S1615-5510 | |
| Fetal Bovine Serum, qualified, heat inactivated | ThermoFisher | 10500064 | |
| Heparinized tubes | ThermoFisher | 12967676 | |
| Heracell 150i CO2 Incubator | ThermoFisher | 16406639 | |
| MESO QuickPlex SQ 120 Human Proinflammatory Panel 1 V-PLEX kit | Meso Scale Discovery | K15049 | |
| MESO QuickPlex SQ 120MM | Meso Scale Discovery | AI1AA-0 | |
| Neubauer Improved Haemocytometer Counting Chamber | Hawksley | AS1000 | |
| Panel of lyophilized recombinant antibody controls for Cytokine Release Assays | NISBC | 19/156 | |
| PBS | ThermoFisher | 10010023 | |
| Polypropylene 96-well microtiter plate | Corning | 3879 | |
| Polystyrene 96-well microtiter plate | Corning | 3799 | |
| RPMI 1640 | ThermoFisher | 11875093 | |
| Sorvall ST 40 Centrifuge | ThermoFisher | 75004525 | |
| Sterile water | ThermoFisher | 15230162 |
References
- Suntharalingam, G., et al. Cytokine storm in a phase 1 trial of the anti-CD28 monoclonal antibody TGN1412. The New England Journal of Medicine. 355 (10), 1018-1028 (2006).
- Hünig, T. The storm has cleared: lessons from the CD28 superagonist TGN1412 trial. Nature Reviews Immunology. 12 (5), 317-318 (2012).
- Wing, M. G., et al. Mechanism of first-dose cytokine-release syndrome by CAMPATH 1-H: involvement of CD16 (FcgammaRIII) and CD11a/CD18 (LFA-1) on NK cells. Journal of Clinical Investigation. 98 (12), 2819-2826 (1996).
- Gaston, R. S., et al. OKT3 first-dose reaction: Association with T cell subsets and cytokine release. Kidney International. 39 (1), 141-148 (1991).
- Riechmann, L., Clark, M., Waldmann, H., Winter, G. Reshaping human antibodies for therapy. Nature. 332 (6162), 323-327 (1988).
- Kung, P., Goldstein, G., Reinherz, E. L., Schlossman, S. F. Monoclonal antibodies defining distinctive human T cell surface antigens. Science. 206 (4416), 347-349 (1979).
- Ball, C., et al. Antibody C region influences TGN1412-like functional activity in vitro. Journal of Immunology. 189 (12), 5831-5840 (2012).
- Vessillier, S., et al. Development of the first reference antibody panel for qualification and validation of cytokine release assay platforms - Report of an international collaborative study. Cytokine: X. 2 (4), 100042(2020).
- Findlay, L., et al. Improved in vitro methods to predict the in vivo toxicity in man of therapeutic monoclonal antibodies including TGN1412. Journal of Immunological Methods. 352 (1-2), 1-12 (2010).
- oVE Science Education Database. Science Education Database. Basic Methods in Cellular and Molecular Biology. Using a Hemacytometer to Count Cells. Journal of Visualized Experiments. , (2023).
- Lehmann, J. S., Zhao, A., Sun, B., Jiang, W., Ji, S. Multiplex Cytokine Profiling of Stimulated Mouse Splenocytes Using a Cytometric Bead-based Immunoassay Platform. Journal of Visualized Experiments. (129), e56440(2017).
- Murthy, H., Iqbal, M., Chavez, J. C., Kharfan-Dabaja, M. A. Cytokine Release Syndrome: Current Perspectives. Immunotargets Therapy. 8, 43-52 (2019).
- Vidal, J. M., et al. In vitro cytokine release assays for predicting cytokine release syndrome: the current state-of-the-science. Report of a European Medicines Agency Workshop. Cytokine. 51 (2), 213-215 (2010).
- Grimaldi, C., et al. Cytokine release: A workshop proceedings on the state-of-the-science, current challenges and future directions. Cytokine. 85, 101-108 (2016).
- Vessillier, S., et al. Cytokine release assays for the prediction of therapeutic mAb safety in first-in man trials - Whole blood cytokine release assays are poorly predictive for TGN1412 cytokine storm. Journal of Immunological Methods. 424, 43-52 (2015).
- Chu, J. W. K., Sharom, F. J. Glycophorin A interacts with interleukin-2 and inhibits interleukin-2-dependent T-lymphocyte proliferation. Cellular Immunology. 145 (2), 223-239 (1992).
- Stebbings, R., Eastwood, D., Poole, S., Thorpe, R. After TGN1412: recent developments in cytokine release assays. Journal of Immunotoxicology. 10 (1), 75-82 (2013).
- Hanke, T. Lessons from TGN1412. Lancet. 368 (9547), author reply 1570 1569-1570 (2006).
- Stebbings, R., et al. #34;Cytokine storm" in the phase I trial of monoclonal antibody TGN1412: better understanding the causes to improve preclinical testing of immunotherapeutics. Journal of Immunology. 179 (5), 3325-3331 (2007).
- Bartholomaeus, P., et al. Cell contact-dependent priming and Fc interaction with CD32+ immune cells contribute to the TGN1412-triggered cytokine response. Journal of Immunology. 192 (5), 2091-2098 (2014).
- Hussain, K., et al. Upregulation of FcγRIIb on monocytes is necessary to promote the superagonist activity of TGN1412. Blood. 125 (1), 102-110 (2015).
- Reed, D. M., et al. An autologous endothelial cell:peripheral blood mononuclear cell assay that detects cytokine storm responses to biologics. The FASEB Journal. 29 (6), 2595-2602 (2015).
- Eastwood, D., et al. Severity of the TGN1412 trial disaster cytokine storm correlated with IL-2 release. British Journal of Clinical Pharmacology. 76 (2), 299-315 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved