A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מיקום אלקטרודות מעוררות חוץ-גולגולתיות ומדידת זרימת דם מוחית ושדות חשמליים תוך גולגולתיים בעכברים מורדמים
In This Article
Summary
אנו מתארים פרוטוקול להערכת עקומות מנה-תגובה לגירוי חוץ-גולגולתי במונחים של מדידות שדה חשמלי במוח וזרימת דם רלוונטית של סמן ביולוגי-מוחי. מכיוון שפרוטוקול זה כולל החדרת אלקטרודות פולשניות למוח, יש צורך בהרדמה כללית, כאשר נשימה ספונטנית עדיפה על פני נשימה מבוקרת.
Abstract
זיהוי תגובות זרימת דם מוחיות (CBF) לצורות שונות של הפעלה עצבית הוא קריטי להבנת תפקוד המוח הדינמי ושינויים באספקת המצע למוח. מאמר זה מתאר פרוטוקול למדידת תגובות CBF לגירוי זרם חילופין תוך גולגולתי (tACS). עקומות מנה-תגובה מוערכות הן משינוי CBF המתרחש עם tACS (mA) והן מהשדה החשמלי התוך גולגולתי (mV/mm). אנו מעריכים את השדה החשמלי התוך-גולגולתי בהתבסס על המשרעות השונות שנמדדו על-ידי מיקרואלקטרודות זכוכית בכל צד של המוח. במאמר זה, אנו מתארים את מערך הניסוי, הכולל שימוש בבדיקות דופלר לייזר דו-צדדיות (LD) או בדימות כתמי לייזר (LSI) כדי למדוד את CBF; כתוצאה מכך, מערך זה דורש הרדמה לצורך מיקום האלקטרודה ויציבותה. אנו מציגים מתאם בין תגובת CBF לבין הזרם כפונקציה של גיל, ומראים תגובה גדולה משמעותית בזרמים גבוהים יותר (1.5 mA ו- 2.0 mA) בחיות ביקורת צעירות (12-14 שבועות) בהשוואה לחיות מבוגרות יותר (28-32 שבועות) (p < 0.005 הפרש). אנו גם מדגימים תגובת CBF משמעותית בעוצמות שדה חשמלי <5 mV/mm, המהווה שיקול חשוב במחקרים בבני אדם בסופו של דבר. תגובות CBF אלה מושפעות מאוד גם משימוש בהרדמה בהשוואה לבעלי חיים ערים, מבקרת הנשימה (כלומר, נשימה אינטובטית לעומת נשימה ספונטנית), גורמים סיסטמיים (כלומר,CO2) והולכה מקומית בתוך כלי הדם, המתווכת על ידי פריציטים ותאי אנדותל. באופן דומה, טכניקות הדמיה/הקלטה מפורטות יותר עשויות להגביל את גודל השדה מהמוח כולו לאזור קטן בלבד. אנו מתארים את השימוש באלקטרודות חוץ-גולגולתיות ליישום גירוי tACS, כולל עיצובי אלקטרודות ביתיות ומסחריות עבור מכרסמים, המדידה המקבילה של CBF והשדה החשמלי התוך גולגולתי באמצעות אלקטרודות הקלטה DC מזכוכית דו-צדדית, וגישות ההדמיה. אנו מיישמים כיום טכניקות אלה כדי ליישם פורמט לולאה סגורה להגדלת CBF במודלים של בעלי חיים של מחלת אלצהיימר ושבץ.
Introduction
גירוי חשמלי תוך גולגולתי (tES; עם גירוי גל סינוס, tACS) היא גישה נפוצה, חיצונית ולא פולשנית לנוירומודולציהמוחית 1,2. בעבר, שיערנו כי במינונים מסוימים, tES (ובמיוחד tACS) עשוי להגביר את זרימת הדם במוח (CBF) באזורי המוח הבסיסיים3. יתר על כן, קשר מנה-תגובה עשוי להתקיים בין הזרם החיצוני המופעל או השדה החשמלי תוך גולגולתי לבין תגובות CBF הנובעות מכך. עם זאת, רוב פרוטוקולי הגירוי הקליניים התמקדו ברמת גירוי מקסימלית נוחה של העור (כלומר, ~ 2 mA) לפרקי זמן מתוכננים (כלומר, 30-45 דקות) כפרוטוקול טיפול 4,5. במכרסמים ניתן להשתמש באלקטרודות מוח חוץ-גולגולתיות פולשניות המופעלות ישירות על הגולגולת כדי לחקור את השדות החשמליים במוח המושרים על ידי tES6. לפיכך, מטרת גישה זו היא לקבוע את ההשפעות של עוצמת tACS בתדרים הרלוונטיים על שינויי CBF במונחים של יחסי מנה-תגובה. עקומת מינון-תגובה זו מבוססת על סמן ביולוגי פיזיולוגי קצר טווח - מדידות ישירות של CBF - ביחס לשדה החשמלי המוטל על המוח3. הראינו בעבר כי באמפליטודות גדולות יותר, בדרך כלל מעבר לטווח השדות החשמליים במוח המושרים על ידי tACS מבחינה קלינית, קיים מתאם כמעט ליניארי בין השדה החשמלי המושרה לבין CBF בקליפת המוח3. עם זאת, גירוי בשדה קטן יותר (כלומר, עוצמה של 1-5 mV/mm) עשוי להיות רלוונטי יותר ואפשרי יותר לשימוש בבני אדם; לפיכך, שינינו את הטכניקות שלנו כדי לזהות שינויים קטנים יותר ב- CBF.
מאמר זה מתאר פרוטוקול לניתוח ההשפעות של זרמי סינוס לסירוגין tES בחוזק שדה נמוך יותר (tACS) על CBF (כלומר, זרם 0.5-2.0 mA, שדה חשמלי 1-5 mV/mm), אשר יכול להיות נסבל על ידי מכרסמים ערים5. פרוטוקול זה כולל שימוש בדימות לייזר חדשני במהלך tACS, כמו גם אלקטרודות זכוכית תוך גולגולתית כפולות, כדי לקבוע הן את התפשטות tACS הפעיל בתוך המוח (כפי שמנוטר על-ידי CBF) והן את עוצמת השדה החשמלי התוך-גולגולתי, שמוצג גם כתרשים וגם כתצלום ניסויי ממשי (איור 1). ישנן השפעות פיזיולוגיות אפשריות רבות של tES במוח, כולל אפנון עצבי ישיר, פלסטיות עצבית והפעלת אסטרוציטים 7,8. למרות ש- CBF נמדד עם tDCS 9,10, מדידות אלה היו איטיות, עקיפות ולא מספיקות להערכת תפקוד המינון-תגובה במוח. לכן, על ידי שימוש בסמנים ביולוגיים מתאימים לטווח קצר (כלומר, CBF, שדות חשמליים) ורצפי הפעלה/כיבוי מהירים של tACS, אנו יכולים כעת להעריך את פונקציית תגובת המינון בצורה מדויקת יותר. יתר על כן, אנו יכולים ליישם טכניקות שונות למדידת CBF, כולל בדיקות דופלר לייזר מוקדיות (LD) והדמיית כתמי לייזר (LSI) עם אזורי עניין מוגדרים.
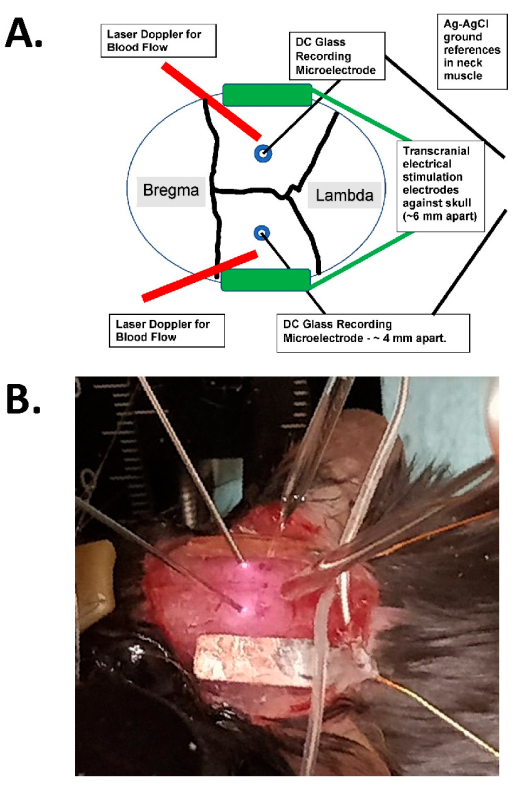
איור 1: דיאגרמת גירוי תוך גולגולתי ודוגמה צילומית . (A) דיאגרמה של מערך הגירוי הטרנס-גולגולתי. התרשים מציג גולגולת עכבר עם תפרים קורונליים וסגיטליים. האלקטרודות הטרנס-גולגולתיות ממוקמות לרוחב וסימטריה על הגולגולת ומותקנות בדבק כירורגי ובהדבקה מוליכה בין האלקטרודות לגולגולת. אלקטרודות אלה מחוברות למכשיר גירוי זרם קבוע התואם לבני אדם, שיכול לציין את התדירות, המשרעת ומשך הגירוי. לצורך הערכת שדות חשמליים תוך גולגולתיים, אלקטרודות זכוכית דו-צדדיות (~2 MΩ) ממוקמות בקליפת המוח (כלומר, בטווח של 1 מ"מ מהאספקט הפנימי של הגולגולת דרך חורי בור קטנים), ואלה אטומות בשמן מינרלי ויש להן קרקע AgCl בשריר הצוואר (מוצגים כחוטים גדולים יותר במרכז הקבורים ברקמת הצוואר התת עורית). אלקטרודות זכוכית אלה מחוברות למגבר DC, והיציאות שלהן נרשמות באמצעות דיגיטציה בעלת ארבעה ערוצים לפחות. בדיקות דופלר לייזר דו-צדדיות ממוקמות גם על הגולגולת לצורך הקלטות. הגולגולת כולה מצולמת גם באמצעות מכשיר הדמיה של כתמי לייזר או מצלמה מקוררת ברזולוציה גבוהה (לפחות 1,024 x 1,024 פיקסלים, עומק פיקסלים של 12-14 סיביות) לזיהוי אותות אופטיים פנימיים. התדר האיזוסבסטי של המוגלובין נבחר בדרך כלל (כלומר, 562 ננומטר) להארה לצורך הדמיית זרימת דם. (B) תמונת תקריב של ניסוי אמיתי, המראה את גשושיות דופלר הלייזר הדו-צדדיות (משמאל), את מיקרואלקטרודות רישום הזכוכית התוך-גולגולתית (הדו-צדדית) הממוקמות דרך חורי הבור, ועם אלקטרודות מעוררות tACS לרוחב. קיצור: tACS = גירוי זרם חילופין תוך גולגולתי. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
כדרך להעריך את המנגנונים, אנו יכולים גם לחקור אינטראקציות עם תהליכים פיזיולוגיים אחרים שגם משנים את CBF, כגון K+ המושרה התפשטות depolarization11. יתר על כן, במקום פגישות מתוכננות בזמנים קבועים, ניתן גם לפתח מערכת לולאה סגורה המבוססת על סמנים ביולוגיים נוספים למגוון מחלות, כפי שהוצע לטיפול באפילפסיה12 (כלומר, מכשירי נוירופייס קליניים). לדוגמה, גירוי מוחי בלולאה סגורה עבור מחלת פרקינסון מבוסס בדרך כלל על פוטנציאלי שדה מקומיים פנימיים חריגים (LFPs) המהותיים למחלה זו בהיעדר מספיק דופמין (בדרך כלל LFPs β-band)13.
Protocol
כל הנהלים בבעלי חיים אושרו על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים באוניברסיטת דיוק או הרשות המקומית המקבילה המסדירה מחקרים בבעלי חיים. עיין בטבלת החומרים לקבלת פרטים על כל החומרים, המכשירים והציוד המשמשים בפרוטוקול זה.
1. הכנת מכשירים
- ודאו שכל הפריטים וכלי הניתוח הדרושים נמצאים במקומם (איור 2): תמיסת ניקוי קרקפת (רפידות אלכוהול), סרט הדבקה, מלקחיים, מספריים ומקדחה להנחת חורי הבור הקטנים (0.5 מ"מ).
- הכינו את האלקטרודות החוץ-גולגולתיות ליישום הגולגולת, וודאו שכל דבק כירורגי נוקה מהן אם נעשה בהן שימוש בעבר.
- ודא את העכבה של אלקטרודות tACS אלה ישירות לפני החלתן על הגולגולת. לשם כך, השתמש בפונקציית המדידה המובנית של מגרה tACS עם שתי האלקטרודות הממוקמות באמבט מלוחים.
הערה: העכבה המועדפת היא <5 KΩ לכל זוג אלקטרודות כדי לאפשר מעבר זרם מספיק על פני הגולגולת. מכשיר הממריץ בודק את העכבה לפני העברת פולסים בזרם קבוע ונותן את הערך ישירות.
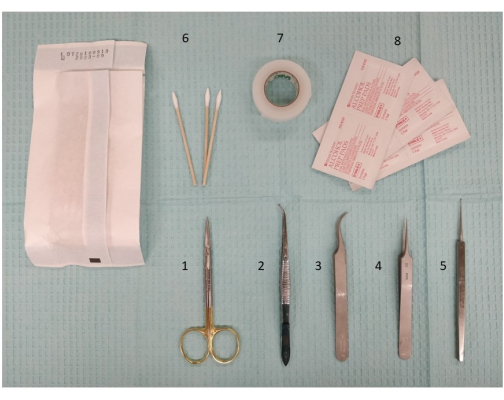
איור 2: צילום של המכשור הנדרש, כולל כלי ניתוח ומספריים, להכנת הגירוי החוץ-גולגולתי. 1. מספריים לניתוח מיקרו, 11.5 ס"מ; 2. מלקחיים, 11.5 ס"מ, עקומה קלה, משונן; 3. Dumont #7 מלקחיים, מעוקל; 4. Dumont #5 מלקחיים; 5. מיקרו קורט, 13 ס"מ; 6. עצות Q; 7. סרט כירורגי; 8. רפידות אלכוהול. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
2. הכנת החיה לניתוח
הערה: עבור ניסויים אלה, השתמשנו ב-14 עכברי ביקורת C57BL/6 בגילאי 12 שבועות עד 33 שבועות, מתוכם חמישה זכרים ותשעה נקבות.
- מרדימים את בעל החיים בתא אינדוקציה עם איזופלורן ב-30% O2 ב~1.5 ליטר/דקה, כאשר ~4% בתחילה לזירוז ו~1.25%-1.5% לשמור על רמת הרדמה עם נשימה ספונטנית ומספיק כדי לחסל את תגובת צביטת הזנב.
- העבירו את החיה למסגרת הסטריאוטקסית לאחר האינדוקציה, ואז הדביקו את הראש לתוך חרוט האף ומוטות האוזן עבור יישום האלקטרודות הבאות והליך חור הבור (איור 1 ואיור 3).
- חבר את חרוט האף של המסגרת הסטריאוטקסית לוופורייזר דרך כניסה ולשקע כדי להסיר כל שארית איזופלורן דרך מערכת נבלות (למשל, פחם או ואקום). ודאו שאין דליפות אוויר מחרוט האף, גם כדי לשמור על רמת ההרדמה עם האיזופלואורן וגם כדי למנוע דליפה מקרית לאוויר החדר (איור 3).
- בדקו את מיקום העכבר במסגרת הסטריאוטקסית, כולל מיקום חרוט האף, כדי לאפשר נשימה ספונטנית ללא אינטובציה, כמו גם התאוששות מתאימה מהרדמה ונבלות כדי להגן על אנשי המחקר (איור 3).
- מניחים את הבדיקות למדידת הדופק, ריווי החמצן בדופק (דופק OX), לחץ הדם והטמפרטורה על החיה; ודא שחמצון הדופק המינימלי הוא 90% והדופק הוא >450 לדקה (הגבול התחתון של האזעקה מוצג כ- 380 פעימות לדקה). תעד את הפרמטרים האלה במהלך ההליך במרווחי זמן קבועים או ברציפות, בהתאם למערכת ההקלטה (איור 3).
- לפני תחילת ההליך, בדוק את רמת ההרגעה של בעל החיים באמצעות (למשל) צביטת בוהן כדי לבדוק את הרפלקסים. אם אין רפלקס, אז רמת ההרגעה היא אופטימלית, כל עוד החיה שומרת על נשימה ספונטנית חמצון הדופק הולם. אם יש רפלקס, להגדיל את המסירה של isoflurane כדי להעמיק את רמת ההרדמה, ולאחר מכן לבדוק מחדש את הרפלקס. התבונן ועקוב ברציפות אחר תדירות הנשימה של החיה, והתאם את אספקת האיזופלורן בהתאם.
- לגלח את שיער הקרקפת או להסיר את השיער עם קרם depilatory (לנקות את שאריות קרם עם מעברים כרית אלכוהול).
- יש למרוח משחת עיניים, ולאחר מכן לנקות את הקרקפת עם שלושה מעברים של יוד ואלכוהול לפני הכריתה באמצעות מספריים.

איור 3: תמונה של החיה במסגרת הסטריאוטקטית, כשהגולגולת חשופה ורק אלקטרודות המגרה tACS נמצאות במקומן (לפני מיקום חור הבור). שימו לב למכשיר לחץ הדם סביב הזנב ומד הדופק אוקסימטר על הכפה, עם הקריאה בצד שמאל. ישנם צינורות נבלות עבור isoflurane סביב חרוט האף. קיצור: tACS = גירוי זרם חילופין תוך גולגולתי. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
3. הליך כירורגי: הפעלת האלקטרודות המעוררות ויצירת חורי הבור
- למחקר סופני, הסירו את הקרקפת באמצעות מספריים כירורגיים, וחשפו את הגולגולת ~3 מ"מ מתפר הלמבדואיד בצורה קאודלית ו~3 מ"מ קדמית לברגמה כדי לחשוף חלק מהתפר הקדמי האחורי. הבלו את הקרקפת באופן קודקודי כדי לחשוף את החלק הראשוני של השריר הרקתי משני הצדדים (איור 3).
- הסר את כל רקמות החיבור התת עוריות כך שהגולגולת נקייה ויבשה ליישום האלקטרודות המעוררות.
- יש למרוח ג'ל מוליך או להדביק על צד האלקטרודות שיהיו במגע עם הגולגולת, ולהדביק את האלקטרודות בדבק-על כירורגי סביב הקצה בנקודות לסירוגין.
הערה: אין לאפשר לג'ל המוליך להפריע לדבק-העל הניתוחי על מנת לאפשר חיבור טוב יותר למשטח הגולגולת. ניתן גם לבודד את המשטח החיצוני של האלקטרודות (מהקרקפת אם הוא סגור במהלך ניתוח הישרדות) באמצעות דבק-על כירורגי. - השתמש באלקטרודות שטוחות מסחריות, או צור אלקטרודות פנימיות באמצעות חוט מבודד בקוטר של 100 מיקרומטר (מולחם לצלחת) ולוח נחושת גמיש ומבודד (על משטח אחד) בגודל 1 מ"מ x 3 מ"מ החתוך בהתאם לגודל הגולגולת.
- מרחו משחת לידוקאין על השריר הרקתי והקרקפת משני הצדדים מבלי להפריע לאלקטרודות כדי להפחית את הפעלת השרירים והעצבים ההיקפיים.
- ברגע שהאלקטרודות החוץ-גולגולתיות מעוררות נמצאות במקומן 4 מ"מ לרוחב לכל צד של הגולגולת (בין הברגמה ללמדא), קדחו שני חורי בור בקוטר 0.5 מ"מ עבור אלקטרודות הזכוכית בקוטר 2 מ"מ בכל צד של קו האמצע, במרחק של 4 מ"מ זה מזה, אורתוגונליים לתפר הקשת (איור 1). מלאו את חורי הבור האלה בשמן מינרלי סטרילי כדי למנוע חדירת זרם לגולגולת מהאלקטרודות החוץ-גולגולתיות.
- אם רוצים שניסוי מסוים יגרום להתפשטות דיכאון (כלומר, דיכאון מתפשט המושרה על ידי אשלגן [K+-SD]), הוסיפו, בצד ימין של הגולגולת, חור בור שלישי בקוטר 0.5 מ"מ ~1.5 מ"מ רוסטרלי לתפר העטרה ו~1 מ"מ לטרלי לתפר הקדמי האחורי. מלא חור בור זה במי מלח ליישום מאוחר יותר של 1 M KCl כדי לגרום ל- K+-SD.
- בדוק את העכבה של האלקטרודות הממריצות מחוץ לגולגולת הן לפני מיקום חור הבור (ובהשוואה לאותן אלקטרודות שהונחו באמבט מלח) והן לאחר מיקום חור הבור כדי לוודא שחורי הבור אינם מפריעים לזרימת הזרם למוח (כלומר, לוודא שההתנגדות אינה משתנה).
הערה: מדידת העכבה מסופקת ישירות על-ידי ההתקן המגרה. באופן כללי, מצאנו שעכבת המערכת הכוללת (כלומר, מהאלקטרודות החוץ-גולגולתיות לאורך מסלול הגולגולת/המוח, בדרך כלל ~3 KΩ) קבועה יחסית ללא קשר לחורי הבור ולמיקרואלקטרודות הזכוכית, מה שמצביע על כך שיש דליפת זרם מינימלית ישירות למוח דרך חורי הבור. - מקם את אלקטרודות הגירוי הטרנס-גולגולתי הכרוני לגירוי כרוני באופן דומה. במקרה זה, בודדו את פני השטח החיצוניים של האלקטרודות, סגרו את הקרקפת, והעבירו את החוטים המבודדים החוצה דרך הקרקפת או ניתבו אותם לשלב ראש קבוע המורכב על הגולגולת.
4. הליך פיזיולוגי
- נתחיל בהיבטים הפיזיולוגיים של הניסוי, ברגע שבעל החיים מוכן לחלוטין לניסוי הפיזיולוגי שאינו הישרדותי. יש לשמור על רמת הרדמה המספיקה הן לנשימה ספונטנית והן לדופק תקין.
- למדוד את CBF הנובע גירוי מחוץ לגולגולת על ידי אחת משתי השיטות הבאות.
- הניחו את העכבר מתחת למכשיר הדמיה של כתמי לייזר עם או בלי אלקטרודות רישום תוך גולגולתיות כדי למדוד את השדה החשמלי התוך גולגולתי במהלך אירועי גירוי (איור 3).
- העבירו את החיה להכנה פיזיולוגית למיקום בדיקות דופלר לייזר דו-צדדיות ואלקטרודות תוך גולגולתיות כדי למדוד את השדה החשמלי התוך-גולגולתי במהלך אפיזודות גירוי (איור 1).
5. מיקום דופלר לייזר דו-צדדי ואלקטרודות זכוכית
- העבר את החיה לשלב מיקרוסקופ ליישום בדיקות דופלר לייזר דו-צדדיות. הניחו את הגשושיות על החלק העליון של משטח הגולגולת בין חורי הבור הדו-צדדיים לתפר העטרה (איור 1).
- מלאו מיקרואלקטרודות זכוכית משוכות (~0.1 μM, עכבה של 2-6 MΩ) ב-0.2 M NaCl, והניחו אותן באמצעות מיקרומניפולטור לתוך שני חורי הבור הממוקמים לרוחב לתפר הקשת 3,14 (איור 1).
הערה: חורי הבור האלה נמצאים בין שתי אלקטרודות הגירוי החוץ-גולגולתי הסימטרי (איור 1). - לאחר החדרתן למוח, ודאו שמיקרואלקטרודות הזכוכית האלה נמצאות ~1 מ"מ בתוך קליפת המוח. ביצוע פרופילי עומק בעומקים סימטריים שונים. מלאו מחדש את חורי הבור בשמן מינרלי סטרילי כדי לבודד מסלול זה לזרימת זרם.
6. הליך גירוי ומדידת עוצמת גירוי זרם חילופין תוך גולגולתי (tACS) או גירוי זרם ישיר תוך גולגולתי (tDCS)
- הקלט נתונים רציפים מבדיקות דופלר לייזר כפולות על הגולגולת ושתי יציאות מיקרואלקטרודות תוך גולגולתיות (שהוקלטו באמצעות מגבר DC עם במות-ראש) באמצעות מערכת דיגיטציה ותוכנה עם לפחות ארבעה ערוצים (בקצב דגימה של 1 קילוהרץ). לאחר שכל הערכים נרשמו במשך בסיס יציב מספיק (כלומר, >10 דקות), בדוק את הגירוי החוץ-גולגולתי.
הערה: איור 4 מראה דוגמה של ארבע התעלות עם שתי אלקטרודות רישום תוך גולגולתיות בתעלות העליונות ותגובת CBF בתעלות התחתונות. - הפעילו פרקי זמן קצרים של גירוי הפעלה/כיבוי באמפליטודות שונות (כלומר, 20-30 שניות, 0.5-2.0 מיליאמפר, בטווח הנסבל) כדי לקבל קו בסיס ברור לפני ואחרי הגירוי (איור 4). הפעילו את הגירוי בין שתי אלקטרודות tACS של הגולגולת משני הצדדים (איור 1) באמצעות מכשיר גירוי מסחרי תואם לבני אדם שמספק זרם קבוע.
- התבונן מקרוב בעכבר עבור עוויתות שרירים או תגובות אחרות ל- tACS, כגון שינוי בדופק או בנשימה, כדי ליצור גבול עליון של סבילות (בדרך כלל ~ 2 mA).
- המשך לעקוב אחר העכבה על פני האלקטרודות עם תקופות גירוי כדי להבטיח שזה קבוע.
- הוסף כמות קטנה (2-3 μL) של 1 M KCl לחור הבור הקדמי14 כדי לגרום לאירועי K+-SD ספונטניים. אלה יוצרים תגובת CBF גדולה ואינטראקציות בין תגובת CBF המושרה על ידי K+-SD לבין תגובת CBF. הערך את תגובת tACS CBF, תוך יישום גירוי tACS לפני ואחרי התרחשות ה- SD.
- בסוף הניסוי, בצע המתת חסד באמצעות מנת יתר של איזופלורן (5%) ולאחר מכן ערוף את ראשו לאחר הפסקת הנשימה ופעימות הלב.
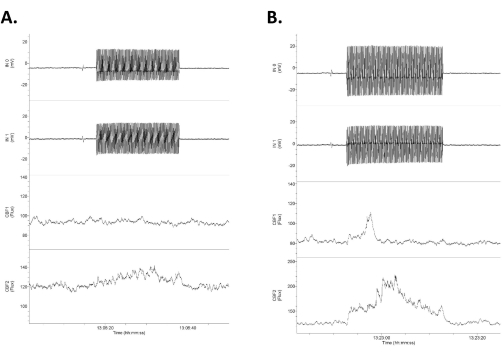
איור 4: נתונים המציגים ארבעה ערוצים של נתונים גולמיים בתגובה ל-tACS בעוצמה נמוכה. הנתונים מסודרים עם שתי השורות העליונות כהקלטות חשמליות DC ישירות תוך גולגולתיות (מסומנות כקלט 1 [IN0] וקלט 2 [IN1]) ושתי השורות התחתונות כרישומי דופלר לייזר דו-צדדיים של זרימת הדם במוח. שימו לב שהתגובות אינן סימטריות בין עקבות זרימת הדם החשמליות והמוחיות הימניות (העליונות) והשמאליות (התחתונות). (A) תגובה קטנה (עלייה של 16% בזרימת הדם) בתגובה לגירוי של 1.2 mV/mm 20 s (0.75 mA). (B) תגובה גדולה יותר (עלייה של 21% בזרימת הדם) בתגובה לגירוי של 1.4 mV/mm (1.0 mA). קיצור: tACS = גירוי זרם חילופין תוך גולגולתי. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
7. חישוב השדה החשמלי
- מדדו את ההבדל בפלט משתי האלקטרודות התוך-גולגולתיות באמצעות ההבדל בחצי הגל (מחזור אחד) של שני גלי הסינוס שתועדו (שני העקבות העליונים באיור 4). חלק הפרש זה (mV) במרחק בין שתי האלקטרודות (מ"מ, כאן ~ 4 מ"מ אך נמדד ישירות בכל מקרה) כדי להגיע לעוצמת השדה (mV/mm)3,6.
תוצאות
תוצאות מייצגות מוצגות באיור 4, איור 5 ואיור 6. איור 4 מראה דוגמה של ארבע התעלות עם שתי אלקטרודות ההקלטה התוך-גולגולתית בתעלות העליונות ותגובות CBF בתעלות התחתונות. ה-tACS סימטרי לאורך הגולגולת, אולם באופן כללי, תגובת השדה התוך-גול?...
Discussion
פרוטוקול זה מתמקד במדידה in vivo, מורדמת, של תגובת CBF כסמן ביולוגי להערכת תגובת המוח ל-tES14. סמנים ביולוגיים ארוכי טווח של תגובת tES כוללים השפעות טיפול היסטולוגיות, כגון מניעה או שינויים בהיווצרות רובד העמילואיד (כלומר, עם גירוי גמא ב -40 הרץ במספר מודלים של אלצהיימר)16,17...
Disclosures
למחברים אין ניגודי עניינים להצהיר.
Acknowledgements
מחקר זה נתמך על ידי המענקים הבאים (ל- D.A.T.): NIA RO1 AG074999, NIA R21AG051103, VA I21RX002223 ו- VA I21 BX003023.
Materials
| Name | Company | Catalog Number | Comments |
| Alcohol pads | HenryShein | 112-6131 | |
| Baby mineral oil | Johnson & Johnson | ||
| BD 1 mL syringe | Becton Dikinson | REF 305699 | |
| C3 Flat Surface Electrodes | Neuronexus | ||
| C57BI mice | from NIH colonies | ||
| Copper skull electrods | In house preparation | ||
| Digidata 1440, Clampex | Axon Instruments | ||
| Dumont #5 forceps | FST | #5 | |
| Dumont #7 forceps curved | Dumont | RS-5047 | |
| Eye ointment | Major | LubiFresh P.M. NDC-0904-6488-38 | |
| Flaming/Brown micropipette puller | Sutter instrument Co. | Model P-87 | |
| Forceps 11.5 cm slight curve serrated | Roboz | RS-8254 | |
| Intramedic needle 23 G | Becton Dikinson | REF 427565 | |
| KCl 1 M | In house preparation | ||
| Laser Doppler Probes | Moor Instruments | 0.46 mm laser doppler probes | |
| Laser Speckle Imaging Device | RWD | RFLSI-ZW | |
| Micro curette 13 cm | FST | 10080-05 | |
| Micro Dissecting Scissors, 11.5 cm | Roboz | RS-5914 | |
| Mouse anesthesia fixation | Stoelting | ||
| Neuroconn-DS | Neurocare | DC-Stimulator Plus | |
| PhysioSuite Monitoring | Kent Scientific | ||
| Q-tips | Fisherbrand | 22363167 | |
| Saline 0.9% NaCl solution | Baxter | 281322 | |
| Sensicam QE | PCO Instruments | ||
| Software | Axon Instruments Clampex | ||
| Surgical glue | Covetrus | 31477 | |
| Surgical tape | 3M Transpore | T9784 |
References
- Bestmann, S., Walsh, V. Transcranial electrical stimulation. Current Biology. 27 (23), R1258-R1262 (2017).
- Bikson, M., et al. Rigor and reproducibility in research with transcranial electrical stimulation: An NIMH-sponsored workshop. Brain Stimulation. 11 (3), 465-480 (2018).
- Turner, D. A., Degan, S., Galeffi, F., Schmidt, S., Peterchev, A. V. Rapid, dose-dependent enhancement of cerebral blood flow by transcranial AC stimulation in mouse. Brain Stimulation. 14 (1), 80-87 (2020).
- Shah, S., Chhatbar, P. Y., Feld, J. A., Feng, W. Integrating tDCS into routine inpatient rehabilitation practice to boost post-stroke recovery. Brain Stimulation. 13 (4), 953-954 (2020).
- Voroslakos, M., et al. Direct effects of transcranial electric stimulation on brain circuits in rats and humans. Nature Communications. 9 (1), 483 (2018).
- Alekseichuk, I., Mantell, K., Shirinpour, S., Opitz, A. Comparative modeling of transcranial magnetic and electric stimulation in mouse, monkey, and human. Neuroimage. 194, 136-148 (2019).
- Tavakoli, A. V., Yun, K. Transcranial alternating current stimulation (tACS) mechanisms and protocols. Frontiers in Cellular Neuroscience. 11, 214 (2017).
- Yavari, F., Jamil, A., Mosayebi Samani, M., Vidor, L. P., Nitsche, M. A. Basic and functional effects of transcranial electrical stimulation (tES)-An introduction. Neuroscience and Biobehavioral Reviews. 85, 81-92 (2018).
- Wachter, D., et al. Transcranial direct current stimulation induces polarity-specific changes of cortical blood perfusion in the rat. Experimental Neurology. 227 (2), 322-327 (2011).
- Han, C. H., et al. Hemodynamic responses in rat brain during transcranial direct current stimulation: A functional near-infrared spectroscopy study. Biomedical Optics Express. 5 (6), 1812-1821 (2014).
- Ayata, C., Lauritzen, M. Spreading depression, spreading depolarizations, and the cerebral vasculature. Physiological Reviews. 95 (3), 953-993 (2015).
- Berenyi, A., Belluscio, M., Mao, D., Buzsaki, G. Closed-loop control of epilepsy by transcranial electrical stimulation. Science. 337 (6095), 735-737 (2012).
- Hoang, K. B., Cassar, I. R., Grill, W. M., Turner, D. A. Biomarkers and stimulation algorithms for adaptive brain stimulation. Frontiers in Neuroscience. 11, 564 (2017).
- Turner, D., A, D. S., Hoffmann, U., Galleffi, F., Colton, C. A. CVN-AD Alzheimer's mice show premature reduction in neurovascular coupling in response to spreading depression and anoxia compared to aged controls. Alzheimer's and Dementia. 17 (7), 1109-1120 (2021).
- Colton, C. A., et al. mNos2 deletion and human NOS2 replacement in Alzheimer disease models. Journal of Neuropathology and Experimental Neurology. 73 (8), 752-769 (2014).
- Castano-Prat, P., et al. Altered slow (<1 Hz) and fast (beta and gamma) neocortical oscillations in the 3xTg-AD mouse model of Alzheimer's disease under anesthesia. Neurobiology of Aging. 79, 142-151 (2019).
- Etter, G., et al. Optogenetic gamma stimulation rescues memory impairments in an Alzheimer's disease mouse model. Nature Communications. 10 (1), 5322 (2019).
- Iaccarino, H. F., et al. Gamma frequency entrainment attenuates amyloid load and modifies microglia. Nature. 540 (7632), 230-235 (2016).
- Martorell, A. J., et al. Multi-sensory gamma stimulation ameliorates Alzheimer's-associated pathology and improves cognition. Cell. 177 (2), 256-271 (2019).
- Dawson, J., et al. Vagus nerve stimulation paired with rehabilitation for upper limb motor function after ischaemic stroke (VNS-REHAB): A randomised, blinded, pivotal, device trial. Lancet. 397 (10284), 1545-1553 (2021).
- Hacker, M. L., et al. Deep brain stimulation in early-stage Parkinson disease: Five-year outcomes. Neurology. 95 (4), e393-e401 (2020).
- Duun-Henriksen, J., et al. A new era in electroencephalographic monitoring? Subscalp devices for ultra-long-term recordings. Epilepsia. 61 (9), 1805-1817 (2020).
- Haneef, Z., et al. Sub-scalp electroencephalography: A next-generation technique to study human neurophysiology. Clinical Neurophysiology. 141, 77-87 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved