הדמיה של mtHyPer7, ביוסנסור רציומטרי למי חמצן מיטוכונדריאליים, בתאי שמרים חיים
In This Article
Summary
מי חמצן (H 2 O2) הםגם מקור לנזקי חמצון וגם מולקולת איתות. פרוטוקול זה מתאר כיצד למדוד H 2 O2מיטוכונדריאלי באמצעות HyPer7 ממוקד מיטוכונדריה (mtHyPer7), ביוסנסור יחסי מקודד גנטית, בשמרים חיים. הוא מפרט כיצד לייעל את תנאי ההדמיה ולבצע אנליזה כמותית תאית ותת-תאית באמצעות תוכנה זמינה באופן חופשי.
Abstract
תפקוד לקוי של המיטוכונדריה, או שינוי תפקודי, נמצא במחלות ומצבים רבים, כולל מחלות נוירודגנרטיביות והפרעות שרירים ושלד, סרטן והזדקנות נורמלית. כאן מתוארת גישה להערכת תפקוד מיטוכונדריאלי בתאי שמרים חיים ברזולוציות תאיות ותת-תאיות באמצעות ביו-חיישן יחסי, זעיר פולשני ומקודד גנטית. הביוסנסור, HyPer7 ממוקד מיטוכונדריה (mtHyPer7), מזהה מי חמצן (H 2 O2) במיטוכונדריה. הוא מורכב מרצף אותות מיטוכונדריאלי המאוחה לחלבון פלואורסצנטי בעל מוטציה מעגלית ותחום H 2 O2המגיב לחלבון OxyR חיידקי. הביוסנסור נוצר ומשולב בגנום השמרים באמצעות מערכת נטולת סמנים CRISPR-Cas9, לביטוי עקבי יותר בהשוואה למבנים הנישאים בפלסמיד.
mtHyPer7 ממוקד כמותית למיטוכונדריה, אין לו השפעה ניתנת לזיהוי על קצב גדילת שמרים או מורפולוגיה מיטוכונדריאלית, ומספק קריאה כמותית עבור H2O2 מיטוכונדריאלי בתנאי גדילה רגילים ועם חשיפה לעקה חמצונית. פרוטוקול זה מסביר כיצד לייעל את תנאי ההדמיה באמצעות מערכת מיקרוסקופ קונפוקלי בדיסק מסתובב ולבצע ניתוח כמותי באמצעות תוכנה זמינה באופן חופשי. כלים אלה מאפשרים לאסוף מידע מרחבי-זמני עשיר על מיטוכונדריה הן בתוך תאים והן בקרב תאים באוכלוסייה. יתר על כן, זרימת העבודה המתוארת כאן יכולה לשמש לאימות ביו-חיישנים אחרים.
Introduction
מיטוכונדריה הם אברונים תאיים אאוקריוטים חיוניים הידועים בתפקידם בייצור ATP באמצעות זרחן חמצוני והובלת אלקטרונים1. בנוסף, מיטוכונדריה הם אתרים לאחסון סידן, סינתזה של שומנים, חומצות אמינו, חומצות שומן וצברי ברזל-גופרית, והעברת אותות 2,3. בתוך התאים, מיטוכונדריה יוצרים רשת דינמית עם מורפולוגיה ופיזור אופייניים, המשתנה בהתאם לסוג התא ולמצב המטבולי. יתר על כן, למרות שהמיטוכונדריה יכולים להתמזג ולהתחלק, לא כל המיטוכונדריה בתא שקולים. מחקרים רבים תיעדו את ההטרוגניות התפקודית של מיטוכונדריה בתוך תאים בודדים בתכונות כגון פוטנציאל ממברנה ומצב חמצוני 4,5,6. שינוי זה בתפקוד המיטוכונדריה נובע בחלקו מנזק לאברון כתוצאה ממוטציות mtDNA (המתרחשות בקצב גבוה יותר מאשר בדנ"א גרעיני) ומנזק חמצוני על ידי מיני חמצן תגובתי (ROS) הנוצרים בתוך אברוני 7,8,9 ומחוצה להם. הנזק לאברון מופחת על ידי מנגנוני בקרת איכות מיטוכונדריאליים שמתקנים את הנזק או מסלקים מיטוכונדריה שניזוקו מעבר לתיקון10.
מי חמצן (H 2 O2) הואמין חמצן תגובתי המהווה מקור לנזק חמצוני לחלבונים תאיים, חומצות גרעין ושומנים. עם זאת, H2 O2 משמש גם כמולקולת איתות המווסתת את הפעילות התאית באמצעות חמצון הפיך של תיולים בחלבוני מטרה11,12. H2O2 מופק מאלקטרונים הדולפים משרשרת הובלת האלקטרונים במיטוכונדריה ומאנזימים ספציפיים, כגון NADPH oxidase ומונואמין אוקסידאז 13,14,15,16,17,18,19,20. הוא גם מנוטרל על ידי מערכות נוגדות חמצון, כולל אלה המבוססות על תיורדוקסין וגלוטתיון21,22,23. לכן, ניתוח של רמות H 2 O2במיטוכונדריה הוא קריטי להבנת תפקידו של מטבוליט זה בתפקוד תקין של המיטוכונדריה והתאים ובתנאים של עקה חמצונית.
המטרה הכוללת של פרוטוקול זה היא לזהות H 2 O 2 מיטוכונדריאלי באמצעות ביו-חיישן מקודד גנטית H 2 O2, HyPer7, הממוקד לאברון (mtHyPer7). mtHyPer7 היא כימרה המורכבת מרצף האותות המיטוכונדריאלי מ-ATP9 (רצף Su9), צורה מעגלית של חלבון פלואורסצנטי ירוק (GFP), ותחום הקישור H 2 O2של חלבון OxyR מ-Neisseria meningitidis24 (איור 1). ב-GFP בעל תמורות מעגליות, ה-N וה-C-termini של GFP המקורי מתמזגים וטרמיני חדש נוצר ליד הכרומופור, מה שמקנה ניידות רבה יותר לחלבון ויכולת גדולה יותר של המאפיינים הספקטרליים שלו בהשוואה ל-GFP25 המקורי. האינטראקציה של תחום OxyR של mtHyPer7 עם H 2 O 2 היא בעלת זיקה גבוהה, H 2 O 2-סלקטיבית,ומובילה לחמצון הפיך של שאריות ציסטאין שמורות והיווצרות גשר דיסולפיד. שינויים קונפורמטיביים הקשורים לחמצון של OxyR מועברים ל-GFP בעל תמורות מעגליות ב-mtHyPer7, מה שגורם לשינוי ספקטרלי במקסימום העירור של כרומופור mtHyPer7 מ-405 ננומטר במצב מופחת ל-488 ננומטר במצב H 2 O2-oxidized26. לפיכך, היחס בין פלואורסצנטיות מ mtHyPer7 בתגובה לעירור ב 488 ננומטר לעומת 405 ננומטר משקף את חמצון הבדיקה על ידי H 2 O2.
באופן אידיאלי, ביו-חיישן אמור לספק קריאה כמותית מוחלטת בזמן אמת של מולקולת המטרה שלו. למרבה הצער, עם זאת, זה לא תמיד אפשרי במדידות בעולם האמיתי. במקרה של חיישני חמצון, כגון mtHyPer7, הקריאה בזמן אמת מושפעת מקצב ההפחתה של הגשר הדיסולפיד. מערכות החיזור המשמשות חיישנים ביולוגיים של ROS שונות, ואלה יכולות לשנות באופן דרמטי את דינמיקת תגובת הגשושית - כפי שניתן לראות בהשוואה בין HyPer7, מופחת על ידי מערכת thioredoxin, ו- roGFP2-Tsa2ΔCR, מופחת על ידי גלוטתיון בשמרים cytosol27. לפיכך, כדי להסיק מסקנה לגבי ריכוז H 2O2 יחסי mtHyPer7, יש להניח כי מערכת ההפחתה שומרת על קיבולת קבועה במהלך הניסוי. למרות שיקולים אלה, HyPer7 וגשושיות קשורות שימשו בהקשרים שונים להשגת מידע על H 2 O2 בתאים חיים25,28,29.
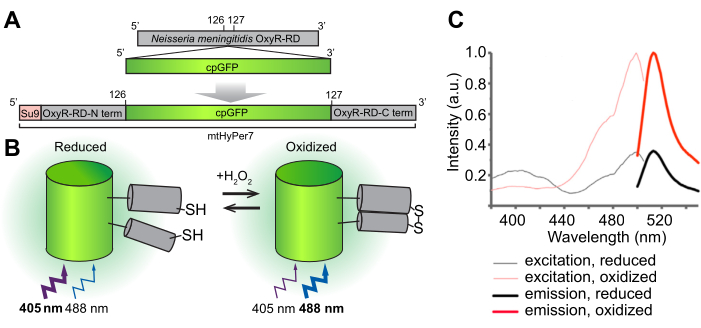
איור 1: תכנון, מנגנון מולקולרי וספקטרום עירור/פליטה של הביוסנסור H 2 O2 mtHyPer7. (A) הגשושית mtHyPer7 נגזרת על ידי החדרת GFP בעל תמורות מעגליות לתחום OxyR-RD מ-Neisseria meningitidis. הוא מכיל את רצף מיקוד המיטוכונדריה מתת-יחידה 9 של סינתאז ATP מ-Neurospora crassa (Su9). (B) איור של מנגנון החישה H 2 O2של mtHyPer7. חמצון של ציסטאין בתחום RD מגביר את הפליטה הפלואורסצנטית בעת עירור ב 488 ננומטר ומקטין את הפליטה הנוצרת על ידי עירור ב 405 ננומטר. (C) ספקטרום עירור ופליטה של HyPer7 בצורות מחומצנות ומופחתות. נתון זה הודפס מחדש באישור פאק ואחרים 24. קיצורים: GFP = חלבון פלואורסצנטי ירוק; cpGFP = GFP בעל תמורות מעגליות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
הדמיה יחסימטרית זו של mtHyPer7 מציעה יתרונות חשובים לכימות H 2 O22 מיטוכונדריה 24,27; הוא מספק בקרה פנימית על ריכוז הבדיקה. בנוסף, השינוי בשיא העירור שנוצר על ידי חשיפה H 2 O 2אינו שלם, אפילו בריכוזים רוויים של H 2 O 2. לפיכך, הדמיית יחס יכולה להגביר את הרגישות על ידי שילוב שתי נקודות ספקטרליות בניתוח.
לגשושית mtHyPer7 המשמשת כאן יש זיקה גבוהה מאוד ל- H 2 O2ורגישות נמוכה יחסית ל- pH24, והיא ממוקדת בהצלחה ל- Caenorhabditis elegans mitochondria30. חלבון זה שימש גם בשמרים27,31. עם זאת, מחקרים קודמים הסתמכו על ביטוי פלסמיד של mtHyPer7, אשר גורם לשונות בין תא לתא בביטוי בדיקה27. בנוסף, המבנה המתואר בפרוטוקול זה שולב באזור שמור ונטול גנים על כרומוזום X32 באמצעות גישה מבוססת קריספר לאינטגרציה ללא סמנים. הביטוי של הגן הביוסנסורי המשולב נשלט גם על-ידי מקדם TEF1 החזק (איור 2). כתוצאה מכך, יש ביטוי יציב ועקבי יותר של הביו-סנסור באוכלוסיות תאי שמרים בהשוואה לזה שנצפה באמצעות ביטוי ביו-סנסור הנישא בפלסמיד, וניתן להפיץ תאים הנושאים את הביו-סנסור ללא צורך במדיה סלקטיבית.
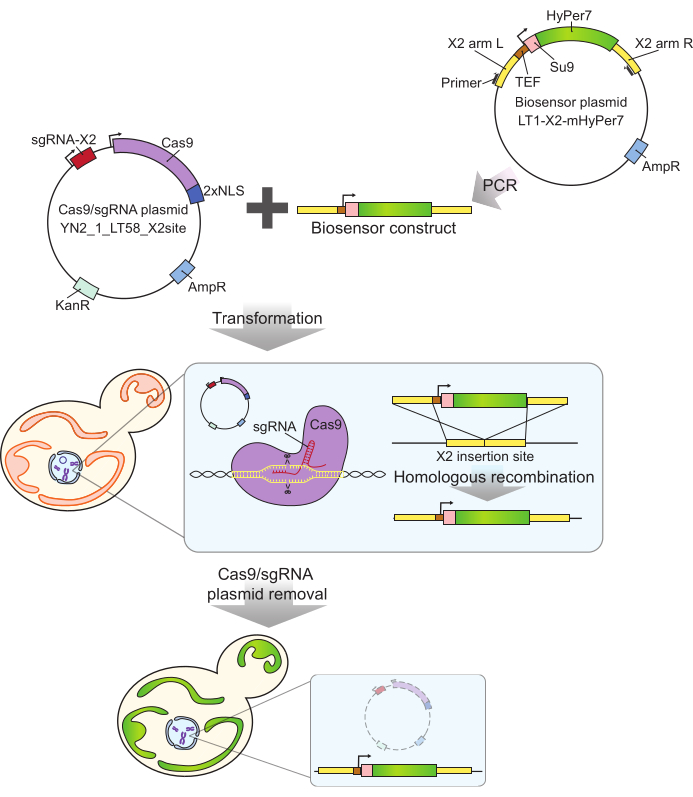
איור 2: יצירת תאים המבטאים mtHyPer7 על-ידי קריספר. הפלסמיד המכיל Cas9 ו- sgRNA (YN2_1_LT58_X2site) ומבנה הביוסנסור המכיל mtHyPer7 המוגבר ב- PCR מוכנסים לתאי שמרים ניצנים על ידי טרנספורמציית ליתיום אצטט. אתר ההחדרה נטול הגנים לכרומוזום X (X2) מזוהה ונחתך על ידי חלבון Cas9 עם sgRNA, והביוסנסור משולב בגנום על ידי רקומבינציה הומולוגית. לאחר זיהוי הטרנספורמטים המוצלחים על ידי סינון מיקרוסקופי, PCR מושבה וריצוף, פלסמיד Cas9 מוסר (נרפא) על ידי גידול במדיה לא סלקטיבית. קיצורים: sgRNA = RNA מדריך יחיד; TEF = גורם משפר תמלול. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
לבסוף, mtHyPer7 מציע יתרונות על פני biosensors אחרים ROS. לדוגמה, צבעים אורגניים המשמשים לזיהוי ROS (למשל, דיהידרואתידיום [DHE]2 ו- MitoSOX3) יכולים לייצר צביעה לא אחידה או לא ספציפית ולעתים קרובות מועברים בממסים כגון אתנול או דימתיל סולפוקסיד, הדורשים בקרות נוספות להשפעות ממס. סוג נוסף של ביו-חיישנים מסוג ROS הם ביו-חיישנים מבוססי העברת אנרגיה בתהודה פלואורסצנטית (FRET) (לדוגמה, Redoxfluor עבור מצב חמצון-חיזור תאי4, וחיישני מי חמצן HSP-FRET5, OxyFRET 6 ו-PerFRET6). בדיקות אלה מקודדות גנטית ורגישות מאוד באופן עקרוני וניתן לכוון אותן כמותית למיטוכונדריה באמצעות רצפי אותות מיטוכונדריאליים מאופיינים היטב. עם זאת, ישנם אתגרים בשימוש בבדיקות מבוססות FRET, כולל רקע עקב עירור צולב ודימום, ודרישות מחמירות לקרבה וכיוון של פלואורופורים עבור FRET להתרחש33,34. בנוסף, גשושיות FRET מורכבות משני חלבונים פלואורסצנטיים הדורשים מבנים גדולים יותר לביטוי בתאים בעלי עניין בהשוואה לגשושיות המזיזות ספקטרה. הפרוטוקול המתואר כאן פותח כדי לנצל את נקודות החוזק של הביו-חיישן מבוסס HyPer7, ולהשתמש בבדיקה קומפקטית, רציומטרית, בעלת זיקה גבוהה ומקודדת גנטית זו לצורך הדמיה כמותית של מי חמצן במיטוכונדריה בשמרים חיים.
Protocol
1. יצירת פלסמיד ביוסנסור, השתלבות בגנום השמרים והערכת המיקוד של mtHyPer7 למיטוכונדריה והשפעות על מורפולוגיה מיטוכונדריאלית, קצב גדילת תאים או רגישות לעקה חמצונית
הערה: עיין בקובץ משלים 1 , טבלה משלימה S1, טבלה משלימה S2 וטבלה משלימה S3 עבור בניית פלסמיד ביוסנסוריישן, זנים, פלסמידים ופריימרים, בהתאמה, המשמשים לבנייה ואפיון של ביוסנסורים. עיין בטבלת החומרים לקבלת פרטים הקשורים לכל החומרים, הריאגנטים והמכשירים המשמשים בפרוטוקול זה.
- הגבירו את מבנה הביו-סנסור מפלסמיד הביו-סנסור באמצעות הפריימרים Y290 ו-Y291 (איור 2) באמצעות תגובת שרשרת פולימראז (PCR).
- ערבבו 500 ננוגרם של פלסמיד הרנ"א Cas9/guide (YN2_1_LT58_X2site32) עם 50 מיקרוליטר של מוצר ה-PCR משלב 1.1 (מבנה הביו-חיישנים). הפכו את התערובת לשמרים ניצנים בשיטת ליתיום אצטט35 ובחרו שנאים על לוחות YPD המכילים 200 מ"ג/מ"ל G418.
- סינון טרנספורמטורים מועמדים על ידי הגברת PCR של DNA גנומי באמצעות פריימרים Y292 ו Y293. עבור טרנספורמטורים הנושאים תוספת בגודל הצפוי (חיובי: 3.5 kb; שלילי: 0.3 kb), רצף את האזור שנוסף לצורך אימות נוסף.
- העריכו את ההשפעה של החיישן הביולוגי על גדילה ותפקוד מיטוכונדריה (איור 3). אם נראה שהחיישן הביולוגי משפיע על תפקוד התאים או המיטוכונדריה, נסו למזער את ההשפעה על ידי שינוי המקדם, אתר האינטגרציה או זן האב.
- לקבוע את ההשפעה של מבנה biosensor על קצב הצמיחה בנוכחות והיעדר עקה חמצונית (למשל, paraquat), כפי שתואר קודם36.
- יש לדלל תאים בפאזה של אמצע לוג לצפיפות אופטית של 600 ננומטר (OD 600) של 0.0035 אינץ'ב-200 מיקרוליטר של מדיה מתאימה, עם וללא טיפול בכל באר של צלחת בעלת תחתית שטוחה של 96 בארות. מדוד את הצפיפות האופטית של התרבית כל 20 דקות במשך 72 שעות באמצעות קורא לוחות. חשב את קצב הצמיחה המרבי (שיפוע) כשינוי המרבי ב- OD על פני מרווח של 240 דקות במהלך הקורס של 72 שעות.
- דמיינו את התאים במיקרוסקופ פלואורסצנטי והעריכו את הבהירות ואת המורפולוגיה המיטוכונדריאלית כפי שתואר קודם לכן37.
- הגדילו את התאים לשלב אמצע הלוג, צבעו את המיטוכונדריה באדום MitoTracker 250 ננומטר למשך 30 דקות, ושטפו פעמיים לפני ההדמיה. צלם ערימות Z בעומק 6 מיקרומטר במרווחים של 0.3 מיקרומטר במיקרוסקופ פלואורסצנטי רחב שדה או קונפוקלי ובדוק חזותית. חפשו מיטוכונדריה היוצרים מבנים צינוריים מוארכים.
- לקבוע את ההשפעה של מבנה biosensor על קצב הצמיחה בנוכחות והיעדר עקה חמצונית (למשל, paraquat), כפי שתואר קודם36.
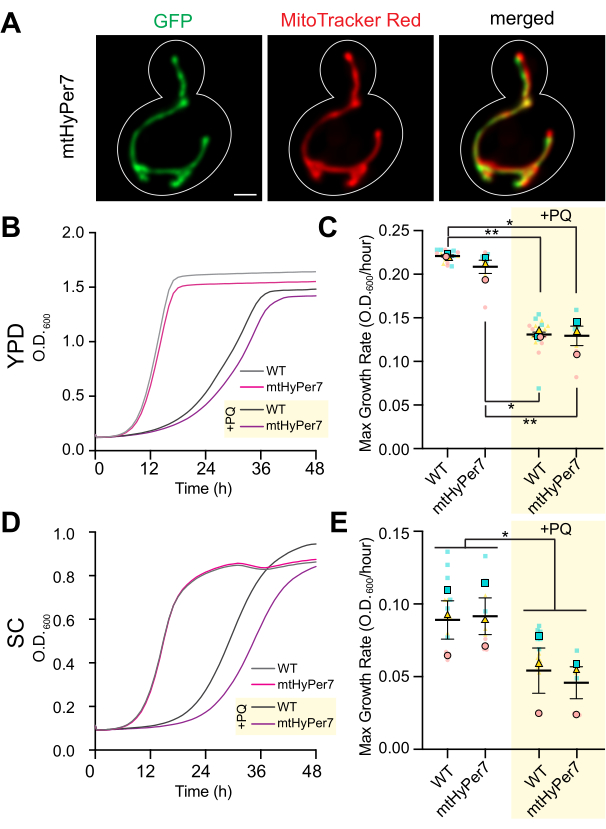
איור 3: mtHyPer7 מיועד למיטוכונדריה ואינו משפיע על המורפולוגיה של המיטוכונדריה, גדילת תאים או רגישות לעקה חמצונית. (A) מורפולוגיה מיטוכונדריאלית בתאי שמרים חיים המבטאים mtHyPer7. פאנל שמאלי: mtHyPer7 דמיינו עם עירור 488 ננומטר. פאנל אמצעי: מיטוכונדריה מסומנים באדום MitoTracker 250 ננומטר. פאנל ימני: תמונות ממוזגות. מוצגות הקרנות בעוצמה מרבית. מיתאר התא מוצג בלבן. סרגל קנה מידה = 1 מיקרומטר. (B,C) עקומות גדילה וקצב גדילה מרבי של תאים מסוג בר ותאים המבטאים mtHyPer7 הגדלים בנוכחות (+PQ) או היעדר פרקוואט של 2.5 מילימטר במדיה YPD. (ד,ה) עקומות גדילה וקצב גדילה מרבי של תאים המבטאים פרא ו- mtHyPer7 הגדלים בנוכחות (+PQ) או היעדר פרקוואט 2.5 mM במדיה SC. כל עקומות הצמיחה הן אמצעי לשלושה שכפולים בלתי תלויים. שיעורי הצמיחה המרביים מיוצגים כממוצע ± שגיאת תקן של הממוצע (SEM). ניתוח עקומת הצמיחה נעשה על ידי דילול תאי שלב אמצע לוג ל- OD 600 של 0.0035 ב-200 μL של מדיה מתאימה לכל באר של צלחת שטוחה בעלת 96 בארות. OD של התרבות נמדד כל 20 דקות במשך 72 שעות באמצעות קורא לוחות. כל זן/מצב היה מצופה בשלשה וקצב הגידול הממוצע שורטט. קצב הצמיחה המרבי (שיפוע) חושב באמצעות השינויים ב- OD על פני מרווח של 240 דקות במהלך 72 שעות. קיצורים: WT = סוג פראי; PQ = פרקוואט. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
2. תרבית תאים והכנה לדימות (איור 4)
- להפיץ את התאים בתווך סינתטי לשלב אמצע לוג להדמיה. תרבית שלב אמצע יומן של 5 מ"ל מספקת מספיק תאים לארבע או חמש שקופיות ובסך הכל >100 תאים ניצנים לניתוח.
- בבוקר יום לפני הניסוי, הכינו תרביות נוזליות על ידי חיסון 5 מ"ל של תווך סינתטי שלם (SC) בצינור חרוטי-תחתון של 50 מ"ל עם מושבה אחת של תאי שמרים.
- לדגור את preculture בשייקר מסלול ב 200 סל"ד ו 30 ° C במשך 6-8 שעות. מדוד את OD 600 של preculture, אשר צריך להיות בשלב באמצע לוג: ~ 0.5-1 × 107 תאים / מ"ל, OD600 ~ 0.1-0.3.
- הכינו תרבית שלב אמצע יומן באמצעות הקדם-תרבות להדמיה למחרת. חשב את כמות הקדם-תרבות הדרושה לתרבית בשלב הביניים לאחר צמיחה בין לילה (8-16 שעות). כאשר התאים גדלים בתווך SC, זמן ההכפלה הוא ~ 2 שעות. לכן, נפח (V) של קדם-תרבות לחיסון תרבית לילה של 5 מ"ל מחושב באמצעות משוואה (1):
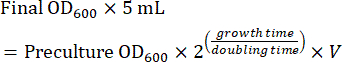 (1)
(1) - חסן 5 מ"ל של מדיום SC בצינור חרוטי-תחתון של 50 מ"ל עם כמות הפרה-תרבות המחושבת בשלב 2.1.3. לגדול בשייקר מסלול ב 200 סל"ד ו 30 ° C במשך 8-16 שעות.
- ביום ההדמיה, אשר כי התרבית שנוצרה בשלב 2.1.4 נמצאת בשלב אמצע היומן (OD600 ~ 0.1-0.3). רכז את התאים מ 1 מ"ל של תרבית שלב אמצע לוג על ידי צנטריפוגה ב 6,000 × גרם במשך 30 שניות. הסר את supernatant, משאיר 10-20 μL של supernatant בצינור. השהה מחדש את גלולת התא על ידי ערבוב עדין עם מדיה שיורית באמצעות מיקרופיפטה.
- השתמש במפוח אוויר או ברקמה נטולת סיבים כדי להסיר אבק משקופית זכוכית והוסף 1.8 μL של מתלה התא למגלשה. כסו את התאים עם #1.5 (170 מיקרומטר עובי) זכוכית כיסוי, הורידו את הכיסוי לאט בזווית כדי למנוע החדרת בועות.
- תמונה מיד ומחק את השקופית לאחר 10 דקות של הדמיה.
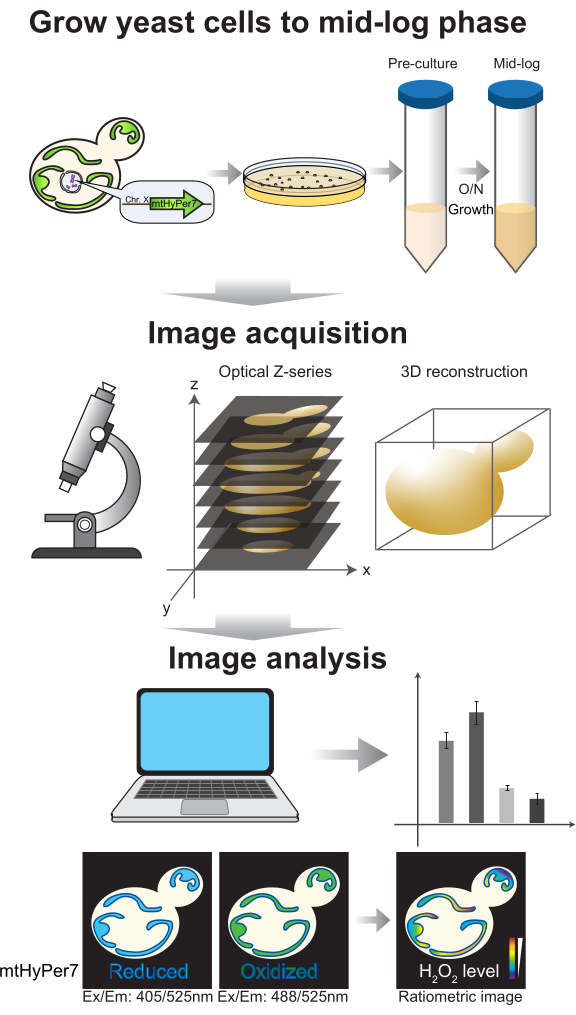
איור 4: גדילת תאים והדמיה. תאי שמרים ניצנים המבטאים mtHyPer7 גדלים לשלב אמצע הלוג. תמונות מסדרת Z נאספות על ידי מיקרוסקופ קונפוקלי בדיסק מסתובב ולאחר מכן עוברות שחזור וניתוח תלת-ממדיים. ראו פרוטוקול סעיפים 2-3. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
3. אופטימיזציה של תנאי הדמיה ואיסוף תמונות (איור 5)
- בחרו מצב הדמיה. עבור חתך אופטי ללא עיבוד לאחר מכן, מכשיר קונפוקלי דיסק מסתובב עדיף. עם זאת, אם האות נמוך, או שמכשיר זה אינו זמין, השתמש בהדמיה של שדה רחב, כדי לוודא שהתמונות בעלות השדה הרחב אינן מפותלות כדי להסיר טשטוש מחוץ למיקוד, כפי שתואר קודם לכן38.
- בחר אופטיקה. השתמש בעדשת טבילת שמן בעלת מפתח מספרי גבוה, כגון 100x/1.45 Plan-Apochromat.
- בחר אורכי גל עירור ופליטה. עבור הדמיה קונפוקלית של דיסק מסתובב, השתמש בעירור לייזר ב- 405 ננומטר ו- 488 ננומטר ובמסנן פליטת GFP סטנדרטי. להדמיית שדה רחב, השתמש בדיודה פולטת אור (LED) או בעירור מנורה, אך ודא שהגדרת המסנן מאפשרת וריאציה של העירור תוך העברת הפליטה דרך מסנן GFP הסטנדרטי.
הערה: ניתן לבצע זאת, לדוגמה, על-ידי הסרת מסנן העירור מקוביית GFP ושימוש בגלגל LED או מסנן כדי לבחור את העירור. - בחר זמן חשיפה ועוצמת תאורה.
- קבע תנאי רכישה המניבים אות הניתן לזיהוי בקלות ורזולוציה מקובלת בכל ערוץ פלואורסצנטי. לדוגמה, במיקרוסקופ קונפוקלי של דיסק מסתובב עם מצלמת sCMOS, השתמש ב- 2 x 2 binning, עוצמת לייזר של 20-40% וחשיפה של 200-600 ms.
- בדוק את ההיסטוגרמה של התמונה. בתמונה של 12 סיביות (4,096 רמות אפור אפשריות), ודאו שהטווח הדינמי הכולל של ערכי הפיקסלים הוא לפחות כמה מאות רמות אפור, ללא רוויה (איור 5A). בנוסף, יש לוודא שהטווח גבוה בסדר גודל אחד מרמת הרעש. חשב את רמת הרעש כסטיית התקן של ערכי פיקסלים באזור ללא תאים בתמונה, הנמדדת כמתואר בשלב 4.1.3.1.
- בדיקה של הלבנה או לחץ מיטוכונדריאלי הנגרם על ידי הדמיה בתנאי ההדמיה שנבחרו. אם נצפתה הלבנה מוגזמת או עלייה במיטוכונדריה H 2 O2, הפחיתו את עוצמת הלייזר והגדילו את החשיפה או הקשירה.
- אסוף סדרה של תמונות בהילוך מהיר, ללא עיכוב בין רכישות, כדי להעריך את ההשפעות של תנאי ההדמיה על יציבות האות ועקה חמצונית במיטוכונדריה. באמצעות תוכנת רכישת המיקרוסקופ או ImageJ, מדדו את ערך הפיקסלים הממוצע בכל ערוץ פלואורסצנטי כדי לאשר את יציבות האות (שינוי של <5%; איור 5B). אם הניסוי אינו כולל הדמיה בהילוך מהיר, יש לוודא שהפלואורסצנטיות יציבה על פני שתיים או שלוש ערימות Z חוזרות (25-35 חשיפות).
הערה: ירידה בפלואורסצנטיות של שני הערוצים עשויה להצביע על הלבנה; עם זאת, ירידה בפלואורסצנטיות המעוררת 405 ננומטר המלווה בעלייה בתעלה המעוררת 488 ננומטר עשויה להצביע על עלייה במיטוכונדריה H2 O2 ועקה חמצונית הנגרמת על ידי הדמיה באברון.
- אסוף סדרה של תמונות בהילוך מהיר, ללא עיכוב בין רכישות, כדי להעריך את ההשפעות של תנאי ההדמיה על יציבות האות ועקה חמצונית במיטוכונדריה. באמצעות תוכנת רכישת המיקרוסקופ או ImageJ, מדדו את ערך הפיקסלים הממוצע בכל ערוץ פלואורסצנטי כדי לאשר את יציבות האות (שינוי של <5%; איור 5B). אם הניסוי אינו כולל הדמיה בהילוך מהיר, יש לוודא שהפלואורסצנטיות יציבה על פני שתיים או שלוש ערימות Z חוזרות (25-35 חשיפות).
- רכוש תמונות. בשעת איסוף אוספי Z, ודא שמרווח הזמן Z זהה לכל התמונות בערכת הנתונים, וכלול את התא כולו. עבור שמרים ניצנים, תמונה עם מרווח Z של 0.5 מיקרומטר ועומק ערימה כולל של 6 מיקרומטר. רכשו תמונות באור משודר כדי לתעד את גבולות התא.
- נתח תמונות באופן ידני או אוטומטי למחצה באמצעות הסקריפטים הזמינים בקובץ משלים 2 ובקובץ https://github.com/theresaswayne/biosensor, באמצעות התפלגות פיג'י של ImageJ39 והתוכנה הסטטיסטית R (איור 6). בהוראות התוכנה, פקודות תפריט היררכיות מוצגות בהדגשה עם "|", המציין רצף של בחירות בתפריט. האפשרויות והלחצנים מוצגים בגופן מודגש.
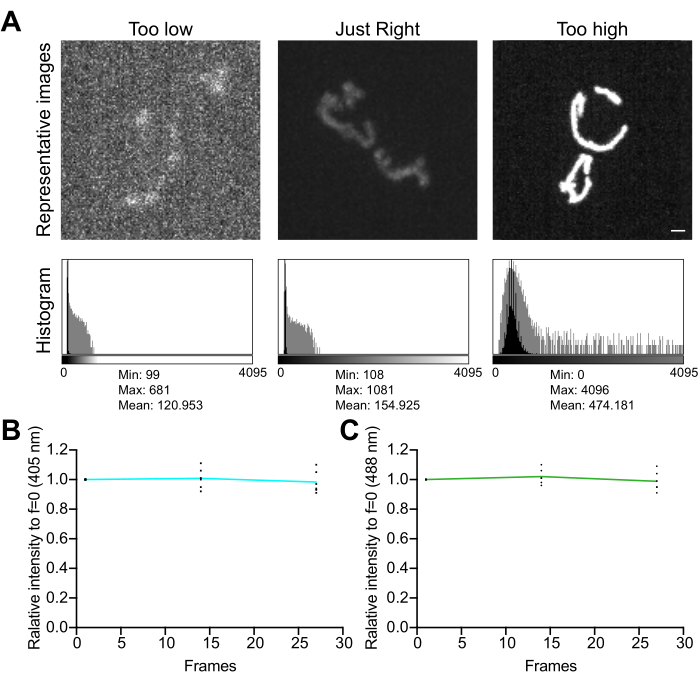
איור 5: אופטימיזציה של הדמיה . (A) הערכה של תמונות והיסטוגרמות עבור טווח העוצמה הנכון. מוצגות הקרנות בעוצמה מרבית של תמונות קונפוקליות בדיסק מסתובב. ההיסטוגרמות מוצגות עם ציר Y ליניארי (שחור) וציר Y בקנה מידה של יומן (אפור) כדי להמחיש את הטווח הדינמי של התמונה. חלוניות שמאליות: תמונה רועשת עם עוצמה נמוכה וטווח דינמי נמוך. חלוניות מרכז: תמונה עם טווח דינמי מקובל (~1,000 רמות אפור) ועוצמה. לוחות ימניים: תמונה עם ניגודיות שאינה משופרת כראוי כדי ליצור רוויה מוגזמת. סרגל קנה מידה = 1 מיקרומטר. (B,C) ניתוח של photobleaching של mtHyPer7. ערימות Z עוקבות נאספו ללא דיחוי, ערימות Z סוכמו, והעוצמה הממוצעת של המיטוכונדריה נמדדה ונורמלה לנקודת הזמן הראשונה. מוצגות תוצאות משלוש נקודות הזמן הראשונות (27 חשיפות). (B) אורך גל עירור: 405 ננומטר. (C) אורך גל עירור: 488 ננומטר. הערכים המוצגים הם ממוצעים של שלושה תאים מכל אחד משלושה ניסויים בלתי תלויים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
4. ניתוח חצי אוטומטי עם סקריפטים
- צור ומדוד תמונות ביחס באמצעות סקריפט ניתוח biosensor (לדוגמה, biosensor.ijm או biosensor-image-subtraction.ijm).
- בחר את הסקריפט שבו ברצונך להשתמש. פרוטוקול השימוש בכל סקריפט דומה; כל ההבדלים יצוינו בטקסט.
- biosensor.ijm: בסקריפט זה, הרקע והרעש מתוקנים באמצעות אזורי תמונה שנבחרו על-ידי המשתמש, ערכים קבועים או ללא חיסור. בחר שיטות לתיקון רקע ורעש באופן עצמאי.
- biosensor-image-subtraction.ijm: בסקריפט זה, הרקע והרעש מטופלים שניהם באותה שיטה שנבחרה על-ידי המשתמש, שעשויה להיות אחת מהפעולות הבאות: תמונה ריקה, אזור שנבחר על-ידי המשתמש בתוך התמונה, ערך קבוע או ללא תיקון.
- בפיג'י, פתח תמונת מחסנית Z רב-ערוצית שנרכשה בשלב 3.5. פתח את קובץ הסקריפט הרצוי לניתוח biosensor. הפעל את קובץ ה- Script על-ידי לחיצה על הפעל בחלון עורך התסריטים . בחלון הדו-שיח שמופיע, הזן את המידע המבוקש.
- בחר את מספרי הערוצים של המונה והמכנה לחישוב יחס. עבור mtHyPer7, המונה הוא הערוץ הנרגש ב- 488 ננומטר, והמכנה הוא הערוץ הנרגש ב- 405 ננומטר. בחרו במספר הערוצים של התמונה המשודרת, אם קיימת, או 0 אם אין.
- בחר את שיטת חיסור הרקע הרצויה מבין ארבע האפשרויות הבאות. אם הרקע אחיד יחסית, בחרו ' בחר אזור בתמונה', המודד ישירות את רמת הרקע בתמונה. אם הרקע משתנה באופן משמעותי לאורך השדה, השתמש בסקריפט biosensor-image-subtraction.ijm ובחר תמונה ריקה (כדי לאסוף תמונה ריקה לתיקון, לכוד ערימת Z רב-ערוצית עם תנאי רכישה זהים בשדה ראייה ללא תאים, או משקופית שנוצרה עם מדיום גידול ללא תאים). ערך קבוע מאפשר הזנה של ערך רקע שנמדד בעבר. אף אחד מהם אינו משאיר את הרקע לא מתוקן, אך עלול להפחית את דיוק המדידה.
- בחר את שיטת חיסור הרעש הרצויה. ערך הרעש משמש כסף נמוך יותר בתמונות הערוץ עם מסיכת הרקע שהופחתו, כדי להפחית את ההשפעה של שונות אקראית בקריאת הגלאי. בחרו באפשרות ' בחר אזור בתמונה ' או 'ערך קבוע ' כדי לאפשר הזנה של רמת רעש שנמדדה קודם לכן, פעולה שבדרך כלל פועלת היטב מכיוון שרמות הרעש קבועות אם תנאי ההדמיה נשמרים קבועים. לחלופין, בחרו ' ללא' והשתמשו בערך של 1 בתור הסף התחתון, מה שעשוי להגדיל את השונות של המדידות.
- בחר אלגוריתם סף כדי לזהות מיטוכונדריה באופן מדויק ועקבי; Otsu או MaxEntropy מומלצים. באופן אידיאלי, השתמש באותו אלגוריתם עבור כל התמונות בניסוי, אך ודא זיהוי מדויק של מיטוכונדריה. השתמש בשיטת סף אחרת אם יש שינויים במורפולוגיה במהלך ניסוי.
- בחר את מספר אזורי העניין (ROI) לכל תא. לדוגמה, אם מודדים הבדלים בין ניצני אם, בחר 2.
- בחר בתיקיית הפלט שבה יישמרו מדידות ותמונות יחס.
- פעל בהתאם להנחיות לתיקון רקע ורעשים.
- בחירת אזור (אם רלוונטי): אם נבחר אזור בתמונה למדידת רקע או רעש, פעל בהתאם להנחיות כדי לצייר אזור רקע (מחוץ לתאים או לכלוכים פלואורסצנטיים) באמצעות הכלי החזר השקעה על מלבן. לאחר ציור האזור, לחץ על אישור.
- הזנת ערך קבוע (אם רלוונטי): אם נבחר ערך קבוע למדידת רקע או רעש, פעל בהתאם להנחיות כדי להזין ערכי רקע ו/או רעש לכל ערוץ פלואורסצנטי.
- תמונת הפניה ריקה (אם רלוונטי): בסקריפט biosensor-image-subtraction.ijm, אם נבחרה תמונה ריקה לתיקון רקע או רעש, פעל בהתאם להנחיות לבחירת קובץ תמונה ריק.
- סמן החזר השקעה למדידה. בתרביות שלב אמצע לוג, להגביל את הניתוח לתאים ניצנים.
- צייר ROI המתאימים לתאים בודדים או לאזורים תת-תאיים בהתבסס על תמונת השדה הבהיר. החזר ההשקעה אינו חייב להתאים בדיוק לקווי המתאר של התא, מכיוון שרק מיטוכונדריה סף בתוך החזר ההשקעה יימדדו. לחלופין, פתח ערכת ROI שנשמרה בעבר: במנהל החזר ההשקעה, לחץ על עוד ולאחר מכן בחר את קובץ החזר ההשקעה.
- הקש T לאחר יצירת כל החזר השקעה כדי להוסיף את החזר ההשקעה שנבחר למנהל החזר ההשקעה. במנהל החזר ההשקעה, סמן את הצג הכל כדי לתעד את התאים שסומנו. כל אזור נוסף יופיע כפריט ממוספר ברשימה של מנהל החזר ההשקעה. אם אתה מנתח יותר מהחזר השקעה אחד לכל תא (למשל, אם וניצן), סמן את החזר ההשקעה באותו סדר עבור כל תא שנותח.
- לאחר שכל החזר ההשקעה הרצוי נוסף למנהל החזר ההשקעה, לחץ על אישור בחלון הדו-שיח סימון תאים .
- בחר את תבנית טבלת המדידות. בחלון הדו-שיח MultiMeasure שמופיע, סמן את האפשרות Measure all slices. סמן את האפשרות שורה אחת לכל פרוסה כדי להפיק טבלה בתבנית הרצויה. השתמש process_multiROI_tables. סקריפט R לעיבוד טבלאות שנוצרו באמצעות האפשרות 'שורה אחת לכל פרוסה '; אל תסמן את צרף תוצאות. חזור על שלב זה 3x (למדידת תמונות המונה [488], המכנה [405] והיחס [488/405]).
- הסקריפט ישמור את קבצי הפלט בתיקיה שנבחרה בשלב 4.1.2.6.
- בחר את הסקריפט שבו ברצונך להשתמש. פרוטוקול השימוש בכל סקריפט דומה; כל ההבדלים יצוינו בטקסט.
- חישוב יחסים ממוצעים משוקללים עבור כל אזור או תא
- באמצעות התוצאות שהתקבלו בשלב הקודם, חשב את יחסי הממוצע המשוקלל עבור כל אזור או תא באמצעות משוואה (2). חשב יחסים "פיקסלים" או "אזוריים" (ראה פרטים בדיון).
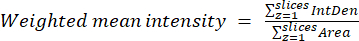 (2)
(2)
הערה: ערכי השטח והצפיפות המשולבת (IntDen) כוללים רק את הפיקסלים בתוך המיטוכונדריה הסף. חישוב זה יכול להיות אוטומטי באמצעות process_multiROI_tables. R סקריפט ו R תוכנה סטטיסטית.
- באמצעות התוצאות שהתקבלו בשלב הקודם, חשב את יחסי הממוצע המשוקלל עבור כל אזור או תא באמצעות משוואה (2). חשב יחסים "פיקסלים" או "אזוריים" (ראה פרטים בדיון).
- צור תמונה ביחס צבעוני. מכיוון ששינויים בגוון (צבע) ברורים יותר לעין האנושית מאשר שינויים בעוצמה, המירו את ערך היחס לסולם צבעים לפרשנות חזותית קלה יותר. קובץ ה- Script colorize_ratio_image.ijm יצבע תמונה ביחס מסיכה.
- בפיג'י, פתחו תמונת אוסף Z ביחס שנוצר בשלב 4.1.6. פתח את קובץ ה-script colorize_ratio_image.ijm. הפעל את קובץ ה- Script על-ידי לחיצה על הפעל בחלון עורך התסריטים . בחלון הדו-שיח שמופיע, הזן את המידע המבוקש.
- שיטת צביעה: באפשרות 'ללא אפנון ', כל הפיקסלים במיטוכונדריה מופיעים באותה בהירות. עם זאת, תמונות מסוימות עשויות להיראות רועשות מכיוון שגם פיקסלים עמומים וגם פיקסלים בהירים תורמים לתמונת היחס. כדי להפחית אפקט זה, השתמש באפשרות אפנון עוצמה .
- ערך מינימלי ומרבי מוצג: ערכים אלה שולטים בטווח ערכי היחס שייצבעו. בחר ערכים הקרובים לערכי המינימום והמקסימום הממוצעים שנצפו בניסוי (בהתבסס על יחסי הממוצע המשוקלל שחושבו בשלב 4.2.1). במהלך ניסוי, הקפד לקבל את כל התמונות עם תנאי הדמיה זהים ולהציג את כל התמונות עם ערכי מינימום ומקסימום זהים.
- מצב הקרנה: ערימות Z מוצגות כהקרנות כדי להציג את כל אוכלוסיית המיטוכונדריה. ההקרנה נוצרת לפני הצביעה. בחרו ' מקס ' להקרנה בעוצמה מרבית (תוך שמירה על היחס המרבי וערכי העוצמה) או ' ממוצע' להקרנה בעוצמה ממוצעת.
- תיקיית פלט: בחר את התיקיה שבה ברצונך לשמור את התמונות הצבעוניות.
- אם האפשרות 'ללא אפנון' נבחרה, בחרו ערכת צבעים (טבלת בדיקת מידע; LUT) בחלון הדו-שיח שמופיע. השתמש ב - Fire או Rainbow RGB LUT המובנה בפיג'י, או בכל LUT רצוי בפורמט .lut של ImageJ (ייבוא מקובץ LUT). מומלץ להשתמש ב- Rainbow Smooth40 LUT (כלול בקובץ משלים 2 וב- GitHub).
- הסקריפט שומר את קבצי הפלט בתיקייה שנבחרה בשלב 4.3.1.4. אלה כוללים את תמונת היחס הצבעוני (Color_RGB.tif) ואת תמונת היחס הצבעוני עם סרגל כיול המציג את ההתאמה בין ערכי היחס לצבע התמונה (Color_with_bar.tif).
- בפיג'י, פתחו תמונת אוסף Z ביחס שנוצר בשלב 4.1.6. פתח את קובץ ה-script colorize_ratio_image.ijm. הפעל את קובץ ה- Script על-ידי לחיצה על הפעל בחלון עורך התסריטים . בחלון הדו-שיח שמופיע, הזן את המידע המבוקש.
5. ניתוח ידני
הערה: גישה זו אורכת זמן רב יותר, אך מאפשרת גמישות בעיבוד מקדים ובקביעת הסף.
- נכון לרקע.
- הגדר אפשרויות בפיג'י.
- לחץ על נתח | הגדר מידות. בחלון הדו-שיח שמופיע, סמן את התיבות עבור Area, Mean, StdDev, IntDen ו - Display Label. הגדר את המקומות העשרוניים ל- 3.
- לחץ על עריכה | אפשרויות | קלט/פלט. בחלון הדו-שיח שמופיע, סמן את התיבות עבור שמור מספרי שורות ושמור כותרות עמודות.
- כדי להגדיל את הרגישות של חישוב היחס, החסר את הרקע מכל ערוץ פלואורסצנטי. אם הרקע אחיד יחסית, מדדו את העוצמה הממוצעת של אזור נטול תאים בתמונה, והפחיתו ערך זה מהתמונה כולה (שלב 5.1.2.1). לחלופין, אם הרקע משתנה באופן משמעותי לאורך השדה, השתמש בתמונה ריקה לתיקון (שלב 5.1.2.2).
- כדי להחסיר אזור שנבחר על-ידי המשתמש, לחץ על תמונה | צבע | פצל ערוצים, והשאר את כל תמונות הערוץ פתוחות, מכיוון שיהיה צורך בהן מאוחר יותר. עבור כל ערוץ פלואורסצנטי, צייר החזר השקעה על הרקע (מחוץ לתאים) ולחץ על נתח | מדידה, או עבור ערימות, לחץ על תמונה | ערימות | מחסנית מדידה. שים לב לערך הממוצע של החזר ההשקעה המופיע בטבלת התוצאות . לחץ על עריכה | בחר ללא, ולאחר מכן עבד | מתמטיקה | חיסור. בחלון הדו-שיח שמופיע, הזן את ערך הרקע הממוצע הנמדד, המעוגל למספר השלם הקרוב ביותר.
הערה: עיגול מונע שגיאות בפעולות בינאריות מאוחר יותר. - כדי להחסיר תמונה ריקה מקובץ נתונים, אסוף תמונה ריקה משדה ראייה נטול תאים לחלוטין או משקופית שהוכנה עם מדיום גידול ללא תאים. לחץ על תהליך | מחשבון תמונות. בחלון הדו-שיח שמופיע, הגדר את הפעולה לחסר והגדר את Image1 ו- Image2 לתמונת התא ולתמונה הריקה, בהתאמה. סמן את צור חלון חדש ותוצאת 32 סיביות.
- כדי להחסיר אזור שנבחר על-ידי המשתמש, לחץ על תמונה | צבע | פצל ערוצים, והשאר את כל תמונות הערוץ פתוחות, מכיוון שיהיה צורך בהן מאוחר יותר. עבור כל ערוץ פלואורסצנטי, צייר החזר השקעה על הרקע (מחוץ לתאים) ולחץ על נתח | מדידה, או עבור ערימות, לחץ על תמונה | ערימות | מחסנית מדידה. שים לב לערך הממוצע של החזר ההשקעה המופיע בטבלת התוצאות . לחץ על עריכה | בחר ללא, ולאחר מכן עבד | מתמטיקה | חיסור. בחלון הדו-שיח שמופיע, הזן את ערך הרקע הממוצע הנמדד, המעוגל למספר השלם הקרוב ביותר.
- הגדר אפשרויות בפיג'י.
- כדי להגביל את הניתוח למיטוכונדריה, בצע סגמנטציה. מאחר שכל ערוץ עשוי לשנות את עוצמתו בהתאם למצב החיישן הביולוגי, השתמשו בסכום של שני הערוצים כדי להגדיר את אזור המיטוכונדריה באופן עקבי.
- ליצירת תמונת סכום, לחץ על תהליך | מחשבון תמונות. בחלון הדו-שיח שמופיע, הגדר את הפעולה להוספה והגדר את Image1 ו- Image2 לשני ערוצי הפלורסנט שהוחסרו ברקע בסדר כלשהו. סמן את האפשרות צור חלון חדש ותוצאת 32 סיביות והמתן להופעת תמונת סכום.
- הגדר את הסף להגדרת מיטוכונדריה בסכום התמונה.
- לחץ על תמונה | התאמה | סף. בחלון סף שמופיע, סמן את רקע כהה ואת היסטוגרמה של מחסנית. הגדר את השיטה לאלגוריתם הרצוי (למשל, Otsu או MaxEntropy). השתמש בסף אוטומטי לשחזור, אך אם אין שיטה אוטומטית מתאימה, התאם ידנית את הסף.
הערה: באופן אידיאלי, יש להשתמש באותו אלגוריתם עבור כל התמונות בניסוי, אך שינויים במורפולוגיה במהלך ניסוי עשויים לדרוש שיטת סף שונה בתנאים מסוימים. - כאשר הסף משביע רצון, לחץ על החל. בחלון הדו-שיח שמופיע, בחרו ' המר למסיכה'. בחלון הדו-שיח שמופיע, סמן רקע שחור והשאר את התיבות האחרות לא מסומנות. שמרו את תמונת המסיכה המתקבלת להערכת דיוק הסגמנטציה.
- לחץ על תמונה | התאמה | סף. בחלון סף שמופיע, סמן את רקע כהה ואת היסטוגרמה של מחסנית. הגדר את השיטה לאלגוריתם הרצוי (למשל, Otsu או MaxEntropy). השתמש בסף אוטומטי לשחזור, אך אם אין שיטה אוטומטית מתאימה, התאם ידנית את הסף.
- המירו את ערכי המסיכה מ- 0 ו- 255 ל- 0 ו- 1, בהתאמה, בלחיצה על תהליך | מתמטיקה | חלוקה. הגדר את הערך ל- 255, וכאשר תתבקש לעשות זאת, בחר באפשרות לעבד את כל התמונות.
- החל את המסיכה על ערוצי הפלואורסצנטיות שהוחסרו ברקע על-ידי לחיצה על תהליך | מחשבון תמונות. בחלון הדו-שיח שמופיע, הגדר את הפעולה להכפלה. קבעו את Image1 ו- Image2 לערוץ המונה ולמסיכה, בהתאמה. סמן את צור חלון חדש ותוצאת 32 סיביות; חזרו על כפל המסיכה בערוץ המכנה.
- הכינו כל ערוץ מוסווה לחישוב יחס על-ידי הגדרת הפיקסלים ברקע ל-NaN ("לא מספר").
- בחר את ערוץ הנומרטור המוסווה ולחץ על תמונה | התאמה | סף. בחלון סף, לחץ על הגדר, ובחלון הדו-שיח שמופיע, הגדר את המינימום לרמת הרעש המחושבת או ל- 1, והשאר את המקסימום כפי שהוא.
- בחלון סף , לחץ על החל. בתיבת הדו-שיח הבאה, בחר Set to NaN. חזור על הפעולה עבור ערוץ המכנה רעול הפנים.
- צור את תמונת היחס.
- לחץ על תהליך | מחשבון תמונות. בחלון הדו-שיח שמופיע, הגדר את הפעולה לחלוקה. הגדר את Image1 ו- Image2 לערוצי המונה והמכנה עם מסיכה שהוחסרו ברקע, בהתאמה. עבור mtHyPer7, המונה הוא הצורה המחומצנת הנרגשת ב-488 ננומטר, והמכנה הוא הצורה המופחתת הנרגשת ב-405 ננומטר. לכן, יחסים גבוהים יותר מצביעים על H 2O2 גבוה יותר.
- סמן את צור חלון חדש ותוצאת 32 סיביות. שמור את תמונת היחס לניתוח.
- לסמן ולכמת תחומי עניין. כל תא או אזור תת-תאי נבחר ומאוחסן כהחזר השקעה במנהל החזר ההשקעה. החזר ההשקעה אינו חייב להתאים באופן מושלם לקווי המתאר של התא, מכיוון שרק אזורי המיטוכונדריה רעולי הפנים יימדדו.
- שימוש בתמונת האור המשודר למניעת הטיה, צור ROI המתאים לתאים בודדים (או אזורים תת-תאיים). בתרביות שלב אמצע לוג, להגביל את הניתוח לתאי שמרים נושאים ניצנים, אשר עוסקים באופן פעיל בחלוקת התא. הקש T לאחר יצירת כל החזר השקעה כדי להוסיף אותו למנהל החזר ההשקעה. סמן את הצג הכל כדי לתעד את התאים שסומנו.
- לחץ על תמונת היחס שנוצרה לעיל, ובמנהל החזר ההשקעה, לחץ על עוד ... | מולטי-מדידה. בחלון הדו-שיח שמופיע, סמן את האפשרות מדוד את כל הפרוסות. אל תסמן את צרף תוצאות. סמן את האפשרות שורה אחת לכל פרוסה כדי להפיק טבלה בתבנית הרצויה. process_multiROI_tables. סקריפט R יעבד טבלאות שנוצרו באמצעות האפשרות שורה אחת לכל פרוסה בתוכנה הסטטיסטית R.
- שמור את התוצאות. לחץ על חלון התוצאות ולאחר מכן על קובץ | שמור ושמור את טבלת התוצאות בתבנית .csv או .xls. הגדר את שם הקובץ כך שיתאים לשם התמונה.
- שמור את החזר ההשקעה. במנהל החזר ההשקעה, תחילה ודא שלא נבחרו החזרי השקעה: לחץ על בטל בחירה ולאחר מכן על עוד | שמור. פתח את החזר ההשקעה שנשמר יחד עם התמונה המקורית בפיג'י כדי להצליב את המידות עם התמונה.
- חשב את היחסים הממוצעים המשוקללים לתא או לאזור באמצעות התוצאות שהתקבלו בשלב הקודם ובמשוואה (3). חשב יחסים "פיקסלים" או "אזוריים" (ראה פרטים בדיון).
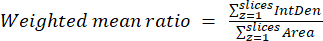 (3)
(3)
הערה: ערכי השטח והצפיפות המשולבת כוללים רק את הפיקסלים בתוך המיטוכונדריה הסף. חישוב זה יכול להיות אוטומטי באמצעות process_multiROI_tables. סקריפט R בתוכנה הסטטיסטית R. - צור תמונה ביחס צבעוני.
הערה: ניתן לבטל אפנון של תמונות צבעוניות, כאשר כל הפיקסלים המיטוכונדריאליים מופיעים באותה בהירות, או עם אפנון עוצמה, כאשר עוצמת הפיקסלים בתמונה המקורית משמשת לקביעת עוצמות בתמונה הצבעונית.- להפקת תמונה צבעונית ללא אפנון:
- פתח את תמונת היחס שנוצרה לעיל. לחץ על תמונה | שכפל /י כדי ליצור עותק של התמונה ולאחר מכן סגרתי את התמונה המקורית.
- אם התמונה היא ערימת Z, בחרו פרוסה בודדת, או צרו הקרנת Z להצגת כל המיטוכונדריה. השתמש בעוצמה מרבית (שמירה על היחס המרבי וערכי העוצמה בכל קואורדינטת XY) או בהקרנה בעוצמה ממוצעת.
- לחץ על תמונה | טבלאות בדיקת מידע והגדר את LUT לערכת הצבעים הרצויה (לדוגמה, Rainbow RGB או Fire [זמין כברירת מחדל ב- ImageJ]). לחלופין, לחץ על קובץ | ייבא LUT ובחר כל LUT רצוי בפורמט .lut של ImageJ, כגון Rainbow Smooth40 (כלול בקובץ משלים 2 וב- GitHub). ודא של- LUT מוקצה צבע כהה לערך 0.
- הגדר את ניגודיות התצוגה על ידי לחיצה על תמונה | התאמה | בהירות/ניגודיות. בחלון בהירות/ניגודיות, לחץ על קבע ובחלון הדו-שיח שמופיע, הזן את הערכים הרצויים עבור הערכים המינימליים והמרביים המוצגים. כדי למקסם את הבדלי הצבע שנצפו, קבעו אותם על המינימום והמקסימום בקירוב המתקבלים בכל התמונות. הגדר את כל התמונות בניסוי לאותן רמות ניגודיות.
הערה: אל תלחץ על החל, מכיוון שפעולה זו תשנה את ערכי הפיקסלים ותמנע יצירה של סרגל כיול מדויק בשלב הבא. - הוסף סרגל כיול צבעים על ידי לחיצה על נתח | כלים | סרגל כיול. בחלון הדו-שיח שמופיע, סמן את האפשרות כיסוי כדי להסיר את הסרגל, אם תרצה, על ידי לחיצה על תמונה | שכבת-על | הסר שכבת-על.
- אם תרצה, הוסף סרגל קנה מידה על ידי לחיצה על נתח | כלים | סרגל קנה מידה. בחלון הדו-שיח שמופיע, הגדר את הגודל, המיקום והצבע הרצויים עבור הסרגל. סמן את האפשרות כיסוי כדי לשמור על צבע הסרגל ללא קשר ל- LUT שנעשה בו שימוש.
- צור תמונת RGB לפרסום על ידי לחיצה על תמונה | שכבת-על | שיטוח. שמור את התמונה שנוצרה.
הערה: תמונה זו מיועדת להצגה או פרסום בלבד. ערכי העוצמה משתנים, כך שלא ניתן למדוד אותם. הסורגים גם נצרבים לצמיתות על התמונה.
- ליצירת תמונה עם אפנון עוצמה:
- לחץ על תמונה | שכפל /י כדי ליצור עותק של התמונה ולאחר מכן סגור את המקור.
- אם התמונה היא ערימת Z, בחרו פרוסה בודדת או צרו הקרנת Z להצגת כל המיטוכונדריה.
- הגדר את ניגודיות התצוגה של תמונת היחס על ידי לחיצה על תמונה | התאמה | בהירות/ניגודיות, ובחלון בהירות/ניגודיות, לחץ על הגדר. בחלון הדו-שיח שמופיע, הזן את הערכים הרצויים עבור הערכים המינימליים והמרביים המוצגים. כדי למקסם את הבדלי הצבעים שנצפו, קבעו אותם על המינימום והמקסימום בקירוב שהושגו בכל התמונות, וקבעו את כל התמונות בניסוי לאותן רמות ניגוד. לחצו על ' החל' כדי לשנות את גודל ערכי הפיקסלים.
- כדי ליצור סרגל כיול, שכפל תמונה משופרת זו וצור סרגל על-ידי ניווט אל נתח | כלים | סרגל כיול. המר את התמונה ואת שכבת העל לפורמט RGB על ידי לחיצה על תמונה | שכבת-על | שיטוח. אם תרצה, הדבק סרגל זה על תמונת RGB עם אפנון עוצמה שהתקבלה בשלב 5.6.2.12 להצגה או פרסום.
- צור תמונה חדשה באותו רוחב וגובה כמו התמונה על ידי לחיצה על קובץ | חדש | תמונה.... בחלון הדו-שיח שנפתח, הגדר את הפרמטרים באופן הבא: סוג: RGB; מלא עם: שחור; רוחב וגובה: 9רוחב וגובה התמונה); פרוסות: 1.
- המר את הערימה החדשה לערימת תמונות HSB (גוון, רוויה, בהירות) על ידי לחיצה על תמונה | סוג | מחסנית HSB.
- לחץ על תמונת יחס הניגודיות המותאם על-ידי ניווט אל עריכה | בחר הכל ולאחר מכן ערוך | העתק. לאחר מכן, לחץ על ערימת HSB, בחר את הפרוסה הראשונה (גוון) ולחץ על ערוך | הדבק כדי להעביר את ערכי היחס.
- בחרו פרוסה 2 (רוויה) בערימת HSB. הגדר את צבע החזית ללבן על-ידי ניווט אל עריכה | אפשרויות | צבעים. לחץ על עריכה | בחר הכל ולאחר מכן ערוך | מילוי, ובחלון הדו-שיח שנפתח, בחרו ' לא' כדי למלא רק את הפרוסה הנוכחית בלבן.
- פתח את תמונת הנתונים הגולמיים ופצל את הערוצים על ידי לחיצה על תמונה | צבע | ערוצים מפוצלים.
- צור את הממוצע של שני ערוצי היחס באמצעות מחשבון התמונות ולחץ על תהליך | מחשבון תמונות. בחלון הדו-שיח שמופיע, הגדר את הפעולה ל- Average והגדר את Image1 ו- Image2 לתמונות המונה והמכנה, בהתאמה. סמן את צור חלון חדש.
- לחץ על התמונה הממוצעת שנוצרה למעלה על ידי ניווט אל עריכה | בחר הכל ולאחר מכן ערוך | העתק. לאחר מכן, לחץ על ערימת HSB, בחר את הפרוסה השלישית (ערך) ולחץ על ערוך | הדבק כדי להעביר את ערכי העוצמה.
- המר את ערימת HSB למרחב הצבעים RGB על ידי לחיצה על תמונה | סוג | צבע RGB. שמור את התמונה שנוצרה.
- להפקת תמונה צבעונית ללא אפנון:
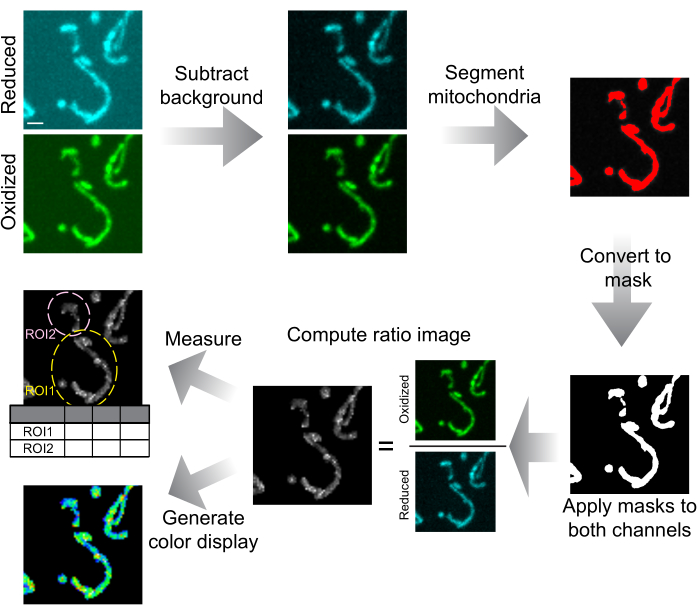
איור 6: סכמטיות של ניתוח תמונות והצגתן. תמונות קונפוקליות בדיסק מסתובב מופחתות תחילה ברקע. המיטוכונדריה מחולקים לפי סף והופכים למסכות עבור כל פרוסה. מסיכות אלה מוחלות על שני הערוצים, והתמונות עם המסיכה משמשות לחישוב היחס. ROI נמשכים כדי למדוד את יחס mtHyPer7 בתאים או באזורים תת-תאיים. ניתן גם ליצור תמונות ביחס צבעוני להצגת נתונים. סרגל קנה מידה = 1 מיקרומטר. קיצור: החזר השקעה = אזור עניין. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
תוצאות
כדי לאשר כי mtHyPer7 הוא בדיקה מתאימה להעריך מיטוכונדריה H 2 O2, לוקליזציה של mtHyPer7 ואת השפעתו על מיטוכונדריה שמרים ובריאות התא הוערכו. כדי להעריך את המיקוד של mtHyPer7, המיטוכונדריה הוכתמו בצבע החיוני הספציפי למיטוכונדריה MitoTracker Red בתאי שמרים ושמרים המבטאים mtHyPer7. באמצעות צביעה אדומה של MitoTracker, נפתרו המיטוכונדריה כמבנים צינוריים ארוכים שהתיישרו לאורך ציר האם-ניצן והצטברו בקצה הניצן ובקצה תא האם הדיסטלי לניצן41. המורפולוגיה המיטוכונדריאלית הייתה דומה בתאי הבקרה ובתאי הביטוי mtHyPer7. נוסף על כך, mtHyPer7 עבר לוקליזציה משותפת עם מיטוכונדריה מוכתמת באדום של MitoTracker (איור 3A). לפיכך, mtHyPer7 היה ממוקד באופן יעיל וכמותי למיטוכונדריה מבלי להשפיע על המורפולוגיה או הפיזור המיטוכונדריאלי הרגיל.
לאחר מכן, בוצעו ניסויי אימות נוספים כדי להעריך את ההשפעה של mtHyPer7 על הכושר התאי והרגישות לעקה חמצונית במיטוכונדריה. שיעורי הגדילה של תאים המבטאים mtHyPer7 במדיה עשירה או סינתטית מבוססת גלוקוז (YPD או SC, בהתאמה) דומים לאלה של תאים מסוג בר שלא עברו טרנספורמציה (איור 3B,D). כדי להעריך את ההשפעות האפשריות על עקה חמצונית במיטוכונדריה, טופלו שמרי בקרה ושמרים המבטאים mtHyPer7 ברמות נמוכות של פרקוואט, מולקולה קטנה הפעילה חמצון-חיזור המצטברת במיטוכונדריה וגורמת לרמות סופראוקסיד גבוהות באברונים24,27. אם ביטוי mtHyPer7 גורם לעקה חמצונית במיטוכונדריה או מגן על המיטוכונדריה מפני עקה חמצונית, אז תאים המבטאים mtHyPer7 צריכים להציג רגישות מוגברת או מופחתת לטיפול בפרקוואט, בהתאמה. טיפול ברמות נמוכות של פרקוואט הביא לירידה בקצב גדילת השמרים. יתר על כן, קצבי הגדילה של תאים המבטאים תאים מסוג פרא ושל mtHyPer7 בנוכחות פרקוואט היו דומים (איור 3C,E). לכן, ביטוי הביוסנסור לא יצר עקה תאית משמעותית בתאי שמרים ניצנים ולא שינה את רגישות השמרים לעקה חמצונית מיטוכונדריאלית.
בהתחשב בראיות כי mtHyPer7 מתאים לחקר מיטוכונדריה H 2 O 2 בשמרים ניצנים, נבדק אם mtHyPer7 יכול לזהות H מיטוכונדריאלי H 2 O 2 בשמרים מסוג בר באמצע לוג ושינויים במיטוכונדריה H 2 O 2 המושרה על ידי תוספת חיצונית H 2 O 2. ניסוי טיטרציה H 2 O2בוצע והיחס הממוצע מחומצן:מופחת (O/R) mtHyPer7 נמדד במיטוכונדריה.
סקריפטי הניתוח האוטומטיים הפיקו מספר קבצי פלט.
תמונת היחס (יחס.tif): ערימת Z המורכבת מהיחס בין ערימות הסף של 488 ננומטר ו- 405 ננומטר מתוקנות רקע. ניתן לצפות בערימה זו בפיג'י ללא עיבוד נוסף; עם זאת, מומלץ לשפר את הניגודיות ו/או לצבוע את התמונה כמתואר בפרוטוקול שלב 4.3 או 5.6 לפני הצפייה.
תמונת המסיכה (מסיכה.tif): ערימת Z המורכבת מאזורי המיטוכונדריה הסף המשמשים לניתוח. יש להשתמש בתמונה זו כדי להעריך את דיוק הסף.
החזר ההשקעה המשמש לניתוח (ROIs.zip): כאשר קובץ זה נפתח בפיג'י, יחד עם תמונת המקור, החזר ההשקעה מונח על גבי התמונה כדי להצליב את טבלת התוצאות ואת תמונת המקור. שמו של כל החזר השקעה משתנה עם מספר תא ומספר החזר השקעה.
טבלאות מדידה (NumResults.csv, DenomResults.csv, Results.csv) המכילות את השטח, הממוצע והצפיפות המשולבת של מיטוכונדריה סף לכל פרוסה בתמונות הנומרטור, המכנה והיחס, בהתאמה. בפרוסות שבהן המיטוכונדריה נעדרו או לא היו ממוקדים, נרשם NaN.
קובץ יומן רישום (Log.txt) המתעד את האפשרויות המשמשות לתיקון רקע ורעש, סף וחישוב יחס.
יחס O/R של mtHyPer7 הראה תגובה תלוית מינון לריכוז H 2 O 2, שהגיע לרמה של 1-2 מילימטר שנוסף חיצונית H 2 O 2(איור 7). באופן מפתיע, יחס HyPer7 היה נמוך יותר בתאים שנחשפו ל-0.1 mM H 2 O2מאשר בתאי הביקורת, אם כי הבדל זה לא היה מובהק סטטיסטית. הסבר אחד לתופעה זו עשוי להיות תגובת הורמזיס, שבה חשיפה לרמה נמוכה של סטרס עלולה לגרום לתגובות סטרס, כגון מנגנונים נוגדי חמצון, אשר בתורם מורידים את כמות ה-ROS הניתנת לזיהוי על ידי הבדיקה. רמות גבוהות יותר של גורמי לחץ, לעומת זאת, עלולות להציף את תגובות הלחץ הפנימיות ולגרום לקריאה גבוהה יותר מ- HyPer7.
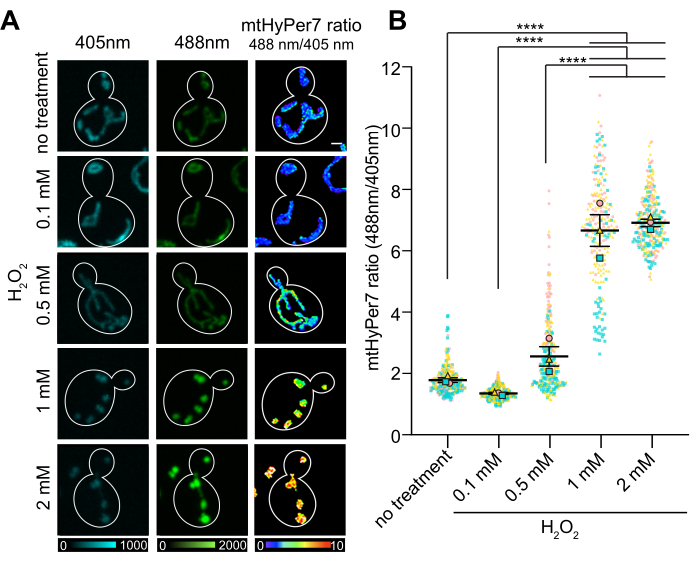
איור 7: תגובה של mtHyPer7 להוספה חיצונית של H 2 O 2. (A) הקרנה מרבית של תמונות מעוררות של 405 ננומטר ו-488 ננומטר והקרנה בעוצמה ממוצעת של תמונות יחסיות של mtHyPer7 בתאי פאזת אמצע לוג שנחשפו לריכוזים שונים של H 2 O 2. Pseudocolor מציין את מחומצן:מופחת mtHyPer7 יחס (קנה מידה למטה). סרגל קנה מידה = 1 מיקרומטר. קו המתאר של התא מוצג בלבן; n > 100 תאים לכל מצב. (B) כימות של mtHyPer7 מחומצן:יחס מופחת בתאי שמרים ניצנים שטופלו בריכוזים שונים של H 2 O2. מוצגים האמצעים של חמישה ניסויים עצמאיים, עם סמלים בעלי צורה וצבע שונים לכל ניסוי. ממוצע ± SEM של היחס בין mtHyPer7 מחומצן:מופחת: 1.794 ± 0.07627 (ללא טיפול), 1.357 ± 0.03295 (0.1 מילימול), 2.571 ± 0.3186 (0.5 מ"מ), 6.693 ± 0.5194 (1 מ"מ), 7.017 ± 0.1197 (2 מ"מ). p < 0.0001 (ANOVA חד-כיווני עם מבחן ההשוואות המרובות של Tukey). ערכי p מסומנים כ: ****p < 0.0001. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
לבסוף, מחקרים קודמים גילו כי מיטוכונדריה חטובים יותר, שהם מופחתים יותר ומכילים פחות סופראוקסיד, עוברים בתורשה מועדפת על ידי תאי בת שמרים4, וכי קטלזות ציטוסוליות מועברות ומופעלות בתאי בת שמרים42,43,44,45. מחקרים אלה מתעדים את התורשה הא-סימטרית של מיטוכונדריה במהלך חלוקת תאי שמרים ואת התפקיד בתהליך זה בכושר תאי הבת ובתוחלת החיים, כמו גם אסימטריה בגיל האם והבת. כדי לבדוק אם קיימים הבדלים ב-H 2 O2 בין אמהות לניצנים, mtHyPer7 נמדד בניצנים ובתאי אם. הבדלים במיטוכונדריה H 2 O 2נצפו בתוך תאי שמרים, וירידה עדינה אך מובהקת סטטיסטית בקריאת הביוסנסור H 2 O 2זוהתה במיטוכונדריה באיבה בהשוואה לאלה שבתא האם (איור 8). ממצאים אלה עולים בקנה אחד עם ממצאים קודמים לפיהם מיטוכונדריה באיבה מוגנים טוב יותר מפני עקה חמצונית. הם גם מספקים תיעוד לכך ש- mtHyPer7 יכול לספק קריאה כמותית עבור H 2 O2מיטוכונדריאלי ברזולוציה תאית ותת-תאית בשמרים ניצנים.
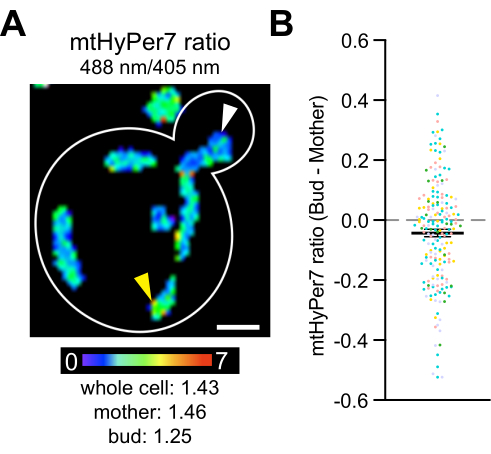
איור 8: רמת H 2 O2במיטוכונדריה נמוכה יותר בתא הבת. (A) הקרנה מרבית של תמונה יחסימטרית של mtHyPer7 בתא מייצג. Pseudocolor מציין את מחומצן:מופחת mtHyPer7 יחס (קנה מידה למטה). ניכרים הבדלים תת-תאיים ביחס (ראשי חץ). סרגל קנה מידה = 1 מיקרומטר. מיתאר תא: לבן. (B) הפרש בין יחס mtHyPer7 בתא ניצן ותא אם. עבור כל תא בודד, ערך יחס האם הופחת מערך יחס הניצן ושורטט כנקודה. n = 193 תאים שנאספו מחמישה ניסויים עצמאיים, המוצגים עם סמלים בצבעים שונים לכל ניסוי. ממוצע ± SEM של ההבדל בין יחס mtHyPer7 בתאי ניצן ואם: -0.04297 ± 0.01266. p = 0.0008 (מבחן t זוגי) לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
טבלה משלימה S1: זנים ששימשו במחקר זה. רשימת זני שמרים בשימוש. אנא לחץ כאן כדי להוריד קובץ זה.
טבלה משלימה S2: פלסמידים ששימשו במחקר זה. רשימה של פלסמידים בשימוש. אנא לחץ כאן כדי להוריד קובץ זה.
טבלה משלימה S3: פריימרים ששימשו במחקר זה. רשימת פריימרים בשימוש. אנא לחץ כאן כדי להוריד קובץ זה.
קובץ משלים 1: פרוטוקול לבניית פלסמיד biosensor. אנא לחץ כאן כדי להוריד קובץ זה.
קובץ משלים 2: סקריפטים לניתוח אוטומטי. עבור כל סקריפט, מסופקים קבצי קלט לדוגמה וקבצי פלט. אנא לחץ כאן כדי להוריד קובץ זה.
Discussion
בפרוטוקול זה, מתוארת שיטה לשימוש ב- mtHyPer7 כחיישן ביולוגי להערכת H 2 O2מיטוכונדריאלי בתאי שמרים ניצנים חיים. הביוסנסור נבנה בשיטה מבוססת קריספר ומוכנס לאזור שמור ללא גנים בגנום השמרים ללא שימוש בסמנים הניתנים לבחירה. בהשוואה לביו-חיישנים הנישאים בפלסמיד, אלה המשולבים באים לידי ביטוי בכל התאים וברמות עקביות, ומספקים תוצאות כימות אמינות יותר. לא נעשה שימוש בסמנים הניתנים לבחירה ליצירת תאים המבטאים mtHyPer7, מה שמאפשר שימוש במגוון רחב יותר של רקעי זן ומקל על השינוי הגנטי של תאים המבטאים ביוסנסורים. חלבון mtHyPer7 ממוקד נכון למיטוכונדריה ללא השפעות ניכרות על המורפולוגיה של המיטוכונדריה, תפקוד, פיזור או קצב גדילת תאים. mtHyPer7 מראה תגובה תלוית מינון לתוספת חיצונית H 2 O2. יתר על כן, mtHyPer7 מסוגל לדווח על ההטרוגניות של איכות המיטוכונדריה עם רזולוציה תת-תאית. לבסוף, שימוש במיקרוסקופ קונפוקלי של דיסק מסתובב, בניגוד למיקרוסקופ רחב שדה להדמיית חיישנים ביולוגיים ממוקדים במיטוכונדריה, גורם לפחות הלבנה של אור לפלואורופורים ומפיק תמונות ברזולוציה גבוהה לניתוח הבדלים תת-תאיים.
מגבלות וגישות חלופיות
שיטה זו אינה מתאימה לתאי הדמיה למשך יותר מ-10 דקות, מכיוון שהתאים יתייבשו מתחת לכיסוי. להדמיה לטווח ארוך יותר, עדיף להשתמש בשיטת אגר פד46 או לשתק תאים בצלחת תרבית תחתית זכוכית מלאה במדיום SC.
הבחירה של biosensor צריך להיות מונחה על ידי ריכוז המטרה בתנאי ניסוי. אם הרגישות של HyPer7 גבוהה מדי, מומלץ להשתמש בגרסת HyPer אחרת, כגון HyPer3 או HyPerRed47,48. עם זאת, יש לציין כי בדיקות HyPer אחרות רגישות יותר ל- pH. עבור רגישות גבוהה יותר, roGFP מבוסס peroxiredoxin, עשוי להיות מתאים יותר (roGFP2Tsa2ΔCR)27.
מצב החמצון היציב של חיישן H 2 O2קשור הן לקצב החמצון והן לקצב החיזור. קצב החמצון של חיישנים ביולוגיים נגרם בעיקר על ידי H 2 O2, אך קצב ההפחתה תלוי במערכות חיזור נוגדי חמצון הפעילות בתא ואברונים. הוכח כי HyPer7 מופחת בעיקר על ידי מערכת thioredoxin בציטוזול שמרים, וההפחתה שלו מהירה יותר מזו של roGFP2Tsa2ΔCR27. לכן, מנגנוני ההפחתה השונים ודינמיקת התגובה של הגשושית צריכים להילקח בחשבון בעת פירוש מדידות של חיישנים ביולוגייםH 2 O2. בפרט, כדי להסיק רמות H2 O2 מקריאת הביו-סנסור, יש להניח כי מערכת ההפחתה שומרת על קיבולת קבועה במהלך הניסוי. כחלופה לסקריפטים המתוארים כאן, מגוון תוכנות אחרות הועמדו לרשות הציבור באופן חופשי לניתוח חיישני חיזור49.
שלבים קריטיים
עם כל biosensor, זה קריטי כדי להוכיח כי biosensor עצמו אינו משפיע על התהליך הנמדד. לכן, השוואת הגידול והמורפולוגיה המיטוכונדריאלית של זנים תחת כל תנאי ניסוי חשובה. כאן, מורפולוגיה מיטוכונדריאלית מוערכת באמצעות MitoTracker Red, אשר מכתים מיטוכונדריה באופן תלוי פוטנציאל הממברנה. עם זאת, השוואה של המיטוכונדריה בתאים שלא עברו טרנספורמציה ועברו טרנספורמציה ביולוגית יכולה להתבצע על ידי צביעה עם טטרמתילרודאמין מתיל אסטר (TMRM), צבע חיוני מיטוכונדריאלי חלופי לחישת פוטנציאלים, או MitoTracker Green, אשר מכתים מיטוכונדריה ללא תלות בפוטנציאל הממברנה. אם יש חשד להשפעות מזיקות, הפחתת רמת הביטוי או שינוי אתר האינטגרציה עשויים לעזור.
אימות התנהגות המינון-תגובה של הגשושית ויחס האות לרעש של טכניקת ההדמיה חיוניים גם הם לאיסוף תוצאות חזקות. אם השונות בתוך קבוצה עולה על השונות בין קבוצות, קשה לזהות את ההבדלים. שונות תוך-קבוצתית עשויה לנבוע משונות אמיתית באוכלוסייה, או מרעש בתהליך האיתור. השלבים העיקריים להגדלת יחס האות:רעש הם רכישת תמונה (טווח ערכי פיקסלים ורעש), חיסור רקע וסף.
ניתן גם להפחית את השפעות הרעש במהלך שלבי החישוב. הגישה הפשוטה ביותר היא לחשב את העוצמה הממוצעת המשוקללת ממדידות תמונת היחס (תוצאות.csv), כאשר כל פיקסל מייצג את היחס המקומי בין יעילות העירור. זה מייצר יחס "פיקסלים". עם זאת, אם יחס אות התמונה:רעש נמוך, ניתן לקבל תוצאות חזקות יותר על ידי חישוב העוצמה הממוצעת המשוקללת עבור החזר השקעה הן בערוצי המונה והן בערוץ המכנה, ולאחר מכן חישוב היחס בין שני אמצעים משוקללים אלה (יחס "אזורי").
לבחירת שיטת סף, הפקודה פיג'י תמונה | התאמה | ניתן להשתמש בסף אוטומטי כדי לנסות באופן אוטומטי את כל שיטות פיג'י המובנות. כדי להעריך סגמנטציה (סף), מסיכה שנשמרה מומרת לבחירה על ידי לחיצה על עריכה | בחירה | צור בחירה, נוסף למנהל החזר ההשקעה (על-ידי הקשה על T) ולאחר מכן הופעל בקובץ התמונה הגולמית. אם המיטוכונדריה אינם מזוהים כראוי, יש לנסות שיטת פילוח אחרת.
בעת השוואת תמונות, חיוני לרכוש את כל התמונות עם תנאי הדמיה זהים, כמו גם להציג את כל התמונות עם שיפור ניגודיות זהה.
יש לקחת בחשבון את התנועה המיטוכונדריאלית בעת מיטוב תנאי ההדמיה. אם המיטוכונדריה נעים באופן משמעותי בין עירור של 405 ל-488 ננומטר, תמונת היחס לא תהיה מדויקת. מומלץ לשמור על זמן חשיפה <500 אלפיות השנייה ולשנות עירור בשיטה המהירה ביותר הקיימת (למשל דופק טריגר או מסנן כוונון אקוסטי-אופטי). בעת לכידת מחסנית Z, יש לבצע את שני העירורים עבור כל צעד Z לפני המעבר לשלב Z הבא.
לצורך הצגת התוצאות, שינויים בגוון (צבע) ברורים יותר לעין האנושית מאשר שינויים בעוצמה. לכן, ערך היחס מומר לסרגל צבעים לפרשנות חזותית קלה יותר. ניתן לבטל אפנון של תמונות צבעוניות, שבהן כל הפיקסלים במיטוכונדריה מופיעים באותה בהירות, או עם אפנון עוצמה, שבו עוצמת הפיקסלים בתמונה המקורית משמשת לקביעת עוצמות בתמונה הצבעונית.
שינוי ופתרון בעיות
כחלופה לאישור תפקוד המיטוכונדריה על ידי אתגר עם פרקוואט, תאים עשויים להיות מצופים העתק או מחוסנים למקורות פחמן מותססים ולא מותססים.
לחיסור רקע, חיסור כדור מתגלגל (על-ידי ניווט אל תהליך | חיסור רקע...) ניתן להשתמש גם כדי להסיר אי-אחידות תאורה. יש לוודא כי נוכחות התאים אינה משנה את הרקע המופחת (על ידי סימון האפשרות ליצור רקע ובחינת התוצאה).
לסיכום, הגשושית mtHyPer7 מספקת שיטה עקבית וזעיר פולשנית לקשר את המצב המורפולוגי והתפקודי של מיטוכונדריית שמרים בתאים חיים, ומאפשרת לחקור גורם עקה תאי חשוב ומולקולת איתות במערכת מודל גנטית נגישה ונגישה.
Disclosures
המחברים מצהירים כי אין להם ניגודי עניינים.
Acknowledgements
המחברים מודים לקתרין פילפו לופז על סיוע טכני מומחה. עבודה זו נתמכה על ידי מענקים מהמכונים הלאומיים לבריאות (NIH) (GM122589 ו-AG051047) ל-LP.
מחקרים אלה השתמשו במשאב המשותף Confocal and Specialized Microscopy של מרכז הסרטן המקיף ע"ש הרברט אירווינג באוניברסיטת קולומביה, שמומן בחלקו באמצעות מענק התמיכה של מרכז הסרטן NIH/NCI P30CA013696.
Materials
| Name | Company | Catalog Number | Comments |
| 100x/1.45 Plan Apo Lambda objective lens | Nikon | MRD01905 | |
| Adenine sulfate | Sigma-Aldrich | #A9126 | |
| Bacto Agar | BD Difco | #DF0145170 | |
| Bacto Peptone | BD Difco | #DF0118170 | |
| Bacto Tryptone | BD Difco | #DF211705 | |
| Bacto Yeast Extract | BD Difco | #DF0127179 | |
| BamHI | New England Biolabs | R0136S | |
| BglII | New England Biolabs | R0144S | |
| Carbenicilin | Sigma-Aldrich | C1389 | |
| Carl Zeiss Immersol Immersion Oil | Carl Zeiss | 444960 | |
| Dextrose (D-(+)-Glucose) | Sigma-Aldrich | #G8270 | |
| E. cloni 10G chemical competent cell | Bioserch Technologies | 60108 | |
| FIJI | NIH | Schindelin et al 2012 | |
| G418 (Geneticin) | Sigma-Aldrich | A1720 | |
| GFP emission filter | Chroma | 525/50 | |
| Gibson assembly | New England Biolabs | E2611 | |
| Graphpad Prism 7 | GraphPad | https://www.graphpad.com/scientific-software/prism/ | |
| H2O2 (stable) | Sigma-Aldrich | H1009 | |
| HO-pGPD-mito-roGFP-KanMX6-HO | Pon Lab | JYE057/EP41 | Liao et al 20201 |
| Incubator Shaker | New Brunswick Scientific | E24 | |
| KAPA HiFi PCR kit | Roche Sequencing and Life Science, Kapa Biosystems, Wilmington, MA | KK1006 | |
| L-arginine hydrochloride | Sigma-Aldrich | #A8094 | |
| laser | Agilent | 405 and 488 nm | |
| L-histidine hydrochloride | Sigma-Aldrich | #H5659 | |
| L-leucine | Sigma-Aldrich | #L8912 | |
| L-lysine hydrochloride | Sigma-Aldrich | #L8662 | |
| L-methionine | Sigma-Aldrich | #M9625 | |
| L-phenylalanine | Sigma-Aldrich | #P5482 | |
| L-tryptophan | Sigma-Aldrich | #T8941 | |
| L-tyrosine | Sigma-Aldrich | #T8566 | |
| mHyPer7 plasmid | This study | JYE116 | |
| Microscope coverslips | ThermoScientific | 3406 | #1.5 (170 µm thickness) |
| Microscope slides | ThermoScientific | 3050 | |
| MitoTracker Red CM-H2Xros | ThermoFisherScientific | M7513 | |
| NaCl | Sigma-Aldrich | S9888 | |
| NEBuilder HiFi Assembly Master Mix | New England Biolabs | E2621 | |
| Nikon Elements | Nikon | Microscope acquisition software | |
| Nikon Ti Eclipse inverted microscope | Nikon | ||
| Paraquat (Methyl viologen dichloride hydrate) | Sigma-Aldrich | Cat. #856177 | |
| RStudio | Posit.co | Free desktop version | |
| Spectrophotometer | Beckman | BU530 | |
| Stagetop incubator | Tokai Hit | INU | |
| Uracil | Sigma-Aldrich | #U1128 | |
| Yeast nitrogen base (YNB) containing ammonium sulfate without amino acids | BD Difco | #DF0919073 | |
| YN2_1_LT58_X2site | Addgene | 177705 | Pianale et al 2021 |
| Zyla 4.2 sCMOS camera | Andor |
References
- vander Bliek, A. M., Sedensky, M. M., Morgan, P. G. Cell biology of the mitochondrion. Genetics. 207 (3), 843-871 (2017).
- McBride, H. M., Neuspiel, M., Wasiak, S. Mitochondria: more than just a powerhouse. Current Biology. 16 (14), 551-560 (2006).
- Shi, R., Hou, W., Wang, Z. -. Q., Xu, X. Biogenesis of iron-sulfur clusters and their role in DNA metabolism. Frontiers in Cell and Developmental Biology. 9, 735678 (2021).
- McFaline-Figueroa, J. R., et al. Mitochondrial quality control during inheritance is associated with lifespan and mother-daughter age asymmetry in budding yeast. Aging Cell. 10 (5), 885-895 (2011).
- Higuchi-Sanabria, R., et al. Mitochondrial anchorage and fusion contribute to mitochondrial inheritance and quality control in the budding yeast Saccharomyces cerevisiae. Molecular Biology of the Cell. 27 (5), 776-787 (2016).
- Higuchi-Sanabria, R., et al. Role of asymmetric cell division in lifespan control in Saccharomyces cerevisiae. FEMS Yeast Research. 14 (8), 1133-1146 (2014).
- Lam, Y. T., Aung-Htut, M. T., Lim, Y. L., Yang, H., Dawes, I. W. Changes in reactive oxygen species begin early during replicative aging of Saccharomyces cerevisiae cells. Free Radical Biology & Medicine. 50 (8), 963-970 (2011).
- Laun, P., et al. Aged mother cells of Saccharomyces cerevisiae show markers of oxidative stress and apoptosis. Molecular Microbiology. 39 (5), 1166-1173 (2001).
- Doudican, N. A., Song, B., Shadel, G. S., Doetsch, P. W. Oxidative DNA damage causes mitochondrial genomic instability in Saccharomyces cerevisiae. Molecular and Cellular Biology. 25 (12), 5196-5204 (2005).
- Roca-Portoles, A., Tait, S. W. G. Mitochondrial quality control: from molecule to organelle. Cellular and Molecular Life Sciences. 78 (8), 3853-3866 (2021).
- Sies, H., Berndt, C., Jones, D. P. Oxidative stress. Annual Review of Biochemistry. 86, 715-748 (2017).
- Sies, H., Jones, D. P. Reactive oxygen species (ROS) as pleiotropic physiological signalling agents. Nature Reviews Molecular Cell Biology. 21 (7), 363-383 (2020).
- Imlay, J. A., Fridovich, I. Assay of metabolic superoxide production in Escherichia coli. The Journal of Biological Chemistry. 266 (11), 6957-6965 (1991).
- Fridovich, I. Mitochondria: are they the seat of senescence. Aging Cell. 3 (1), 13-16 (2004).
- Quinlan, C. L., Perevoshchikova, I. V., Hey-Mogensen, M., Orr, A. L., Brand, M. D. Sites of reactive oxygen species generation by mitochondria oxidizing different substrates. Redox Biology. 1 (1), 304-312 (2013).
- Griendling, K. K., Minieri, C. A., Ollerenshaw, J. D., Alexander, R. W. Angiotensin II stimulates NADH and NADPH oxidase activity in cultured vascular smooth muscle cells. Circulation Research. 74 (6), 1141-1148 (1994).
- Griendling, K. K., Sorescu, D., Ushio-Fukai, M. NAD(P)H oxidase: role in cardiovascular biology and disease. Circulation Research. 86 (5), 494-501 (2000).
- Edmondson, D. E., Binda, C., Wang, J., Upadhyay, A. K., Mattevi, A. Molecular and mechanistic properties of the membrane-bound mitochondrial monoamine oxidases. Biochemistry. 48 (20), 4220-4230 (2009).
- Ramsay, R. R., Singer, T. P. The kinetic mechanisms of monoamine oxidases A and B. Biochemical Society Transactions. 19 (1), 219-223 (1991).
- Ramsay, R. R. Kinetic mechanism of monoamine oxidase A. Biochemistry. 30 (18), 4624-4629 (1991).
- Handy, D. E., Loscalzo, J. Redox regulation of mitochondrial function. Antioxidants & Redox Signaling. 16 (11), 1323-1367 (2012).
- Wood, Z. A., Schröder, E., Robin Harris, J., Poole, L. B. Structure, mechanism and regulation of peroxiredoxins. Trends in Biochemical Sciences. 28 (1), 32-40 (2003).
- Slade, L., et al. Examination of the superoxide/hydrogen peroxide forming and quenching potential of mouse liver mitochondria. Biochimica et Biophysica Acta. General Subjects. 1861 (8), 1960-1969 (2017).
- Pak, V. V., et al. Ultrasensitive genetically encoded indicator for hydrogen peroxide identifies roles for the oxidant in cell migration and mitochondrial function. Cell Metabolism. 31 (3), 642-653 (2020).
- Topell, S., Hennecke, J., Glockshuber, R. Circularly permuted variants of the green fluorescent protein. FEBS Letters. 457 (2), 283-289 (1999).
- Belousov, V. V., et al. Genetically encoded fluorescent indicator for intracellular hydrogen peroxide. Nature Methods. 3 (4), 281-286 (2006).
- Kritsiligkou, P., Shen, T. K., Dick, T. P. A comparison of Prx- and OxyR-based H2O2 probes expressed in S. cerevisiae. The Journal of Biological Chemistry. 297 (1), 100866 (2021).
- Baird, G. S., Zacharias, D. A., Tsien, R. Y. Circular permutation and receptor insertion within green fluorescent proteins. Proceedings of the National Academy of Sciences. 96 (20), 11241-11246 (1999).
- Abedi, M. R., Caponigro, G., Kamb, A. Green fluorescent protein as a scaffold for intracellular presentation of peptides. Nucleic Acids Research. 26 (2), 623-630 (1998).
- Onukwufor, J. O., et al. A reversible mitochondrial complex I thiol switch mediates hypoxic avoidance behavior in C. elegans. Nature Communications. 13 (1), 2403 (2022).
- Vega, M., et al. Antagonistic effects of mitochondrial matrix and intermembrane space proteases on yeast aging. BMC Biology. 20 (1), 160 (2022).
- Torello Pianale, L., Rugbjerg, P., Olsson, L. Real-time monitoring of the yeast intracellular state during bioprocesses with a toolbox of biosensors. Frontiers in Microbiology. 12, 802169 (2022).
- Imani, M., Mohajeri, N., Rastegar, M., Zarghami, N. Recent advances in FRET-based biosensors for biomedical applications. Analytical Biochemistry. 630, 114323 (2021).
- Zadran, S., et al. Fluorescence resonance energy transfer (FRET)-based biosensors: visualizing cellular dynamics and bioenergetics. Applied Microbiology and Biotechnology. 96 (4), 895-902 (2012).
- Gietz, R. D., Woods, R. A. Transformation of yeast by lithium acetate/single-stranded carrier DNA/polyethylene glycol method. Methods in Enzymology. 350, 87-96 (2002).
- Liao, P. -. C., Wolken, D. M. A., Serrano, E., Srivastava, P., Pon, L. A. Mitochondria-associated degradation pathway (MAD) function beyond the outer membrane. Cell Reports. 32 (2), 107902 (2020).
- Higuchi-Sanabria, R., Swayne, T. C., Boldogh, I. R., Pon, L. A. Live-cell imaging of mitochondria and the actin cytoskeleton in budding yeast. Methods in Molecular Biology. 1365, 25-62 (2016).
- Liao, P. -. C., Yang, E. J., Pon, L. A. Live-cell imaging of mitochondrial redox state in yeast cells. STAR Protocols. 1 (3), 100160 (2020).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Collins, T. J. ImageJ for microscopy. BioTechniques. 43, 25-30 (2007).
- Chazotte, B. Labeling mitochondria with MitoTracker dyes. Cold Spring Harbor Protocols. 2011 (8), 990-992 (2011).
- Aguilaniu, H., Gustafsson, L., Rigoulet, M., Nyström, T. Asymmetric inheritance of oxidatively damaged proteins during cytokinesis. Science. 299 (5613), 1751-1753 (2003).
- Erjavec, N., Larsson, L., Grantham, J., Nyström, T. Accelerated aging and failure to segregate damaged proteins in Sir2 mutants can be suppressed by overproducing the protein aggregation-remodeling factor Hsp104p. Genes & Development. 21 (19), 2410-2421 (2007).
- Erjavec, N., Cvijovic, M., Klipp, E., Nyström, T. Selective benefits of damage partitioning in unicellular systems and its effects on aging. Proceedings of the National Academy of Sciences. 105 (48), 18764-18769 (2008).
- Erjavec, N., Nyström, T. Sir2p-dependent protein segregation gives rise to a superior reactive oxygen species management in the progeny of Saccharomyces cerevisiae. Proceedings of the National Academy of Sciences. 104 (26), 10877-10881 (2007).
- Davidson, R., Liu, Y., Gerien, K. S., Wu, J. Q. Real-time visualization and quantification of contractile ring proteins in single living cells. Methods in Molecular Biology. 1369, 9-23 (2016).
- Bilan, D. S., et al. HyPer-3: a genetically encoded H2O2 probe with improved performance for ratiometric and fluorescence lifetime imaging. ACS Chemical Biology. 8 (3), 535-542 (2013).
- Ermakova, Y. G., et al. Red fluorescent genetically encoded indicator for intracellular hydrogen peroxide. Nature Communications. 5 (1), 5222 (2014).
- Fricker, M. D. Quantitative redox imaging software. Antioxidants & Redox Signaling. 24 (13), 752-762 (2016).
- Yang, E. J., Pernice, W. M., Pon, L. A. A role for cell polarity in lifespan and mitochondrial quality control in the budding yeast Saccharomyces cerevisiae. iSCIENCE. 25 (3), 103957 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved