בדיקת תגובת שרשרת של פולימראז דיגיטלי טיפתי לזיהוי וקטורים נגיפיים הקשורים לאדנו במחקרי שפיכה ביולוגית של דמעות
In This Article
Summary
כאן, אנו מציגים פרוטוקול לפיתוח ותיקוף של שיטות מעבדה טובות בזיהוי תואם של וקטורים נגיפיים הקשורים באדנו בדמעות אנושיות על ידי תגובת שרשרת פולימראז דיגיטלית טיפתית לתמיכה בפיתוח קליני של וקטורים של ריפוי גנטי.
Abstract
השימוש בווקטורים נגיפיים לטיפול במחלות גנטיות גדל משמעותית בשנים האחרונות, עם למעלה מ-2,000 מחקרים שנרשמו עד כה. וקטורים נגיפיים הקשורים לאדנו (AAV) מצאו הצלחה מיוחדת בטיפול במחלות הקשורות לעיניים, כפי שהודגם באישור של voretigene neparvovec-rzyl. כדי להביא טיפולים חדשים לשוק, סוכנויות רגולטוריות בדרך כלל מבקשות מחקרי ביושפידינג מוסמכים או מתוקפים כדי להעריך את שחרור הווקטור לסביבה. עם זאת, לא פורסמו הנחיות רשמיות לפיתוח בדיקות מבוססות מולקולרית לתמיכה במחקרי נשירה כאלה על ידי מנהל המזון והתרופות האמריקאי, מה שמשאיר את המפתחים לקבוע שיטות עבודה מומלצות עבור עצמם. מטרת פרוטוקול זה היא להציג פרוטוקול תקף לזיהוי וקטורי AAV בדמעות אנושיות על ידי תגובת שרשרת פולימראז דיגיטלית טיפתית (ddPCR) לתמיכה במחקרי ביושפיכה קליניים. כתב יד זה דן בגישות הנוכחיות בתעשייה לאימות בדיקות מולקולריות ומדגים כי השיטה חורגת מקריטריוני הקבלה של מבחני היעד המוצעים כיום בסקירות טכניות. לבסוף, צעדים קריטיים בביצועים של כל מבחן ddPCR, ללא קשר ליישום, נדונים.
Introduction
הגדרות הטיפול הגנטי משתנות, אך בדרך כלל גורמות להחלפה קבועה מכוונת ולעתים קרובות צפויה של רצף דנ"א ספציפי של הגנום התאי כדי לשנות או לשנות את הביטוי של גן או לשנות את התכונות הביולוגיות של תא חי למטרה קלינית 1,2. וקטורים נגיפיים משמשים יותר ויותר ככלי לריפוי גנטי בשל יעילות ההתמרה שלהם, כאשר דו"ח אחד מציע כי מעל 70% מהניסויים הקליניים הנוכחיים בריפוי גנטי משתמשים בווקטורים נגיפיים3. העניין בווקטורים נגיפיים לריפוי גנטי הולך וצובר תאוצה. דו"ח הנתונים הרבעוני לרבעון 4 לשנת 2022 על נוף הטיפול בגנים, תאים ורנ"א של האגודה האמריקאית לתרפיה גנטית ותאית דיווח כי בשנת 2022, צנרת הטיפול בגנים, תאים ורנ"א מפרה-קליני לרישום מוקדם גדלה ב-7%, מה שמביא את המספר הכולל של טיפולים בפיתוח ל-3,726, מתוכם 2,053 (55%) טיפולים גנטיים4. מנהל המזון והתרופות האמריקני (FDA) אישר כיום 27 טיפולים תאיים וגנטיים לשימוש קליני בבני אדם, חמישה מהם משתמשים באופן ספציפי בווקטורים נגיפיים5.
וירוסים הקשורים לאדנו (AAVs) זכו להתעניינות ספציפית ככלי לריפוי גנטי. מטא-אנליזה שנערכה לאחרונה חשפה כי בשני העשורים האחרונים נערכו כ-136 ניסויים קליניים שחקרו את השימוש ב-AAVs6. בנוסף, שלושה מתוך חמשת הטיפולים הגנטיים שאושרו על ידי ה- FDA בארה"ב מבוססים על AAV. זאת בשל אופיים הניתן לעריכה ברמה גבוהה, טווח מארחים רחב שניתן לכוונן על בסיס שימוש בווקטורים ספציפיים המתרחשים באופן טבעי או מהונדסים באופן מלאכותי, פתוגניות נמוכה ורעילות בבני אדם, ואימונוגניות נמוכה בדרך כלל 7,8. AAVs שימשו בהצלחה גם לטיפול במחלות עיניים במסגרת קלינית מאושרת. Voretigene neparvovec-rzyl הוא טיפול מבוסס AAV2 שאושר על ידי ה- FDA האמריקאי בשנת 2017 ועל ידי סוכנות התרופות האירופית (EMA) בשנת 2018 לטיפול בניוון רשתית9 הקשור למוטציה ביאלית RPE65.
עם העניין הגובר בפיתוח טיפולים מבוססי AAV מגיע הצורך בהדרכה רגולטורית על בדיקות. זיהוי וכימות מדויקים של כל וקטור נגיפי הוא חלק בלתי נפרד משלבי הגילוי, הייצור והבדיקות הפרה-קליניות/קליניות של פיתוח המוצר. ה- FDA בארה"ב החל לפרסם כמה הנחיות לטיפולים גנטיים, כולל על הכימיה, הייצור והבקרה של ריפוי גנטי אנושי יישומי תרופות חדשות ניסיוניות 10, מעקב ארוך טווח לאחר מתן טיפול גנטי11, בדיקות רטרו-וירוס כשירות שכפול 12, והמלצות לווקטורים מיקרוביאליים המשמשים בטיפולים גנטיים 13. ה- EMA פרסם גם שורה של הנחיות הנוגעות לפיתוח מוצרי ריפוי גנטי שבדרך כלל מתיישרים עם המלצות ה- FDA, אם כי קיימים כמה הבדלים14. חשוב לציין כי בעוד שהנחיות אלה אינן קובעות אחריות הניתנת לאכיפה משפטית, למעט כאשר יש התייחסות לתקנות ספציפיות, הן מספקות בהירות לגבי החשיבה הנוכחית של רשויות רגולטוריות בנושא וציפיותיהן לבדיקות הנדרשות להגשת תרופות ואישור רגולטורי.
ה- FDA ממליץ באופן ספציפי כי יש לערוך מחקרים כדי להעריך את ההתפלגות, ההתמדה והפינוי של וקטור מאתר מתן כדי להתמקד ברקמות עיניים ולא עיניות, נוזלים תוך עיניים ודם15. אלה לובשים צורה של הפצה ביולוגית ומחקרי שפיכה. מחקרי הפצה ביולוגית מעריכים חשיפה על ידי חקירת האופן שבו מוצר מתפשט בכל גופו של המטופל מאתר הנטילה. שפיכה מעריכה באופן ספציפי את שחרור המוצר מהמטופל לסביבה ומעלה את האפשרות להעברת הווקטור לאנשים לא מטופלים16. ה-FDA ממליץ על תכנון מחקרי הפצה ביולוגית ושפיכה ביחס לתדירות איסוף הדגימות, משך איסוף הדגימות, סוגי הדגימות שנאספו ותנאי האחסון.
בנוסף, ה- FDA ממליץ על שימוש בתגובת שרשרת פולימראז כמותית (qPCR, או PCR בזמן אמת) לזיהוי כמותי של גנומים וקטוריים בשל קלות הביצועים שלה, פורמט תפוקה גבוהה, זמני אספקה מהירים ורגישות לבדיקה. עם זאת, קיים מחסור יחסי בהמלצות לתכנון והערכת ביצועים של שיטות מולקולריות בהשוואה לאלה הקיימות עבור מולקולות קטנות וגדולות. רבות מההנחיות למחקרים כאלה קשות ליישום על שיטות מולקולריות בשל העיצוב הייחודי והמורכב הן של המוצרים והן של הבדיקות עצמן, מה שמעלה שאלות לגבי נאותות הפלטפורמות הזמינות להערכות המומלצות והשיטות המתאימות לאימות הבדיקה. עד כה, ה- FDA לא דרש אימות רשמי של בדיקות מבוססות PCR, אם כי EMA הטיל דרישה זו17. לאור חלל זה, קבוצות וסדנאות שונות פרסמו סקירות טכניות והמלצות שיצרנים וארגוני מחקר קבלניים ביקשו לעקוב אחריהם18,19,20,21,22,23,24,25. רוב ההמלצות הללו נכתבות במיוחד תוך התחשבות במבחני qPCR, עם הצעות או שינויים לפלטפורמות מתפתחות, כגון PCR דיגיטלי טיפתי (ddPCR), הכלולות רק כרלוונטיות. המלצות עדכניות יותר התמקדו בשיקולים של בדיקות ddPCR, אך התמקדו בעיקר ביישומן לכימות גנום וקטורי בסביבת ייצור ולא במטריצות ביולוגיות מורכבות בהן נתקלים במחקרי ביושפידינג.
בהתאם ליישום קליני ומטרות, ddPCR עשוי להיות מועדף על פני qPCR לתמיכה במחקרי הפצה ביולוגית ונשירה בשל הרגישות המוגברת של ddPCR ויכולתו להתמודד עם הפרעות מטריצה בהשוואה ל- qPCR. יתר על כן, בשל חלוקת הדגימות לכ-20,000 טיפות, ניתן להשיג כימות מדויק של מספר ההעתקה ללא שימוש בעקומה סטנדרטית באמצעות סטטיסטיקת פואסון, דבר המפשט את פיתוח השיטה ותיקוףה. מטרת פרוטוקול זה היא לתאר גישה סטנדרטית לפיתוח ותיקוף של שיטה מבוססת ddPCR לזיהוי וקטורי AAV בדמעות שנאספו מפני השטח של העין לתמיכה במחקרים קליניים של נשירה ביולוגית.
Protocol
1. הכנת מקטע DNA סינתטי
- תכננו והזמינו מקטע DNA סינתטי המכיל את אזור הגברה המטרה לשימוש כבקרת איכות.
- ודא שהרצף מכיל את כל רצף האמפליקון מהפריימר הקדמי לפריימר ההפוך של גן המטרה המעניין, עם הרחבה של ארבעה עד שישה זוגות בסיסים של רצף בקצוות 5' של כל רצף קשירת פריימר.
- הימנעו מהומופולימרים של אדנין ותימין הגדולים מ-12 זוגות בסיסים או זוגות בסיסים של גואנין וציטוזין הגדולים משמונה זוגות בסיסים, שכן הומופולימרים ארוכים עלולים להפריע לסינתזה של מקטע הגן.
הערה: אם אמפליקונים מכילים רצפים כאלה, ניתן לבצע החלפות בסיס כל עוד אתרי החישול של הפריימרים והגשושיות נשמרים. - לחלופין, הכינו פלסמיד ליניארי המכיל את האמפליקון באמצעות אסטרטגיות שיבוט טיפוסיות.
- צנטריפוגה הצינור המכיל את מקטע ה- DNA הסינתטי במיקרוצנטריפוגה למשך ~ 10 שניות כדי להבטיח שהחומר נאסף בתחתית הצינור.
- השהה מחדש את מקטע הדנ"א הסינתטי באמצעות מאגר tris-EDTA (TE) לריכוז של 1.0 ×10 10 עותקים/μL, או לפי הצורך בהתבסס על טווח בדיקת המטרה.
- מערבול לזמן קצר, ולאחר מכן לדגור ב 50 ° C במשך 20 ± 5 דקות. מצננים על קרח.
- הכינו אליציטוטים מרובים, רצוי לשימוש חד-פעמי ואחסנו בטמפרטורה של -70 עד -90°C עד לשימוש.
הערה: מקטעי DNA סינתטיים שהוכנו באופן זה יציבים בדרך כלל למשך 24 חודשים לפחות מתאריך ההשעיה. - אם תרצה, קבע את הריכוז המדויק של מלאי הדנ"א הסינתטי המוכן לפני השימוש כבקרת איכות, או הערך את הריכוז הנומינלי בהתבסס על התרחיף שבו נעשה שימוש.
2. הכנת פריימרים ובדיקה
- תכנן וסדר פריימרים וגשושית הידרוליזה כדי להתמקד באזור ההגברה הרצוי באמצעות אסטרטגיות תכנון טיפוסיות26,27.
- השתמש בצבע כתב פלואורסצנטי 5' (למשל, FAM) ומרווה 3' (למשל, איווה שחור כהה מרווה) תואם למערכת ddPCR.
הערה: קיימות חבילות תוכנה רבות לתכנון מבחני PCR, וניתן להשתמש בכל אחת מהן. לדוגמה, Primer-BLAST של המרכז הלאומי למידע ביוטכנולוגי28 נמצא בשימוש נרחב בשל האפשרויות החזקות לתכנון בדיקות והקלות שבה ניתן להעריך ביואינפורמטיות ספציפיות כדי לזהות השפעות אפשריות מחוץ למטרה. יש לציין כי הכנת פריימרים ובדיקות עשויה להשתנות מהשלבים המפורטים כאן בהתאם לפורמט שבו הם מסופקים.
- השתמש בצבע כתב פלואורסצנטי 5' (למשל, FAM) ומרווה 3' (למשל, איווה שחור כהה מרווה) תואם למערכת ddPCR.
- צנטריפוגה את הצינורות המכילים את הפריימר הקדמי, פריימר הפוך ובדיקה במיקרוצנטריפוגה במשך ~ 10 שניות לחומר גלולה לתחתית הצינור.
- השהה מחדש את הפריימרים ל-20 מיקרומטר באמצעות מאגר TE. מערבולת בקצרה.
- השהה מחדש את הגשושית ל- 10 מיקרומטר באמצעות מאגר TE. מערבולת בקצרה.
- הכינו אליציטוטים מרובים, רצוי לשימוש חד-פעמי ואחסנו בטמפרטורה מינימלית של -20°C עד לשימוש.
הערה: פריימרים ובדיקות שהוכנו באופן זה יציבים בדרך כלל למשך 24 חודשים לפחות מתאריך ההשעיה.
3. הכנת חיץ דילול דגימה
- הפשירו את מאגר ה-PCR ואת ה-DNA של זרע סלמון גזוז בטמפרטורת החדר. מערבלים היטב כדי לערבב.
- הכינו מאגר דילול מדגם, לפי טבלה 1.
- מערבולת ביסודיות. יש לאחסן בטמפרטורה של 2-8 מעלות צלזיוס למשך עד חודש לאחר ההכנה.
טבלה 1: הכנת חיץ דילול דגימה. אנא לחץ כאן כדי להוריד טבלה זו.
4. הכנת תערובת הורים
- הפשירו את תערובת המאסטר ddPCR עבור בדיקות, פריימר קדמי, פריימר הפוך ובדיקה בטמפרטורת החדר ואפשרו להתחמם לפחות 10 דקות לאחר ההפשרה לפני השימוש. יש לאחסן בטמפרטורת החדר עד לשימוש.
הערה: ריאגנטים אלה חייבים להיות מובאים במלואם לטמפרטורת החדר כדי להבטיח היווצרות טיפות יעילה. אין להחזיק ריאגנטים על קרח במהלך ההכנה.- מערבולת ביסודיות ובקצרה צנטריפוגה במיני צנטריפוגה לפני השימוש.
הערה: אנזימי הגבלה מסופקים בדרך כלל בגליצרול ויש להסירם מהאחסון מיד לפני השימוש. מערבבים בעדינות. אין לערבל.
- מערבולת ביסודיות ובקצרה צנטריפוגה במיני צנטריפוגה לפני השימוש.
- הכינו תמהיל מאסטר PCR לכל יעד הגברה. ראה טבלה 2 להרכב תערובת מאסטר PCR מוצע ושנה את ריכוזי הפריימרים והבדיקות לפי הצורך.
- מערבולת יסודית וצנטריפוגה קצרה לפני הוספת אנזים הגבלה. מוסיפים את אנזים ההגבלה והופכים כדי לערבב.
הערה: בשלב זה, 22 μL של תגובת PCR נדרש כדי לקבל נפח סופי של 40 μL של תגובת PCR לאחר היווצרות טיפות (המורכב מ 15 μL של תערובת מאסטר PCR, 5.0 μL של תבנית, ו 20 μL של שמן יצירת טיפות).
- מערבולת יסודית וצנטריפוגה קצרה לפני הוספת אנזים הגבלה. מוסיפים את אנזים ההגבלה והופכים כדי לערבב.
- הוסיפו 16.5 מיקרוליטר תערובת מאסטר לכל באר בהתאם למפת הלוחות. ראו איור 1 מפת לוחות לדוגמה לקבלת דיוק אימות והפעלה מדויקת.
- ודא שהצלחת מכילה שלושה תכשירים עצמאיים מסדרת בקרת האיכות (QC), שלושה אליציטוטים של דמעות אנדוגניות שנבדקו באופן עצמאי שנבדקו, דוקרנים לרמה גבוהה ונמוכה ולא דוקרנים, ושלושה בקרות עצמאיות ללא תבנית (NTC).
- שנו את הפריסה של בארות אלה על פני הצלחת, כאשר סט 1 נטען לפי סדר של ריכוז יורד, סט 2 נטען לפי סדר של ריכוז עולה, וקבוצה 3 נטענת בסדר אקראי כדי להעריך אם יש השפעות ספציפיות למיקום הצלחת.
- ארגן את הדגימות כך שימלאו כמה שיותר עמודות ומלא בארות שאינן בשימוש בתוך עמודה עם מאגר בקרה. כלול מספר מגרשי בקרה אנדוגניים (למשל, יותר בריכות של דמעות או דמעות שנאספו מאנשים) בבארות הנותרות, אם תרצה בכך.
- אוטמים את הצלחת בסרט דבק שקוף. החזיקו את הצלחת בטמפרטורת החדר במהלך הכנת התבנית. לחלופין, החזיקו את הצלחת עד 4 שעות בטמפרטורה של 2-8 מעלות צלזיוס, אך החזירו אותה לטמפרטורת החדר למשך 10 דקות לפחות לפני הוספת התבנית.
טבלה 2: דוגמה להכנת תערובת מאסטר PCR. אנא לחץ כאן כדי להוריד טבלה זו.
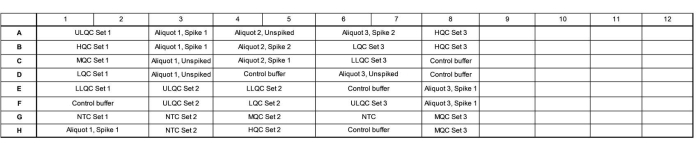
איור 1: מפת לוחות לדוגמה עבור דיוק אימות והפעלה מדויקת. קיצורים: ULQC = בקרת איכות גבול עליון; HQC = בקרת איכות גבוהה; MQC = בקרת איכות בינונית; LQC = בקרת איכות נמוכה; LLQC = בקרת איכות גבול תחתון; NTC = ללא פקד תבנית. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
5. הכנת QCs
- הפשירו מקטעי DNA סינתטיים או פלסמידים ליניאריים בטמפרטורת החדר ואפשרו להם להתחמם לפחות 10 דקות לאחר ההפשרה לפני השימוש. הביאו את התבניות לטמפרטורת החדר כדי להבטיח היווצרות טיפות יעילה.
- יש לאחסן בטמפרטורת החדר עד לשימוש. מערבולת ביסודיות ובקצרה צנטריפוגה במיני צנטריפוגה לפני השימוש.
- הכינו דילולי QC תוך שימוש במאגר דילול הדגימה כמדלל. דוגמה לריכוזים המומלצים להכנה לדיוק ודיוק מובאת בטבלה 3.
הערה: לאחר סיום מוצלח של ריצות דיוק ודיוק, יש להפעיל רק את בקרת האיכות הגבוהה (HQC), בקרת האיכות הבינונית (MQC) ובקרת האיכות הנמוכה (LQC) בכל לוחית. עבור דיוק וריצות מדויקות, לפחות שלושה דילולים עצמאיים של QC כלולים להערכת דיוק ודיוק תוך כדי בדיקה. לאחר ריצות מדויקות ומדויקות, יש לכלול סדרת דילול אחת בלבד. - לאחר ההכנה, מאחסנים את הדילולים בטמפרטורת החדר עד להוספה לצלחת.
- יש לאחסן את הדילולים על קרח או בטמפרטורה של 2-8 מעלות צלזיוס במידת הצורך. לפני השימוש הבא, יש לאפשר לדילול להתחמם לטמפרטורת החדר למשך 10 דקות לפחות לפני השימוש. השליכו את ה-QC בסוף היום.
טבלה 3: הכנת בקרת איכות לדוגמה (QC) באמצעות מקטעי דנ"א סינתטיים דו-גדיליים. קיצורים: ULQC = בקרת איכות גבול עליון; HQC = בקרת איכות גבוהה; MQC = בקרת איכות בינונית; LQC = בקרת איכות נמוכה; LLQC = בקרת איכות גבול תחתון; NTC = ללא פקד תבנית. אנא לחץ כאן כדי להוריד טבלה זו.
6. הכנת דגימות
- יש להפשיר דגימות דמעות שנאספו מניסוי קליני בטמפרטורת החדר עד להפשרה ולאפשר להן להתחמם לפחות 10 דקות לאחר ההפשרה לפני השימוש.
- יש לאחסן בטמפרטורת החדר עד לשימוש. מערבולת ביסודיות ובקצרה צנטריפוגה במיקרו צנטריפוגה לפני השימוש.
- יש לדלל דגימות דמעות ביחס 1:10 (ומעלה) באמצעות מאגר דילול הדגימה כמדלל לצינורות PCR של 0.2 מ"ל או לרצועות PCR של 8 בארות. אטמו את הצינורות.
הערה: בהתאם לריכוז המטרה הצפוי בדמעות, ייתכן שיהיה צורך לדלל עוד יותר את הדגימות או לבדוק דילולים מרובים של כל דגימה. - חממו את הדגימות במחזור תרמי בטמפרטורה של 95°C למשך 10 דקות, ולאחר מכן החזיקו בטמפרטורה של 4°C למשך 5 דקות לפחות כדי להתקרר. יש להשתמש בקצב רמפה של 3°C/s.
הערה: דגימות עשויות להישאר במחזור התרמי ב -4 ° C עד לשימוש באותו יום או להיות קפוא ב -70 עד -90 ° C לאחסון ארוך יותר. שלב זה משמש כדי denature capsid וקטורי, שחרור הגנום. מכיוון שמקטעי DNA סינתטיים QC או פלסמידים ליניאריים הם דו-גדיליים, הם לא צריכים לעבור את שלב החימום הזה. - מחזירים את הדגימות לאחר הקירור לטמפרטורת החדר (או אם הן קפואות, מפשירים בטמפרטורת החדר) ומניחים להן להתחמם לפחות 10 דקות.
הערה: יש להביא את הדגימות במלואן לטמפרטורת החדר כדי להבטיח היווצרות טיפות יעילה.
7. הוספת תבנית
- אחזר את צלחת ddPCR המכילה את תערובת המאסטר. מערבול כל דגימה או צינור דילול QC ביסודיות ובצנטריפוגה קצרה כדי לאסוף את החומר.
- הסר את סרט ההדבקה והוסף 5.5 μL של QC או דגימות לבארות מתאימות של צלחת 96 בארות, בהתאם למפת הלוחות.
הערה: עיין בשלב 4.2.1 לקבלת הסבר על אמצעי האחסון הדרושים - הוסף 5.5 μL של מאגר דילול דגימה לבארות NTC.
- יצירת טיפות דורשת שלכל הבארות של עמוד תהיה תגובה או בקרת חיץ. אם בארות כלשהן של עמודה אינן מכילות תגובות דגימה, דלל 2x ddPCR בקרת חיץ 1:2 באמצעות מים נטולי נוקלאז. הוסף 22 μL של בקרת חיץ ddPCR 1x לכל בארות ריקות של עמודה.
הערה: אם לא נעשה שימוש בטור שלם, אין צורך להוסיף בקרת חיץ לבארות אלה. - מוסיפים אטם נייר כסף מנוקב לצלחת. מניחים את הצלחת באטם הצלחת ואוטמים למשך 5 שניות ב-180°C.
- לחלופין, אטמו את הצלחת בהתאם להמלצות יצרן מערכת ddPCR.
- מערבלים את הצלחת במהירות מרבית למשך 30 שניות לפחות (באמצעות הגדרת מערבולות רציפות; אין להשתמש במערבולות מגע) וצנטריפוגות לזמן קצר בטוויית לוחות.
הערה: ערבוב יסודי ומלא של הצלחת בשלב זה הוא קריטי לחלוקה נכונה של תגובת ה-PCR לטיפות. ודא שאין בועות גלויות בבארות. במידת הצורך, ניתן להחזיק את הצלחת בטמפרטורה של 2-8 מעלות צלזיוס לפני יצירת הטיפות למשך 4 שעות לכל היותר. אם מחזיקים מעמד, מניחים לצלחת להגיע לטמפרטורת החדר למשך 10 דקות לפחות לפני יצירת הטיפות.
8. יצירת טיפות אוטומטית, מחזור תרמי וקריאת טיפות
- צור טיפות במחולל הטיפות האוטומטי באופן הבא.
- במסך המגע, בחר את העמודות במפת הלוחות המכילות דוגמאות. הסיפון של המכשיר יואר כדי לציין אילו חומרים מתכלים (מחסניות DG32, טיפים, מיכל פסולת, שמן ייצור טיפות) נדרשים. אורות צהובים מציינים כי יש צורך להוסיף מתכלה, בעוד אורות ירוקים מצביעים על מספיק חומרים מתכלים זמינים.
- טען את מחולל הטיפות מאחור לחזית.
- עבור בדיקות הידרוליזה, ודא כי שמן הדור טיפות עבור בדיקות מותקן מספיק שמן למספר בארות נשאר. אם נעשה שימוש בכימיה חלופית של PCR, ודא כי מותקן שמן תואם לייצור טיפות.
- מניחים גוש קר במחזיק צלחת הטיפה. ודא שהבלוק בצבע כחול מלא ולא נראה ורוד. מניחים צלחת ddPCR חדשה של 96 בארות בבלוק הקר.
- הניחו את צלחת ה-PCR המוכנה במחזיק צלחת הדגימה. סגור את מכסה המכונה. לחץ על התחל ליצירת טיפות.
- לאחר היווצרות טיפות, סך של 40 μL לכל תגובה מועבר אוטומטית ללוח PCR החדש.
- תוך 30 דקות לאחר השלמת יצירת הטיפות, הסר את הצלחת המכילה את הטיפות מהגוש הקר. עבדו בעדינות מכיוון שהטיפות שבריריות ביותר בשלב זה.
- מוסיפים אטם נייר כסף מנוקב לצלחת. מניחים את הצלחת באטם הצלחת ואוטמים למשך 5 שניות ב-180°C.
- לחלופין, אטמו את הצלחת בהתאם להמלצות יצרן מערכת ddPCR.
- מניחים את הצלחת במחזור תרמי תואם. הזן את תנאי הרכיבה (ראה טבלה 4).
- לאחר סיום המחזור התרמי, החזק את הצלחת במחזור התרמי, מועבר ל 2-8 מעלות צלזיוס, או קרא אותו מיד.
הערה: החזקת הצלחת למשך 12 שעות בטמפרטורה של 4-12 מעלות צלזיוס עשויה לשפר את ספירת הטיפות, אך הדבר אינו נדרש. יש להשיג מספיק טיפות ללא ההחזקה. - טען את הצלחת לתוך קורא הטיפות, להבטיח שיישאר מספיק שמן קורא ולמיכל האשפה יש מספיק מקום. קרא את הטיפות. בצע קריאת טיפות תוך 24 שעות מתחילת המחזור התרמי.
טבלה 4: תנאי מחזור תרמי אופייניים. אנא לחץ כאן כדי להוריד טבלה זו.
9. ניתוח נתונים
הערה: מינימום של 10,000 טיפות לבאר נחוץ לחישוב נכון של ריכוז באמצעות סטטיסטיקה פואסון. אל תנסו לנתח בארות עם פחות מ-10,000 טיפות.
- נדרש סף כדי להגדיר את הטיפות כחיוביות או שליליות. תוכנת ניתוח ddPCR מחילה באופן אוטומטי סף שעשוי להשתנות בין בארות. עם זאת, הגדר ידנית סף לכל בארות הצלחת מעט מעל עוצמת הפלואורסצנט של בארות NTC לקבלת תוצאות עקביות, מדויקות ומדויקות יותר.
הערה: מיקום נכון של הסף עשוי לדרוש אופטימיזציה בהתאם להפרדת הטיפות החיוביות והשליליות וכמה גשם טיפות קיים (ראה איור 2). בדוגמה זו, גרף משרעת הטיפות מציג בארות לדוגמה בכל רמת QC ו- NTC. הקו הסגול מצביע על סף של 1,000, מעט מעל אוכלוסיית הטיפות השלילית. - מודלים סטטיסטיים של פואסון דורשים לפחות שלוש טיפות חיוביות כדי לחשב את הריכוז בביטחון של 95%. ניקח בחשבון את כל הבארות המכילות אפס, טיפה חיובית אחת או שתיים כשליליות והוגדרו לריכוז של אפס27.
- חשב לאחור את מספר העותק בכל דגימת קרע.
- הריכוז, בעותקים/μL, מסופק בדוח הנתונים. השתמש בערך זה כדי לקבוע את הריכוז בעותקים/μL של הדגימה המקורית (כלומר, בדגימת הדמעה).
- כדי לחשב את דילול תגובת ddPCR, חלק את נפח תגובת ה- PCR הראשונית לפני היווצרות הטיפות בנפח התבנית שנוספה. כאשר משתמשים באמצעי האחסון המוצגים בשיטה זו, הדבר מניב ערך של 4.
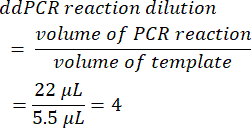
- קבע את גורם הדילול הטורי מהמדגם המקורי (שלב 6.2).
- כדי לקבוע את העותקים/μL בדגימה, הכפל את העותקים/μL בדילול תגובת ddPCR, ולאחר מכן בגורם הדילול הטורי. לדוגמה, הריכוז בעותקים/μL שנוצר בדו"ח הנתונים היה 966; 5.5 μL של תבנית נוסף לכל 22 μL של תגובה. נעשה שימוש בדילול סדרתי בקנ"מ 1:50,000 של הדגימה.
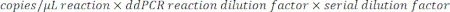
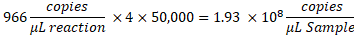
- אם נבדקו דילולים מרובים של אותו מדגם, נתח את כל הדילולים התקפים בטווח וחשב את הממוצע.
- עבור כל QC, חשב את העותקים הצפויים / תגובת PCR μL על ידי חלוקת ריכוז דילול QC נתון (בעותקים/μL) בנפח תגובת ddPCR (20 μL). הדבר מאפשר השוואה ישירה של ערך נומינלי זה לערך העותקים/μL שסופק בדוח הנתונים ללא חישובים נוספים.
הערה: גישה זו שימשה גם לניתוח דגימות הדמעות הקוצניות ששימשו בתוצאות המייצגות. - קבע את הערך הממוצע, סטיית התקן, מקדם השונות (%CV) ואחוז השגיאה היחסית לריכוז הנומינלי (%RE) של הדגימה או ערך QC באמצעות הבארות המשוכפלות (כלול דילולים מרובים אם רלוונטי).
- להערכת דיוק בין-באר, קבע זאת עבור כל אחת מכפילויות הבאר, אם נכללות.
- להערכת הדיוק והדיוק של תוך הבדיקה, קבע זאת עבור כל סדרת דילול או aliquot המשמשים בתוך אצווה.
- להערכת הדיוק והדיוק בין המבחנים, קבע זאת באמצעות אמצעי התוך-בדיקה של כל אחת מהאצוות הכלולות.
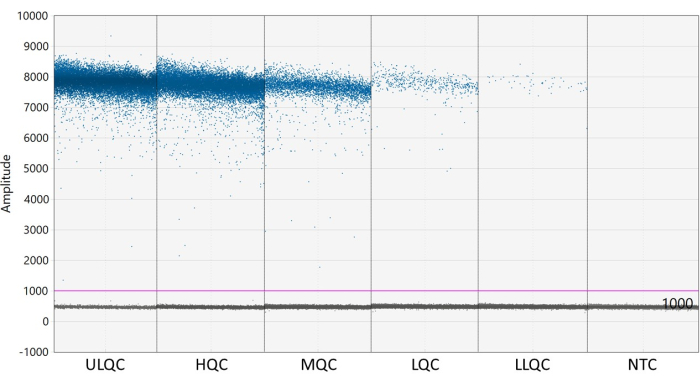
איור 2: דוגמה לקביעת סף. קיצורים: ULQC = בקרת איכות גבול עליון; HQC = בקרת איכות גבוהה; MQC = בקרת איכות בינונית; LQC = בקרת איכות נמוכה; LLQC = בקרת איכות גבול תחתון; NTC = ללא פקד תבנית. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
10. תנאי קבלה למבחן
- השתמש במפרטים הבאים לנתונים המחושבים עבור כל אצווה כדי לקבוע אם האצווה מקובלת. אם תנאים אלה אינם מתקיימים, בטל את תוקף האצווה וחזור עליה.
הערה: קריטריונים אלה נקבעו כקונצנזוס מסקירות טכניות שפורסמו בנושא אימות בדיקה מבוסס PCR 18,19,20,21,22,23,24,25. ייתכן שיהיה צורך לשנות את קריטריוני היעד בהתאם ליישום קליני. - ללא פקד תבנית (NTC)
- ודא שבכל באר NTC יש לפחות 10,000 טיפות.
- ודא כי כל באר NTC יש פחות מ 3 טיפות חיוביות.
- QC וטווח בדיקות
- ודא כי כל באר QC יש לפחות 10,000 טיפות.
- ודא כי הדיוק של בארות משוכפלות של ריכוז QC הוא ≤25.0% CV, למעט בגבול העליון והתחתון של כימות, שם ≤30.0% מקובל. הערך זאת באופן עצמאי עבור כל ערכת QC ורמת ריכוז.
- ודא שהשגיאה היחסית של הריכוז המחושב לאחור בכל רמת QC ממוצעת היא בטווח של ±25.0% RE מהריכוז הנומינלי (עותקים/תגובת PCR), למעט בגבול העליון והתחתון של הכימות, שם ±30.0% RE מקובל. הערך זאת באופן עצמאי עבור כל ערכת QC ורמת ריכוז.
- ודא שלפחות 2/3 מדגימות ה- QC (למשל, ארבע מתוך שש תוצאות) ו- 50% מדגימות ה- QC בכל רמה (נמוכה, בינונית, גבוהה) עומדות בהנחיות אלה.
- דגימות
- ודא כי בארות הדגימה לניתוח יש לפחות 10,000 טיפות.
- ודא כי הדיוק של בארות משוכפלות של דילול מדגם לניתוח הוא ≤25.0% CV.
- ודא שלפחות דילול כלול אחד של הדגימה הנתונה נמצא בטווח הכימות המוגדר של הבדיקה, כפי שהוגדר לעיל בהתבסס על QC הגבול העליון והתחתון.
- אם כל הדילולים הכלולים מניבים תוצאות גדולות מהגבול העליון המוגדר של הכימות, ואם נותר נפח מדגם מספיק, חזור על הבדיקה באמצעות דילול גבוה יותר של הדגימה.
- אם כל הדילולים הכלולים מניבים תוצאה נמוכה מהגבול התחתון של הכימות, ואם נותר נפח מדגם מספיק, חזור על הבדיקה באמצעות דילול נמוך יותר של המדגם.
הערה: דגימות המכילות יותר משלוש טיפות חיוביות, אך יש להן ריכוז מתחת לגבול התחתון של הכימות, יכולות להיות מתוארות כניתנות לזיהוי, אך לא ניתנות לכימות.
תוצאות
למטרות הדגמה, פותחה בדיקה שנועדה לזהות וקטור AAV2 בעל חלבון פלואורסצנטי ירוק משופר (eGFP), עם מקטע DNA סינתטי דו-גדילי המכיל eGFP כבקרת איכות. נכון לעכשיו, יש ויכוח מתמשך האם הווקטור עצמו או מקטע DNA סינתטי או פלסמיד ליניארי הוא המתאים ביותר לשימוש כמו QC. באופן כללי, ניתן להשתמש במקטע DNA סינתטי או פלסמיד ליניארי אם מודגמת שקילות לווקטור בפיתוח השיטה (הנתונים אינם מוצגים). פריימרים וגשושיות תוכננו ועברו אופטימיזציה לזיהוי טרנסגן eGFP. עיין בטבלה משלימה S1 עבור הרצפים המשמשים בעבודה זו. ריכוז מלאי שברי QC נקבע אמפירית באמצעות ddPCR. כל הבדיקות בוצעו תוך שימוש בריכוזים ובתנאי PCR שניתנו כדוגמאות בסעיף הפרוטוקול.
עבור בדיקות qPCR, מומלץ להעריך את הלינאריות, הרגישות, הטווח הדינמי, הדיוק והדיוק של העקומה הסטנדרטית. מכיוון ש- ddPCR אינו מסתמך על עקומה סטנדרטית לכימות היעד, יש לשנות המלצות אלה. במקום זאת, QCs המורכבים ממקטעי DNA סינתטיים דו-גדיליים המדוללים לריכוזים שונים כדי להתפרש על הטווח הצפוי לכימות של תגובת ddPCR בהתבסס על המידול הסטטיסטי של פואסון שימשו 29,30,31,32 כדי להגדיר את הטווח הדינמי והרגישות ולהעריך דיוק ודיוק. הבחירה בריכוזי QC התבססה בעיקר על היחס הצפוי בין טיפות חיוביות לסך כל הטיפות בתוך באר בריכוז נתון. מבחינה מתמטית, ddPCR הוא תיאורטית המדויק ביותר כאשר כ -80% מהמחיצות מגבירות באופן חיובי. ככל שהיחס החיובי לסך הטיפות עולה מעל 0.8, הדיוק יורד עקב הרוויה של המחיצות, כאשר כימות אינו אפשרי ברגע ש-100% מהטיפות חיוביות. בקצה הנמוך, תיאורטית, ניתן לזהות ולכמת טיפה חיובית אחת בלבד, אם כי הדיוק גרוע יותר והבדיקה כפופה לתוצאות חיוביות שגויות ברמה נמוכה. בדרך כלל, לפחות שלוש טיפות חייבות להיות חיוביות כדי שתוצאה תחושב בביטחון של 95%, שהוא הסף לחישוב ריכוז שבו השתמשנו כאן.
הוכנה סדרה של חמישה ריכוזי QC שונים, כאשר מספר העתק היעד / נפחי תגובת PCR μL חושבו צפויים להניב יחס חיובי לסך הטיפות המשתרע על פני הטווח הניתן לכימות של ddPCR, כפי שמוצג בטבלה 5. אלה שימשו להערכת הדיוק והדיוק של הבדיקה. בהערכה כאן, הגבולות העליונים והתחתונים של הכימות לא נדחקו למקסימום התיאורטי האפשרי ב- ddPCR. כימות מדויק עשוי להיות אפשרי ברמות גבוהות ונמוכות יותר ממה שהודגם כאן. יש לפתח את הטווח בהתאם ליישומים במורד הזרם של שיטה זו.
בסך הכל הוכנו שלוש סדרות דילול עצמאיות של QC אלה במאגר דילול דגימה עבור כל אצווה כדי להעריך את הדיוק והדיוק תוך כדי בדיקה. נכללו בארות כפולות של כל דילול QC. כדי לדמות פרוטוקול אימות בפועל, בוצעו בסך הכל שש אצוות דיוק ודיוק על ידי אנליסטים מרובים במשך מספר ימים. התוצאות משש אצוות אלה נותחו כדי להגדיר את הדיוק והדיוק של השיטה תוך המבחן וכדי להגדיר את הטווח הדינמי של הבדיקה.
הביצועים בתוך הבדיקה הוערכו עבור כל אצווה בכל רמת QC. ציפינו שבכל בארות ה-QC וה-NTC יהיו לפחות 10,000 טיפות. נתון זה הושג ב-216 מתוך 216 בארות שנבדקו בכל שש האצוות, עם ספירת טיפות ממוצעת של 19,748 טיפות לבאר (טבלה 6). לאחר מכן, %CV בין בארות של כל קבוצה של בארות כפולות של כל QC היה צפוי להיות ≤25.0%, למעט QC הגבול העליון והתחתון, שם ≤30.0% היה צפוי. זה הושג בקבוצות של 90 מתוך 90 בארות שנבדקו בכל שש האצוות עבור QC, עם %CV ממוצע בין בארות של 3.9% בכל רמות ה- QC (טבלה 7). כל ה-QC הניבו יחס טיפתי ממוצע חיובי לסך כל הטווחים הצפויים שתוארו לעיל (טבלה 6).
בתוך כל אצווה חושבו הממוצע התוך-מבחני וסטיית התקן עבור כל אחת מנקודות סדרת הדילול שהוכנו באופן עצמאי, ואלה שימשו לחישוב ממוצע תוך-בדיקה עבור כל ריכוז בכל בדיקה. זה שימש כדי להעריך את הדיוק והדיוק של הבדיקה (טבלה 8). דיוק מתייחס לשונות בנתונים מעותקים משוכפלים של אותו מדגם הומוגני בתנאי בדיקה רגילים ומוערך על ידי חישוב %CV של האליציטוטים המרובים הכלולים. ציפינו ששלושת האליציטוטים שנבדקו בכל אצווה יניבו %CV תוך בדיקה ≤25.0%, למעט QC הגבול העליון והתחתון שבו ≤30.0% היה צפוי. זה הושג עבור כל חמש רמות QC בכל אחת מ -60 קבוצות (30 מתוך 30 ביצועים בסך הכל). באופן כללי, ניתן להשיג דיוק תוך מבחני גבוה יותר מקריטריוני היעד, עם ממוצע של %CV תוך בדיקה של 7.7% בכל רמות ה- QC. דיוק מתייחס לקרבת ההסכמה בין הערך שנקבע בניסוי לבין הערך הנקוב. זה מוערך על ידי חישוב אחוז השגיאה היחסית (%RE, או %Bias) בין הריכוזים המחושבים של כל QC לבין הריכוזים הנומינליים הצפויים באופן תיאורטי. היה צפוי כי הממוצע תוך המבחן של שלושת aliquots יהיה ±25.0% RE של הריכוז הנומינלי, למעט QC הגבול העליון והתחתון שבו ±30.0% היה צפוי. זה הושג עבור כל חמש רמות QC בכל אחת מ -60 קבוצות (30 מתוך 30 ביצועים בסך הכל). באופן כללי, ניתן להשיג דיוק תוך-מבחני גדול יותר מהיעד שלנו, עם ממוצע מוחלט של %RE בתוך הבדיקה של 4.2% בכל רמות ה-QC. בכל הביצועים של NTC (30 בסך הכל), לא ניתן היה לזהות טיפות חיוביות.
דיוק ודיוק בין בדיקות חושבו גם באמצעות הממוצע תוך כדי בדיקה של כל רמת QC בתוך כל אצווה. הדיוק בין הבדיקות היה צפוי להיות ≤25.0% CV, למעט QC הגבול העליון והתחתון שבו ≤30.0% היה צפוי. כמו כן, עבור דיוק בין מבחנים, ±25.0% RE היה צפוי, למעט QC הגבול העליון והתחתון שבו ±30.0% היה צפוי. נצפו דיוק ודיוק גבוהים משמעותית ממטרות אלה (לוח 9), עם דיוק בין הבדיקות הנע בין 4.0% ל-8.5% ודיוק מוחלט בין 1.0% ל-3.2%. באופן קולקטיבי, תוצאות אלה מראות כי שיטה זו יכולה להשיג דיוק ודיוק תוך ובין-מבחנים מספיקים היטב ביעדי התעשייה הנוכחיים. טווח דינמי של בדיקה זו של 2,500-2.5 עותקים לכל מיקרוליטר של תגובת PCR יכול להיות מוגדר על סמך תוצאות אלה, עם רגישות בדיקה כוללת של 2.5 עותקים לכל μL של תגובת PCR. כאמור, ייתכן שניתן יהיה לאמת טווחים דינמיים רחבים יותר.
לאחר מכן, היה צורך להעריך את דיוק הבדיקה ואת הדיוק בתוך מטריצת היעד - במקרה זה, דמעות. בדרך כלל, בדיקות מאומתות לפני תחילת מחקרים קליניים, כלומר דמעות שנאספו מחולים שטופלו בווקטורים לא צפויות להיות זמינות למטרות תיקוף. זה יכול להיווצר באופן מלאכותי על ידי זינוק וקטור המטרה AAV לתוך דמעות שנאספו מתורמים מתנדבים כדי ליצור QCs קוצים מטריצה. דמעות אנושיות מצטברות נאספו על ידי צד שלישי (BioIVT). לצורך הוכחת עיקרון, נעשה שימוש בווקטור AAV2 המבטא eGFP שנרכש ממקור מסחרי. ריכוז מלאי וקטור AAV2 נקבע אמפירית באמצעות ddPCR, ללא שימוש בשלב בידוד DNA, כמתואר בפרוטוקול זה. בכל ריצה, ה-AAV2 הוזנק באופן עצמאי לשלושת אליציטוטי הדמעות ברמה גבוהה (צפי לתגובת PCR של 1.41 x 103 עותקים/μL) ונמוכה (תגובת PCR של 28.2 עותקים / μL PCR). aliquots unspiked נכללו כבקרה כדי להדגים את הספציפיות של השיטה.
הביצועים בתוך הבדיקה הוערכו עבור כל אצווה בכל רמת ספייק. היה צפוי שבכל דגימות הדמעות יהיו לפחות 10,000 טיפות. זה הושג ב-108 מתוך 108 בארות שנבדקו בכל שש האצוות, עם מספר טיפות כולל ממוצע של 20,208 טיפות לבאר (טבלה 10). לאחר מכן, %CV בין בארות של כל קבוצה של בארות כפולות של כל QC היה צפוי להיות ≤25.0% עבור רמות הזינוק הגבוהות והנמוכות. נתון זה הושג ב-36 מתוך 36 קבוצות של בארות שנבדקו בכל שש האצוות עבור ה-QC, עם ממוצע של %CV בין בארות של 3.2% (טבלה 11).
בתוך כל אצווה חושבו הממוצע התוך-מבחני וסטיית התקן עבור כל אחד מדוקרנים הדמעות שהוכנו באופן עצמאי, ואלה שימשו לחישוב ממוצע תוך-בדיקה עבור כל ריכוז בכל בדיקה. זה שימש כדי להעריך את הדיוק והדיוק של הבדיקה במטריצה (טבלה 12). ציפינו ש%CV תוך כדי בדיקה יהיה ≤25.0% ורמות זינוק גבוהות ונמוכות. זה הושג בשש מתוך שש קבוצות עבור כל רמה. באופן כללי, ניתן להשיג דיוק תוך-מבחני גדול יותר במטריצה מאשר היעד, עם ממוצע תוך מבחן %CV של 3.7% ברמה הגבוהה ו-12.2% ברמה הנמוכה (סה"כ 8.0%). כמו כן, היה צפוי כי %RE בתוך המבחן יהיה ±25.0% בשתי רמות הזינוק. זה הושג בשש מתוך שש קבוצות עבור כל רמה. כמו כן, נמצא באופן כללי כי ניתן להשיג דיוק תוך-מבחני גבוה יותר במטריצה מאשר היעד, עם %RE מוחלט ממוצע תוך מבחני של 8.1% ברמה הנמוכה ו-11.3% ברמה הגבוהה (סה"כ 9.7%). עבור הבקרה ללא קוצים, לא ניתן היה לזהות אות eGFP באף אחד מהאליציטוטים (טבלה 12), מה שמדגים את הספציפיות של השיטה במטריצת הדמעות האנושית.
דיוק ודיוק בין בדיקות במטריצת דמעות חושבו גם הם באמצעות הממוצע התוך-מבחני של כל רמת ספייק בתוך כל אצווה. היה צפוי שהדיוק בין הבדיקות יהיה ≤25.0% קורות חיים, ועבור דיוק בין מבחנים, ציפינו ל±25.0% RE. נצפתה רמת דיוק ודיוק גבוהה משמעותית ממטרות אלה (לוח 13), עם דיוק בין-מבחני של 5.5% ברמה הגבוהה ו-7.1% ברמה הנמוכה, ודיוק מוחלט של 11.3% ברמה הגבוהה ו-8.1% ברמה הנמוכה. יחד, תוצאות אלה מדגימות את הדיוק, הדיוק והספציפיות של השיטה במטריצת דמעות.
טבלה 5: בקרות איכות המשמשות להגדרת הטווח הדינמי של הבדיקה. קיצורים: ULQC = בקרת איכות גבול עליון; HQC = בקרת איכות גבוהה; MQC = בקרת איכות בינונית; LQC = בקרת איכות נמוכה; LLQC = בקרת איכות גבול תחתון; NTC = ללא פקד תבנית. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 6: ספירת טיפות כוללת ויחס חיובי לסך הטיפות של בקרת איכות DNA סינתטי דו-גדילי ו-NTC. קיצורים: ULQC = בקרת איכות גבול עליון; HQC = בקרת איכות גבוהה; MQC = בקרת איכות בינונית; LQC = בקרת איכות נמוכה; LLQC = בקרת איכות גבול תחתון; NTC = ללא פקד תבנית. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 7: סטטיסטיקות QC בין בארות (יעדי העתקה/תגובת PCR μL). קיצורים: ULQC = בקרת איכות גבול עליון; HQC = בקרת איכות גבוהה; MQC = בקרת איכות בינונית; LQC = בקרת איכות נמוכה; LLQC = בקרת איכות גבול תחתון; NTC = ללא פקד תבנית. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 8: דיוק ודיוק תוך כדי בדיקה של QC (יעדי העתקה/תגובת PCR μL). קיצורים: ULQC = בקרת איכות גבול עליון; HQC = בקרת איכות גבוהה; MQC = בקרת איכות בינונית; LQC = בקרת איכות נמוכה; LLQC = בקרת איכות גבול תחתון; NTC = ללא פקד תבנית. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 9: דיוק ודיוק בין בדיקות של QC (מטרות העתקה/תגובת PCR μL). קיצורים: ULQC = בקרת איכות גבול עליון; HQC = בקרת איכות גבוהה; MQC = בקרת איכות בינונית; LQC = בקרת איכות נמוכה; LLQC = בקרת איכות גבול תחתון; NTC = ללא פקד תבנית. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 10: ספירת טיפות כוללת של דגימות דמעות. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 11: סטטיסטיקה בין בארות של דגימת דמעה (מטרות העתקה/תגובת PCR μL). אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 12: דיוק תוך בדיקה ודיוק של דגימות דמעות (מטרות העתקה/תגובת PCR μL). אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 13: דיוק ודיוק בין בדיקות של דגימות דמעות (מטרות העתקה/תגובת PCR μL). אנא לחץ כאן כדי להוריד טבלה זו.
טבלה משלימה S1: רצפים של פריימר, בדיקות ובקרת איכות DNA סינתטי דו-גדילי שנעשה בהם שימוש במחקר זה. אנא לחץ כאן כדי להוריד טבלה זו.
Discussion
ישנם מספר שלבים של פרוטוקול ddPCR שהם קריטיים לביצועים נאותים של הבדיקה. השלב הקריטי הראשון הוא תכנון ואופטימיזציה של פריימרים ובדיקה. באופן כללי, מומלץ להשתמש בכימיה מבוססת בדיקת הידרוליזה על פני כימיה מבוססת צבע (למשל, SYBR Green) בסביבה פרה-קלינית או קלינית בשל הספציפיות הגבוהה שלהם. בנוסף, בחירת יעד ההגברה היא קריטית. בדרך כלל, טרנסגן העניין של הווקטור ממוקד. עם זאת, בשלבים פרה-קליניים מוקדמים יותר או בווקטורים שבהם ייתכן שלא ניתן להבחין בין טרנסגן וקטורי לעומת דנ"א גנומי, ייתכן שיהיה נכון להשתמש במטרות וקטוריות סטנדרטיות. לדוגמה, ניתן לכוון לאזור החוזר הטרמינלי ההפוך, למקדם, לזנב פולי-A, או לצמתים הבין-מקטעים בין רכיבים וקטוריים אלה. בחירת המטרה תשתנה בהתאם לתכנון הווקטורי. פריימר qPCR מסורתי ואסטרטגיות תכנון בדיקה ותוכנה מתאימים בדרך כלל ל- ddPCR. יש לבחור פרמטרים של תכנון שצפויים להניב טמפרטורת חישול עקבית (לדוגמה, 60°C) כדי להפחית את כמות המיטוב הנדרשת. כמו כן, הומלץ לתכנן, להזמין ולהעריך לפחות שלוש קבוצות שונות עבור כל מטרה. לאחר מכן יש לבחור את הקבוצה שמראה את הספציפיות הגדולה ביותר (ללא הגברה בבאר הבקרה השלילית או במטריצה של דנ"א מטרה קשור) ואת הרגישות (כלומר, גבול הזיהוי)20.
אם יש יתרון ביכולת להעביר את הבדיקה בין qPCR ל- ddPCR, מומלץ לייעל תחילה את תנאי הבדיקה באמצעות qPCR, ולזהות תנאים לקבוצה שנבחרה המביאים ליעילות הגברה של 90%-110% עם R2 ≥ 0.98. עם זאת, ddPCR כשיטת נקודת קצה היא בדרך כלל פחות רגישה מאשר qPCR בשל שונות ביעילות הגברה. לכל הפחות, מומלץ להפעיל שיפוע טמפרטורה תרמי בשלב החישול/הרחבה כדי לכסות טמפרטורות מעל ומתחת לטמפרטורות החישול הצפויות ולהעריך את הפרדת משרעת הגשם והפלורסנט בין צבירי הטיפות השליליות והחיוביות כפונקציה של טמפרטורה. אם סביבת העבודה מאפשרת, מומלץ שיהיו תחנות עבודה ייעודיות נפרדות להכנת מיקס אב, הוספת תבנית והגברה. במידת האפשר, יש להפריד אותם פיזית על ידי זרימת עבודה חד-כיוונית עם בקרות הנדסיות מובנות, כגון גישה מבוקרת ולחצי אוויר דיפרנציאליים, כדי להפחית את הסיכון לזיהום צולב ולתוצאות חיוביות שגויות. אם הדבר אינו אפשרי, יש לנקוט משנה זהירות כדי למנוע זיהום צולב.
ישנם שני שלבים בפרוטוקול זה שעשויים להיראות יוצאי דופן למי שרגיל יותר לפיתוח בדיקת qPCR. הראשון הוא הכללת אנזים הגבלה בתמהיל המאסטר PCR. במהלך הגברה ddPCR, כל טיפה עוברת מחזור תרמי לנקודת הקצה. בבדיקה ממוטבת כראוי, התוצאה היא שתי אוכלוסיות של טיפות, קבוצה אחת מציגה רמה גבוהה באופן עקבי של אותות פלואורסצנטיים - החיוביים - וקבוצה אחרת מציגה באופן עקבי רמה נמוכה של אות פלואורסצנטי - השליליים. אם מתרחשת הפרעה ל-PCR, היא עלולה לבטל את הסנכרון של התחלת הגברה של PCR, וכתוצאה מכך הטיפה לא תגיע לרמת הגברה, ולכן נקודות קצה פלואורסצנטיות לא עקביות. במקרה זה, הטיפות יפוזרו בין השליליות לחיוביות, וכתוצאה מכך נוצרת תופעה הנקראת גשם ddPCR. זה יכול לגרום לכימות לא מדויק של היעד וליישום לא עקבי וסובייקטיבי של ערכי סף. המלצתנו לקבוע את הסף מעט מעל האות של NTC, מה שאמור למזער את השפעות הגשם בכימות הסופי מכיוון שכל הטיפות עדיין נחשבות חיוביות, גם אם לא מחזוריות לחלוטין לנקודת הקצה. ל-AAV יש מבנה משני מורכב ביותר, אשר בהתאם ליעד ההגברה, עלול להפחית את הנגישות לפריימרים ולבדיקות, וכתוצאה מכך הפרעות PCR ולכן גשם. הכללת אנזים ההגבלה בתערובת האב חותכת את המבנה המשני הזה כדי להגדיל את הגישה של הפריימרים והגשושיות, ומפחיתה את הגשם, מה שעשוי לשפר בכך את דיוק הבדיקה. ההשפעות של הכללת אנזים הגבלה בתגובת ddPCR תוארו בעבר25,32. ניתן להשתמש בכל אנזים הגבלה, כל עוד הוא מאושר שאינו חותך באזור הגברת המטרה. אין צורך בשלבי עיכול מקדים או בהרכבי חיץ חלופיים.
השלב החריג השני הוא הכנת דגימת הדמעות המכילה AAV. בפרוטוקול זה נעשה שימוש ביחס של 1:10 (או יותר) של דמעות ולאחר מכן הדגימה חומה. בדרך כלל, כאשר דמעות נאספות באמצעות צינור נימי, שהוא שיטת איסוף נפוצה, בממוצע כ 10.0 μL ניתן לאסוף33. הדילול מסייע לטפל בנפח הדגימה המוגבל ולספק מספיק חומר לבדיקת בארות כפולות. בעוד שזה מפחית את הגבול התיאורטי של זיהוי, הרגישות החזקה של ddPCR עדיין צריכה לגרום לזיהוי של כל למעט מספר קטן מאוד של חלקיקים וקטוריים. גישה זו גם יוצרת "גיבוי" היטב אם אחד מהם היה נכשל באופן בלתי צפוי. במקרה זה, או במקרים של נפח דגימה לא מספיק כדי להפעיל שתי בארות, שגיאת פואסון יכולה לשמש להערכת דיוק. יתר על כן, במקרים בהם הריכוז הוא מתחת לגבול הגילוי, זה יוצר הזדמנות למזג נתוני באר כדי לקבוע ריכוז. יש צורך לשחרר את וקטורי AAV מן capsids ויראלי עבור זיהוי ddPCR. כמה שיטות לכימות של AAV כללו שלב עיכול פרוטאינאז K כדי להסיר את הקפסיד הנגיפי34,35,36. לכל הסרוטיפים הטבעיים של AAV יש טמפרטורות התכה של כ -90 מעלות צלזיוס או פחות, כאשר רובם נופלים מתחת ל -80 מעלות צלזיוס; לכן, נראה שמדובר בהכללה מיותרת37. נראה כי חימום לבדו מספיק כדי לשחרר דנ"א וקטורי.
יתר על כן, ddPCR הוא בדרך כלל פחות רגיש מעכבי PCR שעשויים להיות נוכחים במדגם שעשוי להשפיע על בדיקת qPCR. אם שלב בידוד DNA ספציפי נכלל, זה ידרוש גם אימות ספציפי, אשר נמנע בפרוטוקול זה. הדגימות מדוללות לפני החימום עקב קינטיקה של דיפוזיה של הגנום הווקטורי בנוזל. במהלך תהליך החימום והקירור שלאחר מכן, גדילי החישה החיוביים והשליליים של גנום הדנ"א החד-גדילי יכולים להתלכד יחד וליצור מתווך דו-גדילי אם הריכוזים גבוהים מספיק. דילול לפני חימום מפחית את הריכוזים והופך את זה לבלתי סביר מבחינה מתמטית שמספיק מתווכים דו-גדיליים נוצרים כדי להשפיע לרעה על דיוק הכימות. יש לציין כי אסור שמקטעי DNA סינתטיים או פלסמידים ליניאריים המשמשים כבקרות איכות יעברו שלב חימום זה. מכיוון שמדובר בדו-גדילי, חימום יגרום להמרה למתווכים חד-גדיליים. לאחר חלוקה עצמאית של QC חד-גדילי אלה לטיפות, הדבר צפוי לגרום לעלייה כפולה בריכוז ה-QC ביחס לריכוז הנומינלי. לחלופין, אם רוצים לחמם QCs כדי לתקנן את השיטה, יש לקחת זאת בחשבון בבנייה מחדש ובהקצאה של ריכוז נומינלי.
לבסוף, בנוגע להכנת דגימות, פרוטוקולים רבים ממליצים גם על הכללת שלב טיפול DNase כדי להסיר כל DNA וקטורי לא קפסול. שלב זה הוא קריטי במקרים בהם לא רצוי לכמת DNA חופשי הקשור להכנת הווקטור (כגון במהלך כימות למטרות מינון). עם זאת, בהקשר של התפלגות ביולוגית ומחקרי ביו-שפיכה, בדרך כלל רוצים לדעת לאן עבר דנ"א וקטורי כלשהו, ללא קשר אם הוא עטוף או לא. לכן, מומלץ בדרך כלל לא לבצע שלב טיפול DNase במהלך מחקרים כאלה. אם נקבע כי יש צורך לכלול שלב DNase, שלב זה צריך להיות לפני דילול וחימום.
במאמר זה מוצגים נתונים המייצגים את הגישה להערכת הטווח הדינמי, הרגישות, הדיוק והדיוק של השיטה בהקשר של אימות מתאים למטרה ותואם לשיטות מעבדה טובות. היעדר ההנחיות הנוכחיות בנושא זה מותיר את מעבדות התיקוף לקבוע לעצמן קריטריונים לבדיקת יעדים, בהתאם לחשיבה הנוכחית בתעשייה. קבוצות שונות הציבו קריטריוני יעד גבוהים ונמוכים יותר מאלה ששימשו במחקר זה: 19,20,21,22,23,24,25. יש לבחור את קריטריוני בדיקת היעד, עד להגדרתם הנוקשה יותר, לפני התיקוף בהתבסס על היישומים הקליניים המיועדים של השיטה. בהתאם להחלטות במורד הזרם שיש לקבל על בסיס הנתונים, ייתכן שיהיה צורך ברמות גבוהות יותר של דיוק ודיוק. לעומת זאת, תוצאה חיובית לעומת שלילית פשוטה עשויה להספיק.
הגישה התייחסה גם להמלצות להערכת ספציפיות ואפקט מטריצה. שלולית של דמעות שנאספו מאנשים שלא טופלו לא הניבה תוצאה חיובית בבדיקה זו, בעוד שניתן היה לזהות את המטרה כאשר הווקטור נדקר לתוך הדמעות בריכוז גבוה ונמוך במסגרת שיעורי ההחלמה המומלצים. באופן אידיאלי, מטריצה המכילה וקטור אנדוגני (למשל, שנאספה בעקבות טיפול בווקטור נגיפי) תיכלל גם היא בהערכות אלה. עם זאת, אין זה סביר כי דגימות כאלה יהיו זמינות לשימוש בתיקוף. כדי להגביר את החוסן של התיקוף, ניתן להעריך בריכות מרובות של דמעות, או דמעות שנאספו ממגוון אנשים, כדי לקבוע אם מתרחש אפקט מטריצה ספציפי למטופל. לבסוף, מומלץ להעריך את היציבות. בתהליכי עבודה שבהם מיצוי דנ"א מתרחש מתוך המטריצה הביולוגית, ייתכן שיהיה צורך להעריך את יציבות הדגימה והדנ"א שחולץ. בתהליך עבודה זה, הדגימה נבדקת ישירות בבדיקה ללא צורך במיצוי DNA. לכן, בהתחשב בהערכת היציבות של שיטה זו, יש להעריך את יציבות דגימות הדמעות. בדרך כלל, מומלץ לבצע הערכות ספסל, מקרר, הקפאה/הפשרה ויציבות לטווח ארוך. אלה לא בוצעו במסגרת מחקר זה, אך ניתן להשתמש בשיטות שפותחו כאן בהערכה זו, לאחר מניפולציות לדגימות הקלט.
בסך הכל, שיטה זו הוכחה כבדיקה חזקה, חוזרת וניתנת לאימות לזיהוי וקטורים מבוססי AAV בדגימות דמעות. הוא עשוי לשמש כפלטפורמה להתאמה לווקטורים ספציפיים לתמיכה בניסויים קליניים ומספק בסיס לאימות של בדיקה העולה בקנה אחד עם שיטות מעבדה טובות.
Disclosures
כל המחברים הם עובדים של KCAS Bioanalytical and Biomarker Services, ארגון מחקר קבלני המספק שירותי פיתוח מקיפים התואמים ל-Good Laboratory Practices/Good Clinical Practices החל מתמיכה בגילוי מוקדם ועד לרישום מוצרים, כולל תמיכה בבדיקות מבוססות AAV, כמתואר בפרוטוקול זה. KCAS מימנה פרויקט זה ופרסום פרוטוקול זה. אמנם אין הנחיות עדכניות של ה- FDA לתכנון ותיקוף של הניסויים המוצגים במאמר זה, אך המומחים ומובילי הדעה המפתחים מחקרים כאלה ב- KCAS אימצו גישה זו כגישה הבסיסית. קריטריונים ופרמטרים נוספים נדונים על בסיס פרויקט אחר פרויקט ועשויים להיכלל על בסיס השימוש המיועד.
Acknowledgements
ברצוננו להודות לניק ראסל וברנדון מקייטן מ-Bio-Rad על הדיונים המועילים שלהם במהלך פיתוח שיטה זו.
Materials
| Name | Company | Catalog Number | Comments |
| AAV-eGFP Vector | Charles River Laboratories | RS-AAV2-FL | Lot AAV2-0720-FL, used as a proof of principle vector |
| AutoDG Droplet Digital PCR system | Bio-Rad | QX200 | Alternative ddPCR system may be used following manufacturer’s protocol. |
| AutoDG Oil for Probes | Bio-Rad | 1864110 | Or use material compatible with ddPCR system. |
| ddPCR Buffer Control for Probes | Bio-Rad | 1863052 | Or use material compatible with ddPCR system and PCR chemistry. |
| ddPCR Droplet Reader Oil | Bio-Rad | 1863004 | Or use material compatible with ddPCR system. |
| ddPCR Piercable Foil Seals | Bio-Rad | 1814040 | Or use material compatible with ddPCR system. |
| ddPCR Plates 96-Well, Semi-Skirted | Bio-Rad | 12001925 | Or use material compatible with ddPCR system. |
| ddPCR Supermix for Probes (no dUTP) | Bio-Rad | 1863023, 1863024, or 1863025 | Use master mix compatible with primers/probes and ddPCR system. |
| DG32 AutoDG Cartidges | Bio-Rad | 1864108 | Or use material compatible with ddPCR system. |
| Droplet Reader | Bio-Rad | QX200 | Alternative ddPCR system may be used following manufacturer’s protocol. |
| GeneAmp PCR Buffer | Applied Biosystems | N8080129 | N/A |
| Nuclease-Free Water | Ambion | AM9906 | N/A |
| PCR Plate Sealer | Bio-Rad | PX1 | Or use material compatible with ddPCR system. |
| Pipet Tips for AutoDG | Bio-Rad | 1864120 | Or use material compatible with ddPCR system. |
| Pluronic F-68 Non-ionic Surfactant | Gibco | 24040 | N/A |
| Primer and Hydrolysis Probes | Various | Various | Design based on target sequence using general approaches for primer/probe design. Select fluorphores and quenchers compatible with ddPCR system. |
| Restriction Enzyme | Various | Various | Varies with target amplification sequence. Use restriction enzyme that does not cut in the amplified sequence |
| Sheared salmon sperm DNA | ThermoFisher | AM9680 | N/A |
| Synthetic DNA gene fragment or linearized plasmid | Various | Various | Design a synthetic DNA fragment containing the target amplification region for use as a quality control |
| TE Buffer | Teknova | T0224 | Ensure prepared or purchases nuclease free. 10 mM Tris-HCl, 1.0 mM EDTA, pH=8.0 |
| Touch Thermal Cycler | Bio-Rad | C1000 | Or use material compatible with ddPCR system. |
References
- Sherkow, J. S., Zettler, P. J., Greeley, H. T. Is it 'gene therapy. Journal of Law and the Biosciences. 5 (3), 786-793 (2018).
- Ginn, S. L., Amaya, A. K., Alexander, I. E., Edelstein, M., Abedi, M. R. Gene therapy clinical trials worldwide to 2017: an update. The Journal of Gene Medicine. 20 (5), 3015 (2018).
- Ghosh, S., Brown, A. M., Jenkins, C., Campbell, K. Viral vector systems for gene therapy: a comprehensive literature review of progress and biosafety challenges. Applied Biosafety. 25 (1), 7-18 (2020).
- Gene, Cell, & RNA therapy landscape, Q4 2022 quarterly data report. American Society for Gene & Cell Therapy Available from: https://asgct.org/global/documents/asgct_citeline-q4-2022-report_final.aspx (2022)
- Approved Cellular and Gene Therapy Products. United States Food and Drug Administration Available from: https://www.fda.gov/vaccines-blood-biologics/cellular-gene-therapy-products/approved-cellular-and-gene-therapy-products (2022)
- Au, H. K. E., Isalan, M., Meilcarek, M. Gene therapy advances: a meta-analysis of AAV usage in clinical settings. Frontiers in Medicine. 8, 809118 (2022).
- Lundstrom, K. Viral vectors in gene therapy. Diseases. 6 (2), 42 (2018).
- Naso, M. F., Tomkowicz, B., Perry, W. L., Strohl, W. R. Adeno-associated virus (AAV) as a vector for gene therapy. BioDrugs. 31, 317-334 (2017).
- Russell, S., et al. Efficacy and safety of voretigene neparvovec (AAV2-hRPE65v2) in patients with RPE65-mediated inherited retinal dystrophy: a randomized, controlled, open-label, phase 3 trial. Lancet. 390 (10097), 849-860 (2017).
- Chemistry, manufacturing, and control (CMC) information for human gene therapy investigational new drugs (INDs). United States Food and Drug Administration Available from: https://www.fda.gov/regulatory-information/search-fda-guidance-documents/chemistry-manufacturing-and-control-cmc-information-human-gene-therapy-investigationsal-new-drug (2020)
- Long term follow-up after administration of human gene therapy products. United States Food and Drug Administration Available from: https://www.fda.gov/regulatory-information/search-fda-guidance-documents/long-term-follow-after-adminstration-human-gene-therapy-products (2020)
- Testing of retroviral vector-based human gene therapy products for replication competent retrovirus during product manufacture and patient follow-up. United States Food and Drug Administration Available from: https://www.fda.gov/regulatory-information/search-fda-guidance-documents/testing-retroviral-vector-based-human-gene-therapy-products-replication-competent-retrovirus-during (2020)
- Recommendations for microbial vectors used in gene therapy. United States Food and Drug Administration Available from: https://www.fda.gov/regulatory-information/search-fda-guidance-documents/recommendations-microbial-vectors-used-gene-therapy (2016)
- Multidisciplinary: gene therapy. European Medicines Agency Available from: https://www.europa.eu/en/human-regulatory-development/scientific-guidelines/multidisciplinary/multidisciplinary-gene-therapy (2023)
- Human gene therapy for retinal disorders. United States Food and Drug Administration Available from: https://www.fda.gov/regulatory-information/search-fda-guidance-documents/human-gene-therapy-retinal-disorders (2020)
- Design and analysis of shedding studies for virus or bacterial-based gene therapy and oncolytic products. United States Food and Drug Administration Available from: https://www.fda.gov/regulatory-information/search-fda-guidance-documents/design-and-analysis-shedding-studies-virus-or-bacteria-based-gene-therapy-and-oncolytic-products (2015)
- Guideline on the quality, non-clinical and clinical aspects of gene therapy medicinal products. European Medicines Agency Available from: https://www.ema.europa.eu/en/documents/scientific-guideline/guideline-quality-non-clinical-clinical-aspects-gene-therapy-medicinal-products_en.pdf (2018)
- Kaur, S. white paper on recent issues in bioanalysis: mass spec of proteins, extracellular vesicles, CRISPR, chiral assays, oligos; nanomedicines bioanalysis; ICH M10 section 7.1; non-liquid & rare matrices; regulatory inputs (part 1A - recommendations on endogenous compounds, small molecules, complex methods, regulated mass spec of large molecules, small molecule, PoC & part 1B - regulatory agencies' inputs on bioanalysis, biomarkers, immunogenicity, gene & cell therapy and vaccine). Bioanalysis. 14 (9), 505-580 (2022).
- Hays, A., Islam, R., Matys, K., Williams, D. Best practices in qPCR and qPCR validation in regulated bio analytical laboratories. The AAPS Journal. 24 (2), 36 (2022).
- Ma, H., Bell, K. N., Loker, R. N. qPCR and qRT-PCR analysis: Regulatory points to consider when conducting biodistribution and vector shedding studies. Molecular Therapy. Methods & Clinical Development. 17 (20), 152-168 (2020).
- Wissel, M. Recommendations on qPCR/ddPCR assay validation by GCC. Bioanalysis. 14 (12), 853-863 (2022).
- Expectations for biodistribution (BD) assessments for gene therapy (GT) products. International Pharmaceutical Regulators Programme Available from: https://admin.iprp.global/sites/default/files/2018-09/IPRP_GTWG_ReflectionPaper_BD_Final_2018_0713.pdf (2018)
- Pinheiro, L., Emslie, K. R. Basic concepts and validation of digital PCR measurements. Methods in Molecular Biology. 1768, 11-24 (2018).
- Tzonev, S. Fundamentals of counting statistics in digital PCR: I measured two target copies-what does it mean. Methods in Molecular Biology. 1768, 25-43 (2018).
- Prantner, A., Marr, D. Genome concentration, characterization, and integrity analysis of recombinant adeno-associated viral vectors using droplet digital PCR. PLoS One. 18, 0280242 (2023).
- Primer-BLAST. National Library of Medicine, National Center for Biotechnology Information Available from: https://www.ncbi.nim.nih.gov/tools/primer-blast/ (2023)
- Koressaar, T., Remm, M. Enhancements and modifications of primer design program Primer 3. Bioinformatics. 23 (10), 1289-1291 (2007).
- Ye, J. Primer-BLAST: A tool to design target-specific primers for polymerase chain reaction. BMC Bioinformatics. 13, 134 (2012).
- Droplet Digital PCR Application Guide. Bio-Rad Available from: https://www.bio-rad.com/webroot/we/pdf/lsr/literature/Bulletin_6407.pdf (2023)
- Qian, P. L., Sauzade, M., Brouzes, E. dPCR: A technology review. Sensors. 18 (4), 1271 (2018).
- Basu, A. Digital assays part I: portioning statistics and digital PCR. SLAS Technology. 22 (4), 369-386 (2017).
- Sanmiguel, J., Gao, G., Vandeberghe, L. H. Quantitative and digital droplet-based AAV genome titration. Methods in Molecular Biology. 1950, 51-83 (2019).
- Bachhuber, F., Huss, A., Senel, M., Tumani, H. Diagnostic biomarkers in tear fluid: from sampling to preanalytical processing. Scientific Reports. 11, 10064 (2021).
- Martinez-Fernandez de la Camara, C., McClements, M. E., MacLaren, R. E. Accurate quantification of AAV vector genomes by quantitative PCR. Genes. 12 (4), 601 (2021).
- Ai, J., Ibraheim, R., Tai, P. W. L., Gao, G. A scalable and accurate method for quantifying vector genomes of recombinant adeno-associated viruses in crude lysate. Human Gene TherapyMethods. 28 (3), 139-147 (2017).
- Dobnik, D., et al. Accurate quantification and characterization of adeno-associated viral vectors. Frontiers in Microbiology. 10, 1570 (2019).
- Bennett, A., et al. Thermal stability as a determinant of AAV serotype identity. Molecular Therapy Methods and Clinical Development. 6, 171-182 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved