שימוש בדימות STED של תאים חיים כדי להמחיש את מבנה העל של הממברנה הפנימית של המיטוכונדריה במודלים של תאים עצביים
In This Article
Summary
פרוטוקול זה מציג זרימת עבודה להתפשטות, התמיינות וצביעה של תאי SH-SY5Y בתרבית ותאי עצב ראשוניים בהיפוקמפוס של חולדה לצורך הדמיה וניתוח של מבנה אולטרה-מבנה מיטוכונדריאלי באמצעות מיקרוסקופ דלדול פליטה מגורה (STED).
Abstract
מיטוכונדריה ממלאים תפקידים חיוניים רבים בתא, כולל ייצור אנרגיה, ויסות הומאוסטזיס Ca2+ , ביוסינתזה של שומנים וייצור מיני חמצן תגובתי (ROS). תהליכים אלה בתיווך מיטוכונדריה לוקחים על עצמם תפקידים מיוחדים בנוירונים, תיאום חילוף החומרים האירובי כדי לענות על דרישות האנרגיה הגבוהות של תאים אלה, ויסות איתות Ca2+ , אספקת שומנים לצמיחה והתחדשות של אקסונים, וכוונון ייצור ROS להתפתחות ותפקוד עצביים. לכן, תפקוד לקוי של המיטוכונדריה הוא גורם מרכזי במחלות נוירודגנרטיביות. המבנה והתפקוד של המיטוכונדריה קשורים קשר בל יינתק. הממברנה הפנימית המורכבת מורפולוגית עם קפלים מבניים הנקראים cristae מכילה מערכות מולקולריות רבות המבצעות את תהליכי החתימה של המיטוכונדריה. המאפיינים האדריכליים של הממברנה הפנימית הם אולטרה-סטרוקטורליים ולכן קטנים מכדי שניתן יהיה לדמיין אותם במיקרוסקופ מסורתי מוגבל עקיפה. לפיכך, רוב התובנות על אולטרה-מבנה מיטוכונדריאלי הגיעו ממיקרוסקופ אלקטרונים על דגימות קבועות. עם זאת, טכנולוגיות מתפתחות במיקרוסקופ פלואורסצנטי ברזולוציית על מספקות כיום רזולוציה של עד עשרות ננומטרים, ומאפשרות הדמיה של תכונות אולטרה-מבניות בתאים חיים. הדמיה ברזולוציית על מציעה אפוא יכולת חסרת תקדים לצלם ישירות פרטים קטנים של מבנה המיטוכונדריה, התפלגות חלבונים ננומטרית ודינמיקה של קריסטה, ומספקת תובנות בסיסיות חדשות הקושרות מיטוכונדריה לבריאות האדם ולמחלות. פרוטוקול זה מציג את השימוש במיקרוסקופ ברזולוציית על של דלדול פליטה מגורה (STED) כדי להמחיש את מבנה העל של המיטוכונדריה של תאי נוירובלסטומה אנושיים חיים ונוירונים ראשוניים של חולדות. הליך זה מאורגן בחמישה חלקים: (1) גדילה והתמיינות של קו תאי SH-SY5Y, (2) בידוד, ציפוי וגדילה של נוירונים ראשוניים בהיפוקמפוס של חולדה, (3) נהלים להכתמת תאים עבור דימות STED חי, (4) הליכים לניסויי STED של תאים חיים באמצעות מיקרוסקופ STED לעיון, ו-(5) הדרכה לסגמנטציה ועיבוד תמונה באמצעות דוגמאות למדידה וכימות של תכונות מורפולוגיות של הממברנה הפנימית.
Introduction
מיטוכונדריה הם אברונים אאוקריוטים ממקור אנדוסימביוטי האחראים לוויסות מספר תהליכים תאיים מרכזיים, כולל חילוף חומרים מתווך וייצור ATP, הומאוסטזיס יונים, ביוסינתזה של שומנים ומוות תאי מתוכנת (אפופטוזיס). אברונים אלה מורכבים טופולוגית, ומכילים מערכת ממברנות כפולה שיוצרת תת-תאים מרובים1 (איור 1A). הממברנה המיטוכונדריאלית החיצונית (OMM) מתממשקת עם הציטוזול ויוצרת מגעים ישירים בין אברונים 2,3. הממברנה המיטוכונדריאלית הפנימית (IMM) היא קרום חוסך אנרגיה השומר על שיפועי יונים המאוחסנים בעיקר כפוטנציאל קרום חשמלי (ΔΨm) כדי להניע סינתזת ATP ותהליכים אחרים הדורשים אנרגיה 4,5. ה-IMM מחולק גם לקרום הגבול הפנימי (IBM), אשר מדוכא באופן הדוק ל-OMM, ולמבנים בולטים הנקראים cristae הקשורים על ידי קרום ה-cristae (CM). קרום זה תוחם את תא המטריצה הפנימי ביותר מהמרחב התוך-קריסטלי (ICS) ומהמרחב הבין-קרום (IMS).
למיטוכונדריה יש מורפולוגיה דינמית המבוססת על תהליכים מתמשכים ומאוזנים של ביקוע ואיחוי הנשלטים על ידי מכנואנזימים ממשפחת הדינמינים6. היתוך מאפשר קישוריות מוגברת ויצירת רשתות רשתיות, ואילו הביקוע מוביל לפיצול מיטוכונדריה ומאפשר הסרת מיטוכונדריה פגומה על ידי מיטופגיה7. המורפולוגיה של המיטוכונדריה משתנה לפי סוג הרקמה8 והשלב ההתפתחותי9 ומווסתת כדי לאפשר לתאים להסתגל לגורמים הכוללים צרכים אנרגטיים 10,11 וגורמי סטרס 12. תכונות מורפומטריות סטנדרטיות של מיטוכונדריה, כגון מידת היווצרות הרשת (מקושרת לעומת מקוטעת), היקף, שטח, נפח, אורך (יחס גובה-רוחב), מעוגלות ומידת הסתעפות, ניתנות למדידה ולכימות במיקרוסקופ אופטי סטנדרטי מכיוון שהגדלים של תכונות אלה גדולים מגבול העקיפה של האור (~200 ננומטר)13.
ארכיטקטורת Cristae מגדירה את המבנה הפנימי של המיטוכונדריה (איור 1B). ניתן לסווג באופן רחב את מגוון מורפולוגיות הקריסטות כשטוחות (למלריות או דיסקואידיות) או צינוריות-שלפוחיתיות14. כל ה-cristae מתחברים ב-IBM דרך מבנים צינוריים או דמויי חריצים המכונים צמתים cristae (CJs) שיכולים לשמש למידור ה-IMS מה-ICS וה-IBM מה-CM15. המורפולוגיה של Cristae מווסתת על ידי קומפלקסים חלבוניים מרכזיים של IMM, כולל (1) אתר המגע המיטוכונדריאלי ומערכת ארגון cristae (MICOS) השוכנת ב- CJs ומייצבת מגעי IMM-OMM 16, (2) ניוון אופטי 1 (OPA1) GTPase המווסת שיפוץ cristae17,18,19, ו- (3) F1FO ATP סינתאז היוצר מכלולים אוליגומריים מייצבים בקצות cristae (CTs)20, 21. בנוסף, ה- IMM מועשר בפוספוליפידים שאינם דו-שכבתיים, פוספטידיל-אתנולאמין וקרדיוליפין המייצבים את IMM22 המעוקל מאוד. כריסטות הן גם דינמיות, ומדגימות שינויים מורפולוגיים בתנאים שונים, כגון מצבים מטבוליים שונים 23,24, עם מצעי נשימה שונים 25, תחת רעב ועקה חמצונית 26,27, עם אפופטוזיס28,29, ועם הזדקנות 30. לאחרונה הוכח כי cristae יכול לעבור אירועי שיפוץ גדולים על ציר זמן של שניות, מדגיש את הטבע הדינמי שלהם31. ניתן לכמת מספר מאפיינים של cristae, כולל ממדים של מבנים בתוך cristae בודדים (למשל, רוחב CJ, אורך ורוחב cristae) ופרמטרים המקשרים crista בודדים למבנים אחרים (למשל, מרווח intra-cristae וזווית אירוע cristae ביחס ל- OMM)32. פרמטרים אלה של cristae הניתנים לכימות מראים מתאם ישיר עם פונקציה. לדוגמה, היקף ייצור ה-ATP במיטוכונדריה קשור באופן חיובי לשפע של cristae, מכומת כצפיפות cristae או מספר cristae מנורמל לתכונה אחרת (למשל, cristae לכל אזור OMM)33,34,35. מכיוון שמורפולוגיה של IMM מוגדרת על ידי תכונות ננומטריות, היא כוללת אולטרה-מבנה מיטוכונדריאלי, הדורש טכניקות הדמיה המספקות רזולוציה גדולה ממגבלת עקיפת האור. כפי שיתואר להלן, טכניקות אלה כוללות מיקרוסקופ אלקטרונים ומיקרוסקופ סופר ברזולוציה (ננוסקופיה).
התאים העצביים ותאי הגליה של מערכת העצבים המרכזית (CNS) מסתמכים במיוחד על תפקוד המיטוכונדריה. בממוצע, המוח מהווה רק 2% ממשקל הגוף הכולל, אך מנצל 25% מכלל הגלוקוז בגוף ומהווה 20% מצריכת החמצן בגוף, מה שהופך אותו לפגיע לליקויים בחילוף החומרים האנרגטי36. מחלות נוירודגנרטיביות מתקדמות (NDs), כולל מחלת אלצהיימר (AD), טרשת אמיוטרופית צידית (ALS), מחלת הנטינגטון (HD), טרשת נפוצה (MS) ומחלת פרקינסון (PD), הן חלק מהפתולוגיות הנחקרות ביותר עד כה, עם מאמצי מחקר החל מהבנת היסודות המולקולריים של מחלות אלה ועד לחיפוש מניעה והתערבויות טיפוליות פוטנציאליות. NDs קשורים לעקה חמצונית מוגברת שמקורה בחלקה במיני חמצן תגובתי (ROS) הנוצרים על-ידי שרשרת הובלת האלקטרונים במיטוכונדריה (ETC)37, כמו גם שינוי בטיפול בסידן מיטוכונדריאלי 38 ומטבוליזם שומנים מיטוכונדריאלי39. שינויים פיזיולוגיים אלה מלווים בפגמים בולטים במורפולוגיה של המיטוכונדריה הקשורים ל-AD 40,41,42,43,44, ALS45,46, HD47,48,49, MS50 ו-PD 51,52,53. פגמים מבניים ותפקודיים אלה יכולים להיות משולבים על ידי יחסי סיבה ותוצאה מורכבים. לדוגמה, בהתחשב בכך שמורפולוגיית הקריסטה מייצבת אנזימי OXPHOS54, ROS מיטוכונדריאלי לא רק נוצר על ידי ETC, אלא הם גם פועלים לפגוע בתשתית שבה שוכן ה-ETC, ומקדמים מחזור ROS מזין קדימה המשפר את הרגישות לנזק חמצוני. יתר על כן, הוכח כי חוסר ארגון של cristae מעורר תהליכים כגון שחרור DNA מיטוכונדריאלי (mtDNA) ומסלולים דלקתיים הקשורים להפרעות אוטואימוניות, מטבוליות והקשורות לגיל55. לכן, ניתוח המבנה המיטוכונדריאלי הוא המפתח להבנה מלאה של NDs והיסודות המולקולריים שלהם.
שיטות פופולריות לצפייה בקריסטה, כולל מיקרוסקופ אלקטרונים תמסורת, טומוגרפיית אלקטרונים וטומוגרפיית קריו-אלקטרונים (cryo-ET), וטומוגרפיית רנטגן, במיוחד טומוגרפיית רנטגן קריו-רכה, חשפו ממצאים חשובים ועבודה עם מגוון סוגי דגימות 56,57,58,59,60 . למרות ההתקדמות האחרונה לקראת תצפית טובה יותר של אולטרה-מבנה אברוני, שיטות אלה עדיין מגיעות עם האזהרה של דרישת קיבוע דגימה, ולכן אינן יכולות ללכוד דינמיקה בזמן אמת של cristae ישירות. מיקרוסקופ פלואורסצנטי ברזולוציית על, במיוחד בצורות של מיקרוסקופ תאורה מובנה (SIM), מיקרוסקופ שחזור אופטי סטוכסטי (STORM), מיקרוסקופ לוקליזציה פוטואקטיבי (PALM), מיקרוסקופ הרחבה (ExM) ומיקרוסקופ דלדול פליטה מגורה (STED), הפכו לדרכים פופולריות לצפייה במבנים הדורשים רזולוציה מתחת למגבלת העקיפה המגבילה שיטות קלאסיות של מיקרוסקופיה אופטית. כאשר ExM משמש בשילוב עם טכניקה אחרת סופר רזולוציה, התוצאות מרשימות, אבל הדגימה חייבת להיות קבועה ומוכתמת בג'ל61. לשם השוואה, SIM, PALM/STORM ו-STED שימשו בהצלחה עם דגימות חיות, וצבעים חדשים ומבטיחים שבדרך כלל מכתימים את ה-IMM מספקים גישה חדשנית וקלה להדמיה חיה של מיטוכונדריה cristae dynamics 62,63,64,65,66. ההתקדמות האחרונה בצבעים חיים עבור הדמיית STED שיפרה את בהירות הצבע ואת יציבות האור, וצבעים אלה מכוונים ל- IMM ברמה גבוהה יותר של ספציפיות מקודמיהם. פיתוחים אלה מאפשרים איסוף של ניסויים ארוכי טווח של timelapse ו-z-stack עם הדמיה ברזולוציית על, ופותחים את הדלת לניתוח טוב יותר של תאים חיים של מבנה ודינמיקה של מיטוכונדריה.
להלן פרוטוקולים להדמיית תאים חיים של תאי SH-SY5Y לא ממוינים ומובחנים המוכתמים בצבע PKmito Orange (PKMO) באמצעות STED63. קו התאים SH-SY5Y הוא נגזרת תת-משובטת שלוש פעמים מקו תאי ההורים, SK-N-SH, שנוצר מביופסיה של מח עצם של נוירובלסטומה גרורתית 67,68,69,70. קו תאים זה הוא מודל מבחנה נפוץ במחקר ND, במיוחד עם מחלות כגון AD, HD ו- PD, שבהן תפקוד לקוי של המיטוכונדריה מעורב במידה רבה 10,43,71,72,73. היכולת להתמיין תאי SH-SY5Y לתאים עם פנוטיפ דמוי נוירון באמצעות מניפולציה של אמצעי תרבית הוכחה כמודל מתאים למחקר מדעי המוח מבלי להסתמך על תאי עצב ראשוניים10,74. בפרוטוקול זה, חומצה רטינואית (RA) נוספה למדיום תרבית התאים כדי לגרום להתמיינות של תאי SH-SY5Y. RA הוא נגזרת של ויטמין A והוכח כמסדיר את מחזור התא ומקדם את הביטוי של גורמי שעתוק המווסתים התמיינות עצבית75. פרוטוקול לתרבית והדמיית תאים חיים של תאי עצב שבודדו מההיפוקמפוס של החולדה מסופק גם כן. הודגם כי ההיפוקמפוס מושפע מניוון מיטוכונדריאלי, ויחד עם קליפת המוח, הוא ממלא תפקיד חשוב בהזדקנות וב-ND 76,77,78,79,80.
Protocol
1. התפשטות והתמיינות של תאי SH-SY5Y
- הכנת מדיה לגידול תאים ותחזוקתם
- הכינו את מדיום הנשר המעובד של Dulbecco (DMEM, 4.5 גרם/ליטר D-גלוקוז, 4 מילימול L-גלוטמין, 110 מ"ג/ליטר נתרן פירובט) בתוספת אנטיביוטי-אנטי-מיקוטי סופי של 1% (v/v) (10,000 יחידות/מ"ל פניצילין, 10,000 מיקרוגרם/מ"ל סטרפטומיצין, ו-25 מיקרוגרם/מ"ל אמפוטריצין B), וכמויות משתנות של נסיוב בקר עוברי (FBS) (ראו טבלת חומרים). כמויות FBS במדיית בידול משתנות בין FBS סופי של 10%, 5% או 2% (v/v).
- תחזוקת תאים
- שמור על התאים ב- DMEM בתוספת FBS של 10% (v/v) ומקם אותם ב- 37 ° C ו- 5% CO2, ולאחר מכן זרע ב- DMEM המכיל 5% (v/v) FBS להתמיינות. מלאי תאים קפואים אוחסן ב- FBS עם 10% (v/v) dimethyl sulfoxide (DMSO) ב 1-2 x 107 תאים / מ"ל.
- הכנת חומצה רטינואית (RA)
- יש להמיס 7.51 מ"ג all-trans-RA (ראה טבלת חומרים) ב-5 מ"ל אתנול 95% טרי שהוכן לקבלת תמיסת מלאי של 5 מילימטר. ודא את הריכוז עם ספיגה ב 350 ננומטר (ɛ = 44,300 M-1 cm-1), המתקבל מדף המידע של המוצר מפרוטוקולהיצרן 81, באמצעות דילול של תמיסת המלאי ב 5 מיקרומטר באתנול. יש לאחסן מלאי של 5 mM מוגן מפני אור בטמפרטורה של 4°C למשך עד 6 שבועות.
- הכנת פולי-די-ליזין לציפוי כיסוי
הערה: פרוטוקול המוצר פולי-D-ליזין (PDL), שנמצא תחת המקטע מסמכים והורדות באתרספק 82, מספק מידע לציפוי מגוון כלי תרבות.- פרוטוקול זה כולל נפחים המבוססים על כלי בעל 2 תאים עם שטח של 4 ס"מ2 לכל באר עם תחתיות זכוכית כיסוי בורוסיליקט סטריליות #1.5 (ראה טבלת חומרים). דללו את תמיסת הציר של PDL פי שניים עד 50 מיקרוגרם/מ"ל עם PBS של Dulbecco (DPBS; ללא סידן, ללא מגנזיום).
הערה: #1.5 או #1.5H זכוכית כיסוי הם שניהם עוביים מקובלים, אשר חיוניים לאיכות התמונה. עוביים אחרים יגרמו לסטייה כדורית ויש להימנע מהם.
- פרוטוקול זה כולל נפחים המבוססים על כלי בעל 2 תאים עם שטח של 4 ס"מ2 לכל באר עם תחתיות זכוכית כיסוי בורוסיליקט סטריליות #1.5 (ראה טבלת חומרים). דללו את תמיסת הציר של PDL פי שניים עד 50 מיקרוגרם/מ"ל עם PBS של Dulbecco (DPBS; ללא סידן, ללא מגנזיום).
- ציפוי כיסוי עם PDL
הערה: ניתן לחשוף את הכיסויים לאור אולטרה סגול (UV) למשך 10-15 דקות בארון בטיחות ביולוגית לצורך עיקור נוסף.- יש למרוח 1.2 מ"ל של תמיסת PDL של 50 מיקרוגרם/מ"ל על כל באר של כיסויים סטריליים בארון תרבית תאים ולדגור בטמפרטורת החדר למשך שעה אחת. יש להסיר את תמיסת ה-PDL ולשטוף שלוש פעמים במים מזוקקים במינון 3.6 מ"ל. לאחר השלמת הכביסה הסופית, יש לאפשר לתא המצופה להתייבש למשך שעתיים חשופות לאוויר לפני שטיפה ושימוש מיידי או אחסון במיכל אטום בטמפרטורה של 4°C למשך עד שבועיים.
הערה: שטפו היטב את הכיסויים מכיוון שעודף PDL עלול להיות רעיל לתאים.
- יש למרוח 1.2 מ"ל של תמיסת PDL של 50 מיקרוגרם/מ"ל על כל באר של כיסויים סטריליים בארון תרבית תאים ולדגור בטמפרטורת החדר למשך שעה אחת. יש להסיר את תמיסת ה-PDL ולשטוף שלוש פעמים במים מזוקקים במינון 3.6 מ"ל. לאחר השלמת הכביסה הסופית, יש לאפשר לתא המצופה להתייבש למשך שעתיים חשופות לאוויר לפני שטיפה ושימוש מיידי או אחסון במיכל אטום בטמפרטורה של 4°C למשך עד שבועיים.
- התמיינות של תאי SH-SY5Y עם RA
הערה: אין להשתמש בתאים מעל מעבר 15. התאים עוברים במפגש של 80%-90%. נהלי הבידול שונים אך מבצעים שלבים דומים. הבחנה נוספת מנוירובלסטומות לנוירונים בוגרים מתקבלת עם טיפול נוסף בגורם נוירוטרופי מוחי (BDNF) 68,83,84,85, אך לא בוצעה בפרוטוקול זה.
אופציונלי: יש ליצור תאים למשך 24 שעות לפחות לפני הזריעה על זכוכית כיסוי. כדי להכין תאים ממלאי קפוא, הפשירו במהירות בקבוקון תאים קפוא של 1 מ"ל והוסיפו ל-9 מ"ל מדיה שחוממה מראש בתוספת 10% FBS, ואז סחררו מטה ב-350 x גרם במשך 10 דקות (בטמפרטורת החדר) והשליכו סופרנאטנט כדי להסיר DMSO. להשהות מחדש את גלולת התא ב 5 מ"ל של מדיה שחוממה מראש ותאי זרע בבקבוק T-25. ברגע שהתאים מגיעים למפגש של 80%-90%, יש להעביר תאים על ידי ספירה וזריעה שלהם לצורך התמיינות במידת הצורך.- יום 0: תאי זרע.
- זרעו את התאים על זכוכית כיסוי ממלאי קפואים או על בקבוק עבודה. השתמש בצפיפות זריעה של 1.5 x 104 תאים/ס"מ2.
הערה: באר בודדת בזכוכית כיסוי סטנדרטית בעלת 2 תאים עם 4 ס"מ2 של שטח תרבית תדרוש 6.0 x 104 תאים. תאים שיישארו בלתי ממוינים צריכים להיות נזרעים עם DMEM בתוספת 10% (v/v) FBS, ותאים שיהיו ממוינים צריכים להיות זרעים עם DMEM בתוספת 5% (v/v) FBS.
- זרעו את התאים על זכוכית כיסוי ממלאי קפואים או על בקבוק עבודה. השתמש בצפיפות זריעה של 1.5 x 104 תאים/ס"מ2.
- יום 1: התחל טיפול התמיינות RA.
- הכן DMEM בתוספת 5% (v/v) FBS, 1% (v/v) אנטיביוטיקה-אנטי-מיקוטית, וריכוז סופי של 10 μM RA או אתנול באותו נפח תוסף כדי לשמש כבקרת הרכב עבור הליך בידול זה. הסר את המדיה בזכוכית הכיסוי התאית המשמשת לזריעה, שטוף עם PBS 1x, והוסף את DMEM החדש לבארות.
- יום 3: החליפו את המדיה במדיה טרייה המכילה RA או אתנול.
- הסר מדיה מהיום הראשון והחלף במדיה טרייה בתוספת 2% (v/v) FBS, 1% (v/v) אנטיביוטי-אנטי-מיקוטי, או 10 μM RA או 95% אתנול באותו נפח תוסף כדי לשמש כבקרת הרכב עבור הליך בידול זה. הסר את המדיה בזכוכית הכיסוי התאית המשמשת לזריעה, שטוף עם PBS 1x, והוסף מדיה חדשה לבארות.
- יום 6: בצעו את ההדמיה של התאים.
הערה: זמני התמיינות התאים משתנים בהתאם לפרוטוקול, אך שישה ימים של חשיפה ל- RA מספיקים כדי לגרום לפנוטיפ דמוי נוירון בתאי SH-SY5Y86.- בצעו הדמיה חיה, עם פרטים בסעיפים 3 ו-4 (איור 2).
- יום 0: תאי זרע.
2. תרבית נוירונים ראשונית בהיפוקמפוס של חולדה
- הכנת חומרים לבידוד נוירונים בהיפוקמפוס חולדה.
- הכינו תוסף DMEM טרי.
- סנן-לעקר תערובת של DMEM (גלוקוז גבוה, ללא נתרן פירובט) בתוספת 10% (v/v) FBS מומת חום, 1% (v/v) תמיסת נתרן פירובט, ו-1% (v/v) פניצילין-סטרפטומיצין (10,000 U/mL). יש לאחסן עד שבועיים בטמפרטורה של 4°C.
- הכינו מצע גדילת נוירונים טרי בתוספת תזונה.
- סנן-לעקר תערובת של מצע גדילה של נוירונים בתוספת 2% (v/v) תוסף B27, 0.25% (v/v) תוסף גלוטמין, ו-1% (v/v) פניצילין-סטרפטומיצין (ראה טבלת חומרים). יש לאחסן עד שבועיים בטמפרטורה של 4°C.
- הכינו תוסף DMEM טרי.
- הכינו תרבית נוירונים ראשונית בהיפוקמפוס.
- הכינו תרבית נוירונים ראשונית בהיפוקמפוס בעקבות עבודה87 שפורסמה בעבר ומפרוטוקול המוצר באתר היצרן שממנו מתקבל היפוקמפוס חולדת E18 שנותח88 (ראו טבלת חומרים). פרוטוקול זה גורם לאוכלוסייה עצבית בעיקרה עם <2% אסטרוציטים.
הערה: מדיית מצב שינה שאיתה נשלחת רקמה זו תשמש לשלבים עתידיים בפרוטוקול זה. אל תשליך אותו. - הכינו חומרים ומדיה לדיסוציאציה של רקמות.
- להבעיר פיפטה פסטר כדי להקטין את קוטר הצמצם ולאחסן אותו בנייר כסף כדי למנוע זיהום עד לשימוש. חממו מראש את ה-DMEM המוכן, את תמיסת המלח החוצצת של 1X Hank (HBSS) ואת מצע גדילת תאי העצב ל-37°C. הוסף 2 פתיתים של DNAase עם פינצטה סטרילית לצינור חרוטי 15 מ"ל.
- בצע דיסוציאציה של רקמות.
- הסר כמה שיותר מאמצעי תרדמת החורף שההיפוקמפוס של חולדת E18 המנותח מאוחסן בהם לפני הכנסת הרקמה לצינור החרוטי 15 מ"ל המכיל DNAase ודגירת לזמן קצר ב -37 מעלות צלזיוס. הוסף 900 μL של 1X HBSS ואחריו 100 μL של 0.5% טריפסין. לדגור על הרקמה ב 37 ° C במשך 15 דקות.
הערה: ניתן להסיר לוחות מצופים PDL מהאחסון ולהניחם באינקובטור עד לשימוש בזמן דגירה זה.
- הסר כמה שיותר מאמצעי תרדמת החורף שההיפוקמפוס של חולדת E18 המנותח מאוחסן בהם לפני הכנסת הרקמה לצינור החרוטי 15 מ"ל המכיל DNAase ודגירת לזמן קצר ב -37 מעלות צלזיוס. הוסף 900 μL של 1X HBSS ואחריו 100 μL של 0.5% טריפסין. לדגור על הרקמה ב 37 ° C במשך 15 דקות.
- לבצע הומוגניזציה של רקמות וספירת תאים.
- לאחר הדגירה עם טריפסין, להסיר את המדיה ולהוסיף 1 מ"ל מחומם מראש תרדמה media-DNAase מן השלב הקודם לרקמה הומוגנית עם פיפטה פסטר. התקשורת תיראה אטומה ואז תתבהר בהדרגה ככל שההומוגניזציה תימשך.
- הוסף נוירונים מנותקים לצינור חדש עם 4 מ"ל DMEM שחומם מראש ולאחר מכן ספור את התאים באמצעות מונה תאים.
- ביצוע ציפוי תאים וצמיחה של תאים ראשוניים.
- תאי צלחת בצפיפות של כ 1.65 x 104 תאים / ס"מ2 ב- DMEM. עבור זכוכית כיסוי בעלת 2 תאים (4 ס"מ 2), זרעו 65,000 – 70,000 תאים לכל באר עם2 מ"ל DMEM. יש לדגור על תאים בטמפרטורה של 37°C ו-5% CO2 למשך שעתיים לפני בדיקת היצמדות. ברגע שהתאים מתחילים לדבוק, להסיר 1 מ"ל של מדיה ולהחליף אותו עם אותו נפח של מדיה תרדמה, ולאחר מכן בעדינות להתסיס כדי לערבב. לאחר ערבוב המדיה, חזור על תהליך זה והסר מחצית מהמדיה הקיימת והחלף באותו נפח של מצע גידול נוירונים, ולאחר מכן ערבב בעדינות.
הערה: יום הציפוי נחשב ליום במבחנה (DIV) 0, והתאים מוכנים לצילום ב-DIV 7 (איור 2).
- תאי צלחת בצפיפות של כ 1.65 x 104 תאים / ס"מ2 ב- DMEM. עבור זכוכית כיסוי בעלת 2 תאים (4 ס"מ 2), זרעו 65,000 – 70,000 תאים לכל באר עם2 מ"ל DMEM. יש לדגור על תאים בטמפרטורה של 37°C ו-5% CO2 למשך שעתיים לפני בדיקת היצמדות. ברגע שהתאים מתחילים לדבוק, להסיר 1 מ"ל של מדיה ולהחליף אותו עם אותו נפח של מדיה תרדמה, ולאחר מכן בעדינות להתסיס כדי לערבב. לאחר ערבוב המדיה, חזור על תהליך זה והסר מחצית מהמדיה הקיימת והחלף באותו נפח של מצע גידול נוירונים, ולאחר מכן ערבב בעדינות.
- הכינו תרבית נוירונים ראשונית בהיפוקמפוס בעקבות עבודה87 שפורסמה בעבר ומפרוטוקול המוצר באתר היצרן שממנו מתקבל היפוקמפוס חולדת E18 שנותח88 (ראו טבלת חומרים). פרוטוקול זה גורם לאוכלוסייה עצבית בעיקרה עם <2% אסטרוציטים.
3. הכנת תאים להדמיית תאים חיים
הערה: סוגי התאים ומקורם (כלומר, תאים בתרבית ותאים ראשוניים) עשויים להיות שונים בדרישות הצביעה; ראה דוחות שפורסמו לפרטים נוספים62,63.
- הכנת PKmito Orange
הערה: צבעים אחרים שבדרך כלל מכתימים את IMM דווחו64,65,66 והם זמינים מסחרית. PKMO הוא היחיד המשמש בפרוטוקול זה.- אבקת השעיה PKMO (ראה טבלת חומרים) ב- DMSO בהתאם להוראות היצרן89. שאפו את המדיה מהתאים ושטפו במדיה נטולת פנול-אדום שחוממה מראש. הכינו מלאי של PKMO ב-DMEM מחומם מראש, ללא פנול אדום בתוספת FBS של 2% (v/v) או 10% (v/v) בהתאם למצב ההתמיינות, HEPES לריכוז סופי של 20 mM, ו-1% (v/v) אנטיביוטי-אנטי-מיקוטי לפני צביעת התאים בהתאם להוראות היצרן. ניסוח זה, ללא PKMO, הוא אמצעי הדמיה של תאים חיים.
- צביעת תאים עם PKMO
- לדגור את התאים עם צבע ב 37 ° C ו 5% CO2, במשך 30 דקות. יש לשטוף תאים שלוש פעמים במדיית הדמיה של תאים חיים, ולשטיפה הסופית לדגור במשך 30 דקות בטמפרטורה של 37°C, 5% CO2.
- הוסף מדיה טרייה שחוממה מראש להדמיית תאים חיים. התאים מוכנים כעת להדמיה.
הערה: טיפולים אקוטיים (למשל, תרופות ו/או גורמי לחץ), כאשר נעשה בהם שימוש, מתווספים לפני הדמיה חיה; ראו פרק הדיון ותרשים משלים 1.
4. הדמיה של תאים חיים במיקרוסקופ STED
הערה: פרוטוקול זה משתמש במערכת STED הבנויה סביב מיקרוסקופ הפוך, כאשר המערכת מצוינת בטבלת החומרים. מערכת זו מצוידת בלייזר עירור פועם (לייזר 561 ננומטר בהספק נומינלי ~ 300 μW) ובלייזר דלדול STED פועם 775 ננומטר (הספק נומינלי 1.2 W), סורק גלבנו מתכוונן ברציפות וגלאי פוטודיודות מפולת שלגים מבוסס מסנן 615/20 ננומטר (APD). כאן משתמשים בעדשת טבילת שמן 100x/1.40 עבור STED. תוכנת Lightbox משמשת לרכישת תמונות. כל הפרטים שסופקו קשורים ישירות לתוכנה זו ולהגדרת המערכת.
- הנחיות כלליות ושלבים להדמיה
- השתמש באינקובטור או בתא סביבתי כדי לשמור על כדאיות התא, אך ניסויים קצרי טווח בטמפרטורת החדר מקובלים גם כן. שלבים אלה ספציפיים להגדרת STED המתוארת לעיל.
- בחר את ערכות הלייזר והמסנן להדמיה.
- השתמשו בפרמטרים של צבע כתום על ידי בחירת הצבעים המשמשים לצביעה מרשימת הצבעים, או הצבע בעל התכונות הספקטרליות הקרובות ביותר לצבע שנעשה בו שימוש. הפוך אותם לפעילים על-ידי לחיצה כפולה או גרירתם לרשימה לדוגמה, שבה כתוב "גרור צבעים לכאן".
- בחרו אזור לתמונה.
- במבט כולל, צור אזור עניין (ROI) סביב מיטוכונדריה מעניינת על-ידי בחירת לחצן החזר ההשקעה המלבני ולחיצה וגרירה כדי לעצב את האזור. ניתן לשנות את גודל החזר ההשקעה ולסובב אותו באמצעות פינות החזר ההשקעה או קצוות מעוקלים המופיעים בעת ריחוף העכבר מעל פינה.
הערה: סיכום של פרמטרי ההדמיה המוצעים ניתן למצוא בטבלה 1. פרמטרים אלה הותאמו אמפירית באמצעות אלה שדווחו בעבר עבור הגדרת STED זו ושילוב צבע63.
- במבט כולל, צור אזור עניין (ROI) סביב מיטוכונדריה מעניינת על-ידי בחירת לחצן החזר ההשקעה המלבני ולחיצה וגרירה כדי לעצב את האזור. ניתן לשנות את גודל החזר ההשקעה ולסובב אותו באמצעות פינות החזר ההשקעה או קצוות מעוקלים המופיעים בעת ריחוף העכבר מעל פינה.
- הגדר גדר.
- לצד התפריט כללי , בחר בתפריט Gating או לחץ והחזק כדי להוסיף את התפריט לתצוגה. מומלץ להתאים את גלאי STED ל- 1-1.05 ל- 7.8-7.85 ns, כפי שמוצג כאן. זמני Gating יכולים להשתנות ולהיות קצרים כמו 1-1.05 עד 7-7.05 ns.
- התאימו את העוצמה בהתאם לדגימה.
הערה: בדרך כלל, כוח העירור המשמש ל- STED הוא פי 2-3 מההספק המשמש לקונפוקל, כך שמדגם הדורש כוח לייזר עירור של 5% עבור קונפוקל יכול להשתמש בכוח לייזר עירור של 10%-15% במהלך רכישת STED.- הגדר את לייזר העירור עבור STED ל 15%-20% ואת לייזר דלדול STED ל 20%-25% עם הצטברות קו 10. השתמש בזמן שהייה של פיקסלים של 4 μs עם גודל פיקסל של 20-25 ננומטר. חור הסיכה נשמר בטמפרטורה של 1.0 AU עבור תאים בתרבית ו-0.7 AU עבור תאי היפוקמפוס ראשוניים של חולדות על מנת לשפר את החתך האופטי במיטוכונדריה הצפופה יותר.
הערה: ניתן לרכוש תמונות קונפוקליות ותמונות STED לצורך השוואה זו לצד זו (איור 3A, B, איור 4A) או שניתן לרכוש רק STED.
- הגדר את לייזר העירור עבור STED ל 15%-20% ואת לייזר דלדול STED ל 20%-25% עם הצטברות קו 10. השתמש בזמן שהייה של פיקסלים של 4 μs עם גודל פיקסל של 20-25 ננומטר. חור הסיכה נשמר בטמפרטורה של 1.0 AU עבור תאים בתרבית ו-0.7 AU עבור תאי היפוקמפוס ראשוניים של חולדות על מנת לשפר את החתך האופטי במיטוכונדריה הצפופה יותר.
- מידע נוסף עבור סדרות זמן/סדרות z
- בחר את סידרת הזמן.
- בחר את התפריט הנפתח שעה. הגדירו את מספר האיטרציות (5 המשמשות כאן) ואת מרווח הזמן (25 או 30 שניות המשמשות כאן) הרצוי עבור חלוף זמן (איור 3C, D, איור 4B).
הערה: אם מרווח הזמן קצר מזמן הרכישה, האיטרציות יימשכו ללא דיחוי. בעת ביצוע קיטוע זמן, מומלץ מאוד להפעיל יחידת מיקוד מושלמת או מעקב מיקוד דומה כדי למנוע סחף פוטנציאלי.
- בחר את התפריט הנפתח שעה. הגדירו את מספר האיטרציות (5 המשמשות כאן) ואת מרווח הזמן (25 או 30 שניות המשמשות כאן) הרצוי עבור חלוף זמן (איור 3C, D, איור 4B).
- הגדר את טווח עוצמת הקול.
- הגדר את טווח עוצמת הקול z כרצונך על-ידי הפעלת האפשרות Volume והתאמת שני הקצוות של הטווח. גדלי הצעדים ששימשו בפרוטוקול זה לדימות דו-ממדי היו 150-200 ננומטר. גודל צעד מומלץ ביחס לדגימת Nyquist הנדרשת לפירוק STED גולמי ניתן לחשב באמצעות כלים מקוונים90.
הערה: עוצמת הלייזר לדלדול STED ומספר המישורים המצולמים יכולים להגביר את ההלבנה של הצבע ואת חשיפת האור לתא לרמות מזיקות. בדוק סימנים של phototoxicity ו photodamage לאחר הרכישה.
- הגדר את טווח עוצמת הקול z כרצונך על-ידי הפעלת האפשרות Volume והתאמת שני הקצוות של הטווח. גדלי הצעדים ששימשו בפרוטוקול זה לדימות דו-ממדי היו 150-200 ננומטר. גודל צעד מומלץ ביחס לדגימת Nyquist הנדרשת לפירוק STED גולמי ניתן לחשב באמצעות כלים מקוונים90.
- בחר את סידרת הזמן.
5. עיבוד וכלים אנליטיים למבנה אולטרה מיטוכונדריאלי
הערה: עיבוד תמונה (כלומר, deconvolution) הוא אופציונלי, אך בדרך כלל משתמשים בו בעת יצירה וניתוח של תמונות STED לפרסום. Deconvolution לשיפור הניגודיות ולהפחתת הרעש מומלץ מאוד לסגמנטציה אופטימלית של משברים בודדים, כמתואר להלן (איור 2).
- DECONVOLUTION תמונה STED
הערה: התוכנה המשמשת לביטול הפיתול בפרוטוקול זה מסופקת בטבלת החומרים.- הגדר את הפרמטרים המיקרוסקופיים של התמונה.
הערה: ודא שהמטא-נתונים של המיקרוסקופ מוזנים כהלכה בתמונה פרמטרים מיקרוסקופיים. זה כולל מדד שבירה בינוני הרכבה; מדיום טבילה; גודל פיקסל; עירור, פליטה ודלדול אורכי גל; וכל מידע רלוונטי אחר. ניתן לשמור תבניות עם פרמטרים אלה לשימוש חוזר. - בטל תמונות STED גולמיות באמצעות אלגוריתם התוכנה.
- גישה לאלגוריתמים אוטומטיים של deconvolution בתוכנת deconvolution מאפשרת עיבוד תמונה של deconvolution. בחר בלחצן אקספרס והגדר את סוג ביטול הפיתול למהיר, רגיל, אגרסיבי או שמרני עבור דרגות שונות של עוצמת דה-קונבולוציה. מוצגות תמונות מייצגות המשתמשות ב-Express Deconvolution עם הגדרות אגרסיביות (איור 3, איור 4 ואיור 5).
- שמור את התמונות מתוכנת deconvolution בפורמט ICS2.
- עבור deconvolution ידני, בצע את השלבים הבאים.
- בקצרה, בעת ביצוע deconvolution ידני, שמור את תבניות אשף deconvolution עבור עקביות ויש לי אפשרות לטעון תבנית בעת הפעלת האשף. השתמש במידע של פונקציית פיזור נקודות נמדדת (PSF) אם נוצר באמצעות הגדרת רכישה ופרמטרים.
- חתוך תמונת STED גולמית, במידת הצורך, לפני שתוכנת deconvolution תייצב אוטומטית את התמונה. תוספות לחבילות תוכנה לדקונבולוציה מאפשרות פיצוי ספציפי של תוצרי הדמיה אפשריים כגון סחף תרמי וסטיות כרומטיות.
- לאחר מכן, צור היסטוגרמה לוגריתמית כדי לבצע חיסור רקע באופן ידני או אוטומטי. בחר באלגוריתם deconvolution הקלאסי של הערכת סבירות מרבית (CMLE).
הערה: עבור דה-קונבולוציה, ערכי המפתח שיש לכוונן הם סף יחס אות לרעש, מספר האיטרציות וסף האיכות. ניתן להתאים ערכים אלה, וניתן להציג תצוגה מקדימה של הדה-קונבולוציה כדי לקבוע הגדרות אופטימליות.
- הגדר את הפרמטרים המיקרוסקופיים של התמונה.
- סגמנטציה וניתוח חלקיקים
הערה: פרוטוקול זה משתמש ב- FIJI (Is Just ImageJ), תוכנת קוד פתוח (ראה טבלת חומרים), לפילוח וניתוח. תוכנות דומות אחרות, כולל CellProfiler, Icy, Ilastik ו-QuPath, זמינות למטרות אלה.- הכינו תמונות לסגמנטציה.
- פתח את תמונות STED הגולמיות .obf או קבצי .ics2 מתוכנת deconvolution על-ידי מעבר אל File → פתח או לחץ וגרור את הקבצים לסרגל הכלים ImageJ. מכאן, כל עיבוד שמקל על פילוח התמונות יכול להתבצע לפני הסגמנטציה.
- כדי לשמור על עקביות השינויים, רשום פונקציות באמצעות יישומי Plugin →- פקודות מאקרו → הקלט והעתק והדבק פקודות מקשים במאקרו חדש, מתוך Plugins →- New → Macro. הקפד לבחור את התמונה לעיבוד לפני הפעלת המאקרו.
הערה: שינויים מקובלים בדרך כלל לכימות גודל וצורה כוללים חיתוך, הקרנת ערימת z וחיסור רקע עם החלקה מושבתת. יש לבצע שינויים באופן עקבי בין תמונות בתוך ערכת נתונים ולדווח עליהם.
- התאמת הגדרות פילוח Weka ניתנות לאימון
הערה: פרטים נוספים עם הוראות שלב אחר שלב לשימוש בכלי הסגמנטציה החצי-אוטומטי וניתוחים במורד הזרם עבור מיטוכונדריה פורסמו91.- פתח את תמונות STED המפותלות בתוסף Trainable Weka Segmentation (TWS)92 , הממוקם תחת Plugins → Segmentation → Trainable Weka Segmentation. בהגדרות הסגמנטציה, בחרו בטשטוש גאוס, בהקרנות הממברנה ובתכונות מסנן סובל . ברירת המחדל של עובי הממברנה היא 1, וברירת המחדל של גודל טלאי הממברנה היא 19.
- תייגו את מחלקה 1 או 2 כ-"Cristae" ואת השנייה כ-"רקע" (איור 2). ניתן גם לשמור דגמים באמצעות לחצן Save classifier . בחרו באפשרות ' טען מסווג' כדי לעשות שימוש חוזר בקביעות אלה לתמונות אחרות.
- בצע מעקב אחר מחלקות TWS.
- השתמש בכלי קו או בצורות אחרות כדי להדגיש חלק מהרקע או הרקע. לפחות חלק מבחירות הרקע צריכות לכלול רווחים בין הקריסטה. ציירו קו מעל המבנה כדי להקצות לכל אחת מהכיתות, ולאחר מכן בחרו בלחצן ' הוסף אל' בצד ימין עבור cristae או רקע. לחץ פעמיים על מעקב כדי להסיר את המבנה מתווית זו.
- בצע הדרכת סיווג TWS.
- בחר בלחצן מסווג הרכבת בצד שמאל כדי ליצור מפה המבוססת על המידע שסופק לתוסף. ניתן להפעיל ולכבות את שכבת-העל של מחלקות מקוטעות באמצעות הלחצן Toggle Overcover , וניתן לכוונן את אטימות הכיסוי בהגדרות. המסווג יכול להיות מאומן מחדש עם תוויות נוספות. לאחר שביעות רצון, בחר בלחצן קבל הסתברות .
- מדדו את החלקיקים.
- באמצעות מפת ההסתברות cristae, סף את התמונה כדי ליצור מסיכה ולאחר מכן עבור אל ניתוח → ניתוח חלקיקים. באופן כללי, ניתן להשתמש בסוג הסף המוגדר כברירת מחדל ולהתאים את הטווח כדי להבטיח התייחסות לכל הקריסטה. ניתן להתאים את המדידות המסופקות על ידי ניתוח חלקיקים על ידי ניתוח → סט מדידות.
הערה: דוגמאות לפרמטרי גודל וצורה כגון שטח, היקף, מעגליות ויחס גובה-רוחב של הקריסטה נמדדות ומוצגות בהתבסס על המדידות שנבחרו (איור 2, איור 5A, טבלה משלימה 1). - אופציונלי: בחר את תמונת STED הגולמית בממדים זהים לאלה של התמונה המפותלת והחל את החזר ההשקעה מהמנהל, ולאחר מכן בחר מדוד במנהל החזר ההשקעה כדי לקבל ערכי עוצמה.
- באמצעות מפת ההסתברות cristae, סף את התמונה כדי ליצור מסיכה ולאחר מכן עבור אל ניתוח → ניתוח חלקיקים. באופן כללי, ניתן להשתמש בסוג הסף המוגדר כברירת מחדל ולהתאים את הטווח כדי להבטיח התייחסות לכל הקריסטה. ניתן להתאים את המדידות המסופקות על ידי ניתוח חלקיקים על ידי ניתוח → סט מדידות.
- השג חלקות קו.
- עלילות קו נוצרו מתמונות STED מפותלות . ציירו קו רב-נקודתי, התאימו את עובי הקו לרוחב של כמה פיקסלים כדי להפיק רעש ממוצע, וקשרו את הקו כך שיתאים למיטוכונדריה (איור 2, איור 5B). תרשים הקו שנוצר משמש למדידת מרחקי שיא לשיא כדי לדווח על המחזוריות וההתפלגות של cristae על פני טווח מסוים.
הערה: באופן קשור, צפיפות cristae יכולה להיות מדווחת כספירה של cristae עצמאי בתוך אזור נתון כפי שנקבע על ידי מדידת החלק החיצוני של המיטוכונדריה. ניתן לקבוע את האזור המיטוכונדריאלי על-ידי החלת מסנן על תמונת STED מפותלת או גולמית ליצירת מסיכה. ודאו שהמסכה מתאימה במדויק לקו המתאר של המיטוכונדריה לפני מדידת האזור.
- עלילות קו נוצרו מתמונות STED מפותלות . ציירו קו רב-נקודתי, התאימו את עובי הקו לרוחב של כמה פיקסלים כדי להפיק רעש ממוצע, וקשרו את הקו כך שיתאים למיטוכונדריה (איור 2, איור 5B). תרשים הקו שנוצר משמש למדידת מרחקי שיא לשיא כדי לדווח על המחזוריות וההתפלגות של cristae על פני טווח מסוים.
- הכינו תמונות לסגמנטציה.
תוצאות
פרוטוקול זה מתאר את תנאי צמיחת התאים עבור תאים בתרבית ותאים ראשוניים, תוך התמקדות בהדמיית STED של תאים חיים ובניתוחים עוקבים של קריסטות מיטוכונדריאליות. הקרנות שנעשו עם ImageJ של מיטוכונדריה מתאי SH-SY5Y לא ממוינים (איור 3A) ותאי SH-SY5Y ממוינים RA (איור 3B) יכולות להיאסף כערימות z עם קונפוקל מסורתי ו-STED, ואז ניתן לפרק את תמונות STED הגולמיות. ניתן גם לבצע הדמיית Timelapse ולאחר מכן לפרק אותה (איור 3C,D). באמצעות שימוש בפרמטרי הדמיה מעט שונים עבור תאי עצב ראשוניים בהיפוקמפוס של חולדה (טבלה 1), תמונות קונפוקליות ותמונות STED גולמיות יכולות להתקבל כערימות z, ותמונות STED גולמיות יכולות להיות מפותלות (איור 4A). הדמיה בהילוך מהיר של מיטוכונדריה מתאי עצב ראשוניים אפשרית גם כן (איור 4B). באופן כללי, תמונות קיטועי הזמן אמורות להיות מסוגלות להציג אירועים דינמיים מיטוכונדריאליים.
כאשר תחזיות STED גולמיות ו- STED z-stack מפותלות מהדגימות המשמשות לסגמנטציה נראות עקביות, מבוצעות מדידות כמותיות. תוסף TWS משתמש בתמונת STED מפותלת כדי לפלח כדי ליצור מסיכת הסתברות, אשר לאחר מכן משמשת ליצירת מסיכה בינארית של cristae כדי לקבל פרמטרים של גודל וצורה (איור 5A). האזורים ממסיכה זו נשמרים במנהל החזר ההשקעה וניתן להחיל אותם על תמונת STED גולמית אם רוצים בכך כדי למדוד הבדלים בעוצמה יחסית. תחזיות STED מפותלות יכולות לשמש גם כדי לקבוע את מחזוריות הקריסטאה ואת צפיפותה באזור נתון (איור 5B).
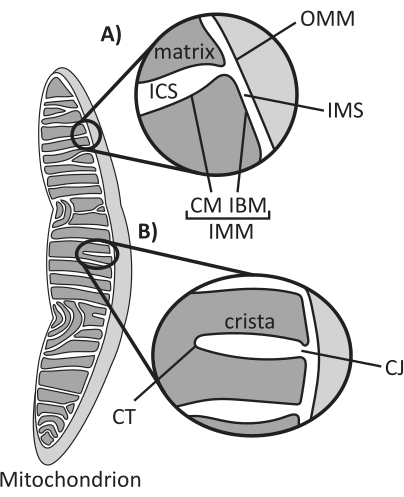
איור 1: מורפולוגיה מיטוכונדריאלית. למיטוכונדריה יש מערכת דו-ממברנית המגדירה תת-תאים שונים (A). Cristae הם קפלים של הקרום הפנימי עם תכונות מוגדרות (B). קיצורים: OMM, קרום מיטוכונדריאלי חיצוני; ICS, חלל אינטרקריסטל; IMS, חלל אינטרממברנה; CM, קרום cristae; IBM, קרום גבול פנימי; IMM, קרום מיטוכונדריאלי פנימי; CT, קצה cristae; CJ, צומת קריסטי. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
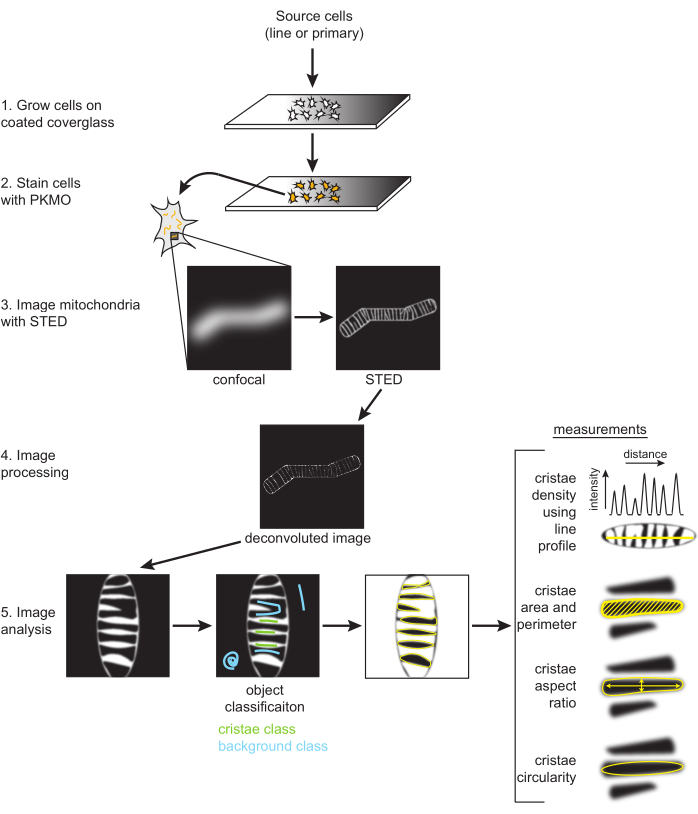
איור 2: סכמה של זרימת עבודה. תאי SH-SY5Y או נוירונים ראשוניים בהיפוקמפוס של חולדה גדלים על זכוכית כיסוי מצופה PDL. תאי SH-SY5Y גדלים במקביל כדי להישאר בלתי ממוינים או נתונים להתמיינות RA במשך שישה ימים. תאי עצב ראשוניים בהיפוקמפוס של חולדה גדלו על זכוכית כיסוי מצופה PDL לאחר שבודדו מחלקי ההיפוקמפוס במשך שבעה ימים. ברגע שהיו מוכנים לצילום, התאים הוכתמו ב-PKMO וצולמו ב-STED. לאחר מכן, תמונות STED גולמיות מפותלות, והתמונות המפותלות מעובדות בפיג'י כדי לקבל מדידות גודל וצורה, כגון צפיפות cristae, שטח, היקף, מעגליות ויחס גובה-רוחב. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
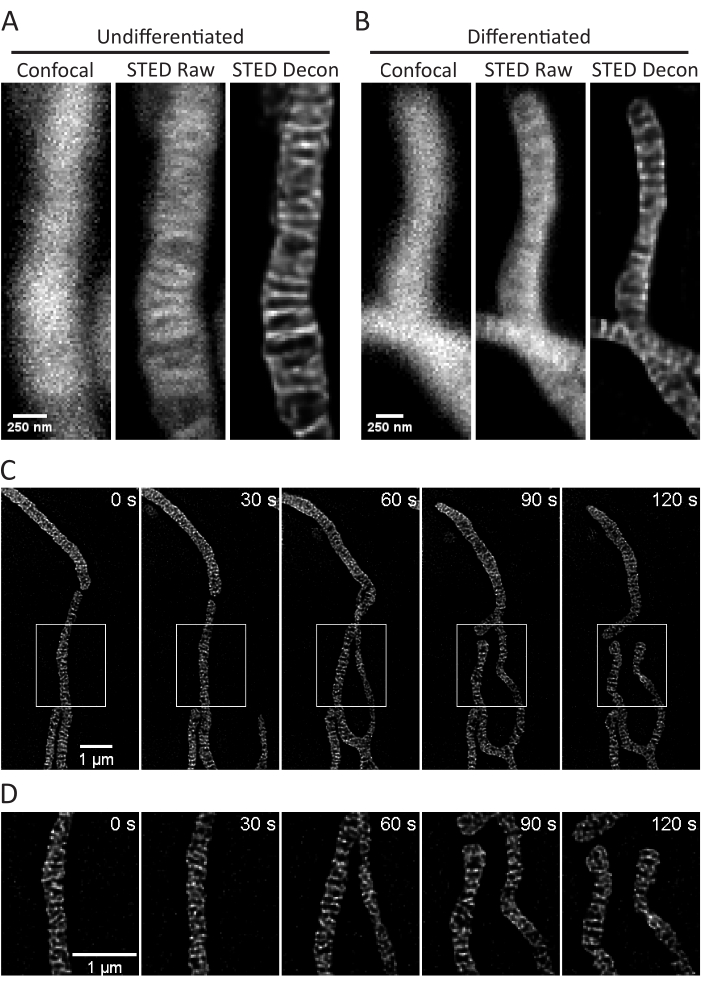
איור 3: הדמיה של מיטוכונדריה בתאי SH-SY5Y. מוצגות הקרנות של תמונת STED מפותלת (משמאל), STED גולמי (במרכז) ו-Huygens deconvolved STED image z-stack (מימין) של מיטוכונדריה מתאי SH-SY5Y לא ממוינים (A) ו-RA-differentiated (B) עם צביעת PKMO. קיטוע זמן עם מרווחים של 30 שניות ו- 5 איטרציות של תאי SH-SY5Y ממוינים RA מוצג (C) עם אזורים נבחרים (תיבות לבנות) המורחבים על (D) באמצעות תמונות בקנה מידה של אזורים אלה ללא אינטרפולציה. פסי קנה מידה: A,B, 250 ננומטר; C,D, 1 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
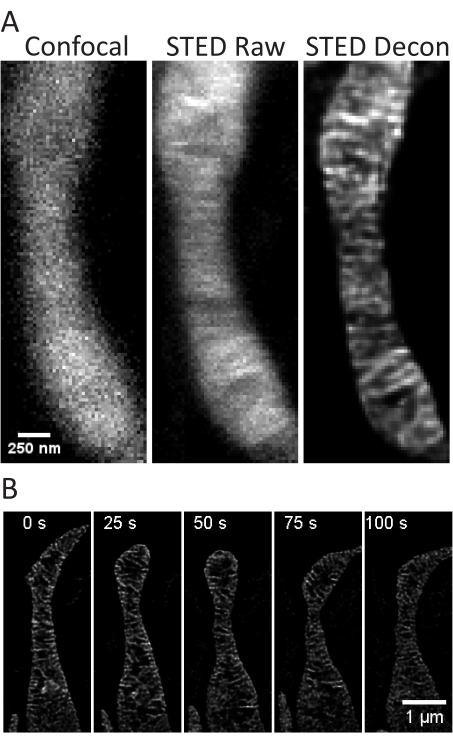
איור 4: הדמיה של מיטוכונדריה בתאי עצב ראשוניים בהיפוקמפוס של חולדה. תמונה קונפוקלית מייצגת (משמאל), STED גולמי (במרכז) והויגנס נטרלה STED מפותל (מימין) מוצגות הקרנות z-stack של מיטוכונדריה מנוירונים ראשוניים בהיפוקמפוס של חולדה (A). מוצג פרק זמן עם מרווחים של 25 שניות ו-5 חזרות של מיטוכונדריה בתאי עצב אלה (B). פסי קנה מידה: A, 250 ננומטר; B, 1 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
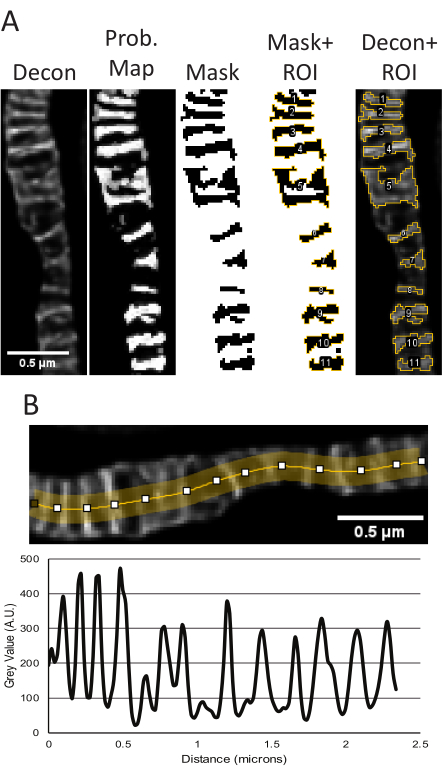
איור 5: עיבוד של תמונות STED מפותלות ב-ImageJ. מוצג שימוש מייצג בתוסף Trainable Weka Segmentation למדידת גודל וצורה של cristae (A). משמאל לימין, מוצגות התמונות הבאות: תמונת STED מפותלת, מפת ההסתברות המבוססת על סגמנטציה מתוסף TWS, המסכה מסף בפיג'י באמצעות מפת ההסתברות כקלט, המסכה עם ה- ROI המתואר, וה- ROI שכבת-על על תמונת STED המפותלת המקורית. ניתן למצוא את מדידות השטח, ההיקף, המעגליות ויחס הגובה-רוחב המתקבלות בהתאם לאובייקטים אלה בטבלה משלימה 1. מוצגת התוויית קו המשתמשת בתמונת STED מפותלת למדידת מרחקי שיא לשיא כקריאה לצפיפות cristae (B). פסי קנה מידה: 0.5 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
| גודל פיקסל (nm) | זמן שהייה (μs) | קו acc. | עירור 561 ננומטר במהלך רכישת STED (%) | עוצמת דלדול STED של 775 ננומטר (%) | גודל צעד (nm) | חור סיכה (AU) | מרווחי זמן של קיטועי זמן | איטראציות של קיטועי זמן | |
| SH-SY5Y ללא הבדל | 20 | 4 | 10 | 15 | 20 | 200 | 1.0 | 30 | 5 |
| RA-Differe-ntiated SH-SY5Y | 20-25 | 4 | 10-12 | 15 | 20-22 | 150-200 | 1.0 | 30 | 5 |
| תאי עצב ראשוניים | 20-25 | 4 | 10 | 10 | 25 | 200 | 0.7 | 30 | 5 |
| הערה: גודל הפיקסלים עשוי להשתנות בהתאם לדרישות ההדמיה ולכוונה לנטרל תמונות. דגימה מתאימה נדרשת עבור deconvolution. גודלי פיקסלים לתמונות STED גולמיות ללא דה-קונבולוציה יכולים להגיע עד 30 ננומטר. | |||||||||
טבלה 1: סיכום פרמטרים של רכישת STED. ההגדרות המשמשות לדימות STED דו-ממדי עבור כל סוג תא, SH-SY5Y לא ממוין, SH-SY5Y ממוין RA ונוירונים ראשוניים בהיפוקמפוס של חולדה, מוצגות. עבור כל הפסקות הזמן, 5 חזרות נלקחו עם מרווחי זמן משתנים בהתבסס על גודל החזר ההשקעה.
איור משלים 1: הדמיה של תאי SH-SY5Y עם תוספת עמילואיד-β (Aβ). מוצגות תמונות קונפוקליות מייצגות (משמאל), STED גולמי (במרכז) ו-STED מפותל (מימין) של תאי SH-SY5Y ממוינים RA עם כתם PKMO (למעלה) ו-Aβ-HiLyte647 (למטה). מוצגות תחזיות z-stack ממוזגות של PKMO STED גולמי (ירוק) עם Aβ STED גולמי (מגנטה) (B) או PKMO STED מפותל (ירוק) עם Aβ STED מפותל (מגנטה) (C). פסי קנה מידה: 0.5 מיקרומטר. אנא לחץ כאן להורדת קובץ זה.
טבלה משלימה 1: מדידות גודל וצורה של קריסטה מקוטעת. מדידות הגודל והצורה של שטח (μm2), היקף (μm), מעגליות ויחס גובה-רוחב, המתאימות לעצמים המתוארים באיור 5A ממיטוכונדריה מקוטעת, מוצגות. אנא לחץ כאן כדי להוריד קובץ זה.
טבלה משלימה 2: סיכום פרמטרים של רכישה עם דגימות β עמילואיד. ההגדרות המשמשות להדמיית STED דו-ממדית של PKMO ו- Aβ-HiLyte647 בתאי SH-SY5Y לא ממוינים וממוינים RA מוצגות. ניתן להשתמש בקונפוקל של Aβ-HiLyte647 לבד מכיוון שאין מבנה ספציפי לפתור; תמונות STED של Aβ-HiLyte647 מוצגות כאן עבור גדלי חלקיקים קטנים יותר. אנא לחץ כאן כדי להוריד קובץ זה.
קובץ משלים 1: פרוטוקול טיפול בעמילואיד-β. אנא לחץ כאן כדי להוריד קובץ זה.
Discussion
פרוטוקול זה מציג את השימוש בקו תאי נוירובלסטומה אנושיים SH-SY5Y ונוירונים ראשוניים בהיפוקמפוס של חולדות עם צבע PKMO חדשני ממוקד IMM עבור דימות STED של תאים חיים. בשל החידוש של PKMO, יש כיום מעט שפורסם באמצעות צבע זה עבור הדמיה STED חי. שימוש בסוגי תאים אלה להדמיית STED מציב אתגרים, במיוחד מכיוון שלתאים עצביים יש מיטוכונדריה צרה יותר. מגבלה אחת של פרוטוקול זה היא צבע PKMO בשימוש, כפי שהוא יכול להיות רעיל לתאים. תאים וקווי תאים שונים מגיבים באופן שונה לצבע, ולכן ייתכן שיידרשו התאמות לריכוז הצבע ולזמן הדגירה כדי למטב את התוצאות לקבלת אות חזק מבלי לפגוע בתאים. פתרון מוצע הוא להוריד את הריכוז ולהגדיל את זמן הצביעה63; עם זאת, זה עלול לגרום לכתמים גרועים יותר מבלי להגדיל את כדאיות התא.
בדומה ל-PKMO, גם הצבע המסחרי Live Orange mito (Table of Materials) מציג רעילות מסוימת של תאים. צבע זה שימש למגוון תאים בתרבית, אך לא הצליח להציג צביעה דומה בתאי SH-SY5Y ממוינים RA בהצלחה עם אותם פרמטרים כמו עמיתיהם הבלתי ממוינים (התצפיות שלנו שלא פורסמו). עם זאת, פרוטוקולי צביעה מקובלים עשויים להיות ממוטבים עבור בדיקה זו וסוגי תאים נבחרים. עם צבע זה נעשה שימוש בזמני גלאי של 1-1.05 עד 7-7.05 ns, כאשר כל שאר הפרמטרים בטבלה 1 נותרו זהים. באופן כללי, צביעת תאים עם מיטו כתום חי של 200-250 ננומטר במשך 45 דקות הניבה תוצאות דומות כפי שהראו תוצאות PKMO. צביעה בריכוז גבוה יותר למשך פחות זמן או צביעה בריכוז נמוך יותר למשך אותה כמות זמן או מעט יותר יכולה להניב תוצאות שונות ועשויה להיות חיובית לסוגי תאים אחרים או לתנאי גדילה אחרים.
הדמיה של תאי עצב ראשוניים בהיפוקמפוס של חולדה שונה מתאים אימורטליים בשל אופי הקרנות האקסון והדנדריט, כמו גם התפלגות המיטוכונדריה בזמן ההדמיה. קושי אחד בחלק זה של הפרוטוקול הוא שצפיפות הזריעה קובעת אם התרבויות הראשוניות יוכלו להיצמד ולגדול בצורה בריאה, ובצפיפות גבוהה יותר, התחזיות נוטות לגדול יתר על המידה על ידי DIV 10. לכן, המיטוכונדריה המצולמים מתאי עצב ראשוניים אלה יגיעו ככל הנראה מגוף התא ולא מההקרנות; עם זאת, צמיחה מוצלחת מצפיפות תאים התחלתית נמוכה יותר מניבה תוצאות הדמיה טובות יותר בזמני גידול מאוחרים יותר. המפתח הוא להבטיח רקע חלש ואור מחוץ למיקוד כדי לקבל את הניגודיות הטובה ביותר עבור STED. כדי לטפל בחששות לגבי אוכלוסיית התאים, תרבית תאי היפוקמפוס ראשוניים במצע גדילה של נוירונים בתוספת B27 מונעת צמיחה של תאי גלייה, והמקור מדווח כי <5% מהתאים הם אסטרוציטים והיעדר תוסף NbActiv1 במצע הגידול מפחית את מספר האסטרוציטים בתרביות ל -<2% 87. הן עבור תאי SH-SY5Y בתרבית והן עבור תאי עצב ראשוניים בהיפוקמפוס של חולדה, ציפוי PDL המשמש לגדילה תורם לאובך רקע בתמונות. מספיק אות לרעש מתבצע עם ההגדרות המדווחות ב- (טבלה 1) ודה-קונבולוציה מסירה את רוב הרקע שנצפה.
בנוסף לדימות המכוסה כאן, ניתן גם להוסיף טיפולים או מתח לתאים לפני או במהלך ההדמיה. לדוגמה, הוספת טרט-בוטיל מי חמצן (tBHP) גורמת לעקה חמצונית, וניתן לעקוב אחר שינויים במיטוכונדריה לאורך זמן לאחר ההוספה. הוספת β עמילואיד (Aβ) עם תג פלואורסצנטי מאפשרת מעקב אחר התפלגות הפפטיד ביחס למיטוכונדריה וכן אחר המבנה המיטוכונדריאלי לאורך זמן. בריאות המיטוכונדריה מעורבת מאוד באלצהיימר, וקיימת תמיכה נרחבת בכך שהיא ממלאת תפקיד ברעילות Aβ 43,71,72. יש לציין כי מצב ההתמיינות של תאי SH-SY5Y משפיע על לוקליזציה85 של קודמן חלבון Aβ (AβPP), ויש לבנות בזהירות ניסויים באמצעות AβPP.
כדוגמה לאופן שבו פרוטוקול זה יכול להיות מותאם, ניתן לראות כי ניתן להוסיף את הגרסה הפלואורסצנטית Aβ(1-42)-HiLyte 647 לתאים מוכתמים ב-PKMO 15 דקות לפני ההדמיה (איור משלים 1). פרמטרי ההדמיה דומים (טבלה משלימה 2), כאשר ההבדל העיקרי הוא שיש צורך בחור סיכה קטן יותר בעת הדמיה של מיטוכונדריה צרה יותר. הדמיה Aβ-HiLyte647 עם STED דורשת פחות עירור כללי (6%-8%) ודלדול STED (10%-12%) עוצמת לייזר ופחות הצטברות (שש). גלאי gating הוא גם מורחב מ 0.1 ל 10 ns. למרות שרזולוציית STED של Aβ אינה הכרחית, יחס האות לרעש הכולל וגודל חלקיקי Aβ של STED גולמי היו טובים יותר מאלה של התמונות הקונפוקליות, וניתן לבצע גם דה-קונבולוציה לאחר מכן. איסוף תמונות STED והקרנות STED z-stack גולמיות של Aβ נראות שימושיות במיוחד בעת מיזוג עם תמונות STED גולמיות או תמונות STED מפותלות של כתם PKMO (איור משלים 1B,C). שני הערוצים נאספו בשלב פריים אחד. מדידות של לוקליזציה תלוית זמן, בדומה לאלה המפורטות באיור 2 ומוצגות באיור 5, היכן שרלוונטי, והבדלים בארכיטקטורה של cristae ניתן לקבל לאחר טיפול במאמץ או תוספות אחרות.
שיטות אפשריות אחרות לתיוג כפול בתאי STED חיים של מיטוכונדריה שלא דווחו כאן אך דווחו על ידי אחרים כוללות שימוש בחלבונים המתויגים ב- SNAP93, חלבונים המתויגים ב- Halo, ושימוש בצבעים חדירים אחרים לתאים עם מטרות גנריות, כגון mtDNA63. יש לציין כי אסטרטגיית התיוג של תיוג SNAP ו-Halo משפיעה על עוצמת האות הפלואורסצנטי המתקבל ועל תוחלת החיים בעת הדמיה94. בנוסף, בעוד פרוטוקול זה מציג מספר דוגמאות של ניתוחים שניתן ליישם על מיטוכונדריה מקוטעת, ישנם ניתוחים רבים אחרים שחבילות תוכנה יכולות לבצע על תמונות אלה.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
תאי עצב ראשוניים בהיפוקמפוס של חולדות סופקו על ידי ד"ר ג'ורג' ליקוטראפיטיס ושיג'ו גו מהמחלקה להנדסה ביו-רפואית באוניברסיטת קונטיקט (סטורס, קונטיקט, ארה"ב). מכשיר ה-Abberior STED השוכן במתקן המתקדם למיקרוסקופיית אור במרכז למשאבי מחקר וציוד פתוח נרכש במענק NIH S10OD023618 שהוענק לכריסטופר או'קונל. מחקר זה מומן על ידי R01AG065879 המענקים של NIH שהוענקו לנתן נ. אלדר.
Materials
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin-EDTA | Gibco | 25300054 | |
| 0.4% Trypan blue | Invitrogen | T10282 | |
| 0.5% Trypsin-EDTA, no phenol red | Gibco | 15400054 | |
| 100 X antibiotic-antimycotic | Gibco | 15240062 | |
| 100 X/1.40 UPlanSApo oil immersion lens | Olympus | Equipped in Olympus IX83 microscope for STED setup described in Section 4 | |
| All-trans-retinoic acid | Sigma | R2625 | |
| Amyloid-β (1-42, HiLyte Fluor647, 0.1 mg) | AnaSpec | AS-64161 | Other fluorescent conjugates available |
| B27 supplement (50 X), serum free | Gibco | 17504044 | |
| Cell Counter (Countess II FL) | Life Technologies | AMQAF1000 | |
| Centrifuge | Eppendorf | 5804-R | |
| Counter slides | Invitrogen | C10283 | |
| Conical tubes (15 mL) | Thermo Fisher Scientific | 339650 | |
| Cuvettes (Quartz Cells) | Starna Cells, Inc. | 9-Q-10 | Used with Spectrometer as described in Section 1.3 |
| DMEM (high glucose with sodium pyruvate) | Gibco | 11995073 | Used for SH-SY5Y cell materials as described in Section 1 |
| DMEM (high glucose no sodium pyruvate) | Gibco | 11965092 | Used for primary cell materials as described in Section 2 |
| DMEM (phenol red-free) | Gibco | 31053028 | Used for imaging as described in Section 3 |
| DMSO | Sigma | D8418 | |
| DNAase I from bovine pancreas | Sigma | DN25 | Used for primary cell materials as described in Section 2.2.1 and 2.2.2 |
| DPBS (no calcium, no magnesium) | Gibco | 14190144 | |
| E18 Rat Hippocampus | Transnetyx Tissue | SDEHP | |
| Ethanol (200 proof) | Fisher Bioreagents | BP28184 | |
| Fetal bovine serum (FBS), not heat-inactivated | Gibco | 26140079 | For cultured cells, in Section 1 |
| Fetal bovine serum (heat inactivated) | Gibco | 10082147 | For primary cell culture, Section 2 |
| Filter sterilization unit (0.1 µm, 500 mL) | Thermo Fisher Scientific | 5660010 | |
| FIJI (Is Just ImageJ) and Trainable Weka Segmentation (TWS) plug-in | -- | -- | Free, open-source image analysis software that includes plug-ins including Trainable Weka Segmentation described in Section 5; TWS plug-in from ref. 90 of the main text |
| GlutaMAX supplement (100 X) | Gibco | 35050061 | Glutamine supplement used for primary cell materials described in Section 2.1.2 |
| Hausser Scientific bright-Line and Hy-Lite Counting Chambers | Hausser Scientific | 267110 | |
| HBSS (no calcium, no magnesium) | Gibco | 14170120 | Used for primary cell materials described in Section 2.2.1 and 2.2.2 |
| HEPES | Gibco | 15630080 | |
| Huygens Professional deconvolution software (V. 20.10) | Scientific Volume Imaging (SVI) | -- | The deconvolution software used in this protocol and described in Section 5 |
| IX83 inverted microscope with Continuous Autofocus | Olympus | -- | This paper uses a STED Infinity Line system built around an Olympus IX83 inverted microscope, described in Section 4 |
| Lightbox software (V. 16.3.16118) | Abberior | -- | Vendor software used for STED image acquisition, described in Section 4 |
| Live Orange Mito dye | Abberior | LVORANGE-0146-30NMOL | Live cell imaging IMM-targeting dye described in Discussion |
| Neurobasal media | Gibco | 21103049 | Used for primary cell materials referred to in Section 2.1.2 |
| Nunc Lab-Tek II 2-well chambered coverglass | Nunc | 155379 | Can purchase a variety of chambers but make sure the coverglass is #1.5 |
| Pasteur Pipets (Fisherbrand) | Thermo Fisher Scientific | 22183632 | |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco | 15140122 | |
| PKmito Orange dye | Spirochrome | SC053 | |
| Poly-D-lysine | Gibco | A3890401 | |
| SH-SY5Y Cell line | ATCC | CRL2266 | |
| Sodium pyruvate (100 mM) | Gibco | 11360070 | Used for primary cell materials described in Section 2 |
| Spectrometer (GENESYS 180 UV-Vis) | Thermo Fisher Scientific | 840309000 | |
| STED Expert Line microscope | Abberior | -- | STED setup can be customized, but at time of purchase instrument was considered Abberior’s Expert Line; brief description of setup is available in Section 4 of protocol |
| T25 flask (TC-treated, filter cap) | Thermo Fisher Scientific | 156367 | Other culture vessels and sizes available |
References
- Iovine, J. C., Claypool, S. M., Alder, N. N. Mitochondrial compartmentalization: emerging themes in structure and function. Trends in Biochemical Sciences. 46 (11), 902-917 (2021).
- Gupta, A., Becker, T. Mechanisms and pathways of mitochondrial outer membrane protein biogenesis. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1862 (1), 148323 (2021).
- Gordaliza-Alaguero, I., Cantó, C., Zorzano, A. Metabolic implications of organelle-mitochondria communication. EMBO Reports. 20 (9), e47928 (2019).
- Klecker, T., Westermann, B. Pathways shaping the mitochondrial inner membrane. Open Biology. 11 (12), 210238 (2021).
- Navarro, A., Boveris, A. The mitochondrial energy transduction system and the aging process. American Journal of Physiology-Cell Physiology. 292 (2), C670-C686 (2007).
- Yu, R., Lendahl, U., Nistér, M., Zhao, J. Regulation of mammalian mitochondrial dynamics: opportunities and challenges. Frontiers in Endocrinology. 11, 374 (2020).
- Horn, A., Raavicharla, S., Shah, S., Cox, D., Jaiswal, J. K. Mitochondrial fragmentation enables localized signaling required for cell repair. The Journal of Cell Biology. 219 (5), e201909154 (2020).
- Glancy, B., Kim, Y., Katti, P., Willingham, T. B. The functional impact of mitochondrial structure across subcellular scales. Frontiers in Physiology. 11, 541040 (2020).
- Bahat, A., et al. MTCH2-mediated mitochondrial fusion drives exit from naïve pluripotency in embryonic stem cells. Nature Communications. 9 (1), 5132 (2018).
- Detmer, S. A., Chan, D. C. Functions and dysfunctions of mitochondrial dynamics. Nature Reviews Molecular Cell Biology. 8, 870-879 (2007).
- Bertholet, A. M., et al. Mitochondrial fusion/fission dynamics in neurodegeneration and neuronal plasticity. Neurobiology of Disease. 90, 3-19 (2016).
- Zemirli, N., Morel, E., Molino, D. Mitochondrial dynamics in basal and stressful conditions. International Journal of Molecular Sciences. 19 (2), 564 (2018).
- Harwig, M. C., et al. Methods for imaging mammalian mitochondrial morphology: a prospective on mitograph. Analytical Biochemistry. 552, 81-99 (2018).
- Pánek, T., Eliáš, M., Vancová, M., Lukeš, J., Hashimi, H. Returning to the fold for lessons in mitochondrial crista diversity and evolution. Current Biology. 30 (10), R575-R588 (2020).
- Gottschalk, B., Madreiter-Sokolowski, C. T., Graier, W. F. Cristae junction as a fundamental switchboard for mitochondrial ion signaling and bioenergetics. Cell Calcium. 101, 102517 (2022).
- Khosravi, S., Harner, M. E. The MICOS complex, a structural element of mitochondria with versatile functions. Biological Chemistry. 401 (6-7), 765-778 (2020).
- Frezza, C., et al. OPA1 controls apoptotic cristae remodeling independently from mitochondrial fusion. Cell. 126 (1), 177-189 (2006).
- Meeusen, S., et al. Mitochondrial inner-membrane fusion and crista maintenance requires the dynamin-related GTPase Mgm1. Cell. 127 (2), 383-395 (2006).
- Patten, D. A., et al. OPA1-dependent cristae modulation is essential for cellular adaptation to metabolic demand. The EMBO Journal. 33 (22), 2676-2691 (2014).
- Paumard, P., et al. The ATP synthase is involved in generating mitochondrial cristae morphology. The EMBO Journal. 21 (3), 221-230 (2002).
- Strauss, M., Hofhaus, G., Schröder, R. R., Kühlbrandt, W. Dimer ribbons of ATP synthase shape the inner mitochondrial membrane. The EMBO Journal. 27 (7), 1154-1160 (2008).
- Basu Ball, W., Neff, J. K., Gohil, V. M. The role of nonbilayer phospholipids in mitochondrial structure and function. FEBS Letters. 592 (8), 1273-1290 (2018).
- Hackenbrock, C. R. Ultrastructural bases for metabolically linked mechanical activity in mitochondria. I. Reversible ultrastructural changes with change in metabolic steady state in isolated liver mitochondria. The Journal of Cell Biology. 30 (2), 269-297 (1966).
- Dlasková, A., et al. Mitochondrial cristae narrowing upon higher 2-oxoglutarate load. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1860 (8), 659-678 (2019).
- Pérez-Hernández, C. A., et al. Mitochondrial ultrastructure and activity are differentially regulated by glycolysis-, krebs cycle-, and microbiota-derived metabolites in monocytes. Biology. 11 (8), 1132 (2022).
- Mannella, C. A. Structural diversity of mitochondria: functional implications. Annals of the New York Academy of Sciences. 1147, 171-179 (2008).
- Plecitá-Hlavatá, L., Ježek, P. Integration of superoxide formation and cristae morphology for mitochondrial redox signaling. The International Journal of Biochemistry & Cell Biology. 80, 31-50 (2016).
- Scorrano, L., et al. A distinct pathway remodels mitochondrial cristae and mobilizes cytochrome c during apoptosis. Developmental Cell. 2 (1), 55-67 (2002).
- Heath-Engel, H. M., Shore, G. C. Mitochondrial membrane dynamics, cristae remodelling and apoptosis. Biochimica et Biophysica Acta (BBA) - Molecular Cell Research. 1763 (5-6), 549-560 (2006).
- Brandt, T., et al. Changes of mitochondrial ultrastructure and function during ageing in mice and Drosophilia. eLife. 6, e24662 (2017).
- Kondadi, A. K., et al. Cristae undergo continuous cycles of membrane remodelling in a MICOS-dependent manner. EMBO Reports. 21, e49776 (2020).
- Quintana-Cabrera, R., Mehrotra, A., Rigoni, G., Soriano, M. E. Who and how in the regulation of mitochondrial cristae shape and function. Biochemical and Biophysical Research Communications. 500 (1), 94-101 (2018).
- Nielsen, J., et al. Plasticity in mitochondrial cristae density allows metabolic capacity modulation in human skeletal muscle: Enlarged mitochondrial cristae density in athletes. The Journal of Physiology. 595 (9), 2839-2847 (2017).
- Afzal, N., Lederer, W. J., Jafri, M. S., Mannella, C. A. Effect of crista morphology on mitochondrial ATP output: A computational study. Current Research in Physiology. 4, 163-176 (2021).
- Heine, K. B., Parry, H. A., Hood, W. R. How does density of the inner mitochondrial membrane influence mitochondrial performance. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology. 324 (2), R242-R248 (2023).
- Wang, W., Zhao, F., Ma, X., Perry, G., Zhu, X. Mitochondria dysfunction in the pathogenesis of Alzheimer's disease: recent advances. Molecular Neurodegeneration. 15, 30 (2020).
- Singh, A., Kukreti, R., Saso, L., Kukreti, S. Oxidative stress: a key modulator in neurodegenerative diseases. Molecules. 24, 1583 (2019).
- Pchitskaya, E., Popugaeva, E., Bezprozvanny, I. Calcium signaling and molecular mechanisms underlying neurodegenerative diseases. Cell Calcium. 70, 87-94 (2018).
- Estes, R. E., Lin, B., Khera, A., Davis, M. Y. Lipid metabolism influence on neurodegenerative disease progression: is the vehicle as important as the cargo. Frontiers in Molecular Neuroscience. 14, 788695 (2021).
- Calkins, M. J., Manczak, M., Mao, P., Shirendeb, U., Reddy, P. H. Impaired mitochondrial biogenesis, defective axonal transport of mitochondria, abnormal mitochondrial dynamics and synaptic degeneration in a mouse model of Alzheimer's disease. Human Molecular Genetics. 20 (23), 4515-4529 (2011).
- Petersen, C. A. H., et al. The amyloid beta-peptide is imported into mitochondria via the TOM import machinery and localized to mitochondrial cristae. Proceedings of the National Academy of Sciences of the United States of America. 105 (35), 13145-13150 (2008).
- Gan, X., et al. Inhibition of ERK-DLP1 signaling and mitochondrial division alleviates mitochondrial dysfunction in Alzheimer's disease cybrid cell. Biochimica et Biophysica Acta (BBA) - Molecular Basis of Disease. 1842 (2), 220-231 (2014).
- Baloyannis, S. J., Costa, V., Michmizos, D. Mitochondrial alterations Alzheimer's disease. American Journal of Alzheimer's Disease & Other Dementias. 19 (2), 89-93 (2004).
- Tillement, L., Lecanu, L., Papadopoulos, V. Alzheimer's disease: Effects of β-amyloid on mitochondria. Mitochondrion. 11 (1), 13-21 (2011).
- Choi, S. Y., et al. C9ORF72-ALS/FTD-associated poly(GR) binds Atp5a1 and compromises mitochondrial function in vivo. Nature Neuroscience. 22 (6), 851-862 (2019).
- Smith, E. F., Shaw, P. J., De Vos, K. J. The role of mitochondria in amyotrophic lateral sclerosis. Neuroscience Letters. 710, 132933 (2019).
- Costa, V., et al. Mitochondrial fission and cristae disruption increase the response of cell models of Huntington's disease to apoptotic stimuli. EMBO Molecular Medicine. 2 (12), 490-503 (2010).
- Costa, V., Scorrano, L. Shaping the role of mitochondria in the pathogenesis of Huntington's disease: Mitochondrial and Huntington's disease. The EMBO Journal. 31 (8), 1853-1864 (2012).
- Vanisova, M., et al. Mitochondrial organization and structure are compromised in fibroblasts from patients with Huntington's disease. Ultrastructural Pathology. 46 (5), 462-475 (2022).
- de Barcelos, I. P., Troxell, R. M., Graves, J. S. Mitochondrial dysfunction and multiple sclerosis. Biology. 8 (2), 37 (2019).
- Park, J., et al. Mitochondrial dysfunction in Drosophila PINK1 mutants is complemented by parkin. Nature. 441, 1157-1161 (2006).
- Meng, H., et al. Loss of Parkinson's disease-associated protein CHCHD2 affects mitochondrial crista structure and destabilizes cytochrome c. Nature Communications. 8, 15500 (2017).
- Lu, L., et al. CHCHD2 maintains mitochondrial contact site and cristae organizing system stability and protects against mitochondrial dysfunction in an experimental model of Parkinson's disease. Chinese Medical Journal. 135 (13), 1588-1596 (2022).
- Cogliati, S., et al. Mitochondrial Cristae shape determines respiratory chain supercomplexes assembly and respiratory efficiency. Cell. 155 (1), 160-171 (2013).
- He, B., et al. Mitochondrial cristae architecture protects against mtDNA release and inflammation. Cell Reports. 41 (10), 111774 (2022).
- Polo, C. C., et al. Three-dimensional imaging of mitochondrial cristae complexity using cryo-soft X-ray tomography. Scientific Reports. 10, 21045 (2020).
- Rybka, V., et al. Transmission electron microscopy study of mitochondria in aging brain synapses. Antioxidants. 8 (6), 171 (2019).
- Mannella, C. A. Structure and dynamics of the mitochondrial inner membrane cristae. Biochimica et Biophysica Acta (BBA) - Molecular Cell Research. 1763 (5-6), 542-548 (2006).
- Fry, M. Y., et al. In situ architecture of Opa1-dependent mitochondrial cristae remodeling. biorxiv. , (2023).
- Barad, B. A., Medina, M., Fuentes, D., Wiseman, R. L., Grotjahn, D. A. Quantifying organellar ultrastructure in cryo-electron tomography using a surface morphometrics pipeline. The Journal of Cell Biology. 222 (4), 202204093 (2023).
- Kunz, T. C., Götz, R., Gao, S., Sauer, M., Kozjak-Pavlovic, V. Using expansion microscopy to visualize and characterize the morphology of mitochondrial cristae. Frontiers in Cell and Developmental Biology. 8, 617 (2020).
- Yang, Z., et al. Cyclooctatetraene-conjugated cyanine mitochondrial probes minimize phototoxicity in fluorescence and nanoscopic imaging. Chemical Science. 11 (32), 8506-8516 (2020).
- Liu, T., et al. Multi-color live-cell STED nanoscopy of mitochondria with a gentle inner membrane stain. Proceedings of the National Academy of Sciences. 119 (52), e2215799119 (2022).
- Yang, X., et al. Mitochondrial dynamics quantitatively revealed by STED nanoscopy with an enhanced squaraine variant probe. Nature Communications. 11, 3699 (2020).
- Zheng, S., et al. Long-term, super-resolution HIDE imaging of the inner mitochondrial membrane in live cells with a cell-permeant lipid probe. biorxiv. , (2022).
- Wang, C., et al. A photostable fluorescent marker for the superresolution live imaging of the dynamic structure of the mitochondrial cristae. Proceedings of the National Academy of Sciences of the United States of America. 116 (32), 15817-15822 (2019).
- Feles, S., et al. Streamlining culture conditions for the neuroblastoma cell line sh-sy5y: a prerequisite for functional studies. Methods and Protocols. 5 (4), 58 (2022).
- Shipley, M. M., Mangold, C. A., Szpara, M. L. Differentiation of the SH-SY5Y human neuroblastoma cell line. Journal of Visualized Experiments. (108), e53193 (2016).
- Kovalevich, J., Langford, D., Amini, S., White, M. K. Considerations for the use of SH-SY5Y neuroblastoma cells in neurobiology. Neuronal Cell Culture. 1078, 9-21 (2013).
- Biedler, J. L., Helson, L., Spengler, B. A. Morphology and growth, tumorigenicity, and cytogenetics of human neuroblastoma cells in continuous culture. Cancer Research. 33 (11), 2643-2652 (1973).
- Swerdlow, R. H. Mitochondria and mitochondrial cascades in alzheimer's disease. Journal of Alzheimer's Disease. 62 (3), 1403-1416 (2018).
- Wang, W., Zhao, F., Ma, X., Perry, G., Zhu, X. Mitochondria dysfunction in the pathogenesis of Alzheimer's disease: recent advances. Molecular Neurodegeneration. 15, 30 (2020).
- Reddy, P. H. Mitochondrial dysfunction in aging and alzheimer's disease: strategies to protect neurons. Antioxidants & Redox Signaling. 9 (10), 1647-1658 (2007).
- Horn, A., Raavicharla, S., Shah, S., Cox, D., Jaiswal, J. K. Mitochondrial fragmentation enables localized signaling required for cell repair. Journal of Cell Biology. 219 (5), e201909154 (2020).
- Korecka, J. A., et al. Phenotypic characterization of retinoic acid differentiated SH-SY5Y cells by transcriptional profiling. PLoS ONE. 8 (5), e63862 (2013).
- Baghel, M. S., Thakur, M. K. Vdac1 downregulation causes mitochondrial disintegration leading to hippocampal neurodegeneration in scopolamine-induced amnesic mice. Molecular Neurobiology. 56 (3), 1707-1718 (2019).
- Jiang, S., et al. Mfn2 ablation causes an oxidative stress response and eventual neuronal death in the hippocampus and cortex. Molecular Neurodegeneration. 13 (1), 5 (2018).
- Mu, Y., Gage, F. H. Adult hippocampal neurogenesis and its role in Alzheimer's disease. Molecular Neurodegeneration. 6, 85 (2011).
- Rao, Y. L., et al. Hippocampus and its involvement in Alzheimer's disease: a review. 3 Biotech. 12 (2), 55 (2022).
- Weerasinghe-Mudiyanselage, P. D. E., Ang, M. J., Kang, S., Kim, J. -. S., Moon, C. Structural Plasticity of the hippocampus in neurodegenerative diseases. International Journal of Molecular Sciences. 23 (6), 3349 (2022).
- . Poly-D-Lysine Available from: https://www.thermofisher.com/order/catalog/product/A3890401 (2023)
- Dravid, A., Raos, B., Svirskis, D., O'Carroll, S. J. Optimised techniques for high-throughput screening of differentiated SH-SY5Y cells and application for neurite outgrowth assays. Scientific Reports. 11, 23935 (2021).
- Hromadkova, L., et al. Brain-derived neurotrophic factor (BDNF) promotes molecular polarization and differentiation of immature neuroblastoma cells into definitive neurons. Biochimica et Biophysica Acta (BBA) - Molecular Cell Research. 1867 (9), 118737 (2020).
- Riegerová, P., et al. Expression and Localization of AβPP in SH-SY5Y cells depends on differentiation state. Journal of Alzheimer's Disease. 82 (2), 485-491 (2021).
- Hoffmann, L. F., et al. Neural regeneration research model to be explored: SH-SY5Y human neuroblastoma cells. Neural Regeneration Research. 18 (6), 1265-1266 (2022).
- Abiraman, K., Tzingounis, A. V., Lykotrafitis, G. K. Ca 2 channel localization and regulation in the axon initial segment. The FASEB Journal. 32 (4), 1794-1805 (2018).
- E18 Rat Hippocampus. Transnetyx Tissue Available from: https://tissue.transnetyx.com/E18-Rat-Hippocampus_4 (2023)
- Kmito ORANGE - Probe for live cell imaging of mitochondria. Spirochrome Available from: https://spirochrome.com/product/pkmito_orange/ (2023)
- Nyquist Calculator. Scientific Volume Imaging Available from: https://svi.nl/Nyquist-Calculator (2023)
- Segawa, M., et al. Quantification of cristae architecture reveals time-dependent characteristics of individual mitochondria. Life Science Alliance. 3 (7), e2019000620 (2020).
- Arganda-Carreras, I., et al. Trainable Weka Segmentation: a machine learning tool for microscopy pixel classification. Bioinformatics. 33 (15), 2424-2426 (2017).
- Stephan, T., Roesch, A., Riedel, D., Jakobs, S. Live-cell STED nanoscopy of mitochondrial cristae. Scientific Reports. 9, 12419 (2019).
- Erdmann, R. S., et al. Labeling strategies matter for super-resolution microscopy: A comparison between HaloTags and SNAP-tags. Cell Chemical Biology. 26 (4), 584-592 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved