A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הדפסה ביולוגית תלת-ממדית הידרוג'לים פוטו-ממדיים לחקר הפעלת פיברובלסטים
In This Article
Summary
מאמר זה מתאר כיצד להדפיס ביו-ממד הידרוג'לים פוטו-ממדיים כדי לחקור התקשות מטריצה חוץ-תאית והפעלת פיברובלסטים.
Abstract
הידרוג'לים שאינם ניתנים לצילום יכולים להשתנות מרחבית וזמנית בתגובה לחשיפה לאור. שילוב סוגים אלה של ביו-חומרים בפלטפורמות של תרביות תאים והפעלת שינויים באופן דינמי, כגון הגברת הנוקשות המיקרו-סביבתית, מאפשר לחוקרים למדל שינויים במטריצה החוץ תאית (ECM) המתרחשים במהלך התקדמות המחלה הפיברוטית (Fibrotic). כאן מוצגת שיטה להדפסה ביולוגית תלת-ממדית של ביו-חומר הידרוג'ל המסוגל לבצע שתי תגובות פילמור רציפות בתוך אמבט תמיכה בג'לטין. הטכניקה של הטבעה הפיכה חופשית של הידרוג'לים מרחפים (FRESH) הותאמה על ידי התאמת ה- pH של אמבט התמיכה כדי להקל על תגובת תוספת מיכאל. ראשית, הביו-דיו המכיל פולי(אתילן גליקול)-אלפא מתקרילט (PEGαMA) הגיב מחוץ לסטויכיומטריה עם קרוסלינקר מתכלה לתאים ליצירת הידרוג'לים רכים. הידרוג'לים רכים אלה נחשפו מאוחר יותר לפוטואינטטור ולאור כדי לגרום להומופולימריזציה של קבוצות לא מגיבות ולהקשיח את ההידרוג'ל. פרוטוקול זה מכסה סינתזת הידרוג'ל, הדפסה ביולוגית תלת-ממדית, פוטו-הקשחה ואפיון נקודות קצה להערכת הפעלת פיברובלסטים בתוך מבנים תלת-ממדיים. השיטה המוצגת כאן מאפשרת לחוקרים להדפיס ביו-ממד בתלת-ממד מגוון חומרים העוברים תגובות פילמור המזורזות ב-pH וניתן ליישם אותם כדי להנדס מודלים שונים של הומאוסטזיס רקמות, מחלות ותיקון.
Introduction
הדפסה ביולוגית תלת-ממדית היא טכנולוגיה טרנספורמטיבית המאפשרת לחוקרים להפקיד במדויק תאים וביו-חומרים בנפחים תלת-ממדיים וליצור מחדש את המבנה ההיררכי המורכב של רקמות ביולוגיות. במהלך העשור האחרון, ההתקדמות בהדפסה ביולוגית תלת-ממדית יצרה רקמות לב אנושיות פועמות1, מודלים פונקציונליים של רקמות כליות2, מודלים של חילופי גזים בתוך הריאה3, ומודלים של גידולים לחקר הסרטן4. המצאת טכניקות הדפסה ביולוגית תלת-ממדיות משובצות, כגון הטבעה הפיכה חופשית של הידרוג'ל מרחף (FRESH), אפשרה לשחזר מבנים מורכבים של רקמות רכות כגון כלי דם ריאתיים5 ואפילו לב אנושי6 בתלת-ממד. הדפסה ביולוגית תלת-ממדית של FRESH מאפשרת הדפסה שכבה אחר שכבה של דיו ביולוגי רך ובעל צמיגות נמוכה באמצעות אקסטרוזיה לתוך אמבט תמיכה דליל גזירה. אמבט התמיכה מורכב מחומר כגון מיקרו-חלקיקי ג'לטין ארוזים היטב הפועלים כפלסטיק בינגהאם ושומרים על הצורה והמבנה המיועדים של הביו-דיו לאחר ההדפסה. לאחר שהמבנה המודפס התמצק, ניתן להמיס את אמבט התמיכה על ידי העלאת הטמפרטורה ל -37 מעלות צלזיוס7.
מאמר סקירה שפורסם לאחרונה סיכם את החומרים שהודפסו בתלת-ממד בפרסומים שונים בטכניקת FRESH. חומרים טבעיים אלה נעים בין קולגן מסוג I לחומצה היאלורונית מתקרילט ומייצגים מספר מנגנוני ג'לציה שונים7. רוב המחקרים המבוצעים בטכניקת הדפסה ביולוגית תלת-ממדית זו משתמשים בביו-חומרים סטטיים שאינם משתנים בתגובה לגירויים חיצוניים. ביו-חומרים הידרוג'ל דינמיים פוטו-פוטו-ג'ל שימשו את המעבדה שלנו ואחרים 8,9,10,11,12 כדי למדל מגוון מחלות פיברוטיות. שלא כמו ביו-חומרים סטטיים, דיו ביולוגי המותאם לשימוש באור מאפשר ליצור מודל מרוכך עם ערך מודולוס אלסטי נמוך יותר, ולאחר מכן להקשיח אותו כדי לחקור תגובות תאיות לעלייה בהתקשות מיקרו-סביבתית.
מחלות פיברוטיות מאופיינות בעלייה בייצור המטריצה החוץ תאית שעלולה לגרום להצטלקות והתקשות13. התקשות רקמות יכולה ליזום פגיעה נוספת והרס של הרקמה הפגועה, גרימת נזק קבוע לאיברים ואפילו מוות; הפרעות פיברוטיות אחראיות לשליש מהתמותה בעולם. פיברובלסטים מייצרים מטריצה חוץ-תאית עודפת וחריגה במצב מחלה זה14,15. התפשטות פיברובלסטים מוגברת ושקיעת מטריצה חוץ-תאית מקשיחים עוד יותר את הרקמה ומפעילים לולאת משוב חיובי פרופיברוטית16,17,18,19. חקר הפעלת פיברובלסטים חיוני להבנת מחלות פיברוטיות. כאן אנו מציגים יתר לחץ דם עורקי ריאתי אנושי (PAH) כדוגמה להפרעה פיברוטית אחת שבה חשוב לחקות את הגיאומטריה התלת-ממדית של כלי הדם באמצעות הדפסה ביולוגית תלת-ממדית ולהציג את יכולות ההתקשות הדינמיות של הידרוג'לים פוטו-ממדיים. PAH הוא מצב שבו הלחץ בעורקי הריאה הראשיים עולה על רמות נורמליות ומפעיל עומס על הלב, מגביר את הפעלת הפיברובלסט ההרפתקני של עורק הריאה האנושי (HPAAF) ומקשיח את רקמות כלי הדם16,17,18,19. נוסחת ביודיו פולי(אתילן גליקול)-אלפא מתקרילט (PEGαMA) מאפשרת התקשות טמפורלית במבנים ומסייעת למדל הן רקמות בריאות והן התקדמות מחלה 5,8,9,10. ניצול תכונה ייחודית זו מאפשר לכמת את ההפעלה וההתרבות של HPAAF בתגובה להתקשות מיקרו-סביבתית בתלת-ממד ועשוי לספק תובנה רבת ערך לגבי המנגנונים התאיים המעורבים במחלה זו. הפרוטוקול המתואר כאן יאפשר לחוקרים ליצור מודלים תלת-ממדיים המשחזרים שינויים במיקרו-סביבה החוץ תאית במהלך התקדמות המחלה או תיקון רקמות ולחקור הפעלת פיברובלסטים.
Protocol
1. סינתזת PEGαMA ואפיון
הערה: סינתזת פולי(אתילן גליקול)-אלפא מתקרילט (PEGαMA) הותאמה מ- Hewawasam et al . ובוצעה בתנאים נטולי לחות9.
- לשקול את המגיבים.
הערה: לדוגמה, שקול 5 גרם 10 ק"ג/מול PEG-הידרוקסיל בעל 8 זרועות (PEG-OH) ו-0.38 גרם נתרן הידריד (NaH) (ראה טבלת חומרים). - מוסיפים ערבוב לבקבוק שלנק במינון 250 מ"ל ומטהרים עם ארגון.
- ממיסים את ה-PEG-OH בנפח הנמוך ביותר של טטרהידרופורן נטול מים (THF) הדרוש להמסה בתוך צלוחיות שלנק.
הערה: כ-80 מ"ל THF יתמוסס ב-5 גרם PEG-OH. הוסף את הכמות המינימלית של THF הדרושה להמסת ה- PEG-OH. - הוסיפו 3 פעמים עודפי NaH טוחנים לתערובת התגובה וערבבו בטמפרטורת החדר (RT) במשך 30 דקות.
- הוסף פי 6 עודף מולארי אתיל 2-(ברומומתיל)אקרילט (EBrMA, ראה טבלת חומרים) טיפה לבקבוק שלנק וכסה את כלי התגובה ברדיד אלומיניום כדי להגן עליו מפני אור. יש לערבב את התגובה בטמפרטורת החדר במשך כ-48 שעות.
הערה: עבור 5 גרם PEG-OH ו- 0.38 גרם NaH, השתמש ב- EBrMA של 3.68 מ"ל עבור תגובה זו. - מוסיפים כמה טיפות של 1 N חומצה אצטית כדי להרוות את התגובה. סנן ואקום את התמיסה באמצעות עזר סינון.
הערה: הוספת חומצה אצטית תייצר בועות גז. הפסיקו להוסיף טיפות חומצה אצטית כאשר הבועות מפסיקות להיווצר מכיוון שזה מעיד על כך שהתערובת רוותה בהצלחה. - רכז את התסנין על מאייד סיבובי וזרז באתר דיאתיל 4 מעלות צלזיוס. יש להשאיר את המשקע מוגן מפני אור בטמפרטורה של 4°C למשך 12-18 שעות.
- הוסף נייר סינון Whatman למשפך Buchner. שפכו באיטיות את תערובת התגובה על נייר המסנן והשתמשו בשאיבת ואקום כדי להפריד את המשקע מאתר דיאתיל. לאסוף את המשקע בבקבוק סינון יבש ונקי.
- יש לייבש את המוצר בוואקום למשך 5 שעות לפחות או לילה בטמפרטורת החדר ולהמיס בנפח מינימלי של מים נטולי יונים. העבירו את המוצר המומס לצינורות דיאליזה (ראו טבלת חומרים) ובצעו דיאליזה כנגד 3.5 ליטר מים שעברו דה-יוניזציה למשך ארבעה ימים לפחות. החליפו את מי הדיאליזה כל 12 שעות.
הערה: המוצר יופיע כאבקה מוצקה לבנה טהורה יבשה לחלוטין לאחר ייבוש בוואקום. - להקפיא את המוצר במהירות הבזק ולבצע lyophilize במשך כ 72 שעות או עד שהוא יבש לחלוטין.
- ממיסים את המוצר בכלורופורם D (CDCl 3). הפעל את הדגימה באמצעות 1H NMR עם פרוטוקול המבצע 248 סריקות עם זמן הרפיה של 2.5 שניות.
- אמת את הפונקציונליות והטוהר של המוצר על ידי כיול שיא הממסCDCl 3 ל- 7.26 עמודים לדקה. שלב את שיא הפרוטונים של עמוד השדרה PEG (d3.71) וכייל את האינטגרציה ל-114.
- שלב את הפסגות הנותרות: PEGαMA 1 H NMR (300 MHz, CDCl 3): d (ppm) 1.36(t, 3H, CH 3-),3.71 (s, 114H, PEG CH 2-CH 2), 4.29 (t, s, 4H, -CH 2-C(O)-O-O, -O-CH 2-C(=CH 2)-), 5.93 (q, 1H, -C=CH 2), 6.34 (q, 1H, -C=CH 2) והשווה את האינטגרציה עבור פסגות קבוצת הקצה αMA alkene לערך הצפוי (1H) בהתבסס על כיול עמוד השדרה של PEG (איור 1).
הערה: בצע ממוצע של שתי הפסגות המסומנות כ- "a" (איור 1) והכפל ב- 100 כדי לקבל את אחוז הפונקציונליות הממוצע של PEGαMA.
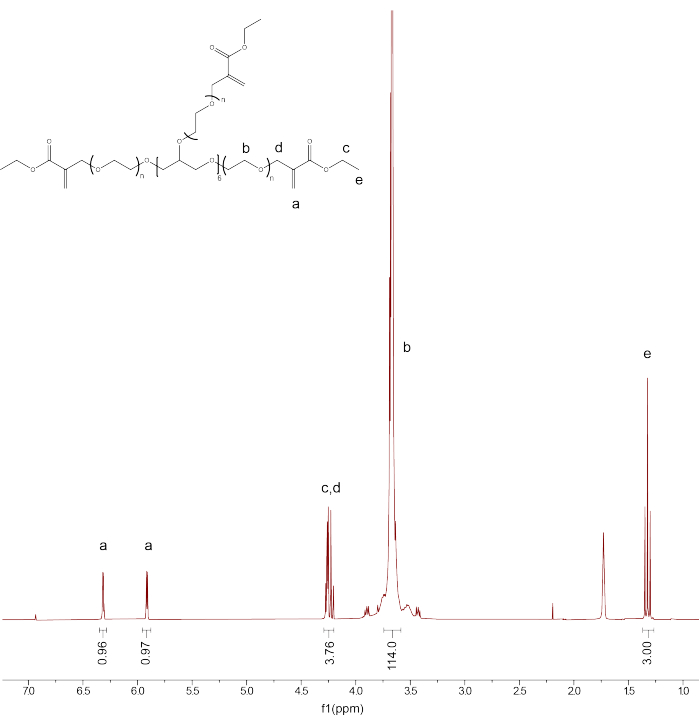
איור 1: Proton NMR אישר תפקוד מוצלח של PEGαMA. ניתוח NMR בוצע בכלורופורם-D (CDCl 3) והראה תפקוד של 96.5%. PEGαMA 1 H NMR (300 MHz, CDCl3): d (ppm) 1.36(t, 3H, CH 3-),3.71 (s, 114H, PEG CH 2-CH 2), 4.29 (t, s, 4H, -CH 2-C(O)-O-O, -O-CH 2-C(=CH 2)-), 5.93 (q, 1H, -C=CH 2), 6.34 (q, 1H, -C=CH 2). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
2. עיצוב דגם והגדרת מדפסת ביולוגית תלת-ממדית
הערה: מדפסת תלת-ממד מסחרית (ראה טבלת חומרים) שונתה על-ידי החלפת המכבש התרמופלסטי במכבש משאבת מזרקים שנבנה במיוחד והותאם מ-Hinton et al.20. עיצובי קוד פתוח זמינים באינטרנט: https://3d.nih.gov/users/awfeinberg.
- פתח את תוכנת Fusion 360 (ראה טבלת חומרים) וצור עיצוב צילינדר חלול תלת-ממדי בעזרת מחשב.
הערה: קובץ להורדה שניתן להשתמש בו לשלב זה ומחקה את הגיאומטריה של כלי הדם ניתן למצוא בקובץ משלים 1. - שמור את הקובץ ופתח אותו בתוך תוכנת Slic3r (ראה טבלת חומרים). בדוק שוב שכל הפרמטרים הם כרצונך, ולאחר מכן לחץ על כפתור הייצוא G-code. שמור את קוד G במחשב.
- פתח את תוכנת Pronterface (ראה טבלת חומרים) והעלה את קובץ G-code.
הערה: תוכנת Pronterface מתממשקת עם המדפסת הביולוגית ומספקת בקרת קלט חומרה מספקת. ניתן למצוא קובץ G-code שמיש בקובץ משלים 2. - העבר את המדפסת הביולוגית ואת כל החלקים הקשורים אליה לארון בטיחות ביולוגית (BSC) באמצעות טכניקות אספטיות.
- הרכיבו קצה מחט קהה באורך 30 גרם 0.5 אינץ' (ראו טבלת חומרים) למזרק זכוכית ההדפסה והניחו בצד.
- חבר את כבל החשמל של המדפסת הביולוגית לשקע. לחץ על לחצן ההפעלה האדום בחזית המדפסת הביולוגית כדי להפעיל אותה. חבר את כבל האפיק הטורי האוניברסלי (USB) בין המחשב למדפסת הביולוגית וודא שכל חיבורי החוטים מבוססים ומחוברים.
3. הכנת אמבט התמיכה והריאגנטים
הערה: בצע את כל השלבים בארון בטיחות ביולוגית באמצעות טכניקות אספטיות.
- הכינו מדיום תרבית תאים המורכב מתוספי SmBM Basal Medium (CC-3181) ו-SmGM-2 SingleQuots (CC-4149), למעט נסיוב בקר עוברי (FBS), בהתאם להוראות היצרן. יש לאחסן בטמפרטורה של 4°C עד לשימוש.
- Aliquot 50 מ"ל של מדיום תרבית התא ולהוסיף 1% v/v של FBS (CC-4149) (ראה טבלה של חומרים) כדי ליצור מדיה בסרום נמוך. יש לאחסן בטמפרטורה של 4°C עד לשימוש.
- יש להשהות מחדש את אבקת תרחיף הג'לטין בהתאם להוראות היצרן באמצעות תרבית תאים סטרילית ללא FBS כממס (ראה טבלת חומרים). מיד לפני השימוש, התאימו את ה-pH הסופי של תמיסת הג'לטין ל-pH 9 באמצעות 2M אשלגן הידרוקסידי (KOH) ו/או 2M חומצה הידרוכלורית (HCl) כדי להתאים את רמת החומציות של התמיסה לפי הצורך באמצעות מד pH.
- מלא את המספר הרצוי של בארות של צלחת 24 באר כל אחד כחצי מלא באמצעות 1 מ"ל של slurry ג'לטין לכל באר באמצעות מזרק ללא המחט.
הערה: מלא באופן אחיד את מרכז הבארות וודא שאין כיסי אוויר. הקש על הצלחת כדי לעזור בפיזור שווה של תרחיף המיקרו-חלקיקים. התאם את הגובה והנפח של הבוצה לכל באר לפי הצורך כדי להתאים לכל גודל וצורה של הדפסה ביולוגית. משתמשים יכולים ליצור מזרק תוצרת בית כדי להעביר את slurry ג'לטין לתוך כל באר. זה יכול להיעשות על ידי הוספת בוכנה מזרק בגודל הנכון לתוך מבחנה 50 מ"ל כבר המכיל את slurry ג'לטין דחוס בתחתית. בעת הכנסת הבוכנה, הכנס חוט מנחה קטן לצד המבחנה כדי לסייע לאוויר להימלט, ולאחר מכן הסר אותו כאשר הבוכנה באה במגע עם תמיסת הג'לטין. מיד לפני השימוש, חתכו את קצה המבחנה עם סכין גילוח כדי ליצור חור לתרחיף הג'לטין החוצה ולחצו על הבוכנה. - הניחו את הלוח המלא ב-24 בארות על מרכז שלב המדפסת הביולוגית והצמידו אותו לבמה.
הערה: איור 2 מציג התקנה כללית של מדפסת ביולוגית. הניחו גומייה סביב במת ההדפסה כדי להצמיד לוח בן 24 בארות לפלטפורמה ולמנוע תזוזה.

איור 2: הגדרת הדפסה ביולוגית בסיסית בתלת-ממד. המדפסת הביולוגית הוקמה בסביבה סטרילית כגון ארון בטיחות ביולוגית, וראש ההדפסה הורכב כך שמזרק הזכוכית ומחט הזכוכית הורדו אנכית לאזור הדפסת אמבט התמיכה שמתחת. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
4. תרבית תאים
הערה: בצע את כל השלבים בארון בטיחות ביולוגית באמצעות טכניקות אספטיות.
- הפשירו תאי HPAAF (הושגו באופן מסחרי, ראו טבלת חומרים) והרחיבו אותם בצלוחיות פלסטיק T-75 שטופלו בתרבית רקמה המכילות SmBM Basal Medium (CC-3181) ובכל תוספי SmGM-2 SingleQuots (CC-4149) בהתאם להוראות היצרן (ראו טבלת חומרים).
הערה: יש להשתמש בפרוטוקולים סטנדרטיים של תרביות תאים עבור תאים דבקים, תוך שמירה על התאים בטמפרטורה של 37°C ו-5%CO2 וחידוש המדיה מדי כמה ימים. - לאחר שה- HPAAFs הגיעו למפגש ~ 80-90%, שאפו את המדיה ושטפו את התאים פעם אחת במי מלח חוצצי פוספט (PBS).
- יש להוסיף כ-4 מ"ל של 0.05% טריפסין-EDTA שחומם מראש לכל בקבוק T-75. הטה את הבקבוק כדי להבטיח שכל משטח תרבית התאים מכוסה בתמיסת טריפסין-EDTA 0.05%. לדגור על הצלוחיות במשך 3-5 דקות ב 37 ° C ולבדוק ניתוק התא.
- ברגע שהתאים צפים, הוסיפו לפחות 6 מ"ל של מדיום הנשר המעובד של דולבקו (DMEM) לכל בקבוק והעבירו את התאים לצינור חרוטי של 50 מ"ל.
- צנטריפוגה את תרחיף התא ב 300 x גרם במשך 5 דקות בטמפרטורת החדר כדי pellet את התאים. שאפו את הסופרנאטנט מכדורית התא והשהו מחדש את התאים במדיה של 1-3 מ"ל עם FBS באמצעות פיפטה של 1000 מיקרוליטר, מה שמבטיח השעיה של תא יחיד.
- מעבירים 10 μL של תרחיף התא לצינור מיקרוצנטריפוגה. מוסיפים 10 μL של תמיסת Trypan Blue ומערבבים היטב. השתמש 10 μL של תערובת זו כדי לספור תאים בתוך hemocytometer באמצעות מיקרוסקופ אור הפוך.
הערה: כדי להשיג ריכוז ביו-דיו סופי של 4 x 106 תאים/מ"ל, הוקצו 800,000 פיברובלסטים לכל 200 מיקרוליטר של ביו-דיו.
5. הכנת ביודיו הידרוג'ל
הערה: הכנת Bioink הותאמה מ- Davis-Hall et al.5. ניתן להשלים את שלבים 5.1-5.2 במקביל לשלבים 4.1-4.3 כדי למזער את הזמן בין איסוף התאים והשעייתו מחדש בדיו הביולוגי. בצע שלבים בארון בטיחות ביולוגית באמצעות טכניקה אספטית.
- הכינו תמיסת 20 mM tris(2-carboxyethyl) phosphine (TCEP, ראו טבלת חומרים) pH 7 ומסנן סטרילי באמצעות מסנן מזרקים 0.2 מיקרומטר. מיד לפני השימוש, יש להוסיף 2 M KOH ו/או 2 M HCl כדי להתאים את רמת החומציות של התמיסה לפי הצורך. מדדו באמצעות מד חומציות והתכווננו בהתאם.
הערה: TCEP מפחית אג"ח דיסולפידיות. - הכינו תמיסת מלאי של 0.25 מ"ג/מ"ל של PEGαMA התלויה מחדש במדיה סטרילית של תרביות תאים ללא FBS, תמיסות מלאי של 250 מילימטר של 1,4-dithiothreitol (DTT), קרוסלינקר מתכלה MMP2 ופפטיד CGRGDS (RGD) (ראו טבלת חומרים), השהיה מחדש ב-TCEP סטרילי של 20 mM, ותמיסת מלאי של 15 wt% של פולי(אתילן אוקסיד) (PEO) במים מזוקקים (DI) באמצעות פיפטות לפי הצורך.
- בהתאם לטבלה 1 כמדריך, שלבו את הכמויות הדרושות בהתאמה של PEGαMA, DTT, קרוסלינקר מתכלה MMP2, PEO, CGRGDS, ומדיה של תרביות תאים בעלות נסיוב נמוך יחד עם הפיברובלסטים בצינור חרוטי של 50 מ"ל.
הערה: מומלץ לבדוק את ה- pH עם רצועות pH לאחר הוספת כל המדיה מלבד תרבית התא מכיוון ששילוב זה אמור לגרום ל- pH להיות קרוב מאוד ל- 6.2. אם נדרשות התאמות pH נוספות, עקוב אחר כמות הנפח הנוספת הדרושה כדי להתאים את ה- pH של הפתרון המקדים. הגדל את הנפח הכולל ל- 200 μL על-ידי הוספת נפח המדיה הנותר של תרבית התא פחות כל נפח שנוסף במהלך התאמת ה- pH הסופית. - ערבבו את הביו-דיו יחד באמצעות פיפטת תזוזה חיובית כדי להבטיח שהתאים הם תאים בודדים ולאשר שתמיסת הקודמן הסופית היא pH 6.2 כדי למנוע פילמור מזורז בסיס במהלך הדפסה ביולוגית תלת-ממדית.
- טען את הביו-דיו לתוך מזרק הזכוכית על ידי הסרת הבוכנה ושימוש במזרק נפרד עם קצה מחט קהה באורך 1.5 אינץ' באורך 1.5 אינץ' (ראה טבלת חומרים) מחובר כדי להעביר את הביו-דיו מצינור הצנטריפוגה למזרק, תוך זהירות להימנע מיצירת בועות אוויר בתוך התמיסה.
- הניחו את מזרק הזכוכית בתוך ראש ההדפסה וחברו רכיבי ראש הדפסה כך שהכל יהיה מורכב היטב ומוכן להדפסה.
הערה: בשלב זה, מזרק הזכוכית בתוך ראש ההדפסה צריך להיות בעל קצה מחט קהה באורך 30 אינץ' 0.5 אינץ' המחובר אליו להדפסה.
| רכיב | ריכוז תמיסת מלאי | סכום להוספה |
| PEGαMA | 0.25 מ"ג/מ"ל | 140 מיקרוליטר |
| DTT | 250 מ"מ | 12.24 מיקרוליטר |
| קרוסלינקר מתכלה MMP2 | 250 מ"מ | 5.25 מיקרוליטר |
| ר.ג.ד. | 250 מ"מ | 1.6 מיקרוליטר |
| PEO | 15 WT% | 33.33 מיקרוליטר |
| מדיית הפעלה ו/או ריאגנטים לכוונון pH | - | 7.58 מיקרוליטר |
| פיברובלסטים | - | 800000 תאים |
טבלה 1: נפחים לדוגמה הדרושים להכנת 200 מיקרוליטר של ביו-דיו (תמיסת קודמן הידרוג'ל ותאי פיברובלסט).
6.3D הדפסה ביולוגית
הערה: בצע את כל השלבים בארון בטיחות ביולוגית באמצעות טכניקות אספטיות.
- באמצעות חיצי הכיוון בתוך תוכנת Pronterface, התאם ידנית את מיקום מחט האקסטרוזיה למרכז הבאר ובתוך תרחיף האמבטיה התומך. השאירו לפחות 1 מ"מ תמיכה באמבט מתחת לקצה המחט.
הערה: לתוכנה אין יכולת לדעת היכן המחט נמצאת בתוך החלל. זה לגמרי תלוי במשתמש להזיז את המחט על ידי לחיצה ידנית על החצים בתוך התוכנה (למשל, לחיצה על החץ למעלה תזיז את המחט למעלה או הרחק מפלטפורמת ההדפסה, וכו '). תמרנו את המחט בזהירות כדי להבטיח שהיא לא תפגע בגבולות הבאר. - ברגע שקצה המחט ממוקם במרכז הבוצה בתוך הבאר, לחצו על כפתור ההתחלה בתוך Pronterface וחכו שההדפסה תושלם כדי להשיג מבנים, כפי שמודגם באיור 3A.
הערה: כדי להדפיס ביו מבנה אחד באמצעות הקובץ שסופק (קובץ משלים 1), זה ייקח בערך 3 דקות. זה לוקח בערך 5 דקות כדי לכוון ולהזיז את המחט ולאחר מכן להדפיס מבנה אחד לחלוטין מתחילתו ועד סופו. - חזור על שלבים 6.1-6.2 עד לעמידה במספר המבנים הרצויים המודפסים ביולוגית.
הערה: מומלץ ליצור יותר מבנים מהנדרש כדי להתחשב בהדפסות לא מוצלחות. אם מתרחש כשל, עבור לבאר הבאה, אפס הכל וחזור שוב על שלבים 6.1-6.2. - השאירו את צלחת הבאר בטמפרטורת החדר וכסו אותה ב-BSC למשך שעה אחת לאחר סיום ההדפסה כדי לאפשר פילמור מזורז בסיס של ההידרוג'ל הניתן לצילום.
- מניחים את צלחת הבאר המכילה מבנים מודפסים ביולוגית תלת ממדית לתוך אינקובטור סטרילי של 37 מעלות צלזיוס ומשאירים אותם למשך 12-18 שעות כדי להמיס את תרחיף האמבטיה התומך.
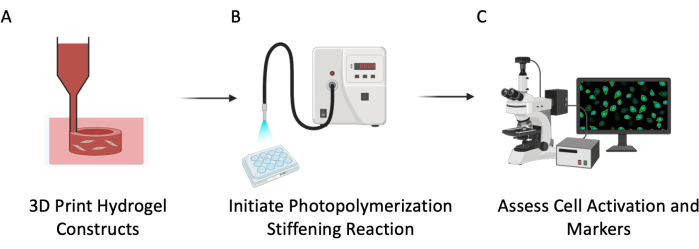
איור 3: סכמה ניסיונית. פרוטוקול זה תואר בשלושה שלבים עיקריים: (A) הדפסה ביולוגית תלת-ממדית של צינורות חלולים PEGαMA עם תאים משובצים כדי לחקות כלי דם ריאתיים. (B) פוטואיניוזציה של תגובת הומופולימריזציה כדי להקשיח את המיקרו-סביבה התאית. (ג) הערכת סמנים תאיים לצורך התרבות והפעלה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
7.3D תרבית בנייה מודפסת ביולוגית ופוטוטיפנינג
הערה: יש לבצע את כל השלבים בארון בטיחות ביולוגית בטכניקות אספטיות.
- הכן תמיסת מלאי ליתיום פניל-2,4,6-טרימתילבנזואילפוספינאט (LAP) ב-2.2 mM (ראה טבלת חומרים) ב-PBS ומסנן סטרילי באמצעות מסנן מזרקים 0.2 מיקרומטר. הגן על פתרון LAP מפני אור.
- לאחר 12-18 שעות, שנה את המדיה סביב המבנים המודפסים ביולוגית. הסר ידנית את המדיה ואת אמבט התמיכה בג'לטין מומס בתוך הבארות והיזהר שלא להפריע למבנים המודפסים ביולוגית.
הערה: כדאי להסיר באיטיות את המדיה תוך החזקת הצלחת בזווית של 45°, כך שהמבנים יוצאים בתוך הבאר וניתן לראות אותם. גליל הידרוג'ל שקוף צריך להיות ניתן לזיהוי בכל באר עם הדפסה מוצלחת (איור 4A). - הוסיפו נפח מתאים של מדיה עם סרום נמוך לכל באר.
הערה: עבור צלחת של 24 בארות, מדיה של 700 μL לכל באר צריכה לכסות לחלוטין את המבנים המודפסים ביולוגית. התאימו לפי הצורך. - להחזיר את הצלחת לאינקובטור ולשנות את המדיה על הדגימות כל 3 ימים או בהתאם לתכנון הניסוי.
- עשרים וארבע שעות לפני נקודת זמן ההתקשות הרצויה, הסר מדיה מהדגימות והחלף אותן במדיה בעלת סרום נמוך בתוספת LAP סטרילי של 2.2 מילימטר.
הערה: כדי לתייג את המבנה באופן פלואורסצנטי, יש לנפח מבנים מודפסים ביולוגית תלת-ממדיים ב-PBS בתוספת 10 מיקרומטר של מתקרילוקסיאתיל תיוקרבמואיל רודאמין B (ראו Tמסוגל של חומרים) למשך הלילה, ולאחר מכן להתקשות כמתואר בשלב 7.6 כדי לתייג את המבנה באופן פלואורסצנטי. העבירו ל-PBS למשך יומיים בטמפרטורה של 4°C כדי להסיר עודפי רודמין ותמונה באמצעות מסנן TRITC (איור 4B,C). - בנקודת זמן ההתקשות הרצויה, הסר מחצית מהמדיה מהבארות להקשחה והנח את הצלחת עם המכסה כבוי תחת אור UV. הפעל את אור העל-סגול והקשיח את המבנים האלה על-ידי יישום אור של 10 mW/cm2 365 ננומטר למשך 5 דקות באמצעות Omnicure (ראה טבלת חומרים) ומסנן פס פס של 365 ננומטר (איור 3B).
הערה: השתמש ברדיומטר/פוטומטר כדי לוודא שעוצמת האור נכונה לפני חשיפת התאים לאור UV. - הסר את המדיה הנותרת מבארות אלה והוסף מדיה טרייה בעלת נסיוב נמוך לכל באר. מחזירים את הצלחת לאינקובטור.
- הוציאו את הצלחת מהאינקובטור ובצעו את מחקר הפעלת הפיברובלסטים בנקודת הזמן הרצויה לאחר שלב 9.
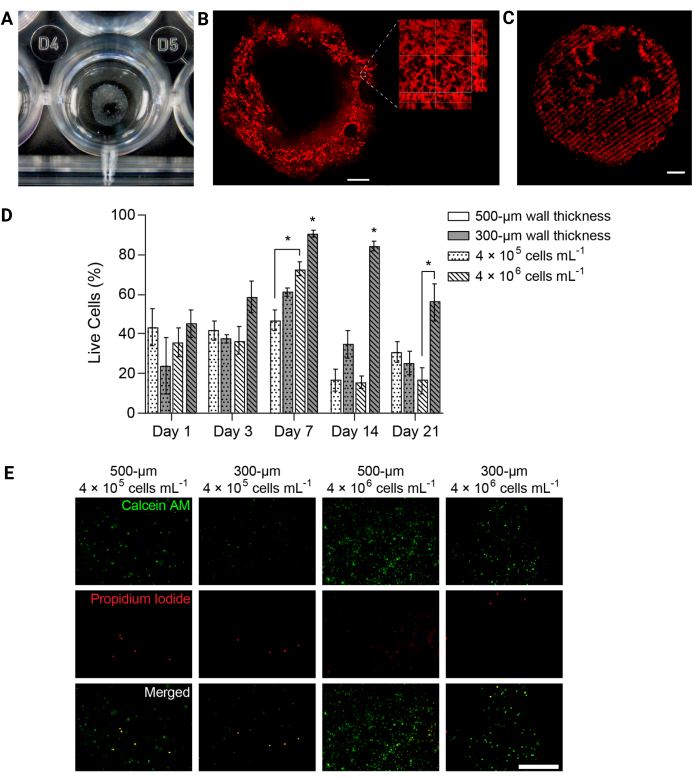
איור 4: מבני הידרוג'ל מודפסים בתלת-ממד תמכו ביכולת הקיום של התאים לאורך זמן. (A) תצלום של מבנה הידרוג'ל מודפס בתלת-ממד בלוח בן 24 בארות. (B) הקרנה בעוצמה מרבית של הידרוג'ל מודפס בתלת-ממד PEGαMA המסומן באופן פלואורסצנטי. סרגל קנה מידה = 1 מ"מ. מיקרוסקופ בהגדלה גבוהה יותר הראה נקבוביות בתוך מבנה ההידרוג'ל המושרות על ידי מיקרו-חלקיקי ג'לטין באמבט התמיכה בהדפסה ביולוגית של FRESH. (C) שפופרת PEGαMA מודפסת בתלת-ממד עם אזורים קשיחים המסומנים באופן פלואורסצנטי שצולמו במיקרוסקופ קונפוקלי (מחסנית z של 100 מיקרומטר מוצגת כהקרנה בעוצמה מרבית) הראתה שליטה מרחבית על התקשות בתלת-ממד. סרגל קנה מידה = 500 מיקרומטר. (D) כדאיות HPAAF במבנים מודפסים בתלת-ממד שנמדדו במבחני Live/Dead. מבנים בעובי 300 מיקרומטר ו-4 × 106 תאים/מ"ל השיגו ביצועים טובים יותר מכל התנאים האחרים בכל נקודת זמן. הכדאיות הגיעה לשיאה ביום השביעי. תנאי זה ונקודת זמן זו נבחרו לניסויים עתידיים. עמודות מציגות ממוצע ± SEM, n = 3. *, עמ' < 0.05, ANOVA, Tukey HSD. (E) תמונות קונפוקליות מייצגות של תאים במבנים תלת-ממדיים המוכתמים בריאגנט חי/מת ביום 7, נקודת הזמן עם הכדאיות הכוללת הגדולה ביותר. Calcein AM מסומן תאים חיים בירוק ופרופידיום יודיד מסומן תאים מתים באדום. העמודה הימנית ביותר מראה שבמצב בעל הביצועים הטובים ביותר הייתה התפלגות תאים אחידה ואחוז גבוה של תאים חיים. סרגל קנה מידה = 500 מיקרומטר. הועתק באישור דייוויס-הול ואחרים 5. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
8. הערכת כדאיות הפיברובלסטים
- בנקודות זמן הכדאיות הרצויות, יש להכתים באמצעות calcein AM ו-propidium iodide (ראו טבלת חומרים).
הערה: לסיכום, יש להסיר מדיה מכל באר ולשטוף את המבנים עם PBS סטרילי. יש לדגור על המבנים בתמיסת צביעה חיה/מתה למשך 40 דקות בטמפרטורה של 37°C על נדנדה. תמיסת הצביעה צריכה להכיל calcein AM (דילול 1:1000) ופרופידיום יודיד (דילול 1:1000) לזיהוי תאים חיים או מתים בעת הדמיה. - מעבירים את המבנים ל-PBS סטרילי ומיד מצלמים במיקרוסקופ פלואורסצנטי קונפוקלי. קבל שלוש תמונות z-stack שונות של 100 מיקרומטר לכל דגימה לכל נקודת זמן, ובטא את הכדאיות כאחוז הממוצע של תאים חיים (איור 4D,E).
9. הערכת הפעלת פיברובלסטים
- הכינו 3% אלבומין בסרום בקר (BSA) ו-0.1% v/v Tween 20 ב-PBS. פתרון זה ייקרא פתרון immunofluorescence (IF).
- בנקודות הזמן הרצויות, הסר מדיה מבארות הדגימה ושטוף את המבנים עם PBS. החלף את PBS עם 4% paraformaldehyde (PFA) ולשמור דגימות אלה על 37 ° C במשך 30 דקות על נדנדה. לאחר מכן, החלף את 4% PFA עם גליצין 100 mM ב- PBS והשאר דגימות אלה על נדנדה בטמפרטורת החדר (RT) למשך 15 דקות נוספות.
- לאחר מכן, להעביר דגימות אלה לתוך Tissue-Tek Cryomolds, לכסות את הדגימה לחלוטין עם טמפרטורת חיתוך אופטימלית (OCT) פתרון (ראה טבלה של חומרים), ולאפשר OCT להתפזר לתוך הדגימות במשך 12-18 שעות ב 4 ° C.
- הקפיאו במהירות הבזק את הדגימות המושרות ב-OCT ב-2-מתילבוטאן באמצעות חנקן נוזלי. מלאו קופסת קלקר או מיכל מתאים אחר בחנקן נוזלי ולאחר מכן הניחו מיכל שני מלא ב-2-מתילבוטאן בתוך החנקן הנוזלי כך שהוא יהיה לפחות בחצי הדרך שקוע. השתמש במלקחיים כדי להחזיק כל קריומולד המכיל דגימה מכוסה OCT בחנקן נוזלי מקורר 2-methylbutane עד להקפאה גלויה. דגימות אלה ניתן לאחסן ב -80 ° C עד שהם מוכנים להקפאה.
התראה: יש להשתמש בציוד מגן אישי (PPE) כגון כפפות להגנה מפני קור, סינר מגן קור ומגן פנים המסופק בערכת הבטיחות הקריוגנית (ראה טבלת חומרים) בעת טיפול בחנקן נוזלי. - קריוסקציה של דגימות OCT קפואות בטמפרטורה של -22°C וחיבור פרוסות בעובי 10 מיקרומטר לשקופיות מיקרוסקופ זכוכית טעונות חיובית. הכינו שלוש שקופיות מיקרוסקופ עם לפחות 3-5 קריוסקציות לכל שקופית עבור כל דגימת הידרוג'ל תלת-ממדית.
הערה: ניתן לאחסן את שקופיות המיקרוסקופ בנקודה זו ב -80 ° C במידת הצורך כנקודת עצירה. - תקן את ההקפאה באצטון קר כקרח למשך 15 דקות כדי לעזור לקריוסקציות להיצמד לשקופיות. שטפו בעדינות את ההקפאה במי RT כדי להסיר את שאריות ה-OCT. תנו לדגימות אלה להתייבש ושרטטו את ההקפאה בעזרת עט הידרופובי (ראו טבלת חומרים).
- חדרו את הדגימות בטמפרטורת החדר עם 0.2% v/v Triton X-100 ב-PBS למשך 10 דקות ולאחר מכן חסמו את המקטעים עם 5% BSA w/v ב-PBS למשך שעה אחת ב-RT.
- הוסף את נוגדן אקטין שריר אלפא חלק (αSMA) של עכבר ראשי (דילול 1:250) (ראה טבלת חומרים) לתמיסת IF. אחסן דגימות חתוכות אלה עם הנוגדן העיקרי עליהן למשך הלילה ב 4 מעלות צלזיוס. שטפו את הדגימות 3 פעמים בתמיסת IF.
- לדגור על המקטעים בתמיסת IF המכילים את נוגדן העז המשני נגד עכבר Alexa Fluor 555 (דילול 1:250) ושתי טיפות של ActinGreen 488 ReadyProbe (ראה טבלת חומרים) למיליליטר של תמיסת IF. כסו את הדגימות לכל השלבים הבאים ברדיד אלומיניום כדי להגן עליהן מפני אור ותנו לתמיסת הנוגדנים המשנית להישאר על הדגימות למשך שעה אחת ב- RT.
- שטפו את המקטעים 3x בתמיסת IF. יש לדגור עליהם ב-300 ננומטר 4',6-diamidino-2-phylindole (DAPI) במי DI למשך 15 דקות ב-RT. יש לבצע שטיפה סופית של המקטעים 3x במי DI.
- באמצעות 10 μL של מגיב אנטי-דהייה זמין מסחרית (ראה טבלת חומרים), לכסות את המקטעים בשיטות סטנדרטיות.
הערה: ניתן לאחסן את השקופיות המותקנות מוגנות מפני אור במקפיא של -80°C עד לצורך הדמיה. - דמיינו את הקריוסקציות באמצעות מיקרוסקופ פלואורסצנטי (איור 3C ואיור 5B). תמונה של שלושה מקטעים אקראיים בכל שקופית באמצעות מטרה של 10x.
הערה: יש לצלם תמונות בערוצי DAPI, FITC ו-TRITC. - העלה את התמונות ל- ImageJ (NIH). כמת את אחוז התאים החיוביים αSMA כמדד להפעלת פיברובלסטים (איור 5A) על-ידי חלוקת המספר הכולל של תאים חיוביים ל-αSMA במספר הכולל של גרעיני תאים עבור כל שדה ראייה.
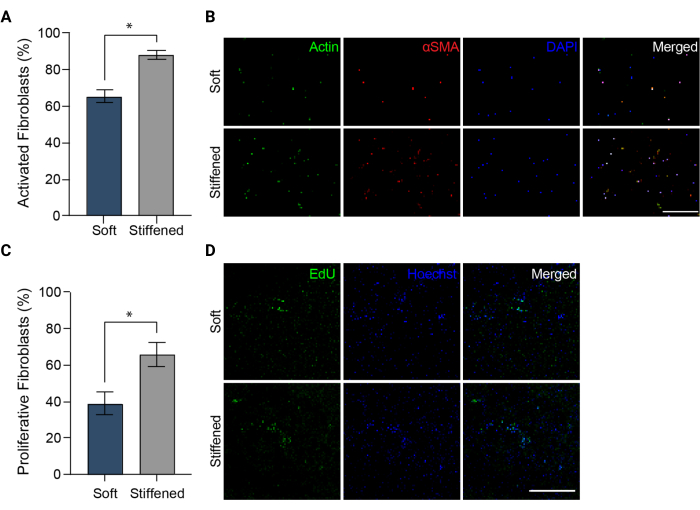
איור 5: הפעלת פיברובלסטים במודלים תלת-ממדיים מודפסים של אדventitia עורקי ריאה . (A) הפעלה פיברוטית בהידרוג'לים תלת-ממדיים רכים ונוקשים שנמדדו על-ידי ביטוי αSMA. HPAAFs במבנים קשיחים היו חיוביים יותר באופן משמעותי עבור αSMA מאשר תאים במבנים רכים. עמודות מייצגות ממוצע ± SEM, n = 3. *, עמ' < 0.05, מבחן Mann-Whitney U. (B) תמונות קונפוקליות מייצגות של אימונוסטיין עבור αSMA, אקטין ו-DAPI בהידרוג'לים תלת-ממדיים רכים ונוקשים. HPAAFs במבנים קשיחים הראו שכיחות גבוהה יותר של αSMA immunofluorescence מאשר תאים במבנים רכים. סרגל קנה מידה = 250 מיקרומטר. (C) התפשטות פיברובלסטים במבנים ביו-מודפסים תלת-ממדיים רכים ונוקשים שנמדדו על ידי חיובי EdU. HPAAFs במבנים קשיחים היו חיוביים יותר באופן משמעותי עבור EdU מאשר תאים במבנים רכים. עמודות מייצגות ממוצע ± SEM, n = 3. *, p < 0.05, מבחן Mann-Whitney U. (D) תמונות קונפוקליות מייצגות של צביעה חיסונית עבור צבע EdU ו-Hoechst בהידרוג'לים תלת-ממדיים רכים ונוקשים. HPAAFs במבנים קשיחים הראו אימונופלואורסנציה EdU נפוצה יותר מאשר תאים במבנים רכים. סרגל קנה מידה = 300 מיקרומטר. הועתק באישור דייוויס-הול ואחרים 5. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
10. הערכת התפשטות הפיברובלסטים
- עשרים וארבע שעות לפני נקודת הזמן הרצויה להתפשטות, הסר את מדיית תרבית התאים מכל באר והחלף במדיה בעלת נסיוב נמוך בתוספת תמיסת 10 μM EdU מערכת הפצת התאים הזמינה מסחרית (ראה טבלת חומרים). מחזירים את הדגימות לאינקובטור לדגירה של לילה.
- בנקודת זמן ההתפשטות הרצויה, תקן את הדגימות המודגרות עם EdU באמצעות 4% PFA ב 37 ° C במשך 30 דקות על נדנדה. החלף את תמיסת 4% PFA עם גליצין 100 mM ב- PBS ודגר על דגימות ב- 37 ° C למשך 15 דקות לפחות. מוסיפים את Hoechst בריכוז מתאים למשך 30 דקות ולאחר מכן שוטפים את המבנים 2x עם PBS.
הערה: ניתן לאחסן את הדגימות מוגנות מפני אור בטמפרטורה של 4°C עד להדמיה. - צלם את כל דגימות ה- EdU הקבועות והמאוחסנות באמצעות מיקרוסקופ פלואורסצנטי והגדרות ומסננים מוצעים של ערכת התפשטות תאים (איור 3C ואיור 5D). קבל שלוש תמונות שונות של ערימת z של 100 מיקרומטר לכל דגימה וצור הקרנות מרביות מכל אחת מערימות z אלה. מדוד את התפשטות HPAAF על-ידי ספירת מספר התאים החיוביים ל-EdU וחלוקה במספר הכולל של תאים שזוהו על-ידי כתם נגדי Hoechst בתוך תמונות ההקרנה המרביות (איור 5C).
תוצאות
פרוטוקול זה מתאר כיצד להדפיס ביו-ממד הידרוג'לים פוטו-ממדיים בתוך אמבט תמיכה כדי ליצור מבנים המסוגלים להתקשות דינמית וטמפורלית לחקר הפעלת פיברובלסטים בגיאומטריות המחקות רקמות אנושיות. ראשית, הפרוטוקול הסביר כיצד לסנתז PEGαMA, עמוד השדרה של מערכת פולימרים פוטוטלית זו. מדידות ספקטרוסקופיית ת...
Discussion
תגובות פילמור דו-שלביות בתגובה לחשיפה מבוקרת לאור יכולות להקשיח ביו-חומרים באמצעות בקרה מרחבית וזמנית. מספר מחקרים רתמו טכניקה זו להערכת אינטראקציות תא-מטריצה בפלטפורמות שונות 5,8,9,10,11,21,22,23.
Disclosures
למחברים אין ניגודי עניינים לחשוף. חלקים מכתב יד זה משוכפלים באישור © IOP Publishing https://doi.org/10.1088/1758-5090/aca8cf. 5 כל הזכויות שמורות.
Acknowledgements
המחברים רוצים להודות לד"ר אדם פיינברג (אוניברסיטת קרנגי מלון) ולאלה שאירחו את סדנת הקוד הפתוח להדפסה ביולוגית בתלת ממד. אנשים אלה אפשרו ללמוד את הטכניקות של הדפסה ביולוגית של FRESH ולבנות את המדפסת הביולוגית התלת-ממדית המשמשת למחקרים אלה. בנוסף, המחברים מבקשים להכיר Biorender.com, אשר שימש ליצירת דמויות בכתב יד זה. עבודה זו נתמכה על ידי מספר קבוצות או מקורות מימון, כולל קרן קהילת רוז (DDH ו- CMM), פרס מחקר מחלות כלי דם ריאתיים בקולורדו (DDH ו- CMM), הקרן הלאומית למדע תחת פרס 1941401 (CMM), מחלקת הצבא תחת פרס W81XWH-20-1-0037 (CMM), המכון הלאומי לסרטן של NIH תחת פרס R21 CA252172 (CMM), מרכז משפחת לודמן לחקר בריאות האישה בקמפוס הרפואי של אוניברסיטת קולורדו אנשוץ (DDH ו- CMM), המכון הלאומי ללב, ריאות ודם של המכונים הלאומיים לבריאות תחת פרסים R01 HL080396 (CMM), R01 HL153096 (CMM), F31 HL151122 (DDH) ו- T32 HL072738 (DDH ו- AT).
Materials
| Name | Company | Catalog Number | Comments |
| AccuMax Radiometer/Photometer Kit | Spectronics Corporation | XPR-3000 | To measure light intensity, used for photostiffening |
| Acetic Acid | Fisher Scientific | BP2401-500 | Used during PEGaMA synthesis |
| Acetone | Fisher Scientific | A184 | Used with the cryosections |
| ActinGreen 488 ReadyProbes | Fisher Scientific | R37110 | Used for staining |
| Aluminum Foil | Reynolds | F28028 | |
| Anhydrous Tetrahydrofuran (THF) | Sigma-Aldrich | 401757-1L | Used during PEGaMA synthesis |
| Argon Compressed Gas | Airgas | AR R300 | Used during PEGaMA synthesis |
| 8 Arm Poly(ethylene glycol)-hydroxyl (PEG-OH) | JenKem Technology | 8ARM-PEG-10K | Used during PEGaMA synthesis |
| 365 nm Bandpass Filter | Edmund Optics | 65-191 | Used for photostiffening |
| Bovine Serum Albumin (BSA) | Fisher Scientific | BP9700-100 | Used during staining process |
| Buchner Funnel | Quark Glass | QFN-8-14 | Used during PEGaMA synthesis |
| Calcein AM | Invitrogen | 65-0853-39 | Used during staining process |
| Celite 545 (Filtration Aid) | EMD Millipore | CX0574-1 | Used during PEGaMA synthesis |
| Charged Microscope Slides | Globe Scientific | 1358W | |
| Chloroform-d | Sigma-Aldrich | 151823-10X0.75ML | Used to characterize PEGaMA |
| Click-iT Plus EdU Cell Proliferation Kit | Invitrogen | C10637 | Used for staining |
| 50 mL Conical Tubes | CELLTREAT | 667050B | |
| Cryogenic Safety Kit | Cole-Parmer | EW-25000-85 | |
| Cryostat | Leica | CM 1850-3-1 | |
| Dialysis Tubing | Repligen | 132105 | |
| 4’,6-Diamidino-2-Phylindole (DAPI) | Sigma-Aldrich | D9542-1MG | Used for staining |
| Diethyl Ether | Fisher Scientific | E1384 | Used during PEGaMA synthesis |
| 1,4-Dithiothreitol (DTT) | Sigma-Aldrich | 10197777001 | Bioink component |
| Dulbecco's Modified Eagle's Medium (DMEM) | Cytiva | SH30271.FS | |
| Filter Paper | Whatman | 1001-090 | Used during PEGaMA synthesis |
| Freezone 2.5L Freeze Dry System | Labconco | LA-2.5LR | Lyophilizer |
| Fusion 360 | Autodesk | N/A | Software download |
| 2.5 mL Gastight Syringe | Hamilton | 81420 | Used for bioprinting |
| 15 Gauge 1.5" IT Series Tip | Jensen Global | JG15-1.5X | Used for bioprinting |
| 30 Gauge 0.5" HP Series Tip | Jensen Global | JG30-0.5HPX | Used for bioprinting |
| Goat Anti-Mouse Alexa Fluor 555 Antibody | Fisher Scientific | A21422 | Used for staining |
| Glycine | Fisher Scientific | C2H5NO2 | Used during staining process |
| Hemocytometer | Fisher Scientific | 1461 | |
| Hoechst | Thermo Scientific | 62249 | Used during staining process |
| Human Pulmonary Artery Adventitial Fibroblasts (HPAAFs) | AcceGen | ABC-TC3773 | From a 2-year-old male patient |
| Hydrochloric Acid (HCl) | Fisher Scientific | A144-500 | Used to pH adjust solutions |
| ImageJ | National Institutes of Health (NIH) | N/A | Free software download |
| ImmEdge® Pen | Vector Laboratories | H-4000 | Used during staining process |
| Incubator | VWR | VWR51014991 | |
| LifeSupport Gelatin Microparticle Slurry (Gelatin Slurry) | Advanced Biomatrix | 5244-10GM | Used for bioprinting |
| Light Microscope | Olympus | CKX53 | Inverted light microscope |
| Lithium Phenyl-2,4,6-Trimethylbenzoylphosphinate (LAP) | Sigma-Aldrich | 900889-5G | Photoinitiator used for photostiffening |
| Liquid Nitrogen | N/A | N/A | |
| LulzBot Mini 2 | LulzBot | N/A | Bioprinter adapted |
| Methacryloxyethyl Thiocarbamoyl Rhodamine B | Polysciences Inc. | 669775-30-8 | |
| 2-Methylbutane | Sigma-Aldrich | M32631-4L | |
| Microman Capillary Pistons CP1000 | VWR | 76178-166 | Positive displacement pipette tips |
| MMP2 Degradable Crosslinker (KCGGPQGIWGQGCK) | GL Biochem | N/A | Bioink component |
| Mouse Anti-Human αSMA Monoclonal Antibody | Fisher Scientific | MA5-11547 | Used for staining |
| OmniCure Series 2000 | Lumen Dynamics | S2000-XLA | UV light source used for photostiffening |
| Paraformaldehyde (PFA) | Electron Microscopy Sciences | 15710 | Used to fix samples |
| pH Meter | Mettler Toledo | FP20 | |
| pH Strips | Cytiva | 10362010 | |
| Phosphate Buffered Saline (PBS) | Hyclone Laboratories, Inc. | Cytiva SH30256.FS | |
| Pipette Set | Fisher Scientific | 14-388-100 | |
| 10 µL Pipette Tips | USA Scientific | 1120-3710 | |
| 20 µL Pipette Tips | USA Scientific | 1183-1510 | |
| 200 µL Pipette Tips | USA Scientific | 1111-0700 | |
| 1000 µL Pipette Tips | USA Scientific | 1111-2721 | |
| Poly(Ethylene Glycol)-Alpha Methacrylate (PEGαMA) | N/A | N/A | Refer to manuscript for synthesis steps |
| Poly(Ethylene Oxide) (PEO) | Sigma-Aldrich | 372773-250G | Bioink component |
| Positive Displacement Pipette | Fisher Scientific | FD10004G | 100-1000 µL |
| Potassium Hydroxide (KOH) | Sigma-Aldrich | 221473-500G | Used to pH adjust solutions |
| ProLong Gold Antifade Reagent | Invitrogen | P36930 | Used during staining process |
| Pronterface | All3DP | N/A | Software download |
| Propidium Iodide | Sigma-Aldrich | P4864-10ML | Used for staining |
| RGD Peptide (CGRGDS) | GL Biochem | N/A | Bioink component |
| Rocker | VWR | 10127-876 | |
| Rotary Evaporator | Thomas Scientific | 11100V2022 | Used during PEGaMA synthesis |
| Rubber Band | Staples | 808659 | |
| Schlenk Flask | Kemtech America | F902450 | Used during PEGaMA synthesis |
| Slic3r | Slic3r | N/A | Software download |
| Smooth Muscle Cell Growth Medium-2 (SmGM-2) BulletKit | Lonza | CC-3182 | Kit contains CC-3181 and CC-4149 components |
| Sodium Hydride | Sigma-Aldrich | 223441-50G | Used during PEGaMA synthesis |
| Sorvall ST 40R Centrifuge | Fisher Scientific | 75-004-525 | |
| Stir Bar | VWR | 58948-091 | |
| Syringe Filter | VWR | 28145-483 | Used to sterile filter solutions |
| T-75 Tissue-Cultured Treated Flask | VWR | 82050-856 | Used for cell culture work |
| Tissue-Tek Cyromold | Sakura | 4557 | |
| Tissue-Tek O.C.T Compound (OCT) | Sakura | 4583 | |
| Tris(2-Carboxyethyl) Phosphine (TCEP) | Sigma-Aldrich | C4706-2G | |
| Triton X-100 | Fisher Bioreagents | C34H622O11 | Used during staining process |
| Trypan Blue | Sigma-Aldrich | T8154-20ML | Used for cell culture work |
| 0.05% Trypsin-EDTA | Gibco | 25-300-062 | Used for cell culture work |
| Tween 20 | Fisher Bioreagents | C58H114O26 | Used during staining process |
| Upright Microscope | Olympus | BX63F | Fluorescent microscope capabilities |
| Water Bath | PolyScience | WBE20A11B | |
| 24-Well Tissue Culture Plates | Corning | 3527 |
References
- Ahrens, J. H., et al. Programming cellular alignment in engineered cardiac tissue via bioprinting anisotropic organ building blocks. Advanced Materials. 34 (26), e2200217 (2022).
- Lin, N. Y. C., et al. Renal reabsorption in 3D vascularized proximal tubule models. Proceedings of the National Academy of Sciences of the United States of America. 116 (12), 5399-5404 (2019).
- Grigoryan, B., et al. Multivascular networks and functional intravascular topologies within biocompatible hydrogels. Science. 364 (6439), 458-464 (2019).
- Kang, Y., Datta, P., Shanmughapriya, S., Ozbolat, I. T. 3D bioprinting of tumor models for cancer research. ACS Applied Biomaterials. 3 (9), 5552-5573 (2020).
- Davis-Hall, D., Thomas, E., Pena, B., Magin, C. M. 3D-bioprinted, phototunable hydrogel models for studying adventitial fibroblast activation in pulmonary arterial hypertension. Biofabrication. 15 (1), (2022).
- Mirdamadi, E., Tashman, J. W., Shiwarski, D. J., Palchesko, R. N., Feinberg, A. W. FRESH 3D bioprinting of a full-size model of the human heart. ACS Biomaterials Science & Engineering. 6 (11), 6453-6459 (2020).
- Shiwarski, D. J., Hudson, A. R., Tashman, J. W., Feinberg, A. W. Emergence of FRESH 3D printing as a platform for advanced tissue biofabrication. APL Bioengineering. 5 (1), 010904 (2021).
- Petrou, C. L., et al. Clickable decellularized extracellular matrix as a new tool for building hybrid hydrogels to model chronic fibrotic diseases in vitro. Journal of Materials Chemistry B. 8 (31), 6814-6826 (2020).
- Hewawasam, R. S., Blomberg, R., Serbedzija, P., Magin, C. M. Chemical modification of human decellularized extracellular matrix for incorporation into phototunable hybrid hydrogel models of tissue fibrosis. ACS Applied Materials & Interfaces. 15 (12), 15071-15083 (2023).
- Saleh, K. S., et al. Engineering hybrid hydrogels comprised healthy or diseased decellularized extracellular matrix to study pulmonary fibrosis. Cellular and Molecular Bioengineering. 15 (5), 505-519 (2022).
- Guvendiren, M., Burdick, J. A. Stiffening hydrogels to probe short- and long-term cellular responses to dynamic mechanics. Nature Communications. 3, 792 (2012).
- Rosales, A. M., Vega, S. L., DelRio, F. W., Burdick, J. A., Anseth, K. S. Hydrogels with reversible mechanics to probe dynamic cell microenvironments. Angewandte Chemie International Edition English. 56 (40), 12132-12136 (2017).
- Wynn, T. A., Ramalingam, T. R. Mechanisms of fibrosis: therapeutic translation for fibrotic disease. Nature Medicine. 18 (7), 1028-1040 (2012).
- Huertas, A., Tu, L., Humbert, M., Guignabert, C. Chronic inflammation within the vascular wall in pulmonary arterial hypertension: more than a spectator. Cardiovascular Research. 116 (5), 885-893 (2020).
- Kendall, R. T., Feghali-Bostwick, C. A. Fibroblasts in fibrosis: novel roles and mediators. Frontiers in Pharmacology. 5, 123 (2014).
- Parker, M. W., et al. Fibrotic extracellular matrix activates a profibrotic positive feedback loop. The Journal of Clinical Investigation. 124 (4), 1622-1635 (2014).
- Habiel, D. M., Hogaboam, C. Heterogeneity in fibroblast proliferation and survival in idiopathic pulmonary fibrosis. Frontiers in Pharmacology. 5, 2 (2014).
- Hu, C. J., Zhang, H., Laux, A., Pullamsetti, S. S., Stenmark, K. R. Mechanisms contributing to persistently activated cell phenotypes in pulmonary hypertension. The Journal of Physiology. 597 (4), 1103-1119 (2019).
- Li, M., et al. Emergence of fibroblasts with a proinflammatory epigenetically altered phenotype in severe hypoxic pulmonary hypertension. The Journal of Immunology. 187 (5), 2711-2722 (2011).
- Hinton, T. J., et al. Three-dimensional printing of complex biological structures by freeform-reversible embedding of suspended hydrogels. Science Advances. 1 (9), e1500758 (2015).
- Brown, T. E., et al. Secondary photocrosslinking of click hydrogels to probe myoblast mechanotransduction in three dimensions. Journal of the American Chemical Society. 140 (37), 11585-11588 (2018).
- Ondeck, M. G., et al. Dynamically stiffened matrix promotes malignant transformation of mammary epithelial cells via collective mechanical signaling. Proceedings of the National Academy of Sciences of the United States of America. 116 (9), 3502-3507 (2019).
- Caliari, S. R., et al. Stiffening hydrogels for investigating the dynamics of hepatic stellate cell mechanotransduction during myofibroblast activation. Scientific Reports. 6, 21387 (2016).
- Liu, F., et al. Feedback amplification of fibrosis through matrix stiffening and COX-2 suppression. Journal of Cell Biology. 190 (4), 693-706 (2010).
- Tschumperlin, D. J., Ligresti, G., Hilscher, M. B., Shah, V. H. Mechanosensing and fibrosis. The Journal of Clinical Investigation. 128 (1), 74-84 (2018).
- Chelladurai, P., Seeger, W., Pullamsetti, S. S. Matrix metalloproteinases and their inhibitors in pulmonary hypertension. European Respiratory Journal. 40 (3), 766-782 (2012).
- Caracena, T., et al. Alveolar epithelial cells and microenvironmental stiffness synergistically drive fibroblast activation in three-dimensional hydrogel lung models. Biomaterials Science. 10 (24), 7133-7148 (2022).
- Ruskowitz, E. R., DeForest, C. A. Proteome-wide analysis of cellular response to ultraviolet light for biomaterial synthesis and modification. ACS Biomaterials Science & Engineering. 5 (5), 2111-2116 (2019).
- Kruse, C. R., et al. The effect of pH on cell viability, cell migration, cell proliferation, wound closure, and wound reepithelialization: In vitro and in vivo study. Wound Repair and Regeneration. 25 (2), 260-269 (2017).
- Filippi, M., et al. Perfusable biohybrid designs for bioprinted skeletal muscle tissue. Advanced Healthcare Materials. , e1500758 (2023).
- Matthiesen, I., et al. Astrocyte 3D culture and bioprinting using peptide-functionalized hyaluronan hydrogels. Science and Technology of Advanced Materials. 24 (1), 2165871 (2023).
- Xu, L., et al. Bioprinting a skin patch with dual-crosslinked gelatin (GelMA) and silk fibroin (SilMA): An approach to accelerating cutaneous wound healing. Materials Today Bio. 18, 100550 (2023).
- Bliley, J. M., Shiwarski, D. J., Feinberg, A. W. 3D-bioprinted human tissue and the path toward clinical translation. Science Translational Medicine. 14 (666), eabo7047 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved