A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
איתור נגיף SARS-CoV-2 על ידי הגברה איזותרמית בתיווך לולאת שעתוק לאחור
In This Article
Summary
כאן אנו מספקים פרוטוקול מלא לסטנדרטיזציה ויישום השיטה לזיהוי נגיף SARS-CoV-2 בדגימות אנושיות על ידי הגברה איזותרמית בתיווך לולאה של שעתוק לאחור (RT-LAMP). שיטה זו, הנעשית תוך 60 דקות, יכולה להיות מותאמת לכל מעבדה או נקודת טיפול בעלות נמוכה ובאמצעות ציוד זול.
Abstract
נגיף תסמונת הנשימה החריפה החמורה קורונה 2 (SARS-CoV-2) השפיע באופן דרמטי על בריאות האדם. זה ממשיך להיות איום על החברה המודרנית כי אנשים רבים מתים כתוצאה של זיהום. המחלה מאובחנת באמצעות בדיקות סרולוגיות ומולקולריות, כגון תגובת שרשרת פולימראז בזמן אמת (RT-PCR). האחרון יש כמה חסרונות כי זה דורש תשתית מיוחדת, ציוד יקר, כוח אדם מיומן. כאן, אנו מציגים פרוטוקול המתאר את השלבים הנדרשים לזיהוי נגיף SARS-CoV-2 באמצעות הגברה איזותרמית בתיווך לולאת שעתוק לאחור (RT-LAMP) בדגימות אנושיות. הפרוטוקול כולל הוראות לתכנון פריימרים בסיליקו, הכנת ריאגנטים, הגברה והדמיה. לאחר סטנדרטיזציה, שיטה זו יכולה להיות מיושמת בקלות ומותאמת לכל מעבדה או נקודת טיפול בתוך 60 דקות בעלות נמוכה באמצעות ציוד זול. הוא מסתגל לאיתור פתוגנים שונים. לכן, זה יכול לשמש בשטח ובמרכזי בריאות לבצע מעקב אפידמיולוגי בזמן.
Introduction
תסמונת הנשימה החריפה החמורה קורונה 2 (SARS-CoV-2) גורמת למחלת קורונה 2019 (COVID-19). ארגון הבריאות העולמי הכריז על מצב חירום לבריאות הציבור שמעורר דאגה בינלאומית ב-30 בינואר 2020 ועל מגפה עולמית ב-11 במרץ 2020. המגפה הביאה ליותר מ-760 מיליון מקרים ו-6.87 מיליון מקרי מוות נכון לתאריך כתיבת מאמר זה1.
ההשפעה של וירוס זה הדגישה את הצורך בכלי מעקב טובים יותר, מדויקים יותר, מהירים יותר וזמינים יותר כדי לשפר את הזיהוי והבקרה של מחלות זיהומיות 2,3. במהלך המגיפה, בדיקות אבחון SARS-CoV-2 התבססו על גילוי חומצת גרעין, נוגדנים וחלבונים, אך זיהוי RT-PCR של חומצת גרעין הוא תקן הזהב4. עם זאת, RT-PCR יש כמה מגבלות; זה דורש ציוד מיוחד, תשתיות, וכוח אדם מאומן ביולוגיה מולקולרית, להגביל את היישום שלה למעבדות מיוחדות. יתר על כן, זה לוקח זמן (4-6 שעות), לא כולל הזמן להעביר את הדגימות למעבדה, אשר יכול לקחתימים 5. אילוצים אלה מונעים עיבוד דגימות יעיל וקבלת המידע הדרוש לתכנון מגירה וניהול אפידמיולוגי.
להגברה איזותרמית בתיווך לולאת שעתוק לאחור (RT-LAMP) יש מספר יתרונות על פני RT-PCR, מה שהופך אותה לאסטרטגיה מושכת לתכנון בדיקות אבחון עתידיות של נקודת טיפול (POCT), במיוחד בהגדרות מוגבלות משאבים6. ראשית, הוא ספציפי מאוד מכיוון שהוא משתמש בין ארבעה לשישה פריימרים המזהים שישה עד שמונה אזורים ברצף המטרה, בין אם זה DNA או RNA 7,8. שנית, מכיוון שהוא פועל בטמפרטורה קבועה, הוא אינו זקוק לציוד מתוחכם כגון מחזורים תרמיים בזמן אמת כדי לייצר את ההגברה, וגם אינו מחייב כוח אדם מיומן להפעלתו. שלישית, זמן התגובה קצר מאוד (~ 60 דקות), וריאגנטים שאינם מיוחדים מאוד מועסקים, מה שהופך אותו לכלי חסכוני6. לאור האמור לעיל ומצב החירום הבריאותי שנגרם על ידי מגיפת COVID-19, ניתן לראות בטכניקה זו שיטת אבחון חלופית מהירה, זולה ופשוטה ליישום בכל מעבדת מחקר9.
הפרוטוקול לסטנדרטיזציה ויישום של מנורת RT-LAMP לזיהוי SARS-CoV-2 בשיטות קולורימטריות באמצעות תרמוסייקלר ואמבט מים מתואר במאמר זה (איור 1). נדונות נקודות קריטיות, מגבלותיהן וחלופות לקידומן.
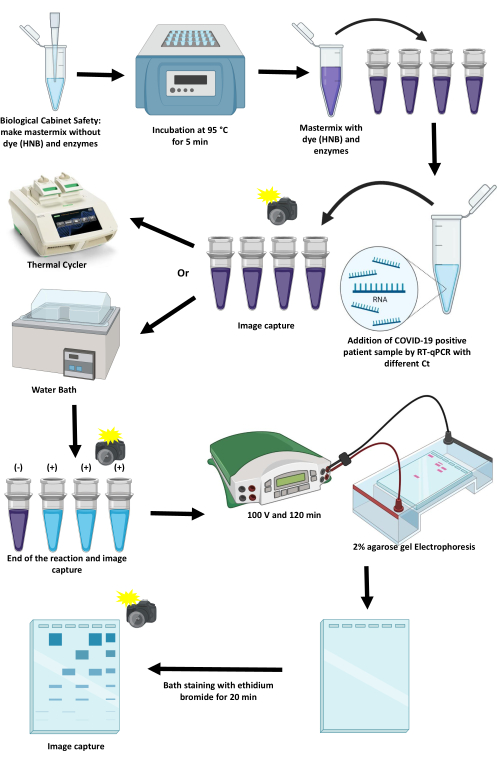
איור 1: סכימת הפרוטוקול להגברת SARS-CoV-2 באמצעות טכניקת RT-LAMP. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Protocol
הדגימות ששימשו סופקו על ידי המעבדה הקלינית של בית החולים האוניברסיטאי Fundación Valle del Lili ותאמו את ה- RNA המטוהר מחולים שנבדקו חיוביים ל- COVID-19 באמצעות טכניקת RT-qPCR. כל החולים נתנו הסכמה מדעת למחקר, ומחקר זה אושר על ידי הוועדה הביו-אתית למחקרים בבני אדם מבית החולים האוניברסיטאי Fundación Valle del Lili.
1. עיצוב והכנה של פריימר RT-LAMP
הערה: ניתן להשתמש בפריימרים של LAMP עם מגוון פלטפורמות, כולל New England BioLabs (NEB) LAMP, Primer Explorer ו-LAMP assay versatile analysis (LAVA). עם זאת, עבור פרוטוקול זה, הכלי NEB LAMP שימש. תכנון פריימר יכול להיעשות באמצעות גנומים של SARS-CoV-2 המתקבלים ממסד הנתונים NextStrain10. טבלה 1 מציגה את ערכת הפריימר המשמשת בפרוטוקול זה.
- עיצוב פריימר ל-LAMP
- להשיג רצפי גנום ויראליים.
- בצע יישור רצף כדי לקבל את רצף הקונצנזוס.
- נווט אל פלטפורמת כלי עיצוב הפריימר NEB LAMP11 ופעל לפי ההוראות במדריך המהיר. כלי זה מייצר את אותן תוצאות כמו פריימר Explorer V5, אבל זה הרבה יותר ידידותי למשתמש בפלט שלה. השתמש במדריכים למשתמש של סייר הפריימר כמדריך לעיצוב פריימר.
- הערכה תרמודינמית של סט הפריימרים
- השתמש בכלי Primer-Dimer12 כדי לבצע ניתוח תרמודינמי על הפריימרים המתקבלים.
- שים את רצפי הפריימר בכלי. לאחר מכן, בחר באפשרות Multiplex Analysis ו- Dimer Structure Report.
- בחר ערכות פריימר עם ΔG לא פחות מ -5.
- הערכת ספציפיות של הפריימרים המעוצבים
- השתמש במסד הנתונים של אוסף נוקלאוטידים (nt/nt) ב- BLAST13 כדי לנתח כל פריימר.
- כדי לבצע את ניתוח BLAST הראשון, בחר את בסיס הנתונים Refseq_rna וסנן את החיפוש עם קבוצת הסוגים השייכים לתת-המשפחה Orthocoronavirinae. הם Alphacoronavirus (מונית: 693996), Gammacoronavirus (מונית: 694013) ו- Deltacoronavirus (מונית: 1159901). בנוסף, הערך את הרצף מול וירוסים אחרים המסתובבים יחד כתת-סוג H1N1 (taxid:114727), וירוס שפעת A (taxid:11320) ונגיף שפעת B (taxid:11520).
- כדי לבצע את ניתוח BLAST השני, בחר את Betacoronavirus GenBank וסנן את החיפוש עם Coronaviridae (מונית:11118) וסארס (taxid:694009). קבוצות אלה מכילות רצפים של כל הגנומים של נגיף הסארס שזוהו, כולל גנומים שנמצאו בעטלפים, Betacoronavirus (taxid:694002).
- עבור פרוטוקול זה, ודא שהפריימרים אינם מתיישרים עם גנומים שאינם גנום המטרה, SARS-CoV-2.
- הכנת פריימר
- סובבו את הבקבוקונים המכילים את הפריימרים האיופיליים עם מיקרוצנטריפוגה (10,000 x גרם, דקה אחת בטמפרטורת החדר [RT]) כדי למנוע הפסדים במהלך פתיחת הצינור.
- יש לייבש מחדש את האבקה האיופילית במי 0.1% דיאתיל פירוקרבונט (DEPC) או במים נטולי נוקלאז לריכוז סופי של 100 מיקרומטר (טבלה 2) ולהמיס היטב על-ידי פיטינג למעלה ולמטה. לאחר מכן, סובב במהירות מרבית (10,000 x גרם, דקה אחת ב- RT) במיקרו-צנטריפוגה כדי לאסוף את כל תמיסות הפריימר בתחתית הצינור.
- הכינו את תערובת הפריימר 10x תחת ארון בטיחות ביולוגית עם פריימר פנימי קדמי (FIP), פריימר פנימי אחורה (BIP), פריימר חיצוני קדמי (F3), פריימר חיצוני אחורה (B3), פריימר לולאה אחורה (LB) ופריימר לולאה קדימה (LF), כפי שמדווח בטבלה 2. כדי למנוע הפסדים, פיפטה או מערבל בעדינות את תמיסת הפריימר לפני ביצוע סיבוב מהיר (10,000 x גרם, דקה אחת ב- RT) עם מיקרוצנטריפוגה.
- אחסנו את תערובת הפריימר 10x בטמפרטורה של -20°C לאחסון לטווח ארוך; עם זאת, התכוננו מספיק לחמישה ניסויים לכל היותר, ללא קשר למספר דגימות כדי להימנע ממחזורי הקפאה-הפשרה רבים מדי.
הערה אם יש צורך בנפח קטן יותר של תערובת הפריימר, התאם את הערכים על-ידי חישוב אמצעי האחסון החדשים (טבלה 2). יתר על כן, ערכות RdRp ו- RdRp/Hel אינן כוללות פריימר LF מכיוון שפריימרים לולאה אינם נדרשים לתגובות RT-LAMP. כתוצאה מכך, החלף את נפח פריימר LF במים נטולי נוקלאז או 0.1% DEPC מים.
2. תגובת RT-LAMP
- הפעל את ארון הזרימה הלמינרית בהתאם להוראות היצרן והמתן לפחות 3 דקות עד שזרימת האוויר תתייצב.
- ברגע שזרימת האוויר יציבה, נקו וחטאו את המשטחים הפנימיים של הארון בטכניקה אספטית. כדי להשיג זאת, השתמש בחומרי החיטוי הבאים בסדר זה: 1000 ppm אמוניום רבעוני (בנזלקוניום כלוריד), 2% היפוכלוריט, 3% מי חמצן ו-70% אתנול.
הערה: במקרה זה, הטכניקה האספטית כרוכה ביישום חומר החיטוי והסרתו עם מפיות מתוך התא החוצה מבלי לעבור על משטחים שנוקו בעבר. - בעזרת חומרי החיטוי משלב 2.2, נקו את החומרים שייכנסו לתא באותו סדר.
הערה: יש להכניס לארון מיקרופיפטים, קופסאות קצה לפילטר, צלוחיות עם צינורות 1.5 מ"ל ו-0.6 מ"ל, צינורות PCR 0.2 מ"ל, ארונות תקשורת וכוס 400 מ"ל. - הביאו כמה מפיות וכפפות ניטריל לתא הנוסעים. לאחר מכן, לכבות את הארון ולחשוף אותו לאור אולטרה סגול (UV) במשך 15 דקות.
אזהרה: כדי למנוע נזק לרקמות ולדנ"א כתוצאה מחשיפה ממושכת לקרינה, יש להימנע משימוש באור על-סגול עד לתום פרק הזמן שנקבע בשלב 2.4.
הערה: בצעו את ההרכבה המוצגת באיור 2 לפני תחילת הפרוטוקול, והתחילו את אמבט המים לאחר השלמת שלב 2.4. חיוני למלא את מיכל המתכת כמעט עד גדותיו במי שתייה ולכוון את הטמפרטורה של פלטת החימום של מעבדת הברזל ל -90 מעלות צלזיוס, מכיוון שהדבר יביא לטמפרטורה של ~ 66.3 מעלות צלזיוס במערכת, המנוטרת באמצעות מדחום הכספית. - לאחר סיום תקופת ההקרנה, הפעל מחדש את הקבינט ופעל לפי ההמלצות בשלב 1.1.
- הניחו את הריאגנטים (טבלה 3, טבלה 4 וטבלה 5) בצידנית מלאה בקרח או במקרר פוליסטירן קטן. שים את המיכל בתוך הארון לאחר ניקוי אותו עם 70% אתנול.
- בצינור מיקרוצנטריפוגה של 0.6 מ"ל, הכינו את תערובת ה-LAMP של הגן להגברה (RdRp, N-A ו-RdRp/Hel), והוסיפו רק את המרכיבים הבאים: 10x Buffer, MgSO4, dNTPs, 1x primers mix ומים נטולי נוקלאז או 0.1% DEPC מים; מערבבים היטב על ידי pipetting כדי הומוגניזציה.
זהירות: בגלל טיפול והתנהגות לא נאותים בתוך הארון, קיים סיכון גבוה לזיהום ריאגנטים. יש לפעול לפי הכללים הבאים כדי לצמצם בעיה זו: (i) להשתמש בטיפים סטריליים ובקצוות סינון; (ii) להשתמש בטיפ אחד לכל מגיב; (iii) לנוע לאט ובזהירות כדי למנוע הפרעה לזרימה הלמינרית; (4) לשמור על הסדר ולהשתמש בחומרים המעטים ביותר; ו-(v) להשתמש בכפפות שונות כדי להכין את התערובת ולהוסיף את החומר הגנטי.
הערה: שמור את כל הריאגנטים, במיוחד אנזימים, על קרח מכיוון ששינויי טמפרטורה יכולים לשנות את טבעם ולשנות את פעילות הפולימראז. - מניחים את הצינור(ים) בנפח 0.6 מ"ל כשהפקק סגור בבלוק חימום ודגרים בטמפרטורה של 95°C למשך 5 דקות.
הערה: הפעל את בלוק החימום עבור צינורות 1.5-2.0 מ"ל הממוקמים מחוץ לארון למשך 30 דקות לפחות לפני תחילת הכנת תערובת המנורה ונטר את הטמפרטורה (95 ° C) באמצעות מדחום כספית או אלכוהול. - לאחר השלמת הדגירה, הניחו את הצינורות בצידנית פוליסטירן מלאה בקרח למשך 5 דקות.
- החזירו את הצינורות לארון הזרימה הלמינרית והשלימו את הכנת תערובת LAMP על ידי הוספת האנזימים DNA פולימראז (Bst 3.0), שעתוק לאחור ופולימראז DNA באיכות גבוהה (טבלה 3, טבלה 4 וטבלה 5). במקרה של שימוש בזיהוי קולורימטרי, הוסף את הצבע hydroxinaphthol כחול (HNB).
- לאחר הוספת ריאגנטים אלה, לערבב את ריאגנטים LAMP היטב על ידי pipeting אותם כדי להמיס את האנזימים ואת הצבע.
- מלא כל צינור PCR עם 22.0 μL של התערובת, נזהר לא ליצור בועות. לאחר מכן, הוסף 3.0 μL של 0.1% מים DEPC או מים נטולי נוקלאז לבקרה השלילית או לצינור ללא בקרת תבנית (NTC) והקצה את הצינור(ים) הנותרים לתוספת (חומר גנטי).
הערה: שמור את צינורות ה- PCR בצנן מלא קרח עד להוספת הדגימה כדי למנוע הפעלת האנזים Bst 3.0 והתחלת התגובה בטרם עת. - הסר את כל החומרים מהארון והשתמש באתנול 70% כדי לנקות את המשטחים. לאחר מכן כבו אותו בהתאם להוראות היצרן.
- באזור נפרד, הוסף 3 μL של הדגימה לכל צינור PCR והומוגני אותו ביסודיות. השתמש מיקרופיפטה 20 μL וטיפים מסנן כדי להשיג זאת.
זהירות: יש להשתמש במיקרופיפטה המשמשת להוספת החומר הגנטי אך ורק למטרה זו ולא ניתן להשתמש בה להכנת התערובת. בדרך זו, זיהום של ריאגנטים נמנע. בנוסף, שמור דגימות RNA על הקרח בכל עת כדי להפחית את האפשרות של פירוק RNA. השתמש בציוד המגן האישי הבא (PPE) לתוספת הדגימה: חלוק חד פעמי, כובע, מסכת N95, טייצים, משקפי מעבדה וכפפות ניטריל. - לפני ביצוע התגובה הקולורימטרית, צלם את צינורות ה- PCR במצלמה באיכות גבוהה. הצבע ההתחלתי עם HNB הוא סגול.
- בצע את התגובה במערכת או בציוד הבאים: (i) מחזור תרמי ו- (ii) אמבט מים.
- מחזור תרמי: הפקד את הצינורות בבלוק התגובה והגדר את התרמופרופיל (ראה טבלה 6) על הציוד.
- אמבט מים: הפקידו את הצינורות במיכלים עגולים והתאימו אותם היטב כדי למנוע מהם לצאת. לאחר מכן, הניחו את המכלים באמבט המים (איור 2A, B) בטמפרטורה המופיעה בטבלה 6.
- במקרה של אמבט מים, ברגע שהצינורות נמצאים בתוך המערכת, הפעל את הטיימר למשך 60 דקות (טבלה 6).
- הסר את הצינורות מהמחזור התרמי או מאמבט המים לאחר זמן התגובה ואחסן אותם ב -4 ° C להפעלה אלקטרופורטית או ב -20 ° C עד לשימוש.
- אם בוצעה תגובה קולורימטרית, צלם את צינורות ה- PCR באמצעות מצלמה באיכות גבוהה. הצבע הסופי עם HNB הוא כחול שמיים.
3. ניתוח מוצרי הגברה בג'ל אגרוז
הערה: שלבים אלה מוצעים כבדיקות נוספות לתגובה קולורימטרית או לבקרה על ביצועים במהלך שלב התקינה. הסיבה לכך היא שהטכניקה עלולה להוות סיכון זיהום עצום למעבדה המבצעת בדיקות אלה.
- הניחו את המיטה בתוך תא האלקטרופורזה כך שגומיות הקצה ייגעו בקירות, ויצרו חלל אטום לתוספת אגרוז (תא פנימי) (איור 3A, B).
- לאחר השלמת שלב 3.1, לשקול את הכמות הדרושה של agarose בכוס 500 מ"ל כדי לקבל ג'ל 2%. לאחר מכן, הוסף את הנפח הנדרש של חיץ 0.5x Tris-אצטט EDTA (TAE) ומיקרוגל למשך 1-2 דקות.
הערה: האגרוז נמס לחלוטין כאשר הוא שקוף וללא גושים כאשר מוציאים אותו מהתנור. אם זה לא אושר, אזורים ג'ל גרוע עלול להישאר, גרימת הפעלה אלקטרופורטית ויזואליזציה של מוצרי הגברה להיות שונה. - הוציאו את הכד מהתנור ושפכו את האגרוז לתוך התא הפנימי שנוצר בשלב 3.1 (איור 3C). לאחר מכן, לבדוק כי אין בועות, ואם יש, להסיר אותם באמצעות קצה micropipette.
- מסדרים את המסרק ליצירת הבארות ומשאירים את האגרוז לג'ל למשך כ-30 דקות בטמפרטורת החדר (RT).
- לאחר זמן זה, הוסף 5 מ"ל של חיץ 0.5x TAE כדי להקל על הסרת המסרקים והמיטה המכילה את הג'ל. לאחר מכן מקמו את הג'ל כך שהבארות נמצאות באנודה (איור 3D).
- מלא את תא האלקטרופורזה במאגר TAE 0.5x לקיבולת שצוינה על-ידי היצרן, וודא שהאלקטרודות באות במגע עם המאגר.
- הוסף 3 μL של סמן משקל מולקולרי לבאר הראשונה של הג'ל והוסף 9 μL של NTC וכל דגימה לבארות הבאות. הפוך אותם על ידי שילוב של 7 μL של מוצר ההגברה עם 3 μL של מאגר העמסה; ואז לטעון 9 μL של תערובת זו לתוך בארות של ג'ל.
- כסו את תא האלקטרופורזה במכסה וחברו את הכבלים ליציאות ספק הכוח בדוגמת צבע. הגדר את מקור החשמל לפרמטרים הבאים: 100 וולט ואמפר קבוע למשך 120 דקות.
- לאחר השלמת ההפעלה האלקטרופורטית, מניחים את הג'ל במיכל עם תמיסת הצביעה (אתידיום ברומיד) ודגרים במשך 30 דקות.
- לאחר הדגירה, מוציאים את הג'ל מתמיסת הכתמים ומניחים אותו בשקית עם רוכסן. זה מונע זיהום של הציוד שישמש כדי לדמיין את המגברים.
- דמיינו את הג'ל על טרנסילטור או מכונת הדמיה כמו Amersham Imager 600.
תוצאות
יישום הפרוטוקול מתחיל בתכנון סט הפריימרים לכל גן מטרה בהתאם לפרוטוקול המתואר לעיל. ביוני 2020 התקבלו 5,000 גנומים של SARS-CoV-2 ממסד הנתונים NextStrain, עם ייצוג של 10% של הגנום הקולומביאני. רצפים אלה יושרו כדי לקבל את רצף הקונצנזוס ששימש בתהליך תכנון הפריימר. טבלה 1 מציגה את ערכת הפריימרים שנבחר...
Discussion
למרות RT-LAMP נחשב כמתודולוגיה משלימה לביצוע אבחון מולקולרי, יש לו גם כמה מגבלות וצעדים קריטיים שיש לקחת בחשבון כאשר הפרוטוקול הוא סטנדרטי ומיושק.
תקינת LAMP לזיהוי SARS-CoV-2 העריכה את הפרמטרים והרכיבים הבאים בתמהיל האב: (א) ריכוז וטמפרטורת היישור של הפריימרים; (ב) ריכוז האנזימים; (ג) ...
Disclosures
נטליה Campillo-Pedroza היא מנכ"לית החברה BioDx: Diagnóstico y Soluciones Biotecnológicas S.A.S. שאר המחברים מצהירים כי אין ניגוד עניינים.
Acknowledgements
עבודה זו מומנה על ידי Sistema General de Regalías מקולומביה, מספר מענק BPIN 2020000100092, ו- Universidad Icesi - Convocatoria Interna, מענק מספר CA0413119. MFVT מומן גם על ידי קרנות פרופסור עוזר מאוניברסיטת לוס אנדס. הגופים המממנים לא השתתפו בתכנון, בביצוע הפעילויות, באיסוף הנתונים ובניתוח הנתונים ובהכנת כתב היד. אנו מודים לבית החולים האוניברסיטאי Fundación Valle del Lili עבור RNA ויראלי מדגימות Sars -CoV-2 ולד"ר Alvaro Barrera-Ocampo על ההערות על כתב היד.
Materials
| Name | Company | Catalog Number | Comments |
| 1 kb DNA Ladder | SOLIS BIODYNE | 07-12-00050 | Store at -20 °C |
| 50x TAE Electrophoresis Buffer | ThermoScientific | B49 | Store at roome temperature |
| Accuris High Fidelity Polymerase | ACCURIS LIFE SCIENCE REAGENTS | PR1000-HF-200 | It can be used in case Q5 High-Fidelity DNA polymerase cannot be purchased. For the enzyme, make aliquots of an appropriate volume and store at -20 °C until use. |
| Agarose | PanReacAppliChem | A8963,0100 | N/A |
| Bst 3.0 DNA Polymerase 8000 IU/mL | New England BioLabs | M0374S/M0374L | For the enzyme, make aliquots of an appropriate volume and store at -20 °C until use. |
| Deoxynucleotide (dNTP) Solution Set | New England BioLabs | N0446S | Store at -20 °C |
| Diethyl pyrocarbonate | Sigma-Aldrich | 159220-25G | Handle it with caution under an extraction cabinet |
| GeneRuler 100 bp Plus DNA Ladder, ready-to-use | ThermoScientific | SM0322 | Store at -20 °C |
| Hydroxy naphthol blue disodium salt | Santa Cruz Biotechnology | sc-215156B | N/A |
| Q5 High-Fidelity DNA polymerase 2000 IU/mL | New England BioLabs | M0491S/M0491L | For the enzyme, make aliquots of an appropriate volume and store at -20 °C until use. |
| WarmStart RTx Reverse Transcriptase 15000 IU/mL | New England BioLabs | M0380S/M0380L | For the enzyme, make aliquots of an appropriate volume and store at -20 °C until use. |
References
- World Health Organization. . Who coronavirus (COVID-19) dashboard (no date). , (2023).
- Ibrahim, N. K. Epidemiologic surveillance for controlling Covid-19 pandemic: types, challenges and implications. Journal of Infection and Public Health. 13 (11), 1630-1638 (2020).
- Rojas-Gallardo, D. M., et al. COVID-19 in Latin America: Contrasting phylodynamic inference with epidemiological surveillance. (Molecular epidemiology of COVID-19 in Latin America). medRxiv. , (2020).
- Liu, R., et al. Positive rate of RT-PCR detection of SARS-CoV-2 infection in 4880 cases from one hospital in Wuhan, China, from Jan to Feb 2020. Clinica Chimica Acta. 505, 172-175 (2020).
- Kevadiya, B. D., et al. Diagnostics for SARS-CoV-2 infections. Nature Materials. 20 (5), 593-605 (2021).
- Tomita, N., Mori, Y., Kanda, H., Notomi, T. Loop-mediated isothermal amplification (LAMP) of gene sequences and simple visual detection of products. Nature Protocols. 3 (5), 877-882 (2008).
- Li, Y., Fan, P., Zhou, S., Zhang, L. Loop-mediated isothermal amplification (LAMP): A novel rapid detection platform for pathogens. Microbial Pathogenesis. 107, 54-61 (2017).
- Notomi, T., Mori, Y., Tomita, N., Kanda, H. Loop-mediated isothermal amplification (LAMP): principle, features, and future prospects. Journal of Microbiology. 53 (1), 1-5 (2015).
- Augustine, R., et al. Loop-mediated isothermal amplification (LAMP): A rapid, sensitive, specific, and cost-effective point-of-care test for coronaviruses in the context of COVID-19 pandemic. Biology (Basel). 9 (8), 182 (2020).
- . Nextstrain Available from: https://nextstrain.org/ (2023)
- . Neb Lamp, NEB LAMP Available from: https://lamp.neb.com/ (2023)
- . Blast: Basic local alignment search tool (no date) Available from: https://blast.ncbi.nlm.nih.gov/ (2023)
- Zhang, Y., et al. Rapid molecular detection of SARS-CoV-2 (COVID-19) virus RNA using colorimetric LAMP. medRxiv. , (2020).
- Lu, R., et al. Development of a novel reverse transcription loop-mediated isothermal amplification method for rapid detection of SARS-CoV-2. Virologica Sinica. 35 (3), 344-347 (2020).
- Najafov, A., Hoxhaj, G. . PCR Guru. , (2017).
- Zhang, Y., et al. Enhancing colorimetric loop-mediated isothermal amplification speed and sensitivity with guanidine chloride. Biotechniques. 69 (3), 178-185 (2020).
- Ramírez-Chavarría, R. G., et al. Automatic analysis of isothermal amplification via impedance time-constant-domain spectroscopy: A SARS-CoV-2 case study. Chemosensors. 11 (4), 230 (2023).
- Haque, M. F. U., et al. A novel RdRp-based colorimetric RT-LAMP assay for rapid and sensitive detection of SARS-CoV-2 in clinical and sewage samples from Pakistan. Virus Research. 302, 198484 (2021).
- Donia, A., et al. Integration of RT-LAMP and microfluidic technology for detection of SARS-CoV-2 in wastewater as an advanced point-of-care platform. Food and Environmental Virology. 14, 364-373 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved