הדמיית סידן ברשתית שטוחה עם גירוי חשמלי
In This Article
Summary
תותבות רשתית יש את היכולת ליצור תפיסות חזותיות. כדי לקדם את הפיתוח של תותבות חדשות, יש צורך בשיטות ex vivo כדי לבדוק מכשירים לפני ההשתלה. מאמר זה מספק פרוטוקול מקיף לחקר פעילות הסידן בשכבת תאי גנגליון הרשתית כאשר הוא נתון לגירוי חשמלי.
Abstract
ניוון רשתית הוא גורם מוביל לעיוורון ברחבי העולם. מאמצים נרחבים נעשים לפתח תותבות רשתית מתקדמות שיכולות לעקוף את תאי קולטני האור הלקויים ברשתית המנוונת, במטרה לשחזר חלקית את הראייה על ידי גרימת תפיסת ראייה. אפיק חקירה נפוץ אחד כרוך בתכנון וייצור של התקנים מושתלים בעלי מבנה פיזי גמיש, המאכלס מספר גבוה של אלקטרודות. זה מאפשר יצירה יעילה ומדויקת של תפיסות חזותיות. עם זאת, עם כל התקדמות טכנולוגית, מתעורר צורך בשיטת ex vivo אמינה וניתנת לניהול כדי לאמת את הפונקציונליות של המכשיר לפני התקדמות לניסויים in vivo , שבהם גורמים מעבר לביצועי המכשיר נכנסים לפעולה. מאמר זה מציג פרוטוקול מקיף לחקר פעילות הסידן בשכבת תאי גנגליון הרשתית (GCL) בעקבות גירוי חשמלי. באופן ספציפי, השלבים הבאים מתוארים: (1) תיוג פלואורסצנטי של רשתית החולדה באמצעות מחווני סידן מקודדים גנטית, (2) לכידת האות הפלואורסצנטי באמצעות מיקרוסקופ פלואורסצנטי הפוך תוך יישום דפוסים ברורים של גירוי חשמלי, ו-(3) חילוץ וניתוח עקבות הסידן מתאים בודדים בתוך GCL. על ידי ביצוע הליך זה, חוקרים יכולים לבדוק ביעילות פרוטוקולי גירוי חדשים לפני ביצוע ניסויים in vivo .
Introduction
הרשתית מכילה פוטורצפטורים, שהם תאים האחראים על חישת אור. הם לוכדים פוטונים וממירים אותם לדחפים עצביים. דחפים אלה מעובדים בתוך הרשתית ומועברים לקליפת המוח הראייתית, וכתוצאה מכך נוצרת תמונה חזותית1. רטיניטיס פיגמנטוזה (RP) וניוון מקולרי תלוי גיל (AMD) הן מחלות ניווניות המאופיינות באובדן פרוגרסיבי של פוטורצפטורים. רטינופתיה זו היא בין הגורמים המובילים לעיוורון ברחבי העולם1, משפיעה על מיליוני אנשים ויש לה השלכות רפואיות, אישיות וסוציו-אקונומיות משמעותיות על חולים, מערכות בריאות והחברה כולה. יתר על כן, עם הזדקנות האוכלוסייה, צפוי כי מקרי AMD יגדל ב -15% עד 20502.
כיום, נעשים מאמצי מחקר רבים כדי לשחזר את הראייה בחולים שנפגעו ממצבים אלה3. גישה מבטיחה אחת היא השימוש בתותבות רשתית, אשר הוכיחו יעילות בשחזור חלקי של ראייה 4,5. מכשירים אלה לוכדים אור מהסצנה החזותית וממירים אותו לפולסים חשמליים. פולסים אלה מועברים באמצעות אלקטרודות בתוך מערך מיקרואלקטרודות (MEA) המושתל בעין, מגרה את תאי העצב ששרדו ועוקף את תפקודם של הפוטורצפטורים שאבדו. תאי גנגליון הרשתית המופעלים (RGCs) מעבירים את הפלט למוח, שם הוא מתפרש כתפיסה חזותית. עם זאת, המגבלות העיקריות של השתלים הנוכחיים טמונות ברזולוציה של ממשק אלקטרודה-רקמה6 וגירוי לא סלקטיבי של סוגי תאים שונים. לכן, כדי לייעל את התכנון של התקנים מושתלים חדשים לשיקום ראייה יעיל יותר, חיוני להבין כיצד ניתן לפתח פרדיגמות גירוי כדי להפעיל באופן סלקטיבי תאים בסמיכות לאלקטרודות.
הדמיית סידן היא טכניקה נפוצה לחקר פעילות עצבית, המציעה מספר יתרונות על פני שיטות לא אופטיות 7,8. ראשית, הוא מספק רזולוציה סלולרית ותת-תאית. שנית, סמני סידן יכולים להתמקד בסוגי תאים ספציפיים. שלישית, היא מאפשרת מעקב ארוך טווח, ורביעית, היא מאפשרת תצפית על אוכלוסיות תאים שלמות תוך הבחנה בין תאים פעילים ללא פעילים. שיטה זו מספקת עדות עקיפה לפעילות תאית ברזולוציה טמפורלית בטווח של מאות אלפיות השנייה. מדדי סידן פלואורסצנטיים המקודדים גנטית, כגון חיישני GCaMP, עוברים שינוי קונפורמציה עם קשירה לסידן, וכתוצאה מכך פלואורסצנטיות מוגברת9. וקטורים נגיפיים רקומביננטיים הקשורים באדנו (AAVs) הם אמצעי יעיל להמרת תאי רשתית עם GCaMP10.
פרוטוקול זה מציג שיטה יעילה המנצלת הדמיית סידן לבדיקת פרוטוקולי גירוי של שתלי רשתית. באופן ספציפי, אנו מתמקדים ברקמת הרשתית של חולדה ex vivo ומספקים הוראות מפורטות שלב אחר שלב, החל מרכישת דגימה ועד ניתוח נתונים. על ידי הצעת מדריך מקיף זה, חוקרים מרקעים שונים יכולים להתחיל ניסויים גירוי חשמלי בביטחון.
Protocol
כל ההליכים בבעלי חיים נערכו בהתאם להנחיות אתיות סטנדרטיות של בעלי חיים (דירקטיבת הקהילות האירופיות 86/609/EU) ואושרו על ידי ועדות האתיקה המקומיות של בעלי חיים. חולדות לונג אוונס בנות 8 שבועות שימשו במחקר הנוכחי. בעלי החיים התקבלו ממקור מסחרי (ראו טבלת חומרים).
1. הכנת מדיה והרכבה שטוחה
- מדיום איימס (1 ליטר)
- בבקבוק זכוכית של 1 ליטר, ערבבו את אבקת Ames' Medium, 1.9 גרם/ליטר NaHCO3, 10 מ"ל פניצילין/סטרפטומיצין 100x, ו-1 ליטר מים שעברו דה-יוניזציה (ראו טבלת חומרים). כוונן את ה- pH ל- 7.4 ואת האוסמולריות ל- 280 mOsm עם מים נטולי יונים, או NaHCO3. עקרו את התמיסה על ידי סינונה דרך מסנן בגודל נקבוביות של 0.2 מיקרומטר מתחת למכסה מנוע.
הערה: יש לאחסן את המדיום המעוקר בטמפרטורה של 4°C. פתרון זה נשאר יציב וניתן להשתמש בו עד חודש אחד.
- בבקבוק זכוכית של 1 ליטר, ערבבו את אבקת Ames' Medium, 1.9 גרם/ליטר NaHCO3, 10 מ"ל פניצילין/סטרפטומיצין 100x, ו-1 ליטר מים שעברו דה-יוניזציה (ראו טבלת חומרים). כוונן את ה- pH ל- 7.4 ואת האוסמולריות ל- 280 mOsm עם מים נטולי יונים, או NaHCO3. עקרו את התמיסה על ידי סינונה דרך מסנן בגודל נקבוביות של 0.2 מיקרומטר מתחת למכסה מנוע.
- ממברנות הרכבה
- חברו קרום נקבובי אחד מסוג PTFE (ראו טבלת חומרים) למכונת כביסה באמצעות טיפות קטנות של דבק. הניחו לו להתייבש למשך 15 דקות לפחות.
- כדי להשיג שקיפות, לטבול את הממברנות באתנול 70% למשך דקה אחת.
- שטפו את הממברנות פעמיים במים נטולי יונים, כדי להסיר לחלוטין את האתנול. אחסנו אותם במים נטולי יונים, כדי למנוע אטימות.
2. תיוג GCL והרכבה שטוחה על רשתית חולדה
הערה: שיטת תיוג זו אינה מבדילה RGCs מתאי אמקרין שנעקרו ממקומם. אם יש צורך בתיוג סלקטיבי של RGCs, שקול להשתמש ב- AAVs עם מקדמים ספציפיים ל- RGC11 ו / או תיוג מדרדר דרך עצב הראייה12. כדי להבחין בין סוגים של RGCs ON- ו- OFF-center, לסווג RGCs בהתבסס על תגובת האור שלהם13,14, ולהשתמש בגרסאות חדשות יותר של מחווני סידן מקודדים גנטית המציעים רגישות מוגברת ויכולת למדוד פוטנציאלי פעולה בודדים15.
- הזרקה תוך ויטריאלית
- הרדימו את חולדת לונג אוונס בת 8 השבועות עם 2% איזופלורן / 1% O2 עד שאין רפלקס פדלים, ושמרו על הרדמה עם מסכת אף של חולדה (ראו טבלת חומרים).
הערה: במהלך ההרדמה, מקם את בעל החיים על כרית חימום כדי לשמור על טמפרטורת הגוף. - יש לתת טיפה אחת של טיפות עיניים מסחריות (ראו טבלת חומרים) כדי להרחיב את האישון.
- לפני שתמשיך בניתוח, בדוק את העין עבור חריגות באמצעות פונדוסקופיה טומוגרפיה קוהרנטית אופטית (OCT) עם מערכת הדמיה רשתית in vivo . יש למרוח טיפה אחת של מתוצל 2% כדי להקל על מגע בין הקרנית לאובייקטיבית (ראו טבלת חומרים).
הערה: אם מתגלות חריגות כלשהן, אל תמשיך בשלבים הבאים עבור עין זו. - יש למרוח טיפה אחת של פרסקאין כהרדמה מקומית. תקן את העפעף ואת לחמית הגפיים באמצעות חוט תפר זמין מסחרית (ראה טבלת חומרים). צור סקלרוטומיה 1 מ"מ 4 מ"מ מהלימבוס באמצעות מחט 30 גרם.
- חברו מחט קהה של 36 גרם למזרק מדויק והזריקו את חלקיקי ה-AAV הנושאים את אינדיקטור הסידן המקודד גנטית לזגוגית למשך 30 שניות, בזווית של 45 מעלות. במחקר זה השתמשנו ב-AAV2-CAG-GCaMP5G (7.5 x 1011 GC/mL ב-HBSS) (ראו טבלת חומרים).
הערה: מבני AAV שאינם מקודדים תוצרי גנים או מולקולות רעלן שעלולים להיות גידוליים ומיוצרים ללא וירוס מסייע יכולים להיות מטופלים במתקני בטיחות ביולוגית ברמה 1 (BSL-1). אחרת, אם נחשב חומר מסוכן ביולוגית תחת הכלת BSL-2, יש לנקוט באמצעי זהירות נאותים16. קידוד AAV עבור GCaMP נחשב BSL-1 ואינו דורש מניפולציה תחת ארונות בטיחות ביולוגית.
- חברו מחט קהה של 36 גרם למזרק מדויק והזריקו את חלקיקי ה-AAV הנושאים את אינדיקטור הסידן המקודד גנטית לזגוגית למשך 30 שניות, בזווית של 45 מעלות. במחקר זה השתמשנו ב-AAV2-CAG-GCaMP5G (7.5 x 1011 GC/mL ב-HBSS) (ראו טבלת חומרים).
- יש למרוח טיפה אחת של טוברדקס (ראו טבלת חומרים) למניעת דלקת וכטיפול מונע אנטיביוטי.
- אם תרצה, חזור על שלבים 2, 3 ו- 4 בעין השנייה.
הערה: בדוק את בעלי החיים 12-24 שעות לאחר הניתוח כדי לוודא שאין תופעות לוואי. - שלושה ימים לאחר ההזרקה, יש לבחון את מבנה הרשתית באמצעות פונדוסקופיה ו-OCT באמצעות מערכת דימות רשתית in vivo (ראו טבלת חומרים).
- שבועיים לאחר ההזרקה, ה- GCL אמור לפלוט פלואורסצנטיות. להעריך את מבנה הרשתית ואת ביטוי AAV על ידי פונדוסקופיה פלואורסצנטית באמצעות מערכת דימות רשתית in vivo .
הערה: על פי Weitz et al.12, פלואורסצנטיות מ- AAV2-CAG-GCaMP5G מורגשת שבוע לאחר ההזרקה ומתגברת בשבועיים. החל מהשבוע הרביעי, ביטוי יתר של GCaMP גורם לתחלואה. תאים גוססים מציגים אות פלואורסצנטי בסיסי גבוה בגרעין ובציטופלסמה שאינו משתנה בתגובה לגירוי. בתאים בריאים, ביטוי GCaMP מוגבל לציטופלסמה ואינו נכלל בגרעין 7,8,12,17,18. תכונות אלה ניתן לראות ex vivo במהלך הדמיה מיקרוסקופית. חלון ביטוי הגנים עשוי להשתנות בהתאם לווקטור הנגיפי ולמקדם שנבחר.
- הרדימו את חולדת לונג אוונס בת 8 השבועות עם 2% איזופלורן / 1% O2 עד שאין רפלקס פדלים, ושמרו על הרדמה עם מסכת אף של חולדה (ראו טבלת חומרים).
- כריתת רשתית והרכבה שטוחה
הערה: שבועיים עד שלושה שבועות לאחר ההזרקה, חולדות המוזרקות תוך זגוגית מורדמות מיד לפני תחילת פרוטוקול האלקטרופיזיולוגיה, בהתאם להנחיות אתיות סטנדרטיות (הנחיית הקהילות האירופיות 86/609/EU) ומאושרות על ידי ועדות אתיות מקומיות. שאיפת פחמן דו חמצני (CO2) משמשת כשיטה להמתת חסד בפרוטוקול זה.- חינוך עיניים
- לחץ בעדינות על החלק החיצוני של המסלול באמצעות זוג מלקחיים מעוקלים כדי להבליט מעט את העין מארובות העין.
- השתמש זוג מספריים קפיץ לחתוך את השרירים המחזיקים את העין לחנך אותו, נזהר לא לנקב את גלגל העין.
הערה: החל משלב זה, נתח את הרשתית תחת מיקרוסקופ סטריאו בתווך איימס מחומצן (95% O2 / 5% CO2).
- כריתת רשתית
- השתמש בזוג מלקחיים מעוקלים קטנים ומספריים קפיציים עדינים כדי להסיר את כל הרקמה שמסביב מגלגל העין.
- קחו פיסת נייר סינון בגודל של כ-3X3 ס"מ והניחו אותה על מכסה צלחת בגודל 3.5 ס"מ. השרו את הנייר במדיום של איימס.
- הניחו את גלגל העין על גבי הנייר, כאשר החלק הקדמי פונה למפעיל. השתמשו בזוג מלקחיים ישרים כדי להחזיק את גלגל העין, ומקמו אותם על גבי האורה-סראטה בזווית של כ-45 מעלות מפני השטח של המנה. בצע חתך קטן עם להב, תוך שימוש ברווח בין המלקחיים הישרים כנקודת התייחסות.
- להחזיר את גלגל העין למדיום של איימס. השתמש בזוג מלקחיים ישרים ומספריים קפיציים עדינים כדי להפריד בין החלק הקדמי והאחורי של העין.
- הסר בזהירות את העדשה באמצעות שני זוגות מלקחיים ישרים. לאחר מכן, להפריד את הרשתית מן sclera.
- חותכים את לובן העין לכיוון עצב הראייה באמצעות מספריים קפיציים עדינים עד לבידוד הרשתית מכוס העין.
- השתמש במיקרוסקופ סטריאו פלואורסצנטי כדי לזהות את אזור הרשתית עם ביטוי מחוון הסידן הטוב ביותר.
הערה: מידת ההתפשטות הנגיפית תלויה בהצלחת הזריקה התוך-ויטריאלית. השגת פלואורסצנטיות על פני חלקים גדולים של הרשתית עשויה לדרוש תרגול. הניסיון של החוקר משחק תפקיד מכריע בהשגת תוצאות אופטימליות. - באמצעות פיפטה פלסטיק חתוך, להעביר את החלק שנבחר של הרשתית על קרום הרכבה (שלבי הרכבה ממברנות). השתמש בזוג מלקחיים ישרים כדי להרכיב את הרשתית בצורה שטוחה כאשר ה-GCL פונה כלפי מעלה.
- בעזרת פיפטה מפלסטיק המחוברת לקצה פיפטה של 100 מיקרוליטר, הסר את המדיה כדי לאפשר לחתיכת הרשתית להיצמד לקרום הנקבובי. הפוך את המכלול על MEA כך שה- GCL יונח על גבי האלקטרודות.
- מלאו את האמבטיה לדוגמה במדיום איימס מחומצן.
- חינוך עיניים
3. הדמיית סידן Ex vivo על גירוי חשמלי
הערה: בעבודה זו, MEA הוכחת היתכנות שימש לניסויים ex vivo . ה- MEAs המותאמים אישית יוצרו עם אלקטרודות נקבוביות מבוססות גרפן בקוטר 25 מיקרומטר על זכוכית בורוסיליקט בעובי 500 מיקרומטר עם עקבות Ti/Au ומאוחר יותר מבודדות עם סיליקון ניטריד ו- SU-8 photoresist12. עם זאת, שיטות הדמיית הסידן תקפות ללא קשר לחומר האלקטרודה המשמש לגירוי.
- כוונו את מערכת הזילוח כך שמדיום איימס המחומצן יחורר כל הזמן את אמבט הדגימה בטמפרטורה של 33°C בקצב זרימה קבוע של 5 מ"ל/דקה.
- באמצעות מיקרוסקופ פלואורסצנטי הפוך המצויד במנורת פלורסנט, קוביית מסנן FITC ומצלמת CMOS, בדוק את הרשתית עבור אזור שבו ניתן לראות את האלקטרודות המעוררות ואת הפלואורסצנטיות מתאים המבטאים GCaMP. במחקר זה נעשה שימוש במטרה אווירית של 20x NA 0.75.
הערה: כדי לגרות (ולהקליט) ביעילות את התאים באמצעות האלקטרודות, הרשתית והאלקטרודה צריכות להיות במגע קרוב. לכן, תאים נמצאים באופן גלוי באותו מישור מוקד כמו האלקטרודות. אם זה לא המקרה, חזור על השלבים של כריתת הרשתית משלב 8 ואילך. בעת שימוש ברשתית ממודלים בריאים של בעלי חיים (עם פוטורצפטורים מתפקדים), שים לב שבכל פעם שמנורת הפלואורסצנט דולקת, יהיו כמה תגובות מעוררות הנוצרות על ידי האור מכיוון שהרשתית רגישה לאור לאורך הגל המשמש להפעלת חיישן GCaMP. ניתן להשתמש בשינויים אלה בסידן המושרה על ידי אור כדי להעריך את המצב הבריאותי של הרקמה. כדי להימנע מערבוב אור עם תגובות חשמליות, הפעל את מנורת הפלואורסצנט לפחות דקה אחת לפני תחילת רכישת התמונה. - כדי לעורר תגובות חשמליות ב-GCL, בחר אלקטרודה כדי לשלוח פולסים מבוקרי זרם. הגדר את פרמטרי הגירוי החשמלי בתוכנה של מכשיר מחולל הדופק, כגון: צורה, משרעת, משך, עיכוב פאזה ותדירות הפולסים שיש ליישם.
הערה: פרמטרי גירוי אפקטיביים יכולים להשתנות במידה רבה מרוחב פולסים של 50 μs עד 100 ms, עם אמפליטודות הנעות בין 0.1 μA ל- 10 μA. פרמטרים אלה, יחד עם תדירות הגירוי, קוטביות הגירוי, מספר הפולסים והעיכובים הבין-פאזיים, יכולים להשפיע על התגובה המרחבית-זמנית שנצפתה על ידי הדמיית סידן 19,20,21,22. רכבת של 40 פולסים דו-פאזיים המספקים גירוי של 1ms, 2 μA יוצרת לעתים קרובות תגובה נראית לעין בתאי עצב מסומנים. - כדי לסנכרן את רכישת התמונה עם מסירת הגירוי, השתמש במחולל הדופק כגורם מפעיל חיצוני כדי לשלוט בתחילת רכישת התמונה. חבר את המצלמה (ראה טבלת חומרים) עם מחולל הדופק באמצעות אות הדק הפלט והגדר את "מצב לכידה" של תוכנת המצלמה ל"מפעיל הפעלה חיצוני". לחץ על Start בתוכנת המצלמה כך שהיא תמתין להפעלה של גורם מפעיל חיצוני. התחל את רכישת התמונה עם תוכנת מחולל הדופק.
הערה: פקד ההדק החיצוני עשוי להיות מוגדר באופן שונה עבור מצלמות שונות. מחקר זה רכש בדרך כלל תמונות (512 x 512 פיקסלים, גווני אפור של 16 סיביות) בקצב של 10 פריימים לשנייה למשך דקה אחת, תוך מתן התפרצויות של רכבות פולס דו-פאזיות כל 10 שניות. העברת הדופק מתחילה לאחר 10 שניות, כך שהפריימים הראשונים בכל הניסויים מתאימים לפעילות ספונטנית. בהתאם לחיישן GCaMP ולניתוח שתבצע, ייתכן שיהיה צורך להתאים את קצב ההקלטה בהתאם לזמני העלייה והדעיכה של מחוון הסידןשלך 8. שקול את הרגישות כדי לזהות פוטנציאלים פעולה יחידה של מחוון סידן15. - שמור את התמונות בשם קובץ הכולל את פרמטרי הגירוי החשמלי שהוחלו, כגון [מספר אלקטרודה]_[משרעת פולס]_[משך פולס]_[תדר פולס]_Image001.
4. ניתוח נתונים
- ImageJ/FIJI לחילוץ פרופיל עוצמת הפלואורסצנטיות לאורך זמן והקואורדינטות המרחביות מסומס התא
- פלח את אזור העניין (ROI) באמצעות "כלי בחירת אזור" והוסף אותו למנהל החזר ההשקעה (ניתוח כלי > >- ROI Manager > Add). בתפריט ROI Manager, שמור אותו כתיקיית .zip (More > Save).
הערה: בדרך כלל, ניתן להחיל את אותם ROI על כל ניסויי הגירוי מכיוון שהם תואמים לאותו FOV. - בחר את "ערך אפור ממוצע" כפרמטר לחילוץ (נתח > הגדר מדידות).
- חלץ את "ערך אפור ממוצע" מהסומס של התא על-ידי לחיצה על עוד > מידה מרובה. תופיע תיבת דו-שיח. הפעילו את האפשרויות 'מדוד את כל 600 הפרוסות' ו'שורה אחת לכל פרוסה ' כדי לקבל טבלה אחת שבה עמודות תואמות להחזרי השקעה ושורות תואמות למסגרות זמן. שמור את הטבלה שנוצרה כגיליון אלקטרוני .xls.
- בחר את "Centroid" כפרמטר שיש לחלץ (נתח > הגדר מדידות).
- חלץ את "Centroid" מה- ROI על ידי לחיצה על מדידה. הטבלה שנוצרה מתאימה לקואורדינטות (X,Y) של החזר ההשקעה. שמור אותו כגיליון אלקטרוני .xls.
- פלח את אזור העניין (ROI) באמצעות "כלי בחירת אזור" והוסף אותו למנהל החזר ההשקעה (ניתוח כלי > >- ROI Manager > Add). בתפריט ROI Manager, שמור אותו כתיקיית .zip (More > Save).
- סקריפט מותאם אישית לזיהוי תאים המגיבים לגירויים
הערה: MATLAB (ראו טבלת חומרים) שימשה כאן, אך ניתן להשיג את השלבים המתוארים בכל שפת תכנות. משתמשים יכולים להשיג את הסקריפט שנבנה בהתאמה אישית על ידי בקשת המחבר המתאים.- תיקון אפקט הלבנה: כדי להפחית את אפקט הרקע וההלבנה, צלם 15-20 פריימים מהתקופות הלא מעוררות שלפני כל פרץ והתאם אותם לעקומה ליניארית [התאמה (poly1)].
הערה: במקרה זה, עבור סרט בן 600 פריימים שבו נשלחו התפרצויות תקופתיות של רכבות פולס כל 10 שניות, מסגרות 1:90, 170:190, 270:290, 370:390, 470:490, 570:590 נחשבו לתקופות לא מעוררות. - נרמל באמצעות הנוסחה: (X-min) / (max-min)
- זיהוי תאים מגיבים
- חשב את ריבוע ממוצע הבסיס (RMS) של התקופות שאינן מעוררות מהנתונים המנורמלים. זה ייחשב כאות הבסיס.
- חשב את המקסימום של תקופות מגרה (מסגרות בין תקופות לא מגרה). במקרה זה, עבור סרט כולל של 600 פריימים שבו התפרצויות תקופתיות של רכבות פולס נשלחו כל 10 שניות, מסגרות 91:169, 191:269, 291:369, 391:469, 491:569 נחשבו תקופות מעוררות.
- אם הערך המרבי עולה על האות הבסיסי פי 2.5 עבור החזר השקעה ספציפי, תייג את התא כמגיב לתקופת גירוי זו. אם התא מגיב לשלוש מתוך חמש תקופות הגירוי, סווג אותו כתא מגיב.
- תיקון אפקט הלבנה: כדי להפחית את אפקט הרקע וההלבנה, צלם 15-20 פריימים מהתקופות הלא מעוררות שלפני כל פרץ והתאם אותם לעקומה ליניארית [התאמה (poly1)].
תוצאות
הפרוטוקול המתואר במחקר זה מבוסס על מחקרי הדמיה פלואורסצנטית וגירוי חשמלי שנערכו על ידי וייץ ואחרים.12. הפרוטוקול מורכב משלושה חלקים עיקריים: (1) תיוג פלואורסצנטי של GCL והרכבה שטוחה של הרשתית על MEA (איור 1-משמאל), (2) הדמיה של פעילות הסידן ב-GCL במהלך גירוי חשמלי (איור 1-באמצע), ו-(3) מיצוי, עיבוד ופענוח של נתוני הדימות (איור 1-מימין).
ראשית, כפי שמתואר באיור 1-משמאל, חולדות Long Evans מוזרקות תוך ויטוויט עם AAV2-CAG-GCaMP5G לפני סשן ההדמיה. הביטוי הנגיפי האופטימלי לווקטור זה מתרחש 2 עד 3 שבועות לאחר הזרקת12,18. לאחר הרדמה מלאה של החיה, חור פיילוט נעשה באמצעות מחט 30 גרם, ולאחר מכן 5 μL של AAV2-CAG-GCaMP5G מוזרק לאט לתוך הזגוגית באמצעות מחט 36 G קהה מחובר מזרק מדויק כדי למנוע ריפלוקס. במהלך ביטוי ויראלי, מערכת דימות רשתית in vivo משמשת להערכת מצב הרשתית לאחר הניתוח, עם תמונות OCT המספקות הדמיה מפורטת של שכבות הרשתית. לאחר השגת ביטוי גנים, הרשתית מופקת בזהירות מכוס העין באמצעות מיקרוסקופ סטריאופוני וכלי דיסקציה מדויקים. מנקודה זו ואילך, הרקמה עוברת מניפולציה במדיה מחומצנת כדי לשמר את הדגימה. הרשתית הנכרתה, כאשר ה-GCL פונה כלפי מעלה, מורכבת לאחר מכן על פלטפורמה המיועדת להרכבה שטוחה כדי להבטיח יציבות ולמנוע ציפה של דגימה. הדגימה מותקנת על משטח MEA כאשר ה-GCL פונה לאלקטרודות.
לאחר מכן, MEA מורכב על לוח הממשק שלו במיקרוסקופ פלואורסצנטי הפוך (איור 1-באמצע). דגימת הרשתית מחוררת עם מדיה מחומצנת ב 33 ° C באמצעות מערכת זילוח. ניתן לשמור את הדגימה בתצורה זו במשך מספר שעות. ערכת הגירוי הרצויה מתוכנתת, והתמונות נרכשות בקצב של 10 מסגרות לשנייה. מומלץ לתת שמות לסרטים בהתאם לפרמטרים של גירוי חשמלי. רכישת תמונה צריכה להתחיל לפני תחילת הגירוי כדי להשיג כמה מסגרות בסיסיות ללא גירוי, אשר ישמש שליטה שלילית.
לבסוף, כפי שמודגם באיור 1-מימין, הנתונים מופקים מתמונות קיטועי הזמן על-ידי פילוח הסומות של התא. אפקטים של הלבנה מתוקנים על-ידי התאמת הנתונים, ותאים מגיבים מזוהים. תאים מגיבים מוגדרים כתאים עם שיאי פלואורסצנטיות במהלך גירוי העולה על קו הבסיס שלהם פי 2.5. אם תא מגיב לשלושה מתוך חמשת פרצי הגירוי, הוא נחשב כמגיב לאותה רכבת גירוי ספציפית.
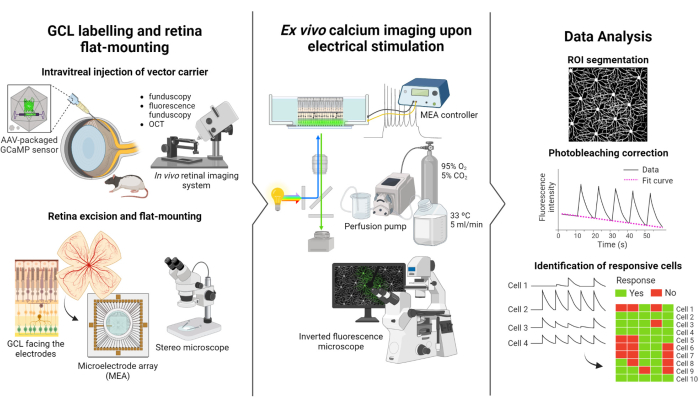
איור 1: סקירה כללית של המחקר. המחשה סכמטית של פרוטוקול התיוג הפלואורסצנטי (משמאל) של ה-GCL של הרשתית והרכבת הדגימה, (באמצע) הכנה להקלטות ex vivo עם גירוי חשמלי המסופק על ידי MEA, וניתוח (מימין) של נתוני דימות הסידן כדי לסווג תאים מגיבים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
רשתית תוך ויטריאלית מוזרקת
שכיחות הסיבוכים הקשורים לזריקות תוך ויטריאליות נמוכה מאוד. עם זאת, ישנם כמה סיבוכים שיכולים לנבוע מהניתוח עצמו, ללא קשר למרכיב המוזרק. סיבוכים אלה כוללים היווצרות קטרקט, דימום בזגוגית, העלאת לחץ תוך עיני ואנדופתלמיטיס23. כדי לקבוע אם סיבוכים אלה נגרמים על ידי הניתוח, בעל החיים צריך לעבור הערכה לפני ההליך באמצעות פונדוסקופיה ו OCT. שלושה ימים לאחר ההזרקה, בעלי החיים צריכים להיות במעקב. באיור 2A-D מוצגת הרשתית של חיה מוזרקת בריאה. לאחר שבועיים של הזרקה, ה-RGCs מתחילים לבטא פלואורסצנטיות, אשר ניתן לדמיין באמצעות פונדוסקופיה פלואורסצנטית (איור 2B,C). תמונות OCT מספקות הדמיה מפורטת של הנטייה והעובי של שכבות הרשתית (איור 2D), ומציעות רזולוציה גבוהה יותר בהשוואה לפונדוסקופיה, במיוחד בעת הערכת היפרדות רשתית. ברגע שהרשתית מותקנת שטוחה ומצולמת באמצעות מיקרוסקופ פלואורסצנטי הפוך, ניתן להבחין בין התאים וצרורות האקסונים. שלא כמו מדדי סידן אחרים, מחוון GCaMP מוגבל לציטופלסמה7, ופלואורסצנטיות אינה נכללת בגרעין (איור 2E).
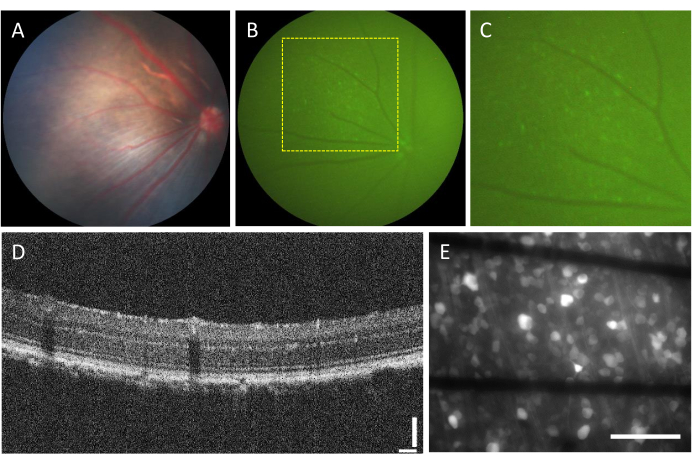
איור 2: תמונות מייצגות של הרשתית התוך ויטריאלית. (A) פונדוסקופיה, (B) פונדוסקופיה פלואורסצנטית, (C) זום אין של פונדוסקופיה פלואורסצנטית, (D) תמונת OCT, ו-(E) תמונת אפי-פלואורסצנטיות של הרשתית הנכרתת המורכבת על MEA מותאם אישית עם אלקטרודות מבוססות גרפן על זכוכית בורוסיליקט בעובי 500 מיקרומטר. ב- (E), קווים שחורים תואמים לעקבות Ti/Au. פסי קנה מידה: 115 מיקרומטר (D) ו- 100 מיקרומטר (E). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
אלקטרודות ומגע GCL
על מנת לעורר תגובות עצביות ביעילות, חיוני לוודא כי הרשתית השטוחה נמצאת במגע הדוק עם פני השטח של MEA. דרך פשוטה לאמת זאת היא על-ידי אישור חזותי אם התאים והאלקטרודות ממוקמים באותו מישור מוקד (איור 3A). אם התאים אינם נמצאים באותו מישור מוקד כמו האלקטרודות (איור 3B), הדבר מצביע על כך שהמגע אינו אופטימלי, מה שיגרום לגירוי פחות יעיל.
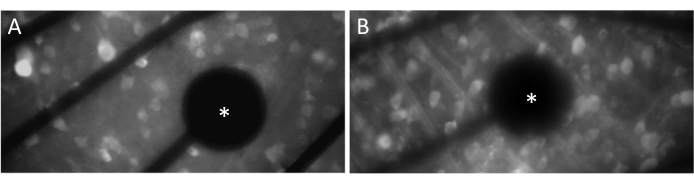
איור 3: אלקטרודות ומגע GCL. (A) תאים והאלקטרודה (כוכבית) באותו מישור מוקד. (B) תאים ואלקטרודות שאינם באותו מישור מוקד, דבר המצביע על מגע תת-אופטימלי לגירוי חשמלי באותו אזור. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
הדמיית סידן Ex vivo על גירוי חשמלי המסופק על ידי MEA
הנתונים המתקבלים מהדמיית סידן מורכבים מתמונות בהילוך מהיר המנטרות את הפעילות העצבית של מאות תאים בתגובה לגירוי חשמלי. גירויי Suprathreshold גורמים לזרימת סידן לתוך הסומות של התא, וכתוצאה מכך שינוי פתאומי בעוצמת הפלואורסצנטיות (וידאו 1). פרוטוקול זה מאפשר לקבוע אם אלקטרודה, MEA ו/או אלגוריתם גירוי מעוררים את התגובה הרצויה ברקמה העצבית. הגודל והגובה של האלקטרודות ב-MEA, כמו גם שיעור הרקמה הנחקרת, יקבעו את ההגדלה האובייקטיבית המתאימה לבחירה. בדרך כלל, עבור מחקרים על גירוי אלקטרודה בודדת בקטרים הנעים בין 5 מיקרומטר ל-100 מיקרומטר, הגדלה אובייקטיבית של פי 20-25 מתאימה (איור 4A), המספקת FOV של כ-600 מיקרומטר x 600 מיקרומטר. עבור ניסויים הכוללים גירוי עם אלקטרודות מרובות, הגדלה אובייקטיבית של 4-10x עשויה להיות נחוצה כדי להעריך שטח רחב יותר של סביב 2 מ"מ x 2 מ"מ. ניתן לזהות בקלות תאים מגיבים על-ידי יצירת הקרנת תמונה בסטיית תקן של סרט קיטועי זמן (איור 4B ווידאו 1).
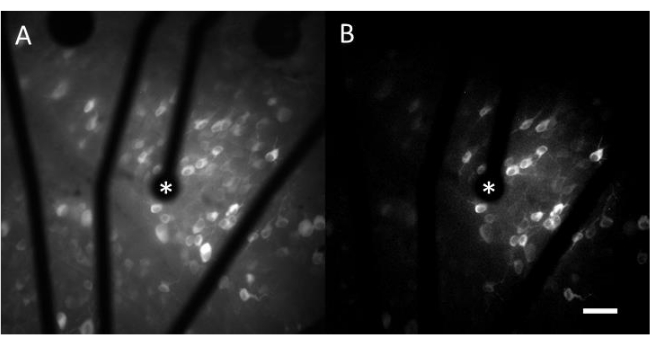
איור 4: הדמיית סידן של GCL עם גירוי חשמלי המסופק על-ידי אלקטרודה בקוטר 25 מיקרומטר. (A) הקרנה מרבית של סרט בהילוך מהיר של 60 שניות ו-(B) הקרנה בסטיית תקן המתארת בבירור תאים המגיבים לגירויים חשמליים מאלקטרודה נקבובית המבוססת על גרפן בקוטר 25 מיקרומטר. האלקטרודה המגרה מסומנת בכוכבית. סרגל קנה מידה: 50 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
ניתוח דינמיקת הסידן לאורך זמן לאחר גירוי מבוקר
עבור כל סומא תאים שזוהה, ערכי העוצמה הממוצעת חולצו לאורך זמן. איור 5A מראה את עקבות הסידן המתוקנות בפוטו-אקונומיקה מהתאים המגיבים. בדוגמה זו, חמישה התפרצויות של רכבות פולס דו-פאזיות (קתודיות-ראשונות, 40 מחזורים, משך 1 אלפיות השנייה, משרעת 2 מיקרו-אמפר) נמסרו כל 10 שניות (מסומנות בקווים שחורים) במהלך רכישת תמונה של 60 שניות. בתוך ניסוי נתון, אותן חמש רכבות פולס מופעלות כדי לבחון את עקביות התגובה. המסגרות שצולמו בתקופות שאינן מעוררות (מודגשות באדום) משמשות לביצוע התאמה ליניארית, תוך תיקון אפקט ההלבנה.
לאחר זיהוי התאים המגיבים, והקואורדינטות שלהם (x,y) ידועות ביחס לאלקטרודה המעוררת, ניתן לבחון את הקשר בין הזרם הדרוש להפעלת התאים לבין המרחק מהאלקטרודה המעוררת (איור 5B). כצפוי, תאים הממוקמים קרוב יותר לאלקטרודה המגרה דורשים ערכי זרם נמוכים יותר כדי לעורר תגובה.
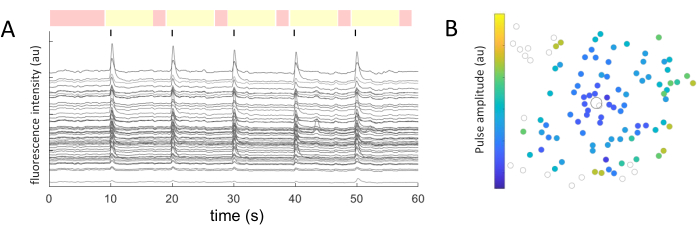
איור 5: ייצוג התגובות החשמליות. (A) עקבות סידן של סומות תאים על 5 התפרצויות של רכבות פולס (דו-פאזית, קתודית-ראשונה, 40 מחזורים, משך אלפית שנייה אחת, משרעת 2 מיקרו-אמפר) כל 10 שניות (קווים שחורים) במהלך רכישת תמונה של 60 שניות. מוצגות נקודות לא מגרה (מסגרות עם סימון אדום) ונקודות גירוי (מסגרות עם סימון צהוב). עקבות העולות על אות הבסיס (ריבוע ממוצע השורש של התקופות הלא מעוררות) פי 2.5 נחשבות לתגובות מעוררות. תאים המגיבים בשלוש מתוך חמש תקופות הגירוי מסווגים כתאים מגיבים. (B) מפת התפלגות פעילות סידן המציגה את האלקטרודה המגרה (עיגול שחור מסומן) ואת התאים (עיגול אפור עם קווי מתאר). קוד הצבע מייצג את משרעת הפולס המינימלית הדרושה כדי לעורר תגובה תאית. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
וידאו 1: הדמיית סידן של GCL עם גירוי חשמלי המסופק על ידי אלקטרודה בקוטר 25 מיקרומטר. הסרטון מציג הבדלים בעוצמת הפלואורסצנטיות עקב גירוי חשמלי מאלקטרודה נקבובית מבוססת גרפן בקוטר 25 מיקרומטר. הצד השמאלי מציג את הסרט המקורי, והצד הימני מציג את הקרנת סטיית התקן שבה ניתן לזהות בקלות תאים מגיבים. סרגל קנה מידה: 50 מיקרומטר. אנא לחץ כאן להורדת סרטון זה.
Discussion
הפרוטוקול המתואר כאן משמש לחקר דינמיקת הסידן המתרחשת ברשתית החולדה GCL לאחר גירוי חשמלי המסופק עם MEA. זוהי שיטה אמינה וניתנת לניהול אך דורשת הכשרה מסוימת, במיוחד כדי לתייג באופן אחיד את ה- GCL ביעילות ולהרכיב את הרשתית כראוי כדי להבטיח מגע אופטימלי בין רקמה לאלקטרודה. פרוטוקול זה הוא ספציפי למכרסמים ויש להתאים אותו אם הוא מיושם על מין מעבדה אחר. הנקודות הקריטיות, השינויים והמגבלות של המתודולוגיה מוצגים בפירוט.
זריקות תוך ויטריאליות
זריקות נמצאות בשימוש נרחב להעברת גנים עיניים, כאשר זריקות תוך ויטריאליות הן ההליך המועדף. הם הוכחו כבטוחים יותר ופחות פולשניים בהשוואה לזריקות תת-רשתית, אשר מציגות את המולקולות המעניינות ישירות בין הפוטורצפטורים לבין אפיתל פיגמנט הרשתית (RPE), ומסתכנות בהיפרדות רשתית10. עם זאת, ישנן מגבלות, במיוחד בעת ביצוע זריקות אלה במודלים מכרסמים. הומור הזגוגית הוא ג'לטיני, מעכב דיפוזיה ויראלית. יתר על כן, העדשה בעיני מכרסם היא גדולה, מה שהופך את זה לא טריוויאלי להחדיר את המחט מבלי לשרוט אותה. מחטי המזרק המדויקות עדינות ויש להחליף אותן לעתים קרובות. כדי למנוע חסימה, שטפו אותם במים נטולי יונים, לפני ואחרי כל שימוש והחליפו אותם באופן קבוע. בנוסף, יש להזריק את התוכן באיטיות כדי למנוע ריפלוקס תמיסה ושינויים בלחץ התוך עיני. השגת פלואורסצנטיות גדולה ואחידה על פני הרשתית עשויה לדרוש תרגול.
התמרה של תאי רשתית
וקטורים נגיפיים הם שיטה מצוינת להעברת גנים in vivo, ו- AAVs נמצאים בשימוש נרחב להמרת תאי רשתית10. הם אושרו כטיפול בכמה רטינופתים הגורמים לעיוורון אנושי24. עם זאת, קיבולת הנשא שלהם מוגבלת ל- 5 קילו-בתים, כולל האלמנטים הרגולטוריים הנדרשים (למשל, המקדם)10,25. ישנם מספר סרוטיפים זמינים, כל אחד עם טרופיזם שונה. בחר את AAV המתאים ביותר בהתבסס על הגנים שיועברו והתאים שיועברו26. עבור תיוג RGCs, מומלץ להשתמש AAV227.
חלון ביטוי גנים
הביטוי הנגיפי האופטימלי עבור AAV2-CAG-GCaMP5G הוא 2 עד 3 שבועות לאחר הזרקת12,18. מעבר לפרק זמן זה, הגרעינים של תאים נגועים הופכים פלואורסצנטיים, תאים מפסיקים להגיב לגירויים, ובסופו של דבר מתים 7,28,29. זאת בשל ביטוי יתר של מחוון GCaMP, אשר translocated לתוך הגרעין. חלון הזמן לביטוי גנים אופטימלי ישתנה בהתאם לווקטור הנגיפי ולמקדםשנבחר 30 ויש לקבוע אותו באופן ניסיוני לפני שתמשיך בפרוטוקול זה.
מגע רקמות-אלקטרודות
לקבלת תוצאות אופטימליות וניתנות לשחזור, השגת מגע טוב בין רקמה לאלקטרודה היא חיונית. מגע לקוי נובע בדרך כלל מהעקמומיות הטבעית של הרשתית. גישה אחת היא לחתוך את הרשתית לרבעים, להרכיב ולצלם קטע אחד בכל פעם. חלקים קטנים של הרשתית יכולים להיות שטוחים טוב יותר, וכתוצאה מכך מגע יעיל יותר עם פני השטח של MEA. סיבה אפשרית נוספת למגע לקוי היא נוכחות של הומור זגוגית. בעת ביצוע ניסויי גירוי המדמים שתל אפי-רשתית, חשוב להסיר בזהירות את הומור הזגוגית במהלך כריתת הרשתית מכיוון שהוא יכול לשמש כמבודד לזרם. כאן, שיטה פשוטה מתוארת כדי לבדוק אם המגע מספיק על ידי הדמיה של האלקטרודה והתאים באותו מישור מוקד.
חלופה למדידות רשתית ex vivo היא לגדל נוירונים ישירות על פני השטח של האלקטרודות. תרבית ראשונית של נוירונים, כגון נוירונים בהיפוקמפוס31, יכולה להיות שימושית לבדיקות ראשוניות כדי להעריך את הפונקציונליות של המכשיר המגרה החדש. עם זאת, גישה זו עדיין דורשת שימוש בחיות מעבדה ואינה מייצגת את המורכבות של רשת הרשתית, החשובה להערכת תגובות סינפטיות לגירוי.
כדי להמחיש את התאים שמתחת לעקבות האלקטרודות והאלקטרודות, MEAs המיוצרים מחומרים שקופים כגון תחמוצת בדיל אינדיום (ITO) יכולים לשמש 19,20,32. בנוסף למדידות אופטיות, ניתן להעריך את פעילות GCL על גירוי חשמלי באמצעות הקלטות חשמליות. ניתן להשתמש ב-MEA כדי לרשום את פוטנציאל השדה המקומי (LFP) של הרקמה. עם זאת, הדבר פוגע ברזולוציה המרחבית, שכן כל אלקטרודה לוכדת פעילות מספר תאים בו זמנית (בהתאם לממדי האלקטרודה). הקלטה אופטית מתגברת על מגבלה זו ומציעה מיפוי ברזולוציה מרחבית גבוהה יותר. היתרון העיקרי שלה הוא היכולת להבחין בין תאים פעילים ולא פעילים תוך מדידת FOV גדול עם רזולוציה של תא בודד. מבין כל מדווחי הפעילות התאית, מדדי סידן מתוארים היטב ונמצאים בשימוש הנפוץ ביותר33.
Disclosures
למחברים אין גילויים להוסיף לכתב היד.
Acknowledgements
אנו מודים למרס ריבאס, אנחל סנדובל, חסוס פלאנגומה, ג'ורדי קורטס, סנדרה אורטונובס לארה ואלינה הירשמן (ICFO-Institut de Ciències Fotòniques) על תמיכתם הטכנית, לאנה דוארי (VHIR, מכון המחקר ואל ד'חברון) מקבוצת המחקר לרפואת עיניים על תמיכתם בזריקות התוך ויטריאליות ובהדמיית הרשתית in vivo .
גופי המימון שתמכו בעבודה זו הם: Fundació CELLEX; פונדאסיו מיר-פויג; Ministerio de Economía y Competitividad - Severo Ochoa תוכנית למרכזי מצוינות במו"פ (CEX2019-000910-S, [MCIN/AEI/10.13039/501100011033]); Generalitat de Catalunya באמצעות תוכנית CERCA; לייזרלאב-אירופה (EU-H2020 GA מס' 871124); קרן La Caixa (LCF/HR19/52160003); ו-Fondo Social Europeo (PRE2020-095721, M.C).
Materials
| Name | Company | Catalog Number | Comments |
| 20x NA 0.75 S Fluor air objective | Nikon | CFI Super Fluor 20X | - |
| 3.5 cm Cell culture dish | Nunc | 12-565-90 | - |
| 30 G needle | VWR | 613-5373 | - |
| 36 G blunt needle | World Precision Instruments | NF36BL-2 | - |
| 6 cm Cell culture dish | Nunc | 12-565-94 | - |
| AAV2-CAG-GCaMP5G | Vector Biolabs | - | - |
| Ames' Medium | Sigma Aldrich | A1420 | - |
| Blade | Swann-morton | 0308 | - |
| Camera | Hamamatsu | ORCA Flash v4.0 | - |
| Carbogen | Air liquide | - | - |
| Curved-forceps | - | - | - |
| Fine spring-scissors | FST | 91501-09 | - |
| FITC filter cube | Nikon | Standard series | - |
| Fluorescent lamp | Nikon | C-HGFI | - |
| Fluorescent stereomicroscope | Nikon | SMZ25 | - |
| HBSS | Capricorn | HBSS-1A | - |
| ImageJ/FIJI | NIH | v1.50i | - |
| In vivo retinal imaging system | Phoenix Research Laboratories | Micron III | - |
| Inverted fluorescence microscope | Nikon | Eclipse Ti | - |
| Isofluorane | Arrane Baxter Laboratories | - | - |
| Long-Evans rat | Janvier | - | - |
| MATLAB (Version R2021b) | Mathworks | - | - |
| Media filters | Merckmillipore | SCGPS02RE | - |
| Methocel 2% | Omni Vision | - | - |
| Microelectrode array (MEA) | - | Custom-made | |
| NaHCO3 | Thermofisher | 42427 | - |
| Penicillin/Streptomycin 100x | Thermofisher | 15140122 | - |
| Phenylephrine | Alcon Cusí Laboratories | 653437.3 | 100 mg/mL |
| Plastic pipette | VWR | 612-1793 | - |
| Porous membrane | Merckmillipore | #JVWP01300 | - |
| Precision syringe | World Precision Instruments | 10 µl Nanofil | - |
| Prescaina | Llorens | - | Oxybuprocaine chlorhydrate (2 mg/mL), local anesthetic |
| Rat nasal mask | Xenotec | XRK-RA | - |
| Small curved-forceps | Bbraun | AESCBD311R | - |
| Spring-scissors | FST | 15040-11 | - |
| Stereo microscope | Zeiss | Stemi 2000 | - |
| Straight forceps | FST | 11252-20 | - |
| Suture filament | Vitrex Medical | 4328 | Nilon monofilament, 7/0, DS12 |
| Tobradex | Alcon Cusí Laboratories | - | Tobramycin (3 mg/mL) and dexamethasone (1 mg/mL) |
| Tropicamide | Alcon Cusí Laboratories | 653486 | 10 mg/mL |
| Washer | Thorlabs | W8S038 | - |
References
- Bourne, R. R. A., et al. Prevalence and causes of vision loss in high-income countries and in Eastern and Central Europe in 2015: Magnitude, temporal trends and projections. British Journal of Ophthalmology. 102 (5), 575-585 (2018).
- Li, J. Q., et al. Prevalence and incidence of age-related macular degeneration in Europe: a systematic review and meta-analysis. British Journal of Ophthalmology. 104 (8), 1077-1084 (2020).
- Roska, B., Sahel, J. A. Restoring vision. Nature. 557 (7705), 359-367 (2018).
- Hornig, R., Velikay-Parel, M. Retina implants. Implantable Sensor Systems for Medical Applications. , 469-496 (2013).
- Lewis, P. M., et al. Advances in implantable bionic devices for blindness: a review. ANZ Journal of Surgery. 86 (9), 654-659 (2016).
- Weiland, J. D., Walston, S. T., Humayun, M. S. Electrical stimulation of the retina to produce artificial vision. Annual Review of Vision Science. 2, 273-294 (2016).
- Tian, L., et al. Imaging neural activity in worms, flies and mice with improved GCaMP calcium indicators. Nature Methods. 6, 875-881 (2009).
- Chen, T. -. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499, 295-300 (2013).
- Nakai, J., Ohkura, M., Imoto, K. A high signal-to-noise Ca2+ probe composed of a single green fluorescent protein. Nature Biotechnology. 19, 137-141 (2001).
- Sahu, B., Chug, I., Khanna, H. The ocular gene delivery landscape. Biomolecules. 11 (8), 1135 (2021).
- Hanlon, K. S., et al. A novel retinal ganglion cell promoter for utility in AAV vectors. Frontiers in Neuroscience. 11, (2017).
- Weitz, A. C., et al. Imaging the response of the retina to electrical stimulation with genetically encoded calcium indicators. Journal of Neurophysiology. 9 (7), 1979-1988 (2013).
- Briggman, K. L., Euler, T. Bulk electroporation and population calcium imaging in the adult mammalian retina. Journal of Neurophysiology. 105 (5), 2601-2609 (2011).
- Baden, T., Berens, P., Franke, K., Román Rosón, M., Euler, T. The functional diversity of retinal ganglion cells in the mouse. Nature. 529, 345-350 (2016).
- Zhang, Y., et al. Fast and sensitive GCaMP calcium indicators for imaging neural populations. Nature. 615, 884-891 (2023).
- Meyer, E. L., Jenkins, C., Rengarajan, K. NIH Guidelines April 2019. Applied Biosafety. 24, (2019).
- Akerboom, J., et al. Optimization of a GCaMP calcium indicator for neural activity imaging. Journal of Neuroscience. 32 (40), 13819-13840 (2012).
- Chang, Y. -. C., Walston, S. T., Chow, R. H., Weiland, J. D. GCaMP expression in retinal ganglion cells characterized using a low-cost fundus imaging system. Journal of Neural Engineering. 14 (5), 056018 (2017).
- Weitz, A. C., et al. Improving the spatial resolution of epiretinal implants by increasing stimulus pulse duration. Science Translational Medicine. 7 (318), 1-12 (2015).
- Chang, Y. C., Ghaffari, D. H., Chow, R. H., Weiland, J. D. Stimulation strategies for selective activation of retinal ganglion cell soma and threshold reduction. Journal of Neural Engineering. 16 (2), 026017 (2019).
- Im, M., Fried, S. I. Temporal properties of network-mediated responses to repetitive stimuli are dependent upon retinal ganglion cell type. Journal of Neural Engineering. 13 (2), 025002 (2016).
- Jensen, R. J., Ziv, O. R., Rizzo, J. F. Thresholds for activation of rabbit retinal ganglion cells with relatively large, extracellular microelectrodes. Investigative Ophthalmology & Visual Science. 46 (4), 1486-1496 (2005).
- Ramos, M. S., et al. Patient-reported complications after intravitreal injection and their predictive factors. Ophthalmology Retina. 5 (7), 625-632 (2021).
- Vandenberghe, L. H., Auricchio, A. Novel adeno-associated viral vectors for retinal gene therapy. Gene Therapy. 19 (2), 162-168 (2012).
- Zin, E. A., Ozturk, B. E., Dalkara, D., Byrne, L. C. Developing new vectors for retinal gene therapy. Cold Spring Harbor Perspectives in Medicine. , a041291 (2023).
- Haggerty, D. L., Grecco, G. G., Reeves, K. C., Atwood, B. Adeno-associated viral vectors in neuroscience research. Molecular Therapy-Methods & Clinical Development. 17, 69-82 (2020).
- Hellström, M., et al. Cellular tropism and transduction properties of seven adeno-associated viral vector serotypes in adult retina after intravitreal injection. Gene Therapy. 16 (4), 521-532 (2009).
- Resendez, S. L., et al. Visualization of cortical, subcortical and deep brain neural circuit dynamics during naturalistic mammalian behavior with head-mounted microscopes and chronically implanted lenses. Nature Protocols. 11, 566-597 (2016).
- Yang, Y., et al. Improved calcium sensor GCaMP-X overcomes the calcium channel perturbations induced by the calmodulin in GCaMP. Nature Communications. 9, 1504 (2018).
- Nieuwenhuis, B., et al. Improving adeno-associated viral (AAV) vector-mediated transgene expression in retinal ganglion cells: comparison of five promoters. Gene Therapy. 30, 503-519 (2023).
- Cunquero, M., Aguilar, E., Loza-Alvarez, P., Planagumà, J. Hippocampal neuronal cultures to detect and study new pathogenic antibodies involved in autoimmune encephalitis. Journal of Visualized Experiments. 184, e63829 (2022).
- Behrend, M. R., Ahuja, A. K., Humayun, M. S., Chow, R. H., Weiland, J. D. Resolution of the epiretinal prosthesis is not limited by electrode size. IEEE Transactions on Neural Systems and Rehabilitation Engineering. 19 (4), 436-442 (2011).
- Grienberger, C., Konnerth, A. Imaging calcium in neurons. Neuron. 73 (5), 862-885 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved