רשתית מפוצלת כהכנה שטוחה משופרת לחקר נוירונים בשכבה גרעינית פנימית ברשתית בעלי חוליות
In This Article
Summary
עבודה זו מציגה תכשיר רשתית שטוח חלופי שבו הסרת גופי תאים קולטי אור מאפשרת פיזור נוגדנים מהיר יותר וגישה משופרת של פיפטת טלאי לנוירונים ברשתית הפנימית לצורך אימונוהיסטוכימיה, הכלאה באתרו וניסויים אלקטרופיזיולוגיים.
Abstract
תאים דו-קוטביים ותאים אופקיים ברשתית בעלי החוליות הם תאי העצב הראשונים שמעבדים מידע חזותי לאחר זיהוי פוטונים על-ידי פוטורצפטורים. הם מבצעים פעולות בסיסיות כגון התאמת אור, רגישות לניגודיות והתנגדות מרחבית וצבע. הבנה מלאה של המעגלים המדויקים והמנגנונים הביוכימיים השולטים בהתנהגותם תקדם את המחקר במדעי המוח החזותיים ואת רפואת העיניים. עם זאת, ההכנות הנוכחיות לבדיקת תאים דו-קוטביים ואופקיים (תושבות שלמות רשתית ופרוסות אנכיות) מוגבלות ביכולתן ללכוד את האנטומיה והפיזיולוגיה של תאים אלה. בעבודה זו, אנו מציגים שיטה להסרת גופי תאים קולטי אור מרשתיות עכבר חיות ושטוחות, המספקות גישה משופרת לתאים דו-קוטביים ואופקיים להידוק טלאים יעיל ותיוג חיסוני מהיר. רשתיות מפוצלות מוכנות על ידי כריכת רשתית עכבר מבודדת בין שתי חתיכות של ניטרוצלולוז, ואז מקלפים אותן בעדינות זו מזו. ההפרדה מפצלת את הרשתית ממש מעל שכבת הפרספקס החיצונית ומניבה שתי חתיכות של ניטרוצלולוז, אחת מכילה את גופי התא קולטני האור והשנייה מכילה את הרשתית הפנימית שנותרה. בניגוד לפרוסות רשתית אנכיות, הכנת הרשתית המפוצלת אינה קוטעת את התהליכים הדנדריטיים של נוירוני הרשתית הפנימיים, ומאפשרת הקלטות מתאים דו-קוטביים ואופקיים המשלבים את התרומות של רשתות מצומדות למרווחים ותאים אמקריניים רחבי שדה. עבודה זו מדגימה את הרבגוניות של הכנה זו לחקר תאים אופקיים ודו קוטביים באלקטרופיזיולוגיה, אימונוהיסטוכימיה וניסויי הכלאה באתרם .
Introduction
הרשתית היא רקמה עצבית דקה הממוקמת בעין האחורית שבה האור מיורט ומעובד לאות אלקטרוכימי שיכול להתפרש על ידי המוח. בחלק האחורי של הרשתית, photoreceptors מוט חרוט מגורה על ידי אור, אשר מפחית את קצב שחרור טוניק של נוירוטרנסמיטר, גלוטמט1. תאי העצב הראשונים שחווים ומגיבים לשינוי זה בריכוז הגלוטמט הנגרם על ידי האור הם התאים הדו-קוטביים (BCs) והתאים האופקיים (HCs), שהסומות שלהם שוכנות באזור החיצוני ביותר של השכבה הגרעינית הפנימית (INL). תאי עצב אלה מסדר שני מבצעים את השלב הראשון של עיבוד אותות ברשתית ומעצבים תכונות קריטיות של ראייה כגון הסתגלות לאור, רגישות לניגודיות והתנגדות מרחבית/צבע2. בעוד שפונקציות אלה יוחסו ל-BCs ול-HCs, המעגלים החשמליים והמנגנונים הביוכימיים שבבסיס תהליכים אלה אינם מובנים במלואם3. לכן, קידום כלים ושיטות לחקר הפיזיולוגיה של BC ו- HC הוא בעל חשיבות עליונה.
קטעי רשתית אנכיים (רוחביים) הוכיחו זה מכבר את המודל המעשי ביותר לחקר BCs ו- HCs; עם זאת, היבטים מסוימים של הפיזיולוגיה BC ו- HC אינם נגישים לנסיין תחת מודל זה. רישומים ישירים מHCs או מדידות עקיפות של השפעתם על BCs אינם משקפים את הקישוריות האנדוגנית של הרשתית מכיוון שהתהליכים הרוחביים של תאים אלה נקטעים במהלך החיתוך. תכשירי רשתית שלמים עוקפים בעיה זו על ידי שימור תהליכים רוחביים אלה, אך שכבות הרשתית שמסביב מציבות אתגר לגישה לתאים אלה4. אמנם יש דוגמאות רבות של immunostaining 5,6,7,8 והקלטות מהדק תיקון9 מנוירונים INL ברשתית הר שלם, יש הזדמנות לזרז ולפשט את איסוף הנתונים האלה. המגבלות המובנות של חתכים רוחביים והאתגרים של דגם ההר כולו היוו אפוא השראה לפיתוח תכשיר רשתית שטוח חלופי זה.
העבודה הבאה מתארת פרוטוקול להסרה קלה של שכבת קולטני האור מרשתיות חיות ושטוחות כדי לשפר את הגישה ל-BCs ול-HCs לקבלת הידוק טלאים פשוט יותר ותיוג חיסוני מהיר ויעיל יותר. קילוף שתי חתיכות של קרום ניטרוצלולוז המחוברות משני צדי הרשתית המבודדת קורע את הרקמה דרך אקסוני קולטני האור, ומותיר רשתית מפוצלת השומרת על שכבת הפרספקס החיצונית (OPL) ועל כל שכבות הרשתית הפנימיות. בעוד שאחרים תיארו פרוטוקולים להפרדה מכנית של שכבות הרשתית, שיטות אלה אינן מתאימות ליישומי הידוק טלאים ומיקרוסקופ או דורשות מניפולציה מייגעת של הרקמה. כמה משיטות אלה דורשות רקמות קפואות או ליופיליות להפרדת שכבות, מה שהופך אותן ללא תואמות לניסויים אלקטרופיזיולוגיים10,11,12. אחרים מיועדים לרקמה חיה, אך דורשים 5-15 קילופים עוקבים עם נייר סינון 4,11 או טיפול בטריפסין 13 כדי להסיר את הפוטורצפטורים. הטכניקה המתוארת כאן משפרת את קודמותיה על ידי פישוט הליך הסרת קולטני האור והרחבת הרפרטואר של יישומים במורד הזרם.
Protocol
עכברים קיבלו מים ומזון והוחזקו במחזור אור/חושך של 12 שעות. עכברים הומתו על ידי חשיפה לאיזופלורן ואחריה נקע צוואר הרחם. כל נהלי בעלי החיים היו בהתאם להנחיות המכונים הלאומיים לבריאות ואושרו על ידי ועדת הטיפול והשימוש המוסדית בבעלי חיים של אוניברסיטת אורגון לבריאות ומדע.
הערה: יש לבצע ניתוח עיניים, דיסקציה של הרשתית ופיצול הרשתית במהירות האפשרית כדי לשמור על בריאות הרקמה החיה. יש לשאוף להשלים את הדיסקציה תוך < 4 דקות לכל עין. שלושת השלבים הללו יבוצעו ברצף. עכברי בר: עכברים בוגרים (>3 חודשים) זכרים ונקבות C57BL/6J שימשו לניסויים. עבור מורפולוגיה של סינפסות, עכברים המבטאים חלבון פלואורסצנטי ירוק (GFP) תחת מקדם Pcp2 (Pcp2-cre/GFP)14 שימשו. עכברים טרנסגניים: להדמיית תאים אופקיים עם GFP במהלך ניסויים אימונוהיסטוכימיים או אלקטרופיזיולוגיים, נעשה שימוש בעכבר מהונדס משולש: vGATFLPo; vGlut2Cre; איי80ד. הזנים vGATFlpo ו-vGluT2Cre הם עכברים המבטאים Flpo או Cre recombinase במורד הזרם של המקדמים שלהם. עכבר Ai80d הוא עכבר כתב מצטלב (CatCh/EYFP) ויבטא רק רודופסין ערוץ חדיר Ca2+ (ChR2) בתאים המבטאים רקומבינזות Cre ו- Flpo. לפיכך, העכבר המהונדס המשולש מבטא ChR2 רק בתאים עם היסטוריה של ביטוי VGAT ו- vGluT2.
1. הכנת חומרים לדיסקציה של הרשתית ולפיצול הרשתית
- הכינו חתיכות של קרום ניטרוצלולוז
הערה: ניתוק הרשתית המפוצלת מקרום הניטרוצלולוז מפחית פלואורסצנטיות רקע במיקרוסקופ ומפשט את רישום מהדק הטלאי. הסרת ממברנה יכולה להתבצע לפני או אחרי קיבוע רקמות. עבור רשתיות מפוצלות קבועות, אין צורך לטפל בחתיכות של קרום nitrocellulose. עבור רשתית מפוצלת חיה, יש לטפל בקרום לפי שלבים 1.1.3 - 1.1.5 כדי להקל על ניתוק עדין מהרקמה.- חותכים 16 חתיכות (או יותר) של קרום ניטרוצלולוז לריבועים בגודל 5 מ"מ x 5 מ"מ. ניתן להכין תוספת בכמויות גדולות ולאחסן לשימוש עתידי.
- מניחים בצד מחצית מחתיכות הממברנה לשימוש מאוחר יותר. חלקים אלה לא יטופלו בתמיסת חסימה.
- יש לדגור על החלקים הנותרים בתמיסת חסימת IHC נטולת חומרי ניקוי (כגון סרום 3% לסוסים + 0.025% NaN3 מדולל ב-PBS) למשך 10 דקות בטמפרטורת החדר, תוך ניעור עדין.
אזהרה: יש להשתמש בציוד הגנה אישי מתאים בעת הטיפול ב-NaN3, שכן הוא רעלן רב עוצמה. - יש לשטוף היטב את חתיכות הממברנה על ידי דגירה במצע איימס חוצץ ביקרבונט במשך 10 דקות בטמפרטורת החדר, תוך ניעור עדין.
- יבש לחלוטין באוויר את חתיכות הקרום החסומות (~ 20 דקות). תייגו ואחסנו את חתיכות הממברנה בטמפרטורת החדר, תוך הפרדה בינן לבין חתיכות הממברנה הלא מטופלות.
- הכנת המדיה של איימס
- הכינו מדיית איימס חוצצת ביקרבונט ותשמרו על התמיסה בטמפרטורת החדר תחת קרבוגציה קבועה (95% O 2 ו-5% CO2).
2. שאיבת עין עכבר
- הרדימו את העכבר בכל שיטה זמינה בהתאם להנחיות IACUC המוסדיות.
- הפוך את העכבר לצד אחד והשתמש בשתי אצבעות כדי ללחוץ בעדינות סביב ארובת העין. זה יגרום לעין לבלוט החוצה מהגולגולת.
- בעזרת מספריים מעוקלים לדיסקציה, חותכים מתחת לעין הבולטת כדי לנתק את עצב הראייה ולהפריד את העין מהגולגולת.
- גרפו את העין עם מספריים והניחו אותה בצלחת פטרי מלאה במצע איימס קר כקרח.
הערה: עבור יישומים במורד הזרם שבהם הרקמה תתוקן לאחר פיצול, PBS קר כקרח ניתן להשתמש במקום מדיה איימס. - חזור על שלבים 2.1 - 2.4 עבור העין הנותרת.
3. דיסקציה ברשתית
- השתמשו בפיפטת העברת הזכוכית המותאמת אישית כדי להעביר עין אחת לצלחת פטרי חדשה המכילה מצע איימס טרי וקר כקרח.
הערה: הפתח הרחב של פיפטת ההעברה המותאמת אישית מונע מעיכה מקרית של הרקמה, ושימוש בזכוכית ממזער את ההיצמדות של הרקמה לדפנות הפיפטה. עם זאת, פיפטת העברת פלסטיק רחבת פה מקובלת גם אם הנסיין כבר מיומן בשימוש בכלי זה. - השתמשו במלקחיים כדי לייצב את העין על ידי הצמדת רקמת החיבור הנוספת שלה לתחתית צלחת הפטרי. לאחר מכן, נקבו את העין לאורך קו האורה-סראטה באמצעות מחט 25G כדי ליצור נקודת כניסה למספריים של Vannas.
- השתמשו במספריים של Vannas כדי לחתוך לאורך קו ה-ora serrata עד שהקרנית משתחררת משאר העין (איור משלים 1A). הסירו את העדשה מהעין באמצעות מלקחיים (איור משלים 1B).
- השתמש פיפטת זכוכית מותאמת אישית כדי להעביר את העין לנפח גדול (≥100 מ"ל) של איימס קרבוגני, וחזור על שלבים 3.1 - 3.3 עם העין הנותרת.
הערה: משקפיים ממוקמים לתוך איימס קרבוגנית כדי לשמור על בריאות הרקמה בעוד הדיסקציה מבוצעת על העין השנייה. - מעבירים עין אחת לצלחת פטרי מלאה באיימס קרבוגני.
- בעזרת מספריים של Vannas, בצעו חיתוך קטן פנימה מקצה הסקלרה, ואז השתמשו בשני זוגות מלקחיים כדי לקלף את לובן העין מהרשתית (איור משלים 1C). הימנעו מתפיסת הרשתית עם המלקחיים. במקום זאת, פרקו את דשי לובן העין שנוצר על ידי חיתוך המספריים.
- השתמשו במספריים של Vannas כדי לחתוך את עצב הראייה המחבר בין לובן העין לרשתית (איור משלים 1D), ואז עקרו בעדינות את הרשתית מלובן העין באמצעות מספריים או מלקחיים כדי לבודד את הרשתית. (איור 1A).
הערה: בעוד שה-RPE יישאר בדרך כלל מחובר למשקוף העין, אין צורך בצעדים נוספים כדי להסיר את ה-RPE במקרה שהוא מחובר לרשתית. בנקודה זו, ניתן לקצץ את קצוות הרשתית באופן אופציונלי עם אזמל כדי למנוע סלסול במהלך שלב ההשטחה (איור 1B). - השתמשו באזמל כדי לחתוך את הרשתית לחצאים או לרבעים (איור 1C), ואז השתמשו בפיפטת ההעברה המותאמת אישית כדי להחזיר את החתיכות לנפח גדול (≥ 100 מ"ל) של מדיית איימס קרבוגנית ברציפות.
הערה: הבחירה של חצאים או רבעים היא סובייקטיבית. בחר את האפשרות הטובה ביותר עבור היישום הרצוי. - חזור על שלבים 3.5 - 3.8 עבור העין הנותרת לפני שתמשיך לפיצול הרשתית.
4. פיצול רשתית
- השליכו את מדיית איימס מצלחות הפטרי והחליפו אותה באיימס קרבוגנית טרייה.
הערה: כדי לשמור על קרבוגניזציה לאורך שארית הליך פיצול הרשתית, החליפו את המדיה בצלחת הפטרי באיימס קרבוגנית טרייה בערך כל 5 דקות. - בעזרת פיפטת ההעברה המותאמת אישית, הניחו חתיכת רשתית על מגלשת זכוכית (7.5 ס"מ x 5 ס"מ), הצמידו את תא הגנגליון כלפי מעלה, ואז שטחו אותה על-ידי הסרת הנוזל שמסביב באמצעות מגבון משימה עדין (איור 1D). במידת הצורך, משכו בעדינות את קצוות הרשתית בעזרת מברשת צבע עדינה תחת מיקרוסקופ דיסקציה.
- השתמשו במלקחיים כדי להוריד חתיכה יבשה בגודל 5 מ"מ x 5 מ"מ של קרום ניטרוצלולוז אל הרשתית, מה שגורם לה להיצמד לצד תא הגנגליון (איור 1E).
הערה: אם נדרשת הסרת קרום מרקמה חיה (כלומר, לצורך אלקטרופיזיולוגיה), השתמש בחתיכה יבשה של קרום שטופלה בסרום לשלב זה (ראה שלבים 1.1.3 - 1.1.5 לקבלת פרטים). זה מפחית את חוזק ההיצמדות לשכבת תאי הגנגליון, מה שמקל על הסרת הרשתית מהניטרוצלולוז לאחר הפיצול. - הפכו את הרשתית כך שהניטרוצלולוז מונח על מגלשת הזכוכית והניחו חתיכה יבשה של קרום בגודל 5 מ"מ x 5 מ"מ על הצד הפוטורצפטור של הרשתית (איור 1F).
- געו בקצה הרטוב של המכחול ברווח שבין שני הקרומים ואפשרו לפעולה נימית למצוץ את האיימס לתוך הכריך (איור 1G). זה מפחית את היצמדות הקרומים לרשתית והוא הכרחי רק אם הרשתית יובשה יתר על המידה עם ניגוב המשימה העדין.
הערה: אם הרשתית איבדה את המראה המבריק שלה, היא התייבשה יתר על המידה, ושלב 4.5 הוא הכרחי. - כדי להבטיח היצמדות אחידה, הפעילו לחץ קל כלפי מטה על הממברנה העליונה בעזרת מברשת צבע רטובה (איור 1H).
- בעת הצמדת הקרום התחתון לזכוכית עם זוג מלקחיים אחד, השתמש בתנועה איטית ויציבה כדי לקלף בעדינות את הקרום העליון עם זוג מלקחיים שני. זה יגרום לרשתית להתפצל ממש מעל ה-OPL (איור 1I).
- השליכו את הממברנה העליונה שמכילה את הפוטורצפטורים (איור 1J, משמאל). הקרום התחתון מכיל את הרשתית הפנימית, שתיקרא מעתה רשתית מפוצלת (איור 1J, מימין).
- להחזיר מיד את הרשתית המפוצלת למדיה איימס קרבוגנית.
הערה: עבור ניסויים על רקמות חיות, רשתית עשויה להפיק תועלת מתקופת התאוששות של 15-30 דקות באיימס קרבוגנית לאחר פיצול.

איור 1: הליך פיצול הרשתית. (A) לאחר שאיבה והכנת משקפיים במדיה קרה של PBS או איימס, בודדו את רשתית העכבר מכוס העין והחליפו את ה-PBS במדיית איימס קרבוגנית בטמפרטורת החדר. (B) בעזרת אזמל, חתכו את קצוות הרשתית עד שלא יהיו אזורים עם תלתל פנימי (אופציונלי). (C) חתכו את הרשתית לרבעים או לחצאים בעזרת אזמל. (D) הניחו פיסה אחת של רשתית על מגלשת זכוכית (צד תא גנגליון כלפי מעלה) באמצעות פיפטת העברה מותאמת אישית והסירו את כל עודפי הרשתית באמצעות מגבון משימה עדין. ודא שהרשתית החצי יבשה מונחת שטוחה על הזכוכית לפני שתמשיך לשלב הבא. השתמש בקצה מברשת צבע רטובה של איימס כדי לפתוח בעדינות אזורים ברשתית שאינם שטוחים. (E) בעזרת מלקחיים, הניחו חתיכה חתוכה מראש של קרום ניטרוצלולוז יבש (5 מ"מ x 5 מ"מ) על הרשתית השטוחה. (F) הפוך את פיסת הניטרוצלולוז כך שהצד הפוטורצפטור של הרשתית פונה כעת כלפי מעלה. לאחר מכן הניחו חתיכה יבשה נוספת של קרום על הרשתית. (G) געו בקצה הרטוב של המברשת ברווח שבין שני הקרומים ואפשרו לפעולה נימית למצוץ את האיימס לתוך הכריך. זה מפחית את היצמדות הקרומים לרשתית והוא הכרחי רק אם הרשתית יובשה יתר על המידה עם ניגוב המשימה העדין. (H) השתמשו בקצה מברשת צבע רטובה כדי ללחוץ בעדינות כלפי מטה על מרכז הרשתית הדחוסה. (I) השתמש בזוג מלקחיים אחד כדי להצמיד את החלק התחתון של הממברנה למגלשת הזכוכית, תוך שימוש בזוג מלקחיים אחר כדי לקלף בעדינות את החלק העליון של הממברנה הרחק מהתחתון. (J) הרשתית הפנימית (משמאל) נשארת על הממברנה התחתונה בעוד שהפוטורצפטורים (מימין) נמשכים משם עם הקרום העליון. לוחות (A), (B), (C), (D) ו-(J) נרכשו באמצעות מיקרוסקופ דיסקציה; סרגל קנה המידה מייצג כ -1 מ"מ; פאנלים (E-I) נרכשו עם מצלמת סמארטפון ללא הגדלה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
5. הכנת רשתית מפוצלת לניסויי אימונופלואורסנציה
הערה: הרשתית המפוצלת עדיין תהיה מחוברת לקרום הניטרוצלולוז עד שלב 5.5. השלימו את כל השלבים 5.1, 5.2, 5.3 או 5.4, לא את כל הארבעה, שכן אלה מיועדים לניסויים שונים.
אזהרה: יש להשתמש בציוד הגנה אישי מתאים ולהמשיך בזהירות בעת הטיפול בפרפורמלדהיד (מקבע).
- הכנה לאימונופלואורסנציה שטוחה
- יש לדגור על הרשתית המפוצלת ב-4% פרפורמלדהיד על קרח למשך 30 דקות תוך שימוש בתמיסה המספיקה לכיסוי מלא של הרשתית.
- שטפו את הרשתיות המפוצלות 3x ב-5-10 מ"ל PBS בטמפרטורת החדר. הפסקה אופציונלית: ניתן להשאיר רשתיות מפוצלות ב-PBS בטמפרטורה של 4°C למשך עד 24 שעות.
- הכנה immunofluorescence עם חלקים אנכיים של רשתית מפוצלת
- יש לדגור על הרשתית המפוצלת ב-4% פרפורמלדהיד על קרח למשך 30 דקות תוך שימוש בתמיסה המספיקה לכיסוי מלא של הרשתית.
- שטפו את הרשתיות המפוצלות 3x ב-5-10 מ"ל PBS בטמפרטורת החדר. הפסקה אופציונלית: ניתן להשאיר רשתיות מפוצלות ב-PBS בטמפרטורה של 4°C למשך עד 24 שעות.
- כאשר הממברנה עדיין מחוברת, לטבול ברצף את הרשתית המפוצלת ב -10%, 20% ו -30% סוכרוז ב -4 מעלות צלזיוס למשך שעה אחת כל אחד כדי להגן על הרקמה בהקפאה.
- הטמע את הרשתיות המפוצלות המוגנות בהקפאה בתרכובת טמפרטורת חיתוך אופטימלית (O.C.T.) ואחסן אותן בטמפרטורה של -80°C (עד 6 חודשים) עד להקפאה.
- הסר את הרשתיות המפוצלות המוטבעות מ- -80°C והשתמש בהקפאה כדי לחתוך מקטעים בעובי 20 מיקרומטר. הרכיבו את החלקים על שקופיות מיקרוסקופ זכוכית טעונות אלקטרוסטטית, אפשרו להם להתייבש באוויר ולאחר מכן אחסנו אותם בטמפרטורה של -20°C למשך עד 6 חודשים.
- הכנה להכלאה פלואורסצנטית כפולה באתרו ואימונוהיסטוכימיה
- יש לדגור על הרשתית המפוצלת ב-4% פרפורמלדהיד על קרח למשך שעתיים תוך שימוש בתמיסה המספיקה לכיסוי מלא של הרשתית.
- שטפו את הרשתיות המפוצלות 3x ב-5-10 מ"ל PBS בטמפרטורת החדר. הפסקה אופציונלית: ניתן להשאיר רשתיות מפוצלות ב-PBS בטמפרטורה של 4°C למשך עד 24 שעות.
- הכנה לאלקטרופיזיולוגיה
- הכינו פיפטות טלאי על ידי משיכת פיפטות זכוכית בורוסיליקט עבות דופן עם חוט להט באמצעות מושך מיקרופיפטה. השתמש רק פיפטות עם התנגדות מדודה בין 6-10 MΩ.
- מילוי אחורי של פיפטות שנמשכו בתמיסה פנימית המכילה (ב-mM): 125 K-gluconate, 8 KCl, 5 HEPES, 1 MgCl 2, 1 CaCl 2,0.2 EGTA, 3 ATP-Mg ו-0.5 GTP-Na.
- הסרת הרשתית המפוצלת מקרום הניטרוצלולוז
- בעזרת עט מחסום הידרופובי, הכינו בארות עגולות על מגלשת מיקרוסקופ (~ 1 ס"מ קוטר) ואפשרו להן להתייבש באוויר במשך 5-10 דקות.
- הניחו את הרשתיות המפוצלות בתוך בארות עט מחסום הידרופוביות מוכנות והוסיפו מספיק PBS כדי לכסות אותן לחלוטין.
- תחת מיקרוסקופ דיסקציה, דחפו את הזיפים של מברשת צבע עדינה מתחת לשולי הרקמה והרימו בעדינות כלפי מעלה. באופן זה, עבדו סביב הרשתית במעגל כדי להרים אותה הרחק מהממברנה.
- השתמש במלקחיים כדי להסיר את הקרום מתחת לחתיכה צפה של הרשתית.
- בזהירות לשאוף משם את PBS הנותרים כך חתיכת הרשתית מגיע לנוח על שקופיות המיקרוסקופ, תא גנגליון בצד למטה.
הערה: אין לבצע את השלבים הבאים ברצף. בחר את הפרוטוקול המתאים ליישום הרצוי (כלומר, אימונוסטיין או הכלאה פלואורסצנטית כפולה באתרו [FISH] ואימונוהיסטוכימיה [IHC] או אלקטרופיזיולוגיה).
6. Immunostaining
- אם עדיין לא מוכן, השתמש בעט מחסום הידרופובי כדי ליצור בארות עגולות על מגלשת מיקרוסקופ (~ 1 ס"מ קוטר) ולאפשר להם להתייבש באוויר במשך 5-10 דקות. כל שלבי הדגירה ושלבי השטיפה יבוצעו בתוך בארות עט אלה.
- יש לדגור על הרשתית המפוצלת או על מקטעי הרשתית המפוצלת האנכית בתמיסת דגירה של נוגדנים (AIS: 3% נסיוב סוסים, 0.5% Triton X-100, 0.025% NaN3 ב-PBS) למשך 30 דקות בטמפרטורת החדר.
- לדגור על הרשתית המפוצלת או על חלקי הרשתית המפוצלת האנכית עם נוגדנים ראשוניים מדוללים ב-AIS למשך שעה אחת בטמפרטורת החדר.
הערה: זמן הדגירה הראשוני של נוגדנים ידרוש אופטימיזציה עבור מטרות חלבון ונוגדנים שונים. - לשטוף את הרקמה 3x בטמפרטורת החדר PBS.
- לדגור את הרקמה עם נוגדנים משניים מדוללים AIS במשך 1 שעה בטמפרטורת החדר. לשטוף את הרקמה 3x בטמפרטורת החדר PBS.
- אם רוצים צביעה גרעינית, דוגרים על הרקמה עם DAPI מדולל ב-PBS במשך 30 שניות בטמפרטורת החדר. לשטוף את הרקמה 1x בטמפרטורת החדר PBS.
- החל טיפה של מדיה הרכבה שקופיות על כל פיסת רקמה ולהרכיב כיסוי זכוכית.
- יש למרוח לק סביב קצוות הכיסוי כדי לאטום את הדגימה. אחסן את השקופית ב- 4 °C.
7. Dual FISH ו-IHC
- אופים את הרשתיות המפוצלות בחום של 18 מעלות במשך 30 דקות בתנור הכלאה כדי להגביר את ההיצמדות למגלשה.
- מלא את פרוטוקול RNAscope FISH בהתאם לפרוטוקול היצרן עם החריגים והשינויים הבאים:
- אין צורך בשלב שליפת אנטיגן. יש להשתמש בפרוטאז III עם זמן דגירה של 18 דקות בטמפרטורת החדר.
- בצע את כל שלבי השטיפה במגלשה בתוך הבארות שנעשו על ידי עט מחסום הידרופובי.
- יש לדגור על הדגימות בנוגדנים ראשוניים מדוללים (ראו טבלת חומרים) ב-PBS למשך 30 דקות בטמפרטורה של 40°C בתנור ההכלאה. שטפו את הדגימות 3x בטמפרטורת החדר PBS.
- יש לדגור על הדגימות בנוגדנים משניים מדוללים (ראו טבלת חומרים) ב-PBS למשך 30 דקות ב-40°C בתנור ההכלאה. שטפו את הדגימות 3x בטמפרטורת החדר PBS.
- יש לדגור על הדגימות ב-1x DAPI למשך 30 שניות בטמפרטורת החדר. שטפו את הדגימות 1x בטמפרטורת החדר PBS.
- יש למרוח טיפה של אמצעי הרכבה נגד דהייה על כל פיסת רקמה ולהרכיב כיסוי זכוכית.
- יש למרוח לק סביב קצוות הכיסוי כדי לאטום את הדגימה. אחסן את השקופית ב- 4 °C.
8. אלקטרופיזיולוגיה
- לאחר הסרת קרום הניטרוצלולוז, העבירו רשתית מפוצלת לתא ההקלטה מהדק טלאי ועגנו אותה בעדינות למקומה עם נבל פלטינה.
- במהלך הניסוי, יש לחורר ללא הרף את הרשתית המפוצלת באמצעות תמיסת איימס המכילה קרבוגניות של 95% O2 ו-5%CO2. שמור על התמיסה בין 32-34 מעלות צלזיוס.
הערה: במהלך הניסוי, ניתן להמחיש את הרקמה באמצעות מיקרוסקופ ניגודיות הדרגתי Dodt. - תחת תאורת החדר, בצע הידוק מתח של כל התא כדי להקליט מנוירוני INL.
- בזמן ההקלטה, דמו תגובות אור באמצעות יחידת הזרקה מיקרו-תאית כדי ליישם תרכובות פרמצבטיות, או LED של 470 ננומטר כדי לעורר צ'אנלרודופסין (ChR2).
הערה: ניתן למדוד את עוצמת האור באמצעות מד הספק אופטי דיגיטלי.
- בזמן ההקלטה, דמו תגובות אור באמצעות יחידת הזרקה מיקרו-תאית כדי ליישם תרכובות פרמצבטיות, או LED של 470 ננומטר כדי לעורר צ'אנלרודופסין (ChR2).
9. מיקרוסקופ קונפוקלי
- עבור immunofluorescence confocal, צלם תמונות עם מיקרוסקופ קונפוקלי באמצעות מטרה טבילת שמן 40x/1.3 או 63x/1.40. השתמשו ב-FIJI כדי להתאים את הבהירות והניגודיות וליצור הקרנות Z מאוספי תמונות.
תוצאות
פיצול רשתית משמר הדקי קולטני אור
כדי לוודא שפיצול הרשתית אינו פוגע בדנדריטים של נוירונים מסדר שני ב-OPL, חלקים אנכיים של רשתית מפוצלת הוכתמו בנוגדנים כנגד חלבון השלפוחית הסינפטי סינפטופיזין (ירוק), וחלבון קינאז C אלפא (PKCα; אדום). הרצועה האינטנסיבית של תיוג סינפטופיזין לאורך החלק העליון של הרשתית המפוצלת מצביעה על כך שהטרמינלים הסינפטיים של קולטני האור נשמרים (איור 2). יתר על כן, צביעת PKCα חושפת מורפולוגיה נורמלית של תאים דו קוטביים מוט (RBCs). לא נראים גרעיני קולטני אור, מה שמצביע על כך שהרשתית מפוצלת בין ה-OPL לבין השורה הפנימית ביותר של גופי תאים קולטי אור (איור 2).
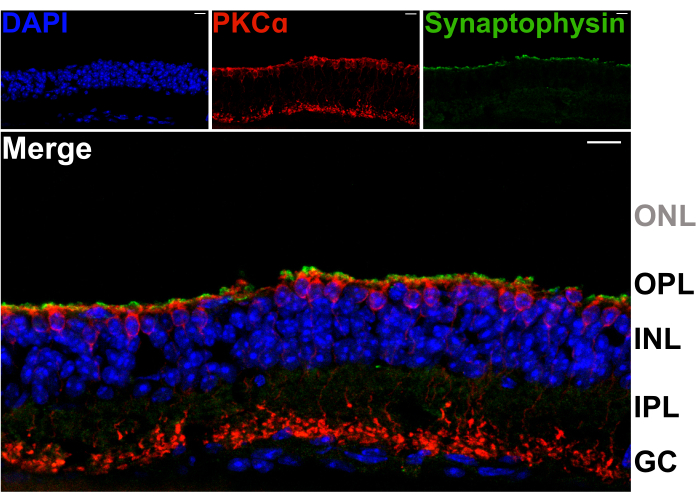
איור 2: רשתיות מפוצלות שומרות על הדקי קולטני אור. מיקרוגרפים קונפוקליים פלואורסצנטיים המראים חתך אנכי של רשתית יריקה שהוקפאה (עובי 20 מיקרומטר) לאחר הליך הפיצול. כל תמונה היא הקרנה מקסימלית של ערימת z קונפוקלית. החלק היה מסומן עם נוגדנים נגד PKCα (מרכז עליון) וסינפטופיזין (למעלה מימין) כדי להמחיש RBCs ושלפוחיות סינפטיות, בהתאמה. התמונה הממוזגת (למטה) מראה שלפוחיות סינפטיות (ירוק), השוכנות בהדקי הפוטורצפטור, ממש מעל התהליכים האפיקליים של RBCs (אדום) ב- OPL. גרעיני התא מסומנים ב-DAPI (כחול). אין גרעיני קולטני אור נראים בתוך ONL. קיצורים: ONL = שכבה גרעינית חיצונית; OPL = שכבת פרספקס חיצונית; INL = שכבה גרעינית פנימית; IPL = שכבת פרספקס פנימית; GC = תאי גנגליון. פסי קנה מידה = 10 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
מורפולוגיה של סינפסה ב-OPL נשמרת לאחר פיצול הרשתית
באמצעות עכבר המבטא GFP ב-RBCs תחת מקדם pcp2, 14 חלבונים קדם-סינפטיים ופוסט-סינפטיים ב-OPL סומנו כחיסוניים כדי להעריך את שלמות השכבה הסינפטית הזו לאחר פיצול14. למרות כוחות הגזירה המתרחשים דרך האקסונים של הפוטורצפטורים, פיצול אינו מפריע למורפולוגיה של סינפסות פוטורצפטור BC ב-OPL, כפי שנצפה מיקום נורמלי של דנדריטים של RBC, המסומנים עבור RGS11, וסרטים סינפטיים של קולטני אור, המסומנים עבור CtBP215 (איור 3). עבור כל מגע סינפטי בין מוטות ו-RBC, RGS11 יכול להיראות כפונקטה אדומה הנמצאת בתוך צורת הפרסה של הסרטים הסינפטיים (ירוק). בניסוי מאוחר יותר, נעשה שימוש בנוגדן אנטי-GPR179 16 כדי לסמן את הקצוות הדנדריטיים הפוסט-סינפטיים ON-BC16, ונוגדן אנטי-PSD-95 שימש לסימון הדקים של קולטי אור מוט קדם-סינפטיים (איור משלים 2). תוצאות אלה מאשרות שוב את יציבות ה-OPL בהכנת הרשתית המפוצלת, שכן דנדריטים של RBC נראים קשורים קשר הדוק עם שותפתם הקדם-סינפטית, הדקי המוטות.
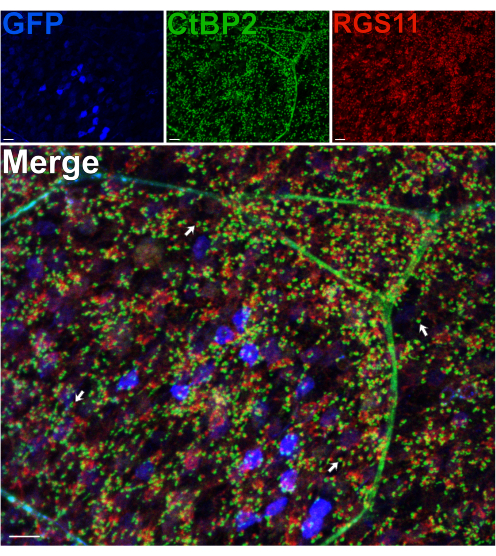
איור 3: מורפולוגיית סינפסה ב-OPL נשמרת לאחר פיצול הרשתית. תמונות אימונופלואורסנציה קונפוקלית של רשתית מפוצלת מעכבר מהונדס המבטאת GFP ב- RBCs תחת מקדם Pcp2. רמות ביטוי GFP (כחול) משתנות בין RBCs ברשתית. לאחר הפיצול, הרשתית תוקנה, ולאחר מכן הודגרה עם נוגדנים נגד CtBP2 (ירוק) ו- RGS11 (אדום) כדי לתייג סרטים סינפטיים קולטי אור וקצוות דנדריטיים ON-BC, בהתאמה. כל זוג אדום-ירוק מייצג מגע סינפטי בין מוט לבין ON-BC. פסי קנה מידה = 10 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
פיצול רשתית שומר על כדאיות RBC
כדי להעריך את הכדאיות של תאי העצב ברשתית הפנימית לאחר פיצול, נעשה שימוש בצבע גרעיני בלתי חדיר וקרוב לאינפרא אדום (MI-NIR), המאפשר זיהוי של תאים מתים. לאחר הדגירה עם MI-NIR, רשתיות מפוצלות תוקנו, ולאחר מכן תויגו עם anti-PKCα כדי לזהות RBCs. מיקרוגרפים קונפוקליים של הרשתית המפוצלת חושפים שונות אזורית בכדאיות התא על פני הרקמה, כאשר אזורים מסוימים חווים שיעורים גבוהים יותר של מוות תאי מאחרים. שונות זו עשויה לנבוע מנזק שנגרם לאזורים מסוימים ברשתית במהלך הליכי הנתיחה, הפיצול או הטיפול (איור 4). בהתחשב בכך שגופי התאים של RBCs שוכנים באזור החיצוני ביותר של ה-INL, קרוב לאתר הפיצול, הייתה הצדקה להערכה זהירה של יכולת הקיום שלהם. קו-לוקליזציה נדירה של PKCα ו-MI-NIR אישרה שרוב RBCs נשארים בני קיימא לאחר פיצול הרשתית (איור 4).
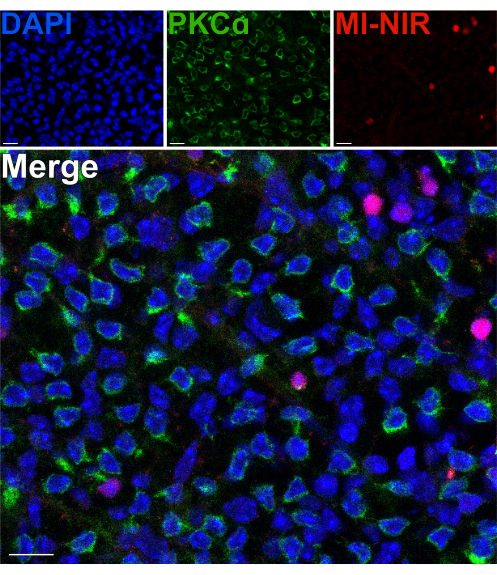
איור 4: תאים דו-קוטביים של מוטות הם בני קיימא לאחר פיצול הרשתית. מיקרוגרפים קונפוקליים פלואורסצנטיים המראים אזור של רשתית מפוצלת בפרספקטיבה שטוחה. לאחר הפיצול, הרשתית החיה הודגרה בצבע MI-NIR (אדום) למשך 30 דקות בטמפרטורה של 37°C. הרשתית תוקנה לאחר מכן ותויגה חיסונית עם נוגדנים נגד PKCα כדי לדמיין RBCs. באזור זה של הרשתית, colocalization של PKCα ו MI-NIR הוא נדיר. MI-NIR מבצע לוקליזציה עם גרעינים (כחולים) שאינם שייכים ל-RBCs. קיצורים: MI-NIR = ממברנה בלתי חדירה NIR כתם חי/מת. פסי קנה מידה = 10 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
רשתיות מפוצלות מקובלות על FISH כפול ו- IHC
על ידי הארכת זמן הקיבוע עבור IHC סטנדרטי, רשתיות מפוצלות יכולות להיות מעובדות ברצף על ידי FISH ו- IHC כדי לסמן mRNA וחלבונים בו זמנית17,18. ניסויים אישרו כי קיבוע של שעתיים בפרפורמלדהיד 4% מניב תיוג mRNA חזק תוך שמירה על אפיטופים חלבוניים לקשירת נוגדנים. FISH בוצע על רשתית מפוצלת ואחריה IHC כדי להמחיש את הביטוי של תת-היחידה לקולטן GABAA δ (GABRD; anti-sense mRNA probes) ביחס למיקום של RBCs (נוגדן אנטי-PKCα) ב-INL החיצוני (איור 5A). ביטוי GABRD mRNA נראה נדיר ב-RBCs (איור 5A); אולם התעתיק מבוטא בשפע על-ידי תאים אמקריניים ותאי גנגליון כפי שמעידה תבנית התיוג על חתכים רוחביים מרשתית שלמה (איור 5B). ב-INL החיצוני (איור 5A), ה-mRNA של GABRD מפוזר באופן שווה יותר בהשוואה ל-INL הפנימי (איור 5C), שם הוא מרוכז בתאים נפרדים. גשושיות אנטיסנס המכוונות לתת-יחידות קולטן GABA אחרות מייצרות דפוסי תיוג ברורים, המדגימים את הספציפיות של הגשושיות (הנתונים אינם מוצגים).
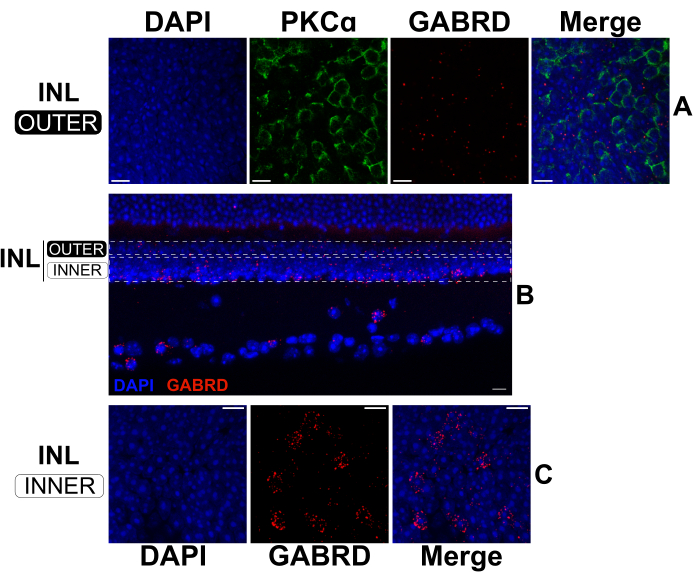
איור 5: FISH כפול ו-IHC ברשתית מפוצלת וברשתית שלמה. (A, C) מיקרוגרפים קונפוקליים של רשתית מפוצלת שטוחה ו-(B) קטע אנכי מרשתית שלמה. תמונות ב- (A) ו- (C) הן הקרנות מרביות של מקטעים אופטיים באזורים העליונים והתחתונים של INL בהתאמה. המלבנים המנוקדים ב- (B) מייצגים את הגבולות המשוערים המשמשים ליצירת ההקרנות המוצגות ב- (A) ו- (C). הרשתית המפוצלת (A, C) הייתה קבועה למשך 2 שעות, ואז סומנה עם בדיקות mRNA אנטיסנס כנגד GABRD (אדום). לאחר מכן, הרשתית המפוצלת הוכתמה בנוגדנים נגד PKCα כדי לסמן RBCs (ירוק). ערוץ PKCα הושמט מהקרנות של ה-INL התחתון לצורך בהירות. הרשתית השלמה ב-(B) הייתה קבועה למשך 24 שעות לפני החיתוך. לאחר מכן, הרשתית הקבועה סומנה עם בדיקות mRNA אנטיסנס נגד GABRD (אדום). כל הדגימות היו מוכתמות ב- DAPI (כחול) במשך 20 שניות לפני הרכבת הכיסוי. קיצורים: INL = שכבה גרעינית פנימית. פסי קנה מידה = 10 מיקרומטר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
רשתיות מפוצלות מתאימות היטב לרישום אלקטרופיזיולוגי מהדק טלאי מ- BCs ו- HCs
כדי לתקן סומא BC או HC ברשתית מסורתית שלמה, הפיפטה חייבת להתקרב מצד תא הגנגליון או מצד הפוטורצפטור. שתי הגישות דורשות חציית מספר שכבות רשתית כדי להגיע ל-INL, שבמהלכו קצה הפיפטה נחסם לעיתים קרובות על ידי פסולת. בהכנת פרוסת ויברטום, הסומות BC ו- HC נגישות בקלות, אך התהליכים הדנדריטיים שלהן עלולים להיקטע ולשבש את הקשרים הרוחביים שלהן. ברשתיות מפוצלות, לעומת זאת, גופי התאים של RBCs ו- HCs יושבים על פני השטח של הרקמה, ומספקים גישה משופרת מאוד לפיפטות טלאי תוך שמירה על המעגלים הרוחביים של OPL.
איור 6 מראה תגובות אור מדומות כימית שתועדו מ-BCs ברשתית מפוצלת. למדיום איימס המחורר נוסף L-AP4 (4 μM), אגוניסט mGluR מקבוצה III, כדי לדמות שחרור גלוטמט מפוטורצפטורים בחושך. אנטגוניסט mGluR6, CPPG (600 מיקרומטר, באיימס), נשף על הדנדריטים של התא המתוקן (מוחזק ב -60 mV) כדי לדמות הבזק אור באמצעות עיכוב של mGluR6. תאים הגיבו לנשיפות CPPG עם שני סוגים של זרמים פנימיים. סוג אחד מראה זרם חולף ואחריו מישור (איור 6A), בדומה לזרמים הקנוניים מעוררי האור שתועדו מ-RBCs בפרוסות רשתית19. הסוג השני נשאר מתמשך לאורך כל משך הנשיפה (איור 6B), בדומה לזרמים שתועדו מתאים דו-קוטביים של חרוט ON (ON-CBC)19.
ניסוי נפרד בוצע כדי להתמקד HCs, סוג תא עם שדה דנדריטי רחב כי לעתים קרובות קשה לשמר בהכנות פרוסה. קו עכבר המבטא רודופסין ערוץ (ChR2) ו- GFP ב- HCs שימש כדי להקל על זיהוי תחת מיקרוסקופ פלואורסצנטי. ראשית, זרמים מ-HCs תועדו בתגובה לסדרה של צעדי דה-פולריזציה (-100 mV עד 50 mV, גודל צעד = 15 mV) שאליהם הם הגיבו עם זרמים פנימיים ואחריו זרמים חיצוניים (איור 6C). התאים האלה עוררו באמצעות פולס קצר של אור כחול (200 מילישניות, 470 ננומטר) שיצר זרמים פנימיים גדולים המונעים על-ידי ChR2 בשני תאים (איור 6D).
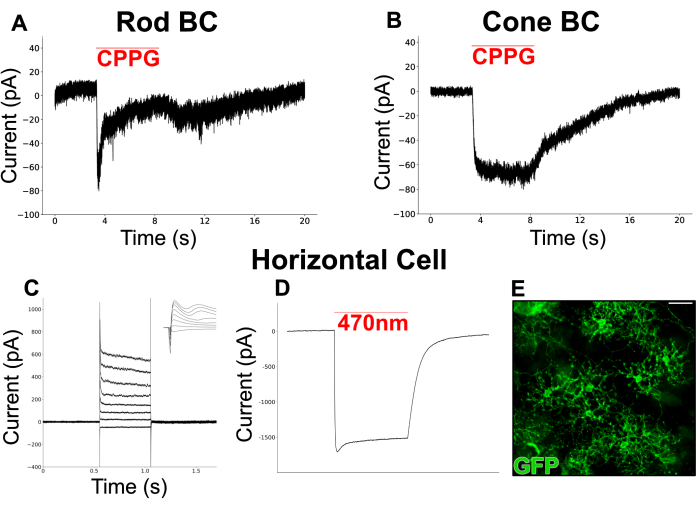
איור 6: הקלטות מהדק טלאי מתאי עצב INL ברשתית מפוצלת. (A) RBC משוער ו-(B) CBC הודקו במתח של -60 mV במדיית איימס מחוררת שהכילה L-AP4 (4 מיקרומטר). התנפחות CPPG (600 מיקרומטר) על הדנדריטים של התאים המהודקים עוררה זרם פנימי שהיה חולף ב-RBC אך נמשך ב-CBC. הקלטת RBC ב-(A) היא עקבה בודדת ואילו הקלטת CBC ב-(B) מייצגת ממוצע של 3 עקבות. (C) הקלטת מהדק טלאי מ-HC ב-vGATFLPo; vGlut2Cre; עכבר Ai80d. הקו האדום מראה את משך הזמן של פולס אור של 200 מילישניות, 470 ננומטר, המשמש להפעלת הזרם הגדול פנימה דרך ChR2. (D) הוזרק תגובות זרם מהידרוכלוריד שהיה מתוח ב-60 mV-, ואז צעד בין -70 mV ל-+35 mV במרווחים של 15 mV וחזר ל-60- mV. הכניסה מראה את אותם עקבות בחלון של 6 אלפיות השנייה המקיף את תחילת שלב המתח. (E) מיקרוגרף אימונופלואורסצנטי של רשתית מפוצלת שטוחה המראה תאים אופקיים המבטאים GFP ב-vGATFLPo; vGlut2Cre; עכבר Ai80d. סרגל קנה מידה = 20 מיקרומטר. הנתונים האלקטרופיזיולוגיים נאספו בקצב דגימה של 20 קילוהרץ וסוננו באמצעות מסנן בסל בעל מעבר נמוך ב-5 קילוהרץ. לאחר מכן יוצאו נתונים, והדמיה וניתוח לא מקוונים בוצעו באמצעות Python 3. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
פיצול הרשתית מאפשר חקירה מהירה של אנטומיה של INL ו-OPL
הממברנה המגבילה החיצונית של הרשתית (ELM) וה-ONL מהווים מחסום בעובי ~90 מיקרומטר, המעכב את דיפוזיית הנוגדנים לרשתית הפנימית ויוצר תנאי אימונוסטיין תת-אופטימליים20,21,22. לכן, מטרות תיוג חיסוני ב- OPL או INL באמצעות רשתית שטוחה קונבנציונלית דורשות פרוטוקולי צביעה עתירי זמן המחייבים לעתים קרובות דגירות נוגדנים 5,6,7,8,20,22 שעות.
הסרת הפוטורצפטורים מאפשרת חדירה מהירה של נוגדנים של נוירונים ברשתית הפנימית. כתוצאה מכך, ניתן להשיג תיוג של מטרות חלבון ברשתית הפנימית תוך שעה אחת בלבד באמצעות שימוש בנוגדנים ראשוניים מצומדים. נוגדנים נגד PKCα ו-Calbindin-D שימשו לסימון RBCs ו-HCs של ה-INL בהתאמה (איור 7). שלא כמו מקטעי רשתית אנכית מסורתיים שחותכים את התהליכים הרוחביים של תאי עצב רחבי שדה, הכנת הרשתית המפוצלת מאפשרת הדמיה של הסוכה הדנדריטית המלאה של תאים רחבי שדה כמו HCs (איור 6E, איור 7).
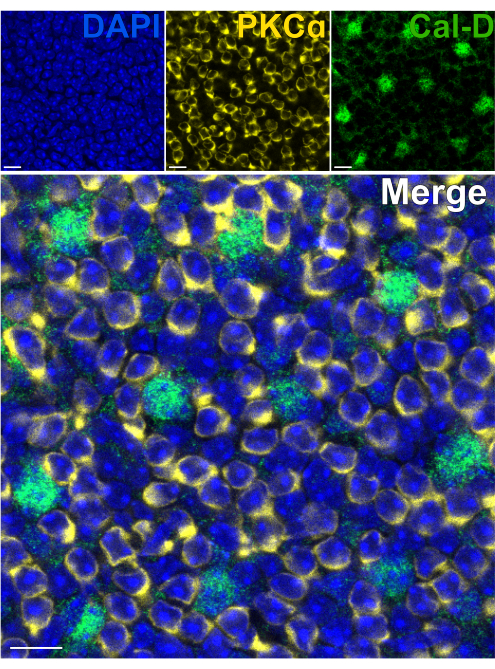
איור 7: תיוג חיסוני מהיר של חלבוני רשתית פנימית ברשתית מפוצלת. תמונות אימונופלואורסנציה קונפוקלית של רשתית מפוצלת מנקודת מבט שטוחה. הרשתית המפוצלת הודגרה עם נוגדנים נגד PKCα (צהוב) וקלבינדין-D (ירוק) במשך שעה אחת בטמפרטורת החדר כדי לסמן ON-BCs ו- HCs בהתאמה. (A) כל תמונה חד-ערוצית היא הקרנת Z ממוצעת המורכבת מארבעה מקטעים אופטיים: DAPI, ממוצע z10-13; קלבינדין-D, ממוצע z11-14; PKCα, ממוצע z11-14. (B) בתמונה הממוזגת, אותן הקרנות מונחות על גבי הטלות. פסי קנה מידה = 10 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
איור משלים 1: שלבי מפתח של דיסקציה ברשתית. כל התמונות צולמו באמצעות מצלמת סמארטפון המותקנת על עדשות העיניים של מיקרוסקופ דיסקציה. (A) תמונה מלמעלה למטה של עין עכבר לאחר הסרת הקרנית. (B) תמונה מלמעלה למטה של עינית העכבר לאחר הסרת העדשה. (C) חתך קטן נעשה בלובן העין של העכבר. חצים מציינים את שני הדשים של לובן העין אשר נמשכים בכיוונים מנוגדים על ידי מלקחיים כדי להתחיל להפריד את הרשתית מן הסקלרה. (D) לאחר שלובן העין נמשך חלקית מהרשתית, מחדירים מספריים של Vannas בין לובן העין לרשתית, ועצב הראייה נקטע ומשחרר את הרשתית. העיגול המנוקד האדום מראה את ראש עצב הראייה, והמספריים מדגימים את מסלול החיתוך הנכון (מכניסים מספריים בין לובן העין לרשתית). הרשתית המבודדת לאחר לובן העין נעלמת. אנא לחץ כאן כדי להוריד קובץ זה.
תרשים משלים 2: אפיון רכיבים קדם-סינפטיים ופוסט-סינפטיים של OPL ברשתית המפוצלת. תמונות אימונופלואורסנציה קונפוקלית מה-OPL ברשתית מפוצלת. הרשתית המפוצלת הודגרה עם נוגדנים נגד GPR179 ו-PSD95 למשך שעה אחת בטמפרטורת החדר כדי לסמן את הקצוות הדנדריטיים של ON-BCs ואת הדקים של פוטורצפטורים, בהתאמה. התמונות השמאלית והמרכזית הן הקרנות מקסימליות של מספר מקטעים אופטיים; אותן הקרנות מונחות על גבי התמונה הימנית ביותר. GPR179 puncta בקצוות הדנדריטיים ON-BC נראים קשורים קשר הדוק עם הדקי פוטורצפטור מוט, ומדגימים מגעים סינפטיים שלמים בתוך OPL. פסי קנה מידה = 10 מיקרומטר. אנא לחץ כאן להורדת קובץ זה.
תרשים משלים 3: פתרון בעיות: הערכת האיכות של רשתית מפוצלת. מיקרוגרפים פלואורסצנטיים של רשתית מפוצלת מוכתמת ב-DAPI כדי להמחיש גרעיני תאים. ניתן לזהות תאים על פי הקוטר ועומק הרקמה של הגרעין. (A) גרעיני קולטני אור הם קטנים יותר, בהירים יותר ושטחיים יותר, ואילו (B) גרעיני BC הם גדולים יותר, עמומים יותר ועמוקים יותר. (C) תמונת הגדלה נמוכה של אזור שבו פוטורצפטורים הוסרו באופן חלקי. הגרעינים המופיעים בפוקוס הם מ-BCs, שהם עמוקים יותר מגרעיני קולטני האור בשולי התמונה שנראים מחוץ למיקוד. פסי קנה מידה עבור (A) ו- (B) = 20 מיקרומטר. סרגל קנה מידה עבור (C) = 50 מיקרומטר. אנא לחץ כאן להורדת קובץ זה.
Discussion
לאחר שקולטני אור ממירים את בליעת הפוטון לשחרור מוליכים עצביים, BCs ו-HCs הם תאי העצב הראשונים ברשתית שמעבדים את האות החזותי23. בעוד חשיבותם של תאי עצב אלה מוערכת היטב, רבים מהתפקודים שלהם אינם מובנים לחלוטין או לא נחקרים לחלוטין. מחקרים רבים בפיזיולוגיה של BC ו-HC עשויים להפיק תועלת מהכנת רשתית שטוחה המשפרת את הגישה לנוירוני INL תוך שמירה על קישוריות רוחבית. פיתוח שיטת הרשתית המפוצלת מייצג מאמץ לספק פרוטוקול קל לרכישת רישומים אלקטרופיזיולוגיים באיכות גבוהה ונתוני מיקרוסקופיה מBCs ו- HCs בכיוון שטוח. הכנת הרשתית המפוצלת המתוארת כאן יכולה להתבצע בכ-20 דקות לעכבר (10 דקות לכל רשתית) לאחר בידוד הרשתית, ללא שימוש בציוד ייעודי. השיטה שואבת השראה מהליכים קיימים להסרת קולטני אור אך מציעה שיפורים משמעותיים בפשטות, במהירות וברבגוניות 4,10,11,12,13. בניגוד לשיטות קודמות להפרדת שכבות רשתית, פיצול הרשתית אינו דורש הקפאה, ליופיליזציה או מריחה חוזרת של דבקים על הרשתית. עם תרגול, כמעט כל photoreceptors ניתן להסיר בקרע אחד עם קרום nitrocellulose. המהירות והקלות של גישה זו מאפשרות למזער את הזמן שהרשתית מבלה מחוץ לאיימס קרבוגני, מה שמאפשר קיום תאים גבוה לפרקי זמן ארוכים; רשתית מפוצלת יכולה להישמר במדיה איימס קרבוגנית במשך מספר שעות לאחר הפיצול. כעדות לבריאות תאי עצב מסוג INL בהכנה זו, כתם של תאים חיים/מתים (איור 4) ואלקטרופיזיולוגיה של מהדק טלאי (איור 6) מאשרים את הכדאיות של RBCs ו-HCs לאחר פיצול.
הסרת שכבת הפוטורצפטור ברשתית מפוצלת מעבירה יתרון משמעותי במהלך התיוג החיסוני על ידי קיצור דרמטי של זמן הדיפוזיה של נוגדנים לתוך INL. ניתן להשלים תיוג נוגדנים ראשוני ומשני תוך שעתיים, שיפור משמעותי לצביעה שטוחה קונבנציונלית שיכולה להימשך 72 שעות או יותר בהתאם ליעד 5,6,7,8,20,22. כתוצאה מכך, ניתן להשיג נתוני מיקרוסקופיה באותו יום של הכנת רקמות, מה שמאיץ באופן דרסטי את קצב הניסויים האימונופלואורסצנטיים. כדי להקל על חישול בדיקות mRNA, ניסויי FISH ממליצים בדרך כלל על זמני קיבוע ארוכים בהרבה (~ 24 שעות) מאשר תיוג חיסוני18. אולם הניסויים שהוצגו כאן מראים שקיבוע של שעתיים עדיין מייצר תיוג FISH יוצא דופן (איור 5). למרות הארכת זמן הקיבוע מ -30 דקות ל -2 שעות, לא היה צורך לבצע שלבי אחזור אנטיגן כדי להשיג תיוג חיסוני מעולה, אך זה עשוי להשתנות עם הנוגדן או האנטיגן. הטיפול בפרוטאז בפרוטוקול FISH עלול להפריע לסימון נוגדנים, ככל הנראה עקב הרס אפיטופים של מטרה. בעיה זו נעקפה על ידי שימוש בנוגדנים רב-שבטיים המכוונים לאפיטופים מרובים, מה שמקטין את הסבירות שהרס אפיטופים יעכב תיוג חיסוני. בנוסף, נעשה שימוש בטיפול מתון בפרוטאז (ACD protease III) כדי למנוע שינוי אפיטופ מוגזם תוך מתן חדירה מספקת לרקמות.
לעיתים, הרשתית תתפצל במקום זאת דרך השכבה הגרעינית החיצונית (ONL), ותשאיר מאחוריה שכבות של סומות קולטניות אור ללא תאי INL גלויים. כדי למנוע זאת, יש לוודא כי הרשתית מונחת שטוחה לחלוטין על הזכוכית, וכי כל שאריות נוזל סביב הרשתית הוסרו. לחיצה חזקה יותר על הניטרוצלולוז עם המברשת עשויה גם לסייע במניעת פיצול דרך ה- ONL. אם הממברנה נעשית רטובה מדי או שהרשתית מקופלת על עצמה, הסיכויים לפיצול מוצלח יפחתו מאוד. שימוש ב- DAPI להכתמת גרעיני תאים שימושי להערכת איכות הפיצול ולקביעת הכיסוי של קולטני האור הנותרים. גרעיני קולטני אור הם קטנים יותר, בהירים יותר ושטחיים יותר (איור משלים 3A), בעוד שגרעיני BC הם גדולים יותר, עמומים יותר ועמוקים יותר (איור משלים 3B). במקרים מסוימים, מישור הקרע ישתנה מעט על פני פיסת הרשתית, וכתוצאה מכך ייווצרו טלאים שבהם גופי התאים של קולטני האור לא הוסרו לחלוטין (איור משלים 3C). עבור יישומים במיקרוסקופ ואלקטרופיזיולוגיה, זה לא מפריע ליכולת לאסוף נתונים איכותיים מאזורים שבהם פוטורצפטורים הוסרו כראוי; שדות גדולים של רשתית פנימית חשופה ניתן למצוא בקלות בעת הדמיה או הקלטה עם פיפטה טלאי. אם רוצים הסרת פוטורצפטור מלאה יותר, ניתן לבצע קרע שני עם חתיכה נוספת של קרום ניטרוצלולוז, אם כי הסרת 100% פוטורצפטור אינה מובטחת. לכן מומלץ להיזהר בעת שימוש ברשתית מפוצלת במחקרי ביטוי גנים או פרוטאומיקה שבהם חומר פוטורצפטור שיורי עשוי להשפיע על התוצאות. עבור יישומים של תא בודד, חשש זה אינו מוצדק, מכיוון שניתן להוציא נתונים מפוטורצפטורים מהניתוח.
היתרונות של הכנת הרשתית המפוצלת הם אולי הבולטים ביותר בהקלטות אלקטרופיזיולוגיות של נוירונים בין-עצביים רחבי שדה. בעוד פרוסות אנכיות מסורתיות קוטעות את התהליכים הנרחבים של תאים רחבי שדה, הכנת הרשתית המפוצלת משאירה את OPL ו- IPL ללא פגע, ומאפשרת ללכוד קלט מתאים רחבי שדה כגון HCs24, A17s 25, TH ACs 26 ו- NOS-1 ACs27 שאחרת היו מתעלמים מהם בפרוסות אנכיות. לכן, פענוח התוצאות והשוואה לנתונים קודמים שנאספו מפרוסות רשתית דורשים מחשבה מעמיקה. עם זאת, בניסויים שהשתמשו בחיקויים פרמקולוגיים של גירוי אור, תוצאות אלה דומות לנתונים שנרשמו מפרוסות רשתית19. על ידי ביטוי ChR2 תחת מקדמים ספציפיים לתא, ניתן לעורר אוכלוסיית תאים רצויה תוך כדי הקלטה מ- BCs ב- INL כדי לחקור את השפעת התא הרצוי על מסלול המידע האנכי. הקלטה ישירה מנוירוני INL עמוקים יותר, כגון תאים אמקריניים, אפשרית גם ברשתית המפוצלת. בעוד שבמקרה זה אלקטרודת המדבקה חייבת לנוע תחילה דרך נוירוני INL שטחיים יותר, יש הרבה פחות רקמה שחוסמת את דרכה בהשוואה להכנה מסורתית של הר שלם.
בנוסף למדידת ההשפעה של תאי שדה רחב על תאי עצב אחרים, שיטה זו מאפשרת הידוק טלאי ישיר של תא בודד מתאי HC, שהדנדריטים שלהם יוצרים רשת מצומדת נרחבת של צומת מרווחים ב-OPL28. תאים אופקיים שולחים משוב קריטי לפוטורצפטורים אשר מעצב את העברת המידע האנכי דרך הרשתית. עם זאת, מאחר שהשדות הדנדריטיים של HCs נחתכים בפרוסות אנכיות, חסרים נתוני רישום של תא בודד. עבודה זו מציגה HCs שלמים מבחינה אנטומית ופיזיולוגית שמהם נרשמים זרמים מעוררי ChR2 בקו עכבר מהונדס משולש (איור 6 C-E). מחוץ לגירוי ChR2, הרשתית המפוצלת יכולה לשמש לחקר זרמי HC אנדוגניים וצימוד צומת פער28. בעוד הרשתית המפוצלת מספקת מודל נוח לחקר קישוריות סינפטית ופעילות עצבית הנגרמת על ידי יישום כימי או גירוי ChR2, היעדר פוטורצפטורים מונע כל חקירה ישירה של תגובות אור טבעיות או מנגנוני הסתגלות לאור.
הדמיה באתרו ברשתית התקדמה באופן ראוי להערכה בשנים האחרונות. עם זאת, רוב מחקרי ההדמיה מוגבלים לשכבת תאי הגנגליון בתכשירי רשתית הר שלמים29. המחברים צופים כי היעדר פוטורצפטורים ברשתית המפוצלת יהפוך אותה למודל אידיאלי להדמיית סידן חיה ב-OPL וב-INL. מעבר להדמיית סידן, למודל זה יש פוטנציאל גדול לשימוש עם ביו-חיישנים מקודדים גנטית כגון iGluSnFR30,31, iGABASnFR 32 ו-pHluorin 33. בשילוב עם הכנת הרשתית המפוצלת, כלים רבי עוצמה אלה עשויים להציע גישה יעילה לחקר האינטראקציות הסינפטיות והתכונות הביופיזיקליות של BCs ו- HCs התורמים לעיבוד האור ברשתית.
Disclosures
המחברים מצהירים כי אין אינטרסים כלכליים מתחרים.
Acknowledgements
עבודה זו נתמכה על ידי מענקי NIH הבאים: מענק NIH R01EY031596 (ל- C.M.); מענק NIH R01EY029985 (ל-C.M.); מענק NIH P30EY010572 (ל-C.M.); מענק NIH R01EY032564 (לב"ש). אנו מודים לתמי היילי על תמיכתה הטכנית בהכנת מקטעי הרשתית, ולד"ר צ'ארלס אלן על תרומתו הנדיבה של בדיקות mRNA FISH המשמשות בעבודה זו.
Materials
| Name | Company | Catalog Number | Comments |
| #1.5 glass coverslips | Fisherbrand | 12544E | |
| 2 pairs of Dumont #5 forceps | Ted Pella | 38125 | |
| 25 gauge needle | Becton Dickenson | 305122 | |
| 470 nm LED | THORLABS | M470L2 | |
| 5-306 curved scissors | Miltex | 5-306 | |
| 9" disposable pasteur pipetes | Fisherbrand | 13-678-20D | for constructing custom transfer pipette |
| Ai80d mouse | Jackson Laboratories | 25109 | RRID: IMSR_JAX:025109 |
| Ames Medium w/L-Glutamate | US Biological | A1372-25 | |
| amplifier control software | Molecular Devices | Clampex 10.3 software | |
| anti-calbindin D28K antibody | Invitrogen | PA-5 85669 | RRID: AB_2792808, host species = rabbit; 1:100 dilution |
| anti-CtBP2 antibody | BD Biosciences | 612044 | RRID: AB_399431, host species = mouse; 1:5000 dilution |
| anti-GPR179 antibody | NA | NA | gift from Kirill Martemyanov; Scripps Research Institute, Jupiter, FL; host species = sheep; 1:1000 dilution |
| anti-PKC alpha antibody | Sigma-Aldrich | P4334 | RRID: AB_477345, host species = rabbit; 1:5000 dilution |
| anti-PKC alpha antibody | Santa Cruz Biotechnology | sc8393 AF594 | RRID: AB_628142, host species = mouse; 1:1000 dilution |
| anti-PSD95 antibody | BD Transduction Laboratories | 610495 | RRID: AB_397862, host species = mouse; 1:1000 dilution |
| anti-RGS11 antibody | NA | NA | gift from Ted Wensel; Baylor College of Medicine, Houston, TX; host species = rabbit; between 1:1000 and 1:5000 dilution |
| anti-Synaptophysin P38 antibody | Sigma | S-S5768 | RRID: AB_477523, host species = mouse; 1:1000 dilution |
| Aquamount mounting media | Epredia | 13800 | slide mounting media |
| C57BL/6J mouse | Jackson Laboratories | 000664 | RRID: IMSR_JAX:000664 |
| carbogen tank | Matheson | NA | 95% O2 and 5% CO2 |
| custom transfer pipette | custom build | NA | Instructions: use scissors to cut off the tip of a plasitc transfer pipette at the point it begins to taper. Use pliers to safely break off the last 2-3 inches of a glass pasteur pipette. Fit the narrow end of the glass pasteur pipette into the wide tip of the plastic transfer pipete. Wrap parafilm around the joint of the two pieces to enhance the seal. |
| Digitical optical power meter | THORLABS | PM100D | |
| dissection microscope | Zeiss | Stemi 2000 | |
| electrophysiology amplifier | Molecular Devices | Axopatch 200B | |
| electrophysiology microscope | Olympus | OLYMPUS, BX50WI | Dodt gradient contrast microscopy |
| Fluoromount-G | SouthernBiotech | 0100-01 | |
| HC PL APO CS2 40x/1.3 | Leica | 506358 | |
| HC PL APO CS2 63x/1.40 | Leica | 15506350 | |
| Hybridization oven | Robbins Scientific | Model 1000 | for RNAscope protocol only |
| Immedge hydrophobic barrier pen | Vector Laboratories | H-4000 | |
| isoflurane | Piramal Critical Care | 66794-017-25 | |
| Kimwipe (delicate task wipe) | Kimtech Science | 34155 | |
| Leica HC PL APO CS2 40x/1.3 oil immersion objective | Leica | 506358 | |
| Leica HC PL APO CS2 63x/1.40 oil immersion objective | Leica | 15506350 | |
| Leica TCS SP8 X confocal microscope | Leica | discontinued | |
| medium 15 mm petri dish | Corning | 25060-60 | eyes are kept here during retina dissection |
| Merit 97-275 steel scissors | Merit | 97-275 | |
| Micropipette Puller | Sutter Instrument | p-97 | |
| Mm-Gabrd-C2 mRNA probe | ACD | 459481-C2 | |
| mouse euthanasia chamber | NA | NA | custom build; glass petri dish covering a small glass jar. |
| nitrocellulose membrane filters | GE Healthcare Life Sciences; Whatman | 7184-005 | 0.45 µm pore size |
| Picospritzer | General Valve Corporation | Picospritzer II | referred to in the text as microcellular injection unit |
| plastic transfer pipets | Fisherbrand | 13-711-7M | for constructing custom transfer pipette |
| Plastic tubing | Tygon | R-603 | for connection to carbogen tank |
| platinum harp | custom build | NA | for anchoring split retinas within the electrophysiology recording chamber. |
| size 0 paint brush | generic | NA | for flattening retina during splitting. |
| SlowFade Gold antifade reagent | Molecular Probes | S36937 | referred to in the text as anti-fade mounting media |
| small 10 mm petri dish | Falcon | 353001 | eyes are placed here following enucleation |
| small glass pane (7.5 cm x 5 cm) | generic | NA | isolatd retina pieces are placed onto this for the splitting procedure |
| Superfrost plus microscope slides | Fisherbrand | 12-550-15 | electrostatically-charged glass microscope slides |
| Thick-walled borosilicate glass pipettes with filament | Sutter Instrument | BF150-86-10HP | |
| Vannas Scissors; straight | Titan Medical | TMS121 | not brand specific; any comparable scissors will work |
| vGATFLPo mouse | Jackson Laboratories | 29591 | RRID: IMSR_JAX:029591 |
| vGlut2Cre mouse | Jackson Laboratories | 28863, 016963 | RRID: IMSR_JAX:028863, RRID: IMSR_JAX:016963 |
| Zombie NIR Fixable Viability Kit | BioLegend | 423105 | referred to in the text as MI-NIR |
References
- Morgans, C. W. Neurotransmitter release at ribbon synapses in the retina. Immunology & Cell Biology. 78 (4), 442-446 (2000).
- Euler, T., Haverkamp, S., Schubert, T., Baden, T. Retinal bipolar cells: elementary building blocks of vision. Nature Reviews Neuroscience. 15 (8), 507-519 (2014).
- Barnes, S., Grove, J. C. R., McHugh, C. F., Hirano, A. A., Brecha, N. C. Horizontal Cell Feedback to Cone Photoreceptors in Mammalian Retina: Novel Insights From the GABA-pH Hybrid Model. Frontiers in Cellular Neuroscience. 14, (2020).
- Walston, S. T., Chang, Y. C., Weiland, J. D., Chow, R. H. Method to remove photoreceptors from whole mount retina in vitro. Journal of Neurophysiology. 118 (5), 2763-2769 (2017).
- Stefanov, A., Novelli, E., Strettoi, E. Inner retinal preservation in the photoinducible I307N rhodopsin mutant mouse, a model of autosomal dominant retinitis pigmentosa. Journal of Comparative Neurology. 528 (9), 1502-1522 (2020).
- Matsuoka, R. L., Nguyen-Ba-Charvet, K. T., Parray, A., Badea, T. C., Chédotal, A., Kolodkin, A. L. Transmembrane semaphorin signaling controls laminar stratification in the mammalian retina. Nature. 470 (7333), 259-263 (2011).
- Matsuoka, R. L., et al. Guidance-Cue Control of Horizontal Cell Morphology, Lamination, and Synapse Formation in the Mammalian Outer Retina. Journal of Neuroscience. 32 (20), 6859-6868 (2012).
- Wässle, H., Puller, C., Müller, F., Haverkamp, S. Cone Contacts, Mosaics, and Territories of Bipolar Cells in the Mouse Retina. Journal of Neuroscience. 29 (1), 106-117 (2009).
- Thoreson, W. B., Dacey, D. M. Diverse Cell Types, Circuits, and Mechanisms for Color Vision in the Vertebrate Retina. Physiological Reviews. 99 (3), 1527-1573 (2019).
- Guido, M. E., et al. A simple method to obtain retinal cell preparations highly enriched in specific cell types. Suitability for lipid metabolism studies. Brain Research Protocols. 4 (2), 147-155 (1999).
- Rose, K., Walston, S. T., Chen, J. Separation of photoreceptor cell compartments in mouse retina for protein analysis. Molecular Neurodegeneration. 12 (1), 28 (2017).
- Todorova, V., et al. Retinal Layer Separation (ReLayS) method enables the molecular analysis of photoreceptor segments and cell bodies, as well as the inner retina. Scientific Reports. 12 (1), 20195 (2022).
- Shiosaka, S., Kiyama, H., Tohyama, M. A simple method for the separation of retinal sublayers from the entire retina with special reference to application for cell culture. Journal of Neuroscience Methods. 10 (3), 229-235 (1984).
- Ivanova, E., Hwang, G. S., Pan, Z. H. Characterization of transgenic mouse lines expressing Cre-recombinase in the retina. Neuroscience. 165 (1), 233-243 (2010).
- Sarria, I., Orlandi, C., McCall, M. A., Gregg, R. G., Martemyanov, K. A. Intermolecular Interaction between Anchoring Subunits Specify Subcellular Targeting and Function of RGS Proteins in Retina ON-Bipolar Neurons. The Journal of Neuroscience. 36 (10), 2915-2925 (2016).
- Orlandi, C., Cao, Y., Martemyanov, K. A. Orphan Receptor GPR179 Forms Macromolecular Complexes With Components of Metabotropic Signaling Cascade in Retina ON-Bipolar Neurons. Investigative Ophthalmology & Visual Science. 54 (10), 7153-7161 (2013).
- Dikshit, A., Zong, H., Anderson, C., Zhang, B., Ma, X. -. J. Simultaneous Visualization of RNA and Protein Expression in Tissue Using a Combined RNAscopeTM In Situ Hybridization and Immunofluorescence Protocol. Methods in Molecular Biology. 2148, 301-312 (2020).
- Wang, F., et al. RNAscope. The Journal of Molecular Diagnostics. 14 (1), 22-29 (2012).
- Morgans, C. W., et al. TRPM1 is required for the depolarizing light response in retinal ON-bipolar cells. Proceedings of the National Academy of Sciences of the United States of America. 106 (45), 19174-19178 (2009).
- Alessio, E., Zhang, D. Q. Immunostaining of whole-mount retinas with the CLARITY tissue clearing method. Investigative Ophthalmology & Visual Science. 61 (7), 5054 (2020).
- Ferguson, L. R., Dominguez, J. M., Balaiya, S., Grover, S., Chalam, K. V. Retinal Thickness Normative Data in Wild-Type Mice Using Customized Miniature SD-OCT. PLoS ONE. 8 (6), e67265 (2013).
- Ivanova, E., Toychiev, A. H., Yee, C. W., Sagdullaev, B. T. Optimized Protocol for Retinal Wholemount Preparation for Imaging and Immunohistochemistry. Journal of Visualized Experiments JoVE. (82), e51018 (2013).
- Kolb, H. Neurotransmitters in the Retina. Webvision: The Organization of the Retina and Visual System. , (1995).
- Chaya, T., et al. Versatile functional roles of horizontal cells in the retinal circuit. Scientific Reports. 7 (1), 5540 (2017).
- Egger, V., Diamond, J. S. A17 Amacrine Cells and Olfactory Granule Cells: Parallel Processors of Early Sensory Information. Frontiers in Cellular Neuroscience. 14, 600537 (2020).
- Dacey, D. M. The dopaminergic amacrine cell. The Journal of Comparative Neurology. 301 (3), 461-489 (1990).
- Park, S. J., et al. Connectomic analysis reveals an interneuron with an integral role in the retinal circuit for night vision. eLife. 9, 56077 (2020).
- Janssen-Bienhold, U., et al. Connexin57 is expressed in dendro-dendritic and axo-axonal gap junctions of mouse horizontal cells and its distribution is modulated by light. The Journal of Comparative Neurology. 513 (4), 363-374 (2009).
- Jain, V., et al. The functional organization of excitation and inhibition in the dendrites of mouse direction-selective ganglion cells. eLife. 9, 52949 (2020).
- Marvin, J. S., et al. Stability, affinity, and chromatic variants of the glutamate sensor iGluSnFR. Nature Methods. 15 (11), 936-939 (2018).
- Strauss, S., et al. Center-surround interactions underlie bipolar cell motion sensitivity in the mouse retina. Nature Communications. 13 (1), 5574 (2022).
- Marvin, J. S., et al. A genetically encoded fluorescent sensor for in vivo imaging of GABA. Nature Methods. 16 (8), 763-770 (2019).
- Beckwith-Cohen, B., Holzhausen, L. C., Wang, T. M., Rajappa, R., Kramer, R. H. Localizing Proton-Mediated Inhibitory Feedback at the Retinal Horizontal Cell-Cone Synapse with Genetically-Encoded pH Probes. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 39 (4), 651-662 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved