A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הערכת צריכת חמצן מיטוכונדריאלית באמצעות מבחן פלואורסצנטי מבוסס קורא צלחות
In This Article
Erratum Notice
Summary
הערכת צריכת החמצן מספקת מידע אינטגרלי על תפקוד המיטוכונדריה. באמצעות בדיקה זרחנית עם קורא לוחות פלורסנט, ניתן להשיג נתונים מדויקים וניתנים לשחזור בקלות ללא ציוד מיוחד. בדיקה זו מאפשרת לכל מעבדה למדוד את צריכת החמצן של מיטוכונדריה מבודדת ולחשב יחסי בקרת נשימה.
Abstract
מיטוכונדריה משרתת פונקציות חשובות רבות, כולל נשימה תאית, ייצור ATP, שליטה באפופטוזיס ופועלת כמוקד מרכזי של מסלולים מטבוליים. לכן, הערכה ניסויית של תפקוד המיטוכונדריה יכולה לספק תובנה לגבי הבדלים בין אוכלוסיות שונות או מצבי מחלה. בנוסף, חשוב להעריך אם מיטוכונדריה מבודדת בריאה מספיק כדי להמשיך בניסויים. מאפיין אחד המשמש לעתים קרובות להשוואת תפקוד המיטוכונדריה בדגימות שונות הוא קצב צריכת החמצן. צריכת חמצן וחישוב יחס הבקרה הנשימתית בתאים שלמים או במיטוכונדריה המבודדת מרקמה יכולים לשרת את כל שלוש המטרות. באמצעות מיטוכונדריה שבודדה מכבד של לטאות מברשת בשילוב עם בדיקה זרחנית הרגישה לתנודות בריכוז החמצן של תמיסה, מדדנו את צריכת החמצן באמצעות קורא לוחות פלואורסצנטי. שיטה זו היא לא רק מהירה ויעילה אלא גם יכולה להתבצע עם כמות קטנה של מיטוכונדריה וללא צורך בציוד מיוחד. הפרוטוקול שלב אחר שלב המתואר כאן מגביר את הנגישות של הערכה תפקודית מיטוכונדריאלית לחוקרים.
Introduction
מיטוכונדריה הם אברונים, בערך בגודל של חיידקים, הנמצאים בתאים אוקריוטיים. הם אברונים ייחודיים מכיוון שהם מכילים DNA ויש להם שני ממברנות, חיצונית ופנימית. הממברנות החיצוניות והפנימיות של המיטוכונדריה מופרדות על ידי חלל בין-ממברני, והממברנה הפנימית מתקפלת למבנים הנקראים קריסטה סביב התא הפנימי ביותר, הנקרא מטריצה. קריסטות אלה מגדילות את שטח הפנים של הממברנה הפנימית כך שמספר תהליכים המשתמשים בקריסטה יכולים להתרחש בו זמנית. בעוד שהמיטוכונדריה מעורבים בתפקודים תאיים רבים כגון שליטה באפופטוזיס ושיכון מסלולים מטבוליים מרובים, תפקידם החיוני בייצור ATP חיוני להישרדות התאים. למעשה, 90% מהאנרגיה של התא מופקת ממיטוכונדריה1. ייצור ATP כרוך ביצירת הבדל אלקטרוכימי על פני הממברנות החיצוניות והפנימיות, המכונה פוטנציאל הממברנה המיטוכונדריאלית (Δψ), הנוצר כאשר יוני H+ נשאבים מהמטריצה לחלל הבין-ממברני. ייצור ATP נרתם בסופו של דבר במהלך חמצון של שווי ערך מפחיתים באמצעות תנועת אלקטרונים דרך שרשרת הנשימה המיטוכונדריאלית (ETC). מקבל האלקטרונים הסופי הוא חמצן מולקולרי (O2). כאשר חמצן נצרך, הפרש ריכוז H+ מצטבר למקסימום שלו, ובשלב זה יוני H+ נעים במורד שיפוע הריכוז שלהם מהחלל הבין-ממברני למטריצה על ידי מעבר דרך קומפלקס סינתאז ה-ATP. התנועה של יוני H+ גורמת לשינוי קונפורמציה בסינתאז ATP, ו-ADP מובא בסמיכות לפוספט אנאורגני כדי להגיב וליצור ATP. לבסוף, ATP מועבר מהמטריצה המיטוכונדריאלית לציטוזול וניתן לאחסן אותו או להשתמש בו כדי להקל על תגובות בשל הכמות הגדולה של אנרגיה חופשית המשתחררת במהלך הידרוליזה של הפוספטים שלו. כל התהליך הזה נקרא זרחון חמצוני, ומכיוון שצורכים חמצן, אומרים שהמיטוכונדריה נושמים2.
ההצטברות והחוזק של Δψ, כמות ה-O2 המופחתת (המכונה צריכת חמצן), כמו גם יצירת ATP יכולים לשמש כאינדיקציות לבריאות התאים. ניתן לכמת מחקרים פונקציונליים מיטוכונדריאלים, כגון מדידת Δψ, תכולת ATP וייצור כולל, וצריכת חמצן בשיטות ביוכימיות מסורתיות או פלואורסצנטיות וזוהר במבחנים מבוססי צלחת. לדוגמה, ניתן להשוות את פוטנציאל הממברנה המיטוכונדריאלית בין דגימות שונות באמצעות צבעים פלואורסצנטיים כגון טטרמתילרודמין אתיל אסטר, הנקשר במיוחד למיטוכונדריה. ניתן לנטר את יצירת ה-ATP על ידי הוספת חלבון זוהר לתגובה שהשינויים בה קשורים לריכוז ה-ATP. כימות שיעורי צריכת החמצן, או שיעורי הנשימה המוחלטים, במהלך OXPHOS, יכול לעזור להבהיר את הגורמים לפערים בתפקוד המיטוכונדריה ובחילוף החומרים האנרגטי. ניתן להשתמש בהערכת צריכת חמצן לחישוב יחסי בקרת נשימה (RCR). ערכי RCR מתארים את היכולת של המיטוכונדריה לייצר ATP בתגובה לזרם ה-ADP, שהוא התפקיד העיקרי של המיטוכונדריה. ערכי RCR מסמלים את המצב הכללי של מיטוכונדריה מבודדת ומאפשרים השוואה של תגובות לטיפולים ניסיוניים שונים. הבדלים בערכי RCR עשויים לייצג תפקוד לקוי של המיטוכונדריה או להצביע על הבדל ביולוגי בין מיטוכונדריות שונות המבודדות משני מקורות או יותר. מדד חשוב נוסף לתפקוד במיטוכונדריה מבודדת הוא יעילות המיטוכונדריה המוגדרת כשומות של ATP המסונתזות לכל שומות של O2, או יחס P/O3.
בהתחשב בכמות המידע שניתן לאסוף ממדידת פרמטרים מיטוכונדריאלים ומקרים שונים שבהם ניתן להשתמש במידע זה, היכולת לאסוף ביעילות נתונים פונקציונליים יכולה להיות שימושית בתחומי מחקר רבים ושונים. מדידות צריכת חמצן במיטוכונדריה מבוצעות במשך עשרות שנים עם מכשור ספציפי מאוד - באמצעות אלקטרודת קלארק, שיכולה להיות מוגבלת על ידי גודל המדגם הדרוש לביצוע מדידות, ולאחרונה, מכשירים מתוחכמים שיכולים למדוד נשימה מיטוכונדריאלית ופרמטרים רבים אחרים אך יכולים להיות חסכוניים. פרוטוקול זה הוא גישה חלופית מותאמת המשתמשת בבדיקה זרחנית רגישה לחמצן (MitoXpress)4,5. אות הבדיקה מזוהה עם קורא צלחות במצב פלואורסצנטי שנפתר בזמן למדידות רציפות לאורך זמן. לזרחן יש הפרש אנרגיה גדול יותר בין הפוטון הנספג והנפלט בהשוואה לפלואורסצנציה ולכן הוא מתאים יותר לניטור רציף של שינויים באות. זה מאפשר כמעט לכל מעבדה לבצע את המדידות הללו, לא רק לאלה שמתמקדות במטבוליזם של המיטוכונדריה או שיכולות להרשות לעצמן ציוד מיוחד ביותר. מערכת המודל שאנו משתמשים בה היא מיטוכונדריה מבודדת משלוש לטאות עצים, שני מיני הורים ואחד מוחדר (מכיל DNA גרעיני ממין הורה אחד ומיטוכונדריה מהשני - הכלאות). לטאות אלה נבחרו מכיוון ששיערנו שיש השלכות מטבוליות ואנרגטיות על יצורים כלאיים בעלי מקורות DNA גרעיניים ומיטוכונדריאלים שונים. השתמשנו בערכת בדיקה זמינה מסחרית עם קורא צלחות רב-מצבי שיכול להגדיל את הגישה לסוג זה של בדיקה לחוקרים ותחומי מחקר נוספים.
Access restricted. Please log in or start a trial to view this content.
Protocol
לטאות הומתו על ידי חנקCO2 ואחריו עריפת ראש מיידית בהתאם למדיניות שהותוותה על ידי המשרד לרווחת בעלי חיים במעבדה והנחיות הוועדה המוסדית לטיפול ושימוש בבעלי חיים של אילון.
1. בידוד מיטוכונדריה6
הערה: שמור על כל התמיסות קרות (טבלה 1) ודגימות על קרח לאורך שלבים אלה.
- הסר את הכבד, שקול אותו ולאחר מכן שטוף אותו עם ~3 מ"ל של מי מלח עם פוספט קר כקרח (1x, -/-).
- טוחנים את הכבד ב-1 מ"ל של L-MIB בעזרת סכין גילוח טרי.
- הביאו את הנפח הכולל של הרקמה בתוספת L-MIB ל-2 מ"ל ושיבשו מכנית את תאי הכבד למשך ארבעה מעברים עם הומוגנייזר Dounce.
- סובב את ההומוגנאט בחום של 300 × גרם (37 מעלות צלזיוס, 10 דקות).
- העבירו את הסופרנטנט לתוך צינור טרי והניחו אותו על קרח.
- השעו מחדש את הגלולה ב-2 מ"ל של L-MIB, הומוגניזציה וסובבו שוב ב-300 × גרם (37 מעלות צלזיוס, 10 דקות).
- שלבו את הסופרנטנטים הן מהספינים והן מהצנטריפוגה בטמפרטורה של 10,000 × גרם (37 מעלות צלזיוס, 10 דקות).
- השעו מחדש את הגלולה ב~0.350 מ"ל של L-MIB.
- קבע את כמות החלבון הכוללת (מ"ג מיטוכונדריה/מ"ל של L-MIB) לשימוש כקירוב לתכולת המיטוכונדריה 4,5,6.
2. צריכת חמצן
- מחממים מראש את כל התמיסות המשמשות (טבלה 1) בשלבים הבאים ל-30 מעלות צלזיוס באמבט מים.
- יש לדלל את המיטוכונדריה ב-LEB ל-6 מ"ג/מ"ל על סמך תוצאות בדיקת ריכוז החלבון בשלב 1.9.
- הגדר את הבדיקה בצלחת תחתונה שקופה סטרילית עם קיר שחור של 96 בארות (טבלה 2).
- הוסף 50 מיקרוליטר מהדגימה (מאגר L-EB או דגימת מיטוכונדריה) לבארות המתאימות.
- יש להוסיף 50 מיקרוליטר של טיפול (L-EB, גלוטמט/מלאט או גלוטמט/מלאט עם ADP).
- יש לדלל את מלאי הגשושית ביחס של 1:10 ב-L-EB ולאחר מכן להוסיף 100 מיקרוליטר של הגשושית הפלואורסצנטית לכל באר.
- הוסף בעדינות 50 מיקרוליטר שמן מינרלי כבד לכל באר כדי לא לכלול חמצן סביבתי.
- קרא מדידות פלואורסצנטיות מתחתית הצלחת בעירור/פליטה של 380/650 ננומטר כל 1.5 דקה למשך 45 דקות. השתמש באופן קינטי עם עיכוב זמן של 30,000 μs וחלון מדידה של 100 μs.
3. ניתוח נתונים
- ייצא את קובץ הנתונים הגולמיים ממחשב קורא הלוחות כקובץ .xls.
- פתח את הקובץ, ולאחר מכן העתק והדבק את הנתונים הגולמיים בכרטיסייה חדשה, וסמן את השורות והעמודות בהתאם.
- התווה את מאגר L-EB בלבד לדגימת הבקרה ו-L-EB + G/M כיחידות פלואורסצנטיות יחסיות (RFU) לעומת זמן.
הערה: קווים אלה צריכים להיות שטוחים יחסית מכיוון שאין מיטוכונדריה, ולכן אין לזהות שינוי בריכוז החמצן. - שרטט את ערכי הדגימה L-EB + G/M כ-RFU לעומת זמן.
- קבע היכן הקריאות הופכות לעקביות יותר ושטח עבור הפקדים.
הערה: זה המקום שבו צריך להתחיל ניתוח נתונים עבור דגימות ניסוי (מסומן בחצים באיור 1A). התגובות יכולות לקחת 10-15 דקות להשתטח ולהגיע למקסימום. - צור תרשים חדש המכיל את הנתונים רק לאחר נקודת הזמן שנקבעה בשלב 3.5 (נקרא נתונים "חתוכים") והוסף את הקו המתאים ביותר כדי להמחיש את הנתונים הגולמיים שיש לנתח.
- חשב את ערך ה-RFU הממוצע של נתוני מאגר הבקרה החתוכים בלבד (מודגש בצהוב). ערך זה משמש כערך ה-RFU המינימלי כקו הבסיס בחישוב החמצן שלהלן.
- חישוב קצב צריכת החמצן (μM O2/min)
- העתק והדבק את האזור הליניארי של הנתונים הגולמיים משלב 3.6 (כלומר, הנתונים החתוכים) כדי לקבוע את ריכוז החמצן בדגימות המיטוכונדריאליות בטיפול G/M + ADP בכל נקודת זמן 7,8,9,10.
- השתמש במשוואה (1)5 כדי לקבוע את ריכוז החמצן בכל נקודת זמן. [O2]a הוא ריכוז החמצן במאגר רווי אוויר (235 מ"מ ב-30 מעלות צלזיוס). I(t), Ia ו-Io הם האות הפלואורסצנטי של הדגימה + הגשושית בזמן t (למשל, דגימה + G/M + ADP), האות הממוצע של הגשושית במאגר רווי אוויר המחושב בשלב 3.7, והאות המקסימלי במאגר לא מחומצן (מוגדר באות המקסימלי שניתן להשיג), בהתאמה.
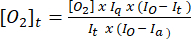 (1)
(1) - התווה את ערכי [O2]t המחושבים בשלב 3.8.2 לעומת זמן והוסף קו מגמה ליניארי יחד עם המשוואה של הקו המתאים ביותר.
הערה: השתמש בשיפוע של כל קו כקצב צריכת החמצן. ניתן לצבור כפילויות או משולשות עבור כל מדגם ולהשתמש בהם להשוואת קצב הצריכה.
- חשב את ה-RCR על ידי חלוקת הנשימה המיטוכונדריאלית עם ובלי ADP, המייצגים מצבים 3 ו-2, בהתאמה.
Access restricted. Please log in or start a trial to view this content.
תוצאות
קצב צריכת החמצן וה-RCR המיטוכונדריאלי נקבעו מהמיטוכונדריה של שלוש לטאות שונות באמצעות ערכת בדיקה עם בדיקה חישת חמצן זרחנית וקורא לוחות פלואורסצנטי סטנדרטי. מחקרים קודמים קבעו כי הבדיקה בערכה זו קשורה ישירות לצריכת חמצן, כאשר הזרחן מרווה על ידי חמצן מולקולרי והאות הפלואו...
Access restricted. Please log in or start a trial to view this content.
Discussion
מדידת תפקוד המיטוכונדריה שימושית כאשר משווים דגימות שונות, כגון מצבי מחלה לעומת מצבים שאינם מחלה, סוגי רקמות שונים מאותה חיה או בין סוגי דגימות שונים. השתמשנו בהשוואה המאוחרת יותר כדי לבחון את ההשערה שלנו שיש השלכה מטבולית ללטאות עצים היברידיות שהכניסו מיטוכונדריה. ישנ...
Access restricted. Please log in or start a trial to view this content.
Disclosures
למחברים אין ניגודי אינטרסים להצהיר עליהם.
Acknowledgements
מחקר זה מומן על ידי NSF CHE-1229562 (VDGM) ומענקים מוועדת המחקר והפיתוח של הפקולטה של אוניברסיטת אילון (VDGM ו-GH) ותוכנית המחקר לתואר ראשון (AJ).
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 96-well black/optical bottom plates | Thermo Fisher | 265301 | Untreated black-wall plates with clear bottoms. |
| ADP | Sigma | A2754 | Dilute 100 µM stock with EB immediately before use. |
| BSA | Thermo Fisher | BP1600-100 | Make 2 mg/mL stock in water for protein assay. |
| Dulbeccos 1x PBS (-/-) | Sigma | D8537 | Make sure the PBS is without Mg2+ or Ca2+ ions. |
| EGTA | Sigma | E3889 | |
| K2HPO4 | Sigma | P3786 | |
| KH2PO4 | Sigma | P0662 | |
| L-glutamic acid | Sigma | G1251 | |
| L-glutamic acid potassium salt | Sigma | S372226 | |
| L-malic acid | Sigma | M8304 | |
| L-malic acid mono-potassium salt | Sigma | 49601 | |
| MitoXpress oxygen consumption kit | Agilent | MX-200-4 | Kit contains probe stock and HS mineral oil. |
| MOPS | Sigma | M3183 | |
| Protien Assay Dye (5x) | BioRad | 500-0006 | Any protein assay can substitute. |
| R version 3.3 | R Core Development Team 2016 | ||
| Thermomax microplate reader EnSpire Multi-mode Plate reader and software | PerkinElmer | Standard fluorescent plate-reader | |
| Trisma base | Sigma | T6066 | Any version of Tris base can be utilized. |
References
- Drew, B., Leeuwenburgh, C. Method for measuring ATP production in isolated mitochondria: ATP production in brain and liver mitochondria of Fischer-344 rats with age and caloric restriction. American Journal of Physiology-Regulatory, Integrative andComparative Physiology. 285 (5), R1259-R1267 (2003).
- Ballard, J. W. O., Pichaud, N. Mitochondrial DNA: more than an evolutionary bystander. Functional Ecology. 28 (1), 218-231 (2014).
- Brand, M. D., Nicholls, D. G. Assessing mitochondrial dysfunction in cells. Biochemical Journal. 437 (3), 575-575 (2011).
- Will, Y., Hynes, J., Ogurtsov, V. I., Papkovsky, D. B. Analysis of mitochondrial function using phosphorescent oxygen-sensitive probes. Nature Protocols. 1 (6), 2563-2572 (2006).
- Hynes, J., et al. Investigation of drug-induced mitochondrial toxicity using fluorescence-based oxygen-sensitive probes. Toxicological Sciences. 92 (1), 186-200 (2006).
- Lampl, T., Crum, J. A., Davis, T. A., Milligan, C., Del Gaizo Moore, V. Isolation and functional analysis of mitochondria from cultured cells and mouse tissue. Journal of Visualized Experiments. (97), 52076(2015).
- Frezza, C., Cipolat, S., Scorrano, L. Organelle isolation: functional mitochondria from mouse liver, muscle, and cultured fibroblasts. Nature Protocols. 2 (2), 287-295 (2007).
- Dunn, D. A., Pinkert, C. A. Nuclear expression of a mitochondrial DNA gene: mitochondrial targeting of allotopically expressed mutant ATP6 in transgenic mice. Journal of Biomedicine and Biotechnology. 2012, 1-7 (2012).
- Irwin, R. W., et al. Medroxyprogesterone acetate antagonizes estrogen up-regulation of brain mitochondrial function. Endocrinology. 152 (2), 556-567 (2011).
- Ma, D., et al. Cancer cell mitochondria targeting by pancratistatin analogs is dependent on functional complex II and III. Scientific Reports. 7 (1), 42957(2017).
- Lakowicz, J. R. Principles of fluorescence spectroscopy. , Springer. New York. (2006).
- Haenel, G. J., Del Gaizo Moore, V. Functional divergence of mitochondria and coevolution of genomes: cool mitochondria in hot Llzards. Physiological and Biochemical Zoology. 91 (5), 1068-1081 (2018).
- Vinsant, S., et al. Characterization of early pathogenesis in the SOD1 G93A mouse model of ALS: part I, background and methods. Brain and Behavior. 3 (4), 335-350 (2013).
- Del Gaizo Moore, V., et al. Chronic lymphocytic leukemia requires BCL2 to sequester prodeath BIM, explaining sensitivity to BCL2 antagonist ABT-737. Journal of Clinical Investigation. 117 (1), 112-121 (2007).
- Chonghaile, T. N., et al. Pretreatment mitochondrial priming correlates with clinical response to cytotoxic chemotherapy. Science. 334 (6059), 1129-1133 (2011).
- Del Gaizo, V., MacKenzie, J. A., Payne, R. M. Targeting proteins to mitochondria using TAT. Molecular Genetics and Metabolism. 80 (1-2), 170-180 (2003).
Access restricted. Please log in or start a trial to view this content.
Erratum
Formal Correction: Erratum: Assessment of Mitochondrial Oxygen Consumption Using a Plate Reader-based Fluorescent Assay
Posted by JoVE Editors on 1/01/1970. Citeable Link.
This corrects the article 10.3791/65760
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved