A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
בהדמיה של פעילות ספונטנית בקליפת המוח החושית של עכבר יילודים ברזולוציה של נוירון יחיד
* These authors contributed equally
In This Article
Summary
אזורים חושיים ראשוניים בניאוקורטקס מפגינים פעילויות ספונטניות ייחודיות במהלך ההתפתחות. מאמר זה מתאר כיצד לדמיין פעילויות נוירונים בודדות ואזורי חישה ראשוניים כדי לנתח פעילויות סינכרוניות ספציפיות לאזור בעכברים ילודים in vivo.
Abstract
מוח היונקים עובר שינויים התפתחותיים דינמיים הן ברמה התאית והן ברמה המעגלית במהלך התקופה שלפני הלידה ואחריה. בעקבות גילויים של גנים רבים התורמים לשינויים התפתחותיים אלה, ידוע כיום כי גם הפעילות העצבית מווסתת תהליכים אלה באופן משמעותי. בקליפת המוח המתפתחת, תאי עצב מפגינים דפוסי פעילות מסונכרנים המתמחים בכל אזור חושי ראשוני. דפוסים אלה שונים במידה ניכרת מאלה שנצפו בקליפת המוח הבוגרת, ומדגישים את תפקידם בוויסות תהליכים התפתחותיים ספציפיים לאזור. ליקויים בפעילות העצבית במהלך ההתפתחות עלולים להוביל למחלות מוח שונות. ממצאים אלה מדגישים את הצורך לבחון את מנגנוני הבקרה העומדים בבסיס דפוסי הפעילות בהתפתחות העצבית. מאמר זה מסכם סדרה של פרוטוקולים כדי להמחיש אזורים חושיים ראשוניים ופעילות עצבית בעכברים ילודים, כדי לדמות את הפעילות של נוירונים בודדים בתוך תת-שדות קליפת המוח באמצעות מיקרוסקופ של שני פוטונים in vivo, ולנתח מתאמי פעילות הקשורים לתת-שדה. אנו מראים תוצאות מייצגות של פעילות סינכרונית דמוית טלאים בתוך חביות בודדות בקליפת המוח הסומטוסנסורית. אנו דנים גם ביישומים פוטנציאליים שונים ובכמה מגבלות של פרוטוקול זה.
Introduction
קליפת המוח מכילה מספר אזורים חושיים בעלי תפקודים מובחנים. האזורים מקבלים קלט שמקורו באיברי החישה המתאימים להם, המועברים בעיקר דרך חוט השדרה או גזע המוח ומועברים דרך התלמוס 1,2. יש לציין כי תאי עצב בכל אזור חושי ראשוני מפגינים פעילות מסונכרנת ייחודית בשלבים התפתחותיים מוקדמים, שמקורה גם באיברי החישה או במרכזי העצבים התחתונים, אך שונה במהותה מהפעילויות שנצפו בקליפת המוח הבוגרת3.
במכרסמים בילודים, למשל, אזור הראייה הראשוני (V1) מציג פעילות דמוית גל, שמקורה ברשתית (גל רשתית) ומתפשט לאורך כל מסלול הראייה תוך שימור רטינוטופיה4. אזור השמיעה הראשוני (A1) מציג פעילות סינכרונית המאורגנת בתת-אזורים בצורת פס המתאימים לפסי האיזותדרים במוח הבוגר. הפעילות נובעת מתאי השערה הפנימיים של השבלול 5,6. קליפת המוח של החבית באזור הסומטוסנסורי הראשוני (S1) מראה תבנית פעילות דמוית טלאים שבה תאי עצב משכבה 4 בתוך חביות בודדות, כלומר תאי עצב המגיבים לשפם בודד, מופעלים באופן סינכרוני7. למרות שהוצע שמקורו בגנגליון הטריגמינלי, מקור הפעילות נותר לא ידוע7. כתוצאה מכך, דפוסי הפעילות של היילודים מתמחים הן בתוך כל אזור חושי ראשוני והן בתוך תת-שדות תוך-אריאליים. הדמיה סימולטנית של פעילות עצבית ומבנה של אזורים חושיים ראשוניים עשויה להקל על חקירת תרומתם של דפוסי פעילות אלה להתפתחות מערכות חושיות.
במאמר זה, סיכמנו סדרה של פרוטוקולים: (1) כדי לדמיין פעילויות עצביות בודדות באמצעות תיוג דליל של GCaMP ואזורי חישה ראשוניים באמצעות עכברי TCA-RFP המבטאים חלבון פלואורסצנטי אדום באקסונים תלמוקורטיקליים7, (2) כדי לדמות פעילות ברמת תא בודד בעכברים ילודים באמצעות מיקרוסקופ של שני פוטונים in vivoו-(3) לנתח את מתאמי הפעילות בתוך קליפת המוח של חבית S1., התוצאות המייצגות מראות פעילות מסונכרנת דמוית טלאים בתוך חביות בודדות של עכבר יום לאחר הלידה (P)6. למרות מגבלות מסוימות, טכניקה זו יכולה לשמש לדימות כרוני, הדמיה בשדה רחב על פני אזורים חושיים מרובים, וניסויי מניפולציה שונים. הניתוח הרב-גוני של הפעילות העצבית במהלך ההתפתחות יעשיר את הבנתנו את מנגנוני היווצרות מעגלי המוח.
Protocol
כל הניסויים נערכו בהתאם להנחיות לניסויים בבעלי חיים של אוניברסיטת קומאמוטו והמכון הלאומי לגנטיקה ואושרו על ידי ועדות הניסויים בבעלי חיים.
1. אלקטרופורציה ברחם (IUE)
- זיווג עכברי TCA-RFP זכרים מרקע ICR עם נקבות עכברי ICR מסוג בר. התבונן בפקק הנרתיק כדי לבדוק הזדווגות בשעות הבוקר המוקדמות של היום שלמחרת. שימו לב לבטן כדי לבדוק הריון שבועיים לאחר מכן.
- הכינו תמיסת פלסמיד המכילה 5 ng/μL TRE-nCre, 1 μg/μL CAG-loxP-stop-loxP-GCaMP6s-ires-tTA-WPRE, ו-0.02% Trypan Blue ב-ddH2O כדי לסמן נוירונים בדלילות על ידי GCaMP באמצעות מערכת סופרנובה8.
- הכן פתרון משכך כאבים המכיל 0.5 מ"ג / מ"ל carprofen ו 0.01 מ"ג / מ"ל buprenorphine. הגנו עליו מפני אור ושמרו אותו בטמפרטורת החדר.
- ביום העוברי (E)14, בצע IUE כדלקמן. שיטות IUE זהות במהותן לדוחות קודמים 9,10,11.
- נגבו את ספסל המעבדה בתמיסת אתנול או גלוטראלדהיד 70%. לעקר את כל כלי הניתוח על ידי autoclaving. חבשו מסכה וחלוק מעבדה כדי להפחית את הסיכון להדבקה בעכבר.
- הכינו מיקרופיפטות זכוכית באמצעות מושך מיקרופיפטה. קח את תמיסת תערובת פלסמיד לתוך micropipette זכוכית באמצעות צינור אספירטור.
- יש להשרות הרדמה לעכברות ההרות ב-E14 באמצעות איזופלורן (2.0% באוויר). יש להרדים את העכברים במהלך ההליך עם איזופלורן (1.2% באוויר). צבטו את הבוהן כדי לוודא שההרדמה עמוקה מספיק. השתמש משחה אופתלמית כדי למנוע יובש בעין.
- יש לחטא את אזור הבטן לפחות שלוש פעמים בסיבובים מתחלפים של פילינג על בסיס יוד ו-70% אתנול. מניחים וילון סטרילי לכיסוי אזור הניתוח. בצע חתך בקו האמצע וחשף את הרחם על גבי השסע.
- יש לחזור על טפטוף מי מלח חמים על הרחם כדי למנוע ממנו להתייבש או להתקרר עד לסגירת הבטן (שלב 1.4.8).
- הזריקו את תמיסת הפלסמיד לצד אחד של החדר הצידי של העוברים בזה אחר זה באמצעות מיקרופיפטה וצינור אספירטור.
- השתמש באלקטרודה מסוג מלקחיים כדי לצבוט את ראשי העובר ולהעביר פולסים חשמליים מרובעים (40 וולט, 50 מילישניות) חמש פעמים במרווחים של שנייה אחת באמצעות אלקטרופורטור.
- להחזיר את הרחם לחלל הבטן. החל ~ 3 מ"ל של מלוחים חמים לתוך החלל. תפרו את קרום הצפק ואת עור הבטן. יש לתת את התמיסה משככת הכאבים במשקל 10 μL/g (קרפרופן במשקל 5 מיקרוגרם/גרם ובופרנורפין במשקל 0.1 מיקרוגרם/גרם) מתחת לעור בחלק האחורי של הצוואר.
- הניחו את העכבר בכלוב התאוששות על כרית חימום (37°C) כדי להתאושש מהרדמה. הניחו את העכבר על בטנו כדי למנוע מהלשון והרוק שלו לחנוק את הגרון. הרחיקו את העכבר מעכברים אחרים ועקבו אחריו עד שיתאושש וינוע כרגיל. החזירו את העכבר לכלוב.
- לאחר ההמלטה, בצעו גנוטיפ כדי לבדוק אם יש אלל RFP, והרדימו את הגורים ללא האלל. שלב זה מומלץ, במיוחד אם ההדמיה נעשית במהלך השבוע השני לאחר הלידה כאשר אות TCA-RFP חלש וקשה לבדוק בשלב 2.2.7.
2. ניתוח חלון גולגולת
- הכן את חיץ קליפת המוח המכיל 125 mM NaCl, 5 mM KCl, 10 mM גלוקוז, 10 mM HEPES, 2 mM CaCl2, ו 2 mM MgSO4 ב ddH2O (pH מותאם ל 7.4 עם 1 M NaOH)12 לפני יום הניתוח. סטריל את החיץ באמצעות מסנן ואקום.
הערה: ניתן לשמור את המאגר בטמפרטורה של 4°C למשך עד 3 חודשים. הנפח הנדרש הוא 5-10 מ"ל לכל גור. - בצע את השלבים הבאים ב- P3-12. עיין גם בדוחות הקודמים שתיארו הליך זה13,14.
- מערבבים 50 מ"ג אגרוז עם 5 מ"ל של חיץ קליפת המוח וממיסים לחלוטין את האגרוז על ידי חימום. קח חלק מהתמיסה לתוך צינור 1.5 מ"ל ולשמור אותו על 42 ° C.
- קח קצת חיץ קליפת המוח לתוך צינור חרוטי 50 מ"ל ולשמור אותו בטמפרטורת החדר. קחו מעט מלח לתוך מיכל (למשל, מכסה של צינור חרוטי 50 מ"ל) ושמרו אותו בטמפרטורת החדר.
- הכן פתרון משכך כאבים המכיל 0.01 מ"ג / מ"ל buprenorphine. הגנו עליו מפני אור ושמרו אותו בטמפרטורת החדר.
- לעקר את כל כלי הניתוח על ידי autoclaving. יש לחטא את המיקרוסקופ הסטריאופוני הפלואורסצנטי באתנול 70%.
- השתמש vaporizer isoflurane כדי לגרום להרדמה בגור עם isoflurane (2.0% באוויר). שימו לב לגור והוציאו אותו כאשר נשימתו מואטת מעט.
הערה: אם ההרדמה ממושכת, נשימתו של הגור עשויה להיפסק למספר שניות. גם אם נשימתו של הגור מתחדשת, הרדמה ממושכת עלולה להפחית את זרימת הדם המוחית של הגור ולגרום לנזק מוחי בלתי הפיך. - יש לחטא את ראש הגור לפחות שלוש פעמים בסיבובים לסירוגין של פילינג על בסיס יוד ו-70% אתנול. הניחו את הגור על כרית החימום (35°C) תחת מיקרוסקופ סטריאו פלואורסצנטי. יש לשמור תמיד על הגור מורדם עם איזופלורן (1.5%-2.5% באוויר).
- בחר את הגורים המבטאים TCA-RFP ו- GCaMP על ידי התבוננות בפלואורסצנטיות דרך הגולגולת. הרדימו את הגורים שאינם מבטאים את שניהם.
- הסר את הקרקפת מעל חצי המוח רחב ככל האפשר בזהירות כדי לא לגרום לדימום. שפשפו את הגולגולת עם צמר גפן סטרילי ספוג במי מלח כדי להסיר רקמת חיבור.
- לאחר שהגולגולת מתייבשת, הדביקו את משטח הקרקפת החתוך לגולגולת בעזרת דבק רקמות.
- העבירו את הגור לכרית חימום בטמפרטורה של 37°C כדי להתאושש מההרדמה. המתינו לפחות 15 דקות כדי לאפשר לדבק להתמצק.
הערה: השהה עד שעה לפני שתעבור לשלב הבא. הכינו גורים אחרים באופן דומה במידת הצורך במהלך תקופה זו. - מרדימים את הגור עם isoflurane. הניחו את הגור על כרית החימום (37°C) תחת מיקרוסקופ סטריאו פלואורסצנטי כשהוא מורדם (1.5%-2.5% איזופלורן באוויר).
הערה: אם ההרדמה מאריכה יותר מהזמן לנקודת הסיום (60 דקות), הרדימו את הגור על ידי עריפת ראשו במהלך הרדמה עם איזופלורן. - סמן את המיקום המבטא GCaMP על הגולגולת בטוש קבוע סטרילי. החל את מאגר קליפת המוח על המיקום.
- הכנס את הפינה של סכין גילוח לתוך הגולגולת. לדחוף את הלהב לאט כדי לגלח את הגולגולת ולעשות חור. צובטים את הגולגולת הסדוקה, בפינצטה, ומסירים אותה.
- בדוק כי חור הגולגולת נעשה בהצלחה על ידי התבוננות בכלי הדם בחור. אם מתרחש דימום, שטפו במהירות את החור עם חיץ קליפת המוח באמצעות מיקרופיפטה. יש לחזור על השטיפה עד שהדימום נפסק לחלוטין.
- יש למרוח טיפת חיץ קליפת המוח על חור הגולגולת ולהניח בזכוכית כיסוי עגולה סטרילית בקוטר 3 מ"מ מעל החור. נגבו את עודפי החיץ בבד לא ארוג. חכו עד שהאזור סביב הזכוכית יתייבש.
- מרחו תמיסת אגרוז חמה סביב קצה הזכוכית באמצעות מיקרופיפטה. מכיוון שיותר מדי אגרוז עלול להפחית את האותות הפלואורסצנטיים, הסירו את התמיסה העודפת מתחת לזכוכית על ידי דחיפה עדינה של הכוס מלמעלה.
- הסר את האגרוז על הזכוכית או רחוק מקצה הזכוכית באמצעות פינצטה. השאירו אגרוז רק סביב היקף הזכוכית החיצונית.
- חכו עד שהאגרוז יתמצק. אם התכווצות האגרוז יוצרת רווח מתחת לזכוכית, הוסיפו תמיסת אגרוז מהצד כדי לכסות את כל קצה הזכוכית. יש להסיר כל נוזל משטח הגולגולת עם בד לא ארוג.
- מערבבים אבקת שרף אקרילי ונוזל במיכל גומי. שואפים את התערובת עם מיקרופיפטה ויוצקים אותה כדי לכסות את האגרוז המקיף את קצה הזכוכית בשרף.
הערה: מכיוון שהשרף מתמצק זמן קצר לאחר ערבוב האבקה והנוזל, יש לערבב אותם שוב ושוב לפני המריחה. הכמויות הדרושות בכל ערבוב הן ~ 500 μL לנוזל ו~0.15 גרם לאבקה. - תקן מוט טיטניום עם שרף על חצי הכדור הנגדי. שמרו על זווית המוט מקבילה לזכוכית הכיסוי. תקן את כל משטח הגולגולת עם שרף.
- יש לתת את התמיסה משככת הכאבים במשקל 10 μL/g (buprenorphine במשקל 0.1 מיקרוגרם/גרם) מתחת לעור בחלק האחורי של הצוואר. החזירו את הגור לכרית חימום בטמפרטורה של 37°C להתאוששות מהרדמה. המתן >60 דקות למיצוק השרף לפני ההדמיה.
הערה: יש להמתין 1-5 שעות לפני ההדמיה. בצע ניתוח על גורים אחרים באופן דומה במהלך תקופה זו.
3. הדמיית סידן של שני פוטונים
- חבר גוניומטר דו-צירי עם לוחית טיטניום ללוח במה עם מיקום XY מתחת למיקרוסקופ. הגדר כרית חימום (35 ° C) על הבמה.
- הפעל את תוכנת הסריקה בתנאים הבאים: פיקסלים, 512 x 512; דו-כיווני, מופעל; ממוצע, אין; שטח הדמיה, 600 x 600 מיקרומטר עם מטרה 20x. הגדר את ההגדרות כך שקצב הסריקה יהיה מהיר מ- 1 הרץ.
- הניחו את הגור על כרית החימום, וקיבעו את מוט הטיטניום לצלחת הטיטניום בעזרת ברגים. שמור על הגור מורדם על ידי הנחת יציאת צינור עבור isoflurane (1.5-2.0% באוויר).
- כוונן את זווית החלון אופקית באמצעות הגוניומטר. הפעל את התאורה האחורית והתבונן בפני השטח של המוח עם עדשה אובייקטיבית 5x, ובחר את אזור ההדמיה לפי מיקום XY.
- שים טיפות עיניים על חלון הגולגולת. החלף את המטרה לעדשת טבילה במים פי 20. התבוננו במשטח קליפת המוח כדי לאשר שזרימת הדם נראית על פני המוח.
- כבו את התאורה האחורית וסרקו את פני השטח של המוח באמצעות מצב פוטון אחד. הגדל את כוח הלייזר כדי להפוך את האוטופלואורסצנטיות הירוקה של הזכוכית ומשטח המוח לגלויים.
- להוריד את ריכוז isoflurane ל 1.0%-1.5%. כסו את המיקרוסקופ כדי למנוע דליפות אור. העבר את תוכנת הסריקה למצב שני פוטונים.
- התאם את עוצמת הלייזר ואת רווח הגלאי המתאימים לסריקת אותות GCaMP ו- RFP. מצא את העומק שבו נראים אותות TCA-RFP. ודא כי העומק הוא שכבה 4, ~ 300 מיקרומטר נמוך יותר מפני השטח של המוח ב P6. בחר את אזור ההדמיה שבו נראים תאי עצב רבים המבטאים GCaMP.
- הפעל הדמיה של הילוך מהיר של אותות GCaMP ו- RFP. אם סריקה דו-ערוצית בו-זמנית אינה ישימה, צלם תמונות GCaMP ו-TCA-RFP לפני ההדמיה.
- עצור isoflurane כדי להחליש את ההרדמה ולצפות בפעילות ספונטנית במשך ~ 20 דקות. עקוב אחר תנועות הגור במהלך ההדמיה באמצעות מצלמת אינפרא אדום. יש לחדש את ההרדמה איזופלורן (2% באוויר) מיד אם נצפתה תגובה כלשהי המעידה על מצוקה.
- לאחר שהגור מפסיק לנוע, חזור על ההדמיה משלב 3.9. שנה את אזור ההדמיה במידת הצורך.
- להרדים את הגור עם מנת יתר של isoflurane. לתקן את המוח על ידי זילוח transcardial של מלוחים ו 4% PFA, ואחריו לאחר קיבוע ב 4% PFA לילה להכין פרוסות משיקות ולבצע immunohistochemistry. אחרת, הרדימו את הגור עם מנת יתר של חומר הרדמה ואחריו עריפת ראש.
- אם בסכר אין גורים אחרים, הרדימו את עכבר האם עם מנת יתר של חומר הרדמה ואחריו נקע צוואר הרחם.
4. ניתוח
- הפעל את MATLAB והפעל את ארגז הכליםEZcalcium 15 כדי לפתוח ממשק משתמש גרפי (GUI) 'ממשק משתמש ראשוני'.
- פצה על סטייה של מסגרת התמונה עקב תנועות עכבר או סיבות אחרות.
- לחץ על תיקון תנועה בממשק המשתמש הגרפי הראשוני כדי לפתוח את ממשק המשתמש הגרפי של תיקון תנועה. לחץ על 'הוסף קבצים...' כדי לטעון קובץ TIF של נתוני ההדמיה.
- הגדר את ההגדרות באופן הבא: תיקון תנועה לא קשיח, ריק; מקדם דגימה, 50; מקס שיפט, 15; גודל אצווה ראשוני, 200; רוחב פח, 200. לחץ על 'הפעל תיקון תנועה' כדי לבצע את התיקון. נתוני הדמיה מתוקני תנועה יישמרו באופן אוטומטי.
הערה: יש להתאים את ההגדרות למאפייני נתוני ההדמיה. אם הסטיות של מסגרות מסוימות אינן מפוצות עקב עיוותי מסגרת לא ליניאריים או תנועה של קליפת המוח בכיוון העומק, פתח את נתוני ההדמיה המקוריים ללא תיקון ב- ImageJ Fiji והסר את המסגרות, והפעל מחדש את שלב 4.2.
- לזהות תאי עצב ולצייר אזורי עניין (ROI).
- לחץ על זיהוי ROI אוטומטי בממשק המשתמש הגרפי הראשוני כדי לפתוח את ממשק המשתמש הגרפי לזיהוי החזר השקעה. לחץ על Add Files... כדי לטעון את נתוני ההדמיה המתוקנים לפי תנועה.
- הגדר את ההגדרות באופן הבא: אתחול, חמדן; שיטת חיפוש, אליפסה; Deconvolution, מוגבל FOOPSI-SPGL1; אוטורגרסיה, ריקבון; משוער # של החזר השקעה, 60 (מומלץ יותר מכפול מהמספר שזוהה חזותית); רוחב ROI משוער, 17 (~ 20 מיקרומטר); סף מיזוג, 0.95; פאדג' פקטור, 0.95; דגימת הפחתה מרחבית, 1; טמפ. דגימת הפחתה, 1; חזרות זמניות, 5.
הערה: יש להתאים את ההגדרות למאפייני נתוני ההדמיה. - לחץ על הפעל זיהוי החזר השקעה כדי לבצע את הזיהוי. נתוני החזר ההשקעה יישמרו באופן אוטומטי.
- לחץ על ROI Refinement בממשק המשתמש הגרפי הראשוני כדי לפתוח את ממשק המשתמש הגרפי של החזר ההשקעה. לחץ על טען נתונים כדי לטעון את נתוני החזר ההשקעה. בחר את החזר ההשקעה שהיה להם תדר פעילות נמוך (<1 הרץ), הממוקם מתחת לגולגולת, או שהכיל נוירונים של נוירונים אחרים. לחץ על אל תכלול החזר השקעה כדי לא לכלול את החזר ההשקעה בניתוח.
- בחר בתבנית ייצוא נתונים ל - XLSX ולחץ על יצא נתונים כדי לקבל קובץ Excel עם ערכי dF/F גולמיים. dF/F משתמש במשוואה (1), כאשר F היא העוצמה הממוצעת של פיקסלים בכל מסגרת, F0 היא עוצמת האות הבסיסית ו- Fb היא פלואורסצנטיות הרקע.
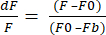 (1)
(1)
- חשב את מקדם המתאם של פירסון של dF/F בין החזר השקעה וצור מטריצת מקדם מתאם. יש להשתמש ב-dF/F רק לאחר שההרדמה נחלשה והחלה להתרחש פעילות ספונטנית (~10 דקות לאחר הפסקת איזופלורן).
- הגדר את קצוות החבית מתמונת TCA-RFP באמצעות פיג'י. סווג את החזר ההשקעה לחביות או לספטה. השווה את המתאם הזוגי בתוך אותה חבית וזה בין חביות שונות.
- צור 1,000 עד 10,000 נתונים פונדקאיות על ידי ערבוב אקראי של ההתכתבות בין ROI ועקבות Ca2+ . לחשב את מקדם המתאם הממוצע בתוך חביות בודדות בכל נתון חלופי, ולהעריך את המובהקות הסטטיסטית של המתאם בנתונים האמיתיים.
הערה: אם לאחת מ-10,000 פונדקאיות יש ערך גבוה מהערך האמיתי, המובהקות הסטטיסטית היא 0.0001. הניתוחים המתוארים בשלבים 4.5 ו-4.6 יכולים להתבצע עבור נתונים מאוגדים מבעלי חיים מרובים, כפי שבוצעו במקומות אחרים 7,16.
תוצאות
איור 1 מראה את התוצאות המייצגות של פעילויות נוירונים בשכבה 4 בקליפת המוח של גור P6 שהודמיינו באמצעות הפרוטוקול הנוכחי. תמונות של שני פוטונים של הערוץ הירוק (GCaMP) והערוץ האדום (TCA-RFP) עברו ממוצע זמני והוצגו באיור 1A. מאחר שפלואורסצנטיות TCA-RFP היי?...
Discussion
בהתחשב בכך שהפעילויות הספונטניות יוצאות מאיבר החישה או ממערכת העצבים התחתונה ונודדות לאזור החישה הראשוני דרך מסלול שווה ערך לזה של מערכת עצבים בוגרת3, חיוני להגדיר את האזור החישה הראשוני ואת מיקומם של תאי עצב מצולמים בתוך האזור. בפרוטוקול זה, התייחסנו לדרי?...
Disclosures
למחברים אין אינטרסים כלכליים מתחרים להצהיר.
Acknowledgements
עבודה זו נתמכה על ידי האגודה היפנית לקידום מענקי מדע בסיוע לאזורי מחקר טרנספורמטיביים (B) (22H05092, 22H05094) ולמענקי מחקר מדעי 20K06876, AMED תחת מענק מספר 21wm0525015, קרן המדע טקדה, קרן נאיטו, קרן Kato Memorial Bioscience, קרן Kowa Life Science Foundation, NIG-JOINT (24A2021) (ל- H.M.); והאגודה היפנית לקידום המדע מענקי סיוע למענקי מחקר מדעי 19K06887 ו-22K06446, קרן הזיכרון קודאמה למחקר רפואי, קרן הזיכרון אואהארה, הקרן לביומדע לזכר קאטו וקרן המדע טקדה (ל-N.N-T). אנו מודים לד"ר טקוג'י איוואסטו על עכברי TCA-RFP.
Materials
| Name | Company | Catalog Number | Comments |
| 20× objective lens (water immersion) | |||
| 250 mL Vacuum Filter/Storage Bottle System | Corning | 431096 | |
| 4%-paraformaldehyde phosphate buffer solution (4% PFA) | Nacalai | 09154-85 | |
| Acrylic resin (UNIFAST II) | GC | N/A | |
| Agarose | Sigma | A9793 | |
| Aspirator tube assembly | Drummond | 2-040-000 | |
| CaCl2•2H2O | Nacalai | 06731-05 | |
| Electroporator | BEX | GEB14 | |
| Eye drop (Scopisol) | Senju Pharmaceutical | N/A | |
| Fluorescence stereo microscope | Leica | M165FC | |
| Glucose | Nacalai | 16806-25 | |
| Heating pad | Muromachi Kikai | FHC-HPS | |
| HEPES | Gibco | 15630-080 | |
| Isoflurane | Pfizer | N/A | |
| KCl | Nacalai | 28514-75 | |
| MgSO4•7H2O | Wako | 131-00405 | |
| Micropipette puller | Narishige | PC-100 | |
| Multiphoton laser | Spectra-Physics | Mai Tai eHP DeepSee | |
| Multiphoton microscope | Zeiss | LSM 7MP | |
| NaCl | Nacalai | 31320-05 | |
| Non-woven fabric (Kimwipe) | Kimberly Clark | S-200 | |
| Phosphate buffered saline (PBS) | Nacalai | 27575-31 | |
| Plasmid: CAG-loxP-STOP-loxP-GCaMP6s-ires-tTA-WPRE | Addgene | pK175 | |
| Plasmid: TRE-nCre | Addgene | pK031 | |
| Precision calibrated micropipets | Drummond | 2-000-050 | |
| Razor blade | Feather | FA-10 | |
| Rimadyl (50 mg/mL Carprofen) | Zoetis JP | N/A | |
| Round cover glass, 3-mm-diameter | Matsunami | CS01078 | |
| Saline | Otsuka | 035175315 | |
| Sodium pentobarbital | Nacalai | 26427-72 | |
| Stage for imaging living pup (two single-axis translation stage for XY positioning, two-axis goniometer, base plate, adjustable pillar for z positioning) | ThorLabs | LT1/M, GN2/M, BM2060/M, MLP01/M | |
| TCA-RFP mouse | N/A | N/A | Mizuno et al., 2018a |
| Tissue adhesive (Vetbond) | 3M | 1469SB | |
| Titanium bar | Endo Scientific Instrument | N/A | Custom made (Mizuno et al., 2018b) |
| Titanium bar fixing plate | N/A | Custom made (Mizuno et al., 2018b) | |
| Trypan blue | Sigma | T8154 | |
| Tweezers with platinum plate electrode, 5 mm diameter | BEX | CUY650P5 | |
| Wild-type ICR mouse | Nihon SLC | Slc:ICR |
References
- Rao, M. S., Mizuno, H. Elucidating mechanisms of neuronal circuit formation in layer 4 of the somatosensory cortex via intravital imaging. Neuroscience Research. 167, 47-53 (2021).
- Iwasato, T., Erzurumlu, R. S. Development of tactile sensory circuits in the CNS. Current Opinion in Neurobiology. 53, 66-75 (2018).
- Martini, F. J., Guillamón-Vivancos, T., Moreno-Juan, V., Valdeolmillos, M., López-Bendito, G. Spontaneous activity in developing thalamic and cortical sensory networks. Neuron. 109 (16), 2519-2534 (2021).
- Ackman, J. B., Burbridge, T. J., Crair, M. C. Retinal waves coordinate patterned activity throughout the developing visual system. Nature. 490 (7419), 219-225 (2012).
- Tritsch, N. X., Yi, E., Gale, J. E., Glowatzki, E., Bergles, D. E. The origin of spontaneous activity in the developing auditory system. Nature. 450 (7166), 50-55 (2007).
- Babola, T. A., et al. Homeostatic control of spontaneous activity in the developing auditory system. Neuron. 99 (3), 511-524.e5 (2018).
- Mizuno, H., et al. Patchwork-type spontaneous activity in neonatal barrel cortex layer 4 transmitted via thalamocortical projections. Cell Reports. 22 (1), 123-135 (2018).
- Mizuno, H., et al. NMDAR-regulated dynamics of layer 4 neuronal dendrites during thalamocortical reorganization in neonates. Neuron. 82 (2), 365-379 (2014).
- Tabata, H., Nakajima, K. Efficient in utero gene transfer system to the developing mouse brain using electroporation: visualization of neuronal migration in the developing cortex. Neuroscience. 103 (4), 865-872 (2001).
- Fukuchi-Shimogori, T., Grove, E. A. Neocortex patterning by the secreted signaling molecule FGF8. Science. 294 (5544), 1071-1074 (2001).
- Saito, T., Nakatsuji, N. Efficient gene transfer into the embryonic mouse brain using in vivo electroporation. Developmental Biology. 240 (1), 237-246 (2001).
- Holtmaat, A., et al. Long-term, high-resolution imaging in the mouse neocortex through a chronic cranial window. Nature Protocols. 4 (8), 1128-1144 (2009).
- Mizuno, H., Nakazawa, S., Iwasato, T. In vivo two-photon imaging of cortical neurons in neonatal mice. Journal of Visualized Experiments. 140, e58340 (2018).
- Egashira, T., et al. In vivo two-photon calcium imaging of cortical neurons in neonatal mice. STAR Protocols. 4 (2), 102245 (2023).
- Cantu, D. A., et al. EZcalcium: Open-source toolbox for analysis of calcium imaging data. Frontiers in Neural Circuits. 14, 25 (2020).
- Maruoka, H., et al. Lattice system of functionally distinct cell types in the neocortex. Science. 358 (6363), 610-615 (2017).
- Antón-Bolaños, N., et al. Prenatal activity from thalamic neurons governs the emergence of functional cortical maps in mice. Science. 364 (6444), 987-990 (2019).
- Guillamón-Vivancos, T., et al. Input-dependent segregation of visual and somatosensory circuits in the mouse superior colliculus. Science. 377 (6608), 845-850 (2022).
- Cardin, J. A., Crair, M. C., Higley, M. J. Mesoscopic imaging: Shining a wide light on large-scale neural dynamics. Neuron. 108 (1), 33-43 (2020).
- Chen, J. L., Voigt, F. F., Javadzadeh, M., Krueppel, R., Helmchen, F. Long-range population dynamics of anatomically defined neocortical networks. eLife. 5, e14679 (2016).
- Ota, K., et al. cell-resolution, contiguous-wide two-photon imaging to reveal functional network architectures across multi-modal cortical areas. Neuron. 109 (11), 1810-1824 (2021).
- Zariwala, H. A., et al. A Cre-dependent GCaMP3 reporter mouse for neuronal imaging in vivo. The Journal of Neuroscience. 32 (9), 3131-3141 (2012).
- Murakami, T., Matsui, T., Uemura, M., Ohki, K. Modular strategy for development of the hierarchical visual network in mice. Nature. 608 (7923), 578-585 (2022).
- Pnevmatikakis, E. A., et al. Simultaneous denoising, deconvolution, and demixing of Calcium imaging data. Neuron. 89 (2), 285-299 (2016).
- Shemesh, O. A., et al. Precision calcium imaging of dense neural populations via a cell-body-targeted calcium indicator. Neuron. 107 (3), 470-486 (2020).
- Giovannucci, A., et al. CaImAn an open source tool for scalable calcium imaging data analysis. Elife. 8, e38173 (2019).
- Pachitariu, M., et al. Suite2p: beyond 10,000 neurons with standard two-photon microscopy. BioRxiv. , (2017).
- Sitdikova, G., et al. Isoflurane suppresses early cortical activity. Annals of Clinical and Translational Neurology. 1 (1), 15-26 (2014).
- Marques-Smith, A., et al. A Transient translaminar GABAergic interneuron circuit connects thalamocortical recipient layers in neonatal somatosensory cortex. Neuron. 89 (3), 536-549 (2016).
- Tuncdemir, S. N., et al. Early somatostatin interneuron connectivity mediates the maturation of deep layer cortical circuits. Neuron. 89 (3), 521-535 (2016).
- Nakazawa, S., Yoshimura, Y., Takagi, M., Mizuno, H., Iwasato, T. Developmental phase transitions in spatial organization of spontaneous activity in postnatal barrel cortex layer 4. The Journal of Neuroscience. 40 (40), 7637-7650 (2020).
- Yu, Y. -. C., et al. Preferential electrical coupling regulates neocortical lineage-dependent microcircuit assembly. Nature. 486 (7401), 113-117 (2012).
- Siegel, F., Heimel, J. A., Peters, J., Lohmann, C. Peripheral and central inputs shape network dynamics in the developing visual cortex in vivo. Current Biology. 22 (3), 253-258 (2012).
- Nakagawa, N., Hosoya, T. Slow dynamics in microcolumnar gap junction network of developing neocortical pyramidal neurons. Neuroscience. 406, 554-554 (2019).
- Valiullina, F., et al. Developmental changes in electrophysiological properties and a transition from electrical to chemical coupling between excitatory layer 4 neurons in the rat barrel cortex. Frontiers in Neural Circuits. 10, 1 (2016).
- Avitan, L., et al. Spontaneous and evoked activity patterns diverge over development. Elife. 10, e61942 (2021).
- Mölter, J., Avitan, L., Goodhill, G. J. Detecting neural assemblies in calcium imaging data. BMC Biology. 16 (1), 143 (2018).
- Nakazawa, S., Mizuno, H., Iwasato, T. Differential dynamics of cortical neuron dendritic trees revealed by long-term in vivo imaging in neonates. Nature Communications. 9 (1), 3106 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved