טיפוח אורגנואידים מסוג גליומה שמקורם במטופל Ex Vivo באמצעות מסוק רקמות
In This Article
Summary
מחקר זה מציג שיטה אוטומטית ליצירת אורגנואידים תלת-ממדיים מסוג גליובלסטומה שמקורם במטופל באמצעות מסוק רקמות. השיטה מספקת גישה מתאימה ויעילה להשגת אורגנואידים כאלה לבדיקה טיפולית.
Abstract
גליובלסטומה, סוג IDH-wild, CNS WHO דרגה 4 (GBM) הוא גידול מוחי ראשוני הקשור להישרדות ירודה של חולים למרות טיפול אגרסיבי. פיתוח מודלים מציאותיים של אקס ויו נותר מאתגר. מודלים של אורגנואידים תלת-ממדיים (PDO) שמקורם במטופל מציעים פלטפורמות חדשניות הלוכדות את ההטרוגניות הפנוטיפית והמולקולרית של GBM, תוך שמירה על המאפיינים העיקריים של הגידולים המקוריים. עם זאת, דיסקציה ידנית ליצירת PDO גוזלת זמן, יקרה ויכולה לגרום למספר PDO לא סדירים ובגודל לא אחיד. מחקר זה מציג שיטה חדשנית לייצור PDO באמצעות מסוק רקמות אוטומטי. דגימות גידול מארבעה חולי GBM ואסטרוציטומה אחת, מוטציה IDH, CNS WHO דרגה 2 עובדו ידנית וכן באמצעות מסוק הרקמות. בגישה הידנית, החומר הגידולי נותח באמצעות אזמלים תחת בקרה מיקרוסקופית, בעוד מסוק הרקמה הופעל בשלוש זוויות שונות. בעקבות תרבית על שייקר אורביטלי בטמפרטורה של 37 מעלות צלזיוס, שינויים מורפולוגיים הוערכו באמצעות מיקרוסקופ שדה בהיר, בעוד שהתפשטות (Ki67) ואפופטוזיס (CC3) הוערכו על ידי אימונופלואורסנציה לאחר 6 שבועות. שיטת מסוק הרקמות הפחיתה כמעט 70% מזמן הייצור והביאה למספר ממוצע PDOs גבוה משמעותית בהשוואה לרקמה המעובדת ידנית מהשבוע השני ואילך (שבוע 2: 801 לעומת 601, P = 0.018; שבוע 3: 1105 לעומת 771, P = 0.032; ושבוע 4:1195 לעומת 784, P < 0.01). הערכת איכות גילתה שיעורים דומים של אפופטוזיס של תאי גידול והתפשטות בשתי שיטות הייצור. לכן, שיטת מסוק הרקמות האוטומטי מציעה גישה יעילה יותר במונחים של זמן ותפוקת PDO. שיטה זו טומנת בחובה הבטחה לבדיקות סקר תרופתיות או אימונותרפיות של חולי גליובלסטומה.
Introduction
גליומות בדרגה נמוכה (LGGs) הן קבוצה של גידולי מוח נדירים יחסית שבדרך כלל מופיעים כגדלים לאט ופחות אגרסיביים בהשוואה לגליומות בדרגה גבוהה כמו גליובלסטומה. הם יכולים להתרחש הן אצל מבוגרים והן אצל ילדים, עם שכיחות מעט גבוהה יותר אצל מבוגרים. השכיחות המדויקת משתנה לפי אזור ואוכלוסייה, אך LGGs מהווים כ-15%-20% מכלל גידולי המוח הראשוניים1. אסטרטגיות הטיפול ב- LGGs כוללות לעתים קרובות שילוב של ניתוח, הקרנות וכימותרפיה, במטרה למקסם את כריתת הגידול תוך שמירה על תפקוד נוירולוגי. ניהול LGGs יכול להיות מורכב, ובחירת הטיפול עשויה להיות תלויה בגורמים כגון מיקום הגידול ומאפיינים מולקולריים2. ההתקדמות בהבנת היסודות הגנטיים והמולקולריים של LGGs הובילה לטיפולים ממוקדים יותר, והמחקר המתמשך ממשיך לחדד גישות טיפול.
גליובלסטומה, מסוג IDH-wild, CNS WHO דרגה 4 (GBM), לעומת זאת, הוא גידול המוח הראשוני השכיח ביותר שנמצא במבוגרים, עם שיעור היארעות בין 3.19-4.17 מקרים לכל 100,000 שנות אדם3. GBM גורמת לתסמינים כגון כאבי ראש, פרכוסים, ליקויים נוירולוגיים מוקדיים, שינויים באישיות ולחץ תוך גולגולתי מוגבר. הטיפול הסטנדרטי עבור GBM כרוך debulking של הגידול, אם אפשרי, ואחריו טיפול קרינתי בשילוב עם Temozolomide4. יתר על כן, שילוב של Temozolomide ו- Lomustine עשוי לשפר את שיעור ההישרדות הכולל החציוני בחולים עם O 6-methylguanine-methyltransferase (MGMT)-promoter methylation5. עם זאת, למרות גישות טיפוליות עדכניות אלה, GBM נותרה מחלה חשוכת מרפא עם פרוגנוזה גרועה, המאופיינת בשיעור הישרדות כולל חציוני של חולים של 16 חודשים עד 20.9 חודשים כאשר שדות טיפול בגידול (TTFields) מתווספים 3,6. מספר גישות אימונותרפיות נחקרו ב-GBM אך הדגימו יעילות מוגבלת in vivo. יתר על כן, מגבלות קליניות ופרה-קליניות מעכבות פריצות דרך טיפוליות7. הקמתו של מודל אקס ויוו מתאים ומציאותי הייתה מאתגרת בשל ההטרוגניות הבין-8 והתוך-גידולית9 של GBM.
קווי תאים קונבנציונליים דו-ממדיים (2D) של מטופלים מייצגים אוכלוסיות תאים הומוגניות ומתאימים לסינון תרופות בתפוקה גבוהה. עם זאת, קווי תאים שמקורם במטופל ואימורטליזציה אינם מצליחים לחקות GBM כראוי בשל הבדלים בתנאי הגידול וסטיות בתכונות גנוטיפיות ופנוטיפיות לאחר מעברים מרובים 10,11,12.
מצד שני, מודלים אורגנואידים תלת ממדיים התגלו לאחרונה כמערכות מבטיחות המשכפלות את ההטרוגניות הפנוטיפית והמולקולרית של איברים וסוגי סרטן שונים 13,14,15,16,17,18. בהקשר של GBM, אורגנואידים מוחיים הונדסו גנטית כדי לדמות מאפיינים דמויי גידול16,17 או בתרבית משותפת עם GSCs או ספרואידים כדי לגרום להסננת תאי גידול 18,19. בעוד אורגנואידים GBM שמקורם במטופל שגודלו בתרבית עם Matrigel ו- EGF / bFGF מציגים סימני היכר של GBM כגון הטרוגניות תאי גזע והיפוקסיה20, עדיין לא ברור באיזו מידה מודל זה יכול לייצג את התכונות המולקולריות העיקריות של גידולים של חולים.
אורגנואידים של GBM (PDOs) שמקורם במטופל הם מודלים מבטיחים שיכולים לשמור על המאפיינים הדומיננטיים של גידולי ההורים המקבילים שלהם, כולל מאפיינים היסטולוגיים, מגוון תאי, ביטוי גנים ופרופילים מוטציוניים. בנוסף, הם מוחדרים במהירות עם השתלתם למוחות מכרסמים בוגרים, ומספקים מודל מציאותי לבדיקות סמים וטיפול מותאם אישית21. עם זאת, ניתוח ידני של רקמת הגידול כדי ליצור PDOs הוא גוזל זמן ויקר. לכן, קיים צורך דחוף בשיטה מהירה שיכולה לייצר מספר רב של PDOs, המאפשרת הערכה מקיפה של גישות טיפוליות שונות טומנות בחובן הבטחה לבדיקות תרופתיות אישיות. מחקר זה מתאר שיטה חדשה לייצור PDOs ישירות מרקמת גידול שזה עתה נותחה באמצעות מסוק רקמות אוטומטי. יתר על כן, PDOs שנוצרו בשיטה זו הושוו עם PDOs שנותחו באופן ידני מאותם חולים במונחים של ספירת PDO, תכונות מורפולוגיות, אפופטוזיס והתפשטות של תאים סרטניים.
Protocol
כל החולים טופלו במחלקה לנוירוכירורגיה, בית החולים האוניברסיטאי וירצבורג, גרמניה, לאחר מתן הסכמה מדעת בכתב בהתאם להצהרת הלסינקי וכפי שאושר על ידי מועצת הביקורת המוסדית של אוניברסיטת וירצבורג (#22/20-me). חומר רקמת גידול מארבעה חולי GBM ואסטרוציטומה אחת, מוטציה IDH, CNS WHO דרגה 2 (גליומה בדרגה נמוכה, LGG) (טבלה 1) התקבל מניתוח ועובד באמצעות הפרוטוקול הבא. התהליך האוטומטי של יצירת PDOs באמצעות מסוק רקמות מכונה מסוק (C) והתהליך של חיתוך ידני של הרקמה עם שני אזמלים תחת בקרה מיקרוסקופית כידני (M). שישה חלקים שווים בגודלם (1-2 ס"מ3) נותחו מדגימת הגידול, ואז כל אחד מהם נחתך לשניים ועובד בצורה הומוגנית בשתי השיטות. בשל ההטרוגניות התוך-גידולית שהוזכרה לעיל, הופקה צלחת אחת בת 6 בארות לכל גישה מכל מטופל, כאשר כל באר מייצגת PDOs מאתר אחר בתוך הגידול המקורי. שני ההליכים בוצעו תחת ארון זרימת אוויר למינרי וכל המכשירים המשומשים עוקרו לפני השימוש. סקירה כללית של הגישה מודגמת באיור 1.
1. הכנת קוביות אגרוז (לגישת C בלבד, אופציונלי)
- ממלאים 50 מ"ל של מלח חוצץ פוספט (PBS) לתוך כד, מוסיפים טבליה אחת של אגרוז (ראה טבלת חומרים), ומערבבים היטב עד להשעיה.
- מחממים את התערובת במיקרוגל במשך 30-40 שניות, תוך הימנעות מרתיחה. לאחר מכן מצננים את התערובת עד שהיא מגיעה ל-47°C.
- יוצקים את תערובת האגרוז לתבנית יציקה אטומה בצורת גליל ונמנעים מהיווצרות בועות. מצננים מיד את הגבס באמצעות מהדק קפוא (-20°C) או על ידי הנחתו על קרח יבש למשך 30 דקות.
2. עיבוד החומר הגידולי
- הכינו קופסת קרח כדי לשמור על חומר הגידול מקורר בדרך מחדר הניתוח למעבדה.
- מעבירים את רקמת הגידול (4-5 סמ"ק) לתוך צינור סטרילי של 50 מ"ל המכיל 25 מ"ל של תרדמת חורף A (ראו טבלת חומרים) המכסה את הגידול ומכניסים את הצינורית לקופסת הקרח.
- תחת ארון זרימת אוויר למינרי, מעבירים את חומר הגידול יחד עם תרדמת A לצלחת פטרי מזכוכית מעוקרת.
- לחסל את הרקמה הנמקית לנתח את כלי הדם בזהירות באמצעות אזמל ומלקחיים רקמות תחת שליטה מיקרוסקופית. זהה רקמה נמקית על ידי אזורים דימומים המציגים גוון חום כתוצאה מדימום, או רקמה המציגה מראה חיוור או לבן יותר ביחס לרקמה בת קיימא סמוכה. שימו לב לא לסחוט או לשבש את הרקמה.
- חותכים את חומר הגידול לשש חתיכות בגודל משוער של 1-2 ס"מ3. חלקו את החתיכות לצלחות פטרי מפלסטיק (n = 6) ממולאות מראש ב-3 מ"ל של מדיום H-GPSA (טבלה 2), כלאחת 22. מניחים את צלחות הפטרי על קרח.
3. הגדרת מסוק הרקמות
- מקם את הלהב כמתואר במדריך היצרן23.
- התאימו את עובי הפרוסה ל-0.45-0.50 מ"מ. כוונו את עוצמת הלהב לבינונית. תקן את ידית שחרור הטבלה למצב "התחל".
4. עיבוד חלקי רקמת הגידול
- עיבוד רקמת הגידול באמצעות המסוק (שיטת C)
- חותכים את קוביות האגרוז לגלילים באורך 2 ס"מ ומדביקים את אחד הצילינדרים הללו על צלחת הפלסטיק העגולה של המסוק באמצעות דבק היסטואקריל (ראו טבלת חומרים).
- צור העמקה בגליל האגרוז באמצעות אזמל, ולאחר מכן הכנס את רקמת הגידול מהבאר הראשונה (שלב 2.5) בתוך בור זה.
הערה: יש לטפל בחומר הגידול בזהירות ולא לסחוט או לדחוף אותו לתוך הפער. המרווח צריך להיות גדול מספיק כדי להתאים את הגידול בקלות, אבל קטן מספיק כדי לשמור על חומר הגידול יציב במהלך תהליך החיתוך. שלבים 4.1.1. ו-4.1.2. הם אופציונליים. - מקם את דיסק הפלסטיק על דיסק ההרכבה של שולחן החיתוך (ראה טבלת חומרים).
- הפעל את המסוק ולחץ על לחצן האיפוס . המסוק מתחיל עכשיו לחתוך (סיבוב ראשון). המכונה נעצרת באופן אוטומטי לאחר שהטבלה מגיעה לסוף וגם אגרוז וגם רקמת הגידול נחתכים לקוטר הרצוי.
- סובב את דיסק ההרכבה ב- 90° ולאחר מכן כוונן את ידית השולחן המשחררת למצב התחלה.
- לחץ על כפתור האיפוס ותן למכונה לחתוך את הרקמה שוב וליצור רקמה בצורת מלבן (סיבוב שני).
- הסר את דיסק הפלסטיק עם החומר המעובד וסובב בזהירות רק את רקמת הגידול ב -90 מעלות באמצעות מרית רקמות.
- הניחו את דיסק הפלסטיק על שולחן החיתוך, לאחר מכן התאימו את ידית השולחן המשחררת למצב התחלה ולחצו על כפתור האיפוס לסיבוב חיתוך סופי (סיבוב שלישי).
- כבה את המסוק והסר את דיסק הפלסטיק. נקו את המסוק ואת הלהבים.
- בעזרת פיפטה חד-ערוצית בנפח 5 מ"ל, שואפים את החומר המעובד יחד עם המדיום לתוך הפיפטה ושוטפים את המתלה בחזרה לצלחת.
- חזור על השלב הקודם 2-3 פעמים כדי להפריד את הרקמה כראוי.
- מחזירים את צלחת הפטרי לקרח וחוזרים על הצעדים (4.1.1-4.1.12) עם 5 הכלים האחרים מכל גידול.
- עיבוד ידני של רקמת הגידול (שיטת M)
- מעבירים את רקמת הגידול מצלחת הפטרי הפלסטית הראשונה (שלב 2.5) יחד עם 3 מ"ל של מדיום H-GPSA (טבלה 2) לצלחת פטרי מזכוכית. חתכו את המקטע ידנית מתחת למיקרוסקופ למקטעים של 0.5 מ"מ באמצעות שני אזמלים.
- מעבירים את הרקמה המנותחת חזרה לצלחת הפטרי מפלסטיק באמצעות פיפטה בנפח 2 מ"ל.
- חזור על שלבים (4.2.1.-4.2.3.) עבור קטעי הגידול בחמש צלחות הפטרי האחרות (שלב 2.5).
5. שטיפת רקמת הגידול
- מטים כל צלחת פטרי כלפי מעלה ל-45 מעלות וממתינים 30 שניות עד שגושי הגידול שוקעים לתחתית המנה.
- יש לשאוף 2.5 מ"ל של מדיום H-GPSA (טבלה 2) בזהירות באמצעות פיפטה של 1 מ"ל ולהיזהר שלא לקחת רקמת גידול כלשהי.
- הוסף 2 מ"ל של חיץ ליזיס RBCs (ראה טבלת חומרים) לכל דגימה. חתיכות הגידול המעובדות חייבות להיות מכוסות לחלוטין על ידי חיץ ליזיס.
- הניחו את 6 הכלים על מכונת ניעור מסלולית במעבדה במהירות איטית למשך 10 דקות.
- יש לשאוף 2 מ"ל של חיץ הליזיס בזהירות כדי לא לקחת שום רקמת גידול.
- חזור על שלבי הכביסה הקודמים (שלב 5.1-5.5) פעמיים באמצעות 2 מ"ל של מדיום H-GPSA (טבלה 2) במקום חיץ ליזיס בכל פעם.
6. טיפוח רקמת הגידול
- שאפו את מדיום H-GPSA (טבלה 2) מכל מנה והחליפו אותו ב-4 מ"ל של מדיום PDO (טבלה 2).
- מעבירים את גושי הרקמה של כל צלחת לבאר אחת בהתאמה של צלחת חיבור נמוכה במיוחד בת 6 בארות (ראו טבלת חומרים).
- הניחו את הצלחת על שייקר אורביטלי בתוך אינקובטור ודגרו בטמפרטורה של 37°C, 5% CO2 ו-150 סל"ד למשך 2-4 שבועות.
- בצע שינוי חצי בינוני כל יומיים על ידי שאיפת 2 מ"ל של מדיום מכל באר והחלפתו ב- 2 מ"ל של מדיום PDO טרי (טבלה 2) שחומם מראש ל- 37 מעלות צלזיוס.
- התבונן ברקמה תחת המיקרוסקופ (מורפולוגיה, צמיחה, צבע בינוני) וחתך PDO גדל (>0.7 מ"מ) או רקמת דבק כדי למנוע היפוקסיה רקמות.
- כדי לעשות זאת, להעביר את PDOs מן החיבור נמוך במיוחד היטב צלחת פטרי זכוכית מעוקר ולהשתמש אזמל לחיתוך. לחלופין, ניתן לפתור PDO דבק על ידי שאיפה אותם עם פיפטה 1 מ"ל. היזהר לא לסחוט את PDOs ולטפל בהם בעדינות.
- הערך את היווצרות ה-PDO על-ידי ספירת ה-PDO כל יומיים ובדוק ביסודיות את המורפולוגיה העגולה הרצויה (איור 2).
7. תיקון והטמעה של PDOs
- תקן שני PDO מכל באר של כל מטופל עם 4% פורמלין במשך 24 שעות לאחר 6 שבועות של תרבית.
- טבלו את ה-PDOs הקבועים בפורמלין חוצץ נייטרלי (נתרן פוספט) עד להטמעה.
- הכנס כל PDO לקלטת (ראה טבלת חומרים) להמשך עיבוד.
- התחל תהליך התייבשות על ידי טבילת הקלטת בתמיסות הבאות כמפורט בהערה להלן:
הערה: 50% אתנול למשך 20 דקות, 70% אתנול למשך 20 דקות, 80% אתנול למשך 20 דקות, 96% אתנול למשך 20 דקות, 100% אתנול למשך 20 דקות, 100% אתנול למשך 30 דקות, 100% אתנול + כלורופורם (יחס של 1:1) למשך 30 דקות, 100% אתנול + כלורופורם (יחס של 1:1) למשך 30 דקות, כלורופורם מוחלט למשך 30 דקות, כלורופורם מוחלט למשך 30 דקות, פרפין למשך 30 דקות, פרפין למשך 30 דקות באמצעות STP 120. - הטמע את PDOs מיובשים בשעוות פרפין ב 58-60 ° C.
- פורסים את מחשבי כף היד המוטבעים בעובי 2.5 מיקרומטר ומרכיבים אותם על שקופיות לצורך צביעה.
8. צביעה immunofluorescence
- הר PDOs לאחר 6 שבועות של תרבות.
- לאחר מכן, יש לבצע צביעה כפולה כנגד חלבון גליה פיברילרי חומצי (GFAP, דילול: 1:100) וסמן ההתפשטות Ki67 (דילול: 1:1000) (ראה טבלת חומרים), כפי שדווח בעבר22.
- באופן דומה, להעריך אפופטוזיס על ידי צביעה כפולה PDOs כנגד GFAP ו anti-caspase-3 (CC3, דילול: 1:400) (ראה טבלה של חומרים).
- צלם תמונות של PDOs באמצעות מיקרוסקופ פלואורסצנטי בהגדלה של פי 40.
- נתחו את התמונות עבור תאים חיוביים ל-GFAP, Ki67 ו-CC3, כמו גם תאים חיוביים כפולים של GFAP/Ki67 ו-GFAP/CC3.
- השתמש בתוכנית הקוד הפתוח פיג'י (ImageJ-win 32) לניתוח תמונות.
9. הערכה וניתוח נתונים
- צלם תמונות שדה בהיר מיקרוסקופיות יומיות במהלך השבוע הראשון של התרבית בהגדרות סטנדרטיות ובהגדלה פי 5.
- התבונן בשינויים המורפולוגיים ועקוב אחר תהליך ההתבגרות הן בגישות עיבוד ידניות והן בגישות עיבוד אוטומטיות.
- בצע ניתוח מורפולוגי באמצעות המיקרוסקופ בהגדרות מצב brightfield סטנדרטיות.
- הערך את מספר ה- PDO והמורפולוגיה במהלך 4 השבועות הראשונים של התרבית ב- PDO מכל חמשת החולים.
- קבל שלוש קריאות של כל ספירת PDO מכל מטופל כדי לחשב את הממוצע ואת שגיאת התקן של הממוצע (SEM).
- לחקור התפשטות ואפופטוזיס ב- PDO משלושה חולים.
- נתח את הנתונים באמצעות חבילת תוכנה סטטיסטית זמינה מסחרית (ראה טבלת חומרים).
- החל מבחני Students-T ו- Mann-Whitney U כדי לקבוע הבדלים בין דור PDO ידני ואוטומטי במונחים של ספירת PDO, התפשטות ואפופטוזיס.
תוצאות
ארבעה חולים עם GBM ואחד עם LGG נכללו לאחר אישור פתולוגי על ידי נוירופתולוג מנוסה (CMM). לרוב החולים היה מקדם MGMT ללא מתילציה, וכל חולי GBM היו מסוג IDH1 ו-IDH2 פראיים (טבלה 1). בממוצע, תהליך הייצור נמשך 88.8 דקות (+/- 6.3 דקות) בגישת C ו-322 דקות (+/- 17.2 דקות) בגישת M. שיעור ההצלחה הכולל היה 87% במדריך ו -93% בגישת המסוק לאחר 4 שבועות של תרבית (n = 5). יתר על כן, PDOs שנגזרו מקבוצת C הגיעו לצורה המעוגלת הרצויה תוך שבוע אחד והיו בוגרים מספיק כדי לשמש בניסויי מבחנה , בעוד שה-PDOs של קבוצת M נותרו לרוב בעלי קצוות חדים ולא מוגדרים (איור 2). רקמת הגידול שעובדה בגישת C הביאה ל-281 PDOs (ממוצע למטופל = 56 +/- 43) לאחר השבוע הראשון של התרבית, בעוד 250 PDOs (ממוצע למטופל= 50 +/- 41) התפתחו בגישת M. במהלך השבוע השני של התרבית, הרקמה של כל חמשת החולים הניבה מספרי PDO גבוהים יותר כאשר הם נוצרו בגישת C (801; ממוצע למטופל= 130 +/- 38) בהשוואה לגישת M (601; ממוצע למטופל= 76 +/- 44; P = 0.018). במהלך השבוע השלישי לתרבית, גישת C צברה בסך הכל 1105 PDOs מכל החולים (ממוצע למטופל = 221 +/- 32) בהשוואה ל-771 PDOs (ממוצע למטופל= 155 +/- 34) בגישת M (P = 0.032). יתר על כן, סך של 1195 PDOs (ממוצע לכל מטופל = 239 +/- 50) שנוצרו לאחר ארבעה שבועות של תרבית כאשר נוצרו עם גישת C לעומת 784 (ממוצע לכל מטופל = 157 +/- 36) באמצעות גישת M (P < 0.01). לכן, שיטת C הראתה ספירת PDOs גבוהה משמעותית החל מהשבוע השני (איור 3). יתר על כן, התנודות היחסיות בספירות PDO הוערכו כדי לחקור את המגמות הדינמיות בין שבועות עוקבים. הניתוח חשף זינוק מרשים בספירת PDO במהלך המעבר הראשוני מהשבוע הראשון לשני בגישת C (265%), מה שהעיד על התקדמות מהירה. לאחר מכן, נרשמה עלייה נמוכה יותר בספירה בשבוע השלישי (75%), המשקפת התאמה זמנית. לעומת זאת, גישת M הראתה עלייה עקבית ויציבה בספירות PDO (92% בשבוע השני, בהתאמה 67% בשבוע השלישי), מה שתרם ליציבות מרשימה בספירה בשבוע הרביעי. מגמת עלייה עקבית זו בספירת PDO מדגישה את האמינות והעמידות של גישת C לאורך כל תקופת התצפית.
שני חולי GBM וחולה LGG אחד נכללו בניתוח מספרי אסטרוציטים (GFAP) בתוך PDOs, התפשטות תאי PDO (Ki67) ואפופטוזיס (CC3). ספירת האסטרוציטים שנקבעה לא גילתה הבדלים משמעותיים בין שתי שיטות העיבוד, עם ממוצע של 43% בגישת C ו-45% בגישת M (איור 4 ואיור 5, איור משלים 1 ותרשים משלים 2). באופן דומה, שיעורי ההתפשטות בתוך PDOs היו דומים בין גישות C (3%) ו- M (1%). רק PDOs שנוצרו בגישת C ממטופל 5 הציגו שיעור התפשטות של 26% בהשוואה ל-1% בגישת M (P = 0.001; איור 4C). שיעורי אפופטוזיס נמוכים בסך הכל זוהו ב-PDO שעובדו בגישת C (3%) בהשוואה ל-2% בגישת M עבור כל החולים, שלא היו שונים באופן משמעותי (איור 5C). יתר על כן, לא היה הבדל משמעותי בין שתי השיטות לגבי מספר האסטרוציטים שעוברים אפופטוזיס (איור 5D).
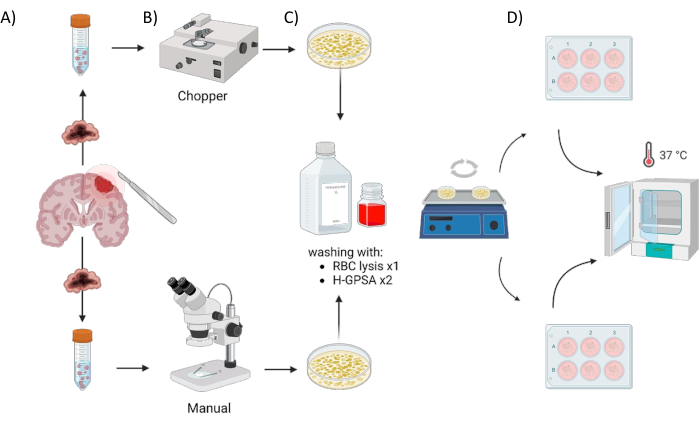
איור 1: סקירה גרפית של תהליך הייצור של אורגנואיד הנגזר ממטופל (PDO) באמצעות מסוק אוטומטי לעומת גישה ידנית. האיור מתאר את השלבים השונים הכרוכים בכך, כולל (A) איסוף דגימות, (B) דיסקציה של חומר גידולי, (C) שטיפה ו-(D) דגירה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
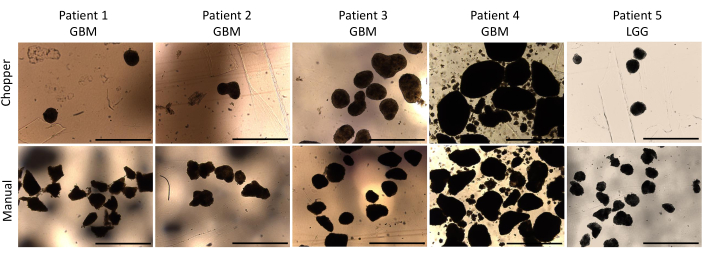
איור 2: מורפולוגיית PDO בשבוע הראשון של התרבית. השוואה בין היווצרות PDOs לאחר דיסקציה הן בשיטה האוטומטית והן בשיטה הידנית. פסי קנה מידה = 1000 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
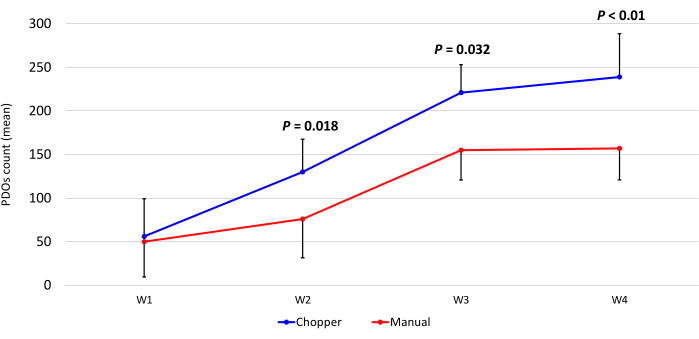
איור 3: ספירת PDO במהלך ארבעת השבועות הראשונים של התרבית. ציר ה-x מציג את הזמן בשבועות (W), וציר ה-y מציג את מספר ה-PDOs של גישת C (כחול) ו-M (אדום) (n = 5). כל נקודת נתונים מייצגת את ספירת הממוצעים, עם קווי שגיאה המציינים את שגיאת התקן של הממוצע. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
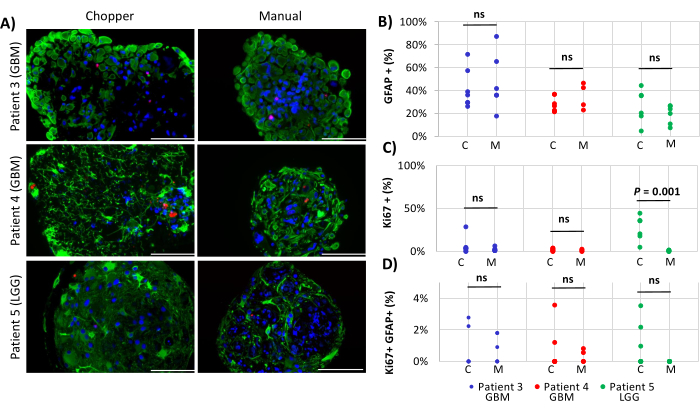
איור 4: שיעורי התרבות תאים בתוך PDOs. (A) תמונות אימונופלואורסצנטיות מייצגות (n = 3) של תאים חיוביים ל-GFAP (ירוק), תאים חיוביים ל-Ki67 (אדום) ו-DAPI (כחול) ב-PDOs ממטופלים 3, 4 ו-5 (טבלה 1). כל PDOs עובדו בשיטות מסוק (C) וידני (M). פסי קנה מידה = 100 מיקרומטר. (B) השוואה בין שתי השיטות לגבי המספר היחסי של תאים חיוביים ל-GFAP, (C) תאים חיוביים Ki67, ו-(D) תאים חיוביים כפולים Ki67/GFAP. תוצאות לא משמעותיות מסומנות על ידי "ns". אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
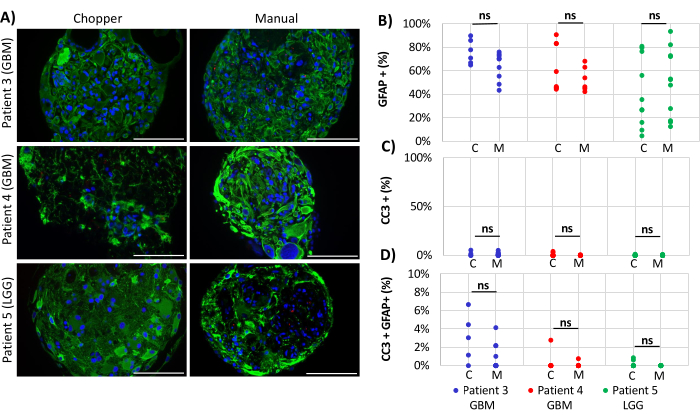
איור 5: שיעורי אפופטוזיס בתוך PDOs. (A) תמונות אימונופלואורסצנטיות מייצגות (n = 3) של תאים חיוביים ל-GFAP (ירוק), תאים חיוביים CC3 (אדום) ו-DAPI (כחול) ב-PDOs ממטופלים 3, 4 ו-5 (טבלה 1). כל PDOs עובדו בשיטות מסוק (C) וידני (M). פסי קנה מידה = 100 מיקרומטר. (B) השוואה בין שתי השיטות לגבי המספר היחסי של תאים חיוביים ל-GFAP, (C) תאים חיוביים CC3, ו-(D) תאים חיוביים כפולים CC3/GFAP. תוצאות לא משמעותיות מסומנות על ידי "ns". אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
טבלה 1: מאפייני המטופלים ופרמטרים קליניים. GBM = גליובלסטומה, סוג IDH-wild, CNS WHO כיתה 4; LGG = גליומה בדרגה נמוכה; KPS = ציון הביצועים של קרנופסקי; MGMT = O 6-methylguanine-DNA methyltransferase; IDH1 = איזוציטראט דהידרוגנאז 1, IDH2 = איזוציטראט דהידרוגנאז 2, ATRX = α-תלסמיה/פיגור שכלי, גן מקושר X; M = מורפולוגיה; CC = ספירת תאים; p = התפשטות; A = אפופטוזיס. אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 2: קומפוזיציות בינוניות. H-GPSA = תרדמת חורף A-Glutamax pencillin streptomycin amphotericin B. PDO = אורגנואידים שמקורם במטופל DMEM: מדיום הנשר המתוקן של דולבקו. NEAA: חומצות אמינו לא חיוניות. Strep עט: פניצילין / סטרפטומיצין אנא לחץ כאן כדי להוריד טבלה זו.
טבלה 3: סקירה כללית של הטכניקות המשמשות ליצירת מודלים של תרביות תאים. אנא לחץ כאן כדי להוריד טבלה זו.
תרשים משלים 1: ערוצים בודדים של צביעת התפשטות של PDOs. (A) DAPI (כחול), (B) תאים חיוביים ל-GFAP (ירוק), (C) תאים חיוביים ל-Ki67 (אדום) ו-(D) תעלות כיסוי ב-PDO ממטופלים 3, 4 ו-5. פסי קנה מידה = 100 מיקרומטר. אנא לחץ כאן להורדת קובץ זה.
איור משלים 2: ערוצים בודדים של צביעת אפופטוזיס של PDOs. (A) DAPI (כחול), (B) תאים חיוביים ל-GFAP (ירוק), (C) תאים חיוביים CC3 (אדום) ו-(D) תעלות כיסוי ב-PDOs ממטופלים 3, 4 ו-5. פסי קנה מידה = 100 מיקרומטר. אנא לחץ כאן להורדת קובץ זה.
Discussion
מחקר זה מציג שיטה מהירה ויעילה ליצירת PDOs. GBM נותר גידול מאתגר לטיפול, המאופיין לעתים קרובות על ידי הישנות ונטל מחלה גבוה 3,6. גישות טיפוליות חדשניות נחוצות בדחיפות, מכיוון שתוצאות מבטיחות שנצפו במבחנה לעתים קרובות אינן מצליחות להוכיח יעילות in vivo במהלך ניסויי שלב I. אחת הסיבות לפער זה יכולה להיות היכולת המוגבלת של קווי תאים אימורטליים שמקורם בחולה, הגדלים בתרביות חד-שכבתיות, לשקף את האינטראקציות המורכבות בין תאים ואת התכונות הגנטיות של הגידול ההורי. בהתחשב בהטרוגניות הבין-גידולית הגבוהה של GBM 8,9, טיפולים מותאמים אישית ממוקדים מועדפים ועשויים להיות מבטיחים ליישומים עתידיים. בניגוד לקווי תאים דבקים דו-ממדיים, לאורגנואידים יש את היכולת לשמור על התכונות של רקמת ההורים21, אך אינטראקציות מורכבות בין תאים לתאים בין הגידול למוח הרגיל הן בעלות חשיבות עליונה וניתן להתעלם מהן באופן פוטנציאלי על ידי מודל זה. עם זאת, ייצור ידני של PDOs הוא תהליך שלוקח זמן, ונזק לרקמות שנגרם על ידי סחיטה עם אזמלים במהלך חיתוך יכול לעכב צמיחה מוצלחת של PDO. לכן, שיטה אוטומטית עברה אופטימיזציה באמצעות מסוק רקמות כדי ליצור מספר גבוה יותר של PDOs עם פחות זמן ומאמץ. בנוסף, הראינו כי שיעורי ההתרבות והאפופטוזיס הכוללים לא היו שונים בין שתי הגישות.
גישת C היא פשוטה, קלה ליישום ומאפשרת יצירה של מספר גדול יותר של PDOs (איור 3). סיבוב הרקמה בין סבב החיתוך השני והשלישי זוהה כשלב קריטי בפרוטוקול. בשלב זה, הרקמה כבר איבדה את שלמותה ויכולה להתפרק בקלות, וכתוצאה מכך חלקים גדולים יותר הדורשים חיתוך נוסף או דיסקציה ידנית מתחת למיקרוסקופ. בעוד שגישת המסוק האוטומטי מאפשרת גודל חיתוך מוגדר מראש בדיוק רב יותר, הגישה הידנית חסרה דיוק בקביעת הגודל של PDOs, מה שמוביל ל-PDO בעלי צורה וגודל לא אחידים, וזה חיסרון לבדיקת תרופות השוואתית (איור 2). עם זאת, בשיטה המוצעת, הסטנדרטיזציה של מספרי תאים לכל PDO אינה מושגת, מה שעלול להוות חיסרון לפרוטוקולים סטנדרטיים לבדיקת תרופות. היתרונות והחסרונות של טכניקות ייצור אורגנואידים שונות 18,19,20,24,25,26,27,28,29,30,31,32,33,34,35,36,
37,38,39,40,41,42 ותחולותיהם מסוכמות בטבלה 3.
רקמת GBM יכולה להשתנות בעקביותה, החל מקשה (אזור חדירה) ועד רכה (ליבה נמקית), מה שיכול להציב אתגרים לגישת המסוק האוטומטי. אם הרקמה קשה מדי, המסוק עלול לסחוט אותה ולפגוע בה, בעוד שרקמות רכות מדי עלולות להימעך. הרקמה שנבחרה הציגה תכונות ייחודיות, כולל רמת ביניים של מוצקות, המתאפיינת באופן ספורדי בצבע ורדרד-אפרפר במקום להפגין שינוי צבע חום או צהוב. רקמה בעלת מרקם ספוגי ומתפורר בקלות הדגימה שימור מעולה בתוך גושי האגרוז, בעוד שרקמת גידול עדינה ונוזלית במיוחד הושמטה מהליך הדגימה. עם זאת, גישת המסוק אפשרה יצירה מוצלחת של מספר גבוה יותר של PDOs בהשוואה לגישה הידנית, אפילו עם רקמה בעלת עקביות תת-אופטימלית. הפתרון העיקרי הוא לשמור על אינטראקציה הדוקה עם המנתח המבצע את כריתת הגידול כדי לעבד רקמות מאזורים שונים של הגידול. במקרים של עקביות רקמה תת-אופטימלית, עיבוד ידני מחדש של הרקמה מתחת למיקרוסקופ היה תוספת מועילה לאחר החיתוך. כדי להסביר את ההטרוגניות, רקמת הגידול חולקה בתחילה לשישה מקטעים, שכל אחד מהם נחתך לאחר מכן בחצי עבור גישת C או M. בתוך ששת החלקים השונים הללו צפויה מידה ניכרת של הטרוגניות. יתר על כן, אפילו בתוך PDOs מאותו קטע או באר, נוכחות של תת-אוכלוסיות נפרדות היא סבירה.
כהוכחת היתכנות, נתוני ההתפשטות והאפופטוזיס דווחו משני חולים עם GBM ומטופל אחד עם LGG, אשר לא מראים הבדלים משמעותיים בין שתי השיטות. הדור של PDOs אינו מוגבל לגידולי מוח ממאירים מאוד, אלא יכול להיות מיושם גם על LGGs. מחקר זה מדגיש כי LGG לעתים רחוקות להציג צמיחה בתרבות 2D, מה שהופך את הפיתוח של מודל מדויק עבור המחקר שלהם בעל ערך רב. פרוטוקול זה נועד להדגים את הרבגוניות של גישה זו ביצירת PDOs מ- GBM כמו גם LGG במהירות וביעילות.
בסך הכל, PDOs יכולים לשמש בעתיד לבדיקות טרום טיפוליות מכוונות מטופל של טיפולים ממוקדים בגידולי מוח ממאירים. מתן שיטה מהירה ויעילה לבדיקת תרופות אישית הוא חיוני, מכיוון שהתקדמות הגידול מתרחשת במהירות, ואפשרויות טיפול בהצלה נחוצות נואשות. כצעד הבא, מודל PDO יכול להיות מוערך עם גישות אימונותרפיות שונות כדי לחקות טוב יותר תגובות טיפול אמיתיות. בעתיד, PDOs יכולים לשמש כדי להסיק מסקנות מתוחכמות לגבי הצורך במחקר נוסף והערכה של טיפולים בסביבה קלינית.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
מחקר זה מומן על ידי המרכז הבינתחומי למחקר קליני (IZKF, B-450) וירצבורג, המרכז הבווארי לחקר הסרטן (BZKF) והפרסום נתמך על ידי Open Access Publishing Fund של אוניברסיטת וירצבורג. ברצוננו להודות לדאגמר המריך וסיגלינדה קונל, שניהם מחלקה לנוירוכירורגיה ניסויית, המחלקה לנוירוכירורגיה, בית החולים האוניברסיטאי וירצבורג, על התמיכה הטכנית. איור 1 נוצר באמצעות www.biorender.com.
Materials
| Name | Company | Catalog Number | Comments |
| 2-mercaptoethanol (1000x) | Gibco | 21985023 | |
| 30% formaldehyde methanol-free | Carl Roth | 4235.1 | Used in 4% concentration |
| 70% ethanol solution | For sterilisation | ||
| Agarose tablets 0.5 g | Carl Roth | HP67.7 | |
| Amphotericin B 250 µg/mL | Gibco | 15290018 | |
| Anatomical forceps | Hartstein | N/A | |
| Anatomical spatula | Hartstein | N/A | |
| B-27 Supplement without vitamin A (50x) | Gibco | 12587010 | |
| Biopsy cassette with cover | Resolab | 37001-b | |
| Blades for McIlwain Tissue Chopper | Campden instruments | Model TC752-1 | |
| CC3 antibody (Asp 175) | Cells signaling technology | 9661 | |
| Disposable scalpel | Feather | 0200130015 | |
| Distilled water | Gibco | 15230089 | To dilute the formaldehyd |
| Dulbecco's Modified Eagle Serum Nutrient Mixture (DMEM) F-12 (1:1) (1x) | Gibco | 11330032 | Includes L-Glutamine and 15 mM HEPES |
| Dulbecco's Phosphate Buffered Saline (PBS) | Sigma Life Sciences | D8537-500ML | Modified, without calcium, chloride and magnesium chloride, liquid, sterile-filtered, suitable for cell culture |
| eBioscience 1x RBC Lysis Buffer | Invitrogen | 433357 | |
| Falcon tube 50 ml Cellstar | Greiner Bio-One | 227261 | |
| GFAP antibody | Santa Cruz Biotechnology | sc33673 | |
| Glass beaker | N/A | N/A | |
| Glass petri dish | N/A | N/A | |
| GlutaMAX (100x) | Gibco | 35050061 | |
| Heracell 240i CO2 Incubator | Thermo scientific | 51032875 | |
| Herasafe 2025 Biological Safety Cabinet | Thermo scientific | 5016643 | |
| Hibernate-A | Gibco | A1247501 | |
| Histoacryl glue | B. Braun surgical | 1050052 | |
| Human Insulin, Solution | Santa Cruz Biotechnology | sc-360248 | |
| Ice box | N/A | N/A | |
| Ki67 antibody | Abcam | ab16667 | |
| McIlwain Tissue Chopper | Cavey Laboratory Engineering | 51350V | |
| Microscope Leica DMI 3000B, DMI 4000B, DMI 6000B | Leica | DMI6000B | For brightfield and immunofluorescence pictures |
| Microscope stereozoom S9D | Leica | W841832 | For manual cutting and to organoids monitoring |
| Microwave | Bosch | N/A | To heat the agarose solution |
| Mounting plastic discs | Cavey Laboratory Engineering | 51354 | |
| N-2 Supplement (100x) | Gibco | 17502048 | |
| NEM Non-Essential Amino Acids (NEAA) (100x) | Gibco | 11140050 | |
| Neurobasal (1x) | Gibco | 21103049 | |
| Orbital shaking machine Rotamax120 | Heidolph | 10304491 | |
| Penicilin Streptomycin | Gibco | 15140122 | |
| Plastic petri dishes Cellstar | greiner bio-one | 628160 | n = 12 |
| Single channel pipette 1000 µm | Eppendorf | 4924000010 | |
| Single channel pipette 5000 µm | Eppendorf | EP3123000276 | |
| Statistical Package for the Social Sciences (SPSS) version 23.0 | IBM | ||
| Surgipath Paraplast | Leica | 39601006 | Embedding medium |
| Ultra-low attachment Nucleon Sphera 6-well plate | Thermo Scientific | 174932 |
References
- Gatto, L., et al. IDH inhibitors and beyond: the cornerstone targeted glioma treatment. Mol Diagn Ther. 25 (4), 457-473 (2021).
- Buckner, J. C., et al. Radiation plus Procarbazine, CCNU, and Vincristine in low-grade glioma. N Engl J Med. 374 (14), 1344-1355 (2016).
- Grochans, S., et al. Epidemiology of glioblastoma multiforme-literature review. Cancers (Basel). 14 (10), 2412 (2022).
- Stupp, R., et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma). N Engl J Med. 352 (10), 987-996 (2005).
- Herrlinger, U., et al. Lomustine-temozolomide combination therapy versus standard temozolomide therapy in patients with newly diagnosed glioblastoma with methylated MGMT promoter (CeTeG/NOA-09): a randomised, open-label, phase 3 trial. Lancet. 393 (10172), 678-688 (2019).
- Stupp, R., et al. Effect of tumor-treating fields plus maintenance temozolomide vs maintenance temozolomide alone on survival in patients with glioblastoma: a randomized clinical trial. Jama. 318 (23), 2306-2316 (2017).
- Desbaillets, N., Hottinger, A. F. Immunotherapy in glioblastoma: a clinical perspective. Cancers (Basel). 13 (15), 3721 (2021).
- Gularyan, S. K., et al. Investigation of inter- and intratumoral heterogeneity of glioblastoma using TOF-SIMS). Mol Cell Proteomics. 19 (6), 960-970 (2020).
- Brennan, C. W., et al. The somatic genomic landscape of glioblastoma. Cell. 155 (2), 462-477 (2013).
- Lathia, J. D., Mack, S. C., Mulkearns-Hubert, E. E., Valentim, C. L., Rich, J. N. Cancer stem cells in glioblastoma. Genes Dev. 29 (12), 1203-1217 (2015).
- Pollard, S. M., et al. Glioma stem cell lines expanded in adherent culture have tumor-specific phenotypes and are suitable for chemical and genetic screens. Cell Stem Cell. 4 (6), 568-580 (2009).
- Timerman, D., Yeung, C. M. Identity confusion of glioma cell lines. Gene. 536 (1), 221-222 (2014).
- Boj, S. F., et al. Organoid models of human and mouse ductal pancreatic cancer. Cell. 160 (1-2), 324-338 (2015).
- Kopper, O., et al. An organoid platform for ovarian cancer captures intra- and interpatient heterogeneity. Nat Med. 25 (5), 838-849 (2019).
- Lee, S. H., et al. Tumor evolution and drug response in patient-derived organoid models of bladder cancer. Cell. 173 (2), 515-528 (2018).
- Bian, S., et al. Genetically engineered cerebral organoids model brain tumor formation. Nat Methods. 15 (8), 631-639 (2018).
- Ogawa, J., Pao, G. M., Shokhirev, M. N., Verma, I. M. Glioblastoma model using human cerebral organoids. Cell Rep. 23 (4), 1220-1229 (2018).
- Linkous, A., et al. Modeling patient-derived glioblastoma with cerebral organoids. Cell Rep. 26 (12), 3203-3211 (2019).
- da Silva, B., Mathew, R. K., Polson, E. S., Williams, J., Wurdak, H. Spontaneous glioblastoma spheroid infiltration of early-stage cerebral organoids models brain tumor invasion. SLAS Discov. 23 (8), 862-868 (2018).
- Hubert, C. G., et al. A three-dimensional organoid culture system derived from human glioblastomas recapitulates the hypoxic gradients and cancer stem cell heterogeneity of tumors found in vivo. Cancer Res. 76 (8), 2465-2477 (2016).
- Jacob, F., et al. A patient-derived glioblastoma organoid model and biobank recapitulates inter- and intra-tumoral heterogeneity. Cell. 180 (1), 188-204 (2020).
- Nickl, V., et al. Glioblastoma-derived three-dimensional ex vivo models to evaluate effects and efficacy of tumor treating fields (TTFields). Cancers (Basel). 14 (21), 5177 (2022).
- Klein, E., Hau, A. C., Oudin, A., Golebiewska, A., Niclou, S. P. Glioblastoma organoids: pre-clinical applications and challenges in the context of immunotherapy. Front Oncol. 10, 604121 (2020).
- Golebiewska, A., et al. Patient-derived organoids and orthotopic xenografts of primary and recurrent gliomas represent relevant patient avatars for precision oncology. Acta Neuropathol. 140 (6), 919-949 (2020).
- Bougnaud, S., et al. Molecular crosstalk between tumour and brain parenchyma instructs histopathological features in glioblastoma. Oncotarget. 7 (22), 31955-31971 (2016).
- Chua, C. W., et al. Single luminal epithelial progenitors can generate prostate organoids in culture. Nat Cell Biol. 16 (10), 951-954 (2014).
- Collingridge, G. L. The brain slice preparation: a tribute to the pioneer Henry McIlwain. J Neurosci Methods. 59 (1), 5-9 (1995).
- Kato, H., Ogawa, T. A technique for preparing in vitro slices of cat's visual cortex for electrophysiological experiments. J Neurosci Methods. 4 (1), 33-38 (1981).
- Teyler, T. J. Brain slice preparation: hippocampus. Brain Res Bull. 5 (4), 391-403 (1980).
- Schulz, E., et al. Preparation and culture of organotypic hippocampal slices for the analysis of brain metastasis and primary brain tumor growth. Methods Mol Biol. 2294, 59-77 (2021).
- Driehuis, E., Gracanin, A., Vries, R. G. J., Clevers, H., Boj, S. F. Establishment of pancreatic organoids from normal tissue and tumors. STAR Protoc. 1 (3), 100192 (2020).
- Driehuis, E., et al. Pancreatic cancer organoids recapitulate disease and allow personalized drug screening. Proc Natl Acad Sci U S A. 116 (52), 26580-26590 (2019).
- Neal, J. T., et al. Organoid modeling of the tumor immune microenvironment. Cell. 175 (7), 1972-1988 (2018).
- Li, X., et al. Oncogenic transformation of diverse gastrointestinal tissues in primary organoid culture. Nat Med. 20 (7), 769-777 (2014).
- Ootani, A., et al. Sustained in vitro intestinal epithelial culture within a Wnt-dependent stem cell niche. Nat Med. 15 (6), 701-706 (2009).
- Zhao, Z., et al. Organoids. Nat Rev Methods Primers. 2, 94 (2022).
- Toh, Y. C., et al. A novel 3D mammalian cell perfusion-culture system in microfluidic channels. Lab Chip. 7 (3), 302-309 (2007).
- Zhang, C., Zhao, Z., Abdul Rahim, N. A., van Noort, D., Yu, H. Towards a human-on-chip: culturing multiple cell types on a chip with compartmentalized microenvironments. Lab Chip. 9 (22), 3185-3192 (2009).
- Homan, K. A., et al. Flow-enhanced vascularization and maturation of kidney organoids in vitro. Nat Methods. 16 (3), 255-262 (2019).
- Huh, D., et al. Reconstituting organ-level lung functions on a chip. Science. 328 (5986), 1662-1668 (2010).
- Kengla, C., Atala, A., Sang Jin, L. Bioprinting of organoids. Essentials of 3D Biofabrication and Translation. , 271-282 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved