התרת אינטראקציות גליקן-חלבון: תהודה מגנטית גרעינית (NMR) להצלה
In This Article
Summary
כאן אנו מציגים פרוטוקול המפרט רכישה, עיבוד וניתוח של סדרת ניסויי NMR שמטרתם לאפיין אינטראקציות חלבון-גליקן בתמיסה. מתוארות רוב המתודולוגיות הנפוצות המבוססות על ליגנדות וחלבונים, אשר ללא ספק תורמות לתחומי הגליקוביולוגיה המבנית ומחקרי הזיהוי המולקולרי.
Abstract
האינטראקציות של גליקנים עם חלבונים מווסתות אירועים רבים הקשורים לבריאות ומחלות. למעשה, הקמת אירועי הכרה אלה והשלכותיהם הביולוגיות קשורים קשר הדוק למבנים התלת-ממדיים של שני בני הזוג, כמו גם לתכונותיהם הדינמיות ולהצגתם על תאי התא המתאימים. טכניקות NMR הן ייחודיות להתרת מאפיינים אלה, ואכן, מתודולוגיות מגוונות מבוססות NMR פותחו ויושמו כדי לנטר את אירועי הקישור של גליקנים עם הקולטנים הקשורים אליהם. פרוטוקול זה מתאר את ההליכים לרכישה, עיבוד וניתוח של שתיים ממתודולוגיות ה- NMR החזקות ביותר המשמשות בתחום הגליקוביולוגיה של NMR, 1H-Saturation Transfer Difference (STD) ו- 1 H,15N-Heteronuclear Single Quantum Coherence (HSQC) ניסויי טיטרציה, המציעים מידע משלים מנקודת המבט של גליקן וחלבון, בהתאמה. ואכן, כאשר הם משולבים הם מציעים ערכת כלים רבת עוצמה להבהרת ההיבטים המבניים והדינמיים של תהליכי זיהוי מולקולרי. גישה מקיפה זו משפרת את הבנתנו את יחסי הגומלין בין גליקן-חלבון ותורמת לקידום המחקר בתחום הגליקוביולוגיה הכימית.
Introduction
זיהוי מולקולרי של גליקנים חיוני לתהליכים רבים הקשורים לבריאות ולמחלות. הספציפיות והסלקטיביות של קולטנים ביולוגיים (לקטינים, נוגדנים, אנזימים) עבור גליקנים תלויה במידה רבה בהתאמת האיזון הרעוע בין המרכיבים השונים של אנתלפיה (CH-π ואן דר ואלס, קשרי מימן, אלקטרוסטטיקה) ואנטרופיה (הידרופוביות, דינמיקה, המסה-המסה)1.
בהתחשב במגוון הכימי הגדול ובאופי הדינמי של גליקנים, שיטות NMR נמצאות בשימוש נרחב לניתוח אינטראקציות גליקן במשך יותר מ -25 שנה2, שכן מתודולוגיות אלה מספקות מידע מעולה על אירועי זיהוי מולקולרי עם פרטים מדויקים, ברזולוציה אטומית 3,4, גם כאשר לא ניתן לאחזר את ראיות האינטראקציה הנדרשות על ידי שימוש במתודולוגיות אחרות. כנקודת מפתח, NMR הוא רב-תכליתי ומאפשר לחקור אירועים דינמיים, ברמה האטומית, בסקאלות זמן שונות, המהווים את הטכניקה הטובה ביותר ללא ספק לחקר המבנה, הקונפורמציה והדינמיקה של גליקנים בתמיסה. עם זאת, התרת מידע זה עשויה להיות תהליך מורכב למדי הדורש שימוש באסטרטגיות מוגדרות היטב יחד עם ניתוח נתונים זהיר5.
טכניקות NMR הן מגוונות, ואכן, ישנן מתודולוגיות רבות שניתן להשתמש בהן כדי לפענח אינטראקציות גליקן-חלבון6. אנו מתארים כאן שתי גישות NMR בסיסיות המשמשות כיום לפענוח אינטראקציות קולטן גליקן 7,8, תוך שימת דגש על האופן שבו ניתן להתיר את ההצגה של אפיטופ המפתח גליקן כמו גם את אתר קישור החלבונים9.
בכל אירוע זיהוי מולקולרי, כאשר קולטן נקשר לליגנד נתון, מתרחש תהליך חילופי כימיקלים המשפיע על פרמטרים רבים של NMR של המשתתפים בקישור10. לכן, מנקודת המבט של NMR, ניתן לעקוב אחר האינטראקציה מנקודת המבט של ליגנד הגליקן או מזה של קולטן החלבון11. באופן כללי, קולטן החלבון הוא ביומולקולה גדולה (תנועה סיבובית איטית, עם קצב בציר הזמן, ולכן הרפיה רוחבית מהירה), בעוד שהגליקן המקיים אינטראקציה יכול להיחשב כמולקולה בגודל קטן-בינוני (תנועה סיבובית מהירה, עם קצב בציר הזמן ps, והרפיה רוחבית איטית)12. מנקודת מבט סטנדרטית, אותות ה-NMR של הגליקן צרים, בעוד אלה של הקולטן רחבים13.
שיטות NMR מבוססות ליגנד מסתמכות על השינוי הדרמטי שחווים פרמטרים רבים של NMR גליקני בעת מעבר מהמצב החופשי למצב המוגבל14. STD-NMR היא טכניקת ה-NMR הניסיונית הנפוצה ביותר להערכת תכונות קשירת גליקן מגוונות15, החל מהסקת קיומה של קשירה במצב תמיסה ועד לקביעת אפיטופ קשירת גליקן; כלומר, האטומים של הליגנד הנמצאים במגע עם קולטן החלבון16.
לחלופין, שיטות NMR מבוססות קולטן מנטרות את השינויים המתרחשים באותות של קולטן החלבון בנוכחות הגליקן ביחס לאלה שנרשמו עבור מצב apo17. אלה מתמקדים בעיקר בסינון הפרעות השינוי הכימי של אותות החלבון בין שני המצבים. הניסוי הנפוץ ביותר הוא 1 H-15N HSQC, או חלופות TROSY18.
השילוב של שתי הגישות מאפשר יישום תמ"ג במערכות רבות ומגוונות המציגות מגוון רחב של זיקות. עם זאת, עבור שיטות NMR מבוססות קולטן, בניגוד לאלה המבוססות על ליגנד, כמות גדולה יחסית של חלבון מסיס, לא מצטבר ויציב מסומן איזוטופ (15N) חייב להיות זמין.
נתאר כאן את שתי השיטות, תוך הדגשת נקודות החוזק והחולשה שלהן. שים לב שהשלבים הבסיסיים המתוארים בפרוטוקול משמשים דוגמאות לשימוש בספקטרומטרים של Bruker. כתוצאה מכך, שמות הפקודות והפרמטרים מתיישרים עם אלה המשמשים ב- TopSpin (תוכנת בקרת הספקטרומטרים של Bruker).
Protocol
1. הפרש העברת רוויה NMR (STD-NMR)
הערה: השורות הבאות מתארות נהלים בסיסיים לרכישה, עיבוד וניתוח של ניסויי STD-NMR. צעדים אלה משמשים להדגמת התועלת של הטכניקה לאיתור קשירת ליגנדים ולהבהרת אפיטופ קשירת הליגנד. להבנה מעמיקה יותר של התכנון והרכישה של ניסויי NMR, עיין במדריך היצרן המתאים המצורף למכשיר ה- NMR.
- רכישה
- הכינו את הדגימה עם קומפלקס ליגנד החלבון. השתמש ביחסים מולאריים של גליקן:לקטין בין 10:1 ל-100:1 עם ריכוזי חלבון הנעים בין 0.01 ל-0.2 מילימול. לאינטראקציה של hGalectin-7 עם LacNAc, השתמש בחלבון 50:1: יחס ליגנד במי מלח חוצצי פוספט ב- pH 7.4.
הערה: קולטן החלבון צריך להיות טהור ולהיות מסיס במאגר המועדף (במקרה של ניסויי STD-NMR, גרסאות מפורקות של המאגר המתאים עדיפות כדי להפחית את הפרעות האות האפשריות של 1H NMR). ריכוז החלבון נבדק מראש באמצעות ספקטרופוטומטר למדידת הספיגה ב-280 ננומטר. - מהתמיסה המוכנה, להעביר נפח כולל של 0.6 מ"ל לצינור NMR 5 מ"מ באמצעות פיפטה.
- הכן את מכשיר ה- NMR בטמפרטורה הנדרשת (טמפרטורות הניסוי הנפוצות נופלות בין 10 ° C ל 45 ° C). פתח את צג בקרת הטמפרטורה באמצעות הפקודה edte והגדר את הטמפרטורה הרצויה. עבור מחקר hGalectin-7 / LacNAc, הטמפרטורה נקבעה ל 25 ° C.
- צור ערכת נתונים חדשה המכילה את רצף הדופק zg.
- לפעולה פשוטה, פתח ניסוי קיים והקלד את הפקודה edc . מופיעה תיבת דו-שיח, מגדירים את הכותרת, את המאפיינים (מפרטים לדוגמה, ממס) וכמה פרמטרים של הניסוי.
- אם נדרש שינוי מרצף הדופק המקורי, נווט בחלונות ased (פרמטרים) ו - AcquPars (פרמטרי רכישה). בשלב זה, בחר את תוכנית הדופק הרצויה מספריית הספקטרומטר.
- עבור ספקטרום NMR סטנדרטי של 1H, בחר את רצף פעימות zg מהרשימה הזמינה.
הערה: במקרה של דגימות עם תכולת מים מוגברת, ייתכן שיהיה צורך להשתמש בתוכניות דיכוי מים כדי להגדיל את יחס האות לרעש. רצוי להשתמש ברצפי פולסים כגון zgesgp, אשר מודולי פיסול עירור המספקים דיכוי מצוין אך שולטים בפאזה של האותות הנותרים. עיין במדריך NMR של היצרנים לקבלת מידע נוסף על סוגי תוכניות דיכוי מים ומאפייניהם העיקריים.
- הכנס את דגימת ה- NMR לבדיקה על ידי הפעלת אוויר הרמת הדגימה. השתמשו בפקודת ej, מקמו את הדגימה על גבי המגנט ונטרלו את הרמת הדגימה באמצעות הפקודה ij.
הערה: כדי להזריק את הדגימה למגנט באמצעות דוגם אוטומטי, השתמש בפקודה sx ואחריה מספר המיקום, n, המתאים למיקום צינור NMR במגש הדוגם האוטומטי. - נעל את אות הממס על ידי הקלדת נעילת הפקודה ולאחר מכן בחירת הממס המתאים מהתפריט.
- לאחר הכנסת הדגימה לבדיקה, השלם את תהליך הכוונון וההתאמה באמצעות atma המודול האוטומטי או כספומט המודול הידני.
- התחל את השיימינג האוטומטי באמצעות הפקודה topshim gui. פעולה זו תפתח ממשק גרפי שבו shim dimension 1D ייבחר ויופעל.
הערה: כדי למזער את חוסר היציבות עקב שינויים עדינים בשדה או בטמפרטורה, ניתן להפעיל אוטושים לצורך רכישת הניסוי. זה יכול להתבצע על ידי גישה לחלון הבקרה BSMS ולחיצה על autoshim. ההפיכה לסימון ירוק מעידה על כך שאוטושים הופעלו. שים לב כי בעת השימוש autoshim, בעיות פוטנציאליות של חוסר יציבות מדגם חייב להיות מבחין. לכן, זהירות מומלץ כאשר autoshim מועסק. - קבע את הדופק של 1H 90°. זה יכול להתבצע באופן אוטומטי באמצעות הפקודה הדופקת .
- שנה פרמטרים שונים בחלון AcquPars. עבור ספקטרום NMR רגיל של 1H, הגדר את מספר הסריקות (NS) על 32, ואת החלון הספקטרלי הרצוי (SW) על ca. 12 עמודים לדקה.
הערה: רצף פעימות zgesgp כולל מודול לדיכוי ממס כדי לחסל את אות HDO השיורי, אשר צריך להיות ממורכז באמצע הספקטרום. למטרה זו, O1 חייב להיות מוגדר במדויק ב - AcquPars. - הגדר את רווח המקלט כדי למנוע גלישה עם הפקודה האוטומטית rga.
- כעת, רכוש את ספקטרום ה- NMR הסטנדרטי של 1H באמצעות הפקודה zg.
- לאחר השלמת הרכישה, עבד את הספקטרום באמצעות הפקודה efp. החל את תיקוני קו הבסיס והפאזה באמצעות שורת התפריטים TopSpin.
הערה: נצפים אותות NMR של 1H שמקורם בגליקן ובחלבון (איור 1). ניתוח מפורט של ספקטרום ה- NMR הנרכש מומלץ לביצוע ניסוי ה- STD NMR, כמפורט בסעיף 1.1.14. - צור מערך נתונים חדש והעלה את רצף פעימות STD NMR לשימוש באותו אופן המתואר עבור ניסוי 1 HNMR בסעיף 1.1.4. במכשירי Bruker, רצפי פולסים שונים זמינים בקטלוג תוכניות הדופק, כולם נקראים stddiffXXX. הפשוטה ביותר (stddiff) אינה כוללת שום סכימת דיכוי מים או מסנן דיכוי חלבונים.
- עבור דוגמאות עם תוכן H2O משמעותי, בחר את הרצפים stddiffgp19 או stddiffesgp, הכוללים שער מים או מודול פיסול עירור. במקרה של ספקטרום עם אותות NMR חלבוניים אינטנסיביים כרקע, בחר את רצפי stddiffXXX.3. בכל מקרה, מטב את הפרמטרים הספציפיים המתאימים עבור כל מודול דיכוי מים (כלומר, d19 בתוכניות ווטרגייט).
- הגדר את תדרי הכיבוי והתהודה עבור ניסוי STD NMR. מצא את רשימת התדרים בפרמטרים AcquPars של החלון ased תחת הערך FQ2LIST. את התדרים המוגדרים בתהודה ומחוץ לתהודה בהרץ יש לכתוב ידנית ברשימה ולשמור תחת שם חדש. רשימה חדשה זו תשמש בניסוי STD-NMR.
- בחרו את תדר התהודה באזור ספקטרלי נטול אותות גליקנים, בדרך כלל בסביבות δ(1H) 0 או 6.6 ppm, עבור גליקנים טיפוסיים (איור 1). הגדר את תדירות התהודה באזור שאינו מציג ליגנד או פרוטון חלבון. זה יכול להיות מוגדר בבטחה ב +18000 או -18000 הרץ.
- הגדר את הפולס המעוצב שישמש בזמן הרוויה בפרמטרים AcquPars של חלון ased .
הערה: ישנן אפשרויות רבות. ניתן להשתמש בבטחה בצורות Gaussian או Eburp, עם רוחב של 90° של פולס סלקטיבי של 50 אלפיות השנייה. - הגדר את הפרמטרים המתאימים במקטע AcquPars.
- הגדר את אורך הפולס של 1H 90°.
- קבעו את ערך ההספק של הפולס המעוצב (המוערך באמצעות הכלי צורה).
- הגדר את זמן הרוויה הכולל. ניתן להשתמש בערכים בין 1 s ל- 4 s באופן קבוע.
- הגדר את עיכוב ההרפיה ל -3 שניות.
- הגדר את מספר הסריקות (NS) לכפולה של 8. בדרך כלל, הוא מוגדר על 256, 512 או 1024 כדי לקבל את יחס האות לרעש הנכון בקבוצות של 2 בכל תדר.
- הגדר את מספר סריקות הדמה (DS) ל- 8.
- הגדר את מספר הנקודות ב- F2 ל- 16k, 32k או 64k.
הערה: מספר גדול יותר של נקודות ב- F2 יביא לשיפור הרזולוציה ויחס אות לרעש. מסיבה זו, מומלץ מאוד להשתמש במינימום של 16,000 נקודות נתונים. - הגדר את מספר הנקודות ב- F1. זהו מספר התדרים שיש להשתמש בהם, במקרה זה, 2 (on-resonance ו- off-resonance).
הערה: על פי המוסכמות, F2 מתייחס לממד הישיר, הממד שלאורכו נדגמת דעיכת האינדוקציה החופשית (FID) ישירות, בעוד F1 מציין את הממד העקיף. - הגדר את רווח המקלט (RG) כדי למנוע גלישה באמצעות הפקודה האוטומטית rga.
- חשב את הזמן של הניסוי הכולל באמצעות הפקודה expt.
- שלח את הניסוי לרכישה באמצעות הפקודה zg.
- בדוק תמיד שהניסוי פועל כראוי לאחר מספר דקות.
- הכינו את הדגימה עם קומפלקס ליגנד החלבון. השתמש ביחסים מולאריים של גליקן:לקטין בין 10:1 ל-100:1 עם ריכוזי חלבון הנעים בין 0.01 ל-0.2 מילימול. לאינטראקציה של hGalectin-7 עם LacNAc, השתמש בחלבון 50:1: יחס ליגנד במי מלח חוצצי פוספט ב- pH 7.4.
- עיבוד
הערה: ספקטרום פסאודו-דו-ממדי מתקבל לאחר החלת הפרוטוקול המתואר לעיל. מספר השורות מתאים למספר התדרים המועסקים, בדרך כלל שניים: on-resonance ו-off-resonance.- עבד את ה- FID עבור הניסוי הראשון.
- בצע את התמרת פורייה של מספר fid 1 (באמצעות הפקודה efp) ובחר את היעד של הספקטרום המעובד (בחר מספר procno). לחלופין, השתמש בפקודה rser 1 כדי לקרוא את ה- fid הראשון.
- לאחר מכן, התאם את גורם הרחבת הקו באמצעות פקודת lb (בדרך כלל 3-5 הרץ), ואת הפאזה. כדי לשלב באופן ידני, לחץ על הכרטיסייה תהליך ולאחר מכן התאם את תפריט המשנה שלב . בצע אפס ותיקונים מסדר ראשון על ידי לחיצה וגרירה על הכפתור המתאים. שמור את תוצאות ההפסקה. בנוסף, בצע תיקון קו בסיס באמצעות שרירי הבטן של הפקודה.
- קרא את ה- fid עבור הניסוי השני, ובצע את התמרת פורייה (באמצעות פקודת efp) עם אותו גורם הרחבת קו. התאם את הפאזה עם אותם פרמטרי פאזה ותיקון קו בסיס ושמור את הספקטרום המעובד עם קוד אחר.
- קרא את שני הספקטרום המעובד עם הפונקציה המרובה ( פקודה: .md) והחסר אותם (off-resonance - on-resonance) באמצעות הלחצן הזמין בתצוגה חזותית מרובה (Δ). הספקטרום החדש הוא ספקטרום STD NMR, שנשמר עם קוד אחר.
- בצע סופראימפוזיציה של ספקטרום STD NMR עם ספקטרום מחוץ לתהודה.
- פתח את ספקטרום התהודה (fid 1) והקלד את הפקודה .md כדי לפתוח את חלון התצוגה המרובים. לאחר מכן, העלה את ספקטרום מחלות המין.
- השווה את התדרים והעוצמות (מוצגים אוטומטית בצד ימין למעלה) של האותות בספקטרום STD NMR. זה מספק את המידע הרצוי על אותם פרוטונים הקרובים לחלבון וקרבתם היחסית. ככל שהעוצמה היחסית גבוהה יותר, כך הם קרובים יותר לחלבון (איור 2).
- מדוד את העוצמות (אינטגרלים) בניסוי מחוץ לתהודה באמצעות התוכנה המתאימה. ב- TopSpin, עבור אל ניתוח > שילוב. הגדר את האזורים וכתוב את האינטגרלים בקובץ (I0).
- למדוד את העוצמות (אינטגרלים) בניסוי STD NMR באמצעות אותם פרמטרים ולכתוב אותם בקובץ (ISTD).
- חשב את ערך STD עבור כל אות פרוטון באמצעות המשוואה הבאה:
STD = (ISTD)/I0.
הערה: הערה: השימוש בשילוב אותות לחישוב ערכי STD דורש שאותות פרוטונים יהיו מופרדים במידה מספקת. כאשר מתרחשת חפיפת אות, כגון עם אוליגוסכרידים, ניתן לקבוע ערכי STD על ידי הערכת יחס עוצמת האות בין ספקטרום STD וספקטרום מחוץ לתהודה. - חשב את מחלת המין היחסית באחוזים. כדי לעשות זאת, תן ערך של 100% לפרוטון המציג את ההבדל המרבי בין העוצמות בספקטרום ה- NMR של Off-resonance לבין ספקטרום ה- NMR של STD. חשב את עוצמות STD היחסיות עבור הפרוטונים האחרים בהתאם.
הערה: ניתוח נכון של נתוני STD, במיוחד לקביעת אפיטופ קשירת ליגנד, דורש הקצאה מלאה של אותות 1H של הליגנד. לכן, מומלץ מאוד להשלים משימה זו לפני רכישת ספקטרום STD.
- עבד את ה- FID עבור הניסוי הראשון.
2. 1ניסויי H-15N HSQC
הערה: השורות הבאות מפרטות את השימוש בניסויי H-15N HSQC 1 כדי לעקוב אחר השינויים בשינויים הכימיים של תהודה של 1H ו- 15N NMR של הקולטן (לקטין) בתגובה לנוכחות כמויות הולכות וגדלות של ליגנד (אוליגוסכריד)19. ניתוח Chemical Shift Perturbation (CSP) המבוסס על הנתונים שחולצו הוא בעל ערך רב לזיהוי שותפים קושרים אך גם למיפוי ממשק קשירת החלבונים ולקביעת זיקות קשירה. להבנה מעמיקה יותר של התכנון והרכישה של ניסויי NMR, עיין במדריך היצרן המתאים המצורף למכשיר ה- NMR.
- רכישה ועיבוד
- הכן את המדגם עם lectin של עניין. ודא שהקולטן מסומן במלואו ב-15N בכל שאריות חומצות האמינו, הן בעמוד השדרה והן בשרשראות הצדדיות. בדרך כלל, כדי לזהות את פסגות הצלב HN הניתנות להחלפת מים בספקטרום, השתמש בתערובת 90:10 של H2O: D2O כדי להכין את התמיסה האגירה. ריכוזי הלקטין הנדרשים נעים בין 0.05 ל-0.2 מילימול, בהתאם לזמינות הקולטן 15N ויחס האות לרעש הדרוש.
הערה: החלבון צריך להיות יציב במשך כל תקופת הניסוי ללא יצירה נראית לעין של משקע בצינור NMR. יתר על כן, זה צריך להיות טהור ומסיס במאגר שנבחר. ההקצאה המלאה של 1H ו-15N של פסגות הצלב של HSQC הייתה צריכה להתבצע קודם לכן, כך שכל פסגה צולבת בספקטרום HSQC מזוהה עם תווית המתאימה לשאריות חומצות האמינו הספציפיות. - מתוך הכנה זו, להעביר נפח כולל של 0.6 מ"ל צינור NMR 5 מ"מ.
- הגדר את מכשיר ה- NMR בטמפרטורה הנדרשת. ראה שלב 1.1.3 ובצע את אותן פעולות.
- צור ערכת נתונים חדשה. ראה שלב 1.1.4 וחזור על הפעולות.
- הוסף את דגימת ה- NMR לבדיקה כמתואר בשלב 1.1.5.
- נעל על אות הממס. כדי להתחיל את הליך הנעילה, השתמש בנעילת הפקודה ובחר את הממס המתאים מהתפריט. ניתן לעקוב אחר אות הנעילה בחלון הנעילה. הגדר את רווח המנעול כך שאות הנעילה יהיה גלוי בחלון הנעילה.
- השלם את תהליך הכוונון וההתאמה באופן אוטומטי (באמצעות הפקודה atma) או באופן ידני (פקודת הכספומט תפתח את חלון בקרת הכספומט כדי להתאים את עקומת הנדנוד).
- הגדר את השימסים האופטימליים באמצעות הכלי TopShim. השתמש בפקודה topshim gui. ראה הוראות בשלב 1.1.8.
- קבע את אורך הפעימה של 1H 90° (כמתואר בשלב 1.1.9) ואת תדירות ההיסט (הפקודה o1calib תפעיל שגרת כיול O1 אינטראקטיבית, תוך אחזור תדר ההסטה). פרמטר מאוחר זה חשוב ביותר כאשר ניסויים עם תוכניות דיכוי ממס מופעלים.
- צור ערכת נתונים חדשה כמתואר בסעיף 1.1.4. כדי להפחית או למנוע את ההפרעה של אות H2O, השתמש ברצף הדופק zgesgp.
- הגדר את הניסוי על-ידי שינוי פרמטרים שונים בחלון AcquPars.
- הצג את אורך הפולס וההיסט של 1H 90° (o1) כפי שנקבע קודם לכן, והגדר את מספר הסריקות (NS) ל- 32 ואת החלון הספקטרלי (SW) בסביבות 12 עמודים לדקה.
- קבעו את עוצמת הפולס המעוצב בעזרת הכלי צורה הזמין בשורת התפריטים Topspin.
- הגדר את רווח המקלט באמצעות הפקודה האוטומטית rga.
- לרכוש את הניסוי באמצעות הפקודה zg ולעבד את FID שנוצר כדי לקבל אתספקטרום 1 H NMR.
- צור ערכת נתונים חדשה שתשמש לרכישת ניסוי 1 H-15N HSQC NMR. בכרטיסייה AcquPars, בחר את תוכנית הדופק hsqcetfpf3gp הזמינה בקטלוג תוכניות הדופק.
- הגדר את הניסוי. טען את הצורות, העוצמות והזמנים המוגדרים כברירת מחדל באמצעות הפקודה getprosol. לאחר מכן, עדכן את הערכים של אורך פולס והיסט של 1H 90°.
- הגדר את הפרמטרים הבאים.
- הגדר את עיכוב ההרפיה על 1-5 שניות.
- הגדר את מספר הסריקות לכפולה של 4. בדרך כלל, הוא מוגדר ל- 8, 16, 32 או 64 כדי לקבל את יחס האות לרעש הנכון.
- הגדר את מספר סריקות הדמה ל- 128.
- הגדר את מספר הנקודות ב- F2 ל- 1k, 2k או 4k.
- הגדר את מספר הנקודות ב- F1: מספר ההפרשים הקבועים של t1 שיש להשתמש בהם. בהתאם לחלון הספקטרלי, זה בין 128 ל 256.
- התאם את מרכז החלון הספקטרלי בממד 15N ל- δ- 117 עמודים לדקה והגדר את הרוחב הספקטרלי המתאים ל- 36 עמודים לדקה. ערכים אלה צריכים להיות ממוטבים עבור כל מערכת מסוימת.
- הגדר את רווח המקלט כדי למנוע גלישה (באמצעות הפקודה rga )
- חשב את זמן הניסוי הכולל. זמן ניסוי טיפוסי הוא כשעה.
- הקלד zg כדי לשלוח את הניסוי לרכישה.
הערה: בדוק תמיד שהניסוי פועל כראוי לאחר מספר דקות. - עבד את ה- FID באמצעות הפקודה xfb. בצע את תיקון קו הבסיס באמצעות הפקודה abs2 ותיקוני פאזה בכרטיסיה תהליך. כדי לבצע פאזה ידנית, לחץ על תפריט המשנה של שלב ההתאמה ולאחר מכן בחר מספר פסגות צולבות של הספקטרום הדו-ממדי. לאחר מכן, החל ברצף אפס ותיקונים מסדר ראשון הן על שורות והן על עמודות על ידי לחיצה וגרירה על הלחצן המתאים. שמור את תוצאות ההפסקה.
- שמור את הספקטרום הדו-ממדי שנוצר.
- הכינו תמיסת מלאי מרוכזת מאוד של הליגנד. ערכים אופייניים הם 50-100 mM.
- מתמיסת המלאי המרוכזת מאוד של הגליקן, העבירו את הנפח המתאים (כמה מיקרוליטרים) לצינור NMR המכיל את הקולטן כדי לקבל את החלבון הרצוי: יחס ליגנד מולארי ולרשום את הספקטרה.
הערה: שלב זה מתחיל את סדרת הטיטרציה, שבה הליגנד עובר טיטרציה לתוך דגימת החלבון. יש לקבוע את יחסי החלבון-ליגנד המתאימים לכל מקרה ומקרה. אם הזיקה המחייבת אינה ידועה לחלוטין, מומלץ להשתמש בכמויות סובסטויכיומטריות של הליגנד בנקודות הראשונות. - בצע את שלבים 2.1.1 עד 2.1.19 עבור המדגם החדש שהוכן.
- חזור על שלבים 2.1.21 ו- 2.1.22 עבור דגימות עם יחס חלבון לליגנד הולך וגדל.
הערה: ההתאמה המדויקת של נתוני סדרת הטיטרציה דורשת רכישה של מספר ניסויים1 H-15 N-HSQC, המכסים מגוון רחב של יחסי חלבון-ליגנד, כולל אלה הדרושים להשגת רוויית חלבון.
- הכן את המדגם עם lectin של עניין. ודא שהקולטן מסומן במלואו ב-15N בכל שאריות חומצות האמינו, הן בעמוד השדרה והן בשרשראות הצדדיות. בדרך כלל, כדי לזהות את פסגות הצלב HN הניתנות להחלפת מים בספקטרום, השתמש בתערובת 90:10 של H2O: D2O כדי להכין את התמיסה האגירה. ריכוזי הלקטין הנדרשים נעים בין 0.05 ל-0.2 מילימול, בהתאם לזמינות הקולטן 15N ויחס האות לרעש הדרוש.
- ניתוח
- דמיינו את ספקטרום HSQC הדו-ממדי המעובד עבור מיני ה-apo באמצעות התוכנה המתאימה: TopSpin, MestReNova ו-CCPNMR הן כולן תוכנות מתאימות לטיפול בנתוני NMR.
הערה: זהו ספקטרום טביעות האצבע של החלבון. השינויים הכימיים שנצפו 1H ו 15N תלויים בסביבה הכימית המתאימה של כל חומצת אמינו, אשר תלוי מאוד במבנה 3D של החלבון. ספקטרום זה נקרא ספקטרום טביעות האצבע של החלבון. ספקטרום HSQC דו-ממדי 1 H-15N מפוזר היטב, שבו כל הפסגות הצולבות מציגות עוצמות אחידות, מצביע על נוכחות של חלבון מקופל היטב19. - צור את הרשימה של 1H ו 15N תדרים עבור כל פסגות הצלב. השימוש בתוכנות משלימות, כגון תוכנית CCPNMR20, יכול לסייע בתהליך.
- הנח את הספקטרום של נקודות הטיטרציה הראשונה או השנייה על זה של חלבון apo.
- לשם כך, פתח את הספקטרום הדו-ממדי המתאים למצב apo, לחץ על הכרטיסייה תצוגה מרובה ולאחר מכן הוסף את הספקטרום הדו-ממדי השני. הבדיקה החזותית של שני הספקטרום מספקת מידע על קיומה של אינטראקציה בין הליגנד לבין החלבון.
הערה: מנקודת מבטו של החלבון, קיומו של קישור מספק שינויים בסביבה הכימית של חומצות האמינו המעורבות ישירות באירוע הזיהוי, עם הפרעות שינוי כימיות מקבילות (CSP).
- לשם כך, פתח את הספקטרום הדו-ממדי המתאים למצב apo, לחץ על הכרטיסייה תצוגה מרובה ולאחר מכן הוסף את הספקטרום הדו-ממדי השני. הבדיקה החזותית של שני הספקטרום מספקת מידע על קיומה של אינטראקציה בין הליגנד לבין החלבון.
- חזור על שלבים 2.2.2 ו- 2.2.3 עבור כל נקודת טיטרציה, וצור רשימות של התדרים 1H ו- 15N עבור כל פסגות הצלב בספקטרום השונה, המתאימות ליחסים מולאריים שונים של ליגנד חלבון.
הערה: ניתן למדוד את השינויים הכימיים בכל נקודת טיטרציה ללא צורך לבצע הקצאה חוצת פסגות חדשה. במקרה של משטר חליפין מהיר, הנפוץ באינטראקציות לקטין:גליקן, אפשר פשוט לעקוב אחר התנועה המתקדמת של פסגות לאורך הטיטרציה. - בדוק כי, עבור נקודת הטיטרציה האחרונה, אין בעצם הפרעות שינוי כימיות ביחס לתוספת הקודמת. עובדה זו מעידה על כך שאתר קשירת החלבון היה רווי בליגנד, שנמצא בעודף גבוה.
- חשב את הפרעות ההזזה הכימיות המרביות (maxCSP) באמצעות המשוואה הבאה:
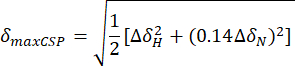
ΔH ו-ΔδN הם הבדלי ההסטה הכימיים בתדרים 1H ו-15N בין מצב apo לנקודת הטיטרציה האחרונה, בהתאמה. - התווה את הפרעות ההסטה הכימיות המרביות (maxCSP) בציר y אנכי של תרשים דו-ממדי לעומת שאריות חומצות האמינו המתאימות (בציר x האופקי).
- בצע בדיקה חזותית של שאריות חומצות האמינו המציגות את ה- CSP המרבי בין מצב החסימה למצב apo של החלבון. סביר מאוד להניח שהם שייכים לאתר המחייב או שהם שכנים שלו.
- אם המבנה התלת-ממדי של החלבון זמין, פתח את ה-PDB המתאים עם התוכנה המתאימה כגון PyMOL או BIOVIA Discovery studio. תוכניות הדמיה מולקולרית אלה נמצאות בשימוש נרחב ביישומי ביולוגיה מבנית. בחר את השאריות המציגות את ה- maxCSP הגבוה ביותר (מעל פעמיים סטיית התקן) עם צבע מסוים כדי להתאים את אתר האיגוד המשוער.
- במקרה של משטר חליפין מהיר, הערך את קבוע הדיסוציאציה (KD) מתוך התאמה לא ליניארית של CSP שנצפה עבור 1 H-15N HSQC פסגות צולבות בכל נקודה (Δδobs) לעומת ריכוז החלבון המסוים [P] והליגנד [L] באותה נקודה:
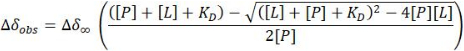
הערה: ניתן להחיל משוואה זו על פסגות צולבות המציגות אותות מבודדים ברורים. הערכים המתקבלים ממוצעים כדי לספק את האומדן של KD.
- דמיינו את ספקטרום HSQC הדו-ממדי המעובד עבור מיני ה-apo באמצעות התוכנה המתאימה: TopSpin, MestReNova ו-CCPNMR הן כולן תוכנות מתאימות לטיפול בנתוני NMR.
תוצאות
במאמר זה אנו מציגים פרוטוקול לניצול ניסויים מסוג 1H-STD NMR ו-1 H-15N HSQC כדי לפענח את פרטי האינטראקציה הקושרת בין לקטינים ואוליגוסכרידים קטנים. התוצאות שהתקבלו בניתוח הזיהוי המולקולרי של LacNAc על ידי hGalectin-7 (hGal-7) כלולות, ומשמשות דוגמה להמחשה ליישום מוצלח של הפרוטוקול וליעילות של מתודולוגיות NMR אלה לחקר הפרטים הקטנים של תהליך הזיהוי המולקולרי. איור 3 מראה אתספקטרום 1 H-STD NMR עבור האינטראקציה של LacNAc עם hGal-7. קיומם של אותות STD NMR מצביע על קשירה (איור 3A). יתר על כן, רק האותות השייכים לפרוטונים הנמצאים במגע הדוק עם החלבון מופיעים, מה שמאפשר את תיחום האפיטופ הקושר (איור 3B). איור 4 מדגיש כיצד ספקטרום H-15N HSQC 1של חלבון יכול לשמש כטביעת האצבע שלו, ואיור 5 מדגים את היישום של ניסויי טיטרציה של 1 H-15N הטרו-גרעיני בקוהרנטיות קוונטית יחידה (HSQC) כדי להגדיר את הפרעות השינוי הכימי של קבוצותאמיד עמוד השדרה h Galectin-7 בעת קשירת LacNAc. נתונים אלה לא רק חושפים את קיומה של אינטראקציה, אלא גם משרטטים את ממשק הקשירה של הלקטין. איור 6 מדגים כיצד ניתוח נתוני הטיטרציה מאפשר להעריך את זיקת הקישור של LacNAc על ידי hGalectin-7, אשר נמצא בטווח המיקרומולרי הגבוה. ממצא זה עולה בקנה אחד עם התוצאות המתקבלות באמצעות טכניקות חלופיות.
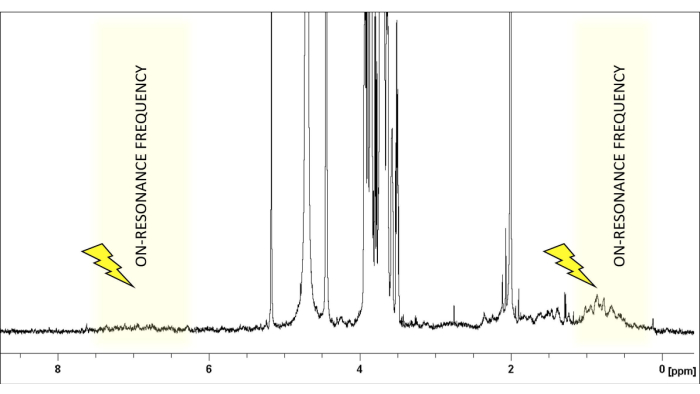
איור 1: בחירת תדר התהודה. 1ספקטרום H-NMR של LacNAc:hGal-7 יחס 50:1 במי מלח חוצצי פוספט ב-pH 7.4. אותות של ליגנד (LacNAc) מוגבלים באזור בין 2.0-5.2 ppm. תדירות הרוויה נבחרת בקפידה כדי להבטיח היעדר פרוטוני ליגנד בטווח של 1-2 ppm, מה שמאפשר הקרנה סלקטיבית של פרוטוני החלבון. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
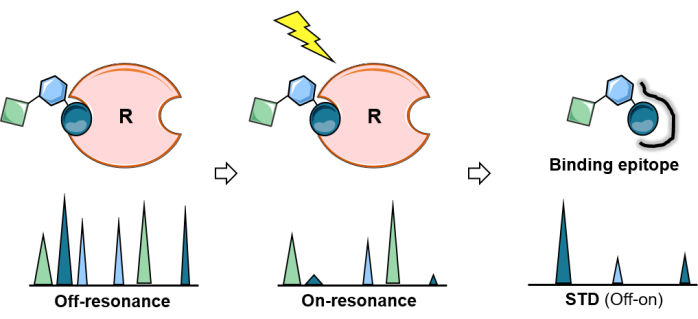
איור 2: ניסוי STD NMR. ייצוג סכמטי של ניסוי STD: הספקטרום הראשון (off-resonance) משמש כנקודת ייחוס ואילו בספקטרום השני (on-resonance) מבוצעת רוויית חלבונים. הרוויה מופצת ביעילות על פני החלבון כולו ומועברת לפרוטוני הליגנד במגע הדוק עם החלבון. ספקטרום ההבדל המתקבל (ספקטרום STD) מניב רק את התהודה שחוו רוויה. ניתוח ניסוי STD מאפשר מיפוי אפיטופי של הסוכר הקושר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
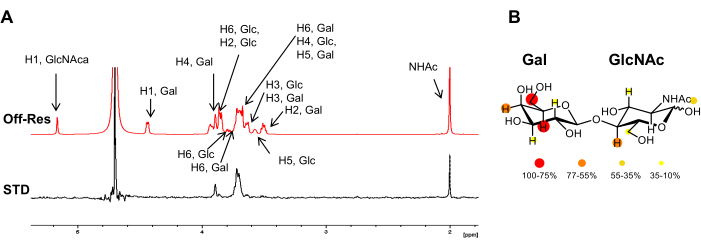
איור 3: ניתוח מחייב מנקודת מבטו של הליגנד. (A) סופראימפוזיציה של ספקטרום מחוץ לתהודה וספקטרום STD-NMR של 1H עבור האינטראקציה של LacNAc עם hGal-7. בספקטרום מחלות מין, רק אותות השייכים לפרוטונים הנמצאים במגע הדוק עם החלבון מופיעים. הביאור של תהודה 1H של הליגנד מדווח בספקטרום מחוץ לתהודה. (B) העוצמות היחסיות של מחלות מין מופו למבנה הכימי של LacNAc. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
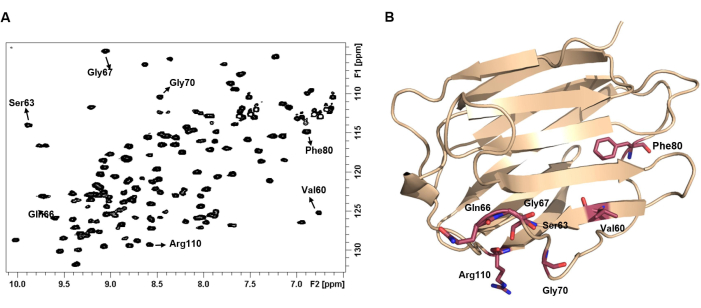
איור 4: ספקטרום H-15N HSQC 1של חלבון מייצג את טביעת האצבע שלו. (A) 1 H-15N HSQC ספקטרום של 100 מיקרומטר של hGal-7 בצורת apo. הספקטרום נרשם ב 25 ° C. כמה פסגות צולבות NH היו מבוארות עם התווית של חומצת האמינו המתאימה להם. (B) כל זוג NH מציג שינוי כימי ייחודי התלוי בסביבה הכימית וכתוצאה מכך, במבנה התלת-ממדי של החלבון. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
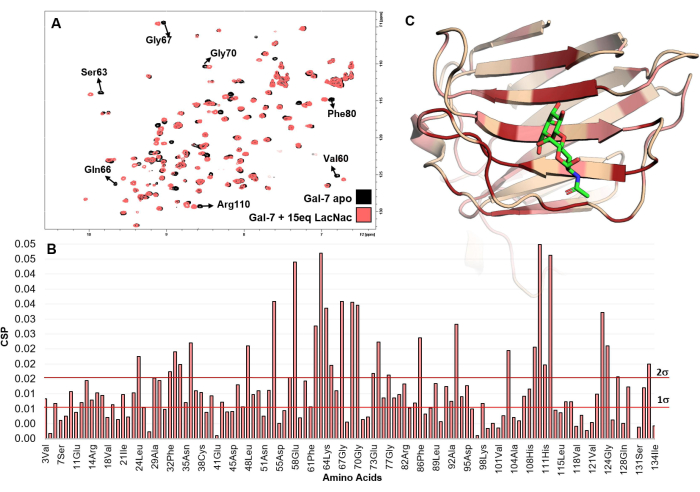
איור 5: ניתוח קשירה מנקודת המבט של החלבון. (A) מוצגת סופר-אימפוזיציה של ספקטרום H-15N HSQC 1שנרשם לטיטרציה של LacNAc לתמיסת HGal-7. בחינה של הספקטרה, שבה כמה פסגות צולבות חוות שינויים כימיים, מצביעה בבירור על אינטראקציה. (B) תרשים הפרעות ההסטה הכימיות המרביות (maxCSP) של אותות האמיד בעמוד השדרה שהוסקו מהטיטרציה של LacNAc (15 שווה ערך) עם hGal-7. (C) חומצות האמינו המוטרדות ביותר של hGal-7, על פי ניתוח CSP, ממופות למבנה PDB 5gal. במודל התלת-ממדי, הצבע האדום מתייחס לערך CSP מעל 2σ, ואילו הצבע הוורוד מתייחס לערכים בין 1σ ל-2σ. האזור הצבעוני מייצג ככל הנראה את אתר הקשירה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
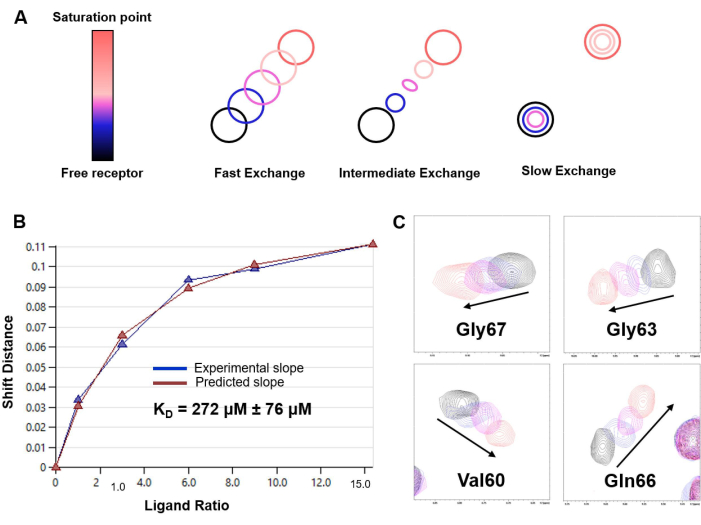
איור 6: קביעת KD בהתבסס על ניסויי טיטרציה H-15N HSQC. (A) ייצוג התבנית שלטיטרציה מבוססת H-15N HSQC בהתאם לשער החליפין הכימי בסקאלת הזמן של NMR של המערכת במחקר (מהיר, בינוני או איטי). משטר החלפה מהיר נצפה במקרה של אינטראקציה LacNAc/hGal-7. (B) עקומת התאמה ואומדן KD המתקבל מניתוח CSP בריכוזי ליגנדים משתנים עבור מערכת המודל של hGal-7 ו- LacNAc disaccharide. KD המשוער מדווח עם השגיאה המתאימה כממוצע של הנתונים עבור 20 חומצות אמינו שונות; (C) קטעים של ספקטרום N-HSQC של 1 H,15המציגים את השינוי של פסגות צולבות נבחרות במהלך הטיטרציה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Discussion
הפרש העברת רוויה NMR (STD-NMR) הפך לשיטת NMR הנפוצה והמגוונת ביותר לחקר אינטראקציות ליגנד-חלבון. כפי שמוצג לעיל, היא מסתמכת על תופעת העברת הרוויה, והמערך הניסויי כרוך ברכישה של שני ספקטרום חד-ממדי (1D) 1H: ספקטרום התהודה¬ וספקטרום ¬off-resonance. במהלך ניסוי התהודה, הרוויה של פרוטונים ספציפיים של החלבון מושגת על ידי הפעלת רכבת של פולסים בתדרי רדיו בהספק נמוך במהלך תקופה מסוימת (זמן הרוויה נע בדרך כלל בין 1-3 שניות). כדי למנוע רוויה ישירה של הליגנד, התדירות והאורך של פעימות הרוויה מותאמים להקרנה סלקטיבית של פרוטונים ספציפיים של החלבון; כלומר, יש ליישם אותם בתדר פנוי מכל אותות הליגנד ובאורך מתאים (איור 1). ככלל אצבע לפעימות רוויה של 50 אלפיות השנייה, יש לשמור על הפרש של 1 חל"מ מאזור הרוויה לאותות הליגנד הקרובים ביותר. בדרך כלל, פעימות רוויה סלקטיבית המיושמות על האזור האליפאטי של החלבון מספקות השפעות רוויה מוגברות. לחלופין, פרוטונים ארומטיים (6-7 ppm) יכולים להיות מוקרנים גם אם מולקולת הליגנד אינה מכילה אותות ארומטיים. זה מאוד שימושי עבור גליקנים המתרחשים באופן טבעי, כפי שהם אינם נושאים קבוצות ארומטיות. ברגע שאזור מסוים של החלבון מוקרן באופן סלקטיבי, הרוויה מתפשטת לאורך החלבון באמצעות הרפיה צולבת דיפולרית 1 H-1H (דיפוזיית ספין). בסופו של דבר, הרוויה מגיעה לפרוטוני החלבונים באתר הקשירה, אשר מועברים לאחר מכן לפרוטוני הסוכר הנמצאים במגע הדוק (r < 5 Å) עם הקולטן באמצעות אינטרמולקולרי 1 H-1H NOEs. ברור שעוצמת האותות של פרוטוני הליגנד הרווי פוחתת. לאחר קבלת הרוויה, בשל הקינטיקה המחייבת, הליגנדות הקשורות באופן ארעי (נדרש חילוף מהיר) מתנתקות ומידע הרוויה נצבר במצב החופשי. בשל התהליך הזה, ספקטרום התהודה של NMR מציג אותות מופחתים (איור 2).
כדי להציג בבירור הפרעה בעוצמה זו של גרעיני 1H של גליקן קשירה, נרכש ספקטרום NMR של פרוטון בקרה (off-resonance) שבו הרוויה מוחלת הרחק מכל קולטן או אות פחמימות (בדרך כלל בין 40-100 ppm), באותם תנאים. הספקטרום ה-1D שהוחסר בין ה-off-resonance ל-on-resonance מראה באופן בלעדי את האותות של גרעיני 1Hשל הליגנד ששינו את העוצמות: אלה שהיו קרובים מספיק לאתר הקישור של הקולטן כדי לקבל את המגנטיזציה (איור 2).
עם זאת, לא כל גרעיני 1H של פחמימה קשורה מקבלים את אותה כמות רוויה. תיאורטית, העברת המגנטיזציה מהקולטן לליגנד הכבול היא תלוית מרחק (1/r6). משמעות הדבר היא שעוצמות הרוויה המועברת בין גרעיני גליקן 1H מכילות מידע על הקרבה המרחבית בין פרוטוני הליגנד לאלה של הקולטן, ועוצמות STD NMR גדולות יותר עבור אותם פרוטונים הקרובים יותר לקולטן. בהתאם לכך, ניסוי STD NMR מאפשר גם לקבוע את אפיטופ הקישור של הפחמימה (איור 2 ואיור 3) מאחר שפרוטונים של הליגנד היושב קרוב יותר לפני השטח של החלבון מראים עוצמות גבוהות יותר מאלה שאינם משתתפים ישירות בקשירה.
הניסוי יכול להיות מיושם על מערכות עם זיקה חלשה-בינונית, לעתים רחוקות על מערכות עם זיקות חזקות בתחום μM או nM נמוך. אכן, היא דורשת שקצב הדיסוציאציה יהיה מהיר בסקאלת זמן ההרפיה. אחרת, מידע העברת הרוויה הולך לאיבוד באמצעות הרפיה לפני שהליגנד מתנתק.
מצד שני, ניסויי NMR מבוססי חלבון הם ייחודיים לפענוח אינטראקציה ליגנד-חלבון עם דיוק ברמת חומצות אמינו מבלי לפתור את מבני הרזולוציה האטומית. הוא בוחן ישירות תופעות של זיהוי מולקולרי בתמיסה ללא צורך בהתגבשות משותפת. מיפוי ניתוח CSP הוא בעל עוצמה יוצאת דופן לגילוי ליגנדות ולמיפוי אתר קשירת החלבונים (איור 4 ואיור 5). שיטה זו ישימה לכל טווח של זיקות בין תחום mM ו- nM, אפילו עבור מערכות שבהן שער החליפין איטי בסקאלת זמן השינוי הכימי21.
עם זאת, גישה זו כנראה לא תעבוד עבור חלבונים עם משקל מולקולרי מעל 30-40 kDa בשל בעיות הרפיה. לאחר מכן ניתן להשתמש בחלופה18 של TROSY, והיא חזקה במיוחד בשילוב עם דאוטרציה של חלבונים. יתר על כן, החלבון צריך להיות מסומן באופן אחיד עם 15N (ועוד מדגם כפול מסומן עם 13C ו 15N כדי להיות מסוגל להשלים את המשימה עמוד השדרה הנדרש). לכן, תנאי ביטוי החלבון, כולל מערכת הביטוי המתאימה צריכים להיות אופטימליים כדי להיות מסוגלים לקבל כמויות מיליגרם של חלבון. חלבונים המציגים נטייה לאוליגומריזציה או צבירה גם אינם מתאימים לניתוח זה. המכשיר המשמש כאן להקלטת נתוני NMR הוא ספקטרומטר Bruker 800 MHz המצויד בקריופרוב TCI. יהיה מאתגר מאוד להשתמש במתודולוגיה זו באמצעות מכשירים מתחת ל-600 מגה-הרץ או ללא בדיקה קריוגנית.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
אנו מודים Agencia Estatal de Investigación של ספרד עבור Severo Ochoa Center of Excellence Accreditation CEX2021-001136-S, במימון MCIN/AEI/10.13039/ 501100011033, ו- CIBERES, יוזמה של Instituto de Salud Carlos III (ISCIII, מדריד, ספרד). אנו מודים גם לנציבות האירופית על פרויקט GLYCOTWIN.
Materials
| Name | Company | Catalog Number | Comments |
| 5 mm Shigemi microtube set mat | CortecNet SAS | S30BMS-005B | |
| Alpha-Lactose-Agarose | Sigma-Aldrich Química S.L. | 7634-5ML | |
| Ammonium chloride (15 N, 99%) | LC-0179-N-50G | Tracer Tecnologías Analíticas S.L | |
| Ampicillin (Sodium Salt) | Melford Laboratories LTD | A40040 | |
| BIOVIA Discovery studio | BIOVIA, Dassault Systèmes | ||
| BL21(DE3) Chemically Competent Cells | Merck Life Science, S.L.U. | CMC0014-40X40UL | |
| Centrifuge | Beckman Coulter | Allegra X-22R | |
| D2O | Cambridge Isotope Laboratories, Inc. | DLM-4-1000 | |
| Incubator | Eppendorf | Innova 42 | |
| IPTG (Isopropyl ß-D-1-thiogalactopyranoside) | VWR International Eurolab S.L. | VW437144N | |
| LacNAc | Elicityl | GLY008 | |
| Luria Bertani (LB) Broth | Merck Life Science, S.L.U. | 3397-1KG | |
| Matraz Erlenmeyer B N 5000 CC | VWR International Eurolab S.L. | 214-1137 | |
| PBS 10x | Bio-Rad | 1610780 | |
| PyMOL | PyMOL Molecular Graphics System | Version 2.0 Schrödinger | |
| Sonicator | Sonics & Materials, Inc. | VC 505 | |
| Superconducting NMR magnet | Bruker | 600 MHz AVANCE III | |
| Superconducting NMR magnet | Bruker | 800 MHz AVANCE III |
References
- Solís, D., et al. A guide into glycosciences: How chemistry, biochemistry and biology cooperate to crack the sugar code. Biochim Biophys Acta. 1850 (1), 186-235 (2015).
- Poveda, A., Jimenez-Barbero, J. NMR studies of carbohydrate-protein interactions in solution. Chem Soc Rev. 27, 133-144 (1998).
- Kogelberg, H., Solís, D., Jiménez-Barbero, J. New structural insights into carbohydrate-protein interactions from NMR spectroscopy. Curr Opin Struct Biol. 13 (5), 646-653 (2003).
- Widmalm, G. Glycan shape, motions, and interactions explored by NMR spectroscopy. JACS Au. 4 (1), 20-39 (2024).
- Marchetti, R., et al. 34;Rules of Engagement" of protein-glycoconjugate interactions: A molecular view achievable by using NMR spectroscopy and molecular modeling. ChemistryOpen. 5 (4), 274-296 (2016).
- Ardá, A., Jiménez-Barbero, J. The recognition of glycans by protein receptors. Insights from NMR spectroscopy. Chem Commun. 54 (38), 4761-4769 (2018).
- Gimeno, A., Valverde, P., Ardá, A., Jiménez-Barbero, J. Glycan structures and their interactions with proteins. A NMR view. Curr Opin Struct Biol. 62, 22-30 (2020).
- Cañada, F. J., et al. Conformational and structural characterization of carbohydrates and their interactions studied by NMR. Curr Med Chem. 29 (7), 1147-1172 (2022).
- Valverde, P., Quintana, J. I., Santos, J. I., Ardá, A., Jiménez-Barbero, J. Novel NMR avenues to explore the conformation and interactions of glycans. ACS Omega. 4, 13618-13630 (2019).
- Jiménez-Barbero, J., Asensio, J. L., Cañada, F. J., Poveda, A. Free and protein-bound carbohydrate structures. Curr Opin Struct Biol. 9 (5), 549-555 (1999).
- Quintana, J. I., Atxabal, U., Unione, L., Ardá, A., Jiménez-Barbero, J. Exploring multivalent carbohydrate-protein interactions by NMR. Chem Soc Rev. 52 (5), 1591-1613 (2023).
- Roldós, V., Cañada, F. J., Jiménez-Barbero, J. Carbohydrate-protein interactions: a 3D view by NMR. Chembiochem. 12 (7), 990-1005 (2011).
- Unione, L., Ardá, A., Jiménez-Barbero, J., Millet, O. NMR of glycoproteins: profiling, structure, conformation, and interactions. Curr Opin Struct Biol. 68, 9-17 (2021).
- del Carmen Fernández-Alonso, M., Díaz, D., Berbis, M. A., Marcelo, F., Cañada, J., Jiménez-Barbero, J. Protein-carbohydrate interactions studied by NMR: from molecular recognition to drug design. Curr Protein Pept Sci. 13 (8), 816-830 (2012).
- Angulo, J., Nieto, P. M. STD-NMR: application to transient interactions between biomolecules-a quantitative approach. Eur Biophys J. 40 (12), 1357-1369 (2012).
- Mayer, M., Meyer, B. Group epitope mapping by saturation transfer difference NMR to identify segments of a ligand in direct contact with a protein receptor. J Am Chem Soc. 123 (25), 6108-6117 (2001).
- Williamson, M. P. Using chemical shift perturbation to characterise ligand binding. Prog Nucl Magn Reson Spectrosc. 73, 1-16 (2013).
- Fernández, C., Adeishvili, K., Wüthrich, K. Transverse relaxation-optimized NMR spectroscopy with the outer membrane protein OmpX in dihexanoyl phosphatidylcholine micelles. Proc Natl Acad Sci U S A. 98 (5), 2358-2363 (2001).
- Yee, A., Gutmanas, A., Arrowsmith, C. H. Solution NMR in structural genomics. Curr Opin Struct Biol. 16 (5), 611-617 (2006).
- Skinner, S. P., Fogh, R. H., Boucher, W., Ragan, T. J., Mureddu, L. G., Vuister, G. W. CCPNMR AnalysisAssign: a flexible platform for integrated NMR analysis. J Biomol NMR. 66 (2), 111-124 (2016).
- Gimeno, A., et al. Minimizing the entropy penalty for ligand binding: Lessons from the molecular recognition of the histo blood-group antigens by human Galectin-3. Angew Chem Int Ed Engl. 58 (22), 7268-7272 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved