הערכה בזמן אמת של Ca2+ מוחלט, ציטוסולי, חופשי והתכווצות מקבילה בכלי לימפה מבודדים בלחץ
In This Article
Summary
פרוטוקול זה מתאר שיטה למדוד בו זמנית סידן ציטוסולי, חופשי [Ca2+]i וקוטר כלי הדם בהתכווצות כלי הלימפה בזמן אמת ולאחר מכן לחשב ריכוזי Ca2+ מוחלטים וכן פרמטרים של התכווצות/ריתמוס. פרוטוקול זה יכול לשמש לחקר Ca2+ ודינמיקה של התכווצות במגוון תנאי ניסוי.
Abstract
כלי הדם הלימפטיים, המכונים כיום לעתים קרובות "מחזור הדם השלישי", ממוקמים במערכות איברים חיוניות רבות. תפקיד מכני עיקרי של כלי הדם הלימפטיים הוא להחזיר נוזלים מחללים חוץ-תאיים בחזרה לצינורות הוורידים המרכזיים. הובלת הלימפה מתווכת על ידי התכווצויות קצובות ספונטניות של כלי הלימפה (LVs). התכווצויות LV מווסתות במידה רבה על ידי העלייה והירידה המחזוריות של סידן ציטוסולי, חופשי ([Ca2+]i).
מאמר זה מציג שיטה לחישוב בו-זמני של שינויים בריכוזים מוחלטים של [Ca2+]i והתכווצות/ריתמוס כלי הדם בזמן אמת ב-LVs מבודדים בלחץ. באמצעות LVs מזנטריים של חולדות מבודדות, חקרנו שינויים ב-[Ca2+]i והתכווצות/ריתמיות בתגובה להוספת תרופות. LVs מבודדים הועמסו במחוון חישת Ca2+ Fura-2AM, ומיקרוסקופ וידאו בשילוב עם תוכנת זיהוי קצה שימש כדי ללכוד [Ca2+]i ומדידות קוטר ברציפות בזמן אמת.
אות Fura-2AM מכל LV כויל לאות המינימלי והמקסימלי עבור כל כלי שיט ושימש לחישוב מוחלט [Ca2+]i. מדידות הקוטר שימשו לחישוב פרמטרים של התכווצות (משרעת, קוטר דיאסטולי סופי, קוטר סיסטולי סופי, זרימה מחושבת) וריתמיות (תדירות, זמן התכווצות, זמן הרפיה) וקורלציה עם מדידות מוחלטות [Ca2+]i .
Introduction
כלי הדם הלימפטיים נמצאים במערכות איברים רבות, כולל המוח, הלב, הריאות, הכליות והמזנטריה 1,2,3,4,5,6, ופועלים על ידי הנעת נוזל (לימפה) מהחללים הבין-תאיים אל צינורות הוורידים המרכזיים כדי לשמור על הומאוסטזיס נוזלים 7,8,9,10 . זה מתחיל עם נימי לימפה עיוורים בתוך מיטות נימי כלי הדם המתנקזים לכלי הלימפה הנאספים (LVs). איסוף LVs מורכב משתי שכבות של תאים: שכבה של תאי אנדותל המוקפת בשכבה של תאי שריר לימפה (LMCs)10,11. העברת נוזל הלימפה מושגת באמצעות כוחות חיצוניים (למשל היווצרות לימפה חדשה, פעימות עורקים, תנודות לחץ ורידי מרכזי) וכוחות פנימיים12.
הכוח הפנימי להובלת הלימפה הוא התכווצות קצבית ספונטנית של איסוף LVs, שהיא המוקד של רוב המחקרים הבוחנים את תפקוד הלימפה. משאבת לימפה פנימית זו מווסתת בעיקר על ידי העלייה והירידה המחזוריות של Ca2+ ([Ca2+]i). דפולריזציה ספונטנית של קרום הפלזמה ב- LMCs מפעילה ערוצי Ca2+ (Cav1.x) מגודרים במתח ומפעילה זרם Ca2+ והתכווצות קצבית LV 8,9,10. תפקיד זה הודגם על ידי חסימת Cav1.x עם חומרים ספציפיים, כמו nifedipine, אשר עיכב התכווצויות LV וגרם להרחבת כלי הדם13,14. העלייה הארעית ב[Ca2+]i או "Ca2+ ספייק" ב- LMCs בתיווך ערוצי Cav1.x עשויה גם להניע מאגרי Ca2+ תוך תאיים על ידי הפעלת קולטני אינוסיטול טריפוספט (IP3) וקולטני ריאנודין (RyRs) על הרשתית הסרקופלזמית (SR)15,16,17,18. הראיות הנוכחיות מצביעות על כך שקולטני IP3 תורמים יותר Ca2+ הנדרש להתכווצויות LV נורמליות בהשוואה ל- RyRs 15,16,19,20,21; עם זאת, RyRs עשוי לשחק תפקיד במהלך פתולוגיה או בתגובה להתערבות תרופתית 17,18. בנוסף, ההפעלה של תעלות K+ 22 המופעלות על ידי Ca2+ ותעלות אשלגן רגישות ל-ATP (KATP)23,24 יכולה לגרום להיפרפולציה של קרום LMC ולעכב פעילות התכווצות ספונטנית.
ישנן תעלות יונים וחלבונים רבים אחרים שעשויים לווסת את הדינמיקה של Ca2+ באיסוף LVs. שימוש בשיטות לחקר שינויים ב- Ca2+ והתכווצות כלי הדם בתגובה לסוכנים פרמקולוגיים בזמן אמת חשוב כדי להבין את הרגולטורים הפוטנציאליים הללו. שיטה מוקדמת יותר שהשתמשה בפורה-2 למדידת שינויים יחסיים ב-LV [Ca2+]i תוארה25. מכיוון שקבוע הדיסוציאציה עבור Fura-2 ו- Ca2+ ידוע26, ניתן לחשב ריכוזים בפועל של Ca2+, מה שמרחיב את היישום של שיטה זו ומספק תובנה נוספת לגבי איתות Ca2+ , רגישות הממברנה ומנגנוני ההתכווצות27, כמו גם מאפשר השוואה בסיסית בין קבוצות ניסוי. גישה אחרונה זו שימשה cardiomyocytes28, ולכן, ניתן להתאים LVs. מאמר זה מציג שיטה משופרת המשלבת את שתי הגישות הללו למדידה וחישוב של שינויים מוחלטים [Ca2+]i וכן התכווצות/ריתמוס כלי דם ברציפות בזמן אמת ב-LVs מבודדים בלחץ. אנו מספקים גם תוצאות מייצגות עבור LVs שטופלו בניפדיפין.
Protocol
חולדות ספראג-דולי זכרים בני תשעה עד 13 שבועות נרכשו מספק מסחרי. לאחר הגעתן, כל החולדות שוכנו ותוחזקו במתקן של אוניברסיטת ארקנסו למדעי הרפואה (UAMS) במתקן לרפואת חיות מעבדה (DLAM) על דיאטת מעבדה סטנדרטית ונחשפו ל -12 שעות של מחזור אור: כהה ב 25 מעלותצלזיוס. כל ההליכים בוצעו בהתאם לפרוטוקול השימוש בבעלי חיים המאושר #4127 על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים (IACUC) של UAMS.
1. דיסקציה וקנולציה של LVs mesenteric
הערה: חשוב להגדיר את תא הזילוח לפני בידוד ה- LVs המזנטריים כדי לוודא שאין הפרעה בזרימה או דליפה שתשבש את הניסוי.
- הכנת אמבט זילוח
- רכשו מיקרופיפטות זכוכית בורוסיליקט (קוטר חיצוני 1.2 מ"מ, קוטר פנימי 0.68 מ"מ ונמשכות לקוטר קצה חיצוני של 75-100 מיקרומטר) מספק מסחרי. חותכים ומלטשים מיקרופיפטות (המכונה צינורית) לאורך של כ-1-2 ס"מ לצורך הרכבה לתוך תא הזלוף המבודד.
- חבר כל צינורית זכוכית רכובה בתא זילוח כלי הדם למתמרי לחץ עצמאיים הממוקמים בקו אחד עם וסתי לחץ עצמאיים המוזנים בכבידה באמצעות צינורות פוליאתילן.
הערה: זה מאפשר מניפולציה עצמאית של לחצי זרימה וזרימה בהתאם לתכנון המחקר. איור 1 מציג את ההגדרה הזו בפירוט. - מילוי תא הזילוח (5 מ"ל), מיקרופיפטות זכוכית, וסת לחץ עצמאי המוזן מכוח הכבידה יחד עם צינורות פוליאתילן בתמיסת מלח פיזיולוגית (PSS; 119 mM NaCl; 24 mM NaHCO3; 1.17mM NaH2PO4; 4.7 mM KCl; 1.17 mM MgSO4; 5.5 mM C6H12O6 (גלוקוז); 0.026 mM C10H16N2O8 (EDTA); ו- 1.6 mM CaCl2) נטול בועות אוויר. לאחר מכן, מהדקים את הלחץ כך שהצינוריות לא ילחצו עליהן.
הערה: ה- pH של פתרון זה הוא ~ 7.5. pH של 7.4 נשמר באמבט הזלוף תוך ניצול CO2 מבעבע כדי לפעול על מערכת חציצה ביקרבונט בתוך PSS כמתואר בשלב 1.3.7. EDTA משמש כאן כדי chelate עודף Ca2+ יונים.
- הכנת קשרים
- קשרו קשרים ידניים כפולים מתחת למיקרוסקופ באמצעות חוט תפר משי קלוע (מידה 8-0). השלבים העיקריים מתוארים באיור 2.
- הפרד חוט להט יחיד.
- השתמש בשני מלקחיים Dumont #5 עם קצוות microblunted ובאמצעות מלקחיים אחד לעשות לולאה כפולה סביב קצה של מלקחיים אחרים.
- בעזרת המלקחיים הלולאים, תפסו את הקצה הרופף של התפר ומשכו אותו דרך שתי הלולאות תוך הקפדה שלא למשוך את הקשר סגור לחלוטין ולהשאיר פתח קטן.
- השתמש מספריים קפיץ Vanna לחתוך תפר עודף משני הצדדים. השתמש בקשרים אלה מאוחר יותר כדי לאבטח את ה- LV על הצינוריות.
הערה: אל תשתמש באותם מלקחיים שאיתם תנתח או תנתח מכיוון שקיימת סכנה גדולה יותר לפגיעה בקצות המלקחיים במהלך הקשירה.
- קשרו קשרים ידניים כפולים מתחת למיקרוסקופ באמצעות חוט תפר משי קלוע (מידה 8-0). השלבים העיקריים מתוארים באיור 2.
- בידוד וקנולציה של LVs mesenteric
- מרדימים בעלי חיים עמוקות על ידי מתן איזופלורן 5% עם מנת יתר של 1.5 ליטר/דקה O2 ואקסנגינט על ידי עריפת ראש.
- בודדו מזנטריות שלמות לדיסקציה של LVs מזנטריים על ידי ביצוע תחילה חתך לאורך קו האמצע של דופן הבטן, יציאה החוצה של המזנטריה, ולאחר מכן חיתוך החיבור ממש מתחת לסוגר הפילורי ו~ 2-3 ס"מ מעל הצקום וכן החיבור לפי הטבעת.
- שטפו את המזנטריות השלמות המנותחות ב-200 מ"ל של PSS קר כקרח ולאחר מכן העבירו לצלחת פטרי מרופדת סיליקון (8-10 מ"מ) (100 מ"מ) המכילה PSS קר כקרח.
- נתחו LVs מזנטריים מסדר שני מרקמת השומן והחיבור שמסביב באמצעות סטריאומיקרוסקופ, דיסקציה Dumont #5 Inox מלקחיים עדינים ומספריים קפיציים של Vanna. כדי לעזור לזהות את הקצוות של LVs לאחר הסרת הרקמה, להשאיר חתיכת שומן קטנה על הקצה הפרוקסימלי של LV.
- מעבירים את ה-LVs המנותחים לתא הזילוח של כלי הדם לצורך קנולציה על צינוריות זכוכית.
- השתמש בשני מלקחיים עדינים מושחזים מראש של Dumont #5 Inox, קצה ישר (0.05 x 0.01 מ"מ) כדי לקנן LVs עם הקצה הדיסטלי של LV על צינורית P1 (inflow) ואת הקצה הפרוקסימלי של הכלי על צינורית P2 (outflow) כדי לחקות את כיוון זרימת הלימפה.
הערה: צינוריות P1 ו-P2 זהות ונבדלות זו מזו רק בקצה ה-LV המחובר. חשוב להשתמש במלקחיים שנפגשים בצורה מושלמת בקצה וללא נזק כדי להקל על אחיזת דופן הכלי הדק.- החליקו קשר קשור יחיד על כל צינורית זכוכית כדי לאבטח מאוחר יותר את הכלי על הצינוריות.
- השתמשו בחתיכת השומן הקטנה כדי לכוון את כיוון ה-LV, והכניסו תחילה את הקצה הדיסטלי ל-P1.
- החליקו את הקשר במורד הצינורית והדקו כדי לאבטח את ה-LV. הקפידו לא להדק יתר על המידה ולשבור את קצה הצינורית.
- לחץ את LV ל 4-5 מ"מ כספית בתא זילוח.
הערה: למטרותינו, הגדרנו לחץ P1 ו- P2 להיות שווים; עם זאת, בהתאם לתנאי הניסוי, ניתן לכוונן את הלחץ בכל צינורית כדי לגרום ללחץ גזירה או זרימה חוזרת. - חזור על שלבים 1.3.6.1-1.3.6.4 כדי לקבע את הקצה הפרוקסימלי של ה-LV ל-P2.
- הניחו את האבן המבעבעת עם 7% פחמן דו חמצני (CO2) / 93% חמצן (O2) בתא האמבטיה כדי לשמור על pH פיזיולוגי.
- חברו את התא לווסת הטמפרטורה והגדירו אותו על 37 מעלותצלזיוס כדי ש-LVs יתאזנו ויפתחו התכווצויות יציבות וספונטניות (כ-30 דקות).
הערה: איור 1 מציג הגדרה זו בפירוט.
2. מדידת ריכוזים מוחלטים של [Ca2+]i ב-LVs
- Fura-2AM צביעה של LVs משומרים
- לאחר התפתחות התכווצויות ספונטניות (משלב 1.3.8), יש לדגור על LVs עם אסטר Fura-2-אצטוקסימתיל (Fura-2AM; 2 μM או 10 μL/5 מ"ל) וחומצה פלורונית (PA; 0.02% W/V או 5 μL/5 מ"ל של 20% PA) למשך 30 דקות בחושך.
הערה: לאחר הוספת Fura-2AM, יש לבצע את כל השלבים הנותרים בחושך. - לאחר 30 דקות, החליפו את התמיסה בתא הזילוח 3 פעמים על ידי ריקון נפח האמבטיה המלא עם ואקום בלחץ שלילי, והחליפו אותו ב- PSS ללא מגיב תואם טמפרטורה (37 oC).
הערה: יש לעשות זאת במהירות כדי למזער את הזמן שה-LV מושעה באוויר. השתמש בשתי הידיים, לדוגמה, יד ימין עבור ואקום ויד שמאל עבור החלפת PSS חדש ללא מגיב. - לאחר השטיפה, יש לדגור על LVs למשך 15 דקות בחושך כדי להסיר מחוון עודף ולאפשר דה-אסטריפיקציה.
- לאחר התפתחות התכווצויות ספונטניות (משלב 1.3.8), יש לדגור על LVs עם אסטר Fura-2-אצטוקסימתיל (Fura-2AM; 2 μM או 10 μL/5 מ"ל) וחומצה פלורונית (PA; 0.02% W/V או 5 μL/5 מ"ל של 20% PA) למשך 30 דקות בחושך.
- לכידת Ca2+ פלואורסצנטיות וקוטר כלי הדם
- העבירו את התא לשלב המיקרוסקופ הפלואורסצנטי ההפוך המצויד במקור אור LED, מטרת פלואור 20x S, מתאם מסגור תאים ומערכת מצלמות וידאו CMOS מהירה, המאפשרת צילום פלואורסצנטי פריים אחר פריים ב-15 הרץ.
הערה: סכימה של הגדרת זרימת עבודה זו מוצגת באיור 3. ניתן ללכוד אות Ca2+ באמצעות מצלמת CCD עם לפחות 15 fps. - חבר את המיקרוסקופ למחשב המצויד בתוכנת הדמיה להקלטת פלואורסצנטיות וזיהוי קצה.
הערה: התוכנה המוזכרת מאפשרת גם הקלטת לחץ בו-זמנית; עם זאת, זה לא נכלל כאן. - הפעל את מקור אור ה- LED ואת ממשק המערכת הפלואורסצנטית.
הערה: הוראות התוכנה המתוארות כאן מתייחסות לתוכנה שאליה מתבצעת הפניה, אך ניתן להשתמש בתוכנות אחרות כדי להשיג נתונים אלה. - תוכנה פתוחה (IonWizard).
- תחת הכרטיסיה קובץ , בחר חדש.
- תחת הכרטיסיה איסוף , בחר ניסוי.
- טען את תבנית הניסוי הרצויה ולחץ על אישור.
הערה: יהיה עליך להגדיר תבנית ניסיונית עם הפרמטרים שיש למדוד. הוראות להגדרת תבנית ניתן למצוא במדריך התוכנה29. - התאם את המעקבים שעל המסך כדי לראות את קוטר כלי השיט, המונה (אות 340), המכנה (אות 380) והיחס בסדר יורד.
- התאם את קנה המידה של ציר y לפי הצורך כדי לסייע בהצגה חזותית של העקבות.
- תחת מעקבים, בחר ערוך מגבלות משתמש. ודא שהאפשרות 'מגבלות אוטומטיות' אינה מסומנת.
- בחר את הפרמטר שברצונך להתאים, הזן את ערכי המינימום והמקסימום עבור הציר ולאחר מכן בחר אישור.
- כדי להתחיל את הניסוי, לחץ על התחל (בתחתית המסך).
- כדי למדוד את קוטר ה-LV בו-זמנית, השתמשו בתוכנת זיהוי הקצה המשולבת במערכת ההדמיה, אשר מייצרת עקבות התכווצות של LVs ב-3 הרץ. השתמשו במדידות האלה כדי לנתח פרמטרים של התכווצות וריתמיות שתוארו בסעיף 3 ומוצגים באיור 4.
- הקפידו לכוונן את התאורה כך שקיר ה-LV ייראה כקווים כהים.
- בחר אזור עניין (ROI) נטול שומן ולכלוך. לאחר תחילת הניסוי, אל תזיז החזר השקעה זה.
- ודא שהסף מוגדר כך שקצה דופן הכלי מזוהה לאורך כל מחזור ההתכווצות.
- למדידות פלואורסצנטיות, הפעל את Photomultiplier Tube (PMT).
- עורר את Fura-2, מחוון יחסי, על-ידי שינוי לסירוגין באורכי גל של 340 ו-380 ננומטר בחשיפות של 50 אלפיות השנייה באמצעות תאורת LED, ולכוד את ספקטרום הפליטה ב-510 ננומטר ב-15 הרץ בכל שדה ההדמיה.
הערה: חשוב לשמור על כל הפרמטרים האופטיים (הגדרות עירור, מסנני פליטה, עדשה אובייקטיבית ומראות דיכרואיות) זהים עבור סדרה שלמה של ניסויים כדי להשיג מדידות Ca2+ הניתנות לשחזור. - מדוד את יחס האות לרקע על ידי קבלת פלואורסצנטיות 340 ו- 380 עם LV באמצע שדה הראייה (אות) ולאחר מכן, באמצעות מניפולטורי הבמה כדי להזיז את שדה הראייה לקצה האמבטיה ללא כלי (תוך הקפדה להימנע מהקצה המרופד בסיליקון ו / או על ידי הסרת פסולת מהאמבטיה) כדי ללכוד את הרקע.
הערה: חשוב לנווט חזרה לחלק המקורי של כלי השיט בכל פעם למדידות Ca2+ . - החליפו את תמיסת האמבטיה ב-PSS נטול מגיבים תואם טמפרטורה כדי להסיר את המחוון העודף באמבטיה. ייתכן שיידרשו מספר חילופי אמבטיה כדי להסיר עודפי Fura-2, לכן חזור על חילוף זה עד שיחס האות לרקע הוא בערך 10:1.
- רשום אות פלואורסצנטי של Fura-2 בקו הבסיס והתכווצויות ספונטניות במשך כ-30 דקות ולאחר מכן תגובת ריכוז מצטברת של ניפדיפין (NIF; 0.1-100 ננומטר), אנטגוניסט Cav1.x תלוי מתח. קבל מדידות רקע עבור כל ריכוז תרופה.
- בסוף כל ניסוי, שטפו את ה-LVs עם PSS נטול Ca2+ תואם טמפרטורה כדי לקבל את האות הפלואורסצנטי המינימלי של Fura-2 (Rmin) ואת הקוטר המרבי של ה-LVs בהיעדר Ca2+. הקפד למדוד את הרקע.
הערה: ל- PSS ללא Ca2+ יש הרכב זהה ל- PSS אך ללא CaCl2, ו- EDTA מוחלף ב- 1 mM EGTA (C14H24N2O10) (pH ~ 7.5). - החליפו את תמיסת האמבטיה עם PSS תואם טמפרטורה המכיל 10 mM Ca2+ ויונומיצין (10 μM IONO), יונופור Ca2+ , כדי לקבל את האות הפלואורסצנטי המרבי Fura-2 (Rmax) ואת הקוטר המינימלי של LVs בתנאים של רוויה Ca2+. הקפד למדוד את הרקע.
- העבירו את התא לשלב המיקרוסקופ הפלואורסצנטי ההפוך המצויד במקור אור LED, מטרת פלואור 20x S, מתאם מסגור תאים ומערכת מצלמות וידאו CMOS מהירה, המאפשרת צילום פלואורסצנטי פריים אחר פריים ב-15 הרץ.
- הנוסחה למדידת מוחלט [Ca2+]i
- השתמש ב- R min ו- Rmax כדי לכייל את היחס בין אורכי גל של 340 ו- 380 ננומטר ולחשב ריכוז Ca2+ חופשי ציטוסולי מוחלט ([Ca2+]i).
- חישוב ריכוז Ca2+ חופשי ציטוסולי מוחלט ([Ca2+]i) באמצעות משוואה (1)26:
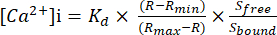 (1)
(1)
כאשר Kd = 225 ננומטר (קבוע דיסוציאציה עבור Fura-2)26, R = יחס 340/380, Rmin = יחס 340/380 בהיעדר Ca2+, Rmax = יחס 340/380 עם תנאי Ca2+ רוויים, Sחופשי = 380 אות בהיעדר Ca2+, Sקשור = 380 אות עם תנאי Ca2+ רוויים
הערה: כל האותות הפלואורסצנטיים תוקנו עבור פלואורסצנטיות רקע. - איור 5 הוא דוגמה למעקב Ca2+ המפרט אילו פרמטרים נרשמים. הגדירו את קו הבסיס Ca2+ כ-Ca2+ הנמוך ביותר במנוחה לפני הזינוק של Ca2+ ואת השיא Ca2+ כ-Ca2+ הגבוה ביותר שהושג במהלך הזינוק של Ca2+ . משרעת היא ההבדל בין Peak ו- Baseline Ca2+. יצא את כל הפרמטרים ישירות מתוכנת ההדמיה, למעט התדירות של ספייק Ca2+ שיש לחשב במצב לא מקוון כמספר הדוקרנים של Ca2+ / s. להלן שלבי מפתח בתוכנה שאליה מתבצעת הפניה כדי להשיג פרמטרים אלה.
הערה: ניתן לייצא עקבות שלמים לקובץ .txt וניתן לנתח או לחשב את כל הפרמטרים בתוכנה שבחרת. - עבורR min, סמן את המקטע של מעקב המונה המתאים לרקע במהלך PSS נטול Ca2+. תיבת דו-שיח תיפתח ותספק את הערכים עבור חלק זה של המעקב.
- תחת פעולות, בחר קבועים.
- בחר רקע סידן-מספרי והזן את מספרי הרקע עבור המונה והמכנה מהשלב הקודם. לחץ על אישור.
- סמן את המקטע של מעקב היחס המתאים ליחס הנמוך ביותר במהלך PSS נטול Ca2+. זה Rmin. שימו לב גם לערך המכנה של סעיף זה; זהבחינם.
- חזור על שלבים 2.3.4 עד 2.3.7 עבור Rmax ו- Sהמאוגדים עם קטע המעקב המתאים ל- PSS חופשי Ca2+ גבוה וליחס הגבוה ביותר.
- תחת פעולות, בחר קבועים.
- בחר כיול סידן-סידן והזן את הערכים המפורטים במשוואה 1. לחץ על אישור.
- התאם אחת מהמעקבים שעל המסך כמתואר בשלב 2.2.8 כדי שתוכל לראות סידן מופחת סידן-נומרי.
- בצע ניתוח ארעי מונוטוני כדי לרכוש את שאר הפרמטרים. הוראות לכך ניתן למצוא במדריך התוכנה30.
- לחלופין, תחת ייצוא, בחר מעקב נוכחי.
- בחר את המיקום שאליו ברצונך לייצא את קובץ .txt ולחץ על אישור.
הערה: הקפד ללחוץ על המעקב הבודד שברצונך לייצא. ניתן לייצא את כל המעקב או מקטעים נבחרים של המעקב.
3. מדידת התכווצות LV וריתמוס
- תוכנת זיהוי הקצה המשולבת במערכת ההדמיה מייצרת עקבות התכווצות למדידות קוטר LV כמתואר לעיל. השתמש במדידות אלה כדי לנתח פרמטרים של התכווצות וריתמיות. איור 4 הוא דוגמה למעקב התכווצות המפרט אילו פרמטרים של התכווצות יש לרשום. יצא את כל הפרמטרים ישירות מתוכנת ההדמיה באמצעות הפונקציה Monotonic Transient Analysis על קוטרמעקב 30, למעט תדירות התכווצויות, זרימה מחושבת ומרווח, שיש לחשב במצב לא מקוון.
הערה: ניתן לייצא עקבות שלמים לקובץ .txt וניתן לנתח או לחשב את כל הפרמטרים בתוכנה שבחרת באמצעות המשוואות שלהלן. - מדידות EDD, ESD, משרעת, תדירות וזרימה מחושבת
- מדוד את הקטרים המקסימליים והמינימליים (קוטר דיאסטולי קצה [EDD] וקוטר סיסטולי סופי [ESD], בהתאמה) שה- LVs יכולים להשיג במהלך ההתכווצויות הקצובות והספונטניות שלהם.
- חשב את משרעת ההתכווצויות (AMP) כהפרש בין EDD ו- ESD.
- חשב את התדירות כמספר ההתכווצויות לכל תקופת מדידה (ב- s).
- חשב את הזרימה המחושבת למיקרומטר באמצעות משוואה (2):
זרימה מחושבת = π/4(EDD2- ESD2)פ (2)
כאשר EDD2 = שטח חתך כלי דם במצב רגוע, ESD2 = מדידת שטח חתך כלי הדם במהלך התכווצות, F = תדירות ההתכווצויות/שנייה
- קצביות: זמן התכווצות והרפיה:
- מדדים אחרים של קצב LV הם זמן התכווצות וזמן הרפיה.
- הגדר את זמן ההתכווצות כזמן שלוקח ל- LV להגיע ל- ESD עם כל התכווצות.
- הגדר את זמן ההרפיה כזמן שלוקח ל- LV להגיע ל- EDD עבור כל הרפיה, מה שייתן אינדיקציה כוללת של ריתמיות בקורלציה עם מוחלט [Ca2+]i במסגרת זמן מסוימת.
- חשב את זמן המרווח (ΔT) מהמשוואה (3).
Δt = t2 (ESD2)-t1 (ESD1) (3)
תוצאות
התכווצות של LVs ושינויים מקבילים ב-Ca2+ ציטוסולי חופשי ([Ca2+]i) הוערכו ב-LVs מזנטריים של חולדות מבודדות לאחר חשיפה לריכוזים משתנים של ניפדיפין (NIF; 0.1-100 ננומטר) (איור 6). הפרמטרים, כולל משרעת ספייק Ca2+, קו הבסיס Ca2+ ושיא Ca2+, הציגו ירידה תלוית ריכוז עם תוספת מצטברת של NIF לתא הזילוח (איור 7A). במקביל, פרמטרים של התכווצות כגון משרעת התכווצות וזרימה מחושבת הדגימו גם הם ירידה הדרגתית (איור 7B). הייתה עלייה קטנה בקוטר ה-EDD עם NIF (איור 7B). תדירות ספייק Ca2+ ותדירות ההתכווצות נראות כתגובת הכל או אף אחד. עם זאת, השפעה זו התרחשה ב -10 ננומטר עבור LV אחד, בעוד שכל ה- LVs הפסיקו את ההתכווצויות ב- 100 ננומטר. לפיכך, הנתונים המשולבים מייצרים גרפים הדומים לתגובת ריכוז מדורגת. השפעה זו עולה בקנה אחד עם פרסומים קודמים שהשתמשו ב- NIF על LVs בתכשירים אחרים (מיוגרפיה של חוטים ולחץ 13,14). תרשימי מנהטן מראים את תגובות ה-LV האינדיבידואליות עבור מדדים של ריתמיות, כולל מרווח, זמן התכווצות וזמן הרפיה (איור 7C). סוג זה של ייצוג נתונים מאפשר לחוקר להקניט את התגובות האלה של הכל או אף אחד או את השונות במקצבי ההתכווצות כדי לספק תובנה נוספת לגבי המנגנונים הבסיסיים. בסופו של דבר, הירידות באמפליטודת ההתכווצות ובתדירותן הביאו לירידה בזרימה המחושבת דרך LVs מבודדים אלה, המשמשים כאינדיקטור חלופי לתפקוד in vivo. בסך הכל, הירידה בהתכווצות LV מתואמת עם הירידה ב- [Ca2+]i. הממצאים שלנו מספקים ראיות ישירות לכך שבטווח של 100 ננומטר, הקרן החדשה לישראל עצרה ביעילות את ההתכווצויות ואת תנודות [Ca2+]i ב-LVs על ידי אנטגוניזם של תעלות Cav1.x הקיימות בתאי שריר הלימפה (LMC).
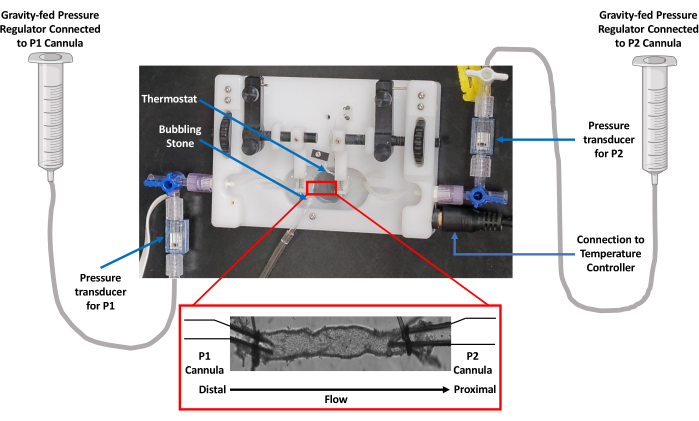
איור 1: תמונה של מבנה תא כלי הדם המבודד. מחקרי זילוח כלי דם השתמשו בתא כלי מבודד המצויד בתרמו-וסת. כוח הכבידה שימש לשליטה בלחץ באמצעות מאגר PSS. הלחץ נוטר על ידי מתמרים המחוברים הן לצינורות זרימה (P1) והן לצינורות זרימה החוצה (P2). קיצור: PSS = תמיסת מלח פיזיולוגית. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 2: הכנת קשר במבט חטוף. (A) הכנת לולאה כפולה תחת מיקרוסקופ דיסקציה באמצעות חוט יחיד של חוט תפר משי 3 רובדים, (B) תפיסת הקצה הרופף ומשיכה שלו דרך שתי הלולאות, (C) משיכת הקשר משני הקצוות כדי לשמור על פתח קטן, ו- (D) חיתוך חוט הלהט העודף מכל צד והקופסה הכחולה מראה קשר ידני כפול מוכן לשימוש. סרגל קנה מידה = 1.5 מ"מ. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
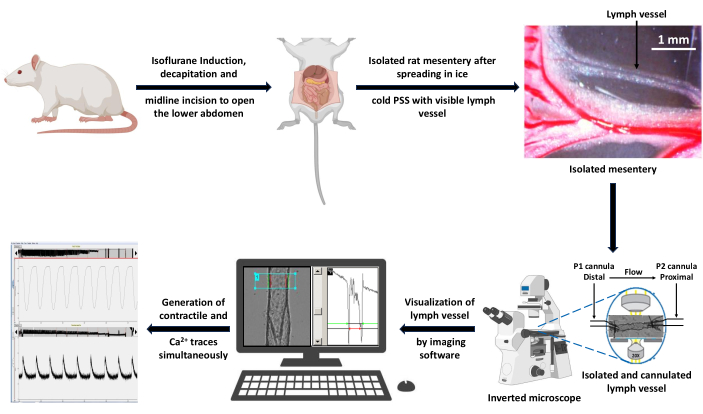
איור 3: סכמטיות של זרימת עבודה ניסיונית לרכישת נתונים. חולדה בריאה הורדמה בהשראת איזופלורן 5% ובוצעה עריפת ראש להוצאת דם גזע. בוצע חתך בקו האמצע כדי לחשוף ולבודד את המזנטריה. המזנטריה המבודדת נפרסה בתמיסת PSS קרה כקרח ו-LV נותח ללא שומן לצורך קנולציה בתא זילוח כלי מבודד. האמבטיה הונחה על במת המיקרוסקופ ההפוך באמצעות עדשה אובייקטיבית פי 20. הספינה התרגשה לחילופין עם אור באורך גל של 340 ו-380 ננומטר והספקטרום הפלואורסצנטי של הפליטה נאסף באמצעות מצלמת CCD ב-510 ננומטר. המחשב המחובר למיקרוסקופ יצר את עקבות ההתכווצות וה- Ca2+ באמצעות לכידת פלואורסצנטיות ותוכנת הדמיה לזיהוי קצה. סרגל קנה מידה = 1 מ"מ. קיצורים: PSS = תמיסת מלח פיזיולוגית; LV = כלי לימפה; CCD = התקן מצומד טעינה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
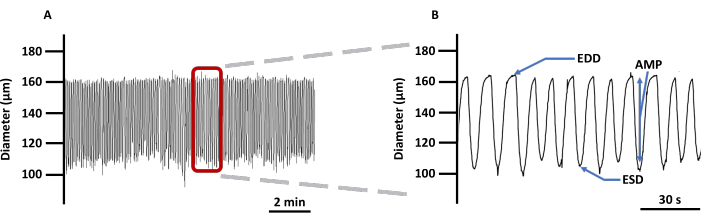
איור 4: מעקב התכווצות LV מייצג. (A) הקלטה לדוגמה של שינויים בקוטר של LVs משומרים העמוסים במחוון הדמיה Ca2+ Fura 2 AM ב-PSS ו-(B) מעקב מוגדל כדי להציג את כל הפרמטרים הקשורים להתכווצות כלי שיט: EDD, ESD, AMP ותדירות. ערכים אלה שימשו לחישוב ריתמיות וזרימה. קיצורים: PSS = תמיסת מלח פיזיולוגית; LV = כלי לימפה; EDD = קוטר דיאסטולי סופי; ESD = קוטר סיסטולי סופי; AMP = משרעת. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
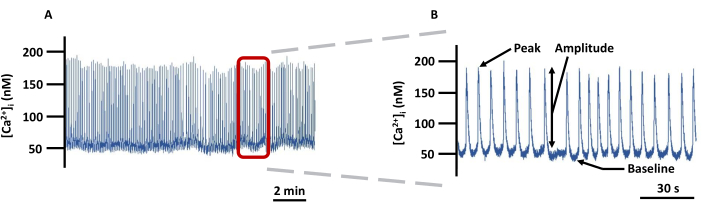
איור 5: מעקב הדמיה מייצג של LV Ca2+ . (A) הקלטה לדוגמה של שינויים ב- [Ca2+]i מוחלט ב- LVs משומרים העמוסים ב- Fura-2 ב- PSS ו- (B) מעקב מוגדל כדי להציג את כל הפרמטרים (שיא, משרעת וקו בסיס) הקשורים ל- [Ca2+]i (לא מתוקן רקע). קיצור: PSS = תמיסת מלח פיזיולוגית. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
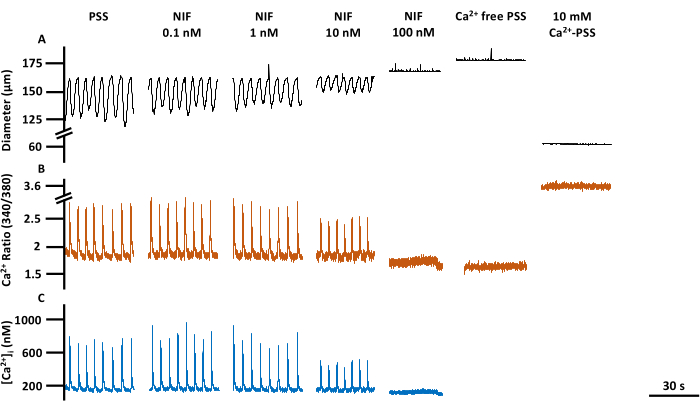
איור 6: התכווצות LV והדמיית Ca2+ במבט חטוף. עקבות מייצגים המתאימים לקוטר (A), (B) יחס 340/380, ו- (C) מוחלט [Ca2+]i של קו בסיס PSS, nifedipine, אנטגוניסט ערוץ Cav1.x (Ca2+), תגובת ריכוז, כולל Rmin ו- Rmax. קיצורים: PSS = תמיסת מלח פיזיולוגית; LV = כלי לימפה; NIF = nifedipine; Rmin = מינימום Fura-2 אות פלואורסצנטי; Rmax = אות פלואורסצנטי מרבי של Fura-2. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
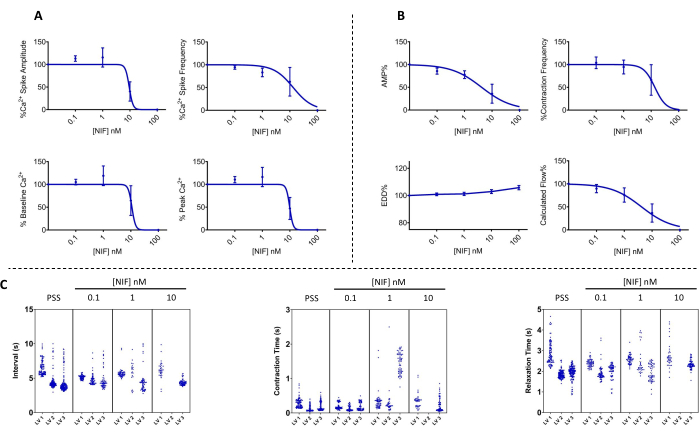
איור 7: תנודת Ca2+ והתכווצות מקבילה שנחסמה על-ידי ניפדיפין ב-LVs. (A) הפרמטרים Ca2+ (n = 3) ו-(B) התכווצות (n = 3) ירדו באופן תלוי ריכוז עם תוספת של nifedipine, אנטגוניסט ערוץ Cav1.x (Ca2+) תלוי מתח. (C) תרשימי מנהטן מייצגים מראים מרווח זמן ממוצע (Δt) בין צירים לבין זמני התכווצות והרפיה. הנתונים מוצגים כממוצע ± SEM. קיצורים: PSS = תמיסת מלח פיזיולוגית; LV = כלי לימפה; NIF = nifedipine; EDD = קוטר דיאסטולי סופי; AMP = משרעת. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Discussion
בשל אופיים השברירי והמזערי של LVs, הכרחי לנקוט בזהירות מרבית הן בתהליכי הדיסקציה והן בתהליכי הקנולציה. אפילו נזק קל לכלי יכול להוביל להתפתחות של LV שאינו בר קיימא או לגרום לחריגות ב [Ca2+]i transients. עקביות בהגדרות עירור חיונית באותה מידה לאורך כל סדרת הניסויים כדי להבטיח השוואה במדידות [Ca2+]i בין קבוצת הביקורת לקבוצות המטופלות. אי שמירה על הגדרות אחידות מהווה סיכון משמעותי להערכת יתר או חסר [Ca2+]i על פני כלי שיט בתוך סדרת ניסויים. באופן דומה, חשוב באותה מידה לזהות ולנטר במדויק את אותו אזור כלי דם לאורך כל ניסוי.
השימוש במחוון היחסימטרי Fura-2AM מנרמל שינויים פלואורסצנטיים הנגרמים על ידי עובי רקמה לא אחיד, פיזור/דליפה פלואורופורית או הלבנה, בעיות נפוצות בצבעים באורך גל יחיד. 31 הדבר מאפשר את הניטור הרציף המתואר בפרוטוקול זה. עם זאת, מכיוון ש- Fura-2 פועל על ידי כלאט Ca2+, ניתן להעמיס יתר על המידה את ה- LVs ולהפחית את [Ca2+]i הזמין להתכווצות או תגובה לתרופות. במקרים אלה, עדיין ניתן לראות קוצים Ca2+ בזמן שהתכווצויות קצובות נעדרות. גם אורך LV משתנה עשוי לתרום לתופעה זו. בעוד שמדידות Ca2+ אלה עשויות עדיין להיות תקפות, ייתכן שיהיה צורך להפחית את הריכוז של Fura-2AM בתצורות משוכפלות כדי להשיג בהצלחה הן מדידות Ca2+ והן מדידות קוטר. התוצאות שלנו כוללות רק LVs שעבורם היו גם קפיצות Ca2+ וגם התכווצויות קצובות בנקודת ההתחלה.
מדידת Rmin ו- Rmax הם שלבים קריטיים בחישוב מוחלט [Ca2+]i. מכיוון ש- R min צריך להיות יחס Fura-2 בהיעדר Ca2+, נוסף ריכוז גבוה של EGTA ל- PSS נטול Ca2+ כדי להבטיח את הקלציה של כל שארית Ca2+ . מחקרים ראשוניים נערכו עם EDTA ב- PSS נטול Ca2+, וזה הביא להתכווצויות כלי דם ספורדיות עם קוצים תואמים Ca2+ . עבור Rmax, ריכוז גבוה של Ca2+ נוסף ל-PSS יחד עם יונופור, יונומיצין, כדי למקסם את האות [Ca2+]i . הפתרון הגבוה Ca2+ עשוי לזרז, אשר עשוי לדרוש את הסרת EDTA מן PSS. חשוב לציין, מדידות נוספות אלה של Rmin ו- Rmax מספקות הזדמנות להעריך שינויים רלוונטיים מבחינה פיזיולוגית ב- [Ca2+]i, אשר יכולים לספק מידע על מנגנוני עוררות והתכווצות הממברנה27 וכן לאפשר השוואות בסיסיות בין קבוצות ניסוי בהשוואה לפרוטוקולים המדווחים רק על יחס 340/380 עבור Fura-2. כישלון בהשגת ערכי Rmin ו- Rmax מספיקים מונע את היכולת לחשב ערכים מוחלטים [Ca2+]i.
בשל האופי המתכווץ של ה- LVs, שיטה זו יכולה לספק רק מדד של רמות Ca2+ גלובליות ולא אירועי שחרור מקומיים של Ca2+ שניתן למדוד בכלי דם משותקים32. עם זאת, שיטה זו היא יתרון בקורלציה שינויים בדינמיקה מוחלטת [Ca2+]i עם התכווצות בהשוואה לשיטות המשתמשות בכלי דם משותקים או תאים בודדים28,32. עבור גישה זו, ההנחה היא שרוב Ca2+ שנמדד מקורו בתאי שריר הלימפה. עם זאת, תאי אנדותל, אשר נמצאים גם ב- LVs מבודדים אלה, עשויים לתרום לאות Ca2+ הכולל שנצפה33. ניתן להעריך תרומה זו באמצעות LVs שנשללו מאנדותל34. התכווצויות LV עשויות גם לגרום לדופן כלי הדם לזוז מעט פנימה והחוצה ממיקוד במהלך מחזור ההתכווצות. לכן, חשוב להשתמש בקטעי כלי קצרים שניתן למשוך מתוח אך מבלי למתוח את הכלי.
מעבר ליישומה ב-LVs, שיטה זו יכולה לשמש לחקר כלי דם מבודדים ממיטות כלי דם אחרות, כולל עורקים וורידים, והיא טומנת בחובה הבטחה לשימוש פוטנציאלי בנוירוביולוגיה ובענפים אחרים של ביולוגיה וסקולרית. חקירת ההשפעות של אגוניסטים או אנטגוניסטים שונים המכוונים למסלולי העברת אותות שונים היא דרך נוספת לחקור את הדינמיקה הבסיסית של Ca2+ . יתר על כן, טכניקה זו יכולה לשמש גם למחקר השוואתי הכולל דגימות בקרה וטיפול מבעלי חיים בהתאמה. יתר על כן, גישה זו ניתנת להתאמה ליישום ברמה התאית, כגון בתאי שריר לימפטיים מבודדים, הדורשים התאמות מינימליות לתא הזילוח ולמטרות המיקרוסקופ. לסיכום, שיטה זו מספקת תובנה רלוונטית פיזיולוגית לדינמיקה הגלובלית של Ca2+ מכיוון שהיא קשורה להתכווצות וריתמיות ב- LVs ומספקת הערכה חזקה של רגולטורים פוטנציאליים של דינמיקת Ca2+ באיסוף LVs.
Disclosures
למחברים אין ניגודי עניינים לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי המכונים הלאומיים לבריאות, כולל המכון הלאומי למדעי הרפואה הכלליים, המרכזים למצוינות במחקר ביו-רפואי (COBRE), המרכז לחקר תגובת מארח לטיפול בסרטן [P20-GM109005], המכון הלאומי לסרטן [1R37CA282349-01], ומלגת הקדם-דוקטורט של איגוד הלב האמריקאי [מספר פרס: 23PRE1020738; https://doi.org/10.58275/AHA.23PRE1020738.pc.gr.161089]. התוכן הוא באחריותם הבלעדית של המחברים ואינו מייצג בהכרח את הדעות הרשמיות של NIH או AHA. איור 1 ואיור 3 נוצרו עם BioRender.com.
Materials
| Name | Company | Catalog Number | Comments |
| 20x S Fluor objective | Olympus Corporation of the Americas (Center Valley, PA, United States) | UPlanSApo | |
| Borosilicate glass micropipettes | Living Systems Instrumentation (Burlington, VT, United States) | GCP-75-100 | |
| Calcium chloride (CaCl2) | Fisher Bioreagents (Waltham, MA, United States) | BP510-500 | |
| Carbon dioxide (CO2) | nexAir (Memphis, TN, United States) | UN3156 | |
| Dissection forceps | Fine Science Tools (Foster City, CA, United States) | 11254-20 | |
| EDTA (C10H16N2O8) | Fisher Bioreagents (Waltham, MA, United States) | BP118-500 | |
| EGTA (C14H24N2O10) | Fisher Bioreagents (Waltham, MA, United States) | O2783-100 | |
| Fura-2AM | Invitrogen (Waltham, MA, United States) | F1221 | |
| Glucose (C6H12O6) | Fisher Bioreagents (Waltham, MA, United States) | D16-500 | |
| Gravity-Fed Pressure regulator | custom-made in the lab | ||
| Heating unit | Living Systems Instrumentation (Burlington, VT, United States) | TC-09S | |
| Imaging software | IonOptix (Westwood, MA, United States) | ||
| Inverted fluorescent microscope | Olympus Corporation of the Americas (Center Valley, PA, United States) | IX73 | |
| Ionomycin | Invitrogen (Waltham, MA, United States) | I24222 | |
| IonOptix Cell Framing Adaptor | IonOptix (Westwood, MA, United States) | 665 DXR | |
| Isoflurane | Piramal Critical Care (Telangana, India) | NDC 66794-017-10 | |
| Isolated vessel perfusion chamber | Living Systems Instrumentation (Burlington, VT, United States) | CH-1 | |
| Knot preparation forceps | Fine Science Tools (Foster City, CA, United States) | 11253-20 | |
| LED light source | Olympus Corporation of the Americas (Center Valley, PA, United States) | TL4 | |
| Magnesium sulfate (MgSO4) | Acros Organics (New Jersey, NJ, Unites States) | 213115000 | |
| MyoCam-S3 Fast CMOS video system | IonOptix (Westwood, MA, United States) | MCS300 | |
| Nifedipine | Sigma (St. Louis, MO, United States) | N7634 | |
| Ophthalmic sutures | |||
| Oxygen (O2) | nexAir (Memphis, TN, United States) | UN1072 | |
| Pluronic acid | Sigma (St. Louis, MO, United States) | P2443 | |
| Potassium chloride (KCl) | Fisher Bioreagents (Waltham, MA, United States | BP366-500 | |
| Pressure monitor system | Living Systems Instrumentation (Burlington, VT, United States) | PM-4 | |
| Pressure Transducer | Living Systems Instrumentation (Burlington, VT, United States) | PT-F | |
| Silicone-lined petri-dish | custom-made in the lab | ||
| Sodium bicarbonate (NaHCO3) | Fisher Bioreagents (Waltham, MA, United States | BP328-500 | |
| Sodium chloride (NaCl) | Fisher Bioreagents (Waltham, MA, United States | BP358-212 | |
| Sodium phosphate (NaH2PO4) | Fisher Bioreagents (Waltham, MA, United States | BP329-500 | |
| Sprague-Dawley rats | Envigo RMS (Indianapolis, IN, USA) | Male | 9-13 weeks old |
| Stereomicroscope | Leica Microsystems (Wetzlar, Germany) | S9D | |
| Vannas spring scissors | Fine Science Tools (Foster City, CA, United States) | 15000-03 |
References
- Takahashi, T., Shibata, M., Kamiya, A. Mechanism of macromolecule concentration in collecting lymphatics in rat mesentery. Microvasc Res. 54 (3), 193-205 (1997).
- Ishikawa, Y., et al. The human renal lymphatics under normal and pathological conditions. Histopathology. 49 (3), 265-273 (2006).
- Fanous, M. Y. Z., Phillips, A. J., Windsor, J. A. Mesenteric lymph: the bridge to future management of critical illness. JOP. 8 (4), 374-399 (2007).
- El-Chemaly, S., Levine, S. J., Moss, J. Lymphatics in lung disease. Ann N Y Acad Sci. 1131 (1), 195-202 (2008).
- Klotz, L., et al. Cardiac lymphatics are heterogeneous in origin and respond to injury. Nature. 522 (7554), 62-67 (2015).
- Louveau, A., et al. Structural and functional features of central nervous system lymphatic vessels. Nature. 523 (7560), 337-341 (2015).
- Aukland, K., Reed, R. K. Interstitial-lymphatic mechanisms in the control of extracellular fluid volume. Physiol Rev. 73 (1), 1-78 (1993).
- Zawieja, D. C. Contractile physiology of lymphatics. Lymphat Res Biol. 7 (2), 87-96 (2009).
- Nipper, M. E., Dixon, J. B. Engineering the Lymphatic System. Cardiovasc Eng Technol. 2 (4), 296-308 (2011).
- Choi, I., Lee, S., Hong, Y. K. The new era of the lymphatic system: No longer secondary to the blood vascular system. Cold Spring Harb Perspect Med. 2 (4), 006445 (2012).
- Ji, R. C. Lymphatic endothelial cells, lymphedematous lymphangiogenesis, and molecular control of edema formation. Lymphat Res Biol. 6 (3-4), 123-137 (2008).
- Scallan, J. P., Zawieja, S. D., Castorena-Gonzalez, J. A., Davis, M. J. Lymphatic pumping: mechanics, mechanisms and malfunction. J Physiol. 594 (20), 5749-5768 (2016).
- Lee, S., Roizes, S., vonder Weid, P. Y. Distinct roles of L- and T-type voltage-dependent Ca2+ channels in regulation of lymphatic vessel contractile activity. J Physiol. 592 (24), 5409-5427 (2014).
- Telinius, N., et al. Human lymphatic vessel contractile activity is inhibited in vitro but not in vivo by the calcium channel blocker nifedipine. J Physiol. 592 (21), 4697-4714 (2014).
- Imtiaz, M. S., Zhao, J., Hosaka, K., vonder Weid, P. Y., Crowe, M., van Helden, D. F. Pacemaking through Ca2+ stores interacting as coupled oscillators via membrane depolarization. Biophys J. 92 (11), 3843-3861 (2007).
- Jo, M., Trujillo, A. N., Yang, Y., Breslin, J. W. Evidence of functional ryanodine receptors in rat mesenteric collecting lymphatic vessels. Am J Physiol Heart Circ Physiol. 317 (3), H561-H574 (2019).
- Stolarz, A. J., et al. Doxorubicin Activates Ryanodine Receptors in Rat Lymphatic Muscle Cells to Attenuate Rhythmic Contractions and Lymph Flow. J Pharmacol Exp Ther. 371 (2), 278-289 (2019).
- Van, S., et al. Dantrolene Prevents the Lymphostasis Caused by Doxorubicin in the Rat Mesenteric Circulation. Front Pharmacol. 12, 727526 (2021).
- Atchison, D. J., Johnston, M. G. Role of extra- and intracellular Ca2+ in the lymphatic myogenic response. Am J Physiol Regul Integr Comp Physiol. 272 (1), R326-R333 (1997).
- Atchison, D. J., Rodela, H., Johnston, M. G. Intracellular calcium stores modulation in lymph vessels depends on wall stretch. Can J Physiol Pharmacol. 76 (4), 367-372 (1998).
- Zhao, J., van Helden, D. F. ET-1-associated vasomotion and vasospasm in lymphatic vessels of the guinea-pig mesentery. Br J Pharmacol. 140 (8), 1399-1413 (2003).
- Cotton, K. D., Hollywood, M. A., McHale, N. G., Thornbury, K. D. Outward currents in smooth muscle cells isolated from sheep mesenteric lymphatics. J Physiol. 503 (1), 1-11 (1997).
- Mathias, R., vonder Weid, P. Y. Involvement of the NO-cGMP-KATP channel pathway in the mesenteric lymphatic pump dysfunction observed in the guinea pig model of TNBS-induced ileitis. Am J Physiol Gastrointest Liver Physiol. 304 (6), G623-G634 (2013).
- Garner, B. R., et al. KATP channel openers inhibit lymphatic contractions and lymph flow as a possible mechanism of peripheral edema. J Pharmacol Exp Ther. 376 (1), 40-50 (2021).
- Souza-Smith, F. M., Kurtz, K. M., Breslin, J. W. Measurement of cytosolic Ca2+ in isolated contractile lymphatics. J Vis Exp. (58), e3438 (2011).
- Grynkiewicz, G., Poenie, M., Tsien, R. Y. A new generation of Ca2+ indicators with greatly improved fluorescence properties. J Biol Chem. 260 (6), 3440-3450 (1985).
- Hill-Eubanks, D. C., Werner, M. E., Heppner, T. J., Nelson, M. T. Calcium signaling in smooth muscle. Cold Spring Harb Perspect Biol. 3 (9), 1-20 (2011).
- Harmer, A. R., Abi-Gerges, N., Morton, M. J., Pullen, G. F., Valentin, J. P., Pollard, C. E. Validation of an in vitro contractility assay using canine ventricular myocytes. Toxicol Appl Pharmacol. 260 (2), 162-172 (2012).
- IonOptix LLC. . IonWizard 7.2 Acquisition. , (2017).
- IonOptix LLC. IonWizard 7.2 Core & Analysis Functions. IonOptix LLC. , (2017).
- Roe, M. W., Lemasters, J. J., Herman, B. Assessment of Fura-2 for measurements of cytosolic free calcium. Cell Calcium. 11 (2-3), 63-73 (1990).
- Zawieja, S. D., et al. Ano1 mediates pressure-sensitive contraction frequency changes in mouse lymphatic collecting vessels. J Gen Physiol. 151 (4), 532-554 (2019).
- Behringer, E. J., et al. Calcium and electrical dynamics in lymphatic endothelium. J Physiol. 595 (24), 7347-7368 (2017).
- Ferrusi, I., Zhao, J., van Helden, D., vonder Weid, P. Y. Cyclopiazonic acid decreases spontaneous transient depolarizations in guinea pig mesenteric lymphatic vessels in endothelium-dependent and -independent manners. Am J Physiol Heart Circ Physiol. 286 (6), H2287-H2295 (2004).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved